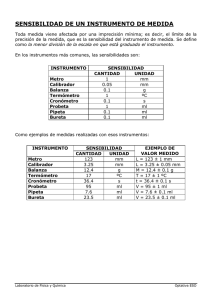
Instituto Politécnico Nacional Unidad Profesional Interdisciplinaria de Ingeniería Y Ciencias Sociales y Administrativas PROCESOS INDUSTRIALES LABORATORIO DE PRÁCTICA DR. Raúl Monsalvo Vázquez Equipo 1 INTEGRANTES Molar Morales Omar Fernando Ordoñez Román Ana Gabriela Rincón Zúñiga Alma Delia Ríos León Jacqueline Elizabeth Salazar Lozada Carlos Alberto SECUENCIA 2AM38 FECHA DE ENTREGA: 28 DE SEPTIEMBRE DEL 2015 HORARIO 11:00 am – 13:00 pm, laboratorio 12 INDICÉ CONTENIDO OBJETIVOS………………………………………………………3 MARCO TEÓRICO……………………………………………....3 DESARROLLO EXPERIMENTAL……………..……………….6 ANALISIS………………………………………………………....9 CONCLUSIÓN……………………………………………………9 CUESTIONARIO………………………………………………..10 BIBLIOGRAFÍA…………………………………………………13 OBJETIVOS 1. Conocer las reglas básicas de higiene y seguridad que se deben aplicar en un Laboratorio de procesos industriales. 2. Enterar del uso y de las precauciones que hay que considerar al manipular el material y equipo que se empleará en el curso. 3. Identificar algunas de las sustancias químicas empleadas en el curso, sus usos y precauciones. MARCO TEÓRICO INTRODUCCIÓN Para entender mejor los principios básicos que se llevan a cabo en el laboratorio de procesos industriales, es indispensable la experimentación. El laboratorio es un lugar donde se podrá comprobar la validez de dichos principios; ofrece también la oportunidad de conocer mejor los procesos que ocurren en la naturaleza. Sin embargo, para conseguir dicho objetivo, es indispensable realizar análisis químicos confiables, y esto sólo puede lograrse, si se conoce el manejo adecuado del equipo y de los reactivos químicos que existen en el laboratorio. Por otro lado, un aspecto fundamental que se debe considerar en un Laboratorio es la seguridad, pues el trabajo en dicho lugar implica que la persona que lleva al cabo la experimentación se exponga a una gran variedad de sustancias químicas, muchas de las cuales conllevan ciertos riesgos durante su manipulación. Por lo anterior, es indispensable tener un reglamento de higiene y seguridad con el fin de reducir riesgos en el manejo del material, equipo y sustancias químicas. Al trabajar con reactivos químicos, es necesario conocer las propiedades de las sustancias empleadas y las precauciones que deben observarse durante su manipulación. Debido a lo anterior, es necesario saber qué tipo de información puede y debe brindar la etiqueta de cualquier sustancia química. MATERIAL Y EQUIPO Algunos de los materiales que se emplearán en el laboratorio se muestran en la siguiente clasificación: VIDRIO Embudo de separación: separar líquidos en mezclas heterogéneas en el embudo la interface indica hasta adonde se pueden separar Embudo: utilizado para realizar filtraciones. Tubo de ensayo: utiliza mayormente como recipiente de líquidos y sólidos, con los cuales se realizan mezclas Vaso de precipitado: Su objetivo principal es contener líquidos o sustancias químicas Matraz destilación: diseñado para la realización de procesos donde se desprenden sustancias gaseosas que posteriormente se quieren condensar. Refrigerante rector: son de uso frecuente en el reflujo, donde los vapores calientes Refrigerante de rosario: Son aparatos destinados a condensar los vapores procedentes de la destilación. Termómetro: Instrumento que sirve para medir la temperatura Bureta: es un tubo graduado de gran extensión, generalmente construido de vidrio. Pipeta: permiten la transferencia de un volumen generalmente no mayor a 20 ml de un recipiente a otro de forma exacta. Probeta: es un instrumento volumétrico que consiste en un cilindro graduado de vidrio que permite contener líquidos Matraz volumétrico: Un matraz aforado es un tipo de recipiente que se utiliza en los laboratorios para medir de forma precisa los volúmenes de los líquidos. El matraz aforado se utiliza regularmente en experimentos químico Matraz de kitasato: Sirve para realizar ensayos de destilación, recolección de gases en cuba hidroneumática (desplazamiento de volúmenes), filtraciones al vacío de sustancias pastosas y sólidas de tamaño muy pequeño. Matraz Erlenmeyer: Es un frasco transparente de forma cónica con una abertura en el extremo angosto, generalmente prolongado con un cuello cilíndrico, suele incluir algunas marcas. Vidrio de reloj: Se utiliza en química para evaporar líquidos, pesar productos sólidos o como cubierta de vasos de precipitados, y contener sustancias parcialmente corrosivas. PORCELANA: Embudo buchner: utilizado para la filtración al vació o filtración a presión asistida. Mortero y pistilo: tiene como finalidad machacar o triturar sustancias sólidas. Crisol: utilizado principalmente para calentar, fundir, quemar, y calcinar. Capsula: utilizado para evaporar el exceso de solvente. Metálicos: soporte universal, anillo de hierro, pinza para tubo de ensayo, mechero de bunsen, rejilla de asbesto, punza para bureta, etc. EQUIPOS DE LABORATORIO: centrifuga, estufa, báscula eléctrica, conectores de gas, conectores de luz, lavabos, etc. DESARROLLO EXPERIMENTAL EXPERIMENTO 1 OBSERVACIÓN El error de medida en el vaso precipitado que tienen con relación a la bureta y probeta. 25ml en la bureta mide 25ml por lo cual no existe error. 25ml en la probeta mide 25ml por lo cual no existe error. El vaso precipitado de 27ml en la probeta mide 25ml, teniendo el vaso precipitado +2 de error. Objeto de Medición 1.-Volumen ml. 2.-Volumen ml. 3.-Volumen ml. 4.-Volumen ml. Bureta Probeta Vaso de precipitado 25 ml. 25 ml. 27 ml. 25 ml. 25 ml. 27 ml. 25 ml. 25 ml. 27 ml. 25 ml. 25 ml. 27 ml. Utilizando los principales materiales volumétricos del laboratorio, se probó que la bureta es el material volumétrico más exacto, ya que la medición del agua fue exacta después sigue la probeta la cual tiene un margen de error del 4% y por último el vaso de precipitados el cual no es exacto y tiene un margen de error del 20% por lo consiguiente este material solo se utiliza para transportar y contener los reactivos. EXPERIMENTO 2 OBSERVACIONES En este experimento pudimos notar que al tomar la temperatura de: Agua destilada (sola) 23°C Agua destilada + NaOH 25°C Como se muestra en la tabla hubo una diferencia de 2° en cuanto a la temperatura al incorporar el hidróxido de sodio al agua destilada. Al agregar posteriormente el cloruro férrico obtuvimos una mezcla turbia la cual dejamos en reposo dentro del vaso de precipitados y al paso de unos minutos el hidróxido de sodio sedimento y se quedó en la parte inferior del vaso de precipitados dejando arriba la disolución de hidróxido de sodio. EXPERIMENTO 3 Experimento 4 ANÁLISIS Experimento N°1 Medición de Volúmenes 1) Determinación de Volúmenes Bureta | 25 ml | Probeta | 27 ml | Vaso de precipitados | 25 ml | Experimento N° 2 Precipitación 2) Determinar la masa Papel NaoH Balanza Eléctrica | 1.1 g | 8 g | Experimento N°3 Centrifugación 3) Cambios de temperatura H2O | NaOH en H2O | 23 °C | 25 °C | Experimento N°4 Filtración Simple El tiempo en que tarda la solución de cloruro de sodio e hidróxido de hierro por el papel filtro hacia el otro vaso de precipitado es de 1 minuto con 38 segundos. CONCLUSIONES En conclusión podemos definir que en el experimento de la medición de volúmenes, se percibe el error sistemático del +/-5% que se puede tener al pasar de un instrumento de medición al otro; y lo recomendable es medirlo con la bureta directamente ya que se alcanza a ver que es más precisa. En el experimento de medición de la masa se pudieron identificar los diferentes datos que registraron los instrumentos de medición, no hubo tanta dificultad para realizar esto, ya que puede ser una actividad cotidiana. Cuando se lleva a cabo el experimento de cambio de temperatura se pueden apreciar muchos cambios, entre ellos, el cambio de color del agua cuando se mezcla el Oxido Férrico, así como también el cambio de temperatura del agua cuando se mezcla con el Hidróxido de Sodio. En el último experimento que se llevó a cabo donde utilizamos la filtración y la centrifugación se pudieron apreciar las separaciones de las sustancias mezcladas; por medio de la filtración se pudieron separar las sustancias por medio de un material que se utilizó; con esto se observó que el agua se filtraba por el material mientras que la otra sustancia se quedaba en el material de filtración. Por otro lado en la etapa de la centrifugación se observó cómo se podían separar las sustancias mediante una fuerza rotativa. Cuestionario 1) ¿Existe diferencia entre el valor de un volumen y otro, según sus datos del experimento? En cualquier caso explique. Si, existe diferencia debido a que son diferentes instrumentos para medir volúmenes. 2) ¿Qué materiales son los más precisos para medir volúmenes de líquidos? La bureta y la probeta, pero en este experimento observamos que la que tuvo diferencia fue la probeta. 3) Defina los siguientes conceptos Peso tara. Es cuando “eliminamos” el peso del recipiente que nos ayuda a pesar la sustancia que nos interesa. Peso neto. Es solo el peso de la sustancia de interés. Sedimentación. Es cuando un sólido se asienta al fondo en un recipiente que contiene un líquido. Disolución. Separación de un sólido de un líquido. Precipitación. Reacción química en la que se permite obtener un sólido a partir de un líquido. Centrifugación. operación de separación en el cual una mezcla se coloca en un recipiente haciendo que este gire a gran velocidad para que dos materiales se separen. Filtración. operación de separación en la que se utiliza un medio filtrante para separar dos materiales. 4) ¿Qué diferencia hay entre un fenómeno físico y uno químico? En el fenómeno física no se cambian las propiedades de las sustancias ocupadas, mientras que en uno química si se alteran. 5) ¿Cuáles son los fenómenos observados en esta práctica son físicos y cuales son químicos? Físicos: medición de volúmenes, medición de la masa, mezcla de NaOH en H2O. Químicos: Mezcla de FeCl3 en H2O, ya que cambia su color y también cambia su peso. 6) Anote la ecuación química y los nombres de las sustancias participantes en la reacción llevada a cabo entre el hidróxido de sodio y el cloruro férrico. FeCl3 (ac) + NaOH (ac) Fe (OH) 3 (ac) + NaCl (ac) Cloruro férrico Hidróxido de sodio Cloruro de sodio Hidróxido de hierro 7) ¿Qué propiedades físicas y químicas tienen las sustancias empleadas en el experimento de precipitación, mismas que deben ser consideradas para manejarlas con seguridad en el laboratorio. Hidróxido de sodio · Peso molecular: 40 · - Punto de ebullición 760 mm de Hg: 1,390°C (2,534°F). · - Gravedad específica (agua=1): 2,13 · - Densidad del vapor (aire=1 en el punto de ebullición del hexano): No corresponde. · - Punto de fusión: 310°C (590°F) · - Presión de vapor a 20°C (68°F): Esencialmente 0. · - Solubilidad en agua, g/100 g de agua a 20°C (68°F): 50 · Función química: Hidróxido · Tipo de reacción: Corrosiva, exotérmica Cloruro férrico Estado físico: Líquido > Color: Marrón oscuro Olor: Débil, semejante al del ácido clorhídrico Temperatura de ebullición: > 100 º C ( depende de la pureza ) Temperatura de la inflamación: No inflamable. Se descompone por el calor liberando ácido clorhídrico. · Densidad del líquido: > 1,4g/ml, dependiendo de la pureza y la temperatura. · Solubilidad en agua: 100% 8) ¿Qué sucede con el valor de la temperatura en el agua, antes y después de agregar hidróxido de sodio? ¿A qué se debe esto? Al principio la temperatura del agua es ambiente, pero al agregar el hidróxido de sodio (NaOH) este tiene una reacción exotérmica. · · · · · · 9) Enliste por separado y según la clasificación que corresponda, el material que utilizo esta primera práctica. Material Probeta Bureta Pipeta Vaso de Precipitados Vidrio Agitador Embudo Equipo Termómetro Bascula Centrifugadora Material Espátula Soporte universal Anillo de fierro Pinzas para bureta Tela de alambre con asbesto de de vidrio de reloj Laboratorio eléctrica metálico BIBLIOGRAFIA -Experimentos de química, partes 1,2 y 3 RIVAS, Villareal y Butruille Editorial Trillas, México, 1982. -Experimentos de química general Dominguez, Xorge A. Editorial Limusa, México, 1978. Prácticas de química general, inorgánica e industrial IBAÑEZ, Jorge G. Editorial Limusa-Noriega, México, 1993. Halliday, David; Robert Resnick; Kenneth S. Krane (2001). Physics v. 1 (en inglés), New York: John Wiley & Sons. ISBN 0-471-32057-9. Serway, Raymond A.; Jewett, John W. (2004). Physics for Scientists and Engineers, 6ª edición (en inglés), Brooks/Cole. ISBN 0-534-40842-7. Tipler, Paul Allen; Gene Mosca (2004). Physics for Scientists and Engineers: Mechanics, Oscillations and Waves, Thermodynamics, 5ª edición (en inglés), W.H. Freeman & Company, pp. 650. ISBN 0-7167-08094. Wald, Robert M. (1994). Quantum Field Theory in Curved Spacetime and Black Hole Thermodynamics (en inglés), Chicago University Press, pp. 205. ISBN 0-226-87027-8.