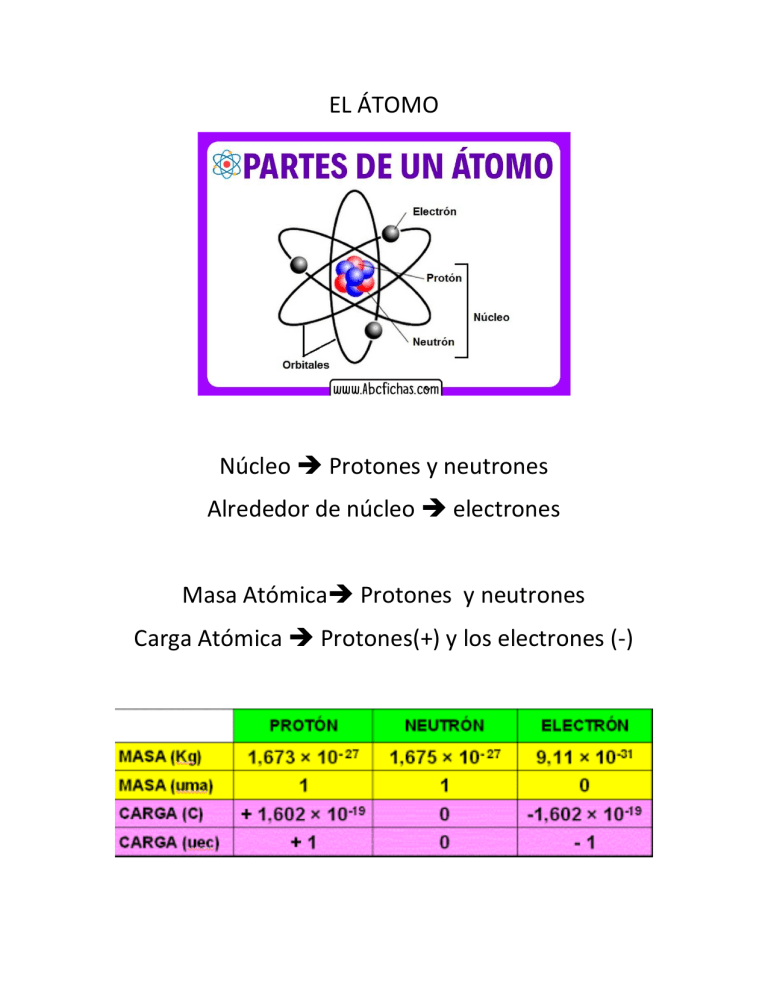
EL ÁTOMO Núcleo Protones y neutrones Alrededor de núcleo Masa Atómica Carga Atómica electrones Protones y neutrones Protones(+) y los electrones (-) La diferencia entre un elemento y otro, es el número de protones que tenga el átomo. Numero atómico = cantidades de protones que tiene un elemento Numero masico = cantidades de protones + neutrones que tiene el átomo A= número masico Z= número atómico → 14 → 14 32 → " " 24 24 68 29 34 14 32 36 → 24 3 32 2! 34 21 24 Investigar sobre los isótopos estables de los elementos de la fila 1 a la 4 de la tabla periódica y los porcentajes que existen en la naturaleza. ISÓTOPOS CALCULAR MASA APROXIMADA DE LA MASA ELEMENTAL DE TABLA PERIODICA Masa Elemental (Peso atómico) $ % 100 !' % 100 !' % 100 (! ) Porcentaje en la naturaleza $ 20% 30% 50% 0.2 28! ' 0.3 30! ' 0.5 33! 31.1 ,$ - En el caso del cloro, el cloro-35 tiene una abundancia relativa de 77.5%, mientras que el cloro-37 tiene una abundancia relativa de 22.5%. $ ./ 0.775 35! ' 0.225 37! 35.45 ,$ - ELECTRÓN( ) NUMEROS CUÁNTICOS 1. 2. 3. 4. Principal Secundario o azimutal Magnético Spin Numero cuántico principal Es la distancia que se encuentran los electrones al núcleo, Se divide en 7 regiones Numero cuántico secundario o azimutal Es la dirección de las orbitas que los electrones giran alrededor del núcleo. Se identifican con las letras: s, p, d, f, g, h Configuración electrónica ú2 3 2á5623 7 8 9 3: - ;3 3 <69 8 Orbital s (empieza nivel 1) Orbital p (empieza nivel 2) Orbital d (empieza nivel 3) Orbital f (empieza nivel 4) Orbital g (empieza nivel 5) Orbital h (empieza nivel 6) 2 1 orbital máximo por nivel 3 orbitales máximo por nivel 5 orbitales máximo por nivel 7 orbitales máximo por nivel 9 orbitales máximo por nivel 11 orbitales máximo por nivel Numero cuántico magnético Es la dirección del giro a favor o en contra de las agujas del reloj, de los electrones cuando se mueven alrededor del núcleo. Se identifican como: $, $ Numero cuántico spin Es el movimiento del electrón en su propio eje, no rota completamente, solo la mitad y regresa a su estado inicial. Se identifican como: ½ , ½ Nivel Energía Orbitales Número máximo de electrones 1 s s,p s,p,d s,p,d,f s,p,d,f,g s,p,d,f,g,h s,p,d,f,g,h 2 8 18 32 50 72 72 254 2 3 4 5 6 7 Configuración electrónica Método llenado de nivel de energía 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s 6p 6d 6f 6g 6h 7s 7p 7d 7f 7g 7h Hidrogeno (H) #A=1 1He #A=2 1#A= 3 1- 2#A= 4 1- 2#A= 5 1- 2- 2; #A= 8 1- 2- 2; #A= 11 1- 2- 2; 3#A= 20 1- 2- 2; 3- 3; 37 #A= 35 1- 2- 2; 3- 3; 37 ) 4- 4;" #A= 50 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? #A= 65 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; #A= 80 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? Método de AufBau 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s 6p 6d 6f 6g 6h 7s 7p 7d 7f 7g 7h #A= 5 1- 2- 2; #A= 8 1- 2- 2; #A= 11 1- 2- 2; 3#A= 20 1- 2- 2; 3- 3; 4#A= 35 1- 2- 2; 3- 3; 4- 37 ) 4;" #A= 50 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; #A= 65 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? @ #A= 80 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) Use los dos métodos #A= 18 #A= 23 #A= 34 #A= 64 #A= 75 #A= 89 #A= 97 #A= 110 #A= 120 #A= 89 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? #A= 97 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 5 " 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? @ #A= 110 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 5 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? 67 #A= 120 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 5 6- 6; 67 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? 67 ) 7; 5 1s 2s 3s 4s 5s 6s 7s AUF BAU 2p 3p 4p 5p 6p 7p 3d 4d 5d 6d 7d 4f 5f 6f 7f 5g 6g 7g 6h 7h 2 PERIOCIDAD QUÍMICA Representativos = Grupo A (s o sp)último nivel Transición = Grupo B (d penúltimo nivel, s ultimo nivel) Tierras Raras NE=6 Lantánidos (sf) NE=7 Actínidos (sf) Ejemplos de Representativos #A= 11 1- 2- 2; 3- Nivel Energía o periodo = 3 Grupo= I A #A= 20 1- 2- 2; 3- 3; 4Nivel Energía o periodo= 4 Grupo= II A #A= 35 1- 2- 2; 3- 3; 4- 37 ) 4;" AufBau Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4;" Nivel Energía o periodo= 4 Grupo= VII A #A= 50 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 5- 5; Nivel Energía o periodo= 5 Grupo= IV A Elemento en Transición Suma 3 IIIB …….Suma 7 Suma 8, 9, 10 VIIB VIIIB suma 11 IB suma 12 IIB Ejemplos de elementos en transición #A= 25 1- 2- 2; 3- 3; 4- 37 " Ordenado 1- 2- 2; 3- 3; 37 " 4- Nivel Energía o periodo= 4 Grupo= VII B #A= 41 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 5Nivel Energía = 5 Grupo= V B #A= 45 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 A Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 A 5- 9 Nivel Energía o periodo= 5 Grupo= VIII B #A= 80 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 6Nivel Energía= 6 Grupo= II B ) Ejemplos de elementos de tierras raras Fila 6 Lantánidos Fila 7 Actínidos #A= 65 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? @ Cuando en Aufbau termina en s y f no se ordena Nivel Energía= 6 Grupo= Tierras raras Lantánidos Ubicación de los siguientes elementos Números atómicos: 33, 41, 45, 56, 60, 79, 92 #A= 33 1- 2- 2; 3- 3; 4- 37 ) 4; Aufbau Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; Nivel Energía y Período = 4 Grupo= V A #A= 56 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 5- 5; 6Nivel Energía= 6 Grupo= II A #A= 60 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? Nivel Energía= 6 Grupo = Tierras raras, Lantánidos (C4) #A= 79 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 @ Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 @ 6Nivel Energía= 6 11 Grupo = I B #A= 92 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? Nivel Energía= 7 Grupo = Tierras raras, Actínidos (C4) Efectué la configuración electrónica y encuentre la ubicación de los siguientes elementos Números atómicos: 47, 57, 67, 71, 98, 112, 130, 150 #A= 57 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? Nivel Energía= 6 Grupo = Tierras raras, Lantánidos (C1) #A= 71 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 6Nivel Energía= 6 Grupo = III B #A= 112 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? 67 Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 6- 6; 67 ) 7- Nivel Energía= 7 Grupo = II B ) #A= 130 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? 67 ) 7; 5 Ordenado 1- 2- 2; 3- 3; 37 ) 4- 4; 47 ) 4? 5- 5; 57 ) 5? 5 Nivel Energía= 7 6- 6; 67 ) 7- 7; Grupo = VIII A #A= 150 1- 2- 2; 3- 3; 4- 37 ) 4; 5- 47 ) 5; 6- 4? 57 ) 6; 7- 5? 67 ) 7; 5 Nivel Energía= 7 Grupo = Tierras raras, Actínidos (C28) 6?