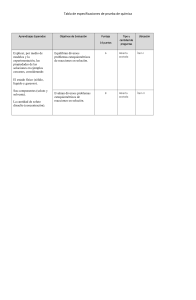
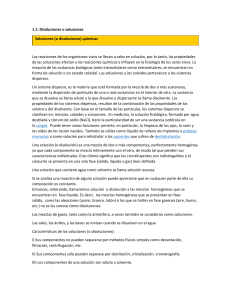
UNIDAD V SOLUCIONES QUÍMICAS Dr. Ing. Carlos Valdez Salazar [email protected] Tecmat 1 - CVS 1 PARA PENSAR Y RECORDAR Tecmat 1 - CVS 2 COMPETENCIAS El alumno define y analiza el concepto entre soluto y solvente. Tecmat 1 - CVS 3 CONTENIDOS A TRATAR • • • • • Competencias Introducción Solutos. Solventes. Solución (o disolución) química Tecmat 1 - CVS 4 OBJETIVOS DE APRENDIZAJE Que el alumno conozca los diferentes tipos de soluciones químicas, que las identifique y analice sus diferencias. Que aprenda a realizar los cálculos necesarios para preparar cada una de ellas. Que el alumno adquiera habilidad para preparar soluciones químicas correctas a diferentes concentraciones. Que los alumnos estén preparados para aplicar este aprendizaje en la parte experimental y laboral. Tecmat 1 - CVS 5 SOLUCIÓN (ó Disolución) Tecmat 1 - CVS 6 INTRODUCCION Una solución (o disolución) es una mezcla perfectamente homogénea de dos o más sustancias. La solución se presenta como una sola fase (sólida, líquida o gas) bien definida. Los componentes se mezclan íntimamente con el otro, perdiendo sus características individuales, es decir, los componentes son indistinguibles. Los componentes se mezclan en proporciones variables, sin cambio alguno en su composición, es decir, no existe reacción química. Tecmat 1 - CVS 7 SOLUCIONES SOLUCIONES MEZCLAS HOMOGÉNEAS DE 02 o MAS SUSTANCIAS: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA Tecmat 1 - CVS GASEOSA 8 SOLUCIÓN (ó Disolución) • SOLUTO: Sustancia a ser disolvida. • SOLVENTE (o disolvente): Disuelve al soluto. SOLUCIÓN (o disolución) = Solvente + Soluto Tecmat 1 - CVS 9 SOLUCIÓN QUÍMICA (ó Disolución) Cuando un sólido se disuelve en un líquido las partículas que lo forman quedan libres y se reparten entre las moléculas del líquido que se sitúan a su alrededor. Sólido (NaCl) Líquido (H2O) Tecmat 1 - CVS Disolución 10 SOLUCIÓN (ó Disolución) Son mezclas homogéneas de dos o mas sustancias: soluto(s) y solvente. a) Soluto: Es la sustancia que se disuelve b) Solvente: ó disolvente, es el componente donde se disuelve el soluto. Sustancia que está presente en mayor cantidad, o quien determina el estado físico de la materia en la que existe una disolución (sólido, líquido o gaseoso). Tecmat 1 - CVS 11 SOLUCIONES Unidades físicas EMPÍRICAS: PORCENTUALES: Unidades químicas VALORADAS: Diluidas Porciento peso Molares Concentradas Porciento volumen Formales Saturadas Porciento masa/volumen Molales Sobresaturadas Normales Tecmat 1 - CVS 12 CLASIFICACION DE SOLUCIONES Tecmat 1 - CVS 13 CLASIFICACION DE SOLUCIONES Tecmat 1 - CVS 14 CLASIFICACION DE DISOLUCIONES En función del estado físico inicial del soluto y del disolvente Tecmat 1 - CVS 15 TIPOS COMUNES DE DISOLUCIONES Estado de la Disolvente disolución Soluto Ejemplo Gas Gas o Aire 2.- Líquido Líquido Gas o Gaseosa 3.- Líquido Líquido Líquido o Vinagre 4.- Líquido Líquido Sólido o Agua de mar 5.- Sólido Sólido Sólido o Latón 1.- Gas Tecmat 1 - CVS 16 a) SOLUCIÓN LÍQUIDA El solvente es liquido así: Sólido en líquido Ejemplo: NaCl en agua Líquido en liquido: Ejemplo: alcohol en agua Gas en líquido Ejemplo: co2 en agua Tecmat 1 - CVS 17 b) SOLUCIÓN SÓLIDA El solvente es sólido: Sólido en sólido: Ejemplo: las aleaciones Líquido en sólido: Ejemplo: mercurio en oro (amalgama) Gas en sólido: Ejemplo: hidrógeno en paladio Tecmat 1 - CVS 18 c) SOLUCIÓN GASEOSA El solvente es gas: gas en gas: Ejemplo: el aire Líquido en gas: Ejemplo: vapor de agua en aire Sólido en gas: Ejemplo: partículas de polvo en el aire. Tecmat 1 - CVS 19 SOLUBILIDAD La solubilidad de una sustancia indica la máxima cantidad de dicha sustancia que es posible disolver en una cantidad de disolvente, a una temperatura concreta. Tecmat 1 - CVS 20 SOLUBILIDAD La cantidad máxima de soluto que se puede disolver recibe el nombre de solubilidad y depende de varios factores: a) De quién sea el soluto y el disolvente. Hay sustancias que se disuelven mejor en unos disolventes que en otros. b) De la temperatura. Normalmente la solubilidad de una sustancia aumenta con la temperatura Tecmat 1 - CVS 21 SOLUBILIDAD Una disolución se dice que está saturada cuando, a una determinada temperatura, contiene la máxima cantidad posible de soluto A C B a) Si añadimos un poco de sal en agua y agitamos, obtenemos una disolución b) Las dos sustancias forman una mezcla homogénea c) Si añadimos más sal, llega un momento que no se disuelve, y precipita al fondo. Tecmat 1 - CVS 22 ¿CUÁNTO SOLUTO SE PUEDE DISOLVER EN UNA CANTIDAD DADA DE DISOLVENTE? Si vamos añadiendo soluto (p.e. azúcar) poco a poco, a un vaso con agua y lo agitamos, observamos que al principio se disuelve sin dificultad, pero si seguimos añadiendo llega un momento en que el disolvente (agua) no es capaz de disolver más soluto (azúcar) y éste permanece en estado sólido, “decantando” en el fondo del recipiente. Tecmat 1 - CVS 23 CLASIFICACIÓN DE LAS DISOLUCIONES Dependiendo de la naturaleza de la fase: Sólida Líquida Tecmat 1 - CVS Gaseosa 24 CLASIFICACIÓN DE LAS DISOLUCIONES Dependiendo del número de componentes: Binaria Ternaria Cuaternaria . . . Tecmat 1 - CVS 25 CLASIFICACIÓN DE LAS DISOLUCIONES Dependiendo del disolvente: • Acuosas • No acuosas Tecmat 1 - CVS 26 CLASIFICACIÓN DE LAS DISOLUCIONES Dependiendo del estado del soluto: Soluto sólido Soluto líquido Tecmat 1 - CVS Soluto gaseoso 27 CLASIFICACIÓN DE LAS DISOLUCIONES Dependiendo de la naturaleza del soluto Electrolíticas: soluto se disocia en iones (ej. sal) (conducen la corriente eléctrica). No electrolíticas: soluto no se disocia en iones (ej. azúcar) (no conducen la corriente eléctrica) Tecmat 1 - CVS 28 EFECTO DE LA TEMPERATURA Solubilidad de gases en líquidos: • Al disolver un gas en un líquido, generalmente, se desprende calor, lo que significa que un aumento de temperatura en el sistema gas-líquido, disminuye la solubilidad del gas porque el aumento de energía cinética de las moléculas gaseosas provoca colisiones con las moléculas del líquido, disminuyendo su solubilidad. Tecmat 1 - CVS 29 EFECTO DE LA PRESIÓN En sólidos y líquidos: La presión no afecta demasiado la solubilidad de sólidos y líquidos; sin embargo, sí es muy importante en la de los gases. En gases: La solubilidad de los gases en líquidos es directamente proporcional a la presión del gas sobre el líquido a una temperatura dada. Tecmat 1 - CVS 30 DISOLUCION EN LA PRÁCTICA Tecmat 1 - CVS 31 RELACIÓN BÁSICA Densidad (r) m = V×r Donde: m : masa medida en g V : volumen medido en ml r : densidad medida en g/ml Ejemplo: Un líquido de densidad 1,2 g/ml; ocupa un volumen de 60 ml. Calcula su masa. m = 60 ml × 1,2 g/ml m = 72 g Tecmat 1 - CVS 32 DENSIDADES DE ALGUNAS SUSTANCIAS Sustancia Densidad en kg/m3 Densidad en g/c.c. Agua 1000 1 Aceite 920 0,92 Gasolina 680 0,68 Plomo 11300 11,3 Acero 7800 7,8 Mercurio 13600 13,6 Madera 900 0,9 Aire 1 0,0013 Butano 2,6 0,026 Dióxido de carbono 1,8 0,018 Tecmat 1 - CVS 33 EJERCICIOS PROPUESTOS 1) Hallar el peso en Tm de una pirámide de wolframio, de base cuadrada, 1´ de lado y altura 10”. 2) Hallar el peso en KN y el volumen en m3 de un cono de litio, de 5´ de diámetro y 2´de altura. 3) Hallar el peso en Tm de una palanquilla de cobre de sección transversal trapezoidal (b1=30cm, b2=15cm, h=25cm) y longitud 2m. 4) Una plancha de forma de paralelogramo, con bases=40cm, altura=20cm, espesor=1”, es de silicio hallar el peso en kp. Tecmat 1 - CVS 34 CONCENTRACIONES Esta dada por la proporción de soluto en la solución. Por la abundancia relativa del soluto en las soluciones, estas pueden ser: a) Diluida: cuando proporcionalmente tienen poco soluto b) Concentrada: cuando proporcionalmente tienen abundante soluto c) Saturadas: cuando la abundancia de soluto es tal que el solvente ya no es capaz de disolver mas soluto. d) Sobre Saturada: cuando tiene mas soluto que su punto de saturación, la sobre saturación se logra mediante procedimientos especiales como por ejemplo calentar la solución Tecmat 1 - CVS 35 CONCENTRACIONES Hablar de solución diluida o concentrada, resulta muy inexacto. Existen formas de determinar cuantitativamante las concentraciones de las soluciones. Existen dos tipos de unidades: Unidades físicas Unidades químicas Tecmat 1 - CVS 36 CONCENTRACIÓN PORCENTUAL Unidades físicas para medir concentración 𝑚 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 % 𝑚𝑎𝑠𝑎 = . 100 𝑚 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝑉 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 % 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 = . 100 𝑉 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝑒𝑛 𝑚𝑎𝑠𝑎 𝑚 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 (𝑔) % = . 100 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑉 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 (𝑚𝑙) Tecmat 1 - CVS 37 [1] PORCENTAJE PESO/PESO (ó MASA/MASA) m solución = m soluto + m solvente (soluciones binarias) Donde: • m solución : masa de la solución medida en g • m soluto : masa del soluto medida en g • m solvente : masa del solvente medida en g 𝑚 𝑠𝑜𝑙𝑢𝑡𝑜 % 𝑆𝑜𝑙𝑢𝑡𝑜 𝑝 𝑝 = . 100 𝑚 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Donde: % Soluto (P/P) : Porcentaje del soluto en peso/peso ó masa/masa soluto Tecmat de 1 - CVS 38 Ejemplo: Una solución de azúcar en agua, contiene 20g de azúcar en 70g de solvente. Expresar la solución en % p/p. soluto + solvente 20g 70g 20g azúcar Xg azúcar → → → 90g solución 100g solución X = 20 * 100 = 90 Tecmat 1 - CVS solución 90g 22,22 %p/p 39 [2] PORCENTAJE VOLUMEN/VOLUMEN 𝑉 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 % 𝑆𝑜𝑙𝑢𝑡𝑜 (𝑉 𝑉) = . 100 𝑉 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Donde: • % Soluto (V/V) : porcentaje volumen/volumen de soluto • V soluto : volumen del soluto medido en mL • V solución : volumen de la solución medido en mL 𝑉 𝑑𝑒 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒 % 𝑆𝑜𝑙𝑣𝑒𝑛𝑡𝑒 (𝑉 𝑉) = . 100 𝑉 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Donde: • % Solvente (V/V): porcentaje volumen/volumen de solvente • V solvente : volumen del solvente medido en mL • V solución : volumen de la solución medido en mL 40 Tecmat 1 - CVS Ejemplo: Calcular la concentración en volumen de una solución alcohólica, que contiene 15 mL de alcohol disueltos en 65 mL de solución. 15 mL alcohol X mL alcohol → → 65 mL solución 100mL solución X = 15 * 100 65 X = 23 %V/V Tecmat 1 - CVS 41 [3] PORCENTAJE PESO/VOLUMEN (ó MASA/VOLUMEN) 𝑚 𝑠𝑜𝑙𝑢𝑡𝑜 % 𝑆𝑜𝑙𝑢𝑡𝑜 𝑝 𝑉 = . 100 𝑉 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Donde: • % Soluto(p/V) • m soluto • V solución : porcentaje del soluto peso/volumen ó masa/volumen : masa del soluto medida en g : volumen de la solución medido en ml Tecmat 1 - CVS 42 Ejemplo: Una solución salina contiene 30g de NaCl en 80 mL de solución. Calcular su concentración en % p/v 30g NaCl Xg NaCl → → 80 mL solución 100mL solución X = 30 * 100 80 X = 37,5 %p/v Tecmat 1 - CVS 43 Ejemplo: Calcula el porcentaje peso/volumen de soluto de una solución formada por 80g de soluto disueltos en 500mL de solución. Si la densidad de la solución es 1,1 g/mL, calcula el porcentaje peso/volumen de solvente. 80 𝑔 % 𝑆𝑜𝑙𝑢𝑡𝑜 𝑝 𝑉 = . 100 = 16% 500 𝑚𝐿 m solución = 500 × 1,1 = 550 g m solvente = 550 – 80 = 470 g 470 𝑔 % 𝑆𝑜𝑙𝑣𝑒𝑛𝑡𝑒 𝑝 𝑉 = . 100 = 94% 500 𝑚𝐿 Tecmat 1 - CVS 44 EXPRESIONES DE CONCENTRACIÓN La descripción de una disolución implica conocer sus componentes y sus cantidades relativas concentración. Formas de expresar la concentración • Fracción molar (x) • Molalidad (m) • Molaridad (M) • Normalidad (N) • Porcentaje en peso (% p/p) {ya no se usa} Tecmat 1 - CVS 45 UNIDADES QUÍMICAS PARA MEDIR CONCENTRACIÓN Se llaman unidades químicas porque utilizan el mol como unidad a diferencia de las unidades anteriores que utilizan solamente unidades físicas . o Molaridad o Molalidad o Normalidad Tecmat 1 - CVS 46 MOLARIDAD (M) Expresa el número de moles de soluto por cada litro de disolución. M= 𝑛 𝑉𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 [𝐿] Siendo • n : número de moles • V : Litro de disolución - Volumen Tecmat 1 - CVS 47 ANALIZANDO Como 𝑛𝑠𝑜𝑙𝑢𝑡𝑜 𝑀= 𝑉𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 (𝐿) 𝑚𝑠𝑜𝑙𝑢𝑡𝑜 (𝑔) 𝑛= 𝑔 𝑀𝑀𝑠𝑜𝑙𝑢𝑡𝑜 ( ) 𝑚𝑜𝑙 Reemplazando se tiene que 𝑚𝑠𝑜𝑙𝑢𝑡𝑜 (𝑔) 𝑀= 𝑔 𝑀𝑀𝑠𝑜𝑙𝑢𝑡𝑜 . 𝑉𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 (𝐿) 𝑚𝑜𝑙 Siendo • M :Molaridad • m : masa del soluto • MM : Masa molar del soluto • V : Volumen de la solución. Tecmat 1 - CVS 48 MOLARIDAD Expresa el número de moles de soluto que hay en 1000 ml de solución Ejemplo: Una solución de nitrato de sodio (NaNO3) indica que en 1000 ml de ella hay 0,5 moles de nitrato de sodio si tomamos sólo 25 ml. En ese volumen habrán 0,0125 moles de nitrato de sodio y la molaridad sigue siendo 0,5 molar. Tecmat 1 - CVS 49 Ejemplo: Calcular la concentración molar de una solución disolviendo 7,2 moles de ácido clorhídrico (HCl) en 7 litros de solución. Solución 1 7,2 moL → 7 L X moL → 1L Solución 2 M = 7,2 moles HCl 7L X= 1,02 moL M = 1,02 moL/L Tecmat 1 - CVS 50 Ejercicio 1 Se tiene una solución de sulfato de aluminio 2 M, con densidad 1,13 g/ml. Exprese esta concentración en : • %p-p • %p-v Tecmat 1 - CVS 51 Ejercicio 2 La densidad de una solución de cloruro férrico 1.6 M es 1,175 g/ml. ¿Cuál es su %p-p y cuál es su molaridad? Determine la molaridad de una solución de carbonato de sodio que se ha preparado disolviendo 5.02 g de carbonato de sodio dihidratado hasta un volumen de 200ml de solución. Tecmat 1 - CVS 52 Ejercicios 3 Al terminar de efectuar un análisis de agua de río se encontró que contiene 13 ppm de ión calcio (Ca2+). ¿cuál es la molaridad del cloruro de calcio (CaCl2) en una muestra de 100g de agua de río? ¿cuál es el % p-p? Tecmat 1 - CVS 53 Ejercicio 4 Se tiene un frasco de ácido sulfúrico (H2SO4 ) cuya etiqueta presenta las siguientes condiciones: 98% de pureza, densidad 1,84 g/mL. Calcule la concentración M. Tecmat 1 - CVS 54 DETERMINACION DE LA CANTIDAD DE SOLUTO. DILUSION: • Procedimiento por el cual se disminuye la concentración de una solución por adición de mayor cantidad de solvente. • Al agregar más solvente, se está aumentando la cantidad de solución pero la cantidad de soluto se mantiene constante Cantidad de soluto = Concentración * Volumen C1 x V1 = C2 x V2 Tecmat 1 - CVS 55 Ejemplo ¿Qué volumen de ácido clorhídrico (HCl) 18M se necesitan para preparar 6 litros de solución 5M? C1 x V1 = 5M 6L C2 18M x V2 X X=5x6 18 X = 1,67 M Tecmat 1 - CVS 56 CONCLUSIONES Las soluciones o disoluciones resultan de mucha importancia ya que se realizan diariamente en nuestras labores cotidianas, por ello la necesidad de estudiarlas. A mayor cantidad de soluto presente en la disolución, mayor será su concentración. Sin los conocimientos que se tienen acerca de las disoluciones, no se podría hacer más cosas con la materia prima, o con otros materiales. P.e. el plástico, del que existen muchos tipos de este material, que se usa ampliamente, y así como este material existen muchos otros. Tecmat 1 - CVS 57 REFERENCIAS BIBLIOGRAFICAS 1) Appold, Hans (1984). Tecnología de los metales. Barcelona: Reverté. (669.9/A64) 2) http://www.educared.net/aprende/anavegar4/comunes/premiados/D/627/ sulubilidad/CONCEPTO.HTM 3) http://eros.pquim.unam.mx/~moreno/cap08.htm#_Toc510771221 4) http://www.educared.net/aprende/anavegar4/comunes/premiados/D/627/ 5) http://encarta.msn.com 6) http://cipres.cec.uchile.cl/~cdolz/links/1.2%20soluciones%20y%20solubil idad.html 7) http://www.uv.es/~baeza/solubi.html Tecmat 1 - CVS 58 SIGUIENTE UNIDAD CORROSION FIN DE LA UNIDAD Tecmat 1 - CVS 59 GRACIAS Nunca confundas el conocimiento con la sabiduría. Uno te ayuda a ganarte la vida; el otro te ayuda a construir una vida. Sandra Cary Tecmat 1 - CVS 60