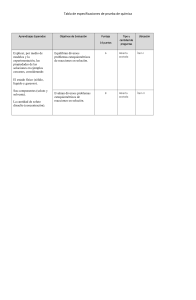
27-8-2022 ACTIVIDAD N°2 La Materia BREMILDA CALLE FLORES 1. Representa mediante esquemas las propiedades y clasificación de la materia. LA MATERIA Es todo aquello que ocupa un lugar en el espacio, que constituye a todos los objetos del universo. PROPIEDADES DE LA MATERIA GENERALES ESPECIFICOS MASA Cantidad de materia que tiene un cuerpo. Se mide con balanza o basculas. Se expresa en gramos, kilogramos. Densidad Dureza Color Brillo Conductividad magnetismo VOLUMEN Es la medida del espacio que ocupa un cuerpo. Se mide en recipientes graduados. Se expresa en 𝑚3 , 𝑐𝑚3 , 𝑚3 .. TEMPERATURA ) Calor (termómetro) Frio (termómetro) SPORADE 2. ¿Cuál es la diferencia entre compuesto y elementos químicos? 3. 4. Compuesto: Se trata de la union de 2 o mas elementos. Elemento Químico: Es un producto constituido por átomos de la misma clase, es la forma más simple de la materia. ¿Cuál es la diferencia entre una mezcla homogenias e heterogeneas? Mezcla homogénea: es una mezcla cuyos componentes estan de forma uniforme y no se distinguen sus componentes a simple vista. Mezcla heterogénea: Es una mezcla en el cual sus elementos, no estan distribuidos de manera uniforme sus componentes se pueden visualizar. Describir los tipos de soluciones. Concentradas: en sustancias como estas, la cantidad de soluto resulta ser mucho más elevada que la de solvente. Diluidas: en esta clase de solución, a diferencia de la anterior, el porcentaje de soluto que la conforma es menor que el de solvente. En estos casos, la diferencia entre ambas resulta ser bastante significativo. AGUA Y ACEITE 5. Saturadas: esta clase de sustancias se caracteriza por el hecho de no poder disolver más soluto estando a cierta temperatura. Si se sobrepasa esta proporción, el resto del soluto quedará en el fondo del recipiente en el que se encuentre la sustancia, sin poder mezclarse. Insaturadas: a diferencia de las sustancias anteriores, en estas no existe una proporción de soluto que supere las proporciones máximas para saturar al solvente encontrándose en una determinada temperatura o presión. Concentrada: en este caso, si bien se hace presente un porcentaje significativo de soluto, este no es el suficiente como para saturar a la solución. Sobresaturadas: en este caso, la cantidad de soluto que se encuentra en la solución es mayor de la que el solvente puede soportar a cierta temperatura. La sobresaturación es la consecuencia de descompresiones hechas de manera precipitada o bien, ante cambios de temperatura muy marcados. Porque es importante conocer las unidades de concentración y los grupos funcionales de las moleculas. Unidades de concentración: La importancia de conocer la concentración de una solución radica en que normalmente se hacen diluciones de ellas para llevarlas a menor valor de concentración, siendo un procedimiento habitual en el laboratorio químico. Las más comúnmente usadas, son: molaridad, molalidad, fracción molar, porcentaje masa-masa, porcentaje volumen-volumen, porcentaje masa-volumen y normalidad. Grupos funcionales de las moleculas: son la porción de una molécula que es capaz de reacciones características. Por tanto, determinan las propiedades y la química de muchos compuestos orgánicos. Un compuesto orgánico es cualquier compuesto que contenga carbono y otro elemento.