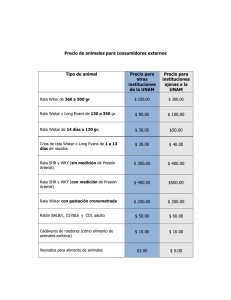
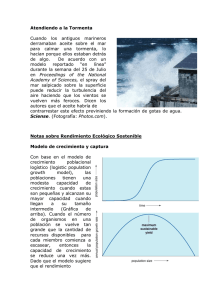
PRÁCTICA No. 4 ANATOMÍA MACROSCÓPICA DE LOS SISTEMAS DE ÓRGANOS EN RATA COMPETENCIAS: Reconocer los componentes anatomofisiológicos de los principales sistemas en la rata. Saber calcular una dosis por peso corporal, saber medir un volumen líquido con una jeringa de insulina, valoración de signos vitales y reflejos en un animal de laboratorio. Localizar, identificar y disecar los órganos que conforman a los principales sistemas de órganos: nervioso, músculo-esquelético, cardiovascular, respiratorio, digestivo, urinario, inmune, endocrino y reproductor. Definir las funciones específicas de cada sistema de órganos y la participación de cada uno en el mantenimiento de la homeostasis. Desarrollar la capacidad de extrapolar los conocimientos adquiridos en la práctica con animales de laboratorio a los fenómenos fisiológicos ocurridos en el humano. INTRODUCCIÓN: La rata de laboratorio es un ser vivo, cuyo organismo suele ser estudiado a través de la observación directa, para que con una mejor comprensión de su funcionamiento pueda, mediante una extrapolación, conocerse mejor al ser humano. Pero para poder hace este estudio, es necesario no causarle al animal un sufrimiento innecesario, por lo que conviene recordar su calidad de seres vivos, que las distintas especies biológicas han sido y son en extremo valiosas para el hombre y que se les debe tratar con cuidado y respeto (NOM-062ZOO-1999). No se tiene la certeza de que los animales mantengan una estructura emocional equivalente a la del hombre, lo que sí es incuestionable es que los estímulos nociceptivos les causan dolor, que parece compararse al sufrimiento humano. Po ello es absolutamente indispensable evitar su manejo inadecuado y sufrimiento innecesario mediante la inducción anestésica. Habitualmente los animales de experimentación se obtienen de un bioterio, sitio donde se reproducen, cuidan y domestican; sin embargo se deben manipular con calma y precaución para evitar que ataquen. Al manipular animales se debe tener en cuenta que la conducta animal en cautiverio es distinta a la conducta del animal en vida libre, debido a la influencia directa del medio ambiente. Los animales de laboratorio, confinados en jaulas, están imposibilitados para procurarse alimento. Ello suele inhibir una de las conductas de supervivencia más característica, la agresividad; que también disminuye por el contacto cotidiano de las personas que los cuidan, por lo que el estudiante no deberá tener temor de 1 tomarla entre sus mano. Se pueden comprar unos guantes para electricista si no se puede vencer ese temor a tocarlas. En caso de recibir una mordida, se deberá lavar el área afectada con agua y jabón abundantes, y aplicarse un desinfectante, ya que aunque se trata de un animal sano, libre de parásitos o infecciones, no se encuentra en un medio estéril. La caracterización de muchos de los fenómenos fisiológicos que se estudian en un curso de “Laboratorio de Fisiología Humana” implica procedimientos invasivos que desde luego, no pueden aplicarse al humano. Así, para fines de enseñanza e investigación para la demostración de diferentes fenómenos fisiológicos se utilizan animales que van desde primates hasta las formas más elementales de vida animal. La práctica que ahora se presenta, permite que el estudiante empiece a conocer a la rata como modelo experimental de mamífero, se percate de la anatomía macroscópica de los principales sistemas de órganos, entienda que cada sistema participa a través de su función particular en el mantenimiento de la homeostasis, es decir el mantenimiento de las condiciones constantes del “medio interno”, y adquiera algunas habilidades manuales que le serán útiles para otros experimentos. Desde el punto de vista anatómico y fisiológico y debido a la considerable similitud que tiene con el ser humano, la rata constituye un excelente modelo de estudio para una gran cantidad de fenómenos fisiológicos, como se podrá apreciar a lo largo del curso de laboratorio. MATERIAL 1) Reactivo biológico (Rata) 2) Jaula para rata, 3) balanza para animales pequeños, 4) mesa de disecciones, 5) Hilo cáñamo doble cero, 6) Algodón, 7) Pentobarbital sódico, 8) Jeringas de 1 y 10 mililitros, 9) Solución salina isotónica, 10)* Estuche de disección, 11) Tubo para ventilación pulmonar, 12) Aguja metálica del # 18 con punta de plástico, 13) Guantes de látex 14)* Hoja de plástico tamaño carta de cualquier color y 15)* Cámara fotográfica. NOTA IMPORTANTE: el material marcado con un asterisco (*) es responsabilidad del estudiante MANEJO DE LA RATA DE LABORATORIO Desde hace muchas generaciones las ratas de laboratorio se han habituado a ser manejadas por el hombre. Recuerde pues, que si éste es su primer contacto con ellas, el novicio es usted. Las ratas muerden, sin embargo, las criadas en el laboratorio raramente lo hacen mientras no se les trate mal. Las siguientes maniobras le permitirán manejarlas sin grandes riesgos. La cola es un apéndice muy conveniente para el manejo del animal y permite levantarlo sin hacerle daño. Para agarrar al animal (si es usted derecho), sujete la cola con la mano derecha; en este estado inmóvil y ocupada en otra cosa la rata trata de alejarse. En esta situación, con la mano izquierda tome al animal, de tal manera que la palma de la mano queda sobre el dorso de la rata, el dedo índice entre el hombro y el cuello del lado izquierdo del animal (por debajo de la mandíbula inferior), y el pulgar por debajo del brazo derecho, de esta manera, el animal no podrá girar la cabeza ni abrir el hocico. Con el resto de los dedos se abraza el tórax del animal suavemente pero con firmeza. Es importante no apretar fuertemente y mucho menos la 2 garganta, pues la rata no suele comprender por qué debería cooperar con alguien que intenta estrangularla (Figura 4.1) Figura 4.1 Manejo (sujeción) de la rata. Es aconsejable no mantener a la rata levantada por la cola, pues son lo bastante ágiles para girar en el aire, trepar por su propia cola y morder a quien la coloca en esta posición tan incómoda. Doblando un poco la mano que sujeta a la cabeza, el cuerpo del animal queda acostado sobre la palma de la mano. No debe agarrarse o apretarse el cuerpo con los otros dedos, pues esta presión resulta molesta y puede desencadenar movimientos de defensa. No es tiempo perdido sino muy bien invertido, aquel que se gasta en manejar a la rata, pasándola de una jaula a otra, o de ahí a la mesa, acostumbrándose tanto el animal como el estudiante al conocimiento mutuo. Una rápida comparación entre la rata y alguno de sus compañeros mostrará de inmediato más diferencias que similitudes. Las diferencias más notables son el tamaño y el peso. El peso que guarda relación con el tamaño, es un parámetro útil para dosificar fármacos y comparar fenómenos fisiológicos y efectos farmacológicos en distintas especies. ANESTESIA Antes de anestesiar a la rata deberá tomar en cuenta lo siguiente: una buena anestesia requiere de una vigilancia constante y estrecha. Por lo tanto en cada práctica la responsabilidad debe recaer en un solo estudiante. Dicha función pues, será rotatoria entre los miembros del grupo en las distintas prácticas. El estudiante que resulte anestesista en algún experimento, será responsable del nivel de anestesia durante la duración del mismo y no deberá en ningún momento relegar esta responsabilidad a otro miembro del grupo. Debe vigilarse continuamente el plano de anestesia para que el animal no se despierte o bien, no llegue a un plano tan profundo que las respuestas fisiológicas por estudiar no puedan observarse. La función fundamental de los anestésicos es la abolición del dolor. Para determinar si la anestesia se encuentra en el nivel adecuado, se evalúa la respuesta a los 3 estímulos dolorosos pinchando las orejas o la cola y buscando reflejos de flexión o cualquier otro movimiento. Otro buen criterio para determinar el nivel de anestesia y establecer si ésta es (a) profunda, (b) quirúrgica o (c) superficial, es la observación de la frecuencia y profundidad de las respiraciones. Para esto, usted ya tomó nota de la frecuencia y profundidad de las respiraciones en la rata despierta, y esas características se comparan con los cambios que muestra la respiración al instalarse la anestesia. Cuando los movimientos respiratorios son muy lentos y superficiales, la anestesia es demasiado profunda. Si la respiración se hace rápida y con movimientos intensos, la anestesia es demasiado superficial. En caso de anestesia demasiado profunda, esta puede progresar hasta provocar la muerte del animal. INYECCIONES Aunque la inyección de sustancias químicas y medicamentos puede hacerse por múltiples vías, aquí practicaremos las de uso más frecuente: intraperitoneal (IP), subcutánea (SC) e intramuscular (IM). Inyección intraperitoneal. Sujete al animal con una mano y con la otra tómela de las patas posteriores y extiéndalas de tal manera que el abdomen del animal quede tenso y expuesto al compañero que realizará la inyección. El compañero que inyecta deberá identificar los cuadrantes inferior izquierdo y derecho del abdomen, ya que en esta zona no hay órganos vitales, excepto asas intestinales. Con la jeringa previamente preparada aplique la punta de la aguja en el sitio escogido y con un movimiento rápido introdúzcala a través de la pared abdominal, al hacerlo se percibe claramente cuando la pared cede al empuje de la aguja. Tenga cuidado de introducir solamente la punta de la aguja en la cavidad peritoneal, ya que existe el riesgo de perforar el intestino. Una vez en el peritoneo, inyecte la solución y saque la aguja en la misma dirección en la cual entró. Los líquidos inyectados en el peritoneo no tienen que estar a la temperatura del cuerpo, pero es mejor calentarlos. DOSIFICACIÓN DE FÁRMACOS EN BASE AL PESO CORPORAL Nombre del fármaco: Pentobarbital sódico Dosis efectiva media como anestésico: 40 mg/kg de peso corporal, Presentación: líquida, con una concentración de: 6.3 g/100 ml = 0.063 g/1 ml = 63 mg/1 ml Vía de administración: IP Para calcular la dosis proceda de la siguiente manera: Pesar y registrar el peso del animal Suponiendo que la rata pesa 385 g, haga la siguiente operación: 40 mg - 1000 g de peso corporal X mg - 385 g de peso de la rata 385 x 40/1000 = 15.4 mg de Pentobarbital sódico Para calcular el volumen que deberá tomar del anestésico proceda a realizar las siguientes operaciones: 63 mg – 1 ml 15.4 mg – X sódico. 15.4 x 1/63 = 0.244 ml de la solución de Pentobarbital 4 Inyección subcutánea. Si la rata está despierta se necesitan dos personas, una que sujeta al animal y la otra que aplica la inyección. Al llegar a este punto se supone que usted es capaz de manejar al animal sin riesgos de ser mordido por él. Por lo tanto, para aplicar la SC, el animal estará sujeto según se describió anteriormente y recostado sobre la palma de la mano, después con la mano libre tome las extremidades posteriores del animal y extiéndalas lo suficiente hasta evitar movimientos, la presión que ejerza sobre ellas no debe lastimar al animal ni impedir la libre respiración. El compañero prepara la jeringa con solución salina isotónica, a una dosis de 0.1 ml/100 g de peso corporal. Proceda a exponer la rata al compañero que va a inyectar. La persona que inyecta levantará un pliegue de la piel en el sitio escogido e introducirá la aguja de la jeringa hasta llegar al espacio subcutáneo en donde prefundirá el líquido de la jeringa. Se saca la aguja y se frota el lugar de la inyección para cerrar el orificio hecho por la aguja. Cada integrante del equipo debe realizar varias inyecciones de práctica en la rata anestesiada. Inyección intramuscular. Sujete al animal según se describió, tome las extremidades inferiores y exponga a su compañero la parte lateral de uno de los muslos. El estudiante que aplicará la inyección ya tendrá la jeringa con la dosis de solución salina preparada (0.1 ml/100 g. de peso corporal); a continuación palpara el muslo para reconocer la zona de mayor masa muscular y colocando la aguja en posición oblicua al muslo, la introducirá aproximadamente hasta la mitad de la masa muscular y lentamente inyectará la solución. Saque la aguja en la misma dirección en la que fue introducida. Cada integrante del grupo debe practicar cada tipo de inyección sobre la rata anestesiada. SISTEMAS DE ÓRGANOS Como el hombre, la rata posee diferentes sistemas de órganos (músculo-esquelético, cardiovascular, urinario, respiratorio, digestivo, nervioso, endocrino, reproductor, inmune, hematopoyético, etc.) Desde muchos puntos de vista, puede considerarse que estas divisiones son arbitrarias, sin embargo, lo importante es reconocer que para el bienestar de los individuos, es necesario que los diversos sistemas de órganos participen de manera integrada, en donde cada uno satisface las necesidades de los otros. En la presente práctica no se sigue el orden mencionado anteriormente, ya que la comodidad de la disección y la conveniencia de observar ciertos órganos mientras el animal todavía vive obligan a proceder diferente. Sin embargo, una vez que se ha terminado de reconocer a cada uno de ellos, se revisará toda la anatomía de la rata y se harán esquemas simples de los diferentes sistemas para compararlos con los esquemas de texto referentes al ser humano. Con el animal anestesiado, sujete al animal boca arriba (decúbito dorsal) sobre la mesa de cirugía, amarre las patas con hilos del doble cero y sujételas a las rondanas localizadas a los lados de la mesa. Anatomía externa de la rata. Proceda a identificar las diferentes estructuras externas. En la cabeza, identifique las ventanas nasales, vibrisas, labio leporino, boca, incisivos superiores e inferiores, el pabellón auricular y meato auditivo externo. En las extremidades anteriores los 5 dedos y el pulgar vestigial. Identifique a lo largo de las líneas mamarias los pezones del tórax, abdomen y la región inguinal. En la parte baja del abdomen localice en el macho el pene, la abertura del prepucio, el escroto con los testículos y el ano. En la hembra identifique el meato urinario, la vagina y el ano. En las extremidades posteriores observe los cojinetes plantares, el tobillo, la rodilla y el muslo. Finalmente observe la cola con sus escamas (Figura 4.2). Figura 4.2 Anatomía externa de rata macho (izquierda) y de rata hembra (derecha). Disección de la rata. Con la rata aún anestesiada, se hace una incisión en la línea media a través de la piel de la superficie ventral, desde el ángulo anterior del maxilar inferior hasta la sínfisis del pubis. Se separan los bordes de la piel y se retraen ligeramente hacia los lados. A continuación se introduce la punta de las tijeras directamente en la línea media, en el extremo inferior de la caja torácica por debajo del apéndice xifoides (Figura 4.3). Al abrir la cavidad torácica los pulmones ya no pueden oxigenar la sangre. En condiciones de anoxia el sistema nervioso central pronto deja de funcionar provocando la muerte del animal. Sin embargo, antes de morir la rata presentará algunas contracciones intensas del músculo diafragma. Observe estos movimientos e identifique al músculo diafragma. Para esto, proceda a abrir la cavidad torácica. Utilizando como referencia el orificio hecho a nivel del apéndice xifoides y pegándose por dentro a la pared torácica anterior, córtela hacia arriba siguiendo primero una de las líneas mamarias (a un lado del esternón), hasta la clavícula del mismo lado. Repita la maniobra en el lado opuesto. Levante y separe la parrilla costo-esternal. Esta maniobra deja expuesta toda la cavidad torácica. Observe los pulmones que se han retraído y el corazón que continúa latiendo. El animal hace algunos intentos por respirar. Observe la contracción de los 6 músculos respiratorios, en especial el abombamiento y aplanamiento del diafragma que separa el tórax del abdomen. Figura 4.3 Apertura de la cavidad ventral Meta el hocico de la rata en el tubo de ventilación pulmonar y sople con cuidado. Observe la distensión pulmonar. Quite el tubo y note como el aire sale de los pulmones. Note la disminución de los latidos del corazón conforme progresa la anoxemia. NOTA: 1) Conforme se extraen los órganos, colocarlos sobre la hoja de plástico “mica” y organizarlos de tal manera que recuerden su localización dentro del cuerpo. 2) Evitar la desecación de los órganos que se vayan extirpando vertiendo con un gotero solución de NaCl al 0.9% (solución salina isotónica). Disección de los órganos del tórax. Con ayuda de la Figura 4.4, identifique el timo sobre la cara anterior de la parte baja del cuello y sobre el corazón. Sepárelo y colóquelo sobre la hoja de plástico. Discuta con sus compañeros las funciones de este órgano. Siguiendo la línea media extienda hacia arriba la incisión, desde la cavidad torácica hasta el maxilar inferior. Identifique en el cuello las glándulas salivales submaxilares y sublinguales y los ganglios linfáticos y extírpelos. Localice la tráquea y sígala hacia abajo desde la laringe hasta su 7 Figura 4.4 Esquema de los órganos internos de la rata división en bronquio derecho e izquierdo y continúe, si es posible, hasta su siguiente ramificación, que corresponden a cada segmento grande del pulmón. Evite cortar los grandes vasos cardiacos. Una vez expuestos los lóbulos pulmonares, corte un fragmento pequeño del pulmón y exprímalo fuertemente entre los dedos. Perciba la sensación táctil de crepitación. Corte otro fragmento pequeño y junto con el anterior póngalos en un vaso con agua. Observe si flotan o se hunden (discuta la prueba de docimasia pulmonar en medicina legal). Identifique la glándula tiroides localizada por abajo de la laringe delante de la tráquea (Fig. 4). Corte la tráquea transversalmente un poco por debajo de la glándula tiroides y ábrala longitudinalmente hacia arriba incluyendo la laringe. Observe cuidadosamente esta estructura e identifique la epiglotis y las cuerdas vocales. Con unas tijeras fuertes corte por el centro la mandíbula inferior. Identifique el nacimiento de la aorta y los vasos que emergen del cayado; diseque la aorta torácica hasta el diafragma (figuras 4.3 y 4.4). Observe las venas yugulares en el cuello y sígalas hacia abajo. Identifique sucesivamente las venas; subclavia y cava superior y la aurícula derecha. Diseque la vena cava inferior desde el diafragma al corazón. Observe el nervio frénico derecho a un lado de la vena cava inferior y sígalo hasta su penetración en el diafragma. 8 Extirpar el corazón, los pulmones y los grandes vasos, lavarlos con agua y colocarlos sobre la hoja de plástico. Disección del corazón. Identifique la arteria aorta y córtela longitudinalmente hasta llegar al ventrículo izquierdo abriéndolo también. Identifique las valvas de la válvula aórtica. Localice la válvula aurículo-ventricular izquierda (mitral) con sus valvas y músculos papilares y cuerdas tendinosas. Abra la aurícula izquierda e identifique la desembocadura de las venas pulmonares, Identifique en la aurícula derecha la desembocadura de las venas cavas inferior y superior. Abra la aurícula y el ventrículo derechos. Identifique la válvula aurículo-ventricular derecha (tricúspide) y la emergencia de la arteria pulmonar en el ventrículo derecho. Observe la disposición de las valvas de la válvula pulmonar. Corte el corazón transversalmente, identifique el tabique interventricular y observe la diferencia en el grosor de las paredes de los ventrículos derecho e izquierdo. Sistema digestivo. Abra la cavidad abdominal siguiendo la línea alba. Observe como el diafragma separa al tórax del abdomen. Corte el músculo diafragma evitando cortar el esófago. Identifique las estructuras de la cavidad abdominal. Observe la lengua y la faringe bucal hasta la epiglotis. Introduzca un estilete por la faringe e identifique el esófago y el estómago. Con los dedos jale suavemente hacia fuera el intestino delgado e identifique el duodeno, el yeyuno y el íleon. Identifique el bazo y discuta con sus compañeros sus funciones. Localice el ciego y las demás porciones del intestino grueso hasta llegar al ano. En el hígado identifique los lóbulos hepáticos y las vías biliares y siga la trayectoria de estas hasta la desembocadura en el intestino delgado. Note la ausencia de la vesícula biliar. El páncreas tiene la forma de numerosas masas tisulares diseminadas en el mesenterio del intestino delgado junto con los respectivos conductos secretores. Observe a contra luz, como estos confluyen en la parte alta del intestino delgado donde desembocan. Corte transversalmente el esófago a nivel de la faringe y diseque todo el tubo digestivo hacia abajo. Corte el diafragma respetando el esófago, y ayudándose con los dedos y tijeras, jale y desprenda suavemente el estómago, y los intestinos delgado y grueso hasta llegar al ano. Corte transversalmente a nivel del recto. Mida y compare las longitudes de los intestinos delgado y grueso. Anote las longitudes en la hoja de resultados. Una vez que ha disecado el tubo digestivo y el hígado, colóquelos en la hoja de mica y dispóngalos lo más parecido a como se encontraban en la cavidad abdominal. Sistema urinario. Con la extirpación de la mayoría de los órganos abdominales, queda expuesta la pared posterior de la cavidad abdominal. Ayudándose de los esquemas de las Figuras 4.5 y 4.6, localice los riñones y encima de ellos a las glándulas suprarrenales. Identifique en ambos riñones la pelvis renal, los uréteres y su desembocadura en la vejiga. Trate de identificar la arteria y la vena renales. 9 Figura 4.5 Sistema urogenital de la rata macho Extirpe un riñón, córtelo longitudinalmente por la mitad y observe como la pirámide renal se proyecta en la pelvis. Separe del cuerpo las diferentes estructuras del sistema urinario y organícelas sobre la hoja de mica. Sistema reproductor. Los órganos de la reproducción dependerán, claro está, del sexo del animal. Si la rata es hembra, cada ovario se localizará a un lado de la pared posterior del abdomen, justo por debajo de los riñones. Identifique los ovarios, las trompas de Falopio y los cuernos uterinos hasta su unión con la vagina. Diseque un ovario y trate de identificar los folículos ováricos. Observe los pequeños oviductos y como estos se continúan con los respectivos cuernos uterinos (útero bicorne) Figura 4.6 En el macho pueden encontrarse los testículos en el abdomen o en el escroto. Identifique los testículos así como la cabeza el cuerpo y cola del epidídimo y el conducto deferente hasta la próstata. Identifique las vesículas seminales, la próstata ventral y la uretra interna. Diseque un testículo, ábralo en dos y se observe su contenido. Sistema nervioso. Para extraer el sistema nervioso central proceda de la siguiente manera; con unas tijeras fuertes, corte la cabeza del animal entre el agujero magno occipital y la primera vértebra cervical. Para retirar la calota, identifique el agujero magno e introduzca una de las ramas de la tijera de tal manera que la porción superior del hueso occipital queda entre las ramas. Teniendo cuidado de no lastimar al cerebelo y demás tejido nervioso, corte 10 Figura 4.6 Aparato reproductor de la rata hembra lateralmente hacia arriba y adelante los huesos del cráneo (del occipucio hacia el hueso frontal). Repita la maniobra en lado opuesto. De esta manera, la calota queda prácticamente desprendida. Levántela hacia la nariz y sepárela del cráneo. Así, el cerebro queda expuesto pero unido al cráneo por la base. Para separar el cerebro de la base del cráneo, seccione transversalmente los bulbos olfatorios y los nervios ópticos que se encuentran inmediatamente por debajo y pegados a la base del cráneo. Levante con cuidado la masa encefálica de adelante hacia atrás y observe a la glándula hipófisis (pituitaria) en el piso del cráneo y fija a él por su cubierta de meninges. Identifique el tallo hipofisiario que une a la glándula con el hipotálamo. Al seguir levantando el cerebro, el tallo hipofisiario se rompe, así como los nervios de los diferentes pares craneales. Continúe levantando el cerebro hasta llegar al agujero occipital. El cerebro ha quedado desprendido del cráneo. Colóquelo sobre la mesa, proceda a identificar los hemisferios cerebrales, el cerebelo, la glándula pineal, el bulbo raquídeo, el puente y el hipotálamo. Haga un corte coronal a nivel parietal e identifique los ventrículos cerebrales. Para extraer la médula espinal, proceda a cortar transversalmente entre las vértebras lumbares 3 y 4. Con una jeringa de 10 ml y una aguja del # 18 unida a un tubo de plástico del mismo calibre proceda a inyectar agua a presión en el canal raquídeo de abajo hacia arriba. La médula saldrá intacta por el extremo cervical. Identifique los diferentes niveles medulares, la emergencia de los nervios periféricos y la cola de caballo. Extirpe uno de los ojos del animal, abra la esclerótica y con cuidado extraiga el cristalino (lente esférica convexa). Mire a través de él y vea como las imágenes se observan invertidas. RESULTADOS FECHA:__________________ 1) Edad del animal________________ 2) Sexo___________________ 3) Cepa_____________ 4) Peso______________ 5) Hacer los cálculos para determinar la dosis de Pentobarbital sódico. 11 6) Hacer un esquema de cada uno de los sistemas de órganos estudiados y señalar con sus nombres los respectivos órganos que lo conforman. 7) Explicar la función global de cada uno de los diferentes sistemas de órganos. ANÁLISIS Se compararán las constantes vitales de una rata como modelo fisiológico, para extrapolar este conocimiento al humano. ¿Existió alguna variación en la frecuencia cardiaca o respiratoria durante la inducción anestésica? ¿durante la aplicación del mantenimiento? Explique: ¿Al comparar los 2 sujetos de experimentación, existió alguna variación? Justifique su respuesta. CONCLUSIONES (Enumerar al menos 5 conclusiones de la información adquirida que a usted le parecieron más relevantes). BIBLIOGRAFÍA 1. Armstrong G.G. Anatomía Macroscópica de los Sistemas de Órganos. En: Manual de Prácticas de Fisiología. Editorial Interamericana. México. pp 3-12. 1970. 2. Chiasson R.B. Laboratory Anatomy of the White Rat. WM. C. Brown Company Publishers. Iowa. 1978. 3. Hebel R, and Stromberg M.W. Anatomy of the Laboratory Rat. Williams and Wilkins Co. Baltimore. 1976. 4. Olds R.J. and Olds J.R. A Colour Atlas of the Rat. Dissection Guide. Wolfe Medical Publications Ltd (Ed). 1979. 5. Quintanar Stephano J.L. Anatomía Macroscópica de los Sistemas de Órganos. En: Manual de Prácticas de Laboratorio. Universidad Autónoma de Aguascalientes. 12 Anexo: Periodos y planos de anestesia. 13
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados