PRACTICA No. 3 Miguel Angel Garcia Popo 19010721.docx (1)
Anuncio

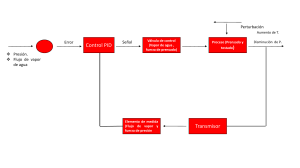
INGENIERÍA QUÍMICA MATERIA: LABORATORIO INTEGRAL II PROFESOR: JOSE ULISES ROA MAESTRO AUXILIAR: _________________ PRESENTA: ESTUDIANTE No. DE CONTROL MIGUEL ANGEL GARCIA POPO 19010721 GRUPO: 7c2E SALÓN: LFQ HORARIO: 7 - 10 PRÁCTICA No. 3. NOMBRE DE LA PRÁCTICA: “DIAGRAMA DE EQUILIBRIO DE FASES DE PRESIÓN PARA UN LÍQUIDO PURO” FECHA DE REALIZACIÓN: 20 ENERO 2023 FECHA DE ENTREGA: 27 ENERO 2023 INSTITUTO TECNOLÓGICO DE ORIZABA PRÁCTICA No. 3. “DIAGRAMA DE EQUILIBRIO DE FASES DE PRESIÓN PARA UN LÍQUIDO PURO” OBJETIVO. Medir la presión de vapor de un líquido puro por un método estático, dentro de un intervalo de temperatura y calcular su calor de vaporización aproximado mediante la ecuación de Clausius-Clapeyron. COMPETENCIAS: 1. Obtener la curva de presión de vapor de un líquido puro 2. Manejar el equipo para determinar la presión de vapor. 3. Calcular el calor Clausius-Clapeyron. de vaporización aproximado mediante la ecuación de FUNDAMENTO. La presión de vapor que ejerce temperatura. un líquido va en relación directa con la INTRODUCCIÓN. Cuando se eleva la temperatura de un recipiente que contenga un líquido, este se evapora parcialmente para establecer una presión de vapor encima del líquido que depende de la naturaleza de éste, y esta en equilibrio constante a cualquier temperatura establecida. Esta presión es conocida como presión saturada de vapor del líquido correspondiente. En tanto se mantiene ésta, el líquido no exhibe tendencia a evaporarse, pero a una presión menor, hay una nueva transformación hacia la fase de gas, y a otra más elevada se verifica una condensación, hasta restablecer una presión de equilibrio. Al elevar la temperatura del líquido, aumenta la presión de vapor, debido a que más moléculas ganan la energía cinética necesaria para desprenderse de la superficie del líquido. Cuando la presión de vapor llega a ser igual a la presión del espacio gaseoso, el líquido hierve. INSTITUTO TECNOLÓGICO DE ORIZABA Líquido Líquido Punto crítico Punto crítico Punto triple Sólido Punto triple Sólido Vapor Diagrama P-T para una sustancia pura que se contrae durante la congelación Vapor Diagrama P-T para una sustancia pura que se expande durante la congelación FIGS. 6.1. DIAGRAMAS PRESIÓN-TEMPERATURA PARA SUSTANCIAS PURAS. En el diagrama P-T, (Fig. 6.1) se tienen tres curvas que separan las fases sólida, líquida y de vapor, de aquí que este diagrama se le conoce como diagrama de fases. Estas tres curvas se unen en el punto triple. La curva que separa la fase sólida de la fase de vapor recibe el nombre de curva de vaporización y se le conoce también como curva de puntos de ebullición. Un punto sobre la curva de vaporización constituye un estado de equilibrio de las fases vapor-líquido. La presión a la cual el líquido se vaporiza es la presión de saturación, correspondiente a una temperatura dada. A esta presión también se le llama presión de vapor. La temperatura a la que se presentan los fenómenos descritos, se le conoce como temperatura de saturación correspondiente a una temperatura dada, es decir, se tiene una sola presión de saturación a esa temperatura. Esto se comprueba de acuerdo a la regla de fases de Gibbs. F = C–p+2 F = Grados de libertad o número de variables intensivas a fijar para tener definido un sistema. C = No. de componentes. P = No. de fases en equilibrio. En el equilibrio líquido-vapor se tienen dos fases en equilibrio, y como es de un líquido puro se tiene un solo componente, entonces el número de grados de libertad será: C = 1 p = 2 F = 1–2+2 = 1 INSTITUTO TECNOLÓGICO DE ORIZABA ECUACIÓN DE CLAUSIUS – CLAPEYRON. Para un líquido cualquiera la vaporización va acompañada de absorción de calor y la cantidad de éste, para una temperatura y presión de vapor dadas, requerida para calentar cierto peso de líquido se le conoce con el nombre de calor de vaporización y es la diferencia de entalpía de vapor y líquido. ΔHv = Hv – Hl ΔHv = calor de vaporización. Hv = entalpía del vapor Hl = entalpía del líquido. La ecuación que relaciona el cambio de temperatura que debe acompañar al de presión en un sistema de dos fases de una sustancia pura en equilibrio, es la ecuación de Clausius – Clapeyron y es la siguiente: δ P ΔHv = δT Para un gas ideal V = RT / P δ P ΔHv = δT δT T RT P δ P ΔHv P = δT δT RT2 δ P ΔHv δT P R T2 δ P ΔHv δT R T2 = = P P2 δ P ΔHv T2 δT R T2 = P P1 T1 T2 T ΔV INSTITUTO TECNOLÓGICO DE ORIZABA ln ln P2 ΔH = P1 R T P2 ΔH 1 P2 P1 T1 T2 = - P1 ln 1 - R ΔH T T1 1 = - 1 - R T2 T1 MÉTODOS PARA DETERMINAR PRESIÓN DE VAPOR. Existen diversos procedimientos para determinar la presión de vapor de un líquido, los cuales se clasifican de manera general en: métodos estáticos y métodos dinámicos. La diferencia principal entre ambos métodos radica en el hecho de que en los primeros se deja que el líquido establezca su presión de vapor sin que exista ningún disturbio en el sistema, mientras que en los métodos dinámicos, se varía la presión hasta que el líquido hierve, leyéndose la temperatura de ebullición. SEGURIDAD EN EL LABORATORIO. Asegurar el matraz para evitar que se caiga y se rompa. MATERIAL. MATERIAL Y EQUIPO 1 Matraz de dos bocas 1 Termómetro 1 Cristalizador con hielo o baño termostático. 1 Vaso de p.p. de 250 ml. 2 Soportes 1 Pinzas universales. 1 Trampa para vacío 1 Manómetro en U. 1 Trampa para vacío. Adaptadores para hacer el vacío en el matraz de dos bocas (adaptador con llave, mangueras, tapones, etc). 1 Bomba de vacío. REACTIVOS. 50 ml. Acetona. INSTITUTO TECNOLÓGICO DE ORIZABA PROCEDIMIENTO: 1. Instale el equipo como se muestra en la Fig.6.2 2. Determine la presión de vacío del sistema (sin muestra) (L1) Para esto se hace lo siguiente: Se conecta el matraz de dos bocas, vacío; la llave de la adaptación para conectar al vacío debe estar abierta, la que da a la atmósfera y la de la trampa, cerradas. Se acciona la bomba de vacío y se abre lentamente la llave de la trampa, hasta que quede abierta totalmente. Se cierra la llave y se apaga la bomba. Se lee la presión de vacío en el manómetro (si el menisco del mercurio baja continuamente, es indicio de que hay una fuga en el sistema, ésta debe localizarse y eliminarse). 3. Vierta la sustancia problema (acetona) en el matraz de dos bocas, conéctelo al aparato e introdúzcalo en el cristalizador que debe tener hielo. 4. Bajar la temperatura de la acetona y hacer las determinaciones a 0, 5, 10, 15 y 20 °C 5. Una vez alcanzada la temperatura deseada, determinar la presión de vapor (L2) leyéndola en la columna de Hg. 6. Anote los datos obtenidos en la Tabla de Datos Experimentales. FIG. 6.2.- EQUIPO PARA DETERMINACIÓN DE PRESIÓN DE VAPOR. INSTITUTO TECNOLÓGICO DE ORIZABA TABLA DE DATOS EXPERIMENTALES. Punto Temp. °C Presión de Presión de vacío (L1) vacío (L2) sin muestra con muestra Presión de vapor = (L1)- (L2) °K 1 T ln P 1 2 3 4 5 Aparte de estar llenada a mano también la llené y la hice en excel porque odio mi letra y mi TOC no me permite entregar algo así. CÁLCULOS Y GRÁFICAS. 1. Graficar presión de vapor (mm Hg) contra la temperatura en ° K. Gráficas hechas en Excel y a mano para que no se enoje yo no sienta que me salió todo feo por hacerlo a mano. INSTITUTO TECNOLÓGICO DE ORIZABA 2. Graficar ln P contra la inversa de la temperatura absoluta (1 / T). Trazar la mejor recta que ajuste sus puntos experimentales. Gráficas hechas en Excel y a mano para que no se enoje yo no sienta que me salió todo feo por hacerlo a mano. INSTITUTO TECNOLÓGICO DE ORIZABA 3. Calcular la pendiente de la recta en la gráfica anterior. Para el cálculo de la pendiente puedo hacer dos cosas, la primera sería ésta: Primero tendría que permutar todas las pendientes presentes en la gráfica y calcular los valores de cada una de ellas apoyandome con la formula básica, para al final obtener un promedio… En total serían diez pendientes. cada una con una combinación cartesiana distinta en base a los valores de lnP y 1/T; donde lnP y 1/T serían Y y X respectivamente y cartesianamente. tal que así: INSTITUTO TECNOLÓGICO DE ORIZABA Pero excel es más preciso que nosotros así que lo haremos por ahí… Odio trabajar a mano… me hace sentir ineficiente profe… Primero seleccionamos el comando y nuestros rangos para calcular la pendiente. ............. Obteniendo un valor cercano pero MAS PRECISO al obtenido con cálculos arcaicos. para posteriormente graficarla así bien bonito. También la hice a mano para que no diga que nO… INSTITUTO TECNOLÓGICO DE ORIZABA 4. Calcular el calor de vaporización con la siguiente fórmula : Δ Hvap (pendiente) m = R Tomaremos el valor de la pendiente calculada en Excel y despejaremos el valor de la Entalpía de vapor de nuestra acetona quedándonoa tal que así: m * R = - Δ Hvap Nuestra pendiente es un valor adimensional, por lo que podemos multiplicarla por el valor de R que más nos convenga, en éste caso en el del SI, para obtener un valor de Entalpía en j/mol. Multiplicando: ( - 7145.2471 ) * ( 8.31446261815324 ) = - ( - 59408.8897 ) j/mol = 59.4088897 kj/mol Obtuvimos una entalpía positiva lo que concuerda con el comportamiento real del sistema, recordando que en una entalpía positiva, el sistema se comporta de manera endotérmica, lo que explica el descenso de la temperatura debido al robo de calor latente por la acetona durante el cambio de fase a vapor. 5. Calcular el calor de vaporización usando la ecuación de Classius-Clapeyron. Compare con el anterior y con la bibliografía. INSTITUTO TECNOLÓGICO DE ORIZABA 6. Calcular gráficamente (de la 2ª gráfica) los parámetros de la ecuación. (La ecuación de Antoine llena un menos no un más) ln P = A - B / T Aquí compararemos los valores del logarítmo de la presion respecto a la temperatura calculando en base a la ecuación de Antonio (Antoine), Los valores de A y B, son coeficientes calculados empíricamente, por lo que tendremos que recurrir a una tabla de datos de los coeficientes de Antonio, los cuáles nos sirven en el rango de temperatura de -13 a 55 ºC. dónde trabajamos en la práctica. Acetona ; A = 7.1171 ; B = 1210.5950 Sustituyendo tal que así para cada temperatura: ln P = 7.1171 + ( 1210.5950 / TºC ) Lo cuál hice en excel para ahorrar espacio dentro de la hoja. Obteniendo así mismo su gráfica. 7. Usando la ecuación anterior determinar las presiones de vapor de la acetona a 5 y 10 °C Despejando: ln P = A + B / T Obtenemos: P = e^(A + ( B * T^-1 ) Sustituyendo para ambas temperaturas: P = e^( 7.1171 + ( 1210.595 * 5^-1 ) = 1.745271196 E+108 mmHg P = e^( 7.1171 + ( 1210.595 * 10^-1 ) = 4.63863381 E+55 mmHg Nos da números exorbitantes, pero no es problema, pues en diversos libros mencionan que usar sólo dos parámetros no basta, y se requiere de mayor precisión en diversos compuestos. para ello mostraré los resultados aplicando la ecuación de Antonio con 3 parámetros. Acetona ; A = 7.1171 ; B = 1210.5950 ; C = 229.6640 P = e^( 7.1171 + ( 1210.595 / [ 5 + 229.664 ] ) = 7.086955675 mmHg P = e^( 7.1171 + ( 1210.595 / [ 10 + 229.664 ] ) = 7.892259446 mmHg Obteniendo valores más cercanos a los obtenidos experimentalmente, entre más parámetros usemos como adicionar D, E y F, más preciso será nuestro modelo. INSTITUTO TECNOLÓGICO DE ORIZABA OBSERVACIONES. En primera estancia se utilizó hielo para esta practica por lo que se coloco debajo de un cristalizador para su uso con el termómetro, Es necesario tener en trozos el hielo para que pudimos mover el cristalizador en caso de que este no funcione bien a la hora de tomar la temperatura. Como toda práctica, se dieron las principales indicaciones para el uso de manómetro de Hg, una de las principales y mas importante es que en la imagen se observa la bomba de vacío, esta es importante revisarla antes de empezar la practica ya que esta debe estar cerrada, así como la del adaptador ya que podríamos tener algún tipo de fuga. Ya conteniendo el hielo en el cristalizador y la bomba de vacío funcionando ya solo era esperar a que en el termómetro marcaran las temperaturas que nos indico la profesora, que en este caso era (20°, 15°C, 10 °C, 5°C y 0ºC). Otro punto importante es que la temperatura bajaba en algunos casos muy rápido por lo que los compañeros debían estar muy pendientes de la presión, por lo tanto, se capturaba una foto para tener una lectura precisa al momento, y así leerlo en la foto y anotar. INSTITUTO TECNOLÓGICO DE ORIZABA Se obtuvieron muy bien los datos que se requerían por lo que podríamos concluir que fue un trabajo en equipo excelente a pesar de que estábamos todo el grupo, todo fue muy organizado. IDENTIFICACIÓN Y TRATAMIENTO DE RESIDUOS GENERADOS. Anotar la cantidad de Residuos generados en la práctica, y describir el y/o los tratamientos aplicados. Esta sustancia se ocupó de 150 a 200 ml de acetona la cual ya que no estaba contaminada y se procuró cuidar desde que se introdujo al matraz, por lo cual se regresó a su contenedor inicial y no se desechó. CONCLUSIONES: La presión de vapor es una de las propiedades más importantes y útiles de los líquidos. Esta propiedad influye en el diseño y operación de procesos industriales, químicos, físicos y biológicos, como consecuencia de la existencia de interfases en las que participa el vapor. A lo largo de nuestra formación como ingenieros químicos, hemos hablado del equilibrio líquido –vapor y de cómo los diagramas PT son de gran importancia en operaciones unitarias como la destilación, por lo que, haber comprendido de manera teórica durante el desarrollo de la práctica, el cómo usar el equipo, obtener los datos y posteriormente manipularlos para su análisis, es de gran ayuda. BIBLIOGRAFÍA: Diagramas de equilibrio - Tecnología Industrial Bachillerato. (s. f.). Recuperado 8 de octubre de 2022, de google.com/site/federubiotecindbachillerato/home/2obachillerato/materiales/ 4-diagramas-de-equilibrio Presión_de_vapor. (s. f.). Recuperado 8 de octubre de 2022, de quimica.es/enciclopedia/Presi %C3%B3n_de_vapor.html Phase Changes. (s. f.). Recuperado 8 de octubre de 2022, de hyperphysics.phyastr.gsu.edu/ hbasees/thermo/phase2.html Just a moment. . . (s. f.). Recuperado 8 de octubre de 2022, de researchgate.net/publication/ 334308162_Ecuacion_ClausiusClapeyron_y_Relaciones_de_Maxwell HOJA DE EVALUACIÓN (PERSONAL) Estudiante: Punto a calificar 1. Datos, Cálculos y/o Gráficas 2. Observaciones 3. Cuestionario 4. Identificación y Tratamiento de Residuos 5.Conclusiones 6. Bibliografía 7. Limpieza y Participación en sesión Total Ponderación (%) 15 25 10 10 15 5 20 100 Calificación