Tarea de Pirometalurgia: Entalpía y Óxidos Metálicos
Anuncio

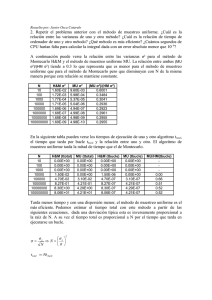
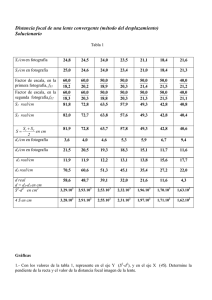
Ana Fernanda Alejandres Dueñas Tarea #2 Pirometalurgia Objetivo: Calculo de las variaciones de entalpia a distintas temperaturas mediante la formula: ∆𝑯𝑻𝑹𝒙 = ∆𝑯𝒐𝑹𝒙 + ∆𝒂(𝑻𝟐 − 𝟐𝟗𝟖. 𝟏𝟓) + ∆𝒃 𝟐 (𝑻𝟐𝟐 − 𝟐𝟗𝟖. 𝟏𝟓𝟐 ) − ∆𝒄 ( 𝟏 𝑻𝟐 − 𝟏 𝟐𝟗𝟖.𝟏𝟓 )+ ∆𝒅 𝟑 (𝑻𝟑𝟐 − 𝟐𝟗𝟖. 𝟏𝟓𝟑 ) ec(1) Introducción La entalpia de formación estándar representa la variación de entalpia en condiciones estándar (298.15K a 1atm) cuando se forma un mol de compuesto a partir de sus elementos en su estado normal de agregación a 298.15K. La entalpia de formación podrá ser positiva, reacción endotérmica, o negativa, reacción endotérmica. En este caso estamos utilizando la entalpia de reacción de algunos óxidos metálicos como criterio para evaluar la afinidad de ciertos metales hacia el oxígeno; entre menor (más negativa) sea la variación de entalpia mayor será la afinidad del metal por el oxígeno, mientras que mayor sea (más positiva) menor será la afinidad del metal por el oxígeno. Procedimiento 1. Se escribieron las reacciones de formación de los óxidos y se ajustaron para un mol de O2: 4 2 𝐴𝑙(𝑠) + 𝑂2(𝑔) → 𝐴𝑙2 𝑂3(𝑠) 3 3 2𝐶𝑎(𝑠) + 𝑂2(𝑔) → 2𝐶𝑎𝑂(𝑆) 4𝐴𝑔(𝑠) + 𝑂2(𝑔) → 2𝐴𝑔2 𝑂(𝑠) 2𝐶𝑎(𝑠) + 𝑂2(𝑔) → 2𝐶𝑎𝑂(𝑆) 2𝑃𝑏(𝑠) + 𝑂2(𝑔) → 2𝑃𝑏𝑂(𝑆) 2𝑍𝑛(𝑠) + 𝑂2(𝑔) → 2𝑍𝑛𝑂(𝑆) 2. Se obtienen los datos para calcular ΔHRxT y Δa, Δb, Δc y Δd para el calculo de Cp, para todos las reacciones. Elemento/compuesto Al O2 Al2O3 Ʊ ΔH°f -1.3333333 -1 0.66666667 0.00E+00 0.00E+00 -4.01E+05 a b 4.94E+00 7.16E+00 2.55E+01 c 2.96E-03 1.00E-03 4.25E-03 0.00E+00 -4.00E+04 -6.82E+05 d 0.00E+00 0.00E+00 0.00E+00 Ana Fernanda Alejandres Dueñas Tarea #2 Pirometalurgia Elemento/compuesto Ca O2 CaO Ʊ ΔH°f a b c d -2 0.00E+00 6.06E+00 -1.74E-03 0.00E+00 5.67E-06 -1 0.00E+00 7.16E+00 1.00E-03 -4.00E+04 0.00E+00 2.00 -1.52E+05 1.19E+01 1.08E-03 -1.66E+05 0.00E+00 Elemento/compuesto Ag O2 Ag2O Ʊ ΔH°f a b c d -4 0.00E+00 5.09E+00 2.04E-03 3.60E+04 0.00E+00 -1 0.00E+00 7.16E+00 1.00E-03 -4.00E+04 0.00E+00 2.00 -7.30E+03 1.42E+01 9.75E-03 -1.00E+05 0.00E+00 Elemento/compuesto Pb O2 PbO Ʊ ΔH°f a b c d -2 0.00E+00 5.63E+00 2.30E-03 0.00E+00 0.00E+00 -1 0.00E+00 7.16E+00 1.00E-03 -4.00E+04 0.00E+00 2.00 -5.24E+04 1.10E+01 3.75E-03 -1.00E+05 0.00E+00 Elemento/compuesto Zn O2 ZnO Ʊ ΔH°f a b c d -2 0.00E+00 5.35E+00 2.40E-03 0.00E+00 0.00E+00 -1 0.00E+00 7.16E+00 1.00E-03 -4.00E+04 0.00E+00 2.00 -8.38E+04 1.17E+01 1.22E-03 -2.18E+05 0.00E+00 3. Se calculan las variaciones totales de entalpia y a, b, c, y d para Cp. Calculamos para el trióxido de aluminio(III) ΔH°𝑅𝑥(𝐴𝑙2𝑂3) = −4/3𝑚𝑜𝑙(0 𝑐𝑎𝑙/𝑚𝑜𝑙) − 1𝑚𝑜𝑙(0 𝑐𝑎𝑙/𝑚𝑜𝑙) + 2/3𝑚𝑜𝑙(−4.01𝐸5) ΔH°𝑅𝑥(𝐴𝑙2𝑂3) = −267266.67 𝑐𝑎𝑙 Δa(𝐴𝑙2𝑂3) = −4/3𝑚𝑜𝑙(4.94 𝑐𝑎𝑙/𝑚𝑜𝑙) − 1𝑚𝑜𝑙(7.16 𝑐𝑎𝑙) + 2/3𝑚𝑜𝑙(2.55𝑐𝑎𝑙/𝑚𝑜𝑙) Δa(𝐴𝑙2𝑂3) = 3.24𝑐𝑎𝑙 Δb(𝐴𝑙2𝑂3) = −4/3𝑚𝑜𝑙(2.96𝐸 − 3 𝑐𝑎𝑙/𝑚𝑜𝑙) − 1𝑚𝑜𝑙(1𝐸 − 3 𝑐𝑎𝑙/𝑚𝑜ñ) + 2/3𝑚𝑜𝑙(4.25𝐸 − 3) Δb(𝐴𝑙2𝑂3) = −2.11𝐸 − 3𝑐𝑎𝑙 Δc(𝐴𝑙2𝑂3) = −4/3𝑚𝑜𝑙(0𝐸5 𝑐𝑎𝑙/𝑚𝑜𝑙) − 1𝑚𝑜𝑙(−4𝐸5 𝑐𝑎𝑙/𝑚𝑜𝑙) + 2/3𝑚𝑜𝑙(−6.82𝐸5) Δ𝑐(𝐴𝑙2𝑂3) = −4.15𝐸5𝑐𝑎𝑙 Δd(𝐴𝑙2𝑂3) = −4/3𝑚𝑜𝑙(0𝐸 − 6 𝑐𝑎𝑙/𝑚𝑜𝑙) − 1𝑚𝑜𝑙(0𝐸 − 6 𝑐𝑎𝑙/𝑚𝑜𝑙) + 2/3𝑚𝑜𝑙(0𝐸 − 6) Δd(𝐴𝑙2𝑂3) = 0𝐸 − 6𝑐𝑎𝑙 Ana Fernanda Alejandres Dueñas Tarea #2 Pirometalurgia Repetimos para todas las reacciones: Compuesto ΔH°f (cal) Δa (cal) Δb (cal) Δc (cal) Δd (cal) Al2O3 -267266.67 3.24E+00 -2.11E-03 -4.15E+05 0.00E+00 CaO -303200 4.43E+00 4.63E-03 -2.92E+05 -1.13E-05 Ag2O -14600 8.40E-01 1.03E-02 -3.04E+05 0.00E+00 PbO -104880 3.48E+00 1.90E-03 -1.60E+05 0.00E+00 ZnO -167600 5.56E+00 -3.36E-03 -3.96E+05 0.00E+00 4. Calculamos ΔHTRX para todas las especies de metales con todas las temperaturas de la siguiente forma: −𝟐. 𝟏𝟏𝑬 − 𝟑𝒄𝒂𝒍 (𝟓𝟎𝟎𝟐 − 𝟐𝟗𝟖. 𝟏𝟓𝟐 ) 𝟐 𝟏 𝟏 𝟎𝒄𝒂𝒍 − (−𝟒. 𝟏𝟓𝑬𝟓𝒄𝒂𝒍) ( − )+ (𝟓𝟎𝟎𝟑 − 𝟐𝟗𝟖. 𝟏𝟓𝟑 ) 𝟓𝟎𝟎 𝟐𝟗𝟖. 𝟏𝟓 𝟑 ∆𝑯𝑻𝑹𝒙 = −𝟐𝟔𝟕𝟐𝟔𝟔. 𝟔𝟕𝒄𝒂𝒍 + (𝟓𝟎𝟎 − 𝟐𝟗𝟖. 𝟏𝟓) + ∆𝑯𝑻𝑹𝒙 = −𝟐𝟔𝟕𝟑𝟒𝟒. 𝟑𝟕𝒄𝒂𝒍 Y repetimos para todas las especies T(K) 298.15 ΔHTRx Al2O3 ΔHTRx CaO (cal) ΔHTRx Ag2O ΔHTRx PbO ΔHTRx ZnO (cal) (cal) (cal) (cal) -267266.67 -303200.00 -14600.00 -104880.00 -167600.00 500 -267344.37 -301955.33 -14009.15 -104241.15 -167284.56 700 -267186.93 -299855.91 -12774.06 -103408.58 -166802.05 900 -267008.70 -296862.01 -11048.17 -102459.38 -166353.36 1100 -266867.14 -292832.64 -8873.58 -101415.70 -165993.36 1300 -266784.33 -287601.92 -6266.50 -100286.08 -165743.15 1500 -266770.60 -280995.67 -3234.48 -99074.49 -165612.56 Ana Fernanda Alejandres Dueñas Tarea #2 Pirometalurgia 5. Graficamos el cambio de entalpia con respecto a la temperatura en Excel: Cambio de ΔHR con respecto a T 0.00 200 400 600 800 1000 1200 1400 1600 -50000.00 ΔHR (cal) -100000.00 Al2O3 -150000.00 CaO -200000.00 Ag2O PbO -250000.00 ZnO -300000.00 -350000.00 T(K) Conclusión Gracias a la gráfica podemos observar cómo se comportan las especies de los metales a diferentes temperaturas y por ello nos damos cuenta que mientras aumenta la temperatura la variación de entalpia tiende hacia lo positivo; esto nos indica que la afinidad de los metales hacia el oxigeno disminuye con respecto al aumento de la temperatura, por lo que podemos decir que entre más aumentemos la temperatura nos será más fácil separar el oxigeno del metal en los óxidos. Ana Fernanda Alejandres Dueñas Tarea #2 Pirometalurgia Referencias: Dabby S. Rafael (s.f.). formacion_compress.pdf Entalpía de formación[Archivo pdf] entalpia-de-