- Ninguna Categoria
Espectrofotometría: Cuantificación de Polifenoles en Té Negro
Anuncio
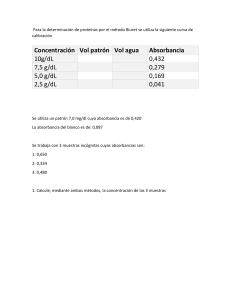
Laboratorio Bioquímica 2021-II 1 of 1 Reporte de laboratorio Espectrofotometría: Espectros de absorción y cuantificación espectrofotométrica de biomoléculas Diego Sánchez 1 y Camila Sánchez 2 1 Universidad de la Sabana; [email protected] 2 Universidad de la Sabana; [email protected] Received: 04-08-2021 Summary: This report aims to study polyphenols (antioxidant micronutrients) specifically the quantification of polyphenols extracted from black tea via vortex and ultrasound. To carry out the practice, the Folin- Ciocalteu test was carried out, a reactive that in presence of phenol groups carries out a Redox reaction which leads to the formation of a blue complex that was subsequently analyzed in the spectrophotometer. For the correct determination of polyphenols in the sample a calibration curve was made taking as solute the galic acid, this curve allowed the obtaining of the molar extinction coefficient for the galic acid leading to a value of 1,3275 mg-1mLcm with a minimum error of 3.4% compare to literature value. Finally it was determined by graphical methods that the concentration of polyphenols in black tea was 141,5 ppm and 196,4 ppm for vortex and ultrasound respectively leading to the conclusion ultrasound method of exraction is more efficient due to its great capacity for extracting organic compounds from liquid and solid matrix. Introducción: La bioquímica es por excelencia uno de los mayores campos de estudio de la química, su principal objetivo es el estudio de la composición química de las biomoléculas tales como proteínas, carbohidratos, lípidos, ácidos nucleicos entre otros. Para llevar a cabo el estudio de las moléculas antes mencionadas se requiere la utilización de técnicas analíticas que permitan su caracterización fisicoquímica junto con su debida cuantificación. Uno de los métodos más utilizados para este propósito es la espectroscopía, esta busca estudiar la interacción (absorción, transmisión, reflexión) entre la materia y la radiación electromagnética. En bioquímica es común la realización de espectroscopía UV-visible ya que permite la identificación de compuestos con dobles enlaces aislados, triples enlaces, enlaces peptídicos y demás heteroátomos; está técnica tiene como fundamento la interacción de la materia con la absorción de energía luminosa y su capacidad de almacenarla como energía interna por medio de los saltos energéticos que presentan los átomos desde su estado basal a un estado excitado una vez ha estado en contacto con la luz, finalmente esa energía absorbida es liberada permitiendo a la molécula regresar a su estado basal. Existen factores tales como pH, concentración de sal y disolvente que generan desplazamientos en los espectros UV (Abril, 2004, pg 2) 2 Laboratorio Bioquímica 2021-II 1 of 1 La espectroscopía revela datos de alta importancia molecular como la absorbancia (A), la ley de Lambert-Beer relaciona la absorbancia de luz monocromática y concentración de un cromóforo en solución por medio de la expresión: Donde C (M) representa la concentración del cromóforo, I es el recorrido generado por la longitud de onda emitida (longitud de celda) expresada en cm y ε es el coeficiente de extinción expresada en M-1 ‧cm-1, parámetro que define cuán fuertemente una sustancia absorbe la luz a una longitud de onda. (Serrano, 2015, pg 8-9). Esta práctica se realizó con el fin de estudiar la interacción entre la luz UV y la materia en estudio, para así cuantificar los polifenoles (micronutrientes de alta importancia) presentes en la muestra problema (Té negro). Esto con el objetivo de comprender los efectos de los procesos de extracción en la lectura espectroscópica, como la agitación vortex y el ultrasonido realizado. Dichos aspectos fueron medidos cuantitativamente por medio de la ley de Lambert-Beer al realizar una curva de calibración con el ácido gálico, junto con la determinación de su coeficiente de extinción molar por método gráfico, cálculos que facilitaron la correcta cuantificación de polifenoles en la muestra problema. Metodología Determinación de la humedad. La materia prima usada fue Té negro, proporcionada por el docente, el cual venía previamente deshidratado y donde por ende se asumió un porcentaje de humedad equivalente al 4%. Extracción de los polifenoles. Se pesaron 1.6617 g de hojas de Té negro las cuales ya estaban previamente cortadas, se transfirió la muestra cuantitativamente a un tubo falcon de 50 mL protegido de la luz con papel aluminio, se adicionaron 20 mL de Etanol y se procedió a agitar 5 veces en vortex durante 1 minuto (4 veces) durante 20 minutos. Luego se filtró en algodón y se recogió el sobrenadante en un matraz aforado para luego llevar a volumen con etanol, esto fue la muestra problema. Simultáneamente se realizó el mismo proceso, sin embargo, en este caso solo se realizó una agitación en vortex y se llevó a baño de ultrasonido 5 minutos, siendo 1 minuto de baño continúo seguido por 1 de reposo, en total, 3 baños en 5 minutos. Realización de la curva de calibración. Se prepararon los estándares en tubos eppendorf de 100 µ𝐿 , para ello se tomaron volúmenes iniciales arbitrarios de ácido gálico y se estableció un volumen final fijo para cada parámetro, equivalente a 100 µL, con ello y la concentración de la solución patrón equivalente a 1040 µg/ mL fue posible determinar la concentración de cada estándar, los cálculos fueron realizados por medio de la ecuación 1 y se ven reflejados en la tabla 1. 3 Laboratorio Bioquímica 2021-II 1 of 1 Cuantificación. Se adicionaron 20 µ𝐿 de los extractos y estándares a cada pozo, por cada solución se usaron 2 pozos para tener resultados por duplicado, sumado a esto se llenaron 2 pozos con el blanco y las muestras problema del vortex y ultrasonido. Se adicionó 100 µ𝐿 del reactivo FO diluido en agua (1:4) y 75µ𝐿 de Na2CO3 (7% p/v). Se cubrió de la luz dejándolo en un cajón oscuro por 15 minutos. Posteriormente se determinó la absorbancia a 630 nm usando un lector de microplacas (10). Se sustrajo la absorbancia del blanco a la de las muestras y estándares y se procedió a determinar la cantidad de polifenoles presentes en la muestra. Resultados y Análisis de resultados El principal objetivo de la presente práctica es determinar y cuantificar polifenoles en una muestra problema, para ello se realizó el ensayo Folin-Ciocalteu (FC). Este reactivo es una mezcla de wolframato sódico y molibdato sódico en ácido fosfórico capaz de reaccionar con los compuestos fenólicos. El ácido fosfomolibdotúngstico (formado por las dos sales en el medio ácido), tiene un color amarillo característico, este al ser reducido por los grupos fenólicos da lugar a un complejo de color azul intenso (complejo fosfomolíbdico-fosfotungstico). (García, s.f, pg. 4-5) Se considero necesario el implemento de una curva de calibración para la determinación de concentración de polifenoles en la muestra problema, por lo cual se realizaron diferentes disoluciones de ácido gálico (10.4, 20.8, 41.6, 83.2, 166.4, 332.8 µg/ mL) a partir de una solución patrón con una concentración equivalente a 1040 µg/ mL. Las cantidades específicas para cada disolución fueron calculadas por medio de la ecuación (1). Ecuación 1. Determinación concentración estándares. 𝐶1𝑉1 = 𝐶2 𝑉2 (1040 µ𝑔/𝑚𝐿)(1 µ𝐿) = 𝐶2 100 Tabla 1. Concentraciones estándares. Volumen Inicial (µL) 1 2 4 8 16 32 Volumen Etanol (µL) Concentración (µg/mL) 99 10,4 98 20,8 96 41,6 92 83,2 84 166,4 68 332,8 Una vez los estándares fueron preparados se procedió a acondicionar los 9 pozos a analizar, de manera que los pozos 2-7 corresponden a cada concentración de ácido gálico (de menor a mayor concentración), el pozo 8 la muestra problema tras una extracción vortex, el pozo 9 la muestra problema con extracción por ultrasonido y la cubeta 1 fue usada como blanco. Adicionalmente a cada pozo se adiciono 100 µL del reactivo FC y 75 µL de carbonato sódico permitiendo así que la 4 Laboratorio Bioquímica 2021-II 1 of 1 reacción reducción-oxidación entre los grupos fenólicos y los iones molibdato se llevara a cabo formando el complejo de color azul, cuya intensidad fue medida en el espectrofotómetro a 630 nm obteniendo así los resultados presentes en la tabla 2. Tabla 2. Resultados absorbancia de las muestras. Absorbancia Registrada. 1 2 3 4 5 6 7 8 9 Inicial 0,257 0,344 0,195 0,295 0,506 0,307 0,615 0,189 0,298 Dupli cado 0,201 0,254 0,295 0,284 0,282 0,53 0,799 0,407 0,48 A partir de la Tabla 2 se puede observar que el blanco registra valores tanto en la muestra inicial como su duplicado, siendo esta una posible fuente de error en las mediciones y absorciones del resto de las muestras representando errores en la curva de calibración, para eliminar dicho error es necesario restar el valor de blanco obtenido tanto en la muestra inicial como su duplicado obteniendo así la tabla 3 en donde se omite el valor de blanco por efectos prácticos para su representación gráfica. Tabla 3. Resultados blancos sustraído. Absorción registrada Inicial Duplicado 2 0,087 0,053 3 -0,062 0,094 4 0,038 0,083 5 0,249 0,081 6 0,05 0,598 7 0,358 0,329 8 -0,068 0,206 9 0,041 0,279 Seguidamente se realizó un promedio de los valores obtenidos inicialmente y sus duplicados, para con ellos generar la gráfica de concentración de polifenoles en función de la absorción registrada en cada celda obteniendo así la Tabla 4 junto con la Figura 1. Tabla 4. Promedio absorción registrada. 5 Laboratorio Bioquímica 2021-II 1 of 1 Promedios de absorción registrada Concentración 0,07 10,4 0,016 20,8 0,0605 41,6 0,165 83,2 0,1895 166,4 0,478 332,8 Figura 1. Curva de calibración promedio de resultados experimentales. Curva de calibración de ácido gálico 0,6 y = 0,0013x + 0,0182 R² = 0,9531 Absorbancia 0,5 0,4 0,3 0,2 0,1 0 0 50 100 150 200 250 300 350 Concentración (µg/ mL) La ley de Lambert-beer refleja que la absorción de luz a una determinada longitud de onda es directamente proporcional a la concentración de una disolución de un compuesto. Teniendo esto en cuenta se esperaba obtener una línea recta con pendiente positiva al graficar los datos de la tabla 4 ya que a mayor absorbancia debe ser mayor la concentración del compuesto diluido. Al observar la Figura 1 se puede notar que el promedio de los datos recolectados tiene una tendencia lineal con un coeficiente de correlación equivalente a 0.9531; a la vez y teniendo en cuenta la Ley de LambertBeer se puede determinar que la pendiente de dicha linealización representa el valor del coeficiente de extinción molar del ácido gálico, que para el caso presente obtiene un valor total de 0,0013 µg-1 mLcm-1 equivalente a 1,3275 mg-1mLcm-1, la literatura expresa un valor de 1,374 mg-1mLcm-1 como se observa en la figura 2 mostrando un error relativo mínimo del 3.4%. 6 Laboratorio Bioquímica 2021-II 1 of 1 Figura 2. Curva de calibración referencia de ácido gálico. (Rodríguez A, 2017) Según la ley de Lambert-Beer el coeficiente de extinción molar depende de variables como la concentración, absorbancia y la distancia que recorre la luz, este último valor suele ser estándar teniendo en cuenta que para este tipo de prácticas los tubos para la lectura de microplacas- llamados pozos a lo largo de este informe- usados suelen tener 1 cm de longitud, la absorbancia se ve afectada por el valor de longitud de onda que se aplique en el espectrofotómetro UV, poseen una relación directamente proporcional, dónde se establece que en 750 nm se obtiene la mejor lectura (Nieves Diaz, 2007), ahora bien, la lectura realizada en esta práctica fue a 630 nm, por lo que el valor de absorbancia discrepa con el de la literatura realizada al valor recomendado. Es de gran importancia mencionar los errores presentados en la práctica para evitar repetirlos a futuro, se puede decir que no se logró una linealización perfecta de coeficiente de relación de 0,99 por las posibles fallas cometidas al realizar los estándares, debido a un mal uso de las micropipetas, hecho que afecta la absorbancia del estándar en gran medida, dónde puede verse más evidenciada esta hipótesis es en la concentración de 20,8 µg/mL, ya que el valor de absorbancia es menor al de la concentración inmediatamente anterior y posterior, en este caso, ese estándar debió quedar con una concentración inferior a 10,4 µg/mL para justificar el valor obtenido. Así mismo al observar los datos registrados en la Tabla 2 se puede evidenciar una amplia diferencia de datos de absorción entre la muestra inicial y su duplicado, para lo que existen varias posibilidades de error que pudieron afectar los resultados, la primera de ellas y más probable resulta en errores con el material de laboratorio como lo fue la punta empleada en la micropipeta, durante la ejecución de la práctica se observó que en varias ocasiones quedaba un poco de muestra dentro de la punta, hecho que en su momento no representó mayor importancia, pero pudo generar discrepancias en los resultados. Al manejar cantidades del orden micro cualquier alteración a las cantidades puede generar irregularidades en cuanto a concentración de la sustancia buscada se refiere; reflejando así valores inferiores a los presentados por duplicado. 7 Laboratorio Bioquímica 2021-II 1 of 1 Para la determinación de polifenoles en las muestras problema se debe tomar el valor de absorbancia obtenido en el espectrofotómetro y reemplazarlo en la ecuación de la curva de calibración, para efectos prácticos a la hora de comparar con la literatura se toma la ecuación obtenida con concentración en unidad de mg/mL (Ecuación 2), sumado a esto, debido al evidente error de la fila inicial (Tabla 2), la determinación se realizó con base en la prueba duplicado, la cual cuenta en general con valores de mayor fiabilidad. Ecuación 2. 𝑦 = 1,3275𝑥 + 0,0182 Al reemplazar los valores de Y (Absorbancia) -registrados en la tabla 3- se obtiene la concentración en mg/mL para la muestra agitada en vortex y en ultrasonido, siendo 0,1415 mg/mL y 0,1962 mg/mL respectivamente. Realizando los cálculos correspondientes se convierte este valor a ppm para comparar con los datos registrados en la literatura, el valor de la muestra vortex es de 141,5 ppm y el de la muestra Ultrasonido es de 196,4 ppm. El té negro puede variar su concentración de polifenoles dependiendo su proveniencia e infusiones, por lo tanto, no existe un valor fijo para su cantidad ya que es muy variable, el té negro comercial ronda los 130 ppm, infusiones de té negro importadas rondan los 350 ppm y algunas otras importaciones procedentes de Inglaterra y Estados Unidos pueden llegar hasta a los 550 ppm (María Jiménez, 2017), como se puede observar el rango es muy amplio debido a lo mencionado anteriormente, los valores obtenidos en la práctica encajan dentro de los rangos dados, acercándose más a ser un té comercial, confirmando la efectividad del proceso realizado. El ultrasonido dio mejores resultados que el vortex debido a que este tiene gran capacidad de extracción de compuestos orgánicos de matrices líquidas y sólidas (Anyuri Fajardo, 2016), la extracción vortex desplaza el equilibrio en el sentido de la saturación del solvente (Jiménez, 2008), esta extracción resulta más efectiva en la referencia obtenida por el control de temperatura aplicado a ambos métodos, en este caso, no se tuvo esta consideración por lo que los resultados variaron. Para determinar la cantidad total de polifenoles en las muestras problemas debe de multiplicarse la concentración por el volumen total (25 mL en ambos casos), de esta forma se obtienen 3,53 mg de polifenoles en la muestra agitada con Vortex y 4,91 mg para la muestra agitada con ultrasonido. Finalmente, y teniendo en cuenta el porcentaje de humedad reportado por el docente se hizo uso de la ecuación 3. Ecuación 3. Determinación peso seco y peso húmedo. % 𝐻𝑢𝑚𝑒𝑑𝑎𝑑: (𝑃𝑒𝑠𝑜 ℎ𝑢𝑚𝑒𝑑𝑜 − 𝑃𝑒𝑠𝑜 𝑠𝑒𝑐𝑜) ∗ 100 𝑃𝑒𝑠𝑜 ℎ𝑢𝑚𝑒𝑑𝑜 Determinado así que el peso seco de polifenoles representa 3,39 mg para la extracción vortex y 4,71 mg parala extracción ultrasonido Conclusiones 8 Laboratorio Bioquímica 2021-II 1 of 1 El valor de extinción molar de ácido gálico encontrado fue de 1,3275 mg-1mLcm-1, el cual comparado al de la literatura, 1,374 mg-1mLcm-1 presenta un error del 3,4%, causado entre otras razones por la longitud de onda aplicada, de 630 nm en la práctica y de 750 en la referencia, hecho que afecta la absorbancia, sumado a errores de carácter experimental en el desarrollo. Se cuantificaron 3,53 mg de polifenoles en 25 mL de extracto en la muestra problema agitada con Vortex y 4,91 mg en la muestra agitada con Ultrasonido, a su vez que concentraciones de 141,5 ppm y 196,4 ppm, respectivamente. Estos valores de concentración coinciden con los de la literatura, los cuales tienen rangos amplios variando por su proveniencia e infusiones, no obstante, están más próximos a rangos de té comercial de 130 ppm que a otro tipo de tés. Referencias • Abril N. (2004) Espectrofometría: Espectros de absorción y cuantificación colorimétrica de biomoléculas. Universidad de Cordoba. Pg 2. • Fajardo-Romero, A. Arroyo-Rivera, A. Ramírez-Navas, J.S. (2016) Extracción de flavonoides totales de la envoltura externa de cebolla roja (Allium cepa) UGCiencia 22, 119126. • García.E, Fernandes. I, Fuentes.A. (s.f). Determinación de polifenoles por el método FolinCiocalteu. Universidad Politécnica de Valencia. Pg2 • Jiménez, A. (2008). Desarrollo de un proceso a escala de laboratorio para la extracción de colorante a partir de la flor del árbol de majagua (hibiscus elatus). Universidad EAFIT Medellín. Recuperado de https://repository.eafit. edu.co/bitstream/handle/10784/352/ AstridEliana_JimenezRamirez_2008. pdf?sequence=1&isAllowed=y • Jiménez M. (2017) Polifenoles presentes en infusiones y té negro. Instituto politécnico nacional. Pg 4. • Ramírez A. (2017). Efecto de los frutos de Acacia farnesiana en la dieta caprina: presencia de compuestos bioactivos y actividad antioxidante de la leche. (Tesis de pregrado) Universidad Nacional Autónoma de México. Ciudad de México. • 9 Serrano.J.(2015). El espectro espectromágnetico Absorción visible-ultravioleta. Pg8-9 Laboratorio Bioquímica 2021-II 10 1 of 1
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados