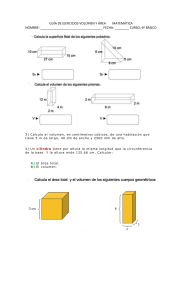
RA 1 LEY DE LA TERMODINÁMICA Presentada por: Ángeles Vega Oscar Villanueva Vazquez Salvador Definición de sistemas Abiertos y Cerrados ■ Sistema abierto: es aquél que intercambia ■ Sistema cerrado: es aquél que intercambia energía y materia con los alrededores. energía (calor y trabajo) pero no materia con los alrededores (su masa permanece constante). Cálculos energéticos en sistemas Sistema cerrado Sistema abierto En un recipiente liquido con las siguientes características y teniendo en cuenta que en tablas de agua liquida saturada tenemos un Vesp= 1.036 x 10 -3 m3/kg Y una presión de 70.183KPa. m=50Kg T=90°C Se obtiene una entalpia especifica h3 de 667.22 kJ/kg . EN el primer calculo energía de volumen de control. En el segundo se obtuvo gracias a tablas que la entalpia era de 377.04 kJ/kg. Análisis la ecuación de la ley-Matemáticamente La primera ley de la termodinámica en conceptos matemáticos: Dónde; = Calor suministrado al sistema [Cal, Joules] = Incremento en la energía del sistema [ Cal, Joules] = Trabajo realizado por el sistema [Cal, Joules] Definir eficiencia térmica, ciclo termodinámico y sus características Se denomina ciclo termodinámico al proceso que tiene lugar en dispositivos destinados a la obtención de trabajo a partir de dos fuentes de calor a distinta temperatura o, de manera inversa, a producir el paso de calor de la fuente de menor temperatura a la fuente de mayor temperatura mediante la aportación de trabajo. Ciclo Otto La eficiencia se utiliza para describir la energía que un sistema puede extraer y hacer útil de su fuente de energía. Entre estos sistemas se encuentran las centrales eléctricas, los motores y las turbinas. Desarrollo de un ejercicio Problema Suponga que un sistema pasa de un estado a otro, intercambiando energía con su vecindad. Calcule la variación de energía interna del sistema en los siguientes casos: a) El sistema absorbe 100 cal y realiza un trabajo de 200 J. b) El sistema absorbe 100 cal y sobre él se realiza un trabajo de 200 J. c) El sistema libera 100 cal de calor al alrededor, y sobre él se realiza un trabajo de 200 J. a) Para iniciar a resolver este inciso, debemos entender lo que nos pide. + El sistema absorbe 100 cal , que convertiremos en Joules. + El sistema realiza el trabajo de 200 J. Convertimos lo que absorbe el sistema: 𝟒. 𝟏𝟖𝑱 𝟏𝟎𝟎𝑪𝒂𝒍 = 𝟒𝟏𝟖𝑱 𝟏𝒄𝒂𝒍 Ahora esto nos indica que por fórmula tendremos: ∆𝑈 = 418𝐽 − 200𝐽 = 218𝐽 Observamos que la energía interna del sistema aumenta considerablemente a 218 J. ∆𝑈 = ∆𝑄 − ∆𝑇 b) Para este caso analizamos de la siguiente manera el inciso. + El sistema absorbe 100 cal – El trabajo fue realizado sobre el sistema 200J Por fórmula tenemos: Por lo que ahora, tenemos 618 Joules, y observamos un gran incremento de la energía interna. ∆𝑼 = 𝟒𝟏𝟖𝑱 − −𝟐𝟎𝟎𝑱 = 𝟔𝟏𝟖𝑱 c) En este caso el sistema hace las dos versiones distintas al inciso a), pues aquí tenemos el siguiente análisis. – El sistema libera 100 cal [Se convierte a Joules] – Se le aplica un trabajo sobre el sistema de 200 J Por fórmula tendríamos algo así: ∆𝑼 = −𝟒𝟏𝟖𝑱 − −𝟐𝟎𝟎𝑱 = −𝟐𝟏𝟖𝑱 Vemos que la energía del sistema disminuye considerablemente, y esto es lógico puesto que nada más recibió 200 J de energía y a su vez estaba liberando 418 Joules. Aplicación en la industria Eficiencia en una caldera utilizada en la industria Sistemas de ahorro en calderas industriales Precalentador de agua permite ahorrar de un 2% a un 12%. Precalentador de aire permiten ahorrar hasta un 5%. La eficiencia de estos dispositivos debe mayor a 90%. Una caldera es un recipiente metálico cerrado que, aplicando el calor de algún combustible sólido, líquido o gaseoso, produce vapor o calienta un fluido a una temperatura superior a la del ambiente y presión por encima de la atmosférica Las principales aplicaciones de las calderas de vapor se encuentran en el sector agropecuario y la industria agroalimentaria, el sector textil, el sector químico, la industria del papel y el caucho; el sector de la arcilla, el vidrio y el hormigón; y el sector servicios. De forma específica, las calderas de vapor se usan para el procesamiento de carne y la fabricación de salchichas; el acabado o revestimiento de hilados textiles, tejidos o artículos textiles confeccionados; la producción de productos de química orgánica; la producción de celulosa y papel; la producción de cristal o la producción de calor en hoteles o lavanderías, entre otros muchos usos. Gracias por su atención!! Fuentes de Consulta ■ Eficiencia - Enciclopedia de Energia. (s. f.). https://energyeducation.ca/Enciclopedia_de_Energia/index.php/Eficiencia ■ Innovación Docente Area MMT EINA-UZ. (2018, 23 mayo). Balance de energía en sistemas abiertos. YouTube. https://www.youtube.com/watch?v=5Eg1uWKKWlk ■ Julián, C. (2022, 21 noviembre). Leyes de la Termodinámica - Ejercicios Resueltos. Fisimat | Blog de Física y Matemáticas. https://www.fisimat.com.mx/leyes-de-la-termodinamica/ ■ Primer Principio de la Termodinámica. Sistemas termodinámicos. (s. f.). https://www2.montes.upm.es/dptos/digfa/cfisica/termo1p/sistema.html