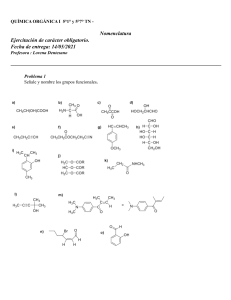
Química 2 Segunda edición Química 2 Segunda edición María Concepción Barbachano Rodríguez Revisión técnica Martha Lilia Rodríguez Arriaga Centro de Estudios Tecnológicos Industrial y de Servicios No. 59 (CETIS-DGETI) Torreón, Coahuila, México Zenaida Barbosa Ortiz Centro de Enseñanza Técnica Industrial Tonalá, Jalisco, México María del Carmen Gutiérrez Hernández Universidad Nacional Autónoma de México Datos de catalogación bibliográfica Autora: Barbachano Rodríguez, María Concepción Química 2 Segunda edición PEARSON EDUCACIÓN, México, 2015 ISBN: 978-607-32-3172-5 Área: Bachillerato/Ciencias Formato: 18.5 x 23.5 cm Páginas: 216 Química 2 Segunda edición Libro del estudiante El proyecto didáctico Química 2 es una obra colectiva creada por encargo de la editorial Pearson Educación de México, S.A. de C.V, por un equipo de profesionales en distintas áreas, que trabajaron siguiendo los lineamientos y estructuras establecidos por el departamento pedagógico de Pearson Educación de México, S.A. de C.V. Especialistas en Química responsables de los contenidos y su revisión técnico-pedagógica: Obra original: María Concepción Barbachano Rodríguez Revision técnica: Martha Lilia Rodriguez Arriaga, Zenaida Barbosa Ortiz y María del Carmen Gutiérrez Hernández. Dirección general: Sebastián Rodríguez Dirección de contenidos y servicios digitales: Alan Palau Gerencia de contenidos K-12: Jorge Luis Íñiguez Gerencia de arte y diseño: Asbel Ramírez Coordinación de bachillerato y custom: Lilia Moreno Coordinación de arte y diseño: Mónica Galván Edición sponsor: Berenice Torruco Supervisión de arte y diseño: Gustavo Rivas Edición de desarrollo: José Huerta Lectura de pruebas: Arlen Jiménez Diseño de portada: Fabiola Baires Diagramación: Miguel Ángel Martínez. ISBN LIBRO IMPRESO: 978-607-32-3172-5 ISBN E-BOOK: 978-607-32-3173-2 D.R. © 2015 por Pearson Educación de México, S.A. de C.V. Avenida Antonio Dovalí Jaime # 70. Torre B, Piso 6, Colonia Zedec Ed Plaza Santa Fe, Delegación Álvaro Obregón, México, Distrito Federal C.P. 01210 Cámara Nacional de la Industria Editorial Mexicana Reg. Núm. 1031 Impreso en México. Printed in Mexico. 1 2 3 4 5 6 7 8 9 0 - 17 16 15 14 Reservados todos los derechos. Ni la totalidad ni parte de esta publicación pueden reproducirse, registrarse o transmitirse, por un sistema de recuperación de información en ninguna forma ni por ningún medio, sea electrónico, mecánico, fotoquímico, magnético o electroóptico, por fotocopia, grabación o cualquier otro, sin permiso previo por escrito del editor. El préstamo, alquiler o cualquier otra forma de cesión de uso de este ejemplar requerirá también la autorización del editor o de sus representantes. www.pearsonenespañol.com Dedicatoria Dedico esta obra a mis padres, Humberto Barbachano y Elvira Rodríguez, quienes con su dedicación, sacrificio, consejos y ejemplo, lograron reformar a una mujer de estructura sólida para desenvolverse como persona útil a su país en le desempeño de la profesión; a mis hermanos y hermanas que con su experiencia profesional, amor y cariño entrañables supieron encausar mis expectativas profesionales en beneficio de la sociedad a la que pertenecemos; a mis amadas hijas, Elvira, Karla y Sophia, motores primordiales de mi vida, que sin escatimar tiempos, sueños y deseos, gestaron momentos detonantes para apoyar este gran proyecto. A todos, ¡muchas gracias! M. en C. Ma. Concepción Barbachano Rodríguez [v] Contenido Presentación Introducción Competencias genéricas Competencias disciplinares vi vii ix xii Unidad 1 ESTEQUIOMETRÍA Secuencia didáctica 1 Reacciones químicas Ecuación química Tipos de reacciones Balanceo de ecuaciones Secuencia didáctica 2 Leyes ponderales Unidades químicas Cálculos estequiométricos Confirmación de conocimientos de la unidad 1 3 6 9 16 35 42 51 56 Unidad 2 DISOLUCIONES QUÍMICAS Secuencia didáctica 3 Disoluciones Generalidades Clasificación de disoluciones Estequiometría de disoluciones 59 Secuencia didáctica 4 Ácidos y bases Teorías ácido-base Escalas de medición de acidez y basicidad Neutralización 79 Confirmación de conocimientos de la unidad 2 [ vi ] 61 62 65 84 86 89 95 Unidad 3 QUÍMICA DEL CARBONO Secuencia didáctica 5 Química orgánica alifática Introducción a la química orgánica ¿Qué es el carbono? Clasificación de hidrocarburos Secuencia didáctica 6 Hidrocarburos aromáticos Generalidades de los hidrocarburos aromáticos Compuestos orgánicos de importancia biológica Confirmación de conocimientos de la unidad 3 99 102 103 108 135 137 159 173 Prácticas de laboratorio (9 sesiones) 1. Reacciones químicas 2. Tipos de reacciones 3. Balanceo de ecuaciones 4. Estequiometría 5. Preparación de disoluciones 6. Ácidos y bases 7. Titulación 8. El carbono 9. Grupos funcionales 175 177 179 182 185 187 190 192 194 Glosario Bibliografía Tabla periódica 196 197 198 [ vii ] Presentación Este libro de texto pretende ser un auxiliar didáctico con el que alumnos y docentes de la asignatura de Química 2 logren uno de los objetivos principales de la Reforma Integral de Educación Media Superior (RIEMS): dotar a los estudiantes de una educación basada en competencias genéricas y disciplinares; es decir, en algo más que una serie de conocimientos que pueden adquirirse no sólo de manera memorística —como se ha trabajado tradicionalmente—, sino también de procesos mentales complejos que permitan a los estudiantes enfrentar situaciones diversas a lo largo de su vida y desempeñarse adecuadamente para los retos del siglo XXI. Las disciplinas, como unidades de conocimiento, deben recuperar aprendizajes históricos importantes definidos en un marco de rigor metodológico. La estructura de dichas disciplinas es el centro del aprendizaje académico que debe ser aprovechado para seguir construyendo sobre éste y otros tipos de aprendizajes. Por tanto, este material didáctico presenta una secuencia lógica de contenidos que recupera conocimientos adquiridos (previos), necesarios para la adquisición de los nuevos por aprender. Este texto de Química 2 para el nivel medio superior pretende apoyar a los alumnos en el entendimiento de esta ciencia de una forma clara, sencilla, precisa y dinámica mediante un fuerte componente metodológico basado en competencias, con el fin de que empleen los conceptos fundamentales y básicos de la química orgánica e inorgánica al proponer fórmulas y plantear ecuaciones que les permitan explicar los tipos de fenómenos o reacciones que se presentan principalmente en la producción de diversos compuestos, fundamentales para la formación de otros. Asimismo, que reconozcan los tipos de soluciones que se forman, y que realicen los cálculos estequiométricos necesarios para la cuantificación de las masas que se involucran, al igual que la rapidez y las circunstancias en que se presentan, cuando existe una transformación de unas sustancias en otras de importancia química, biológica y ecológica. Además, se ejemplifican todos estos conceptos para lograr los aprendizajes significativos hacia una mejor comprensión de los procesos que se presentan en todos los niveles de nuestro Universo. La autora [ viii ] Introducción El objetivo de facilitar el aprendizaje no es un fin en sí mismo, sino que está en función de que el alumno logre cada vez mayor autonomía; es decir, que aprenda con el maestro, sin el maestro y a pesar del maestro. La autonomía debe ser vista como requisito indispensable de acceso a la era de la información y el conocimiento. Es más un punto de llegada que de partida; y por ello, resultan de gran utilidad las ideas referidas al establecimiento de competencias que vayan haciendo cada vez más accesible y compleja la tarea. Los niveles de competencia deberán acompañarse de las condiciones de desempeño requeridas para que los alumnos vayan accediendo a niveles superiores de desarrollo intelectual de forma independiente e interdependiente. Facilitar el aprendizaje implica saber seleccionar lo que corresponde a la fase de planificación de corte estratégico y prospectivo para anticiparse a los resultados y logros. En este punto, esta obra dosifica el contenido del programa de Química 2 para el nivel medio superior en tres unidades: unidad 1, Estequiometría; unidad 2, Disoluciones químicas, y unidad 3, Química del carbono, mediante una secuencia lógica de contenidos, acompañados por las competencias genéricas y disciplinares. En la presentación de los contenidos teóricos, en primera instancia, se acerca a los alumnos a que obtengan información de los mismos para el posterior desarrollo de habilidades y destrezas en la resolución de problemas mediante actividades de aprendizaje. Se presentan ejemplos tanto algebraicos como químicos, además de una serie de actividades para la confirmación de los conocimientos adquiridos. Para reafirmar dichos conocimientos se incluyen prácticas de laboratorio, se incorporan preguntas intercaladas y figuras como elementos didácticos y, al final de los temas, el cuestionamiento del porqué de los aprendizajes. Por otra parte, se incluyen secciones de confirmación de los conocimientos para complementar el desarrollo integral del estudiante. Unidad 1. Estequiometría. Incluye los temas de Reacciones químicas (como eje transversal) y Leyes ponderales. En esta unidad se persigue la conceptualización, identificación, aplicación de leyes en la resolución de problemas y la concientización sobre los efectos de las reacciones químicas cuando se hace buen o mal uso de los recursos naturales. Unidad 2. Disoluciones químicas. A través de los temas: Disoluciones y Ácidos y bases se genera el reconocimiento en la conceptualización, unidades de medición y aplicación de normas para la identificación y/o preparación de soluciones, que es tarea obligada, ya que las soluciones están presentes en todos los niveles. También se trata la importancia que su aplicación implica a nivel industrial, médico, biológico y ecológico, así como en los estilos de vida saludables. Unidad 3. Química del carbono. El desarrollo del tema sigue la misma secuencia lógica de su contenido en esta unidad con los temas Química orgánica alifática e Hidrocarburos aromáticos. Orienta a los estudiantes a conocer sistemas de nomenclatura, estructuras y la importancia de las funciones orgánicas, al igual que los compuestos de importancia biológica. Identificar y cuidar responsablemente las fuentes no renovables más importantes de obtención de compuestos del carbono es tema obligado de esta unidad. [ ix ] Para finalizar con el contenido de la obra, se presenta un glosario, cuyo objetivo es apoyar a los alumnos en la terminología empleada en el texto, a efecto de que no sea un obstáculo para continuar con su aprendizaje. Por último, se incluye como una tabla periódica con un formato amigable al alumno. Confiamos en que la vasta experiencia de la autora, que se refleja a lo largo de las páginas de esta obra, se trasluzca como aporte al quehacer cotidiano en el aula, de alumnos y maestros. [x] Competencias genéricas 1. Se conoce y valora a sí mismo y aborda problemas y retos teniendo en cuenta los objetivos que persigue. 1.1 Enfrenta las dificultades que se le presentan y es consciente de sus valores, fortalezas y debilidades. 1.2 Identifica sus emociones, las maneja de manera constructiva y reconoce la necesidad de solicitar apoyo ante una situación que lo rebase. 1.3 Elige alternativas y cursos de acción con base en criterios sustentados y en el marco de un proyecto de vida. 1.4 Analiza críticamente los factores que influyen en su toma de decisiones. 1.5 Asume las consecuencias de sus comportamientos y decisiones. 1.6 Administra los recursos disponibles teniendo en cuenta las restricciones para el logro de sus metas. 2. Es sensible al arte y participa en la apreciación e interpretación de sus expresiones en distintos géneros. 2.1 Valora el arte como manifestación de la belleza y expresión de ideas, sensaciones y emociones. 2.2 Experimenta el arte como un hecho histórico compartido que permite la comunicación entre individuos y culturas en el tiempo y el espacio, a la vez que desarrolla un sentido de identidad. 2.3 Participa en prácticas relacionadas con el arte. 3. Elige y practica estilos de vida saludables. 3.1 Reconoce la actividad física como un medio para su desarrollo físico, mental y social. 3.2 Toma decisiones a partir de la valoración de las consecuencias de distintos hábitos de consumo y conductas de riesgo. 3.3 Cultiva relaciones interpersonales que contribuyen a su desarrollo humano y el de quienes lo rodean. 4. Escucha, interpreta y emite mensajes pertinentes en distintos contextos mediante la utilización de medios, códigos y herramientas apropiados. 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.2 Aplica distintas estrategias comunicativas según quienes sean sus interlocutores, el contexto en el que se encuentra y los objetivos que persigue. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 4.4 Se comunica en una segunda lengua en situaciones cotidianas. 4.5 Maneja las tecnologías de la información y la comunicación para obtener información y expresar ideas. 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo a categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen a una serie de fenómenos. [ xi ] Competencias genéricas (continuación) 5.4 Construye hipótesis y diseña y aplica modelos para probar su validez. 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 5.6 Utiliza las tecnologías de la información y comunicación para procesar e interpretar información. 6. Sustenta una postura personal sobre temas de interés y relevancia general, considerando otros puntos de vista de manera crítica y reflexiva. 6.1 Elige las fuentes de información más relevantes para un propósito específico y discrimina entre ellas de acuerdo a su relevancia y confiabilidad. 6.2 Evalúa argumentos y opiniones e identifica prejuicios y falacias. 6.3 Reconoce los propios prejuicios, modifica sus puntos de vista al conocer nuevas evidencias, e integra nuevos conocimientos y perspectivas al acervo con el que cuenta. 6.4 Estructura ideas y argumentos de manera clara, coherente y sintética. 7. Aprende por iniciativa e interés propio a lo largo de la vida. 7.1 Define metas y da seguimiento a sus procesos de construcción de conocimiento. 7.2 Identifica las actividades que le resultan de menor y mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. 7.3 Articula saberes de diversos campos y establece relaciones entre ellos y su vida cotidiana. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.2 Aporta puntos de vista con apertura y considera los de otras personas de manera reflexiva. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. 9. Participa con una conciencia cívica y ética en la vida de su comunidad, región, México y el mundo. 9.1 Privilegia el diálogo como mecanismo para la solución de conflictos. 9.2 Toma decisiones a fin de contribuir a la equidad, bienestar y desarrollo democrático de la sociedad. 9.3 Conoce sus derechos y obligaciones como mexicano y miembro de distintas comunidades e instituciones, y reconoce el valor de la participación como herramienta para ejercerlos. 9.4 Contribuye a alcanzar un equilibrio entre el interés y bienestar individual y el interés general de la sociedad. [ xii ] Competencias genéricas (continuación) 9.5 Actúa de manera propositiva frente a fenómenos de la sociedad y se mantiene informado. 9.6 Advierte que los fenómenos que se desarrollan en los ámbitos local, nacional e internacional ocurren dentro de un contexto global interdependiente. 10. Mantiene una actitud respetuosa hacia la interculturalidad y la diversidad de creencias, valores, ideas y prácticas sociales. 10.1 Reconoce que la diversidad tiene lugar en un espacio democrático de igualdad de dignidad y derechos de todas las personas, y rechaza toda forma de discriminación. 10.2 Dialoga y aprende de personas con distintos puntos de vista y tradiciones culturales mediante la ubicación de sus propias circunstancias en un contexto más amplio. 10.3 Asume que el respeto de las diferencias es el principio de integración y convivencia en los contextos local, nacional e internacional. 11. Contribuye al desarrollo sustentable de manera crítica, con acciones responsables. 11.1 Asume una actitud que favorece la solución de problemas ambientales en los ámbitos local, nacional e internacional. 11.2 Reconoce y comprende las implicaciones biológicas, económicas, políticas y sociales del daño ambiental en un contexto global interdependiente. 11.3 Contribuye al alcance de un equilibrio entre los intereses de corto y largo plazo en relación con el ambiente. [ xiii ] Competencias disciplinares 1. Establece la interrelación entre la ciencia, la tecnología, la sociedad y el ambiente en contextos históricos y sociales. 2. Fundamenta opiniones sobre los impactos de la ciencia y la tecnología en su vida cotidiana, asumiendo consideraciones éticas. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder a preguntas de carácter científico, consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 8. Explica el funcionamiento de máquinas de uso común a partir de nociones científicas. 9. Diseña modelos o prototipos para resolver problemas, satisfacer necesidades o demostrar principios científicos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. 11. Analiza las leyes generales que rigen el funcionamiento del medio físico y valora las acciones humanas de riesgo e impacto ambiental. 12. Decide sobre el cuidado de su salud a partir del conocimiento de su cuerpo, sus procesos vitales y el entorno al que pertenece. 13. Relaciona los niveles de organización química, biológica, física y ecológica de los sistemas vivos. 14. Aplica normas de seguridad en el manejo de sustancias, instrumentos y equipo en la realización de actividades de su vida cotidiana. [ xiv ] Unidad uno Estequiometría Reacciones químicas Ecuaciones químicas Tipos de reacciones Balanceo de ecuaciones Leyes ponderales Unidades químicas Cálculos estequiométricos Estequiometría Competencias disciplinares que se tratan en la unidad 1. Establece la interrelación entre la ciencia, la tecnología, la sociedad y el ambiente en contextos históricos y sociales. 2. Fundamenta opiniones sobre los impactos de la ciencia y la tecnología en su vida cotidiana, asumiendo consideraciones éticas. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico, consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. 11. Analiza las leyes generales que rigen el funcionamiento del medio físico y valora las acciones humanas de riesgo e impacto ambiental. 12. Decide sobre el cuidado de su salud a partir del conocimiento de su cuerpo, sus procesos vitales y el entorno al que pertenece. 14. Aplica normas de seguridad en el manejo de sustancias, instrumentos y equipo en la realización de actividades de su vida cotidiana. Tema integrador de la unidad Con ayuda de su profesor, el grupo elegirá un tema relacionado con su entorno —a partir de los contenidos tratados en esta unidad— para dar una respuesta significativa a las interrogantes que surjan durante el aprendizaje de los contenidos. Es deseable que el tema elegido se coordine con otras asignaturas para obtener respuestas más integrales en la obtención de los conocimientos por aprender. Puede utilizarse un cuadro como el que se propone a continuación. TEMA INTEGRADOR Asignatura 1 Problemática: Observaciones [2] Asignatura 2 Problemática: Asignatura 3 Problemática: Asunto significativo Unidad 1 | Secuencia 1 secuencia uno Reacciones químicas Reacciones químicas El experimentador que no sabe lo que está buscando no comprenderá lo que encuentra. Claude Bernard Propósito de la secuencia Competencias disciplinares Adquirir las nociones estequiométricas suficientes para argumentar la importancia de los cálculos respectivos en procesos que tienen repercusiones económicas y ecológicas en el medio en el que se presentan. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 4.5 Maneja las tecnologías de la información y la comunicación para obtener información y expresar ideas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo a categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 7.2 Identifica las actividades que le resultan de menor y mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. [3] Química 2 Contenidos que aborda la secuencia 1 Conceptuales • Reacciones químicas. Ecuaciones químicas. Tipos de reacciones. Balanceo de ecuaciones. || || || Procedimentales Axiológicos • Realizará las actividades propuestas para reafirmar el conocimiento adquirido. • Desarrollará investigaciones con base en las fuentes bibliográficas sugeridas. • Responderá preguntas intercaladas mediante la reflexión. • Desarrollará responsabilidades y compromisos al reconocer que las reacciones se realizan en todos los niveles. • Valorará la importancia de la cuantificación de las reacciones para sustentar el cuidado del medio ambiente. • Promoverá el uso responsable de las sustancias químicas en nuestra vida diaria. • Valorará las aportaciones históricas de científicos en los enunciados de las leyes estequiométricas. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) Producto esperado Instrumentos de evaluación sugeridos 1. Actividad grupal (p. 5) • Cuestionario • Guía de observación 2. Actividad grupal (pp. 8-9) • Cuestionario y resolución de ejercicios • Guía de observación 3. Actividad grupal (p. 10) • Resolución de ejercicios • Guía de observación 4. Actividad individual (p. 11) • Resolución de ejercicios • Lista de cotejo 5. Actividad individual (p. 12) • Resolución de ejercicios • Lista de cotejo 6.Actividad individual (p. 14) • Resolución de ejercicios • Lista de cotejo 7. Actividad grupal (p. 16) • Reporte de práctica 1 • Rúbrica 8.Actividad grupal (p. 16) • Reporte de práctica 2 • Rúbrica 9. Actividad individual (pp. 17-18) • Resolución de ejercicios • Lista de cotejo 10. Actividad grupal (p. 20) • Resolución de ejercicios • Guía de observación 11. Actividad individual (p. 21) • Resolución de ejercicios • Lista de cotejo 12. Actividad individual (p. 23) • Resolución de ejercicios • Lista de cotejo 13. Actividad grupal (p. 26) • Resolución de ejercicios • Guía de observación 14. Actividad individual (p. 28) • Resolución de ejercicios • Lista de cotejo [4] Unidad 1 | Secuencia 1 Reacciones químicas Apertura de secuencia Reacciones químicas Lee con atención el siguiente texto y realiza la actividad grupal que aparece al final. El cambio climático, la contaminación del agua, la reducción de la capa de ozono y las energías renovables son temas que en la actualidad ocupan lugares relevantes en los medios de comunicación y que han cobrado gran importancia en nuestra vida diaria. En el campo de la química son numerosos los avances y las investigaciones científicas que están permitiendo desarrollar materiales que protejan el medio ambiente y que ayuden a lograr la calidad y el estilo de vida que deseamos. Hay gente que considera que la industria química es perjudicial para el ambiente, y aunque existe una gran cantidad de reacciones químicas que han llevado a reconsiderar si la química es una ayuda o un obstáculo para el ambiente, informarse sería un buen punto de partida para forjarse un criterio propio al respecto. Potenciar las ciencias químicas a través de la investigación y el desarrollo con el fin de conservar un buen nivel de vida —en armonía con el ambiente y con la naturaleza—, es pues el mayor desafío de todas las ramas de la ciencia moderna, en especial de las que se dedican a la integración de la tecnología con la naturaleza y con el ser humano. A partir de ello, el reto será motivar y fomentar la cooperación para convertirnos en agentes activos del desarrollo ambiental y de la sustentabilidad del planeta, buscando los beneficios económicos, socioculturales y ambientales que proporcionen una adecuada calidad de vida sin poner en riesgo la de las generaciones futuras. Escribe los números correspondientes ACTIVIDAD GRUPAL Competencias genéricas 1. Reúnanse en equipos de tres o cuatro integrantes y a partir del texto anterior discutan las preguntas siguientes: Competencias disciplinares a) ¿Cómo sabemos que ha ocurrido una reacción química en nuestro entorno? b) ¿Qué impacto tienen los malos hábitos personales de consumo sobre los recursos naturales? c) ¿Qué podemos hacer al respecto? 2. Cada equipo presentará sus respuestas ante el grupo y, guiados por su profesor, escribirán sus conclusiones generales. 3. Incorporen esta actividad a su portafolio de evidencias. [5] Química 2 Desarrollo de secuencia Entremos en materia Estequiometría Para entender el porqué de las reacciones químicas, así como el manejo estequiométrico de éstas en todos los niveles, es necesario conocer algunos conceptos base, como los que explicaremos a continuación. La estequiometría es una rama de la química que estudia las proporciones ponderales o volumétricas en una reacción química (desde el punto de vista cuantitativo). En 1792, el químico alemán Jeremías B. Richter fue el primero en usar el término para designar la estequiometría como la disciplina que mide las proporciones según las cuales se deben combinar los elementos químicos. Richter fue uno de los primeros químicos en descubrir que las masas de los elementos y las cantidades en que se combinan se hallan en una relación constante, la cual puede ser representada mediante una ecuación química. La relación que tienen las cantidades relativas de reactivos y productos involucrados en una reacción química pueden mostrarse mediante la realización de cálculos estequiométricos para conocer con precisión la cantidad que se va a obtener de un determinado producto. Reacción química Se dice que ha ocurrido un fenómeno o reacción cuando se efectúa un cambio que responde a diversos factores: •Cuando el cambio que se presenta altera la naturaleza interna de los cuerpos, se dice que el cambio, fenómeno o reacción es químico. •Si el cambio no altera las sustancias que en él se involucran, se dice que el cambio, fenómeno o reacción es físico. Durante una reacción química existe el rompimiento y la formación de nuevos enlaces que dan lugar a sustancias nuevas, cuyas propiedades son diferentes a las de las sustancias que les dieron origen. La reacción química es un proceso que se realiza constantemente en todos los niveles del Universo, y para representarla se utiliza un modelo matemático llamado ecuación química. Ecuación química La ecuación química es una relación que muestra las cantidades relativas de reactivos y productos involucrados en una reacción química. Los cálculos estequiométricos [6] Unidad 1 | Secuencia 1 Reacciones químicas correspondientes se realizan con base en las reacciones químicas para conocer con precisión la cantidad que se va a obtener de un determinado producto. La representación algebraica o matemática de una reacción química se compone de letras, números y signos auxiliares para la interpretación correcta de las reacciones. Ejemplo: aA bB 2H2 O2 cC dD 2H2O Por tanto, los componentes de una ecuación química son los siguientes: Literales. Son las letras que representan los símbolos de los elementos (fórmulas) de las sustancias. Ejemplo: NaCl Coeficientes. Son los números que se anteponen a las literales (fórmulas), e indican el número de veces que está presente la fórmula (número de moléculas que participan en la reacción). Ejemplo: 2NaCl (significa que son 2 moléculas de NaCl). Subíndices. Son los números pequeños que se escriben al pie de cada símbolo, y representan el número de átomos que intervienen en la fórmula. Ejemplo: H2SO4 (en esta fórmula intervienen 7 átomos: 2 átomos de hidrógeno, 1 átomo de azufre y 4 átomos de oxígeno). Flechas. Separan unas sustancias de otras (reactivos de productos); en ellas se acostumbra determinar las condiciones bajo las cuales se efectúa la reacción, como presión, temperatura, calor, catalizadores (cat.), etcétera. 2 atm Ejemplo: N2 3H2 2NH3 cat. Signos auxiliares. Estos signos se agregan para representar la reacción química lo más completa posible. Algunos de estos signos son: (g) ( ) (s) ( ) (l) ( ) ( ac ) Estado gaseoso Calor Estado sólido Reversibilidad Estado líquido Irreversibilidad Acuoso ( ) (P) (T) ( STP ) ( ) (E) ( λυ ) Liberación de gases Presión Temperatura Condición estándar Precipitación de sólidos Energía de activación Energía de radiación electromagnética [7] Química 2 La ecuación química está compuesta por dos fracciones separadas entre sí por flechas. A B C reactivos D productos En el lado izquierdo se escriben los reactivos y en el lado derecho se anotan los productos que se obtienen por la acción entre los reactivos. Así que para: N2(g) 3H2(g) 2NH3(g) nitrógeno hidrógeno gaseoso amoniaco calor Los reactivos son el nitrógeno e hidrógeno gaseoso, y el producto es el amoniaco con liberación de energía en forma de calor. En esta ecuación reaccionan 1 molécula de nitrógeno con 3 moléculas de hidrógeno para formar 2 moléculas de amoniaco, más calor liberado. También se puede interpretar del siguiente modo: reaccionan 2 átomos de nitrógeno con 6 átomos de hidrógeno para producir la misma cantidad de átomos en un compuesto diferente que es el amoniaco. Escribe los números correspondientes ACTIVIDAD GRUPAL En equipos de dos o tres personas realicen la siguiente actividad con el fin de reforzar los conocimientos aprendidos. Competencias genéricas Competencias disciplinares 1. Observen cuidadosamente cada una de las ecuaciones, determinen y contesten las preguntas. I. 2H2 ( g ) O2 ( g ) 2H2O ( l ) a) ¿La reacción anterior es irreversible? b) ¿Cuántas moléculas de agua se producen? c) ¿Cuántas moléculas de oxígeno participan? II. 2HCI Zns ZnCI2s H2 ( g ) d) ¿Cuáles son los productos de la ecuación anterior? e) ¿Cuántas moléculas de zinc participan? f) ¿Cuántos átomos de hidrógeno se liberan? [8] Unidad 1 | Secuencia 1 III. 2KCIO3 ( s ) Reacciones químicas 2KCI ( I ) 3O2 ( g ) g) ¿Cuántos reactivos participan en la ecuación anterior? h) ¿Cuántos productos se obtienen? i) ¿En qué estado de agregación se encuentra el reactivo? IV. 2Mn(CO)5s 7O2g 2MnO2s 10CO2 ( g ) j) ¿Cuántas moléculas de oxígeno reaccionan en la ecuación anterior? k) ¿Cuántos átomos de oxígeno se obtienen? l) ¿Cuáles son los productos? V. KBr ( ac ) AgNO3 ( ac ) 2KNO3 ( ac ) AgBr ( s ) m) En la ecuación anterior, ¿qué significa el signo (ac)? n) ¿Qué sustancia se precipita? o) ¿La reacción es irreversible? 2. Incorporen esta actividad a su portafolio de evidencias. Tipos de reacciones Debido a la formación y ruptura de enlaces entre los átomos de las sustancias que intervienen en las reacciones, éstas se clasifican en los siguientes tipos. •• Reacciones de síntesis (combinación). •• Reacciones de análisis (descomposición). •• Reacciones de sustitución simple (simple desplazamiento). •• Reacciones de sustitución doble (doble desplazamiento). •• Reacciones endotérmicas y exotérmicas. •• Reacciones de óxido-reducción. •• Reacciones ácido-base (neutralización). Reacciones de síntesis (combinación) Se caracterizan por la unión de 2 o más reactivos para formar un solo producto, como se muestra a continuación. [9] Química 2 Ejemplos algebraicos AB A B 2 reactivos 1 producto ABC A B C 3 reactivos 1 producto Ejemplos químicos 2H2O 2H2 O2 Agua + azúcar + jugo de limón Escribe los números correspondientes Competencias genéricas limonada ACTIVIDAD GRUPAL Realicen la siguiente actividad para reforzar los conocimientos aprendidos. 1. En equipos de tres o cuatro personas recuperen el aprendizaje que adquirieron acerca del tema de nomenclatura del curso de Química I, y completen los espacios del siguiente ejercicio, determinando las fórmulas de las sustancias que participan en la reacción de síntesis que corresponda. Ejemplo: SO2 H2O H2SO3 Competencias disciplinares a) Cu O2 b) H2O Ca(OH)2 c) Br2 O2 d) SO3 e) H2SO4 H2O H2CO3 f) Na Cl2 g) O2 K2O i) O2 Cr O3 j) H2O h) Hg O2 Ba(OH)2 2. Incorporen esta actividad a su portafolio de evidencias. Reacciones de análisis (descomposición) Son aquellas reacciones en las que a partir de un solo reactivo se obtienen dos o más productos. Estas reacciones son lo contrario de las de síntesis, por lo que se les nombra de descomposición de un reactivo en sus componentes. [ 10 ] Unidad 1 | Secuencia 1 Reacciones químicas Ejemplos algebraicos: AB A B ABC A B C Ejemplos químicos: 2H2O 2H2 O2 2KClO3 2KCl 3O2 Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Completa los espacios determinando las fórmulas de las sustancias que participan en la reacción de análisis que corresponda. Ejemplo: CaCO3 c) NH3 Competencias disciplinares CaO CO2 a) H2SO4 b) NaCl Competencias genéricas H2O Na H2 d) AgNO3 e) P2O5 f) BeCl2 Be 2. Incorpora esta actividad a tu portafolio de evidencias. Reacciones de sustitución simple (simple desplazamiento) Son aquellas reacciones en las que a partir de dos reactivos —uno elemental y el otro compuesto—, una fracción del reactivo compuesto es sustituida por el reactivo elemental. Si el reactivo elemental es metal y el compuesto es una sal, el metal desplazará el metal de la sal de acuerdo a la siguiente serie de reactividad química: Metales: Au Hg Ag Cu H Pb Sn Ni Fe Zn Al Mg Na Ca K Halógenos: I2 Br2 Cl2 F2 De acuerdo a la serie de reactividad anterior un elemento desplazará al de su izquierda (hay reacción), mientras que no podrá desplazar al elemento que se encuentre a su derecha (no hay reacción); por ejemplo, el Zn desplazará al H pero no podrá desplazar al Na. [ 11 ] Química 2 Algunas reacciones de este tipo son: 1. Metal Ácido Sal H2 2. Metal H2O Hidróxido H2 3. Metal Oxisal Metal Sal 4. Halógeno Sal Haloidea Hidrosal Halógeno Ejemplos algebraicos: AB C AC B A BC C BA Ejemplo químico: Mg 2HCl MgCl2 H2 En esta reacción el magnesio sustituye al hidrógeno (ya que son equivalentes en cuanto a cargas, y el hidrógeno es una fracción del ácido clorhídrico) para formar una sal haloidea (cloruro de magnesio) como producto de la sustitución. Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. Completa los espacios de forma individual determinando las fórmulas de las sustancias que participan en la reacción de sustitución simple. Al finalizar el ejercicio puedes comparar resultados con los de tus compañeros. Competencias disciplinares a) NaI Cl2 b) Zn HCl c) Cl2 d) Br2 H2O KOH e) Na 2. Incorpora esta actividad a tu portafolio de evidencias. [ 12 ] H2 Unidad 1 | Secuencia 1 Reacciones químicas Reacciones de sustitución doble (doble desplazamiento) Son aquellas reacciones en las que, a partir de 2 reactivos compuestos, una fracción de uno de los reactivos es sustituida o desplazada por una fracción del otro reactivo, y las 2 fracciones que fueron sustituidas se unen entre sí para formar un producto nuevo. Ejemplo algebraico AB CD AD CB Ejemplo químico HCl NaOH NaCl H2O Algunas reacciones de este tipo son: 1. Ácido Base 3. Óxido Ácido Sal Base( s ) → Oxisal Hidrosal Ácido Sal( s ) → Sal Base Sal( ac ) Sal( s ) → Sal Ácido → 2. Sal Sal Sal H2O 5 neutralización Oxisal Hidrosal( s ) Sal H2O calor 5 hidrólisis 4. Formación de gas: Ácido Oxisal Sal H2O Gas→ [ 13 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. Para reforzar el aprendizaje adquirido completa los espacios, determinando las fórmulas de las sustancias que participan en la reacción de sustitución doble. Competencias disciplinares a) H2SO4 Na2SO4 b) CaO K2O c) Na2S SeCl2 d) KCl AgCl KNO3 e) Ca(OH)2 K2O f) KOH K3PO4 2. Incorpora esta actividad a tu portafolio de evidencias. Reacciones endotérmicas y exotérmicas El calor de reacción es la cantidad de calor que se transfiere durante una reacción, dependiendo de si en la reacción se libera calor (negativo) o si se absorbe calor (positivo). Las reacciones termoquímicas se clasifican en reacciones exotérmicas y reacciones endotérmicas. Reacciones exotérmicas. Son las reacciones que liberan energía calorífica y su calor de reacción es negativo porque su contenido energético es mayor en los reactantes que en los productos. La formación de agua a partir de hidrógeno y oxígeno es un ejemplo de reacción exotérmica, como se observa a continuación. Ejemplo: H2 1 O 2 2 25 ºC y 1 atm H2O( g ) 57.82 Kcal Reacciones endotérmicas. Son aquellas que para llevarse a cabo deben absorber energía calorífica y su calor de reacción es positivo, ya que los productos tienen mayor contenido energético que los reactantes. [ 14 ] Unidad 1 | Secuencia 1 Reacciones químicas Reacciones de oxidación-reducción Un ejemplo de reacción endotérmica es la producción de ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera gracias a la radiación ultravioleta proporcionada por la energía del Sol. También se produce esta reacción en las tormentas, en las proximidades de las descargas eléctricas. 3O2 ENERGÍA 2O3 Las reacciones endotérmicas y especialmente las relacionadas con el amoniaco impulsaron una próspera industria de generación de hielo a principios del siglo xix. Actualmente el frío industrial se genera con electricidad en máquinas frigoríficas. En este tipo de reacciones existe transferencia de electrones de un átomo a otro; tales procesos, de gran importancia práctica, se conocen como reacciones de oxidación-reducción (abreviado, “redox”). En una reacción “redox” la oxidación y la reducción ocurren simultáneamente, depende una de otra, y el número total de electrones perdidos por una especie química en la oxidación debe ser igual al número de electrones ganados por la otra especie en la reducción. Ejemplos: Zn0 O20 Zn2O2 N2 O2 N4O4 Reacciones ácido–base (neutralización) Es una reacción entre un ácido y una base. Generalmente en las reacciones ácido-base se forma agua y una sal. Un ejemplo es el producto de la reacción ácido-base entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH), que forma cloruro de sodio (NaCl, sal) y agua (H2O). Ejemplo: HCl(ac) NaOH(ac) NaCl(ac) H2O ( l ) [ 15 ] Química 2 ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 1 de la página 175. 2. Incorporen esta actividad a su portafolio de evidencias. ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 2 de la página 177. 2. Incorporen esta actividad a su portafolio de evidencias. En química analítica y otras ramas de la química, el análisis cuantitativo es el estudio experimental de las cantidades de sustancia que aparecen en una muestra o que intervienen en una reacción, y no solamente en la identificación de qué sustancias están presentes, esto lo estudia el análisis cualitativo. Por ejemplo, a un químico se le podría dar una muestra sólida desconocida. Él usará técnicas "cualitativas" para identificar los componentes presentes, y luego técnicas "cuantitativas" para determinar la cantidad de cada uno de estos componentes. Una vez que se conoce la presencia de cierta sustancia en una muestra, la cuantificación puede ayudar en la determinación de sus propiedades específicas. Por ejemplo, el análisis cuantitativo realizado por espectrometría de masas sobre muestras biológicas puede aportar, por la proporción de abundancia de ciertas proteínas específicas, indicaciones de ciertas enfermedades, como el cáncer. Balanceo de ecuaciones La ley de la conservación de la masa de Lavoisier nos dice que: La masa no se crea ni se destruye, sólo se transforma. Por ende, para hacer valer esta ley hay que balancear las reacciones químicas representadas por las ecuaciones. El balanceo consiste en hacer equivaler los dos lados de la ecuación (como en una balanza); es decir, que lo mismo que entre como reactivo sea lo mismo que salga como producto, pero transformado. [ 16 ] Unidad 1 | Secuencia 1 Reacciones químicas Son 3 los métodos utilizados para el balanceo de ecuaciones: •• Método por tanteo. •• Método redox (oxidación-reducción). •• Método algebraico. Sea cual fuere el método a utilizar, las fórmulas son inalterables. ¿Qué significa esto?: que lo único que debemos hacer es utilizar coeficientes para aumentar (o disminuir) el número de moléculas y así aumentar el número de átomos, los subíndices de las fórmulas no deben modificarse al balancear la reacción. De acuerdo con Antoine-Laurent Lavoisier, en toda reacción química la suma de las masas reaccionantes es igual a la suma de las masas de los productos de la reacción. Ejemplo algebraico A Peso A B C Peso B Peso C D Peso D Ejemplo químico Peso NaOH HCl NaCl H2O 40 g 36.4 g 58.4 g 18 g Suma 76.4 g 76.4 g De acuerdo con este ejemplo, podríamos preguntarnos: ¿de dónde provienen las cantidades 40 g, 36.4 g, 76.4 g, etc.?, ¿cuál es su utilidad? Analiza y consulta las masas atómicas de los elementos en la tabla periódica. Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Una vez analizado y comprendido el ejemplo anterior, y consultando los datos en la tabla periódica, determina (de igual forma) en tu cuaderno el peso de cada sustancia que participa en las reacciones que se presentan. Comprueba que la suma de las masas reaccionantes sea igual a la suma de las masas de los reactivos. Competencias genéricas Competencias disciplinares (Continúa) [ 17 ] Química 2 (Continuación) a) Zn 2HCl ZnCl2 H2 b) 4Na O2 2Na2O c) 4Fe 3O2 2Fe2O3 d) Si en algunos de los ejemplos anteriores la suma de las masas —tanto de reactivos como de productos— no fueran iguales, ¿qué está pasando? 2. Incorpora esta actividad a tu portafolio de evidencias. Método por tanteo Este método es útil para balancear ecuaciones sencillas y consiste en hacer equivaler ambos lados de la ecuación mediante el uso de coeficientes; es decir, convertir las flechas en igualdad, lo que implicará que tengamos el mismo número de átomos de cada elemento en ambos lados de la ecuación. Mientras nos familiarizamos con el método, es válido enlistar debajo de la flecha los elementos participantes de la siguiente manera: NaOH H₂SO₄ Na₂SO₄ H₂O R P 1 Na 2 5 O 5 3 H 2 1 S 1 Si analizas la ecuación verás que no está balanceada, porque si comparamos cantidades de reactivos contra productos nos daremos cuenta de que las cantidades no son iguales, por tanto, [ 18 ] Unidad 1 | Secuencia 1 Reacciones químicas empezamos a utilizar coeficientes para aumentar la cantidad de moléculas a uno u otro lado de la ecuación hasta lograr igualar el número de átomos que hay a cada lado. Como puedes notar, entra como reactivo 1 átomo de Na y salen como producto 2 átomos; por tanto, si aumentamos a 2 moléculas de NaOH, el resultado sería: 2NaOH H₂SO₄ Na₂SO₄ H₂O R P 2 Na 2 6 O 5 4 H 2 1 S 1 Con esta acción observamos que la ecuación aún no está balanceada, por lo cual continuamos ahora con el oxígeno, donde entran 6 átomos como reactivo y salen 5 como producto; por consiguiente, si aumentamos a 2 las moléculas de agua, la cuenta quedaría así: 2NaOH H₂SO₄ Na₂SO₄ 2H₂O R P 2 Na 2 6 O 6 4 H 4 1 S 1 Como se logró la igualdad en la cantidad de átomos que entran con la cantidad de átomos que salen, podemos afirmar que la ecuación está balanceada. 2NaOH H₂SO₄ Na₂SO₄ 2H₂O Es decir, reaccionan 2 moléculas de NaOH con 1 molécula de H₂SO₄ para dar como producto 1 molécula de Na₂SO₄ y 2 moléculas de agua. [ 19 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD GRUPAL 1. Una vez analizado y comprendido el ejemplo anterior, en equipos de dos personas balanceen las siguientes ecuaciones mediante el método por tanteo. Cuando se familiaricen con dicho método pueden eliminar el listado de elementos y balancear directamente sobre la ecuación. Competencias disciplinares a) Cr O2 Cr2O3 b) MgS AlCl3 MgCl2 Al 2S3 c) K H2O KOH H2 d) LiI AgNO3 LiNO3 AgI e) Mg HNO3 Mg(NO3)2 H2O N2 O2 2. Incorporen esta actividad a su portafolio de evidencias. Método redox (oxidación-reducción) Las reacciones también se balancean considerando las reglas para asignar los grados de oxidación de los elementos que participan en ella; pero, ¿qué es la oxidación? Oxidación. Es un cambio químico en el cual un átomo o grupo de átomos puede donar o perder electrones. Es una transformación que convierte un átomo neutro en un ión positivo (+) llamado catión; esta transformación está acompañada de la pérdida de electrones, y esto se debe a una oxidación. Ejemplo: 26Fe El hierro en los sistemas vivos tiene número atómico 26, lo que significa que posee 26 protones en el núcleo y 26 electrones en su estructura atómica. Su configuración electrónica es: 1s2 2s2 2p6 3s2 3p6 4s2 3d 6. Según el modelo de Bohr: 2 2 2 2 6 8 6 2 6 14 2 Observarás y recordarás que los últimos 2 electrones son los de valencia y serán los que tiende a perder el átomo; si en su núcleo existen 26p y 24e en su capa, debes reconocer que ese [ 20 ] Unidad 1 | Secuencia 1 Reacciones químicas átomo de Fe se transformó en un ión positivo (catión Fe2) debido a que sufrió una transformación química, es decir, se oxidó. Fe 2 Fe 2e De igual forma, todo átomo que pierde electrones se oxida y queda cargado positivamente con el mismo número de electrones perdidos. Ejemplo: H Mg Cu Cu Ca Al 1e 2e 1e 2e 2e 3e H¹ Mg² Cu¹ Cu² Ca² Al³ Si los átomos pierden los electrones, ¿éstos a dónde se van?, ¿dónde quedan? Explicaremos esto con un ejemplo práctico: si pierdes 10 pesos, seguramente alguien encontrará esos 10 pesos, lo cual significa por una parte que esa persona va a ganar mientras tú pierdes, y por otra, que va a ganar la cantidad que tú pierdas; pues igual ocurre con los electrones: un átomo pierde electrones (se oxida) y otro átomo los va a ganar (o sea, se va a reducir). Escribe los números correspondientes ACTIVIDAD INDIVIDUAL Competencias genéricas 1. Para que domines este concepto en una tabla periódica, juega con otros elementos como sodio, litio, bario, cobre y plata de igual forma: quitando electrones y convirtiéndolos en iones. Aunque los datos no sean verdaderos, tú juega, y sigue jugando; el objetivo es dominar tu habilidad de razonamiento. Competencias disciplinares 2. Incorpora esta actividad a tu portafolio de evidencias. Reducción. Es un cambio químico en el cual un átomo o grupo de átomos gana o recibe los electrones que se perdieron en una oxidación; es una transformación que convierte un átomo neutro en un ión negativo () llamado anión. Dicha transformación está acompañada por la ganancia de e, y esto se debe a una reducción. Ejemplo: 17Cl Su configuración electrónica es: 1s22s22p63s23p5; según el modelo de Bohr: 2 2 2 2 5 6 8 7 [ 21 ] Química 2 Observa que los últimos 7 electrones son de valencia. Si el cloro gana un electrón, en su núcleo existirán 17 cargas positivas () y rodeando al núcleo 18 cargas negativas (), y ese átomo de Cl se transformará en ión (anión Cl1 ), y sufrirá una transformación química, es decir, se reduce. Igual que en la oxidación, pero en el sentido inverso, en la reducción se ganan electrones y se carga con signo negativo el átomo del elemento. Cl1 O2 S2 Cl 1e O 2e S 2e Ejemplo: En resumen, la oxidación y la reducción siempre ocurren de forma simultánea, y el número total de electrones perdidos en la oxidación es el mismo número de electrones ganados en la reducción. Esto implica que si un átomo —en una oxidación— pierde uno o más electrones, otro átomo —en una reducción— estará ganando el mismo número de electrones que pierde el primero. Todos los átomos en forma elemental son neutros; si el átomo pierde un e, queda cargado positivamente, convirtiéndose en catión; si el átomo gana un e, queda cargado negativamente, convirtiéndose en anión. Cuando los elementos no son neutros —o sea que están en forma iónica— al seguirse oxidando o reduciendo sólo se van ajustando las cargas; un ejemplo sería el siguiente. Mn2 2e Mn4 2e Mn6 4e 1ª oxidación Mn2 5e Mn7 1ª reducción 2ª oxidación 3ª oxidación Continuación Mn7 2e Mn5 5e Mn0 2ª reducción 3ª reducción Si interpretas la idea del ejemplo anterior, observarás que se muestran 6 fenómenos, y que los productos de éstos van cambiando en su grado de oxidación en respuesta a los acontecimientos. Analizando la 1ª oxidación, el Mn2 ya tiene perdidos 2 e (es una forma oxidada) y pierde otros 2, por lo que en total lleva perdidos 4 electrones y el producto es Mn4; y si continuamos reflexionando, veremos que cada reacción tiene su propia explicación. Entonces, siendo congruente, ¿en qué reacción se presenta la forma más oxidada? ¿Cuál es la menos oxidada? ¿Cuál es la más reducida?... Es fácil, sólo es cuestión... ¡de razonar! [ 22 ] Unidad 1 | Secuencia 1 Reacciones químicas Escribe los números correspondientes ACTIVIDAD INDIVIDUAL Competencias genéricas 1. Para que domines este otro concepto, con ayuda de una tabla periódica juega con otros elementos quitando o agregando electrones y convirtiéndolos en iones, por ejemplo hierro, cobre y mercurio, tú juega y sigue jugando; el objetivo es dominar tu habilidad de razonamiento. Competencias disciplinares 2. Incorpora esta actividad a tu portafolio de evidencias. Reglas para asignar el número de oxidación (núm. ox.) El número de oxidación de un elemento en una especie química es la carga que puede tener un átomo cuando se aplican las siguientes reglas: 1. Los átomos en forma elemental tienen número de oxidación 0. Ejemplo: Mg0, Fe0, H20, Cl20, Zn0, O20 2. En compuestos que contienen oxígeno, éste tiene núm. ox. 2, exceptuando el peróxido de hidrógeno y el difluoruro de oxígeno. 2 O; 1 H2O2 , agua oxigenda 2 OF2 difluoruro de oxígeno 3. En compuestos que contienen hidrógeno, éste tiene núm. ox. 11, exceptuando los hidruros, como los hidruros de litio y magnesio. 1 H; 1 LiH , 1 MgH2 4. Los iones monoatómicos tienen núm. ox. igual a la carga del ión que los acompaña, pero con signo contrario. HNO3; NaOH; 1 H 1 Na 1 , (NO3) , (OH) 12 monoatómicos [ 23 ] Química 2 5. Los iones poliatómicos tienen grado de oxidación igual a la carga del ión que los acompaña, pero con signo contrario. 1 3 1 2 1 1 H3PO4 ; H3(PO4) H2SO4 ; H2(SO4) HNO3 ; H(NO3) H2CO3 ; H2(CO3) 1 2 poliatómicos 6. La suma algebraica de los números de oxidación en una molécula debe ser igual a cero. 1 7 2 KMnO4 8 (8) 0 1 3 2 CuClO2 4 ( 4) 0 3 2 Al2(SO4)3 6 (6) 0 Pasos para balancear una ecuación por el método redox Partiendo de la siguiente ecuación, revisemos los pasos para el balanceo por el método redox: KMnO4 HCl MnCl2 Cl2 KCl H2O Paso 1. Escribir los grados de oxidación de todos los elementos. 1 7 2 KMnO4 1 1 HCl 2 1 MnCl2 0 Cl2 1 1 KCl 1 2 H2O Paso 2. Comparando cómo entran como reactivos y cómo salen como productos, identificar las especies que cambian en su grado de oxidación, y formar semiecuaciones. 12 Cl 7 Mn [ 24 ] 0 Cl2 2 Mn Unidad 1 | Secuencia 1 Reacciones químicas Paso 3. Balancear las semiecuaciones en relación con el número de átomos. En este caso, el cloro como reactivo tiene 1 electrón ganado, pues es anión, y como producto se convierte en elemental, lo cual significa que pierde ese electrón por cada átomo; si salen (se producen) 2 átomos de cloro (Cl2) deben entrar (reaccionar) 2. Poniendo un coeficiente 2 que afecte a toda la semi reacción del reactivo, se iguala la masa y el total de electrones perdidos se vuelve 5 2e2. Cl20 2 (Cl1 - 1e-) En el caso del manganeso, como reactivo entra con un número de oxidación de 7 y como producto sale como 2. Esto sugiere que el manganeso, de 7e2 que tenía perdidos, recupera o gana 5e2; por tanto, se queda con número de oxidación 2. Como entra 1 átomo y sale 1 átomo, todo queda en equilibrio; es decir, la misma cantidad de materia que entra es la misma cantidad que sale. Mn 7 5eMn2 Por lo general en este paso se duda acerca de la determinación del número de electrones perdidos o ganados. Cuando esto sucede, se sugiere utilizar la “escala del brinquito”. Para calcular el cambio en el número de oxidación, se toma en cuenta la siguiente escala; el magnesio de 7 pasa a 2, brinca 5 lugares, se redujo; el cloro de 1 pasa a 0, brinca un lugar, se oxidó. Reducción Mn da 5 brincos de 7 a 2 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 Cl da 1 brincos de 1 a 0 Oxidación Paso 4. Se determina el número de e- que se pierden y que se ganan. Es aquí donde se balancea por el método redox; los electrones perdidos “se le dan” como coeficientes a la especie que gana, y los electrones ganados “se le dan” como coeficientes a la especie que pierde. 1 2(Cl - 1e-) 7 Mn 5e- 0 5Cl2 existe pérdida - oxidación 2 2Mn existe ganancia - reducción Paso 5. A la especie que pierde electrones (la que se oxida) y que ocasiona que otra los gane se le conoce como agente reductor, porque al perder obliga a que otra gane, mientras que a la especie que gana electrones (la que se reduce) y que obliga a que otra pierda para ella ganar se le conoce como agente oxidante. 1 2(Cl - 1e-) 7 Mn 5e- 0 5Cl2 Oxidación (agente reductor) 2 2Mn Reducción (agente oxidante) [ 25 ] Química 2 Paso 6. Una vez teniendo los coeficientes que resultaron de la pérdida y la ganancia de electrones se colocan a las especies en la ecuación general y se culmina balanceando por tanteo. 2 KMnO4 Escribe los números correspondientes 2 MnCl2 16 HCl 5 Cl2 2 KCl 8 H2O ACTIVIDAD GRUPAL Competencias genéricas 1. En equipos de dos personas identifiquen los sistemas, reglas y principios que intervienen en el balanceo por redox. Balanceen las siguientes ecuaciones determinando cuál se oxida, cuál se reduce, cuáles son los oxidantes y cuáles son los reductores. Competencias disciplinares a) Cu HNO3 Cu(NO3)2 NO H2O b) FeCl2 H2O O2 FeCl3 Fe(OH)3 Cl2 c) KMnO4 KCl H2SO4 MnSO4 K2SO4 Cl2 H2O d) HNO3 H2S NO S H2O e) Mg HNO3 Mg(NO3)2 N2 H2O 2. Incorporen esta actividad a su portafolio de evidencias. Método algebraico Este método de balanceo se fundamenta en el uso del álgebra, y consiste en elaborar ecuaciones algebraicas de cada uno de los elementos para luego despejar incógnitas. Revisemos los pasos para este método a través de un ejemplo. Paso 1. A cada una de las sustancias se le asigna una letra. a K2Cr2O7 b FeCl2 c d e HCl CrCl3 KCl f Paso 2. Se elabora una ecuación para cada uno de los elementos. (ec. 1) K 2a e (ec. 2) Cr 2a d (ec. 3) O 7a g (ec. 4) Fe b f (ec. 5) Cl (ec. 6) H [ 26 ] 2b + c 3d + e + 3f c 2g FeCl3 g H2O Unidad 1 | Secuencia 1 Reacciones químicas Paso 3. Se analizan las ecuaciones que se formularon para identificar la letra que aparece el mayor número de veces y asignarle un valor arbitrario; se observa que la letra a es la más conveniente. Por lo general se inicia asignando el número 2; si no equivaliera con este valor, podemos otorgar el 3, 4, etcétera. Paso 4. Tomando como base el valor de a 5 2, comenzamos a sustituir valores para despejar incógnitas. Entonces, si a 5 2; para (ec. 1) 2a e 2(2) e para (ec. 2) 2a d 2(2) d para (ec. 3) 7a g 7(2) g por tanto, e 4 por tanto, d 4 por tanto, g 14 Como no conocemos los valores para b, f o c, la ecuación 6 puede ayudar a encontrar los demás valores para (ec. 6) c 2g si g 14 entonces: c 2(14) por tanto, c 28 La ecuación que podría facilitar el despeje de incógnitas sería: (ec. 5)2b 2b 2b 2b c 28 28 28 3d e 3f 3(4) 4 3f 12 4 3f 16 3f Nos quedamos con 2 incógnitas; pero como b f , entonces: 28 16 3f 2f 12 f y b 12 Paso 5. Teniendo todos los valores de las literales, éstas se agregan como coeficientes a cada una de las sustancias de la reacción: a 2K2Cr2O7 b 12FeCl2 c d 28HCl 4CrCl3 e 4KCl f 12FeCl3 [ 27 ] g 14H2O Química 2 Paso 6. Por último, se realiza el conteo y comparación para verificar la cantidad de átomos que entran como reactivos y que salen como productos. 4 4 14 12 52 28 Escribe los números correspondientes Competencias genéricas K Cr O Fe Cl H 4 4 14 12 52 28 ACTIVIDAD INDIVIDUAL 1. Para que reafirmes e identifiques el sistema, reglas y principios del balanceo por método algebraico, balancea por el método algebraico las siguientes ecuaciones. Competencias disciplinares a) CuO NH3 Cu N2 H2O b) Ca3(PO4)2 SiO2 C c) KMnO4 HCl CaSiO3 CO P MnCl2 KCl Cl2 H2O 2. Incorpora esta actividad a tu portafolio de evidencias. Cierre de secuencia Conclusión del caso inicial Retoma la actividad de la página 5 y lee con atención el siguiente texto. Elabora y entrega un resumen y una conclusión en relación con el tema: ¿la industria química es perjudicial para el ambiente? Las sustancias se rigen por leyes físicas universales, y una de ellas es el equilibrio entre los sistemas. Se ha demostrado de forma experimental que no todas las sustancias reaccionan por el simple hecho de entrar en contacto con otras sustancias, sino que existen reglas que debemos considerar. En la industria química, alimenticia, farmacéutica, metalúrgica, cosmética, textil, entre otras, se producen anualmente millones de toneladas de diferentes sustancias o productos para satisfacer diversas necesidades de la sociedad. Los procesos de producción deben acompañarse de un alto grado de eficiencia en el uso y consumo de sustancias o materiales químicos para lograr el mínimo desperdicio posible. En un proceso cualquiera por lo general no suele tenerse un 100% de eficiencia, ya que siempre va acompañado de pérdidas que dependen de la manipulación y purificación de las sustancias involucradas. Una pérdida considerable de sustancias en una reacción implica una merma económica para cualquier empresa. [ 28 ] Unidad 1 | Secuencia 1 Reacciones químicas En el hogar, cuando no tenemos el cuidado de maximizar el uso de nuestros alimentos, pueden existir pérdidas que se reflejarán a corto plazo en nuestros bolsillos. Por ejemplo, para elaborar un pastel debemos tener cuidado de incluir los ingredientes necesarios y suficientes para que nuestro producto sea el óptimo. Si agregáramos exceso de leche o de harina, el objetivo no se lograría y terminaríamos por desechar a la basura la intención junto con el alimento. Ejercicios de cierre C on la intención de reforzar los conocimientos aprendidos, realiza de manera individual las actividades que se presentan para el cierre de esta secuencia. I. Observa la siguiente ecuación química y responde en los espacios —donde se describe la característica de los componentes de la misma— la definición que corresponda. K2Cr2O7 (s) 5H2SO4 (l ) 3H2S 2KHSO4 Cr(SO4)3 (s) 7H2O (l ) 3S 1. ¿Son reactivos el ácido sulfúrico y el agua? sí no 2. Símbolo que significa “precipitación de sólidos”. 3. Cuando el dicromato de potasio, el ácido sulfúrico y el ácido sulfhídrico reaccionan entre sí para formar productos, ya no pueden volver a su estado inicial. falso verdadero 4. ¿Cuál es el signo que determina el número de átomos de un elemento químico? 5. Dibuja los símbolos que significan las fórmulas de los compuestos. 6. Los signos que marcan la dirección o sentido de la reacción son: [ 29 ] Química 2 7. Los productos se escriben en el lado derecho de la ecuación. falso verdadero 8. La ecuación que se mostró al inicio del ejercicio se encuentra desbalanceada. falso verdadero 9. Elemento que se emplea para determinar el número de moléculas que participan. 10. Una ecuación química es la representación de una reacción química. sí no II. Resuelve los siguientes problemas. 1.A un paciente se le recetó Alkagel(Al(OH)3) para aliviar su acidez estomacal (HCl), ocasionada por el consumo de alimentos irritantes. Escribe la ecuación que representa la reacción que se lleva a cabo en el estómago del paciente y determina el tipo de reacción de que se trata. 2.Supón que eres un laboratorista industrial y que se te pide obtener magnesio (Mg) a partir del cloruro de magnesio (MgCl2). Para llevar a cabo la tarea sólo cuentas con 2 metales: potasio (K) y estaño (Sn). ¿Qué metal utilizarías y por qué? Escribe la ecuación y determina el tipo de reacción que se llevaría a cabo. [ 30 ] Unidad 1 | Secuencia 1 Reacciones químicas 3.En tu casa, tu mamá derrama accidentalmente un frasco de ácido muriático (HCl) sobre la estufa que está lavando con sosa cáustica (NaOH) para eliminar el cochambre. Escribe la ecuación correspondiente y determina el tipo de reacción. ¿Crees que sea peligroso que se combinen las 2 sustancias? ¿Por qué? 4.En Met-Mex Peñoles se obtiene hierro a partir de la pirita (FeS), y para llevar a cabo una reducción se le agrega magnesio (Mg.) Escribe la ecuación y determina el tipo de reacción que se verifica. 5.En la elaboración de bebidas gasificadas se mezcla un líquido saborizado [agua (H2O) con sabor] y un gas a presión (CO2) a baja temperatura, obteniendo así el refresco gaseoso. Escribe la ecuación y determina el tipo de reacción. 6.La fachada de mármol (CaCO3) de un edificio ha sido dañada por la lluvia ácida (H2SO4). Escribe la ecuación química y determina el tipo de reacción. [ 31 ] Química 2 7.En el proceso de tostación del zinc (ZnO) en la industria metalúrgica, se obtiene zinc puro al reaccionar el óxido con el carbono (C). Escribe la ecuación y determina el tipo de reacción. 8.La combustión de la gasolina en los automóviles libera anhídrido sulfúrico (SO3), que al combinarse con la humedad del medio ambiente (H2O) produce lluvia ácida. Escribe la ecuación y determina el tipo de reacción. 9.En el suelo, las bacterias transforman el nitrato de potasio (KNO3) en sal y oxígeno. Escribe la ecuación y determina el tipo de reacción. 10. Para producir oxígeno a nivel laboratorio, se descompone el clorato de potasio (KClO3) mediante un catalizador conocido como dióxido de manganeso. Escribe la ecuación y determina el tipo de reacción. [ 32 ] Unidad 1 | Secuencia 1 Reacciones químicas III. En tu libreta de apuntes balancea con el método por tanteo las ecuaciones que se presentan a continuación y coloca la respuesta en cada ecuación. Al(NO3)3 H₂SO₄ HNO3 Al2(SO4)3 Ba(OH)2 HCl BaCl2 H2O SO2 H2O H2SO3 Cu HNO3 Cu(NO3)2 NO H2O KMnO4 HCl KCl MnCl2 H2O Cl2 FeS O2 Fe2O3 SO2 IV. A hora balancea por el método redox las siguientes ecuaciones en tu libreta de apuntes y coloca la respuesta en cada ecuación. NaHCO3 Na2CO3 CO2 H2O KNO3 CO CO2 NO2 K2O Al H2SO4 Al2(SO4)3 H2 CO Fe2O3 FeO CO2 Na H2O NaOH H2 V. B alancea en tu libreta de apuntes por el método algebraico las ecuaciones que aparecen enseguida y coloca la respuesta en cada ecuación. Al(NO3)3 H2SO4 HNO3 Al2(SO4)3 Ba(OH)2 HCl BaCl2 H2O KMnO4 HCl MnCl2 KCl Cl2 H2O Evaluación de la secuencia didáctica En acuerdo con su profesor, seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia. Evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas, así como aquellos que deben tener en cuenta para mejorar sus resultados. [ 33 ] Química 2 Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas [ 34 ] Evaluación de la estrategia Aspectos que debo Aspectos que para mejorar consideré al desarrollar considerar los resultados de la estrategia la actividad secuencia dos Unidad 1 | Secuencia 1 Materia y energía Leyes ponderales Muchos fracasos de la vida han sido de hombres que no supieron darse cuenta de lo cerca que estaban del éxito, cuando se rindieron. Thomas Alva Edison Propósito de la secuencia Competencias disciplinares Utilizar nociones estequiométricas para realizar cálculos en los que se aplican las leyes conocidas como ponderales, argumentando la importancia de los cálculos en procesos que tienen repercusiones económicas y ecológicas en el medio en el que se desarrolla el alumno. Fundamentar el impacto científico y tecnológico en la contaminación ambiental y buscar estrategias de prevención. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 4.5 Maneja las tecnologías de la información y la comunicación para obtener información y expresar ideas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo a categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 7.2 Identifica las actividades que le resultan de menor a mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. [ 35 ] Química 2 Contenidos que aborda la secuencia 2 Conceptuales • Leyes ponderales. Unidades químicas Cálculos estequiométricos || || Procedimentales Axiológicos • Realizará las actividades propuestas para reafirmar el conocimiento adquirido. • Desarrollará investigaciones con base en fuentes bibliográficas y tecnologías de la información sugeridas. • Responderá preguntas intercaladas mediante la reflexión. • Desarrollará responsabilidades y compromisos al reconocer que las reacciones se realizan en todos los niveles. • Valorará la importancia de la cuantificación de las reacciones para sustentar el cuidado del ambiente. • Promoverá el uso responsable de las sustancias químicas en su vida diaria. • Valorará las aportaciones históricas de científicos en los enunciados de las leyes estequiométricas. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) Producto esperado Instrumentos de evaluación sugeridos 1. Actividad grupal (p. 37) • Cuestionario • Guía de observación 2. Actividad individual (p. 42) • Resolución de ejercicios • Lista de cotejo 3. Actividad individual (pp. 43-44) • Resolución de ejercicios • Lista de cotejo 4. Actividad grupal (pp. 45-46) • Problemas • Guía de observación 5. Actividad grupal (p. 48) • Resolución de ejercicios • Lista de cotejo 6.Actividad individual (pp. 50-51) • Resolución de ejercicios • Guía de observación 7. Actividad grupal (pp. 53-54) • Ejercicios • Guía de observación 8.Actividad grupal (p. 54) • Reporte de práctica 3 • Rúbrica 9. Actividad grupal (p. 54) • Reporte de práctica 4 • Rúbrica [ 36 ] Unidad 1 | Secuencia 2 Leyes ponderales Apertura de secuencia Leyes ponderales Lee con atención el siguiente texto y realiza la actividad grupal que se indica. En México la pirotecnia es una técnica que permite crear una reacción controlada de tipo explosivo para generar un resultado atractivo. Su elaboración es un trabajo artesanal de calidad e innovación con conocimientos ancestrales y de la cual viven miles de familias. Ha estado arraigada en nuestras tradiciones y festividades desde tiempos antiquísimos y es compañera indispensable en nuestras fiestas y celebraciones populares, donde las luces de colores, las formas y los estallidos son parte de nuestra cultura. La materia prima que es utilizada para este fin es la pólvora, que consiste en 75% de clorato de potasio, 15% de carbón natural y 10% de azufre. Su uso está regulado por reglamentos de explosivos a nivel internacional, los cuales determinan las restricciones y legislaciones necesarias para evitar riesgos. ACTIVIDAD GRUPAL 1. En equipos de cuatro personas discutan el texto anterior y por escrito enlisten lo siguiente: a) Los productos relacionados con la pirotecnia que comúnmente se elaboran y comercializan para celebrar las fiestas navideñas. b) Las situaciones más comunes de accidente por su uso indebido. c) Los factores probables de ese tipo de accidentes. d) Algunas recomendaciones para evitarlos. Escribe los números correspondientes Competencias genéricas Competencias disciplinares 2. Incorporen esta actividad a su portafolio de evidencias. Desarrollo de secuencia Entremos en materia Leyes ponderales La estequiometría, que estudia las posibles combinaciones químicas, se basa en las leyes conocidas como ponderales (relativas al peso de las sustancias). Estas leyes son: 1. Ley de Lavoisier (Ley de conservación de la masa). 2. Ley de Proust (Ley de las proporciones definidas). 3. Ley de Dalton (Ley de las proporciones múltiples). 4. Ley de Richter-Wensell (Ley de las proporciones recíprocas). [ 37 ] Química 2 Ley de Lavoisier Antoine-Laurent Lavoisier, químico filósofo y economista francés —considerado el padre de la química moderna—, enunció la Ley de la conservación de la materia, que por los avances de la ciencia actualmente ha sido modificada a Ley de la conservación de la masa. Dicha ley afirma que en una reacción química la suma de las masas de los reactivos es igual a la suma de las masas de los productos; es decir, que “La masa no se crea ni se destruye, sólo se transforma” siempre en la misma proporción. Un ejemplo de la Ley de Lavoisier puede apreciarse en la siguiente reacción química balanceada, en la que la suma de las masas del sodio (Na) y del cloro (Cl2) es igual a la masa del producto (NaCl) de dicha reacción. Ejemplo: 2Na Cl2 2NaCl 2(23 g) 70.8 g 2(58.4 g) 116.8 g 116.8 g Ley de Proust Joseph-Louis Proust, químico francés y uno de los fundadores de la química moderna, realizó numerosos experimentos y descubrió que la proporción en masa de cada uno de los componentes en una reacción se mantenía constante en el compuesto final. Estas conclusiones lo llevaron a enunciar la Ley de las proporciones definidas o constantes, dice que: “Cuando las sustancias reaccionan entre sí, siempre lo hacen en la misma proporción”; es decir, que la relación entre las sustancias que reaccionan siempre es definida y constante. Un ejemplo para la Ley de Proust se observa en la reacción química que aparece enseguida, en la que el sodio (Na) y el cloro (Cl2) reaccionan entre sí para obtener el cloruro de sodio (NaCl) como producto final. Ejemplo: Na Cl2 NaCl Por tanto, puede notarse que no existe una proporción entre el sodio y el cloro porque queda 1 cloro sin reaccionar. [ 38 ] Unidad 1 | Secuencia 2 Leyes ponderales Entonces, para lograr una proporción y cumplir la Ley de Proust, 2 átomos de sodio (Na) deben reaccionar con 2 átomos de cloro (Cl2) que equivalen a una molécula de cloro para formar 2 moléculas de cloruro de sodio (NaCl). 2NaCl 2Na Cl2 Si la cantidad de sodio aumentara en más de 2 moléculas, quedaría sodio sin reaccionar, ya que no existiría el suficiente cloro para que reaccionara con ese aumento. Ley de Dalton John Dalton fue un químico y físico británico. En 1803, mientras trataba de explicar su Ley de las presiones parciales —y siendo tutor de química conocedor de la obra de Lavoisier—, comenzó a formular su mayor contribución a la ciencia: la teoría atómica, en la que adoptó la idea del átomo y dibujó partículas individuales para ilustrar las reacciones químicas. Cuando se encontraba estudiando la reacción del óxido nítrico con oxígeno, descubrió que la reacción podía tener lugar con dos proporciones diferentes, lo que lo llevó a establecer en 1808 la Ley de las proporciones múltiples, ésta dice que: “Cuando dos sustancias reaccionan entre sí para formar dos o más compuestos, siempre y cuando el peso de una de las sustancias se mantenga constante, el peso de la otra sustancia aumentará en una relación de números enteros y sencillos." La Ley de Dalton puede ejemplificarse en la siguiente tabla. Las dos primeras columnas corresponden a las sustancias que reaccionan entre sí para formar uno o más productos (tercera columna). La cuarta y quinta columnas muestran la forma en que estas reacciones se asocian con la Ley de las proporciones múltiples. 2 Sustancia 1 Sustancia Oxígeno C Carbono O2 Producto Proporciones múltiples CO Anhídrido carbonoso En estos 2 productos de la reacción del carbono con el oxígeno, el carbono se mantiene en el mismo peso y el oxígeno aumenta en una relación de números enteros y sencillos: 1y1 1y2 CO2 Anhídrido carbónico Explicación o fundamento El carbono presenta 2 valencias (2, 4) y puede formar 2 productos diferentes. (Continúa) [ 39 ] Química 2 (Continuación) 2 Sustancia 1 Sustancia Oxígeno Producto N2O3 Anhídrido nitroso N Nitrógeno O2 Hg Mercurio O2 Cl2 Cloro O2 N2O5 Anhídrido nítrico HgO Óxido mercúrico Hg2O Óxido mercuroso Cl2O Óxido de dicloro Cl2O3 Óxido cloroso Cl2O5 Óxido clórico Cl2O7 Óxido perclórico Proporciones múltiples Explicación o fundamento En estos 2 productos de la El nitrógeno reacción del nitrógeno con el presenta 2 valencias oxígeno, el nitrógeno se mantiene (3, 5) y puede formar 2 productos en el mismo peso y el oxígeno diferentes. aumenta en una relación de números enteros y sencillos: 2y3 2y5 El mercurio presenta En estos 2 productos de la 2 valencias reacción del mercurio con el (2, 1) y puede oxígeno, el oxígeno se mantiene formar 2 productos en el mismo peso y el mercurio diferentes. aumenta en una relación de números enteros y sencillos: 1y1 2y1 El cloro presenta 4 En estos 4 productos de la reacción del cloro con el oxígeno, valencias positivas el cloro se mantiene en el mismo (1, 3, 5, 7) y puede formar 4 peso y el oxígeno aumenta en una relación de números enteros productos diferentes con el oxígeno. y sencillos: 2y1 2y3 2y5 2y7 Ley de Richter-Wensel Jeremias B. Richter fue un famoso químico alemán a quien se debe la noción de peso equivalente y consecuentemente la ley que lleva su nombre: Ley de Richter o Ley de las proporciones recíprocas o equivalentes, que dice: “Las masas de dos elementos diferentes que se combinan con una misma cantidad de un tercer elemento, guardan la misma relación que las masas de aquellos elementos cuando se combinan entre sí." Esto significa que si dos elementos diferentes, cada uno con un cierto peso, son capaces de combinarse con el peso dado de un tercer elemento, los pesos de aquellos primeros elementos serán capaces de combinarse entre sí, o bien con múltiplos o con submúltiplos de dichos pesos. [ 40 ] Unidad 1 | Secuencia 2 Leyes ponderales Al hablar de pesos equivalentes debemos recordar que la valencia es el número que expresa la capacidad que tiene un átomo o molécula para combinarse o reaccionar con otros átomos o moléculas y formar compuestos; representa el número de electrones que cada átomo puede aceptar, ceder o compartir al unirse con otro. Para determinar la valencia se toma como referencia el átomo de hidrógeno. Las siguientes reacciones químicas ejemplifican cómo se relaciona el peso equivalente de los elementos con su valencia. En la reacción A el sodio tiene valencia 1 y el oxígeno valencia 2; por tanto, 2 átomos de sodio (Na) serían equivalentes a 1 átomo de oxígeno (O). Visto desde el punto de vista de pesos equivalentes, 46 g de sodio reaccionan con 16 g de oxígeno, lo cual equivale a 23 g de sodio y 8 g de oxígeno. Reacción A Na1 23 g O2 8g De la misma manera, en la reacción B, el sodio tiene valencia 1 y el cloro tiene valencia 1, por tanto, 1 átomo de sodio (Na) es equivalente a 1 átomo de cloro (Cl). Entonces, en esta ocasión reaccionan 23 g de sodio con 35.4 g de cloro. Reacción B Na1 23 g Cl1 35.4 g En los siguientes ejemplos se muestran los pesos equivalentes de los elementos que conforman tres diferentes compuestos. Dichos pesos equivalentes resultan de un análisis similar al realizado anteriormente con ayuda de las valencias. CaO H2O Masa del Ca Masa del O Masa del H Masa del O 40 g 16 g 2g 16 g 20 g 8g 1g 8g CaH2 Masa del Ca Masa del H 40 g 2g 20 g 1g La valencia se relaciona con el peso equivalente de un elemento a través de la siguiente fórmula: Peso equivalente = masa molecular valencia (Continúa) [ 41 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. Completa los cuadros según los ejemplos anteriores. Competencias disciplinares HCl Masa del H CaCl2 Masa del Cl Masa del Ca Masa del Cl 2. Incorpora esta actividad a tu portafolio de evidencias. Unidades químicas En las reacciones químicas intervienen partículas muy pequeñas como son: iones, átomos, moléculas, etc; para contar y pesar estas partículas se utilizan unidades conocidas, como las siguientes: 1. Masa atómica. 2. Masa molecular (peso molecular). 3. Átomo-gramo. 4. Molécula-gramo (peso molecular). 5. Mol (número de Avogadro). 6. Volumen molar. 1. Masa atómica Es la masa promedio de un átomo de un elemento en relación con la masa de un átomo de carbono (12C), al que se le ha asignado la masa atómica 12 unidades de masa atómica (umas). La masa atómica indica cuántas veces es mayor o menor la masa de un átomo en relación con la masa del carbono (12C). Ejemplo: C 12 umas Mg 24 umas He 4 umas 6, 6 12, 12 2, 2 12C 2 veces el 12C 1/3 de veces el 12C 2. Masa molecular (peso molecular) Es la masa de una molécula de una sustancia, y es igual a la suma de las umas de los elementos que forman la molécula. Ejemplo: [ 42 ] Oxígeno 8 8 16 umas por cada átomo 1 1 de 12C 3 Unidad 1 | Secuencia 2 Leyes ponderales Masa molecular O2 16 2 32 umas * Agua H2O H 1 2 2 umas O 16 1 16 umas Masa molecular 18 umas * Dióxido de carbono CO2 C 12 1 12 umas O 16 2 32 umas Masa molecular 44 umas * Sulfato de sodio Na2SO4 Na 32 2 64 umas S 32 1 32 umas O 16 4 64 umas Masa molecular 160 umas 3. Átomo-gramo El átomo-gramo es lo mismo que masa atómica pero expresado en gramos, así que para: C 12 umas 12 gramos Mg 24 umas 24 gramos He 4 umas 4 gramos 4. Molécula-gramo (peso molecular [p.m.]) Es la masa molecular expresada en gramos. Así que para una molécula de: Oxígeno, el p.m. 16 g Agua, el p.m. 18 g Dióxido de carbono, el p.m. 44 g Sulfato de sodio, el p.m. 142 g Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Para reforzar el conocimiento adquirido, calcula el peso molecular de los siguientes compuestos. Deberás consultar los datos necesarios en la tabla periódica. Competencias genéricas Competencias disciplinares (Continúa) [ 43 ] Química 2 (Continuación) a) KMnO4 p.m. = h) Fe(OH)2 p.m. b) H3PO4 p.m. = i) H2SO4 p.m. = c) MnCl2 p.m. = j) Cl2 p.m. = d) KCl p.m. = k) FeS p.m. = e) NO p.m. = l) Mg(NO3)2 p.m. = f) HNO3 p.m. = m) SO3 p.m. = g) AgNO3 p.m. = n) NaCl p.m. = = 2. Incorpora esta actividad a tu portafolio de evidencias. 5. Mol (número de Avogadro) Como sabemos, en los laboratorios existen instrumentos y equipos que sirven para medir o pesar las cantidades de las sustancias cuando se realiza un análisis cuantitativo. Estos instrumentos pueden ser pipetas, probetas, balanzas etc., pero en algunas situaciones debemos medir sustancias muy pequeñitas como son los iones, átomos y moléculas. Para esto no existe ninguna balanza o instrumento que pueda ayudarnos; por tal motivo se utiliza el concepto de mol, que es una unidad de medición para esas partículas. Por tanto, “mol es una unidad de cantidad de partículas” que se contienen en un compuesto o sustancia. Éstas partículas pueden ser iones, átomos o moléculas. El mol tiene un valor matemático conocido como número de Avogadro (NA), y es igual a 6.023 1023 partículas. Ejemplo: Nuestra escuela es una escuela, o sea que es 1 mol de escuela, y su valor matemático es 6.023 1023 escuela, en ella existen 20 aulas, es decir, que hay 20 mol de aula, y cada aula, que es 1 mol, tiene un valor de 6.023 1023 aula. En total, ¿cuál es el valor de 20 mol de aula? Por otra parte, en cada mol de aula hay 50 pupitres, y cada pupitre es 1 mol de pupitre. ¿Cuál es el valor de cada pupitre? De los 50 pupitres que existen, solamente 45 están ocupados por alumnos; entonces, si has comprendido el concepto, ¿cuántos mol de alumnos asistieron a clase de química hoy y cuál es su valor? Como ya te habrás dado cuenta, estos ejemplos son un tanto burdos, pero nos ayudan a comprender y organizar los diferentes niveles de identificación de partículas al utilizar la unidad de mol. [ 44 ] Unidad 1 | Secuencia 2 Leyes ponderales Escribe los números correspondientes ACTIVIDAD GRUPAL 1. En equipos de dos personas, y para familiarizarse con el concepto de mol, observen y analicen los datos de la siguiente tabla. Fórmula Masa Núm. de moles g/mol o peso molecular C 12 1 12 g O2 32 1 32 g NaCl H2SO4 58.4 98 1 1 Núm. de moléculas Competencias genéricas Competencias disciplinares Núm. de átomos 6.023 1023 átomos de carbono 6.023 1023 moléculas de oxígeno 12.046 1023 átomos de oxígeno 58.4 g 6.023 1023 moléculas de cloruro de sodio 6.023 1023 átomos de sodio y 6.023 1023 átomos de cloro 12.046 1023 átomos 98 g 6.023 1023 moléculas de ácido sulfúrico 7(6.023) 1023 átomos 42.1 1023 átomos 2. Completen los datos que falten en la tabla siguiente. Por último, para confirmar el aprendizaje, resuelvan en su cuaderno o libreta los problemas que se presentan y compartan los conocimientos que adquirieron con sus compañeros de clase. Fórmula CO2 Masa Núm. de moles 24 1 1 g/mol o peso molecular Núm. de moléculas Núm. de átomos 6.023 1023 átomos de magnesio 6.023 1023 moléculas de bióxido de carbono (Continúa) [ 45 ] Química 2 (Continuación) Fórmula Masa Núm. de moles 2 H3PO4 98 g/mol o peso molecular Núm. de moléculas Núm. de átomos 12.046 1023 átomos de hidrógeno 2g 1 a) ¿Cuántos átomos hay en 10 gramos de calcio si su peso molecular es 40 g/mol? b) ¿Cuántos átomos hay en 25 gramos de agua si su peso molecular es 18 g/mol? c) ¿Cuántos moles hay en 1.2 1023 moléculas de amoniaco NH3? d) ¿Cuántos átomos hay en 1 mol de ácido sulfúrico, H2SO4? e) ¿Cuántos moles hay en 76 g de ácido nítrico, HNO3? f) ¿Cuántos gramos hay en 5 moles de sulfuro de arsénico, As2S3? 3. Incorporen esta actividad a su portafolio de evidencias. 6. Volumen molar Es el volumen que ocupa un mol de cualquier gas en condiciones normales (o estándar) de presión y temperatura (STP, por sus siglas en inglés). El volumen molar a condiciones estándar (STP) de presión (1 atm) y temperatura (0 C) tiene un valor constante de 22.4 L. Ejemplo: 1 mol de CO2 es equivalente a 44 g y ocupa 22.4 L 1 mol de H2 es equivalente a 2 g y ocupa 22.4 L 1 mol de NH3 es equivalente a 17 g y ocupa 22.4 L Vm 22.4 L CO2 Recipiente 1 Vm 22.4 L H2 Vm 22.4 L Recipiente 2 P 1 atm (760 mm Hg) y T 0 °C [ 46 ] NH3 Recipiente 3 Unidad 1 | Secuencia 2 Leyes ponderales Partiendo del esquema anterior, supongamos que tenemos 3 recipientes de igual capacidad de volumen (25 L), en cada uno de ellos colocamos 3 sustancias diferentes en condiciones STP y los cerramos herméticamente. Hasta este momento, ¿qué igualdad identificas?, ¿qué diferencia observas? Las cantidades a colocar son: R1 44 g R2 2 g R3 17 g ¿Las cantidades son iguales? Obviamente que no, pero ¿por qué no son iguales? Si comprendiste el concepto de volumen molar notarás que las cantidades no son iguales, pero sí son equivalentes; es decir, que en cada recipiente se contiene 1 mol de gas, (diferente gas; pero 1 mol de cada uno). Observarás también que el volumen es el mismo en los 3 recipientes a las condiciones establecidas; pero si aumentáramos la presión a 2 atm, ¿el volumen molar aumentaría o disminuiría?, ¿tú qué crees? En este contexto, si variáramos la cantidad de sustancia (concentración) a la mitad, ¿qué volumen se ocuparía? De igual modo, ¿qué sucedería con el volumen si aumentáramos la temperatura a 10 C? ¿Qué pasa con un gas cuando lo calentamos? En nuestros hogares cotidianamente se utilizan ollas de presión para cocer algunos alimentos; éstas, a diferencia de los recipientes del ejemplo, tienen una válvula de presión. Si no tuvieran esa válvula, ¿qué te imaginas que sucedería cuando las calentamos? [ 47 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD GRUPAL 1. Para reforzar el concepto de volumen molar, en equipos de tres personas calculen en su libreta o cuaderno el volumen de los siguientes gases en condiciones normales de presión y temperatura. Competencias disciplinares a) 1.7 g de NH3 (amoniaco) b) 560 g de CO2 (dióxido de carbono) c) 12.8 g de SO3 (trióxido de azufre) Significado cuantitativo de las ecuaciones químicas Una ecuación química nos da la siguiente información cuantitativa: 2AB 2NaCl 2A + B2(g) 2Na + Cl2(g) 2 átomos de A y 2 átomos de B producen 2 átomos de A y 2 átomos de B. 2 moléculas de AB producen 2 moléculas de A y una molécula de B2 en forma de gas. 2 moles de AB producen 2 moles de A y un mol de B2. 2 moles de AB producen 2 moles de A y 22.4 L de B2. Cuadro de fórmulas necesarias para realizar cálculos estequiométricos relacionados con las unidades químicas Moles Número de Avogadro (NA) Volumen n m p.m. Fórmulas Unidades n mol moles m masa g p.m. peso molecular g /mol N número de átomos o moléculas N n (Na) V n (Vm) n mol moles NA 6.023 x 1023 átomos o moléculas/mol V volumen litros n mol moles Vm volumen molar (STP) litros/mol 2. Incorporen esta actividad a su portafolio de evidencias. [ 48 ] Unidad 1 | Secuencia 2 Leyes ponderales Quizá en este punto te preguntes: una vez que he aprendido los contenidos del tema, ¿en qué puedo aplicarlos? Quizá hayas visto textos similares a los siguientes Verduras a la italiana Poción para convertirse en sapo Ingredientes: Ingredientes: 15 champiñones grandes 2 berenjenas medianas picadas 2 calabazas medianas picadas 1 cucharada de mantequilla 1 pizca de sal 1/4 de cucharada de pimienta negra 1/4 de taza de queso parmesano 2 jitomates medianos 1/2 cebolla 1 diente de ajo ... Se licúa el jitomate, la cebolla el diente de ajo... • 1 saco de culebras • 1 rabo de lagarto • 2 ancas de rana • 1 diente de Drácula • 2 gotas de sangre Tararín, tarará… y un sapo serás. En una receta se determinan los ingredientes (reactivos) y el resultado que se va a obtener (producto). Se proporcionan las cantidades, como: una pizca, 1 cucharada, 1 saco, 1 diente, 2 gotas, 2 piezas, etcétera. En una reacción química sucede exactamente igual: al balancear una ecuación se obtienen las cantidades exactas de cada reactivo para obtener determinados productos; es decir, al balancear una reacción se determina “una receta química” con sus ingredientes y sus respectivas cantidades. A partir de nuestra experiencia diaria sabemos a qué equivale una cucharada, un vaso, una pizca, una gota, etc., pero no sucede igual en el campo de la química, donde es indispensable el análisis químico cuantitativo (mejor conocido como estequiometría) para poder estudiar las unidades químicas, conocerlas, identificarlas y aplicarlas. Las unidades químicas son las herramientas que hemos de utilizar para desarrollar nuestras habilidades y destrezas en la resolución de problemas de cálculos estequiométricos, lo que hace necesario conocerlas para aprovechar de manera efectiva, suficiente y consciente los recursos que nos proporciona la naturaleza en cantidades razonables. Observa el esquema de la página siguiente y coméntenlo grupalmente. [ 49 ] Química 2 Cómo aprovecha conscientemente el ser humano los recursos naturales Mediante reacciones químicas Beneficio Industria Compuestos químicos Productos de abono Salud Petroquímica Alimentación Ambiente Basura Nuevos productos Recursos naturales Frutas Reciclaje Fuente de energía Verduras Fuente de trabajo Enfermedad Petróleo Plásticos Escribe los números correspondientes Competencias genéricas Cáscaras Medicamentos Leche Frutas Trigo Quesos Jugos Cereal ACTIVIDAD INDIVIDUAL 1. Para reforzar el tema de unidades químicas, en tu libreta o cuaderno resuelve los ejercicios que se plantean a continuación. Comenta con tu profesor y compañeros la forma de resolver estas incógnitas. Si es necesario, utilicen la información que proporciona la tabla periódica. Competencias disciplinares Problemas de masa-masa Estos problemas se basan en situaciones en las que es posible calcular la masa de una sustancia producida por otra. Por ejemplo: a) ¿Cuántos moles de NaCl se necesitan para obtener 355 g de Cl2 en la siguiente reacción? NaCl [ 50 ] Na Cl2 Unidad 1 | Secuencia 2 Leyes ponderales b) Calcular la cantidad de KOH en moles necesarios para neutralizar 20 g de H2SO4. KOH H2SO4 K2SO4 H2O Problemas de masa-volumen Estos problemas te permiten calcular la masa o el volumen utilizado o producido entre sustancias en una reacción química. a) ¿Cuántos gramos de zinc se necesitan para obtener 11.2 L de hidrógeno? b) ¿Qué cantidad en gramos de NaCl se necesitan para producir 20 L de HCl al reaccionar con H2SO4? Problemas de volumen-volumen En estos problemas es posible calcular el volumen de algunos compuestos cuando los reactivos y productos son gases. a) Calcular el volumen de H2 necesario para producir 100 L de NH3 (amoniaco). b) ¿Cuántos litros de O2 se necesitan para quemar 50 L de C2H2 (acetileno)? C2H2 O2 CO2 H2O (vapor) 2. Incorpora esta actividad a tu portafolio de evidencias. Cálculos estequiométricos Las fórmulas empíricas proporcionan una información mínima acerca de un compuesto, con el número relativo de moles. Ejemplo: Determinar la fórmula empírica de un compuesto que contiene 11.9 g de H2 y 88.89 g de O2. 11.19 g g de H 11.1 11.1 así; ≈2 1 5.5 peso atómico H 88.89 g g de O 5.5 Moles de O2 5.5 así; 1 16 g 5.5 peso at. O Moles de H2 Relación estequiométrica: H 2 O 1 Fórmula: H2O [ 51 ] Química 2 Porcentajes de composición Es posible calcular la composición de un compuesto si se conoce la proporción de la masa del compuesto en la fórmula. Ejemplo: Calcular el porcentaje de composición para el agua, H2O. Peso atómico H 1 g (1 g 2 2 g) Peso atómico O 16 g (16 g 1 16 g) Peso molecular H2O 1g22g 16 g 1 16 g 18 g/mol Por factor de conversión: ( Hidrógeno: 2g Oxígeno: 16 g ( 100% 18 g 100% 18 g ) 5 11% ) 5 89% Fórmulas empíricas utilizando porcentajes de composición Ejemplo: Un mol de un compuesto pesa 78 g. Si el 92.3% es carbono y el 7.7% es hidrógeno, ¿cuál será su fórmula? 1 mol 5 78 g C 5 92.3% 5 92.3 g H₂ 5 7.7% 5 7.7 g 7.7 92.3 g 7.7 1 mol Mol C 7.7 12 g/mol 7.7 g 7.7 Mol H 1 mol 7.7 1 g/mol 7.7 Relación estequiométrica: 1 : 1 C 1 H 1 Masa de C 12 g masa de H 1 g Entonces; 12 g 1 g 13 g; así Fórmula: [ 52 ] C6H6 (Benceno) 78 g 6 13 g Unidad 1 | Secuencia 2 Leyes ponderales Escribe los números correspondientes ACTIVIDAD GRUPAL 1. En equipos de tres personas resuelvan en su cuaderno o libreta de apuntes los siguientes problemas para reforzar e integrar el conocimiento de la Unidad 1, Estequiometría. Apóyense en la tabla periódica. Competencias genéricas Competencias disciplinares a) Se tienen 2.435 g de un metal M cuyo peso atómico es 121.76 g/mol que, al quemarse con 0.962 g de azufre forma un compuesto. ¿Cuál es su fórmula? Peso atómico M 121.76 g Peso atómico S 32 g Moles de M Moles de S Relación estequimétrica: M S Fórmula: b) Calculen la fórmula empírica de un compuesto X que pesa 1 g y está formado por 0.4665 g de hierro en combinación con azufre. c) Determinen la fórmula de una sustancia que contiene 71.4 g de calcio y 28.6 g de oxígeno. d) Se ha calculado que una muestra contiene 40 g de carbono, 6.7 g de hidrógeno y 53.3 g de oxígeno. Calculen su fórmula empírica. e) Calculen el porcentaje (%) de agua que tiene el sulfato de calcio dihidratado (CaSO4 2H2O). f) Calculen el porcentaje de calcio y de nitrógeno que se tiene en Ca(NO3)2. g) Calculen el peso en gramos de fósforo que hay en 200 kg de Ca(H2PO3)2. h) Determinen la fórmula empírica de un compuesto que tiene 43.65% de fósforo y 56.36% de oxígeno. i) Determinen la fórmula empírica del compuesto formado por 21.8% de magnesio, 27.9% de fósforo y 50.3% de oxígeno. j) Calculen el porcentaje de agua que tiene el NiSO4 6H2O. k) Calculen el porcentaje de plata y de nitrógeno que se contiene en Ag(NO3)2. l) Calculen el peso en gramos de calcio (Ca) que hay en 100 kg de Ca(H2PO3)2. m) De la siguiente ecuación: KClO3 KCl O2 • ¿Cuántos gramos de O2 se obtendrán a partir de 400 g de KClO3 si el rendimiento de la reacción es del 95%? (Continúa) [ 53 ] Química 2 (Continuación) • ¿Cuántos gramos de KClO3 se requieren para obtener 400 g de O2 si el rendimiento de la reacción es del 95%? • ¿Cuántos reactivos se requieren para cubrir el 100%? 2. Incorporen esta actividad a su portafolio de evidencias. ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 3 de la página 179. 2. Incorporen esta actividad a su portafolio de evidencias. ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 4 de la página 182. 2. Incorporen esta actividad a su portafolio de evidencias. Cierre de secuencia Conclusión del caso inicial Retomando la actividad de apertura de la página 37, elabora un resumen con base en la conclusión a la que se llegó en la primera actividad grupal de esta secuencia 2, y realiza los ejercicios que se proponen a continuación. E jercicios de cierre Con la intención de reforzar los conocimientos aprendidos hasta ahora, realiza de manera individual las actividades que se presentan para el cierre de la secuencia. I. De la siguiente ecuación: KMnO4 HCl MnCl2 Cl2 KCl H2O a) ¿Cuántos moles de KMnO4 se necesitan para producir 500 g de KCl? b) ¿Cuántos gramos de KMnO₄ reaccionan para obtener 100 L de Cl2? c) ¿Cuál es el número de moléculas que participan de HCl para la producción de 4 moles de MnCl2? d) ¿Cuál será el volumen molar de 2.5 moles de Cl2? e) ¿Qué cantidad de MnCl2 se produce a partir de 350 g de KMnO4? [ 54 ] Unidad 1 | Secuencia 2 Leyes ponderales II. Las plantas producen glucosa mediante el proceso de la fotosíntesis, en el que gracias al efecto de la luz solar, el agua con que se riegan y el CO2 del aire se produce su alimento: la glucosa. La reacción es la siguiente: CO2 H2O C6H12O6 O2 Calcula la cantidad en moles de dióxido de carbono y de agua que se necesitan para producir 50 g de glucosa y así las plantas sigan creciendo. III. En el salero de un restaurante de comida china se agregaron 25 g de cloruro de sodio (NaCl). ¿Cuántas moléculas se encuentran contenidas en ese recipiente? Evaluación de la secuencia didáctica En acuerdo con su profesor, seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia, evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas y aquellos que deben tener en cuenta para mejorar sus resultados. Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas Evaluación de la estrategia Aspectos que debo Aspectos que considerar para mejorar consideré al desarrollar los resultados de la estrategia la estrategia [ 55 ] Química 2 Confirmación de conocimientos de la Unidad 1 Propuesta de primer examen parcial Con el propósito de que reafirmes los conocimientos adquiridos en la Unidad 1, lee detenidamente y responde cada una de las cuestiones que se presentan a continuación. I. Determina el tipo de reacción que se lleva a cabo en las ecuaciones que se presentan de acuerdo con las siguientes claves: reacción de síntesis (RS), reacción de análisis (RA), reacción de sustitución simple (SS), reacción de sustitución doble (SD). 1. HNO3 Mg(OH)2 2. 3. 4. 5. Mg(NO3)2 H2O KCl O2 KClO3 N2 H2 NH3 Na2S Mg Na MgS SO2 H2O H2SO3 II. Balancea la siguiente reacción por el método redox, determinando el agente oxidante y el agente reductor. PbS Cu2S HNO3 Pb(NO3)2 Cu(NO3)2 NO2 S8 H2O III. Resuelve: a) Un enfermo que se encuentra hospitalizado por enfisema pulmonar requiere de un tanque de 20 L de oxígeno (O2). ¿Cuántos moles se encuentran contenidas en el tanque? b) Se quiere preparar 5 000 kg de amoniaco a partir de la siguiente reacción: N2 3H2 ¿Qué cantidad de hidrógeno se necesita? [ 56 ] 2NH3 Unidad dos Disoluciones químicas Disoluciones Disoluciones químicas Ácidos y bases Generalidades Clasificación de disoluciones Estequiometría de disoluciones Teorías Escalas de pH, pOH Neutralización Competencias disciplinares que se tratan en la unidad 1. Establece la interrelación entre la ciencia, la tecnología, la sociedad y el ambiente en contextos históricos y sociales. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas, y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la disolución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. 12. Decide sobre el cuidado de su salud a partir del conocimiento de su cuerpo, sus procesos vitales y el entorno al que pertenece. 14. Aplica normas de seguridad en el manejo de sustancias, instrumentos y equipo en la realización de actividades de su vida cotidiana. Tema integrador de la unidad Con ayuda de su profesor, el grupo elegirá un tema relacionado con su ambiente que pudiese, a partir de los temas que se tratan en esta unidad, aportar una respuesta significativa en el aprendizaje de los contenidos. Es deseable coordinar el tema elegido con otras asignaturas para obtener respuestas integrales en la obtención de los conocimientos por aprender. Puede utilizarse un cuadro como el que se propone a continuación. TEMA INTEGRADOR Asignatura 1 Problemática: Observaciones [ 58 ] Asignatura 2 Problemática: Asignatura 3 Problemática: Asunto significativo secuencia tres Unidad 1 | Secuencia 1 Materia y energía Disoluciones Investigar, es ver lo que todo el mundo ha visto, y pensar lo que nadie más ha pensado. Albert Szent-Györgi Propósito de la secuencia Competencias disciplinares Adquirir el conocimiento fundamental de las diversas disoluciones y sus componentes, así como el desarrollo de capacidades para el cálculo efectivo y eficiente de las diferentes concentraciones empíricas y valoradas (porcentuales, molares, normales, etc.). Del mismo modo, adquirir la habilidad en la realización de prácticas de valoración y/o titulación de disoluciones para comprender su utilidad en la industria y su importancia en los sistemas biológicos. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la disolución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo con categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 6.4 Estructura ideas y argumentos de manera clara, coherente y sintética. 7.2 Identifica las actividades que le resultan de menor a mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. [ 59 ] Química 2 Contenidos que aborda la secuencia 3 Conceptuales • Reacciones químicas. Generalidades. Clasificación de disoluciones. Estequiometría de disoluciones. || || || Procedimentales Axiológicos • Realizará las actividades propuestas para reafirmar el conocimiento adquirido. • Desarrollará investigaciones en fuentes bibliográficas sugeridas. • Responderá preguntas intercaladas mediante la reflexión. • Desarrollará responsabilidades y compromisos al reconocer que las disoluciones se encuentran en todos los sistemas y en todos los niveles. • Valorará la importancia de la cuantificación de las sustancias para fundamentar el cuidado de la salud y del ambiente. • Promoverá el uso responsable de las disoluciones en su vida diaria. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) 1. Actividad grupal (p. 61) 2. Actividad individual (p. 62) 3. Actividad individual (p. 69) 4. Actividad individual (p. 73) 5. Actividad grupal (p. 74) [ 60 ] Producto esperado • Cuestionario • Resolución de casos • Resolución de casos • Resolución de problemario • Reporte de práctica 5 Instrumentos de evaluación sugeridos • Guía de observación • Lista de cotejo • Guía de observación • Lista de cotejo • Rúbrica Unidad 2 | Secuencia 3 Disoluciones Apertura de secuencia Disoluciones Lee con atención el siguiente texto y a continuación resuelve la actividad grupal. Las disoluciones se presentan con mucha frecuencia en nuestra vida diaria y en casi todos los objetos de uso cotidiano, como en las monedas que utilizamos para la adquisición de bienes y servicios, o en los utensilios de cocina, champús, dentífricos, instrumentos musicales, medicamentos, cosméticos, bebidas refrescantes, etc. También están presentes en los fluidos corporales, como sangre, saliva, lágrimas y orina, entre otros. ACTIVIDAD GRUPAL En equipos de cuatro personas resuelvan por escrito el siguiente cuestionario y compartan sus respuestas con todo el grupo. 1. ¿Por qué las alhajas de oro (aretes, collares, pulseras, etc.) adquieren la dureza suficiente —que nos permite darles una forma definida— si los metales en estado puro son blandos? Escribe los números correspondientes Competencias genéricas Competencias disciplinares 2. ¿Por qué las lágrimas tienen el sabor característico que presentan? 3. ¿De qué elementos se compone la sangre? 4. Incorporen esta actividad a su portafolio de evidencias. Desarrollo de secuencia Entremos en materia Generalidades En la ciencia química, las mezclas son la unión de dos o más especies químicas diferentes, en las que cada una de las sustancias que las componen conserva sus propiedades químicas características y se clasifican en homogéneas y heterogéneas. Mezclas homogéneas. Son aquellas que presentan una sola fase, es decir, que no se observan los componentes que las forman. Por ejemplo: agua con sal, sal con azúcar, agua con alcohol, agua de limón. Mezclas heterogéneas. Son aquellas en donde se presentan dos o más fases, lo que significa que se pueden observar los componentes que conforman la mezcla. Por ejemplo: agua con aceite, agua con arena. A las mezclas homogéneas también se les conoce como disoluciones, porque la única [ 61 ] Química 2 fase que presentan está formada a su vez por una fase dispersa llamada soluto (que se encuentra en menor cantidad y se disuelve en el disolvente), y un medio dispersante denominado disolvente (que se encuentra en mayor cantidad y disuelve al soluto). En caso de que el soluto y el disolvente se presenten en igual cantidad (50% y 50%), la especie química que tomará el papel del disolvente será la que comúnmente se utiliza como tal, es decir, como disolvente. Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. En forma individual, responde en tu libreta de apuntes las siguientes cuestiones. Competencias disciplinares Al elaborar una limonada: a) ¿En qué estado agregas los ingredientes? b) ¿Qué tipo de mezcla obtendrías? c) Si se te pidiera que separaras los ingredientes con los que elaboraste la limonada, ¿qué elementos obtendrías? Al preparar un café: a) ¿Qué ingredientes utilizas? b) ¿En qué estado agregas esos ingredientes? c) ¿Qué tipo de disolución preparas? 2. Incorpora esta actividad a tu portafolio de evidencias. Clasificación de disoluciones Las disoluciones de mezclas homogéneas se pueden clasificar por el estado de agregación (sólido, líquido y gaseoso) en que se encuentran las especies químicas que vayan a disolverse, como se muestra en la tabla siguiente. Clasificación de mezclas por su estado de agregación Tipos de mezcla [ 62 ] Componentes (disolvente/soluto) Sólidas Sólido en sólido Sólido en gas Sólido en líquido Líquidas Líquido en líquido Líquido en sólido Líquido en gas Ejemplos •Aleaciones • •Latón • (zinc y cobre) •Acero • (fierro‐carbón mineral) •Amalgamas • •Mercurio, • zinc y eugenol Alcohol en agua Agua en sal (salmuera) Agua y oxígeno (agua oxigenada) Unidad 2 | Secuencia 3 Disoluciones Clasificación de mezclas por su estado de agregación Tipos de mezcla Gaseosas Componentes (disolvente/soluto) Gas en gas Gas en líquido Gas en sólido Ejemplos Gaseosas Cervezas Aire Vapor de agua Esmog Las disoluciones de mezclas heterogéneas son conocidas como emulsiones. En función de lo anterior, las disoluciones se clasifican en empíricas y valoradas. Disoluciones empíricas Diluidas Concentradas Saturadas Sobresaturadas Disoluciones valoradas Porcentuales: m/m ; m/v ; v/v Molares Molales Normales Formales Disoluciones empíricas Este tipo de disolución se basa en un análisis de la concentración (que es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente) y no se requiere un cálculo cuantitativo, sino que únicamente implica cantidades de soluto disuelto en volumen de disolvente, como se observa a continuación: •• Disoluciones diluidas. Son aquellas en que la cantidad de soluto en un disolvente es muy pequeña. •• Disoluciones concentradas. Son aquellas en las que la cantidad de soluto es un poco menor que la cantidad en el disolvente. •• Disoluciones saturadas. En ellas se ha disuelto la máxima cantidad posible de soluto en el disolvente. •• Disoluciones sobresaturadas. Cuando tenemos una disolución saturada y continuamos agregando soluto, no existirá más disolvente que disuelva ese aumento de soluto a menos que se caliente la disolución. Soluto Disolvente Ejemplos de disoluciones diluidas, concentradas y saturadas. [ 63 ] Química 2 Disoluciones valoradas Este tipo de disolución implica mediciones cuantitativas, por lo que las concentraciones se expresan en porcentajes (%, disoluciones porcentuales), molaridades (M, disoluciones molares), normalidades (N, disoluciones normales), etc. Más adelante se desarrollará la forma de calcular las dos primeras. Las disoluciones porcentuales se expresan de la siguiente manera: Porciento masa/masa (% m/m), es la relación que expresa la cantidad de la masa de soluto por cada 100 g de disolución y está dada en unidades de %(g/g), es decir: %m/m [masa de soluto (g)/masa de disolución (100 g de disolución)] ∗ 100 % (g/g) Porciento masa/volumen (% m/v), es la relación que expresa la cantidad de la masa de soluto por cada 100 mL de disolución y está dada en unidades de %(g/mL), es decir: %m/v [masa de soluto (g)/volumen de disolución (100 mL de disolución)] ∗ 100 % (g/mL) Porciento volumen/volumen (% v/v), es la relación que expresa la cantidad de volumen de soluto por cada 100mL de disolución y está dada en unidades de %(mL/mL), es decir: %v/v [volumen de soluto (mL)/volumen de disolución (100 mL de disolución)] ∗ 100 % (mL/mL) Las disoluciones molares son aquellas en donde se expresa la cantidad de moles de soluto que se disuelven en 1000 mililitros de disolución (1L); la concentración molar se define como: M número de moles de soluto (mol)/volumen de la disolución (L) 1 molar mol/L Las disoluciones molales son aquellas en donde se expresa la cantidad de moles de soluto en relación con el peso del disolvente, la principal ventaja de esta unidad de concentración, con respecto a la molaridad, radica en el hecho de que la molalidad no está en función del volumen; por lo tanto, es independiente de la temperatura y la presión. m número de moles de soluto (mol)/peso de la disolución (kg) 1 molal mol/kg Las disoluciones normales son aquellas que se expresan como el peso equivalente químico del soluto que se disuelve en 1000 mililitros de disolución (1L); esta concentración se define como: N (número eq./g de soluto)/1 L disolución 1 Normal Eq. Q/L El equivalente químico (Eq. Q) depende de la especie química a la que nos estemos refiriendo, en el caso de las especies ácidas es el número de hidrógenos o protones que pueden ser sustituibles o reemplazables en una especie química; para las sales corresponde al número de protones que pueden ser sustituibles; para el caso de las bases corresponde al número de iones hidroxilo que contiene el compuesto, mientras que para compuestos que actúan en una reacción redox corresponde a la cantidad de electrones transferidos cuando se oxida o se reduce un mol de compuesto. El peso equivalente químico se calcula como: eq./g p. m. /núm. eq. g/eq. [ 64 ] Unidad 2 | Secuencia 3 Disoluciones Ejemplos: Especie química Núm. de equivalentes químicos Peso molecular (p.m.) Fórmula eq./g p.m. núm. eq. g /eq Peso Eq. Q HCl H (11) (1 átomo) 1 Eq. Q 36.4 g 36.4 g 1 eq. 36.4 g /eq. Al2O3 Al (31) (2 átomos) 6 Eq. Q 102 g 102 g 6 eq. 17 g /eq. H2SO4 H (11) (2 átomos) 2 Eq. Q 98 g 98 g 2 eq. 49 g /eq. Mg(OH)2 Mg (21) (1 átomo) 2 Eq. Q 58 g 58 g 2 eq. 29 g /eq. En el ejemplo del HCl existe 1 protón (11) en 36.4 g de ácido, que es igual a 1 equivalente químico; en el Al2O3 ,por cada átomo de aluminio hay 3 electrones transferidos (para este caso el estado de oxidación del aluminio es 31) y como el compuesto tiene 2 átomos de aluminio, el total de cargas transferidas será de 6. Así que dividiendo el peso molecular (p.m.) entre 6, resulta que por cada 17 g de óxido hay 1 equivalente químico. Analiza los demás ejemplos utilizando el procedimiento que se describió. Las disoluciones formales son aquellas que se expresan como el peso fórmula del soluto que se disuelve en un litro disolución: F (peso fórmula de soluto) 1 L de disolución 1F Estequiometría de disoluciones Al realizar cálculos estequiométricos de las disoluciones valoradas nos vamos a encontrar con dos situaciones comunes: 1a. situación: Necesitamos preparar disoluciones a diferentes concentraciones. 2a. situación: Necesitamos calcular la concentración de disoluciones que fueron preparadas con anterioridad. Principalmente necesitamos “leer” correctamente el problema para determinar a qué situación (1a. o 2a.) nos enfrentamos. Porciento masa-masa % (m/m) Porciento masa-volumen % (m/v) Cálculo de disoluciones porcentuales 2ª situación 1 situación a % m/m masa de soluto (100%) masa de disolución masa soluto (% m/m) (masa de disolución) 100% (fórmula despejada de la primera) (fórmula despejada de la primera) 1ª situación 2ª situación % m/v masa de soluto (100%) volumen de disolución (fórmula despejada de la primera) m soluto (% m/v) (volumen de disolución) 100% (fórmula despejada de la primera) [ 65 ] Química 2 Porciento 1ª situación volumen-volumen: volumen de soluto (100%) % v/v % (v/v) volumen de disolución Escribe los números correspondientes Competencias genéricas 2ª situación V soluto (% v/v) (volumen de disolución) 100% ACTIVIDAD INDIVIDUAL Analiza de forma individual la resolución de cada uno de los ejemplos que se presentan e intenta resolverlos por ti mismo. Competencias disciplinares Disoluciones porcentuales (m/m) 1. ¿Cuántos gramos de Ca(OH)2 se necesitan para preparar 500 g de una disolución al 30% (m/m)? S i “leemos” correctamente el problema, nos daremos cuenta de que se solicita calcular el peso del soluto; por tanto, debemos elegir la segunda situación. Fórmula m soluto Datos (% m/m) (masa de disolución) 100% m soluto % m/m ? 30% (g/g) m disolución 500 g Sustitución Operación m soluto (30%) (500 g) 15,000 g 150 g 100% 100 Resultado 150 g % entre % se eliminan y las unidades resultantes son gramos (g). Preparación de la disolución Debemos pesar 150 g de soluto y 350 g de disolvente (un ejemplo de disolvente podría ser agua) para poder obtener 500 mL de disolución de Ca(OH)2 al 30%. ¿Por qué pesamos gramos y obtenemos mililitros? Debemos recordar que la densidad del agua es 1 g/mL; esto significa que 1 gramo de agua es igual a 1 mililitro de agua (propiedad específica del agua). Expresar mililitro (mL) es equivalente a expresar cc (centímetro cúbico o cm3), es decir: 1 mL 1 cm3 2. Si 250 gramos de una disolución de cloruro de sodio (NaCl) se evaporan hasta la sequedad dejando como residuo 40 gramos de soluto, ¿cuál era el porcentaje de sal en la disolución? Si leemos con atención el problema, veremos que se solicita calcular el porcentaje en masa de la disolución; por tanto, debemos elegir la primera situación. [ 66 ] Unidad 2 | Secuencia 3 Fórmula Disoluciones Datos masa de soluto masa de disolución % m/m Sustitución % m/m (100%) Operación ? %m m soluto 40 g m disolución 250 g Resultado 40 gramos 40 (100%) (100%) 250 gramos 250 16% (m/m) g entre g se eliminan y las unidades resultantes son % (m/m). Disoluciones porcentuales (m/v) 1. ¿Cuál es el porcentaje de soluto de una disolución que se preparó con 25 g de carbonato de potasio disolviendo en H2O hasta completar 175 mL de disolución? Datos Fórmula % m/v masa de soluto (100%) volumen de disolución Factor unitario: (100 mL de disolución) (25 g de KCO3) (175 mL de disolución) 14.28 g Sustitución Operación % m/v 14.28 g 100 mL % m/v (14.28) (100%) 100 % m/v ? m soluto 25 g V disolución 175 mL Resultado 14.28% (m/v) mL de agua es igual a g de agua; g entre g se eliminan y las unidades resultantes son % (m/v). 2. ¿Cuál es la cantidad de soluto C12H22O11 (azúcar) contenido en 825 mL de disolución glucosada al 20% (m/v)? Fórmula Datos m soluto Sustitución m soluto (%m/v) (volumen de disolución) 100% Operación (20%) (825 mL) 16 500 mL 100% 100 m soluto ? % m/v 20% (g/mL) v disolución 825 mL Resultado 165 g % entre % se eliminan y las unidades resultantes son mL. [ 67 ] Química 2 Factor unitario: (825 mL de disolución) (20 g de C12H22O11) (100 mL de disolución) 165 g de C12H22O11 Disoluciones porcentuales v/v 1. ¿Cuántos mililitros de ácido nítrico (HNO3) se requieren para preparar 15 00 mL de una disolución al 25%? Fórmula Datos v soluto (% v/v) (volumen de disolución) 100% Sustitución v soluto Operación (25%) (1 500 mL) 100 % V soluto ? % v/v 25 % (mL/mL) v disolución 1 500 mL Resultado 37 500 mL 100 375 mL % entre % se eliminan y las unidades resultantes son mL. Preparación de la disolución Debemos medir 375 mL de soluto y 1 125 mL de disolvente (que generalmente es agua) y se obtienen 1 500 mL de disolución de HNO3 al 25%. 2. ¿Qué porcentaje de soluto tendrá una disolución alcohólica que se preparó disolviendo 280 mL de alcohol etílico en 1 720 mL de agua? Fórmula Datos % v/v volumen de soluto volumen de disolución Sustitución % v/v 280 mL (100%) 2 000 mL (100%) Operación 28 000 % 2 000 mL entre mL se eliminan y las unidades resultantes son % (v/v). 3. Incorpora esta actividad a tu portafolio de evidencias. [ 68 ] % v/v ? v soluto 280 mL v disolución 2 000 mL Resultado 14% (v/v) Unidad 2 | Secuencia 3 Disoluciones Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Resuelve individualmente en tu cuaderno los siguientes problemas para reforzar e integrar el aprendizaje de las disoluciones porcentuales. Problema Tipo de disolución porcentual Fórmula a utilizar Competencias genéricas Competencias disciplinares Resultado del problema a) S e evapora una muestra de 135 g de agua de mar a sequedad y queda un residuo de 4.75 g de soluto. Calcula el % de masa del soluto presente en el agua de mar original. b) Un explosivo industrial común contiene 94% (m/v) de nitrato de amonio y 6% (m/v) de aceite combustible. ¿Qué cantidad de cada componente de la disolución se deben mezclar para preparar 500 g del explosivo? c) Calcula los gramos de soluto que deben disolverse en 350 g de agua para preparar una disolución de sulfato de potasio al 19% (m/v). d) Si se disuelven 75 mL de vinagre (ácido acético) en 225 mL de agua, ¿cuál es el porcentaje v/v de vinagre en la disolución? e) Una disolución blanqueadora comercial tiene 3.62% (m/v) de hipoclorito de sodio. ¿Cuál es la masa del hipoclorito en un recipiente que contiene 2 500 mL de disolución blanqueadora? f) Se prepararon 200 mL de una disolución de alcohol etílico al 32%. ¿Cuál es el volumen de soluto que se utilizó en esta preparación? g) Se prepara una disolución que contiene 6.9 g de bicarbonato de sodio (NaHCO3, polvo para hornear) en 43 mL de agua. ¿Cuál es el porcentaje m/v de soluto en la disolución? 2. Incorpora esta actividad a tu portafolio de evidencias. [ 69 ] Química 2 Cálculo de disoluciones molares El cálculo estequiométrico de disoluciones molares es aún más analítico y específico que el de las disoluciones porcentuales, ya que debemos tomar en cuenta los moles de las especies químicas que participan como soluto. Generalmente los solutos líquidos en estado puro no existen en la naturaleza como tales, sino que están combinados con disolventes. Además, algunas veces necesitaremos calcular la concentración de disoluciones preparadas con anterioridad, o bien, preparar una disolución a cierta concentración. Es por esto que nos vamos a enfrentar con cuatro situaciones diferentes, que se observan en el siguiente esquema: Soluto sólido Disoluciones molares Soluto líquido Cálculo de concentración molar Preparación de disolución a concentración molar Cálculo de concentración molar Fórmula M P soluto (p.m. soluto) (V) Fórmula P soluto (M) (p.m. soluto) (V) Fórmula M (V soluto) (d) % (pureza) (p.m. soluto) (V) 100% Fórmula Preparación de disolución (M) (p.m. soluto) (V) (100%) a concentración molar V soluto (d) (% pureza) Nota: d 5 densidad del soluto Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL Analiza individualmente la resolución de cada uno de los ejemplos que se presentan enseguida e intenta resolverlos. Competencias disciplinares 1. Calcula la molaridad de una disolución de ácido ascórbico (C6H8O6) —también conocido como vitamina C— que se preparó disolviendo 1.8 g de ácido en suficiente cantidad de agua para obtener 125 mL de disolución. Como el ácido ascórbico es sólido, determinamos la fórmula. Fórmula M P soluto (p.m.) (V) Datos M ? P soluto 1.8 g p.m. (12 g/mol) (6) (1 g/mol) (8) (16 g/mol) (6) 176 g/mol V 125 mL 0.125 L * El volumen debe manejarse siempre en litros (L). [ 70 ] Unidad 2 | Secuencia 3 Sustitución M Operación 1.8 g (176 g/mol) (0.125 L) Disoluciones Resultado 1.8 mol 22 L 0.08 mol/L 0.08 M g entre g se eliminan y las unidades resultantes son mol/L. Observaciones La definición de molaridad es mol/L. Por tal motivo, el volumen de la disolución debe convertirse en unidades de litro cuando sea necesario, de acuerdo con los datos que nos proporcione el problema. 2. Determinar los g de soluto que se deben disolver para preparar 200 mL de una disolución 0.66 M de carbonato de calcio (CaCO3). Como el carbonato de calcio es sólido, determinamos la fórmula. Fórmula P soluto (M) (p.m.) (V) Datos P soluto ? M 0.66 mol/L p.m. (40 g/mol) (1) + (12 g/mol) (1) + (16 g/mol) (3) 100 g/mol V 200 mL 0.200 L Sustitución Operación P soluto (0.66 mol/L) (100 g/mol) (0.2 L) 0.66 3 100 g 0.2 Resultado 13.2 g mol entre mol se eliminan; L entre L se eliminan, y las unidades resultantes son g. Observaciones La definición de molaridad es mol/L. Por tal motivo, el volumen de la disolución debe convertirse en unidades de litro cuando sea necesario de acuerdo con los datos que nos proporcione el problema; debemos sustituir la M de molaridad por sus unidades para poder eliminarlas en la operación. 3. ¿Cuál es la molaridad de 500 mL de una disolución de HCl que se preparó con 150 mL de ácido de 1.18 g/mL de densidad y 82% (m/v) de pureza? Como el ácido clorhídrico es líquido, determinamos la fórmula. Fórmula M (V soluto) (d) (% pureza) (p.m). (V) (100%) Datos M V soluto d (densidad) pureza p.m. ? 150 mL 1.18 g/mL 82% (1 g/mol) (1)+ (35.4 g/mol) (1) 36.4 g/mol V = 500 mL 0.500 L (Continúa) [ 71 ] Química 2 (Continuación) Sustitución Operación M (150 mL) (1.18 g/mL) (82% ) (36.4 g/mol) (0.5 L) (100%) Resultado 14,514 mol 1 820 L 7.9 mol/L 7.9 M mL entre mL se eliminan; g entre g se eliminan; % entre % se eliminan, y las unidades resultantes son mol/L. Observaciones El peso molecular del soluto debe estar en g/mol, la densidad en g/mL, el volumen del soluto en mL y el volumen de la disolución en L. 4. ¿Qué volumen de soluto se encuentra disuelto en 750 mL de disolución 0.33 M de ácido sulfúrico (H2SO4), teniendo una densidad 5 1.27 g/mL y 90% (m/v) de pureza? Como el ácido sulfúrico es líquido, determinamos la fórmula. Datos V soluto ? M 0.33 mol/L d 1.27 g/mL Fórmula pureza 90% (M) (p.m.) (V) (100%) p.m. (1 g/mol) (2) + (32 g/mol) + (16 g/mol) (4) V soluto (d) (% pureza) 98 g/mol V 750 mL 0.750 L Sustitución V soluto Operación 2 425.5 mL (0.33 mol/L) ( 98 g/mol) (0.75 L) (100%) 114.3 (1.27 g/mL) (90%) Resultado 21.2 mL mol entre mol se eliminan; L entre L se eliminan; g entre g se eliminan; % entre % se eliminan, y las unidades resultantes son mL. Observaciones Las mismas que en el ejemplo anterior. 5. Incorpora esta actividad a tu portafolio de evidencias. Una vez que has aprendido la estequiometría de las disoluciones, seguramente te preguntarás: ¿para qué nos sirven las disoluciones?, ¿en qué se utilizan?, ¿son importantes? Por la inmensa cantidad de procesos y productos que se obtienen de las reacciones entre solutos y disolventes, la estequiometría cobra gran importancia, ya que hacer un mal cálculo de la cantidad de reactivos a usar en una reacción puede ocasionar grandes pérdidas económicas a la industria, desequilibrios ecológicos y daños a la salud. [ 72 ] Unidad 2 | Secuencia 3 Disoluciones Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Para reforzar e integrar el conocimiento de las disoluciones normales, desarrolla en tu cuaderno los siguientes problemas y completa la tabla. Problema Fórmula a utilizar Competencias genéricas Competencias disciplinares Resultado del problema a) Calcular la normalidad de una disolución blanqueadora compuesta por 10 g de cloruro de calcio (CaCl2) en 250 mL de disolución. b) ¿Qué cantidad de soluto se necesita para preparar 750 mL de una disolución 0.03 N de KMnO4? c) Determina el peso del soluto disuelto en 100 mL de disolución 4.5 N de clorato de magnesio Mg (ClO3)2 d) ¿Qué volumen de H2SO4 con densidad de 1.28 g/mL y un 85% de pureza se requiere para preparar 250 mL de una disolución 0.15 N? e) ¿Cuántos mililitros de HCl con 75% de pureza y densidad de 1.3 g/mL se deben disolver para preparar 700 mL de una disolución 0.05 N? f) Para preparar 300 mL de una disolución 0.5 N de hidróxido de magnesio Mg(OH)2. ¿Qué cantidad de soluto se requiere para prepararla? g) ¿Cuál es la normalidad de 1 500 mL de una disolución que se preparó con 20 mL de HNO3 (ácido nítrico) con densidad de 1.27 g/mL y 85% de pureza? h) ¿Qué normalidad tiene una disolución de 0.75 L que se preparó con 25 g de NaOH? i) ¿Qué cantidad de Eq. Q/L se tiene en 500 mL de una disolución que se preparó mezclando 46 mL de HNO3 cuya densidad es 1.18 g/mL y 76% de pureza? j) ¿Cuál es la normalidad de 1 litro de disolución que contiene 3.5 mL de ácido fosfórico (H3PO4) con densidad de 1.10 g/mL y 85% de pureza? k) Se quiere preparar 150 mL de disolución de HCl ¾ N. El porcentaje de pureza del ácido es 98% y su densidad es de 1.12 g/mL. ¿Qué volumen se deberá medir para preparar la disolución? l) ¿Cuál es la normalidad de una disolución que se preparó disolviendo 75 g de NaCl en 500 g de agua? 2. Incorpora esta actividad a tu portafolio de evidencias. [ 73 ] Química 2 Conocer las expresiones de las unidades químicas en las reacciones y en las disoluciones nos ayuda a descubrir características de sustancias en disolución de interés para las industrias alimentaria, farmacéutica, cosmética, vinícola, etc. Para entender la relevancia del tema, analicemos la siguiente lectura. En la industria farmacéutica se presta gran atención a las preguntas acerca de la fiabilidad de las pruebas que se hacen en países de ingresos bajos y medianos durante la fabricación de medicamentos. Sin embargo, los verdaderos peligros potenciales se observan en el nivel de calidad de la fabricación, sobre todo en la dosificación de los principios activos. En 2007 y 2008, cientos de pacientes a los que se suministraba heparina —un anticoagulante preventivo para uso en cirugías y diálisis—, sufrieron graves reacciones alérgicas a causa de una mala producción en la planta manufacturera. A la farmacéutica que distribuía el medicamento le costó tiempo, dinero y esfuerzo hallar el origen del problema. En 2009, según el Institute for Safe Medication Practices, 19 551 personas fallecieron en Estados Unidos como resultado directo de un medicamento que se les prescribió. Aunque ese fue el número de muertes que se reportó, es muy probable que no sea real, ya que se estima que sólo se reporta 10% de los decesos causados por medicamentos. Desde una perspectiva conservadora, se puede decir que el número de muertes causadas por medicamentos que se consideraban “seguros” ronda unas 200 000 al año. Esto equivaldría al triple de personas que mueren al año por problemas relacionados con la diabetes, y cuatro veces al número de decesos derivados de enfermedades renales. En general, las muertes causadas por medicamentos de receta aprobados por la FDA son muchas más que las ocasionados por la cocaína, la heroína y otras drogas ilegales, o los fallecimientos por accidentes de tránsito. Fuente: www.vanityfair.com/politics/features/2011/01/ deadly-medicine-201101?printable=true&currentPage=all ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 5 de la página 185. 2. Incorporen esta actividad a su portafolio de evidencias. [ 74 ] Unidad 2 | Secuencia 3 Disoluciones Cierre de secuencia Conclusión del caso inicial Es poco común que en la naturaleza se encuentren los elementos en estado absolutamente puro; por lo general, se encuentran combinados entre sí con otros de igual o semejantes características. Es así como el ser humano utiliza sus conocimientos para elaborar productos que satisfagan sus necesidades y les proporcionen mejores niveles de vida. Para ejemplificar esta realidad, investiga de qué están elaborados los productos y artículos de la siguiente lista. 1. El chorizo casero 2. La arena de los mares 3. Los ladrillos 4. Las libretas 5. Las prendas de vestir sintéticas Redacta un breve resumen que fundamente y justifique si los elementos de los puntos anteriores son o no mezclas o disoluciones. [ 75 ] Química 2 Ejercicios de cierre Con la intención de reforzar los conocimientos aprendidos, realiza de manera individual las actividades que se presentan para el cierre de la secuencia. I. Encuentra en la siguiente sopa de letras los enunciados que corresponden a las pistas que se proporcionan en la siguiente página. D C V A E M T U D E N S I D A D X E H C M E D I O E D I S P E R S A N T E K O X D A R L M W I C P S A U N O L I M N O X I L E H C E S Q E F O Ñ C L A D C C L A L X S V N S O B G A N B I E R E M I B S U B M E Z C L A S P M S V O N B E T S A I S L G U F V S E M E E E T L A N E E D D L E E C V E E S E W L R X E H C O E A A E A M O G N L V W R A D A R L E V A R S A U F P A T A F O D M I E A N B I M U M S T E L I E L A A T R E M Y S V E E T E O S E S R U S V M O S L A O E K W A W U E V S C L I A E E N V M O L A R E S E C C F V X E H C C W V F V H U L C L A S E R O F E A N B A I E G E I T X E H C D I S O L U C I O N S R V A L O R A D A F A P X E H C F O X E H C L A E A N B I V C L A E T N E L A V I U Q E S O S E P E Q U A N B I X E H C O F O C L A D A R X E H C M I L I L I T R O S O E A N B I N 1. Si tomas una jarra y le agregas agua fría, azúcar y jugo de limón, estarás preparando una refrescante bebida. Al mezclar los ingredientes no observas distintivamente todo lo que mezclaste, ¿qué obtuviste, químicamente hablando? 2. Quieres reparar una parte dañada de la fachada de tu casa y consigues cemento, arena y agua, así como una pala y una cuchara de albañil. Una vez que reúnes todos tus materiales con los instrumentos necesarios, ¿qué producto estás fabricando? [ 76 ] Unidad 2 | Secuencia 3 Disoluciones 3. En nuestro hogar, para disfrutar la hora de la comida se prepara una suculenta sopa de verduras, elaborándola con un poco de agua, algunas papas, calabacitas, col o repollo, zanahorias, brócoli, ejotes, jitomate (tomate), cebolla, ajo y una pizca de sal. ¿Se necesitó pesar o medir con exactitud cada uno de los ingredientes? , ¿Es importante la cantidad de verduras que se utiliza? ¿De qué forma se preparó la sopa? 4. Para calmar los dolores musculares después de realizar actividades deportivas, la gente suele mezclar un poco de alcohol con cierta cantidad de agua, y utilizar la disolución como relajante. ¿Cómo interpretarías esta preparación? 5. Cuando se desea barnizar un mueble de madera que ha perdido su brillo por el paso del tiempo y la tierra del ambiente, se emplea esmalte y thinner. ¿Qué función cumple el thinner? . ¿Qué nombre recibe esa función? 6. Las disoluciones que se expresan como equivalentes químicos por litro de disolución se llaman 7. La cantidad de sustancia dispersa en una disolución 8. Nombre que reciben las disoluciones en las que se ha disuelto la máxima cantidad de soluto 9.La cantidad de masa contenida por unidad de volumen es una magnitud aplicada a los líquidos 10. Las disoluciones que relacionan el número de moles en 1 L de disolución son 11. Las disoluciones que involucran un cálculo cuantitativo se clasifican como: 12. Es el peso de un hidrógeno o protón contenido en 1 litro de disolución: 13. Son unidades físicas que también se conocen como cm3 o cc 14. Las disoluciones que contienen gran cantidad de soluto disuelto en el disolvente adecuado son [ 77 ] Química 2 Evaluación de la secuencia didáctica En acuerdo con su profesor seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia. Evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas y aquellos que deben tener en cuenta para mejorar sus resultados. Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas [ 78 ] Evaluación de la estrategia Aspectos que consideré al desarrollar la estrategia Aspectos que debo considerar para mejorar los resultados de la estrategia secuencia cuatro Unidad 1 | Secuencia 1 Materia y energía Ácidos y bases Las ciencias aplicadas no existen, sólo las aplicaciones de la ciencia. Louis Pasteur Propósito de la secuencia Competencias disciplinares Reconocer las características y propiedades de los ácidos y las bases al identificarlas mediante las teorías de Arrhenius y BrØnsted-Lowry y el uso de reactivos para su valoración; definir las escalas de pH y pOH, y determinar su concentración mediante el proceso de titulación. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas, y comunica sus conclusiones. 7. Explicita las nociones científicas que sustentan los procesos para la disolución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 6.4 Estructura ideas y argumentos de manera clara, coherente y sintética. 7.2 Identifica las actividades que le resultan de menor y mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. [ 79 ] Química 2 Contenidos que aborda la secuencia 4 Conceptuales • Ácidos y bases. Teorías ácido-base. Escalas de medición de acidez y basicidad. Neutralización. || || || Procedimentales Axiológicos • Realizará las actividades propuestas para reafirmar el conocimiento adquirido. • Responderá preguntas intercaladas mediante la reflexión. • Desarrollará consultas en fuentes bibliográficas sugeridas. • Realizará prácticas de laboratorio para reafirmar y comprobar los aprendizajes obtenidos. • Desarrollará responsabilidades y compromisos al reconocer la importancia del correcto uso y aplicación de las sustancias ácidas y alcalinas que se encuentran en todos los sistemas en los que nos desenvolvemos. • Valorará la importancia de la cuantificación de las sustancias ácidas y básicas para fundamentar el cuidado del ambiente. • Promoverá el uso responsable de las sustancias ácidas y básicas en nuestra vida cotidiana. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) Producto esperado Instrumentos de evaluación sugeridos 1. Actividad grupal (p. 81) • Proceso desarrollado y resultado obtenido • Guía de observación 2. Actividad individual (p. 83) • Investigación adquirida • Lista de cotejo 3. Actividad grupal (p. 87) • Proceso desarrollado y tabla resuelta • Lista de cotejo 4. Actividad individual (p. 90) • Proceso desarrollado y cuestionario resuelto • Guía de observación 5. Actividad grupal (p. 90) • Reporte de práctica 6 • Rúbrica 6. Actividad grupal (p. 91) • Reporte de práctica 7 • Rúbrica [ 80 ] Unidad 2 | Secuencia 4 Ácidos y bases Apertura de secuencia Ácidos y bases Los ácidos y las bases conllevan una gran importancia en la vida de todos los seres que habitan el planeta Tierra, ya que la acidez y la basicidad de las sustancias juegan un papel muy importante en todos los ámbitos, como se verá enseguida. Si hiciéramos un recuento de todas las actividades que realizamos en un día común, podríamos identificar que dichas sustancias forman parte incluso de nosotros mismos. ACTIVIDAD GRUPAL 1. En equipos de tres personas lean con atención el siguiente relato y determinen el objetivo del mismo para llegar a una conclusión. Si hacemos un recuento de cómo se desarrolla un día normal de una persona promedio, es muy probable que sea como el que se describe a continuación: Escribe los números correspondientes Competencias genéricas Competencias disciplinares Por las mañanas, al iniciar el día, comenzamos con un baño o ducha en el que utilizamos jabón, champú y otros productos elaborados a base de hidróxidos (hidróxido de sodio o sosa cáustica, hidróxido de potasio o potasa). La siguiente actividad por lo general es desayunar alimentos que casi siempre son frescos, como jugos, frutas, leche o yogur, cuyo componente principal son ácidos (el ácido cítrico del limón, la naranja o la toronja; el ácido láctico en la leche, etcétera). Más tarde, si es un día lleno de actividad o estrés en la escuela o el trabajo, muchas veces nuestro horario de comida se retrasa, lo que implica que nuestros jugos digestivos se liberen ocasionando acidez en el estómago (gastritis por liberación del ácido clorhídrico), que el sistema nervioso se desestabilice y un leve grado de neurosis empiece a dar muestra de desequilibrios. Algunos desequilibrios importantes pueden ser los iónicos, como la falta de electrolitos tales como sodio (Na), potasio (K), magnesio (Mg2) o calcio (Ca2), que pueden llegar a causar deshidratación corporal. Al cocinar los alimentos generalmente utilizamos ciertos condimentos a base de ácidos, como el ácido acético o vinagre para saborizar ensaladas; la ingesta de refrescos lleva implícita una buena dosis de ácido carbónico (gaseosas); y si se comen de postre algunas frutas, se tiene presente el ácido ascórbico o vitamina C en limones o naranjas, el ácido málico en manzanas, el bicarbonato de sodio en polvos para hornear y el cloruro de sodio (sal) como condimento, que aunque no son ácidos ni bases, sino sales, juegan un papel importante en la acidez y basicidad de los alimentos. 2. Expongan al grupo el resultado de su análisis e incorporen esta actividad a su portafolio de evidencias. [ 81 ] Química 2 Desarrollo de secuencia Entremos en materia Ácidos y bases En las industrias alimentaria, farmacéutica, textil, médica, biológica y química, entre otras, se requieren estrictos controles de acidez o basicidad de los productos para ofrecer calidad y confiabilidad de los mismos. La mayor parte de las reacciones que resultan de un análisis cuantitativo en laboratorios de control de calidad se lleva a cabo entre electrolitos o ionógenos, mejor conocidos como ácidos, bases y sales. Para entender correctamente la importancia de los electrolitos debemos conocer algunos puntos importantes que forman parte de la Teoría de la ionización: 1. Los ácidos, las bases y las sales disueltos en disolventes adecuados (generalmente agua), se disocian en unidades llamadas iones. Algunas características son: •• Los ácidos originan iones H. •• Las bases originan iones OH. •• Las sales originan iones () diferentes al H y iones negativos () diferentes al OH. 2. Los iones que se liberan en una disolución están cargados eléctricamente, lo que les permite conducir la corriente eléctrica: •• Los iones que en la electrólisis emigran hacia el ánodo (electrodo ), están cargados negativamente y se llaman aniones (como sucede en las baterías de los automóviles). •• Los iones que emigran al cátodo (electrodo ), están cargados positivamente y se llaman cationes. 3. La ionización es un proceso que obedece a un equilibrio reversible. 4. Los ionógenos diferentes varían en cuanto a su grado de ionización. 5. El grado de ionización aumenta si se diluye la disolución, y es cuando los ionógenos se consideran completamente ionizados a disolución infinita. 6. Cada ión tiene propiedades físicas y químicas propias. Los ácidos y las bases pueden clasificarse como débiles y fuertes. En la siguiente tabla se resumen algunas características y se da un ejemplo de cada tipo. [ 82 ] Unidad 2 | Secuencia 4 Ácidos y bases Clasificación de ácidos y bases Ácidos Los ácidos son sustancias que contienen hidrógeno (H) y que en disolución producen iones H. Ácidos débiles Son aquellos que disueltos en agua se hallan muy poco disociados o ionizados y que, por tanto, presentan poco pronunciadas las propiedades características del ión H. Ácido carbónico H2CO3 → ← H HCO3 Ácidos fuertes Son aquellos que disueltos en agua están muy ionizados y, por tanto, presentan muy marcadas las características del H, como son: conductividad eléctrica, gran actividad química, sabor agrio. Ácido clorhídrico HCl → ← H Cl En general, los ácidos tienen sabor acre, hacen cambiar el papel tornasol de azul a rojo, neutralizan las bases y reaccionan con los metales activos del grupo I A y II A de la tabla periódica. Bases Las bases son sustancias que contienen el grupo OH (ión oxidrilo) y que en disolución producen iones OH. Bases débiles Son aquellas que disueltas en agua se hallan muy poco ionizadas y por tanto presentan muy poco marcadas las propiedades típicas del ión OH. Bases fuertes Son aquellas que disueltas en agua se hallan muy ionizadas y por tanto presentan muy marcadas las propiedades características del ión OH, como son: gran conductividad eléctrica, gran actividad química, sabor a lejía (jabón). Amoniaco 1 NH3 H2O → ← NH4 OH2 Hidróxido de potasio (potasa) KOH → ← K OH Hidróxido de sodio (sosa cáustica) → Na OH NaOH ← En general, las bases tienen sabor amargo, cambian el papel tornasol de rojo a azul, neutralizan los ácidos y causan una sensación resbaladiza al tacto. Las sales son sustancias que en disolución acuosa liberan iones diferentes al H y iones diferentes al OH2, además de que tendrán sus propiedades características de acuerdo con los radicales que las formen. ACTIVIDAD INDIVIDUAL 1. De manera individual consulta en Internet los alimentos de consumo cotidiano clasificados como ácidos o bases débiles. 2. Anota en tu cuaderno la información que adquiriste. Escribe los números correspondientes Competencias genéricas Competencias disciplinares 3. Incorpora esta actividad a tu portafolio de evidencias. [ 83 ] Química 2 Teorías ácido-base Svante August Arrhenius Fue galardonado con el Premio Nobel de Química en 1903. Para desarrollar su teoría, Arrhenius definió los ácidos como sustancias del tipo HX, que en disolución se disocian produciendo iones H y X, y a las bases como sustancias del tipo MOH, que en disolución se disocian produciendo iones M y OH. A la neutralización la definió como el resultado de la combinación de esos iones para dar agua. HX MOH H X M OH H2O H OH Las ideas de Arrhenius se tuvieron que ampliar por varias razones. Una de ellas fue que el protón del ácido NO existe en disoluciones acuosas, sino que el ión que se libera se combina con una molécula de agua (H2O) para formar el ión hidronio (H3O). Brønsted-Lowry El danés Johannes Nicolaus BrØnsted y el británico Thomas Martin Lowry ampliaron la definición de ácidos y bases al describir un ácido como un donador de protones y una base como un receptor de protones. Explicaron que dependía de la naturaleza de las moléculas si el disolvente actúa como ácido o como base, además de que una reacción ácido‐base consiste en la transferencia de un protón desde un ácido a una base para formar un nuevo ácido y una nueva base. De acuerdo con lo anterior, observemos el siguiente cuadro donde los pares ácido 1 base 1 o ácido 2 base 2 se llaman pares conjugados. Por ejemplo, el ión [ 84 ] Unidad 2 | Secuencia 4 Ácidos y bases acetato (Ac) es la base conjugada del ácido acético (HAc), y el amoniaco (NH3) es la base conjugada del ión amonio (NH4). ácido 1 base 1 ácido 2 base 2 H2O H2O H3O OH HCl H2O H3O Cl HAc H2O H3O Ac H2O NH3 NH4 OH En el siguiente esquema se observa la reacción de disociación del ácido acético, donde el agua actúa en este caso como base. De acuerdo con la teoría de BrØnstedLowry, el ácido acético dona un protón al agua para dar como producto final al ión hidronio y al ión acetato. H O O H C C H2O CH3 C H3O O OH H Gilbert Newton Lewis Para poder completar la teoría de BrØnsted–Lowry, Lewis definió un ácido como toda sustancia que puede aceptar un par de electrones, y la base como una sustancia que tiene un par de electrones no compartidos que puede ceder. La reacción ácido−base para Lewis es la donación de un par de electrones que un átomo hace a otro. Al producto de la reacción se le denomina aducto, que es un producto AB formado por la unión directa de dos moléculas A y B, sin que se produzcan cambios estructurales en las porciones A y B. ácido base A :B ácido base a ducto A:B Complejo ácido-base BF3 F BF4 H NH3 NH14 [ 85 ] Química 2 Escalas de medición de acidez y basicidad Una vez que aprendimos cómo se define un ácido y una base, podemos hacer uso de las escalas de medición que nos permiten medir cuantitativamente la acidez (el grado en que es ácida una sustancia) y la basicidad (el grado en que es básica una sustancia) de distintas sustancias, como son la escala de pH y la de pOH. Escala de pH El pH se relaciona con la concentración del ión H en la disolución y se define como: pH log (1/[H]) log [H] donde, log logaritmo base 10 [H] concentración del ión H Ejemplo: Si la concentración de H 1.0 105, entonces: pH log (1.0 105) (5.0) 5; pH 5 Si la concentración de H = 5.0 104, entonces: pH log (5 104) (0.7 4) (3.3); pH 3.3 Cuando el pH de una disolución es menor que 7 (entre 1 y 6.9) en la escala, se dice que es una disolución ácida, lo cual sugiere que la cantidad de iones H es mayor que la concentración de iones OH. Cuando el pH de una disolución es de 7 en la escala, se dice que es una disolución neutra, lo cual sugiere que la cantidad de iones H+ es igual a la concentración de iones OH. Cuando el pH de una disolución es mayor que 7 (entre 7.1 y 14) en la escala, se dice que es una disolución básica, lo cual sugiere que la cantidad de iones OH es mayor que la concentración de iones H. Escala de pOH El pOH se relaciona con la concentración de iones oxidrilo (OH) y se define de la siguiente manera; pOH log (1/[OH]) log [OH] donde, log logaritmo base 10 [OH] concentración del ión OH [ 86 ] Unidad 2 | Secuencia 4 Ácidos y bases Existen reglas para el buen uso y entendimiento de las escalas, como son las siguientes. 1. En agua y en disoluciones acuosas neutras a 25 C, el pH 7; es decir, el pH es neutro. 2. En una disolución ácida la [H] es mayor que la [OH], por tanto en la escala del pH una disolución ácida será cuando se tenga un pH menor que 7, mientras que en la escala del pOH una sustancia será ácida cando su pOH sea mayor que 7. 3. En una disolución alcalina la [OH] es mayor que la [H], por tanto en la escala del pOH una disolución es básica cuando su pOH es menor que 7, mientras que en la escala del pH una sustancia será básica cuando su pH sea mayor que 7. Escribe los números correspondientes ACTIVIDAD GRUPAL 1. En equipos de tres personas, consigan las sustancias que se muestran en la tabla. 2. Con la ayuda de su profesor, introduzcan un trozo de papel pH en cada una de las sustancias, y consultando la escala de pH del cuadro comparativo de escalas que se muestra en la siguiente página, determinen el grado de acidez y basicidad de cada sustancia. Competencias genéricas Competencias disciplinares 3. Anoten sus observaciones y conclusiones en su cuaderno. Sustancia pH Sustancia ácida Sustancia básica Jugo de limón Refresco Saliva Ácido sulfúrico Detergente líquido Agua Leche Pasta de dientes Hidróxido de sodio 4. Incorporen esta actividad a su portafolio de evidencias. [ 87 ] Química 2 Cuadro comparativo de escalas pH [OH] pOH 1.0 100 0.0 1.0 1014 14 1.0 101 1 1.0 1013 13 1.0 102 2 1.0 1012 12 1.0 103 3 1.0 1011 11 1.0 104 4 1.0 1010 10 1.0 105 5 1.0 109 9 1.0 106 6 1.0 108 8 1.0 107 7 1.0 107 7 Neutro muy ácido Acidez [H] poco ácido Neutro 8 1.0 106 6 1.0 109 9 1.0 105 5 1.0 1010 10 1.0 104 4 1.0 1011 11 1.0 103 3 1.0 1012 12 1.0 102 2 1.0 1013 13 1.0 101 1 1.0 1014 14 1.0 100 0 poco básico Alcalinidad 1.0 108 muy básico Si el pOH 5, la disolución es una base de fuerte Si el pH 5, la disolución es un ácido de fuerte Si el pOH 1, la disolución es una base fuerza media Si el pH 1, la disolución es un ácido fuerza media Indicadores Los indicadores son sustancias ácidas o básicas débiles cuyo color es diferente en el estado ionizado que en el estado no ionizado y se utilizan para determinar aproximadamente el pH de una disolución. Ejemplo 1: Fenolftaleína Es un ácido débil, que en disoluciones ácidas permanece incoloro pero en presencia de bases se torna de color rosa o violeta. De medio neutro a medio básico: H2Fenolftaleína 2 OH Incoloro Fenolftaleína2 2H2O Rosa Cuando se agrega una base, la fenolftaleína (siendo esta inicialmente incolora) pierde H, formándose el anión y haciendo que tome coloración rosa. [ 88 ] Unidad 2 | Secuencia 4 Ácidos y bases Si agregamos a este indicador un ácido, aumentará la [H], haciendo retroceder así la disociación del indicador, el cual se vuelve incoloro. Ejemplo 2: Anaranjado de metilo XOH X OH Amarillo Rojo Si agregamos a este indicador una base, aumentará la [OH] haciendo retroceder así la disociación del indicador, el cual se vuelve amarillo. Los indicadores pueden ser colorantes naturales como: •• El tornasol, obtenido de líquenes. •• La cúrcuma, extraída de la raíz de una planta india. •• Colorantes orgánicos sintéticos como: anaranjado de metilo, fenolftaleína, verde de bromocresol, azul de timol, etcétera. INDICADORES ÁCIDOS Tornasol Cúrcuma Anaranjado de metilo Fenolftaleína BASES Rojo Amarillo Rojo Incoloro Azul Parda Amarillo Rosa Neutralización Una reacción de neutralización es una reacción entre un ácido y una base. Si en la reacción participan un ácido fuerte y una base fuerte, se obtiene una sal y agua, mientras que si una de las especies es de naturaleza débil, se obtiene su respectiva especie conjugada y agua. Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor. La neutralización es fundamentalmente la combinación de iones de hidrógeno con iones oxidrilo para formar agua. HX H X MOH M OH H X M OH H2O MX Es decir, H OH H2O Por tanto, se alcanza la neutralidad exacta cuando la concentración de iones de hidrógeno y de oxidrilo son iguales. [H] [OH] 1014 pH 7 (neutro) [H] [OH] 1014 [ 89 ] Química 2 Si la concentración de iones OH2 es mayor que 107, la disolución pierde la neutralidad y se convierte en ácida, y si es menor que 107, la disolución es alcalina. Estas reacciones son útiles en el análisis cuantitativo, y se puede usar una disolución indicadora para conocer el punto en el cual se ha alcanzado la neutralización completa. También son útiles como métodos electroquímicos mediante el uso de un pH-metro (se lee: "peachímetro) en la conductimetría. Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL De manera individual, determina los productos que se obtienen en las siguientes reacciones de neutralización y responde el cuestionario que se presenta. No olvides balancear las ecuaciones. Competencias disciplinares a) H2SO4 NaOH b) Ca(OH)2 HCl c) H2CO3 KOH En la reacción a): 1. ¿Cuál sustancia es el ácido y cuál es la base? 2. ¿Cuál es el principal producto de la neutralización? 3. Si determinaras el pH de los productos mediante el uso de papel indicador, ¿qué pH se obtendría? En la reacción b): 1. ¿Cuál sustancia es el ácido y cuál es la base? 2. ¿Cuál es el subproducto de la neutralización? 3. Si determinaras el pH del subproducto mediante el uso de papel indicador, ¿qué pH se obtendría? En la reacción c): 1. ¿Cuál sustancia es el ácido y cuál es la base? 2. ¿Cuál neutraliza a cuál? 3. Si midieras el pH del ácido, ¿qué valor obtendrías? 4. Si midieras el pH del hidróxido, ¿que valor obtendrías? Incorpora esta actividad a tu portafolio de evidencias. ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 6 de la página 187. Incorporen esta actividad a su portafolio de evidencias. [ 90 ] Unidad 2 | Secuencia 4 Ácidos y bases ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 7 de la página 190. Incorporen esta actividad a su portafolio de evidencias. Cierre de secuencia Conclusión del caso inicial Retomando el caso inicial, resuelve el siguiente crucigrama. 5 3 2 6 1 7 4 8 9 10 Verticales 1. Condimento empleado para resaltar el sabor de los alimentos cuya fórmula química es NaCl. 2. Condimento alimenticio utilizado en la preparación de ensaladas. 3. Sustancias que en disolución acuosa liberan iones H. 4. Fruto cítrico de característica ácida que proporciona vitaminas y beneficia el sistema respiratorio. 5. Proceso en el cual los ácidos y las bases alcanzan el equilibrio químico. Horizontales 6. Característica de disoluciones cuyo pH = 7. 7. Producto de higiene personal elaborado a base de lejía (hidróxido de sodio) utilizado en el baño diario. 8. Trastorno ocasionado por la elevada acidez en el estómago del tracto digestivo. 9. Bebida elaborada a base de ácido carbónico. 10. Compuesto químico que se encuentra como ácido en las manzanas. [ 91 ] Química 2 E jercicios de cierre Con la intención de reforzar los conocimientos adquiridos en el tema de ácidos y bases, realiza de manera individual las actividades que se presentan, y responde marcando o subrayando las respuestas correctas. 1. Sustancias que tienen sabor amargo, cambian el papel tornasol de rojo a azul y su pH está entre 7 y 14. a) Neutras. b) Bases. c) Ácidas. d) Puras. 2. Autor(es) de la teoría que afirma que un ácido es un donador de protones y una base es un receptor de protones. a) Lewis. b) Arrhenius. c) BrØnsted-Lowry. d) Lavoisier. 3. Escala que se relaciona con la concentración de iones oxidrilo. a) pH. b) Neutralización. c) Normalidad. d) pOH. 4. Sustancias cuyo color es diferente en estado ionizado y son empleadas para la determinación de la acidez o basicidad de las disoluciones. a) Indicadores. b) Neutras. c) Puras. d) Básicas. 5. Reacciones de sustitución doble cuyo fundamento es obtener productos neutros como sal y agua. a) Oxidación-reducción. [ 92 ] Unidad 2 | Secuencia 4 Ácidos y bases b) Neutralización. c) Ácido-base. d) Exotérmicas. 6. Sustancias que en disolución acuosa liberan iones H. a) Básicas. b) Coloidales. c) Ácidos. d) Sales. 7. Teoría que afirma que los ácidos son sustancias del tipo HX, y las bases del tipo MOH. Además, en disolución producen iones H y X / M y OH, respectivamente. a) BrØnsted-Lowry. b) Lewis. c) Neutralidad. d) Arrhenius. 8. Escala de acidez y basicidad que se define como: pH = log (1/[H]) log [H] a) Escala de pH. b) Escala centígrada. c) Escala de pOH. d) Escala cuántica. 9. Indicador natural que se obtiene de plantas conocidas como líquenes. a) Cúrcuma. b) Tornasol. c) Anaranjado de metilo. d) Verde de bromocresol. 10. Indicador orgánico sintético comúnmente utilizado en el análisis químico cuantitativo para determinar el grado de acidez de las disoluciones. a) Anaranjado de metilo. b) Fenolftaleína. c) Tornasol. d) Verde de bromocresol. [ 93 ] Química 2 Evaluación de la secuencia didáctica En acuerdo con su profesor, seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia, evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas y aquellos que deben tener en cuenta para mejorar sus resultados. Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas [ 94 ] Evaluación de la estrategia Aspectos que consideré al desarrollar la estrategia Aspectos que debo considerar para mejorar los resultados de la estrategia Unidad 2 | Secuencia 4 Ácidos y bases Confirmación de conocimientos de la unidad 2 Propuesta de segundo examen parcial Con el propósito de que reafirmes los conocimientos adquiridos en la unidad 2, resuelve cada una de las cuestiones que se presentan a continuación. I. Completa los espacios. 1. Las uniones de dos o más compuestos químicos diferentes en las que cada sustancia conserva sus propiedades son conocidas como , y se clasifican y heterogéneas. en 2. Las disoluciones se componen de y . 3. Los disolventes son la fracción de las disoluciones que se encuentran en proporción. 4. En las disoluciones de soluto dentro del disolvente. se ha disuelto la máxima cantidad posible 5. Las disoluciones que implican mediciones cuantitativas y que se expresan en molaridad, normalidad y porcentualidad son clasificadas como . 6. El es el número de hidrógenos que pueden ser sustituidos o remplazados en una especie química. 7. La concentración de las disoluciones que se expresan en moles/litro de disolución es conocida como . 8. Las disoluciones en las que se expresan equivalentes químicos contenidos en 1 litro . de disolución son conocidas como 9. es la rama de la ciencia química que estudia las posibles combinaciones entre las sustancias. 10. Es una disolución aquella donde la cantidad de soluto es mínima comparada con la cantidad de disolvente. II. Responde brevemente cada una de las cuestiones siguientes. 1. ¿Cuál es el disolvente más comúnmente utilizado en química inorgánica? [ 95 ] Química 2 2. ¿Qué diferencia existe entre una disolución diluida y una concentrada? 3. ¿Por qué no son sinónimos los términos disolución saturada y disolución concentrada? 4. ¿Cuál es el contenido y el porcentaje de cada componente de una disolución de cloruro de magnesio (MgCl2) al 15%? 5. ¿Qué entiendes por disolución ácida? 6. ¿Qué entiendes por disolución básica? 7. ¿Qué significa el término neutralización? III. Realiza los cálculos necesarios en la resolución de los siguientes problemas. 1. ¿Cuántos gramos de nitrato de plata (AgNO3) se requieren para preparar 400 g de una disolución al 5%? 2. ¿Qué volumen de soluto se encuentra disuelto en 750 mL de disolución 0.33 N de ácido sulfúrico (H2SO4), que tiene una densidad de 1.27 g/mL y 90% de pureza? 3. Calcula la normalidad de una disolución de hidróxido de sodio (NaOH) que se preparó pesando 100 gramos de sosa y 100 gramos de agua. [ 96 ] Unidad tres Química del carbono Química orgánica alifática QUÍMICA DEL CARBONO Hidrocarburos aromáticos Introducción a la química orgánica ¿Qué es el carbono? Clasificación de hidrocarburos Generalidades de los hidrocarburos aromáticos Compuestos orgánicos de importancia biológica Competencias disciplinares que se tratan en la unidad 1. Establece la interrelación entre la ciencia, la tecnología, la sociedad y el ambiente en contextos históricos y sociales. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas, y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. 11. Analiza las leyes generales que rigen el funcionamiento del medio físico y valora las acciones humanas de riesgo e impacto ambiental. 12. Decide sobre el cuidado de su salud a partir del conocimiento de su cuerpo, sus procesos vitales y el entorno al que pertenece. 13. Relaciona los niveles de organización química, biológica, física y ecológica de los sistemas vivos. 14. Aplica normas de seguridad en el manejo de sustancias, instrumentos y equipo en la realización de actividades de su vida cotidiana. Tema integrador de la unidad Con ayuda de su profesor(a), el grupo elegirá un tema relacionado con su ambiente que pudiese, a partir de los temas que se tratan en esta unidad, aportar una respuesta significativa en el aprendizaje de los contenidos. Es deseable coordinar el tema elegido con otras asignaturas para obtener respuestas integrales en la obtención de los conocimientos por aprender. Puede utilizarse un cuadro como el que se propone a continuación. TEMA INTEGRADOR Asignatura 1 Problemática: Observaciones [ 98 ] Asignatura 2 Problemática: Asignatura 3 Problemática: Asunto significativo secuencia cinco Unidad 1 | Secuencia 1 Materia y energía Química orgánica alifática Un diamante es un pedazo de carbón que se ha formado bajo presión. Henry Kissinger Propósito de la secuencia Competencias disciplinares Reconoce e identifica los tipos de compuestos orgánicos, sus fuentes de obtención, estructuras, nomenclaturas y métodos de obtención, desarrollando destrezas y habilidades en la adquisición del conocimiento de la química orgánica para generar una comprensión integral y su aplicación posterior en el desarrollo sustentable rumbo al avance científico y tecnológico que nuestro país requiere. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas, y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. 10. Relaciona las expresiones simbólicas de un fenómeno de la naturaleza y los rasgos observables a simple vista o mediante instrumentos o modelos científicos. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 4.3 Identifica las ideas clave en un texto o discurso oral e infiere conclusiones a partir de ellas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo con categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 6.4 Estructura ideas y argumentos de manera clara, coherente y sintética. 7.2 Identifica las actividades que le resultan de menor a mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. [ 99 ] Química 2 Contenidos que aborda la secuencia 5 Conceptuales • Química orgánica alifática. Introducción a la química orgánica. ¿Qué es el carbono? Clasificación de hidrocarburos. || || || Procedimentales • Realizará las actividades propuestas para reafirmar el conocimiento adquirido de manera individual o colaborativa. • Desarrollará investigaciones en fuentes bibliográficas sugeridas. • Responderá preguntas intercaladas mediante la reflexión. • Integrará las características principales de los compuestos orgánicos clasificados como alifáticos para diferenciarlos por su grupo funcional. Axiológicos • Desarrollará responsabilidades y compromisos al reconocer que las sustancias orgánicas se encuentran en todos los sistemas y en todos los niveles. • Valorará la importancia de la cuantificación de las sustancias para fundamentar el cuidado del ambiente. • Promoverá el uso responsable de los compuestos orgánicos en su vida diaria. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) 1. Actividad grupal (p. 102) 2. Actividad grupal (p. 107) 3. Actividad grupal (p. 111) 4. Actividad grupal (pp. 115-116) 5. Actividad individual (pp. 121-122) 6. Actividad individual (p. 125) 7. Actividad individual (p. 128) [ 100 ] Producto esperado • Resolución de ejercicios • Resolución de ejercicio • Reporte de práctica 8 • Resolución de ejercicios • Resolución de ejercicios • Resolución de ejercicios • Resolución de ejercicios Instrumentos de evaluación sugeridos • Guía de observación • Lista de cotejo • Guía de observación • Lista de cotejo • Lista de cotejo • Guía de observación • Lista de cotejo Unidad 3 | Secuencia 5 Química orgánica alifática Apertura de secuencia Química orgánica alifática Lee con atención el siguiente texto y a continuación resuelve la actividad grupal. La sobrepoblación mundial, que origina grandes aglomeraciones demográficas en ciudades industrializadas —así como en las poblaciones que están en vías de serlo— desencadena una gran demanda de bienes de consumo. Esto genera el aumento volumen de desechos conocidos como basura, que generalmente terminan acumulándose en lugares no destinados para ello, al aire libre, generando muchos problemas higiénicos debido a la proliferación de numerosas bacterias y virus, lo que causa una gran cantidad de enfermedades por contaminación ambiental. Algunas veces, la basura se elimina por medio de la incineración, pero esto también origina un desprendimiento de grandes cantidades de gases tóxicos que contaminan la atmósfera. Una alternativa para disminuir la contaminación por basura ha sido su reciclaje una vez que ha sido clasificada de acuerdo con su composición: orgánica (residuos de alimentos y jardinería) e inorgánica (bolsos, empaques y envases de plástico, metal, vidrio, papel, cartón, etcétera). [ 101 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD GRUPAL En equipos de tres personas, completen la tabla que se muestra enseguida con ayuda de las siguientes indicaciones: Competencias disciplinares 1. Primero, enlisten los materiales de que están compuestos los desechos domésticos más comunes. 2. Clasifíquenlos como orgánicos o inorgánicos de acuerdo con la información que cada miembro del equipo posea. Respondan “Sí” o “No” en caso de que el desecho requiera incineración o reciclaje. Materiales de desecho ¿Orgánico? ¿Inorgánico? Incineración Reciclaje 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 3. Incorporen esta actividad a su portafolio de evidencias. Desarrollo de secuencia Entremos en materia Introducción a la química orgánica La química orgánica se constituyó como disciplina en la década de 1930, cuando el término “orgánico” suponía que los compuestos procedían de organismos vivos. En la actualidad, los químicos consideran como compuestos orgánicos a aquellos que contienen carbono principalmente, además de hidrógeno y otros elementos. Por ello la química orgánica tiende a denominarse química del carbono. La química orgánica, o química del carbono, es muy importante para la tecnología (combustibles, colorantes, papel, tinta), en las ciencias biológicas, la medicina, la genética, etc. debido a que la cantidad de estos compuestos es mucho mayor que la de los inorgánicos. [ 102 ] Unidad 3 | Secuencia 5 Química orgánica alifática Se conocen moléculas orgánicas que contienen miles de átomos de carbono cuyo arreglo espacial es muy diverso y complejo, pero ¿a qué se debe que este elemento sea el que divide la ciencia química en las ramas orgánica e inorgánica?, ¿qué tiene de especial? De todos los elementos químicos clasificados en la Tabla Periódica de Mendeleiev, el carbono tiene la posibilidad de conformar enlaces entre sus mismos átomos con una estructura tetraédrica permitiendo así la formación de grandes cadenas, estructuras o anillos de diversos tamaños, lo que para cualquier otro elemento sería imposible. ¿Qué es el carbono? El carbono es un elemento sólido y no metálico. Se encuentra formando los compuestos orgánicos y forma parte de algunos compuestos inorgánicos (anhídridos, ácidos carbonosos, ácidos carbónicos y sus respectivas sales). En estado puro se presenta como diamante o grafito, tiene un número atómico de 6 y una masa atómica de 12. En su núcleo tiene 6 neutrones, 6 protones y 6 electrones distribuidos (configuración electrónica) de la siguiente manera: 2 electrones en su primer nivel s y 4 electrones en el segundo nivel (2 electrones en el 2s y 2 electrones en el 2p). Su configuración electrónica en su estado natural o estado basal es: 1s2 2s2 2p2 Protones Neutrones C 1s 2s 2px 2py 2pz Electrones Estructura del carbono, según Bohr. Un átomo de carbono, al momento de formar combinaciones, promueve un electrón desde su orbital atómico 2s hasta el orbital 2p vacío, lo que le permite generar un máximo de 4 enlaces covalentes compartiendo electrones con otros átomos. Casi nunca es bivalente, y normalmente es tetravalente debido a que en sus combinaciones los dos electrones de 2s y el tercer orbital p vacío intervienen en la formación de los enlaces: 1s2 2s1 2px1 2py1 2pz1 Su estructura tetraédrica se debe a los cuatro electrones desapareados, y se explica por medio de la teoría de la hibridación. Si se mezcla el orbital 2s con los tres orbitales 2p, se tendrán cuatro orbitales híbridos, 2sp3, que tienen exactamente la misma energía y por tanto esos cuatro electrones son muy reactivos en igualdad de grado. H 109.28° C H H H Tetravalencia del carbono. [ 103 ] Química 2 Hibridación del carbono Es la variación de la energía en el átomo para pasar un electrón del orbital s al orbital p. Cuando en un átomo se mezclan los electrones entre orbitales, se crea una nueva configuración electrónica adquiriendo también nuevas propiedades. Así, el tipo de enlace que forma el carbono con cuatro hidrógenos es el enlace covalente híbrido sp3, y es más estable que el original s o p. En una analogía, podemos decir que una mula es un híbrido de raza, ya que proviene de la cruza entre un asno y una yegua; las características nuevas de la mula son que no puede reproducirse, no reacciona y es estable. Algo similar sucede en los átomos. Enlaces carbono-carbono Cuando los carbonos empiezan a reaccionar entre sí, se van habilitando nuevas configuraciones y por tanto nuevas hibridaciones, como sp3 (con cuatro enlaces sencillos llamados sigma σ, y pueden ser C-H, C-C), sp2 (con dos enlaces sencillos y un enlace doble que es una combinación de un enlace sigma con un enlace llamado pi, π), y sp (con un enlace triple y uno sencillo, el enlace triple está conformado por dos enlaces pi y uno sigma). Tipos de enlaces. Los enlaces sencillos se encuentran en hidrocarburos saturados y sus principales características son: •• Son muy fuertes. •• Se llevan a cabo entre CC, CH y CX (halógenos). •• Existe libre rotación entre CC. Los enlaces dobles se encuentran en hidrocarburos insaturados y sus principales características son: •• Son débiles, altamente reactivos. •• Se forman entre orbitales puros. •• Tienen rotación limitada. Los enlaces triples se encuentran en hidrocarburos insaturados y sus principales características son: •• Son más débiles que los dobles, altamente reactivos. •• Se forman entre orbitales puros. [ 104 ] Unidad 3 | Secuencia 5 Química orgánica alifática Propiedades de los compuestos orgánicos Además de los enlaces sencillos, dobles y triples, existen enlaces iónicos y covalentes que les brindan a los compuestos distintas propiedades. En el siguiente cuadro comparativo se pueden observar las diferentes propiedades de las sustancias orgánicas e inorgánicas. Propiedades Sustancias orgánicas (compuestos covalentes) Sustancias inorgánicas (compuestos iónicos) Tipo de enlace Predomina el enlace covalente (comparten electrones) Predomina el enlace iónico (ceden o adquieren electrones) Solubilidad Son solubles en disolventes no polares (disolventes orgánicos) Por lo general son solubles en agua Conductividad eléctrica No conducen la electricidad en disolución Conducen la corriente eléctrica en disolución Puntos de fusión y ebullición Presentan bajos puntos de fusión y ebullición Presentan altos puntos de fusión y ebullición Estabilidad Son muy inestables; tienden a descomponerse Son muy estables Velocidad de reacción Generalmente sus reacciones son lentas Sus reacciones son casi instantáneas Estructuras Estructuras complejas de elevado peso molecular (generan redes moleculares) No forman estructuras complejas y sus pesos moleculares son bajos (generan redes cristalinas formadas por los iones) Isomería Es un fenómeno muy común Es un fenómeno raro, pero sí ocurre Tipos de cadena De acuerdo con la tetravalencia del átomo de carbono (forma cuatro enlaces), a los compuestos orgánicos podemos representarlos mediante los tres tipos de fórmulas que se muestran enseguida. Fórmula condensada o molecular Fórmula desarrollada o gráfica Semidesarrollada o de estructura H CH4 H C H C2H6 H H H H C C H H C C H C2H4 C2H2 H CH3 CH3 CH2 CH2 CH CH H H H CH4 H C C H [ 105 ] Química 2 Clasificación de las estructuras Lineales Saturados Arborescentes Acíclicos (cadena abierta) Lineales No saturados Arborescentes Simples Saturados Arborescentes Alicíclicos Estructuras de compuestos orgánicos Simples Homocíclicos (átomos de C e H) No saturados Arborescentes Aromáticos Cíclicos (cadena cerrada) Simples Saturados Heterocíclicos (otros átomos: O, S, N, P) Arborescentes Simples No saturados Arborescentes Lineales no saturados Lineales saturados N c c c c c Cíclico saturado Cíclico no saturado Homocíclicos [ 106 ] Arborescentes S Heterocíclicos Aromáticos cíclicos Benceno Unidad 3 | Secuencia 5 Química orgánica alifática ACTIVIDAD GRUPAL Para reforzar e integrar el conocimiento del tema, y reconociendo que cada vértice corresponde a un átomo de carbono con sus respectivos hidrógenos, escriban la clasificación de las siguientes estructuras y su fórmula condensada. Escribe los números correspondientes Competencias genéricas Competencias disciplinares 1. 2. 3. 4. S 5. 6. H N Incorporen esta actividad a su portafolio de evidencias. [ 107 ] QUÍMICA 2 Clasificación de hidrocarburos Los compuestos orgánicos que se obtienen del petróleo son llamados comúnmente hidrocarburos. Su nombre proviene de que están formados por carbono e hidrógeno, se extraen del subsuelo mediante la perforación de pozos y son producto de la descomposición de plantas y animales fósiles. El petróleo (llamado también oro negro) contiene una gran variedad de compuestos conocidos como derivados; estos son separados entre sí mediante el proceso de destilación fraccionada. Una vez obtenidos los diferentes componentes, pasan al proceso de transformación para uso directo del consumidor. En la siguiente figura se muestra el proceso completo de obtención del petróleo y sus derivados. Destilación Fraccionada del Petróleo 20 C 150 C Fracción TRANSFORMACIÓN 200 C Gas licuado 300 C Combustibles Calefacción doméstica 370 C Pozo de petróleo Extracción Conducción Oleoducto 400 C # de C Hasta 40 1-5 40-180 6-10 180-230 11-12 130-305 13-17 305-405 18-25 405-515 26-38 Aplicación Gas Gasolina Queroseno Motores diesel y Hornos a petróleo Aceites ligeros Lubricantes de motores Aceites pesados Cremas Vaselina Pavimento T C Sobre 515 39 Alquitranes y asfaltos Yacimiento de petróleo Extracción, transformación, distribución y consumo del petróleo. A los hidrocarburos se les clasifica en dos grupos: alifáticos y aromáticos, que a su vez se clasifican en varios subgrupos, como se observa en el siguiente cuadro sinóptico y se detalla enseguida. HIDROCARBUROS Alifáticos (grasoso) Alcanos Alquenos Alquinos Alifáticos cíclicos [ 108 ] Aromáticos (olorosos) Benceno Alcoholes Aldehídos y cetonas Ácidos carboxílicos Éteres y ésteres Aminas y amidas Unidad 3 | Secuencia 5 Química orgánica alifática Hidrocarburos alifáticos. Se caracterizan por tener una cadena abierta de átomos de carbono; es decir, los átomos de carbono están unidos a un único átomo de carbono, formando así una línea de átomos que no se cierra. Se clasifican en alcanos, alquenos y alquinos, dependiendo del tipo de enlaces que tengan (sencillos, dobles o triples, respectivamente). También puede haber casos en los que un hidrocarburo alifático posea una cadena cerrada de átomos de carbono, formando con ellos una figura, como un triángulo, un cuadrado, un pentágono, etc., en cuyo caso se conocen como hidrocarburos alifáticos cíclicos o más comúnmente como hidrocarburos alicíclicos. Hidrocarburos aromáticos. Se caracterizan por poseer una cadena cerrada de, por lo general, seis átomos de carbono, que forma una figura hexagonal en la que hay tres enlaces dobles y tres simples. Por tanto, para que un hidrocarburo sea aromático debe estar presente un hexágono como el que se describió. Estos dos grupos se explicarán a detalle más adelante. Tipos de reacciones comunes en compuestos orgánicos Existen reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos más comunes son: adición, eliminación, sustitución, oxidación, reducción y combustión. Adición. Requieren un centro de insaturación para generar enlaces sencillos. H3C H3C CH3 CH3 H2 C C H3C H C C H H3C CH3 CH3 Eliminación. En sentido contrario a las reacciones de adición, se forman enlaces múltiples. H H H H H C C H C C H H H H2 H Sustitución. Cuando un átomo o grupo de átomos es desplazado por otro. H H H Br H C C H Br2 H C C H H2 H H Br H Oxidación. Aumento en la cantidad de oxígeno por combustión o la acción de un agente oxidante. CH3 CH CH CH3 H H C C H3C CH3 2-buteno KMnO4 KMnO4 CH3 CHOH CHOH CH3 OH OH H3C C C CH3 H H 2,3-butanodiol [ 109 ] Química 2 Reducción. Adición de hidrógenos o disminución de oxígeno (inverso a la oxidación). OH H SO conc. 2 4 (adición de hidrógenos) H2/Pd (disminución de oxígeno) Combustión. Los compuestos se queman en presencia de oxígeno, liberándose una gran cantidad de energía. CH2 CH2 3O2 2CO2 2H2O energía Otros tipos de reacciones son: saponificación, condensación, esterificación, halogenación, etcétera. Tipos de carbonos Quizá de niño jugaste al “chicote”, en el que los participantes se toman de las manos y corren en fila sin soltarse entre sí. Supongamos que los niños de la siguiente imagen se disponen a jugarlo. Si analizamos la fuerza de unión entre los niños, nos daremos cuenta de que en el caso 1, difícilmente se separarán las dos niñas; la unión es más fuerte porque las fuerzas están equilibradas, es decir, es más probable que se suelte una niña de un niño. Observa los casos 2 y 3 e imagina en qué punto es más probable que se rompa la unión. Caso 1 Caso 2 Caso 3 Tipos de niños = tipo de carbonos. Así como sucede con los niños en el juego del chicote, pasa lo mismo con las moléculas orgánicas, en que los rompimientos de enlace se efectúan donde la unión es más débil. Las fuerzas de enlace las determinarán los carbonos, dependiendo de su ubicación en la cadena. Por tal motivo, los carbonos se clasifican en primario, secundario, terciario y cuaternario. Carbono primario. Es aquel que está unido a un solo carbono; los tres hidrógenos de un carbono primario también serán primarios. Primario H3C CH3 Primario Carbono secundario. Son aquellos que tienen dos carbonos unidos a él; sus dos hidrógenos serán secundarios. [ 110 ] Unidad 3 | Secuencia 5 Química orgánica alifática Primario H3C CH2 CH3 Primario Secundario Carbono terciario. Se encuentra unido a tres átomos de carbono; su único hidrógeno es terciario también. CH3 H3C CH2 C CH3 Terciario H Carbono cuaternario. Están unidos a cuatro átomos de carbono y no tiene hidrógenos. CH3 H3C CH2 C CH3 Cuaternario CH3 ACTIVIDAD GRUPAL 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 8 de la página 192. 2. Incorporen esta actividad a su portafolio de evidencias. Hidrocarburos alifáticos Los hidrocarburos alifáticos tienen características aceitosas: pueden ser de cadena abierta o cerrada, saturados e insaturados, cíclicos y no cíclicos; y pueden disolver sustancias aceitosas, grasas, resinas y otras. Son muy útiles en la industria para la obtención de sustancias como pinturas y pegamentos; en la síntesis en química orgánica, donde a menudo son utilizados como materia prima, y en el hogar como combustibles. Alcanos También llamados parafinas, son hidrocarburos saturados, de cadena abierta, constituidos por carbono e hidrógeno; sus enlaces son covalentes sencillos C C; presentan hibridación sp3, y son insolubles en agua y solubles en disolventes orgánicos como benceno, éter, cloroformo, etcétera. Fórmula general: CnH2n+2, donde n es el número de carbonos. Nomenclatura básica: sus nombres llevan prefijos (como nombre matriz) con terminación ano. La siguiente tabla nos muestra varios ejemplos de alcanos, así como el número de carbonos (#C) e hidrógenos (#H) que tienen, su estructura desarrollada y su estructura simplificada. Alcanos Metano #C #H Fórmula CnH2n+2 1 4 CH4 Estructura desarrollada Estructura simplificada H H C H CH4 H (Continúa) [ 111 ] Química 2 (Continuación) Alcanos Etano #C #H Fórmula CnH2n+2 2 6 Estructura desarrollada C2H6 H H Propano 3 8 C3H8 H 4 10 C4H10 H Pentano 5 12 C5H12 H Hexano 6 14 C6H14 H Heptano 7 16 C7H16 H Octano 8 18 C8H18 H Nonano 9 20 C9H20 H Decano 10 22 C10H22 H H C H H C H H H C H H H C H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H CH2 CH3 H H H CH2 CH2 CH3 C H H H C H H H H C H (CH2)3 CH3 CH3 (CH2)4 CH3 CH3 (CH2)5 CH3 CH3 (CH2)6 CH3 CH3 (CH2)7 CH3 CH3 (CH2)8 CH3 H C H CH3 H H C H H H H H C H CH3 H C C H H C H CH3 C C H CH3 H C C H H C C H H C C H H CH3 H C C H H C C H H C C H H C C C H H C H C C C H C C C C H H C H H C H H C H H C H Butano H Estructura simplificada C C H H H H H H C C C C C C C C C C H H H H H H H H H H Eicosano 20 42 CH3 (CH2)18 CH3 Tricontano 30 62 CH3 (CH2)28 CH3 Tetracontano 40 82 CH3 (CH2)38 CH3 Pentacontano 50 102 CH3 (CH2)48 CH3 H Grupos alquilo Si a un alcano se le suprime un átomo de hidrógeno resulta un radical alquilo, quedándose el carbono con el enlace, mismo que se utilizará para enlazarse a la cadena principal de la molécula. Un grupo alquilo resulta del rompimiento homolítico de un enlace carbono-hidrógeno, generándose el grupo alquilo correspondiente, por tener un electrón sin compartir se vuelve muy reactivo y forma parte de las ramificaciones del hidrocarburo. Los nombres de los radicales alquilo se forman cambiando la terminación ano por la terminación il o ilo. [ 112 ] Unidad 3 | Secuencia 5 Química orgánica alifática H H C H H Rompimiento homolítico del enlace. La siguiente tabla nos muestra varios ejemplos de alcanos, así como su estructura y su grupo alquilo. Alcanos Estructura Metano CH4 Etano Propano Butano Grupo alquilo CH3 CH3 CH3 CH2 CH3 CH2 CH3 CH3 CH3 CH2 CH3 Metil o metilo CH2 Etil o etilo CH3 CH2 CH2 Propil o propilo CH3 CH2 CH2 CH2 Butil …. Pentano CH3 (CH2)3 CH3 CH3 (CH2)3 CH2 Pentil …. Hexano CH3 (CH2)4 CH3 CH3 (CH2)4 CH2 Hexil …. Heptano CH3 (CH2)5 CH3 CH3 (CH2)5 CH2 Heptil…. Octano CH3 (CH2)6 CH3 CH3 (CH2)6 CH2 Octil…. Nonano CH3 (CH2)7 CH3 CH3 (CH2)7 CH2 Nonil…. Decano CH3 (CH2)8 CH3 CH3 (CH2)8 CH2 Decil…. Isomería. Son isómeros aquellos compuestos que tienen el mismo número de átomos de la misma especie, pero con diferente acomodo en el espacio, es decir, diferente estructura. Son compuestos diferentes y sus propiedades son también diferentes. CH3 CH3 CH CH3 CH3 CH2 CH2 CH3 Isobutano n-butano Para nombrar los diferentes isómeros se utilizan cuatro tipos de isomería: n, iso, sec y ter t. n. Cuando todos los carbonos forman una cadena recta lineal. CH3 CH2 CH2 CH2 CH2 CH3 n-hexano [ 113 ] Química 2 La nomenclatura de la IUPAC admite los nombres tradicionales de algunos radicales substituidos, utilizando los prefijos iso, sec y ter lo que facilita la nomenclatura en estos casos. Estos prefijos son válidos solamente cuando son cadenas conformadas por carbono e hidrógeno (alcanos y radicales derivados), pero si llegan a tener otro tipo de sustituyente (OH, halógenos, etc) deberán nombrarse de forma sistemática como se verá más adelante. iso. Cuando hay un grupo metilo (CH32) unido al penúltimo átomo de una cadena continua hidrocarbonada. Se escribe en letras redondas y sin espacio entre el nombre del prefijo y el alcano. H3C CH2 CH CH3 CH3 Isopentano sec. Este prefijo indica la presencia de un grupo metilo en la posición 1 del radical unido a la cadena principal. Debe escribirse en letra cursiva. 1 2 4 6 5 3 H3C CH 10 8 7 12 11 9 CH2 CH2 CH3 5-sec-pentildodecano tert. Este prefijo indica la presencia de dos grupos en la posición 1 del radical unido a la cadena principal. Debe escribirse en letra cursiva. 1 2 4 3 5 H3C C CH3 6 8 7 9 CH3 3-tert-butilnonano Nomenclatura IUPAC para alcanos El sistema de nomenclatura IUPAC (International Union of Pure Applied Chemistry) diseña un conjunto de normas que sigue de una forma sistemática las mismas reglas para todas las familias de compuestos orgánicos, facilitando su aplicación y entendimiento, salvo algunas variantes específicas. Regla 1. Se selecciona la cadena continua más larga de átomos de carbono. La estructura matriz llevará el nombre que le corresponda de acuerdo con el número de carbonos con terminación ano. [ 114 ] Unidad 3 | Secuencia 5 Ejemplo: H CH3 H H C C H Química orgánica alifática CH3 C C CH3 H CH2 CH3 CH3 Pentano Regla 2. Identificar los grupos alquilo unidos, (que son las ramificaciones) en la cadena principal y, por medio de números, indicar su posición. Enumerar la cadena por el extremo donde resulten los números más bajos. Ejemplo: H CH3 H 5 4 3 H C C H CH3 2 1 C C CH3 H CH2 CH3 CH3 Pentano Regla 3. Al nombrar los grupos alquilo, hacerlo por orden de tamaño creciente. Si un mismo grupo aparece más de una vez, se usan los prefijos di 2; tri 3; tetra 4, etcétera. Ejemplo: H CH3 H CH3 H C C H H C C CH3 CH2 CH3 CH3 2,2,4-trimetil–3-etilpentano Otros ejemplos: CH3 CH CH3 CH3 CH3 CH2 CH2 CH CH2 CH CH3 CH3 2-metilpropano CH3 CH2 CH3 2-metil-4-etilheptano CH3 CH2 CH CH CH2 CH3 CH2 CH3 3-metil-4-etilhexano Escribe los números correspondientes ACTIVIDAD GRUPAL Para reforzar e integrar el conocimiento del tema, en parejas determinen el nombre correcto de las siguientes estructuras siguiendo el orden que se propone. 1. Identificar la cadena continua más larga de carbonos. Competencias genéricas Competencias disciplinares 2. Encerrar en un círculo los grupos alquilo que observen. 3. Jerarquizar por orden de tamaño creciente: metil, etil, propil, etcétera. (Continúa) [ 115 ] Química 2 (Continuación) 4. Observar por cuál extremo se localiza la mayor parte de las ramificaciones. 5. Enumerar los carbonos de la cadena del punto 1. Estructura CH3 CH2 CH3 CH CH3 CH2 Nombre CH2 CH CH3 CH3 CH2 CH2 CH3 CH CH2 CH3 CH3 CH2 CH2 CH2 CH CH2 CH3 CH CH3 CH3 CH3 CH2 CH3 CH CH2 CH CH2 CH2 CH2 CH3 CH2 CH2 CH CH3 CH2 CH CH CH2 CH2 CH2 CH2 CH2 CH CH3 CH2 CH2 CH3 CH3 CH3 CH3 CH2 CH2 CH3 2,3,5-trimetilheptano 3,4-dimetil-5-propiloctano 6. Incorporen esta actividad a su portafolio de evidencias. A continuación se resumen algunas propiedades de los alcanos en la siguiente tabla. Propiedades físicas de alcanos Son no polares e hidrofóbicos. Se disuelven en disolventes orgánicos no polares o débilmente polares; son buenos lubricantes y preservativos para metales (evitan la corrosión y oxidación de metales.) Los n alcanos tienen cadena recta, sin ramificaciones. Son menos densos que el agua 5 0.7 g/c.c. Solubilidad Densidad [ 116 ] Unidad 3 | Secuencia 5 Química orgánica alifática Propiedades físicas de alcanos Puntos de ebullición Los puntos de ebullición aumentan a medida que aumenta el número de carbonos en la cadena. Puntos de fusión Los puntos de fusión también aumentan a medida que aumenta el número de carbonos en la cadena. Puntos de fusión y Puntos de ebullición 300 250 200 150 100 °C 50 0 250 2100 2150 2200 2250 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Núm. de carbonos Reacciones químicas de obtención. Los alcanos se obtienen directamente por destilación fraccionada del petróleo, y también pueden sintetizarse a partir de otros compuestos, que igualmente se obtienen del petróleo. La siguiente tabla muestra los mecanismos más significativos en este tipo de hidrocarburos. Métodos de obtención Tipo de reacción de alcanos 1. Hidrogenación de alquenos y alquinos Los hidrocarburos, al presentar insaturaciones que son enlaces muy débiles, tienden a reaccionar fácilmente con el hidrógeno. Adición H H C C H Fundamento H2, Pt, Pd o Ni CH3 CH3 H Se rompe el enlace doble carbono-carbono y se generan dos nuevos enlaces sencillos carbono-hidrógeno. H C C H Alquino H2, Pt, Pd o Ni H H C C H H H2, Pt, Pd o Ni H3C CH3 Alcano Alqueno Se rompen primero el enlace triple, luego el enlace doble carbono-carbono, y se generan dos nuevos enlaces sencillos carbono-hidrógeno en cada una de las etapas. (Continúa) [ 117 ] Química 2 (Continuación) Métodos de obtención Tipo de reacción de alcanos 2. Reducción de halogenuro de alquilo (deshidrohalogenación con reactivo de Grignard) Mg Halogenuro de alquilo Fundamento El halogenuro de alquilo es un alcano que tiene cualquier halógeno (F, Cl, Br, I) en lugar de un hidrógeno. Al someterlo con magnesio se forma el reactivo de Grignard; a su vez éste, al estar en contacto con el agua, se reduce formando el alcano correspondiente. Adición y reducción H2O reactivo de Grignard (organometálico) halogenuro de alquil magnesio H3C CH2 CH CH3 Alcano Mg H3C CH2 CH CH3 H3C CH2 CH CH3 Cl H2O H3C CH2 CH CH3 MgCl Cloruro de sec-bultilo H H Butano Cloruro de sec-bultimagnesio La pirólisis o cracking es un mecanismo por el cual a los alcanos se les hace pasar por temperaturas muy elevadas. Los de grandes cadenas o muy pesados se convierten, algunos, en alcanos ligeros, y otros en alquenos con ciertos residuos de hidrógeno. Reacciones características de los alcanos Tipo de reacción Oxidación 1. Combustión Fundamento Los hidrocarburos, al entrar en contacto con el oxígeno, forman bióxido de carbono (anhídrido), y con el resto de los constituyentes (hidrógenos) con exceso de oxígeno generan agua. nCO2 nH2O Alcano 1 nO2 CH3 CH2 CH2 CH2 CH3 8O2 Sustitución 2. Halogenación H3C CH2 CH3 X2 5CO2 6H2O Los alcanos tienden a reaccionar con cualquier halógeno (F, Cl, Br, I) con lo cual se efectúa la sustitución de hidrógenos. El resultado consiste en la obtención de un alquilo con halógeno llamado halogenuro de alquilo, más el ácido respectivo. 200C 400C Luz u.v. H3C CH CH3 H X X halogenuro de isopropilo reactividad: X2 Cl2 Br2 H3C CH2 CH3 Br2 H2 3 2 1 200C 400C Luz u.v. H3C CH CH3 HBr Br Bromuro de isopropilo [ 118 ] halogenuro de hidrógeno Bromuro de hidrógeno Unidad 3 | Secuencia 5 Química orgánica alifática Usos y aplicaciones. En el hogar, los hidrocarburos de bajo peso molecular se utilizan como gas butano en estufas, bóileres y, en general, en aparatos de calefacción. Algunos se utilizan como materia prima en la elaboración de velas (parafina); en la industria se emplean para la síntesis de otros productos. Hidrocarburos en el hogar. Alquenos También llamados olefinas, son hidrocarburos insaturados, de cadena abierta, constituidos por carbono e hidrógeno. Sus enlaces son dobles (vinílicos) C = C, presentan hibridación sp2, son insolubles en agua y solubles en disolventes orgánicos como benceno, éter, cloroformo, etcétera. Fórmula general: CnH2n, donde n es el número de carbonos. Nomenclatura básica: como la característica principal es el doble enlace carbono-carbono, el miembro más simple es el eteno, a partir del alqueno de cinco átomos de carbono, el nombre se forma con un prefijo que indique el número de átomos de carbono que constituye la cadena y la terminación eno. Algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación -eno por -ileno, como es el caso del eteno, que en ocasiones se llama etileno, o el propeno por propileno. La siguiente tabla nos muestra varios ejemplos de alquenos, así como el número de carbonos (#C) e hidrógenos (#H) que tienen su estructura desarrollada y su estructura simplificada. Alquenos #C #H Fórmula CnH2n Eteno (etileno) Propeno (propileno) Estructura desarrollada H 2 4 C2H4 H CC H 6 C3H6 H CH2 CH2 H H H 3 Estructura simplificada CC C H H H CH2 CH CH3 (Continúa) [ 119 ] Química 2 (Continuación) Alquenos #C #H Fórmula CnH2n 2-buteno (butileno) 4 H H H C CC C H H H H CC C C C H H H H H H 5 1-hexeno (hexileno) 6 10 C5H10 H H 12 C6H12 CC H 1-hepteno (heptileno) 7 14 C7H14 CC H 8 16 C8H16 H CC H 1-noneno (nonileno) H H 9 18 C9H18 H CC 10 20 C10H20 H CH3 H H H H H C C C C C H CH3 CH2 CH CH2 CH2 CH3 H C H H C C C H C C C C C H C CH2 CH (CH2)3 CH3 CH2 CH (CH2)4 CH3 CH2 CH (CH2)5 CH3 CH2 CH (CH2)6 CH3 CH2 CH (CH2)7 CH3 H H H H H H H H H H H H C H H C H H C H C H H C H C H H H H H H CC C C C C C C C C H H H H H H H H H H CH CH H H H H H H H H H H H C H H Estructura simplificada H H H H H H H H H H H H 1-octeno (octileno) Dienos C4H8 H H 1-penteno (pentileno) 1-deceno (decileno) 8 Estructura desarrollada H Son los alquenos que presentan 2 dobles ligaduras y sus nombres llevarán terminación dieno. Ejemplo: 2,3–butadieno H2C CH HC CH2 Nomeclatura IUPAC para alquenos Regla 1. Se selecciona la cadena continua más larga de carbonos que contenga el enlace doble; la cual llevará el nombre que le corresponda según el número de carbonos con terminación eno. Se enumera la cadena por el extremo donde la ubicación del enlace doble resulte con el número más bajo e indicar la ubicación del enlace doble. Ejemplo: H CH3 C C CH2 CH3 CH2 CH CH2 CH2 CH2 CH3 H 1-hepteno Regla 2. Identificar los grupos alquilo unidos a la cadena principal, y por medio de números indicar su posición. CH2 CH3 CH3 H C H 1 C CH2 CH CH2 2 3 4 CH2 CH2 CH3 5 1-hepteno [ 120 ] 6 7 Unidad 3 | Secuencia 5 Química orgánica alifática Regla 3. Al nombrar los grupos alquilo, hacerlo por orden de tamaño creciente. Si un mismo grupo aparece más de una vez se usan los prefijos di 2; tri =3; tetra 4, etcétera. CH3 H C CH2 CH3 C CH2 CH CH2 CH2 CH2 CH3 H 2-metil-4-n-propil-1-hepteno Otros ejemplos: CH3 CH3 HC CH H3C CH CH CH3 5-Etil-3,6-dimetil-3-hepteno CH2 CH3 H2C C H3C CH CH CH3 CH CH3 CH3 2,5-dimetil-3-hexeno C CH2 CH3 CH CH3 H CH2 CH CH2 CH2 CH CH2 CH3 CH2 CH3 3-etil-1,5-hexadieno 2-metil-2-penteno Escribe los números correspondientes ACTIVIDAD INDIVIDUAL 1. Para reforzar e integrar el conocimiento del tema, y siguiendo la metodología IUPAC, de forma individual determina el nombre correcto de las siguientes estructuras, o escribe las estructuras de los alquenos que se te presentan. Estructura CH3 C CH CH3 CH2 CH2 Competencias genéricas Competencias disciplinares Nombre CH3 CH2 CH3 CH CH2 CH3 H2C C CH CH2 CH3 CH CH3 CH C CH3 CH2 CH3 CH2 (Continúa) [ 121 ] Química 2 (Continuación) Estructura Nombre CH3 CH3 CH CH2 HC CH CH CH2 H2C CH C CH2 CH3 CH3 CH2 H 4-etil-2-metil-2,5-octadieno 2-metil-2-butileno 3,4-dimetil-1-penteno 5-metil-3-heptileno 7-etil-5-tert-butil-3-isopropil-2-noneno 2. Incorpora esta actividad a tu portafolio de evidencias. A continuación, en la siguiente tabla se resumen algunas propiedades de los alquenos. Propiedades físicas de alquenos Solubilidad Densidad Puntos de fusión y ebullición Estabilidad [ 122 ] Son hidrofóbicos e insolubles en agua. Se disuelven en disolventes orgánicos, como el benceno, éter, cloroformo, gasolina y éteres. Son menos densos que el agua (entre 0.6 y 0.7 g/mL). Aumentan al incrementarse el número de carbonos en la cadena. Su doble ligadura se rompe fácilmente, por lo que presentan reacciones de adición, sustitución y degradación. Unidad 3 | Secuencia 5 Química orgánica alifática Reacciones químicas de obtención Reacciones químicas de obtención. Los alquenos se obtienen directamente por destilación fraccionada del petróleo, también pueden sintetizarse a partir de otros compuestos, que igualmente se obtienen del petróleo, la tabla muestra los mecanismos más significativos en este tipo de hidrocarburos. Métodos de obtención de alquenos Tipo de reacción Eliminación, sustitución 1. Deshidrohalogenación de halogenuros de alquilo C C KOH H Alcohol C C KX H2O X Reactividad de desidrohalogenación de halogenuros de alquilo 3 2 1 Eliminación 2. Deshidratación de alcoholes C C H OH Ácido C C H2O calor o el triángulo que equivale a calor Facilidad de deshidratación de alcoholes 3 2 1 Reducción (adición de hidrógenos) 3. Reducción de alquinos H H2 H cis C C Pd o Ni-B(P-2) R C C R Na o Li, R R H R C C NH3 R trans H Reacciones características de alquenos Adición de hidrógeno 1. Hidrogenación catalítica C C H2 Tipo de reacción Pt, Pd o Ni C C H H (Continúa) [ 123 ] QUÍMICA 2 (Continuación) Reacciones características de alquenos Tipo de reacción Pt, Pd o Ni CH3 CH CH2 H2 cat. CH3 CH2 CH3 Propileno Propano Adición de hidrógeno y halógeno 2. Halogenación C C C C X2 X X X2 Cl2 , Br2 Cl CH3 CH CH2 Cl2 en CCl4 Propileno CH3 CH CH2 Cl 2,3-dicloropropano (dicloruro de propileno) 3. Adición de halogenuro de hidrógeno C C HX C C H H2 O2 CH3 CH CH2 X HX HCl, HBr, Hl Cl CH3 CH CH3 Markovnikov 2-cloropropano HCl sin H2O2 CH3 CH2 CH2 Cl anti Markovnikov 1-cloropropano (cloruro de isopropilo) Usos y aplicaciones. Por la reactividad del enlace doble, los alquenos son importantes intermediarios en la síntesis de una gran variedad de compuestos. El de mayor uso industrial es el etileno, que se utiliza para obtener el plástico (polietileno), de gran uso en la fabricación de drenajes, envases, bolsas y aislantes eléctricos. Como materia prima se utiliza para obtener alcohol etílico, etilen-glicol, cloruro de vinilo y estireno. Polietileno como materia prima. [ 124 ] Unidad 3 | Secuencia 5 Química orgánica alifática Escribe los números correspondientes ACTIVIDAD INDIVIDUAL Competencias genéricas 1. Para reforzar e integrar el conocimiento del tema, observa, determina y escribe qué partes de los artículos que se muestran enseguida se fabricaron o contienen polipropileno. Competencias disciplinares 2. Incorpora esta actividad a tu portafolio de evidencias. Alquinos Los hidrocarburos cuyas moléculas tienen un enlace triple carbono-carbono (C C) se denominan alquinos; por esta insaturación contienen menos hidrógenos que los alquenos y aún menos que los alcanos. Se cree que el miembro más sencillo es el etino o acetileno. Presentan hibridación sp, son insolubles en agua y solubles en disolventes orgánicos. Fórmula general: CnH2n2, lo cual significa que los alquinos son isómeros de los dienos. omenclatura básica: a los alquinos se les nombra de acuerdo con los siguientes dos sisN temas: a) Como derivados del acetileno (para alquinos sencillos). b) Por los nombres IUPAC (para alquinos más complejos). Como la característica principal es el enlace triple carbono-carbono, el miembro más simple es el etino o acetileno. Sus nombres IUPAC llevan el nombre matriz con terminación ino, y las reglas para nombrarlos son enteramente las que se han utilizado para alcanos y alquenos, salvo la diferencia de la terminación. [ 125 ] Química 2 La siguiente tabla nos muestra varios ejemplos de alquinos, así como el número de carbonos (#C) e hidrógenos (#H) que tienen, su estructura desarrollada y su estructura simplificada, y su nomeclatura en función del acetileno. Alquinos #C #H Fórmula CnH2n2 Estructura simplificada Nomenclatura acetileno Etino 2 2 C2H2 Propino 3 4 C3H4 1–butino 4 6 C4H6 1–pentino 5 8 C5H8 H C C (CH2)2 CH3 Propilacetileno 1–hexino 6 10 C6H10 H C C (CH2)3 CH3 Butilacetileno 1–heptino 7 12 C7H12 H C C (CH2)4 CH3 Pentilacetileno 1–octino 8 14 C8H14 H C C (CH2)5 CH3 Hexilacetileno 1–nonino 9 16 C9H16 H C C (CH2)6 CH3 Heptilacetileno 1–decino 10 18 C10H18 H C C (CH2)7 CH3 Octilacetileno H C H H C C C C H Acetileno CH3 Metilacetileno C CH2 Etilacetileno CH3 Nomenclatura IUPAC para alquinos Regla 1. Se selecciona la cadena continua más larga de carbonos que contenga el enlace triple; la estructura matriz llevará el nombre que le corresponda, según el número de carbonos, con terminación ino. Se enumera la cadena por el extremo donde la ubicación del triple enlace resulte con el número más bajo e indicar la posición que ocupa el triple enlace en la cadena. Ejemplo: CH3 CH3 CH3 C C 3 4 C CH2 CH CH3 5 6 H3C CH2 1 [ 126 ] 2 4-octino 7 8 Unidad 3 | Secuencia 5 Química orgánica alifática Regla 2. Identificar los grupos alquilo unidos a la cadena principal, y por medio de números indicar su posición. CH3 CH3 C C 3 4 CH3 C CH2 CH CH3 5 6 7 8 H3C CH2 1 2 4-octino Regla 3. Al nombrar los grupos alquilo, hacerlo por orden de tamaño creciente. Si un mismo grupo aparece más de una vez, se usan los prefijos di 5 2; tri 5 3; tetra 5 4, etcétera. CH3 CH3 C C CH3 C CH2 CH CH3 H3C CH2 3,3,7-trimetil - 4-octino Otros ejemplos: CH3 CH3 H CH3 C C CH3 C C C CH3 C CH3 H3C CH2 CH3 4-metril-2-pentino 4-etil-4-metil-2-hexino Nomenclatura acetileno. Considerando el enlace triple carbono-carbono como la característica acetileno, se identifican los dos grupos alquilo unidos a ella nombrándolos por orden de tamaño creciente, seguidos de la palabra acetileno. Como base para este tipo de nomenclatura, utilizaremos los mismos ejemplos anteriores. H3C CH3 CH3 C C H3C H2C C CH2 CH CH3 Acetileno Isobutil-tert-pentilacetileno CH3 H H3C C C C CH3 CH3 Metil-sec-propilacetileno o Metil-isopropilacetileno CH2 H3C C C C CH3 H3C CH2 Metil-tert-hexilacetileno [ 127 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. De manera individual para reforzar e integrar el conocimiento del tema, y siguiendo la metodología IUPAC, determina el nombre correcto que se solicita de las siguientes estructuras, o escribe en tu libreta las estructuras de los alquinos que se te presentan. Competencias disciplinares Nomenclatura IUPAC Estructura Nomenclatura acetileno CH3 H3C C C C CH3 CH3 6-etil-4-metil-2-octino Etil-isopropilacetileno CH3 H3C C C CH3 CH3 C CH CH3 n-butilacetileno Dietilacetileno H3C C C CH2 CH3 2. Incorpora esta actividad a tu portafolio de evidencias. [ 128 ] Unidad 3 | Secuencia 5 Química orgánica alifática Propiedades físicas. Las propiedades de los acetilenos o alquinos son muy similares a las de los alcanos y alquenos: prácticamente son insolubles en agua y solubles en acetona, benceno, éter, cloroformo, y algunos alcoholes. Los más sencillos son gases a temperatura ambiente (27 C), son menos densos que el agua, y sus puntos de fusión y ebullición aumentan a medida que se incrementa el número de carbonos en la molécula. Reacciones químicas de obtención Métodos de obtención de alquinos Tipo de reacción Adición, eliminación 1. Deshidrohalogenación de dihalogenuros de alquilo H H C C H H X2 H H C X H H X KOH (alcali) H C NaNH2 C C X H C C H Acetileno H H Alqueno Eliminación 2. Deshalogenación de tetrahalogenuros H X X C C X H H C C 2ZnX2 H 2Zn Acetileno X Reacciones características de alquinos Tipo de reacción Adición de hidrógeno 1. Hidrogenación H C C H 2H2 6-etil- H H H C C H H Alquino H Alcano Adición de halógeno 2. Halogenación Cl H C C H Alquino Cl2 CCl4 H Cl2 C C H Cl Dicloroalqueno (dicloroetileno) CCl4 H Cl Cl C C H Cl Cl Tetracloroetano (Continúa) [ 129 ] QUÍMICA 2 (Continuación) Reacciones características de alquinos Tipo de reacción Adición de hidrógeno y halógeno 3. Hidrohalogenación Cl H C C H HCl Alquino H Cl HCl C C H H Cl Dicloroalqueno Adición de agua y halógeno; tautomería ceto - enol 4. Adición de agua H Alquino C C H Cloroalqueno H C C H H H2O H2SO4 Hg SO4 H H C C H H OH Alcohol vinílico C C H O H Aldehído Usos y aplicaciones Aplicación de hidrocarburos alifáticos en la comunidad. El metilacetileno y el acetileno son los hidrocarburos de su serie que tienen mayor importancia comercial. Se emplean como combustible en sopletes de soldadura y oxiacetilénicos. El acetileno es un gas incoloro de olor desagradable que se maneja y almacena con precaución en recipientes con tabiques refractarios humedecidos en acetona, ya que se disuelve fácilmente en ella. En la industria química, los alquinos en general son importantes productos en la síntesis del PVC; los polialquinos (polímeros generados a partir de los alquinos) son semiconductores orgánicos. Algunos se encuentran presentes en ciertos fármacos, es decir, los alquinos forman parte de nuestra vida diaria. [ 130 ] Unidad 3 | Secuencia 5 Química orgánica alifática Cierre de secuencia Conclusión del caso inicial Retomando el caso inicial y reconociendo que estamos inmersos en una época en la que se tiende a consumir a veces en forma desmedida, conducta que se manifiesta en todas las esferas poblacionales, es un compromiso social y común salvar nuestro planeta mediante acciones que generen niveles de vida saludables para todos los seres vivos, fomentando así ahorros económicos, médicos y biológicos sustentables. Por tal motivo, se hace necesario tomar medidas locales y pertinentes que favorezcan esta intención. Tomando como base los puntos que se presentan a continuación elabora una sugerencia personal al respecto: ¡Todos podemos contribuir! Te puedes ayudar con las siguientes preguntas. •• ¿Cómo podemos fomentar una conciencia ciudadana? •• ¿Qué podemos hacer para no quemar ni talar plantas? •• ¿Cómo podemos lograr que no se tire basura en lugares inapropiados? •• ¿Qué podemos hacer para regular el servicio de aseo urbano? •• ¿Cómo podemos controlar el uso de fertilizantes y pesticidas? •• ¿Cómo se pueden crear vías de desagüe para las industrias con el fin de que sus residuos no lleguen a los mares ni ríos sobre todo si son utilizados para el servicio o consumo tanto por el ser humano como por los animales? •• ¿Cómo es posible controlar los derramamientos accidentales de petróleo? Ejercicios de cierre C on el objetivo de reforzar los conocimientos del tema, lee detenidamente cada una de las cuestiones siguientes. I. Responde el siguiente cuestionario, indicando la respuesta correcta. 1. ¿Cuál es el hidrocarburo alifático más simple? a) Metano. b) Benceno. c) Dimetilacetileno. [ 131 ] Química 2 2. Compuesto complejo de características orgánicas en el que coexisten partes sólidas, líquidas y gaseosas. a) Alcohol. b) Gasolina. c) Petróleo. 3. Se clasifican en alcanos, alquenos y alquinos. a) Heterocíclicos. b) Hidrocarburos insaturados. c) Hidrocarburos alifáticos de cadena abierta. 4. Son moléculas orgánicas formadas solamente por hidrógeno y carbono. a) Alcanos. b) Alquenos. c) Hidrocarburos. 5. R ama de la ciencia que se encarga del estudio de los compuestos que contienen por lo menos un átomo de carbono. a) Química. b) Orgánica. c) Analítica. 6. Si una cadena alifática saturada se cierra formando un anillo o ciclo, se denomina. a) Amina. b) Benceno. c) Cicloalcano. 7. Es el hidrocarburo alifático insaturado más simple. a) Metano. b) Etileno. c) Acetileno. 8. ¿Cuáles de las siguientes reacciones son más comunes en los hidrocarburos alifáticos saturados? a) Halogenación y combustión. b) Deshidratación, halogenación y deshidrogenación. [ 132 ] c) Adición de halógenos, deshidrogenación, reducción. Unidad 3 | Secuencia 5 Química orgánica alifática 9. L a principal diferencia entre los hidrocarburos alifáticos y aromáticos es: a) Su solubilidad. b) Su peso molecular. c) Su tipo de enlace C C. 10. ¿Cuál de los siguientes compuestos es un acetileno? a) CH3 CH2 CH3. b) CH C CH3. c) CH3 CH CH CH3. II. Determina el nombre correcto de las siguientes estructuras. CH3 CH CH2 CH3 H3C CH CH2 CH3 H3C CH2 CH CH2 CH CH CH2 H3C C H CH3 CH3 a) b) CH3 CH CH CH2 H3C CH2 CH2 CH2 C C c) III. Escribe la estructura desarrollada de los siguientes hidrocarburos alifáticos. a) 3-etil-2,2,3-trimetilpentano. b) Dimetilacetileno. [ 133 ] Química 2 c) 3,3-dimetil-1-buteno. Evaluación de la secuencia didáctica En acuerdo con su profesor(a), seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia, evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas y aquellos que deben tener en cuenta para mejorar sus resultados. Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas [ 134 ] Evaluación de la estrategia Aspectos que consideré al desarrollar la estrategia Aspectos que debo considerar para mejorar los resultados de la estrategia secuencia seis Unidad 1 | Secuencia 1 Materia y energía Hidrocarburos aromáticos La química orgánica es la química de los compuestos de carbono. La bioquímica es el estudio de los compuestos de carbono que andan a cuatro patas. Mike Adams Propósito de la secuencia Reconoce e identifica los tipos de compuestos orgánicos, sus fuentes de obtención, estructuras, nomenclatura, y métodos de obtención, a la vez que desarrolla destrezas y habilidades en la adquisición del conocimiento de la química orgánica para generar una comprensión integral y su aplicación posterior en el desarrollo sustentable rumbo al avance científico y tecnológico que nuestro país requiere. Competencias genéricas 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo cómo cada uno de sus pasos contribuye al alcance de un objetivo. 5.2 Ordena información de acuerdo a categorías, jerarquías y relaciones. 5.3 Identifica los sistemas y reglas o principios medulares que subyacen en una serie de fenómenos. 7.2 Identifica las actividades que le resultan de menor a mayor interés y dificultad, reconociendo y controlando sus reacciones frente a retos y obstáculos. Competencias disciplinares 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. 4. Obtiene, registra y sistematiza la información para responder preguntas de carácter científico consultando fuentes relevantes y realizando experimentos pertinentes. 5. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas, y comunica sus conclusiones. 6. Valora las preconcepciones personales o comunes sobre diversos fenómenos naturales a partir de evidencias científicas. 7. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. [ 135 ] Química 2 Contenidos que aborda la secuencia 6 Conceptuales • Hidrocarburos aromáticos. Generalidades de los hidrocarburos aromáticos. Compuestos orgánicos de importancia biológica. || || Procedimentales • Realizará las actividades propuestas de manera individual o colaborativa para reafirmar el conocimiento adquirido en la formulación y nomenclatura de los hidrocarburos. • Responderá preguntas intercaladas mediante la reflexión. • Desarrollará consultas en fuentes bibliográficas sugeridas. • Integrará las características principales de los hidrocarburos aromáticos para diferenciarlos por su grupo funcional. • Reconocerá la importancia de los compuestos orgánicos en el área biológica y lo que implica el consumo de una dieta sana en el desarrollo normal del ser humano. Axiológicos • Desarrollará responsabilidades y compromisos al reconocer que las sustancias orgánicas se encuentran en todos los sistemas y en todos los niveles. • Valorará la importancia de la cuantificación de las sustancias para fundamentar el cuidado del ambiente y de la salud. • Promoverá el uso responsable de los compuestos orgánicos en su vida diaria. Productos de la secuencia Estrategia centrada en el aprendizaje (ECA) Producto esperado Instrumentos de evaluación sugeridos 1. Actividad grupal (p. 137) • Cuestionario y discusión • Guía de observación 2. Actividad individual (p. 143) • Resolución de cuestionario • Lista de cotejo 3. Actividad individual (p. 150) • Proceso desarrollado y resultado obtenido • Lista de cotejo 4. Actividad individual (p. 157) • Proceso desarrollado y resultado obtenido • Lista de cotejo 5. Actividad individual (p. 158) • Proceso desarrollado y resultado obtenido • Lista de cotejo 6.Actividad grupal (p. 159) • Reporte de práctica 9 • Rúbrica 7. Actividad individual (p. 163) • Resolución de actividad • Lista de cotejo 8.Actividad individual (pp. 164-165) • Cuestionario • Lista de cotejo 9. Actividad individual (p. 165) • Investigación • Guía de observación • Resolución de esquema y cuestionario • Lista de cotejo 10. Actividad grupal (p. 168) [ 136 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Apertura de secuencia Hidrocarburos aromáticos El omega 3 es una sustancia que beneficia el organismo en la medida en que regula los niveles de colesterol y protege la salud del corazón. Sus moléculas están formadas por un grupo carboxilo y una larga cadena de carbonos. Generalmente está contenido en peces de agua fría o profunda, en mariscos, verdolagas, lechuga, espinacas, fresas y pepino, entre otros alimentos. Los tipos más importantes de omega 3 son: •• El ácido eicosapentaenoico. •• El ácido docosahexaneoico. •• El ácido alfa-linolénico. Escribe los números correspondientes ACTIVIDAD GRUPAL Competencias genéricas En equipos de cuatro o cinco personas, discutan el tema para resolver el siguiente cuestionario y expongan sus respuestas ante todo el grupo. Competencias disciplinares 1. ¿Por qué es importante una buena alimentación en nuestra dieta diaria? 2. ¿Qué alimentos se consideran indispensables para la dieta humana? 3. ¿Qué tipo de personas requieren altos niveles de consumo de omega 3? 4. ¿Por qué es recomendable la ingesta de omega 3 para los habitantes de nuestro país? Incorporen esta actividad a su portafolio de evidencias. Desarrollo de secuencia Entremos en materia Generalidades de los hidrocarburos aromáticos Los hidrocarburos aromáticos son aquellas sustancias que poseen propiedades químicas especiales asociadas con el núcleo o anillo del benceno. El término “aromático” significa fragante u oloroso. Estos compuestos se caracterizan por su tendencia a las reacciones de sustitución iónica. [ 137 ] Química 2 Los hidrocarburos aromáticos y sus derivados son compuestos cuyas moléculas están formadas por una o más estructuras cíclicas o acíclicas estables, pero con características aromáticas. Las principales fuentes de obtención de los hidrocarburos aromáticos son la destilación de la hulla, la destilación catalítica, la destilación del petróleo crudo y la alquilación de las series más bajas de hidrocarburos aromáticos. Los aceites esenciales pueden obtenerse de los pinos, los eucaliptos y otras plantas aromáticas. Benceno Es el principal hidrocarburo aromático. Su fórmula molecular es C6H6, y su estructura es un anillo donde sus 6 átomos de carbono se encuentran dispuestos formando un hexágono; a su vez, en cada vértice de la estructura éstos soportan 6 hidrógenos. H H H H H H H H H H H H (a) (b) (c) La estructura del benceno es un híbrido de resonancia de dos estructuras contribuyentes (a y b), es por ello que normalmente se representa como un hexágono con un círculo (c) para indicar que los electrones se encuentran deslocalizados. Esta estructura se debe a August Kekulé y suele llamarse anillo bencénico o estructura de Kekulé; el benceno se caracteriza por tener la gran estabilidad que le confieren sus 3 enlaces dobles y el efecto de resonancia. A los hidrocarburos aromáticos derivados del benceno también se les llama arenos, siendo los más comunes el tolueno, etilbenceno, benzaldehído, fenol, xileno, anilina, etc., productos de la monosustitución de un hidrógeno del benceno. Su característica aromática se manifiesta por la nube cíclica de electrones pi () deslocalizados. Si un compuesto cíclico posee una estructura plana, podemos decir que es un compuesto aromático si cumple con la regla de Hückel, que indica que para que una molécula de este tipo sea aromática debe tener 4n 2 electrones pi (electrones deslocalizados), por ejemlo: n 1 entonces 4(1) 2 6 electrones pi (Benceno) n 2 entonces 4(2) 2 10 electrones pi (Naftaleno) Los bencenos monosustituidos se nombran añadiendo el prefijo del sustituyente a la palabra benceno (entre paréntesis se coloca también el nombre común con el que se conoce a estos compuestos): CH3 Metilbenceno (tolueno) [ 138 ] H2C CH3 Etilbenceno OH Hidroxibenceno (fenol) NH2 Aminobenceno (anilina) Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Usos. El benceno se utiliza como constituyente de combustibles para motores, disolventes de grasas, aceites y pinturas; en el grabado fotográfico de impresiones; como intermediario químico en la manufactura de detergentes, explosivos, productos farmacéuticos y tinturas; en la síntesis de otros productos químicos, como el estireno, cumeno (en varias resinas) y ciclohexano (en nailon y fibras sintéticas), en la manufactura de ciertos tipos de caucho, lubricantes y plaguicidas. Grupos funcionales. A la clasificación de compuestos orgánicos —en función de sus propiedades, que son determinantes para generar familias— se le conoce como grupos funcionales. Los principales grupos funcionales se muestran en el siguiente cuadro. Grupo funcional Halogenuro de alquilo X Alcoholes y fenoles Fórmula general R X oxhidrilo o OH hidroxilo R OH Aldehídos CH carbonilo R CH O Cetonas CO carbonilo R CO R Ácidos carboxílicos COOH carboxilo R COOH Aminas NH2 amino R NH2 Amidas CONH2 amida R CONH2 Éteres O oxa R O Ésteres COO carboxilato R COO halogenuro O R = cualquier grupo alquilo Función química R R Alcoholes Los alcoholes son compuestos orgánicos que contienen el grupo hidroxilo u oxidrilo –OH (como grupo funcional) unido a un átomo de carbono. El grupo puede ser primario, secundario o terciario; sus compuestos pueden ser de cadena abierta o cerrada; saturado o insaturado, y puede estar halogenado o contener un anillo aromático. Los grupos OH unidos a un anillo bencénico dejan de ser alcoholes y adquieren las características y propiedades de los fenoles. Fórmula general. Los alcoholes son compuestos del tipo ROH, donde R puede ser cualquier grupo alquilo. Nomenclatura. Los alcoholes se nombran mediante tres sistemas diferentes: •• Nombres comunes para alcoholes simples. •• Sistema carbinol. •• Nomenclatura IUPAC. [ 139 ] Química 2 En la nomenclatura común, a los alcoholes simples se les nombra con la palabra alcohol seguida del nombre del grupo alquílico con terminación ico. H3C OH CH3 CH2 OH Alcohol metílico Alcohol etílico CH3 CH CH3 CH3 CH2 CH2 CH2 OH Alcohol butílico OH Alcohol isopropílico En el sistema carbinol, en general a los alcoholes se les consideran derivados del alcohol metílico (C OH). Así, sólo se nombran los grupos alquílicos con el sufijo carbinol. Cuando al benceno lo nombramos como radical, se utiliza la palabra "fenil o fenilo". H3C OH CH3 CH2 OH Carbinol Metilcarbinol CH3 CH CH3 CH3 CH2 CH2 CH2 OH n-propilcarbinol OH Dimetilcarbinol CH3 CH2 C OH CH3 CH2 C OH CH2 CH3 Trifenilcarbinol Trietilcarbinol En el sistema IUPAC, primero se elige como estructura matriz la cadena más larga que contenga el grupo –OH, y se nombra el grupo alquilo con terminación ol. Como segundo paso, se indica la posición del grupo –OH en la cadena matriz por medio del número más bajo dentro de la cadena. Y como tercer paso, los demás grupos unidos a la cadena se nombran también por medio de números. Ejemplos: H3C OH CH3 CH2 OH Metanol Etanol CH3 CH CH3 OH CH3 CH2 CH2 CH2 OH 1-butanol 2-propanol CH3 CH3 CH3 CH2 CH CH2 OH 2-metil-1-butanol [ 140 ] CH CH2 OH 2-feniletanol CH3 CH2 C CH3 OH 2-metil-2-butanol Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Los alcoholes con 2 grupos –OH se conocen como glicoles, y sus nombres llevan como terminación la palabra glicol o diol indicando el número de carbono al cual se encuentran unidos los OH correspondientes. H2 H2C CH2 C CH2 CH2 CH3 CH CH2 H2C CH2 H2C CH2 OH OH OH OH H Propilenglicol o 1,2-propanodiol Etilenglicol o etanodiol C C HO H OH 1,2-ciclohexanodiol H H HO OH 1,2-ciclopentanodiol Un alcohol se clasifica, de acuerdo con el tipo de carbono que lleva el grupo –OH, como primario, secundario o terciario, en donde R1, R2, R3 5 cualquier grupo alquilo (puede darse el caso que los grupos alquilos sean iguales, R1 5 R2 5 R3, o bien que sean diferentes entre sí R1 R2 R3). H H R3 R1 C OH R1 C OH R1 C OH H R2 R2 Primario Secundario Terciario Propiedades físicas. Por tener el grupo –OH, los alcoholes presentan una cierta polaridad debido a la electronegatividad del O que es mayor que la del C o la del H , ésto permite la formación de puentes de hidrógeno entre sus moléculas lo que a su vez provoca que sus puntos de ebullición sean muy elevados en comparación con los hidrocarburos del mismo peso molecular. Esto se debe a que requieren mayor energía para romper los puentes de hidrógeno que mantienen unida la molécula del alcohol. Los alcoholes más simples son miscibles en agua, y esta propiedad disminuye a medida que aumenta el número de carbonos en la molécula. •• El metanol es el alcohol más sencillo, y se obtiene por reducción del monóxido de carbono con hidrógeno, es un líquido incoloro, su punto de ebullición es de 64.7 ºC, y es venenoso. •• El etanol, por su parte, se obtiene por fermentación de materia vegetal, con una concentración máxima de 15% (v/v) de etanol. Por destilación aumenta esta concentración hasta el 98% (v/v); también se puede obtener por hidratación del etileno (eteno), que se logra a partir del petróleo. Es un líquido incoloro, con punto de ebullición de 78 ºC y fácilmente metabolizado por nuestros organismos, aunque el abuso en su consumo causa alcoholismo. A continuación se muestra una tabla con las diferentes reacciones químicas para obtener alcoholes. Obtención de alcoholes 1. Oximercuración-desmercuración H C C H H H H Alqueno Hg (OAc)2 H2O H Acetato mercúrico H C C H HO Hg OAc H H NaBH4 H C C H Adición Markovnikov HO H (Continúa) [ 141 ] Química 2 (Continuación) Obtención de alcoholes H CH3 CH2 C H HgOAc Hg(OAc)2 H2O C CH3 CH3 CH2 C C CH3 H H H NaBH4 CH3 CH2 C C CH3 OH H 2-penteno OH H 3-pentanol 2. Síntesis de Grignard H H H H C O RMgX2 H2O H C OMgX2 H C OH Mg X R R Alcohol 1º CH3 C O CH3 R H2O C CH3 OMgX2 RMgX2 CH3 R CH3 C OH Mg2 X2 Dimetilcetona CH3 Alcohol 3º Reacciones Las reacciones de un alcohol pueden involucrar la ruptura de enlaces C OH o bien el enlace O H, características de los con la correspondiente eliminación y formación de un nuevo enlace; o en otro momento, por una alcoholes sustitución, en la que un determinado grupo puede remplazar el OH o el H, formándose un nuevo compuesto. 1. Reacción con halogenuros de hidrógeno R OH HX R H H2O Reactividad de HX: Hl HBr HCl Reactividad de ROH: alílico bencílico 3° 2° 1° H CH3 C CH3 OH HBr conc. CH3 CH CH3 H2O o NaBr, H2SO4 reflujo Alcohol isopropílico Br Bromuro de isopropilo (halogenuro de alquilo) 2. Deshidratación R OH Ácido C C H2O Reactividad de ROH: 3° 2° 1° CH3 CH CH3 OH Alcohol isopropílico [ 142 ] H2SO4 CH3 CH CH2 H2O 1-propeno Unidad 3 | Secuencia 6 Hidrocarburos aromáticos ACTIVIDAD INDIVIDUAL Para reforzar e integrar el conocimiento del tema, responde en tu cuaderno las cuestiones que se te presentan, y siguiendo los mecanismos de reacción determina el procedimiento para la obtención de alcoholes y sus reacciones con otras sustancias. Escribe los números correspondientes Competencias genéricas Competencias disciplinares 1. Entre un alcohol y un fenol existe una diferencia que los separa, ¿cuál es? 2. De todos los tipos de alcoholes, ¿cuál es el más reactivo? 3. Cuando los alcoholes presentan 2 grupos OH, ¿con qué nombre se reconocen? 4. Menciona algunas aplicaciones de los alcoholes. 5. Si se hiciera reaccionar alcohol propílico con ácido sulfúrico, ¿qué productos se generarían? Escribe la ecuación correspondiente. 6. Se requiere una pequeña cantidad de etanol para sedar a un paciente accidentado, pero en el laboratorio sólo se cuenta con etileno, ¿qué se necesitaría para producir el alcohol necesario? 7. Explica el mecanismo de reacción del alcohol butílico en presencia de ácido clorhídrico (HCl). Incorpora esta actividad a tu portafolio de evidencias. Usos. Los alcoholes se utilizan como materia prima en la química alifática, como disolventes en reacciones químicas y, en general, en la síntesis de casi cualquier tipo de compuestos orgánicos. El alcohol metílico es sumamente venenoso. La toxicidad se adquiere por prolongadas exposiciones que afectan las vías respiratorias y el sistema nervioso. [ 143 ] QUÍMICA 2 El alcohol etílico es el producto sintético más antiguo empleado por el hombre, y es uno de los más importantes disolventes para lacas, barnices, perfumes y condimentos. Es el alcohol de las bebidas alcohólicas que se consume al 95%(v/v); a concentración de 100% se le conoce como alcohol absoluto. Se emplea medicinalmente como desinfectante de heridas y como analgésico con efecto hipnótico (ocasiona sueño). Tiene una importante aplicación en la fabricación de perfumes, ya que disuelve los aceites esenciales extraídos de flores y frutos. En la actualidad se utilizan los alcoholes de manera importante y sustentable para la generación de energías, como el biodiesel, que minimiza la contaminación de máquinas de combustión interna. Reactor Recuperación de alcohol Alcohol Sedimentador Aceite vegetal Catalizador Ácido mineral Lavado Biodisel Evaporador Glicerina Purificación Neutralización-sedimentación Destilación Ácidos grasos [ 144 ] Evaporador Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Aldehídos y cetonas Los aldehídos y las cetonas son el tipo de sustancias que contienen el grupo carbonilo (CO), por lo que se les denomina compuestos carbonílicos; el grupo carbonilo es el que determina sus propiedades. Como son sustancias que presentan el mismo grupo funcional, sus propiedades y características son muy similares, aunque con variantes, por ser sustancias diferentes. Esta diferencia radica en que en el aldehído uno de los radicales siempre es hidrógeno. Fórmula general R1 H C O R C O R2 Aldehído R 5 H o cualquier grupo alquilo aromático o alifático Cetona R1, R2 5 cualquier grupo alquilo aromático o alifático Por su estructura, el primer miembro de la familia de los aldehídos es el metanaldehído, metanal o formaldehído, mientras que el primer miembro de la familia de las cetonas es la dimetilcetona, propanona o acetona. Nomenclatura IUPAC. Se sigue la pauta usual que se aplica en los demás compuestos orgánicos, como se muestra en la siguiente tabla. Aldehídos Nombre Estructura Cetonas Otra nomenclatura Nombre Estructura Otra nomenclatura H Metanal C O Metanaldehído, formaldehído C O Etanaldehído, acetaldehído H H Etanal CH3 H Propanal C O CH2 Propanaldehído, propionaldehído H3C H3C CH3 H C O Butanal (CH2)2 CH3 C O Propanona Acetona o dimetilcetona H3C Butanaldehído, n-butiraldehído C O 2-butanona CH2 Etilmetilcetona H3C (Continúa) [ 145 ] Química 2 (Continuación) Aldehídos Nombre Estructura Cetonas Otra nomenclatura Nombre H3C H Pentanal C O (CH2)3 n-pentaldehído H3C C O (CH2)4 n-hexaldehído H3C C O (CH2)5 (CH2)2 n-heptaldehído C O 4-heptanona (CH2)2 Dipropilcetona H3C H3C C O (CH2)6 (CH2)2 n-octaldehído C O 4-octanona Propilbutilcetona (CH2)3 CH3 H3C H3C H C O (CH2)7 (CH2)3 n-nonaldehído C O 5-nonanona Di-n-butilcetona (CH2)3 CH3 H3C H3C H C O n-decaldehído (CH2)3 C O 5-decanona (CH2)8 CH3 Metil-n-propil cetona H3C H [ 146 ] C O (CH2)2 CH3 Decanal CH2 3-hexanona H Nonanal Dietilcetona H3C CH3 Octanal C O CH2 H Heptanal Otra nomenclatura CH2 3-pentanona CH3 Hexanal Estructura (CH2)4 H3C n-butil-n-pentil cetona Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Siguiendo la metodología usual de la IUPAC, que se aplica en los demás compuestos orgánicos, como primer paso para nombrar los aldehídos y cetonas se elige la cadena continua más larga que contenga el grupo carbonilo, dando el nombre matriz con terminación al para aldehídos y ona para las cetonas. Como segundo paso, la posición de un sustituyente (grupo alquilo) se indica por un número, siendo considerado el carbón carbonílico como número 1 en aldehídos; en las cetonas se enumera por el extremo donde el carbón carbonílico resulte con el número más bajo. Y como tercer paso, se nombran los sustituyentes o grupos alquilo por orden de tamaño creciente; si un mismo sustituyente aparece más de una vez, se utilizan los prefijos di, tri, tetra, etcétera. Ejemplo para aldehídos: H 5 4 3 2 H 1C O CH3 CH2 CH2 CH 5 4 3 2 H 1C O C O CH3 CH2 CH2 CH CH3 CH2 CH2 CH CH3 CH3 CH3 Pentanal 2-metil 2-metilpentanal Los aldehídos aromáticos presentan un anillo aromático unido al grupo carbonilo, y el representante de este grupo de compuestos es el benzaldehído. Ejemplo para cetonas: 1 O 2 3 6 4 CH3 5 CH3 CH C CH2 CH CH3 3-hexanona CH3 1 O 2 3 4 O 5 CH3 CH C CH2 CH CH3 CH3 CH C CH2 CH CH3 2,5-dimetil CH3 6 CH3 CH3 CH3 2,5-dimetil-3-hexanona Las cetonas aromáticas reciben el nombre de felonas. Propiedades físicas. La presencia del grupo carbonilo convierte los aldehídos y cetonas en compuestos polares. Los compuestos de hasta cuatro átomos de carbono forman puentes de hidrógeno con el agua, lo cual los hace completamente solubles en agua y en disolventes orgánicos; con mayor número de carbonos se vuelven completamente insolubles en agua. Sus puntos de ebullición son mayores que los de los alcanos del mismo peso molecular, pero menores que los de los alcoholes y ácidos carboxílicos respectivos. Las tablas que siguen a continuación nos muestran las reacciones químicas para poder obtener aldehídos y algunas reacciones características. [ 147 ] Química 2 Obtención de aldehídos 1. Oxidación de alcoholes primarios H R C OH H K2 Cr2 O7 dicromato de potasio H C O R Alcohol primario Aldehído Ejemplo: H Catalizador CH3 CH2 CH2 C OH Alcohol-n-butílico Cr2 O722 H H H CH3 CH2 CH2 C O H CH3 CH2 CH2 C O Butanal 2. Deshidrogenación de alcoholes Cu2CrO2 R CH2 OH Cromito de cobre cat. 300 °C R C O H Ejemplo: Cu2CrO2 CH3 CH2 OH Etanol Cromito de cobre cat. 300 °C CH3 C O H2 H Acetaldehído Reacciones características de los aldehídos 1. Adición de reactivo de Grignard R1 R1 C O R 2MgX H C R2 H H2 O H OH OMg1X2 Aldehído R1 C R2 OH Alcohol 2. Reacción de Cannizzaro R C O H Aldehído [ 148 ] H Base fuerte NaOH R C O O Sal de ácido R CH2 OH Alcohol Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Las siguientes tablas nos muestran las reacciones químicas para poder obtener cetonas y algunas reacciones características. Obtención de cetonas 1. Oxidación de alcoholes secundarias OH R CH R´ K2 Cr2 O7 O R C R´ Alcohol 2° Ejemplo: Cetona H CH3 O C CH3 CH3 C CH3 Acetona OH Cr2 O722 2. Acilación de Friedel-Crafts H O R C Cl O AlCl3 R C HCl Cetona Reacciones características de las cetonas 1. Reducción de hidrocarburos Zn(Hg), HCl conc. R R CH2 R' Reducción de Clemmensen Compuestos sensibles a bases R CH2 R' Reducción de Wolff-Kishner Compuestos sensibles a ácidos C O R´ NH2NH2 ,base 2. Adicción de reactivo de Gringnard R2 R2 C O R1MgX R3 R3 C R1 OMgX H2O H1 R2 R3 C R1 OH [ 149 ] Química 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD INDIVIDUAL 1. Para reforzar e integrar el conocimiento del tema, propón las fórmulas de los siguientes compuestos. Competencias disciplinares a) Isobutiraldehído b) 3-metilpentanal c) 2-etilbutanal d) Butiraldehído e) Etilisopropilcetona f) 2-pentanona g) Dietilcetona 2. Incorpora esta actividad a tu portafolio de evidencias. Uso de aldehídos y cetonas Aldehídos •• El metanal o aldehído fórmico es el de mayor uso en la industria, fundamentalmente para la obtención de resinas fenólicas y la elaboración de explosivos. •• Adhesivos, en cintas como masking tape, diurex, cinta scotch. •• Resinas alquídicas y poliuretano expandido, en la elaboración de uno de los plásticos técnicos que se requieren en la sustitución de piezas metálicas de automóviles y maquinaria. Cetonas •• La cetona que mayor aplicación industrial tiene es la acetona (2-propanona), que se utiliza como disolvente para lacas y resinas. •• Síntesis de medicamentos (vitaminas sintéticas). •• Su mayor consumo se destina para la producción del plexiglás, así como para la elaboración de resinas epoxi y poliuretanos. •• La metiletilcetona y la ciclohexanona, además de utilizarse como disolvente, se emplean para la obtención de la caprolactama, (monómero en la fabricación del nailon 6), y por oxidación del ácido adípico, para fabricar el nailon 6,6. [ 150 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Muchos aldehídos y cetonas forman parte de los aromas naturales de las flores y las frutas, por lo cual se emplean en la perfumería y en la elaboración de aceites esenciales como: • El benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina (escencia de vainilla) y el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela). De origen animal existe la muscona y la civetona, que son utilizados en la industria de la perfumería como fijadores para conservar y potenciar los aromas. SOLUCION A BASE DE Síntesis de medicamentos. Formaldehído, fabricación de explosivos. Elaboración de perfumes. Adhesivos, como masking tape. Ácidos carboxílicos Los ácidos carboxílicos son compuestos orgánicos que presentan acidez, y se caracterizan por la presencia del grupo carboxilo (-COOH) unido a cualquier grupo alquilo o arilo. Cuando la cadena carbonada presenta un solo grupo carboxilo, los ácidos se llaman monocarboxílicos (ácidos grasos). Cuando la cadena carbonada presenta dos grupos carboxilo, los ácidos se llaman dicarboxílicos. Fórmula general R C O OH Grupo carboxilo C O O H ácido benzoico (Aromático) H C O O H Ácido fórmico Nomenclatura. A los ácidos carboxílicos alifáticos se les nombra más por su origen que por su estructura química, y se les da la terminación ico. Al ácido más sencillo se le conoce como fórmico, el cual es el causante del ardor que produce la picadura de las hormigas (en latín, fórmica "hormiga"). [ 151 ] Química 2 ACTIVIDAD INDIVIDUAL 1. Para reforzar e integrar el conocimiento del tema, investiga las características de los siguientes ácidos carboxílicos. Estructura Ácido fórmico (veneno de hormiga) Ácido acético (vinagre) Ácido propiónico Ácido butírico Ácido valeriánico Ácidos carboxílicos Nombre O H C OH CH3 C CH3 CH2 C CH3 CH2 CH2 C CH3 CH2 CH2 CH2 C Ácido láurico CH3 (CH2)10 C Ácido mirístico CH3 (CH2)12 C Ácido caproico Ácido caprílico Ácido cáprico Ácido palmítico Ácido esteárico CH3 (CH2)4 C CH3 (CH2)6 C CH3 (CH2)8 C CH3 (CH2)14 C CH3 (CH2)16 C O OH O OH O OH Olor a mantequilla rancia (latín butyrum 5 mantequilla) O OH O OH O OH O OH O OH O OH O OH O OH 2. Incorpora esta actividad a tu portafolio de evidencias. [ 152 ] Características Se encuentran en las Grasas de las cabras (latín caper 5 cabra) Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Los ácidos de cadena ramificada y los sustituidos se nombran como derivados de los ácidos de cadena recta. Para indicar la posición de los grupos alquilo se emplean las letras del alfabeto griego α, β, γ y δ. β α CH3 CH2 CH CH C CH3 CH3 Ácido α, β-dimetilvaleriánico O γ OH β α CH3 CH2 CH C CH3 O OH Ácido α-metilbutírico γ β O α CH2 CH2 CH2 C OH Ácido γ-fenilbutírico Nomenclatura IUPAC. Básicamente, las reglas para nombrar este tipo de compuestos es la misma que la utiliza en los demás compuestos: se antepone la palabra ácido con terminación oico. O O O CH3 CH2 CH2 CH2 C CH3 CH2 CH C CH2 CH2 CH2 C OH OH OH CH3 Ácido pentanoico Ácido 2-metilbutanoico Ácido 4-fenilbutanoico En la siguiente tabla podemos observar algunas propiedades que presentan los ácidos carboxílicos: solubilidad, punto de ebullición, punto de fusión y comportamiento químico. Propiedades de los ácidos carboxílicos Solubilidad Punto de ebullición Punto de fusión Comportamiento químico Los primeros cuatro ácidos monocarboxílicos alifáticos son líquidos solubles en agua; la solubilidad disminuye a medida que aumenta el número de átomos de carbono volviéndose sustancias sólidas, blandas, e insolubles en agua. El ácido pentanoico es parcialmente soluble y a partir de ahí, los ácidos de cadenas más grandes son solubles en disolventes polares, como alcoholes, benceno, etcétera. Los ácidos carboxílicos presentan puntos de ebullición elevados debido a la presencia de los puentes de hidrógeno. Los ácidos fórmico y acético son líquidos El punto de fusión varía según el número de olores irritantes. de carbonos, después de 6 carbonos, Los ácidos butíricos, valeriano y caproico el punto de fusión se eleva de manera presentan olores desagradables. irregular. Los ácidos monocarboxílicos aromáticos son sólidos cristalinos con puntos de fusión altos. Los ácidos con mayor cantidad de carbonos presentan poco olor. Este grupo funcional consta de un grupo carbonilo (C O) y de un hidroxilo (-OH). El -OH es el que resiente casi todas las reacciones, o sea, pérdida de protón (H) o remplazo del grupo -OH por otro grupo. El grupo -COOH confiere carácter polar a los ácidos y permite la formación de puentes de hidrógeno entre la molécula del ácido y la molécula de agua, por lo cual su solubilidad es similar a los alcoholes. La presencia de dos átomos de oxígeno en el grupo carboxilo hace posible que dos moléculas de ácido se unan entre sí por puente de hidrógeno doble, formando un dímero cíclico. [ 153 ] Química 2 Propiedades de los ácidos carboxílicos Nombre Punto de fusión [°C] Punto de ebullición [°C] Solubilidad en agua [g/100 mL] Ácido metanoico 8 100.5 Muy soluble Ácido etanoico 16.6 118 Muy soluble Ácido propanoico 22 141 Muy soluble Ácido butanoico 6 164 Muy soluble Ácido etanodioico 189 239 Poco soluble Ácido propanodioico 135.6 Soluble Ácido fenilmetanoico 122 Soluble Ácido ftálico 231 250 Poco soluble Las siguientes tablas nos muestran las reacciones químicas para poder obtener ácidos carboxílicos y algunas reacciones características. Obtención de ácidos carboxílicos 1. Oxidación de alcoholes primarios H R C OH KMnO4 H R C O OH Ejemplo: CH3 CH3 CH2 C CH2 OH KMnO4 CH3 CH3 CH2 C C H H O OH 2. Oxidación de compuestos alquil bencénicos o derivados Ejemplo: R CH3 Br o-bromotolueno [ 154 ] O KMnO4 o K2Cr2O7 C OH2/∆ OH O KMnO4, OH− C ∆ Br OH Ácido o-bromobenzoico Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Reacciones características de los ácidos carboxílicos 1. Conversión en derivados funcionales (en cloruros de ácido) SOCl2 O R C Ejemplo: O C OH O PCl3 OH PCl5 R C 100º PCl5 Cl Cloruro de ácido Ácido benzoico COCl POCl3 HCl Cloruro de benzoilo 2. Conversión en ésteres O R C OH H R'OH O R C OR' H2O Reactividad de R'OH: 1 2 3 Éster Ejemplo: O C OH CH3 OH H Metanol Ácido benzoico O C OCH3 H2O Benzoato de metilo Derivados de los ácidos carboxílicos. Son compuestos que tienen el grupo acilo o el grupo arilo en los ácidos alifáticos o aromáticos. Entre estos derivados se encuentran: las sales de ácido, los ésteres, los haluros de ácidos, los anhídridos de ácidos, las amidas y las imidas. Usos de ácidos carboxílicos Ácido Aplicación Características Ácido acrílico Es materia prima para fabricar plásticos, barnices, resinas elásticas y adhesivos transparentes. Líquido incoloro, inflamable, cáustico y de olor punzante. Ácido benzoico Se usa como conservador de alimentos, y como pomada con efecto antimicótico. Sólido, poco soluble en agua y de acidez ligera. Ácido linoleico Líquido oleoso, incoloro o Ácido graso esencial, necesario en la dieta de amarillo pálido, soluble en los mamíferos. Es uno de los precursores de las prostaglandinas y otros componentes de tipo disolventes orgánicos. hormonal. Se utiliza en la fabricación de pinturas y barnices. Ácido oleico Se utiliza en la fabricación de jabones y cosméticos, en la industria textil y en la limpieza de metales. Líquido oleoso e incoloro, no soluble en agua, pero sí en benceno, alcohol, éter y otros muchos disolventes orgánicos. (Continúa) [ 155 ] Química 2 (Continuación) Usos de ácidos carboxílicos Ácido caprílico El ácido caprílico y sus sales presentan acción dermatomicótica o actividad fungicida contra diversos hongos. Líquido amarillo con olor rancio característico. Sólido orgánico blanco de apariencia cristalina. Ácido esteárico Se utiliza en mezclas lubricantes, materiales resistentes al agua y desecantes de barnices, y en la fabricación de velas de parafina. Combinado con hidróxido de sodio, el ácido esteárico forma jabón (estearato de sodio). Ácido etanoico o Ácido acético El ácido acético se utiliza en la producción de acetato de rayón, plásticos, películas fotográficas, disolventes para pinturas y medicamentos como la aspirina. Líquido incoloro, olor irritante y sabor amargo. Compuesto incoloro. Ácido láctico El ácido láctico que se forma en la leche por la fermentación de la lactosa es el que la hace agriarse. El ácido láctico se utiliza para elaborar queso, bebidas suaves y otros productos alimenticios. Ácido cítrico Se emplea como aditivo en bebidas y alimentos para darles un agradable sabor ácido. También se utiliza en fármacos, para elaborar papel cianotipo, en imprenta textil y como agente abrillantador de metales. Sólido blanco, soluble en agua y ligeramente soluble en disolventes orgánicos. Éteres Se consideran derivados de los alcoholes, ya que el hidrógeno del grupo OH es sustituido por un radical alquilo o arilo; se obtienen mediante reacciones de sustitución en un medio ácido. Fórmula general. R – O – R´ en donde R R´ o R R´. Nomenclatura. Existen varios métodos para nombrar a los éteres: ••Nombrando los radicales de lo más simple a lo más complejo, unidos por el prefijo oxi. ••Nombrando los radicales de lo más simple a lo más complejo, con terminación éter. ••Nombrando el grupo alquilo más simple con terminación oxi, seguida del grupo alquilo restante con terminación -ano del alcano correspondiente. ••Señalando mediante un número (el más bajo) el carbono que contiene el oxígeno, seguido del nombre del radical que lo soporta con terminación oxi, y completando con el radical restante y la terminación -ano. Ejemplo: CH3 O CH2 CH3 [ 156 ] 1. metil-oxi-etil 2. metiletil éter 3. metoxietano 4. 1-metoxietano Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Los éteres, al igual que el cloroformo (tricloruro de metilo), se utilizan en la industria farmacéutica como anestésicos de bajo espectro (inhiben el sistema nervioso central); actúan como desinflamatorios de uso externo; son excelentes disolventes orgánicos de grasas, perfumes, pinturas, barnices y colorantes, y en la industria se emplean en la fabricación de aromatizantes y como combustible para motores a diesel. Escribe los números correspondientes ACTIVIDAD INDIVIDUAL Competencias genéricas 1. Para reforzar e integrar el conocimiento del tema, propón individualmente las estructuras de los siguientes compuestos. Competencias disciplinares a) isobutilhexil éter b) dipropil éter c) 2-etoxipropano 2. Incorpora esta actividad a tu portafolio de evidencias. Ésteres Son derivados de los ácidos carboxílicos, ya que se generan por la sustitución del hidrógeno del OH del grupo carboxílico por un grupo alquilo. Los ésteres principalmente son el producto de la condensación de ácidos carboxílicos con un alcohol (esterificación). Fórmula general. R – COO – R´ donde R 5 R´ o R ≠ R´ Nomenclatura. Para nombrar los ésteres se escribe el nombre del ácido carboxílico del que deriva con la terminación -oato, seguida del nombre del grupo alquilo del alcohol con la terminación ilo. Ejemplo: O CH3 CH2 C Ácido propanoico O OH CH3 OH Alcohol metílico CH3 CH2 C O CH3 Propanoato de metilo El etanoato de etilo es comúnmente conocido como acetato de etilo. Los ésteres se caracterizan por tener un aroma peculiar, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales; los más comunes se muestran en la siguiente tabla. Éster Olor o sabor Éster Olor o sabor Etanoato de isopentilo Plátano Butanoato de pentilo Pera Acetato de bencilo Jazmín Pentanoato de pentilo Manzana Acetato de n-octilo Naranja Butanoato de metilo Piña [ 157 ] Química 2 Reconociendo las características de los ésteres, podrías suponer, ¿qué es el poliéster? El nombre nos obligaría a pensar que pudieran ser varios ésteres unidos entre sí, y que además sus propiedades, características y usos deberían ser similares. Aunque su grupo funcional es de un éster, los poliésteres son compuestos sintéticos derivados del petróleo; algunos poliésteres se obtienen por medio de una reacción llamada polimerización para obtener fibras destinadas a la elaboración de hilos, botellas de plástico, etc. Aminas Son compuestos que se generan por la sustitución de hidrógenos en la molécula de amoniaco por grupos alquilo. Dependiendo del número de hidrógenos sustituidos, las aminas podrán ser primarias, secundarias o terciarias. NH3 H N R Amoniaco H N R R´´ N R H R´ R´ Amina primaria Amina secundaria Amina terciaria Sus denominación lleva el nombre del o los grupos alquilo sustituyentes seguido(s) de la palabra amina. H N CH3 H Amina primaria: metilamina Escribe los números correspondientes Competencias genéricas H N CH3 CH3 Amina secundaria: dimetilamina CH3 N CH3 CH2 CH3 Amina terciaria: dimetiletilamina ACTIVIDAD INDIVIDUAL 1.Para reafirmar el tema, escribe las estructuras de las siguientes aminas y determina si son primarias, secundarias o terciarias. Competencias disciplinares a) pentilamina b) metildimetilamina c) tert-butilamina d) dietilamina e) trietilamina 2. Incorpora esta actividad a tu portafolio de evidencias. [ 158 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Amidas Son compuestos nitrogenados al igual que las aminas; se derivan de los ácidos carboxílicos, donde el grupo OH es remplazado por –NH2 para generar el grupo amida. O C N R R También pueden ser: primarias, secundarias y terciarias, dependiendo del número de sustituyentes en el átomo de nitrógeno. La importancia de estos compuestos radica en las amidas complejas, ya que la unión de aminas con ácidos forman poliamidas, los cuales son polímeros que consisten en una serie de enlaces amida que unen alternadamente un ácido con una amina, un ácido con una amina, y así sucesivamente. Los enlaces peptídicos son importantes e indispensables en nuestra vida, ya que son proteínas que contienen gran cantidad de aminoácidos unidos entre sí por enlaces amida. Una poliamida ampliamente utilizada en la industria es el nailon 6,6, que contiene unidades alternadas de 1,6-hexanodiamina y ácido 1,6-hexanodioico (conocido como ácido adípico). Escribe los números correspondientes ACTIVIDAD GRUPAL Competencias genéricas 1. En equipos de cuatro integrantes realicen la práctica de laboratorio número 9 de la página 194. Competencias disciplinares 2. Incorporen esta actividad a su portafolio de evidencias. Compuestos orgánicos de importancia biológica Los seres vivos, como fundamento principal de estudio de la ciencia biológica, están constituidos anatómica y funcionalmente por células, que a su vez se componen químicamente de sustancias orgánicas e inorgánicas a las que se conoce como compuestos de importancia biológica. Vistas anatómicas del ser humano. [ 159 ] Química 2 Ejemplos de compuestos inorgánicos: •• Agua. •• Sales minerales. Ejemplos de compuestos orgánicos: •• Carbohidratos. •• Lípidos. •• Proteínas (ácidos nucleicos). •• Vitaminas •• Hormonas. Cuando hablamos de seres vivos nos referimos a todos los seres que tienen vida (es decir, que nacen, crecen, se reproducen y mueren), desde los más simples (unicelulares) hasta los más complejos (pluricelulares). En este tema químico-biológico nos enfocaremos en el ser humano, ya que estudiarlos a todos competería a otra área del conocimiento: la biología. Así pues, todos los seres requerimos de sustancias para el mantenimiento fisiológico del organismo, y para lograr el equilibrio en nuestras funciones debemos consumir alimentos que le aporten los nutrientes necesarios a nuestro cuerpo para que se realice un metabolismo adecuado de los mismos. Esos nutrientes se obtienen mediante una dieta rica y balanceada en sustancias o compuestos mencionados con anterioridad: frutas, verduras, carnes, cereales, leche (y derivados), huevo, pastas, etc. En la imagen se muestran, en orden de importancia, los alimentos de la dieta. Grasas y aceite (lípidos) Azúcares (carbohidratos) Leche, yogurt, queso Carne, huevo, pescado (proteínas) (proteínas) Verduras Frutas (vitaminas) (vitaminas) Leguminosas, pasta Cereales (carbohidratos) (carbohidratos) Pirámide nutricional. [ 160 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Alimentos con alto contenido de carbohidratos: papas, zanahorias, miel, chocolate, azúcar, bebidas (como refrescos), panes, harinas y frutas secas. Alimentos que contienen lípidos: vísceras (como hígado, corazón), sesos, yema de huevo, langostas, mantequilla, mariscos en general, ciertas carnes. Alimentos ricos en proteínas: frijoles cocidos, leche, avena, garbanzo, aguacate, huevo, queso, lentejas y arroz integral. Alimentos ricos en aminoácidos: cereales integrales, galletas integrales, vegetales, legumbres, frutas. Los alimentos tardan aproximadamente 10 minutos en llegar al estómago, pero la función metabólica inicia desde que se ingieren por la boca. Carbohidratos Los carbohidratos son también llamados glúcidos (de glucosa) o azúcares. Formados únicamente por carbono, hidrógeno y oxígeno (de ahí su nombre, carbo- hidr- ato, o hidratos de carbono), son derivados de aldehídos, cetonas y alcoholes, ya que contienen en sus moléculas el grupo carbonilo y varios grupos OH. Los carbohidratos se pueden encontrar como moléculas muy sencillas o muy complejas, y son llamados monosacáridos o polisacáridos respectivamente. La mayoría de sus nombres lleva la terminación osa. Ejemplos: glucosa, fructosa, sacarosa (azúcar de mesa), ribosa, desoxirribosa, etcétera. OH H H C H C O C H C OH O H H HO C H O C H C OH HO H C OH H C OH H Glucosa OH H C C H OH OH CH2OH C C H HO H H OH OH H Fructosa CH2OH O H HO H OH H H OH O H CH2OH C C H H OH OH H O CH2OH Sacarosa [ 161 ] CH2OH Química 2 CHO H C OH H C OH H C OH H CH2OH H OH O HOH2C H H OH OH HO H O H C OH H H H HO Ribosa H H Desoxirribosa Clasificación de los carbohidratos Glucosa Monosacáridos (Una unidad) Fructosa Galactosa Sacarosa (azúcar común) Oligosacáridos (2 o 10 unidades) Lactosa Maltosa Carbohidratos (CHOS) Homopolisacáridos Almidón Glucógeno Celulosa Quitina Heteropolisacáridos Pectina Hemicelulosa Mucopolisacáridos Polisacáridos (Muchas unidades) Los carbohidratos son importantes porque las células obtienen su energía a partir de ellos; por tal motivo, son la base de la alimentación humana. Los carbohidratos se encuentran presentes en cualquier parte de la célula ya que la energía se requiere en todos los niveles. En las células vegetales la glucosa es el producto final del proceso conocido como fotosíntesis. Por medio del proceso de la fotosíntesis, la planta convierte la energía proveniente de los rayos solares, con ayuda del CO2 y H2O, en energía almacenada en forma de enlaces de glucosa (C6H12O6) y libera O2 al medio, es así como las plantas fabrican su propio alimento (autótrofas). La combinación de miles de moléculas de glucosa genera un producto más complejo que proporciona el material de soporte de la planta conocido como celulosa; de igual forma se generan los almidones contenidos en las semillas. Cuando el ser humano ingiere estos productos (glucosa) en la alimentación, los mismos son degradados por el hígado para formar el glucógeno (reserva), indispensable en la síntesis [ 162 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos de otros productos. Parte de la glucosa, participa en la síntesis de grasas por un lado (colesterol) y de aminoácidos (hormonas) por el otro, mediante compuestos nitrogenados; estos últimos, a su vez, formarán parte de algunas proteínas. El glucógeno (almidón animal) es un polisacárido que se almacena en el hígado y en los músculos de los animales; se descompone en ácido pirúvico y láctico, importantes en la contracción de los músculos. Por la gran cantidad de carbohidratos que se consumen en la dieta, o que se sintetizan a partir de otros, a continuación se muestran algunas de sus funciones en los seres vivos: •• Son generadores de energía para el metabolismo (combustibles). •• Forman parte de las membranas y pared celular de todas las células. •• Tienen funciones de gran importancia en los músculos, huesos, cartílagos y tendones. Productos que contienen carbohidratos. ACTIVIDAD INDIVIDUAL Para reforzar e integrar el conocimiento del tema, realiza las actividades que se solicitan. 1. Determina qué granos y semillas contienen almidón. Escribe los números correspondientes Competencias genéricas Competencias disciplinares 2. Industrialmente, ¿para qué se emplea la celulosa? 3. Investiga los niveles normales de azúcar en la sangre que debe tener un adulto joven. Incorpora esta actividad a tu portafolio de evidencias. [ 163 ] Química 2 Lípidos Son llamados también grasas, y no se disuelven en agua. Se componen de carbono, hidrógeno y oxígeno. Constituyen un grupo de compuestos que se originan en las células y adquieren gran importancia en el organismo debido a que: ••Sirven como reserva de energía, y en los animales se almacenan en el tejido adiposo. ••Protegen el cuerpo del frío, ya que son excelentes aislantes térmicos. ••Son componentes, al igual que los carbohidratos, de las membranas celulares, cuya función es regular la entrada y salida de materiales en la célula. ••Representan el grupo de ésteres glicéricos de ácidos grasos de elevado peso molecular; los más comunes son los triglicéridos. Los lípidos son derivados de muchos ácidos carboxílicos y se clasifican como sigue: Ácidos grasos y derivados Eicosanoides Saponificables Prostaglandinas Tromboxanos Leucotrienos Lípidos neutros Lípidos Lípidos anfipáticos No saponificables Escribe los números correspondientes Competencias genéricas Acilgliceroles Ceras Glicerolípidos Esfingolípidos Terpenos Esteroides Hidrocarburos Lípidos pírrolicos ACTIVIDAD INDIVIDUAL Cuando un individuo no posee buenos hábitos alimenticios, al cabo del tiempo su cuerpo comienza a manifestar diversos problemas, generalmente de tipo cardiaco; también se presentan situaciones de sobrepeso y, por consiguiente, se le diagnostica obesidad y diabetes. En México, una gran parte de la población presenta este tipo de enfermedades; clínicamente se habla de los niveles de triglicéridos y colesterol en la sangre. De manera individual, responde las siguientes preguntas. Competencias disciplinares 1. ¿Qué tipo de compuestos son los triglicéridos y el colesterol? 2. ¿Cómo crees que afectan fisiológica y psicológicamente al paciente? [ 164 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos 3. ¿Cómo se pueden controlar? 4. ¿Qué medidas se deben llevar a cabo para disminuir los índices de triglicéridos y de colesterol? 5. ¿Cómo afecta al sector salud el porcentaje de esta incidencia? Incorpora esta actividad a tu portafolio de evidencias. Escribe los números correspondientes ACTIVIDAD INDIVIDUAL Competencias genéricas Para reforzar e integrar el conocimiento del tema, realiza las actividades que se recomiendan y comenta los resultados con tus compañeros y tu profesor(a). Competencias disciplinares 1. Investiga en Internet: a) ¿Cuál es la diferencia entre grasas, aceites, ceras y ácidos grasos? b) ¿Qué significa el término saponificable? c) Respecto del colesterol, ¿por qué se recomienda el omega 3? d) ¿Qué es específicamente el omega 3? e) ¿Qué relación tienen los esteroides con los gimnasios? 2. Investiga con un médico o con expertos las preguntas que te has planteado hasta este punto en relación con el consumo excesivo de grasas. Incorpora esta actividad a tu portafolio de evidencias. Proteínas Son macromoléculas de elevado peso molecular, y se definen como compuestos poliméricos que contienen carbono, hidrógeno, oxígeno y nitrógeno; algunas proteínas pueden poseer azufre, fósforo, magnesio, zinc, hierro y cobre. Se constituyen por la condensación de aminoácidos unidos entre sí por enlaces peptídicos que forman grandes cadenas conocidas como polipéptidos. Las proteínas constituyen el componente nitrogenado mayoritario de la dieta y el organismo, y cumplen una función meramente estructural o plástica, por lo que nos ayudan a construir y regenerar nuestros tejidos. Además, son importantes porque actúan desempeñando diversas funciones, como las que se listan enseguida. [ 165 ] Química 2 •• Reguladoras. Como materia prima, intervienen en la formación de los jugos digestivos, hormonas, proteínas plasmáticas, hemoglobina, vitaminas y enzimas que llevan a cabo las reacciones químicas que se realizan en el organismo. •• Catalizadoras. Son enzimas que aceleran la velocidad de las reacciones químicas del metabolismo, como la amilasa salival y la pepsina. •• Como medio de transporte. Son transportadoras de oxígeno en la sangre, como la hemoglobina. •• Como elementos estructurales. Son responsables de la estructura del organismo y de los tejidos de sostén y relleno, como el conjuntivo (colágeno, elastina y reticulina). La contracción muscular se realiza a través de la miosina y actina, proteínas contráctiles que permiten el movimiento celular. •• De defensa. Participan en la formación de anticuerpos y como factores de regulación que actúan contra infecciones o agentes extraños, trombina y fibrinógeno. •• Hormonales. Son proteínas reguladoras como la insulina, que regula los niveles de azúcar en la sangre. •• Genéticas. Son responsables de la herencia, como son los ácidos nucleicos (ADN y ARN), que trasmiten información genética de generación a generación. •• Homeostáticas. Colaboran en el mantenimiento del pH. •• Transducción de señales. Rodopsina. Las proteínas se componen de la combinación de 20 aminoácidos esenciales; son ácidos carboxílicos (con un radical alquilo o arilo) que contienen el grupo amino (−NH2). La diversidad de proteínas depende de las diferentes combinaciones entre éstos y sus secuencias. Ejemplo: H H H H N C H R O H C O H H N C H R O C O Aminoácidos Nombre Abrev. Función Alanina Ala Interviene en el metabolismo de la glucosa. Arginina Arg Importante en la producción de la hormona del crecimiento y en el mantenimiento y reparación del sistema inmunológico. Asparagina Asn Interviene específicamente en los procesos metabólicos del sistema nervioso central (SNC). (Continúa) [ 166 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos (Continuación) Aminoácidos Nombre Abrev. Función Ácido aspártico Asp Importante para la desintoxicación del hígado y su correcto funcionamiento. El ácido L-aspártico se combina con otros aminoácidos formando moléculas capaces de absorber toxinas del torrente sanguíneo. Cisteína CySH Interviene en la desintoxicación; actúa como antagonista de los radicales libres. Ácido glutámico Glu Tiene gran importancia en el funcionamiento del sistema nervioso central y es estimulante del sistema inmunológico. Glicina Gly Es componente de numerosos tejidos del organismo. *Valina Val Estimula el crecimiento y reparación de los tejidos, el mantenimiento de diversos sistemas y el balance de nitrógeno. *Leucina Leu Con la L-isoleucina y la hormona del crecimiento (HGH) interviene en la formación y reparación del tejido muscular. *Isoleucina Ileu Con la L-leucina y la hormona del crecimiento interviene en la formación y reparación del tejido muscular. Serina Ser Interviene en la desintoxicación del organismo, el crecimiento muscular y el metabolismo de grasas y ácidos grasos. *Treonina Tre Ayuda al hígado en sus funciones generales de desintoxicación. *Metionina Met Colabora en la síntesis de proteínas y constituye el principal limitante en las proteínas de la dieta, a la vez que determina el porcentaje de alimento que va a utilizarse a nivel celular. *Lisina Lis Es uno de los más importantes aminoácidos, pues interviene en diversas funciones, incluyendo el crecimiento, reparación de tejidos, anticuerpos del sistema inmunológico y síntesis de hormonas. *Fenilalanina Fen Interviene en la producción del colágeno para la estructura de la piel y el tejido conectivo, y también en la formación de diversas neurohormonas. Tirosina Tir Es un neurotransmisor directo y puede ser muy eficaz en el tratamiento de la depresión. Prolina Pro Está involucrada en la producción de colágeno y tiene gran importancia en la reparación y mantenimiento de músculo y huesos. Hipro Involucrada también en la producción de colágeno aunque no es decisiva. Su concentración en la orina ayuda como un indicador de forma ósea. Tri Implicado en el crecimiento y producción hormonal, especialmente en la función de las glándulas de secreción adrenal, interviene en la síntesis de la serotonina, neurohormona involucrada en la relajación y el sueño. His En combinación con la hormona del crecimiento (HGH) y algunos aminoácidos asociados, contribuye al crecimiento y reparación de los tejidos con un papel específicamente relacionado con el sistema cardiovascular. Hidroxiprolina *Triptófano Histidina *Aminoácidos esenciales que el organismo no puede sintetizar y que se deben adquirir de la dieta. [ 167 ] QUÍMICA 2 Escribe los números correspondientes Competencias genéricas ACTIVIDAD GRUPAL Para reforzar e integrar el conocimiento del tema, en equipos de tres personas: 1. Indiquen en el esquema que se presenta qué tipo de proteínas intervienen en las diversas partes del organismo que aparecen señaladas, y cuáles son. Pueden consultar con su profesor(a). Competencias disciplinares 2. De acuerdo con su experiencia o investigaciones previas, expliquen con sus propias palabras qué sucede en el organismo cuando: a) La insulina no es suficiente para transportar el azúcar en la sangre. b) Se consumen más grasas que proteínas. c) Existe una gran liberación de anticuerpos. Incorporen esta actividad a su portafolio de evidencias. [ 168 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Cierre de secuencia Conclusión del caso inicial Retomando la actividad de la página 137, elabora y entrega un resumen de por qué es importante el consumo del omega 3 en la dieta, con productos de origen natural y no sintético, como sugieren algunos complementos alimenticios. Considera para tu resumen las estadísticas a nivel mundial sobre obesidad. Ejercicios de cierre Encuentra en la siguiente sopa de letras la respuesta a cada uno de los enunciados que se te presentan. Pueden localizarse de derecha a izquierda, o viceversa; de arriba abajo o viceversa; diagonal de arriba abajo, o viceversa. M I R A Q U I S I S E T N I S O T O F S C R I L S A N T O A Ñ O Q V X Z K S O I A O Q U I M I C A D O R G A N I C A R N R L H O R P M I N A I C A M I Z X N M U B I C A R B I N O L E H Z A N D U I I B O X O M E T R D S I I X E C A D A E C D H O M E R X Q A O N O N B D M E S T O A I B A L Q U E N O S X C S P L K I O Z X D R N A E J M E N U O X U Q A Q R X A R A D I M A B E T O R S I N L V C P B L A C H A M G A G A U C A R L O I M I S C T N I G Y M S B H B J U A J B N J E O O R N W P E T R O L E O S H E E V A X H S A O T E A C O S Y O N E L N M E S O S C U A N C N U M E C C A M Y C P I E L A C E T O N A S A U E N Z I M E C A L E Z X D R O N E L L D X A L C A N O S X S A N D D I O S G M A N A V E R O X A H J Y I E M I D A T R W V X A I M K J D N W H O M B R I N E T E R E S H B E E Y P M U I D [ 169 ] Química 2 Verticales 1. Los ácidos carboxílicos presentan en su estructura el grupo: 2. Es un hidrocarburo cíclico y aromático cuya fórmula general es C6H6: 3. Los compuestos de importancia biológica cuya función principal es proporcionar la energía necesaria para el metabolismo son conocidos como: 4. L as macromoléculas, o polímeros, cuya unidad estructural son los aminoácidos se reconocen como: 5. Las sustancias que presentan un grupo OH unido a un átomo de carbono son llamadas: 6. El nombre que recibe el ácido que contiene el veneno de las hormigas es: Horizontales 1. Ciencia que estudia todos los compuestos que contienen carbono: 2. La fuente principal de obtención de hidrocarburos es: 3. A los hidrocarburos que presentan hibridación sp3, saturados e insolubles en agua y tienen enlaces sencillos C-C se les llama: 4. Los compuestos que contienen un enlace doble carbono–carbono reciben el nombre de: 5. Al compuesto cuya fórmula general es R-CO-R y que es ampliamente utilizado en la cosmética como disolvente de barnices se le denomina: 6. El proceso por el cual las plantas elaboran su propio alimento generando glucosa se llama: 7. Los alcoholes presentan en su estructura el grupo conocido como: 8. Se emplea en la industria farmacéutica como anestésico de corto tiempo: [ 170 ] Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Diagonales 1. Los compuestos formados únicamente por carbono e hidrógeno reciben el nombre de: 2. Los compuestos que sirven como reserva energética y como aislantes térmicos y quedan soporte mecánico a las células se conocen como: 3. Sustancias que se obtienen por sustitución de hidrógenos en la molécula de amoniaco: 4. Es el compuesto que al igual que las cetonas contiene en su molécula el grupo carbonilo: 5. L a proteína secretada por el páncreas que tiene función hormonal y de transporte de azúcar en la sangre se denomina: 6. El producto generado por las plantas por medio de la clorofila es: 7. Es el principal ácido nucleico cuya función es transmitir las características genéticas de generación en generación: [ 171 ] Química 2 Evaluación de la secuencia didáctica En acuerdo con su profesor(a), seleccionen las estrategias centradas en el aprendizaje (ECA) que resultaron más significativas en el desarrollo de sus competencias a lo largo de esta secuencia, evalúen su desempeño en cada una de ellas y escriban los aspectos que consideraron al desarrollarlas y aquellos que deben tener en cuenta para mejorar sus resultados. Portafolio de evidencias Estrategias centradas en el aprendizaje (ECA) seleccionadas [ 172 ] Evaluación de la estrategia Aspectos que consideré al desarrollar la estrategia Aspectos que debo considerar para mejorar los resultados de la estrategia Unidad 3 | Secuencia 6 Hidrocarburos aromáticos Confirmación de conocimientos de la unidad 3 Propuesta de tercer examen parcial Con el propósito de que reafirmes los conocimientos adquiridos en la unidad 3, lee detenidamente cada una de las cuestiones que se te presentan y responde según sea el caso. 1. ¿Cuál es la diferencia entre un hidrocarburo alifático y un hidrocarburo aromático? 2. Explica: ¿por qué el carbono es capaz de formar más compuestos que cualquier otro elemento? 3. ¿Qué significan los términos “saturado” e “insaturado” en los compuestos orgánicos? 4. Escribe dos ejemplos de hidrocarburos saturados y dos ejemplos de hidrocarburos insaturados. 5. Escribe el nombre de las siguientes estructuras: a) CH3 CH3 CH3 CH2 CH CH2 CH CH2 C CH2 CH3 CH3 CH3 b) CH3 CH CH CH2 CH3 CH2 CH3 [ 173 ] Química 2 CH3 CH2 CH3 c) CH3 C C CH2 CH2 CH C CH2 CH3 CH3 6. Determina la estructura de los siguientes compuestos. a) 3-metil-3-butanal b) 2,4-pentadiona c) Ácido 3-metilpentanoico 7. Escribe la fórmula y estructura del benceno. [ 174 ] Reacciones químicas Introducción Las reacciones químicas son procesos que se realizan continuamente en el Universo, y para representarlas nos valemos de modelos útiles para su correcta interpretación. Objetivo Conocer y familiarizarse con la simbología utilizada en la representación de las reacciones efectuadas en el laboratorio. Material y reactivos Material Reactivos Azufre Limadura de hierro Imán Disolución de cloruro de bario Ácido sulfúrico concentrado Clorato de potasio Dióxido de manganeso Astillas de madera 1 cápsula de porcelana 1 mechero de Bunsen 1 pinzas para crisol 2 tubos de ensayo 1 pinzas para tubo de ensayo 1 soporte universal 1 anillo para soporte 1 tela de asbesto Experimentación Experimento 1. En una cápsula de porcelana, coloquen aproximadamente 1 g de azufre en polvo y un poco de limadura de hierro. Mézclenlos perfectamente y después acerquen un imán. Comparando las propiedades de las sustancias antes y después del experimento, observamos que éstas realizado fue cambiaron, por lo cual concluimos que el fenómeno (sí/no) . Experimento 2. Calienten intensamente la mezcla del experimento anterior, después déjenla enfriar y acerquen nuevamente el imán. Comparando las propiedades de las sustancias antes y después del experimento, notamos que éstas lizado fue (sí/no) Prácticas de laboratorio Práctica 1 cambiaron, por lo que concluimos que el fenómeno rea. Entonces, este tipo de fenómenos constituye una . Modelos representativos 1. Si a la sustancia azufre la representamos como A, a la sustancia hierro como B y a la [ 175 ] Química 2 unión de ambas en una sola como sustancia C, entonces el fenómeno del experimento 2 quedaría representado algebraicamente como: 2. A las sustancias que se encuentran a la izquierda (antes de la flecha) se les llama reactivos, a las que están después de la flecha se les denomina productos; por tanto, en el experimento 2 los reactivos son: ;y los productos son: Experimento 3. En un tubo de ensayo coloquen 5 mL de disolución de cloruro de bario y agreguen unas cuantas gotas de ácido sulfúrico. Anoten sus observaciones. La reacción efectuada es: BaCl2 H2SO4 BaSO4 2 HCl a) ¿Qué significa el símbolo ( )? b) ¿Qué significa el símbolo ( )? Experimento 4. En un tubo de ensayo agreguen una pequeña cantidad de KClO3 y una pizca de dióxido de manganeso como catalizador. Calienten el tubo de ensayo e introduzcan, con cuidado, en la boca del tubo una astilla pequeña de madera encendida. La reacción efectuada es: KClO3(s) KCl(s) + O2(g) a) ¿Qué significa (s)? b) ¿Qué significa ( g)? Conclusiones 1. ¿Qué aprendiste en esta actividad? 2. Desde tu punto de vista, menciona lo que te pareció más impactante del desarrollo de esta práctica. ¿Descubriste algo durante el desarrollo de ella que no sabías? 3. Comenta con el grupo y con tu profesor(a). [ 176 ] Prácticas de laboratorio Práctica 2 Tipos de reacciones Objetivo Efectuar, interpretar y familiarizarse con los diferentes tipos de reacciones. Material y sustancias Material 4 tubos de ensayo de 5mL 1 mechero de Bunsen 1 pinzas para tubo de ensayo Sustancias Astillas de madera Sodio metálico Disolución de sulfato de cobre Óxido de mercurio Ácido clorhídrico concentrado Experimentación Experimento 1. En un tubo de ensayo de 5 mL perfectamente seco, coloquen una pizca de sodio metálico con ayuda de una espátula perfectamente seca. Acerquen el tubo al mechero (usando pinzas) hasta que se efectúe la combustión con el oxígeno. Ten cuidado de no dirigir la boca del tubo de ensayo hacia ti o tus compañeros. a) La reacción es de tipo: b) Completen la ecuación de la reacción: Na O2 c) Efectúen el balanceo de la ecuación por el método de tanteo: Experimento 2. Introduzcan un clavo de fierro en una disolución de sulfato de cobre. Tomen en cuenta el color del fierro y el color inicial de la disolución. Anoten sus observaciones antes y después de esperar un tiempo. a) La reacción es de tipo: b) Completen la ecuación de la reacción: Fe CuSO4 c) Efectúen el balanceo de la ecuación por el método de tanteo: [ 177 ] Química 2 Experimento 3. En un tubo de ensayo chico, limpio y seco, viertan una pequeña cantidad de óxido de mercurio II; calienten el tubo con la llama del mechero usando pinzas, y coloquen una astilla de madera encendida en la boca del tubo. a) La reacción es de tipo: b) Completen la reacción de la ecuación: HgO c) Efectúen el balanceo de la ecuación por el método de tanteo: Experimento 4. En un tubo de ensayo agreguen una pequeña cantidad de sulfato cúprico o sulfato de cobre(II) y 1 mL de ácido clorhídrico. a) La reacción es de tipo: b) Completen la ecuación de la reacción: CuSO4 + HCl c) Efectúen el balanceo de la ecuación por el método de tanteo: Conclusiones Anota las observaciones de cada experimento. 1. 2. 3. 4. [ 178 ] Prácticas de laboratorio Práctica 3 Balanceo de ecuaciones Introducción La Ley de Lavoisier dice que “La masa no se crea ni se destruye, sólo se transforma”, y trata de explicar que la suma de las masas reaccionantes es igual a la suma de las masas de los productos de la reacción. Objetivo Comprobar experimentalmente el fundamento de la Ley de Lavoisier. Material y sustancias Material 1 cápsula de porcelana 1 balanza granataria 1 mechero de Bunsen 1 soporte universal 1 tela de asbesto 1 pinzas para crisol 1 cucharilla Sustancias Bicarbonato de sodio Información El carbonato ácido de sodio (o bicarbonato de sodio) se descompone por calentamiento, de acuerdo con la siguiente ecuación: NaHCO3(s) Na2CO3(s) + CO2( g) + H2O Con base en los pesos moleculares de cada sustancia expresada en gramos (tomar en cuenta que primero debe balancearse la ecuación, revisa el inciso a), ¿qué cantidad de reactivos intervienen? , y qué cantidad de productos se obtienen en la reacción? a) La ecuación balanceada es: 2 NaHCO3(s) Na2CO3(s) + CO2(g) + 3 H2O b) Los pesos moleculares de cada compuesto con base en la tabla periódica son: Compuestos NaHCO3 Na2CO3 CO2 H2O Peso molecular [ 179 ] Química 2 c) Los coeficientes de la ecuación indican el número de veces que se encuentra presente el peso molecular anterior (p.m.); por tanto, si se expresa el p.m. en g, la ecuación balanceada indica que: g de NaHCO3 se descomponen para producir g de Na2CO3, + g de CO2 y g de H2O. d) La suma de los pesos moleculares (expresada en g) de las sustancias reaccionantes es de g; y la suma de los pesos moleculares de las sustancias resultantes es de g. e) Entonces, la suma de los p.m. (en g) de las sustancias reaccionantes es: que las sustancias resultantes. f) Este enunciado corresponde a la ley de: ( 1. Conservación de la energía 2. Conservación de la masa 3. Proporciones constantes mayor/igual/menor ) Experimentación Con el fin de no desperdiciar mucho reactivo en la comprobación experimental, utilizaremos el 20% de la cantidad que obtuvimos en el inciso c (de reactivo), por lo que teóricamente: g de NaHCO3 se descomponen para producir g de Na2CO3(sólido), más g de CO2(gas) y g de H2O(vapor). 1. Pesen una cápsula de porcelana limpia y seca. Anoten el peso: g. 2. Al peso medido de la cápsula de porcelana, súmenle los g de NaHCO3 calculados anteriormente (20%), anoten el peso y coloquen esa cantidad de NaHCO3 (20%) en la cápsula de porcelana. Cápsula + NaHCO3 g 3. Calienten la cápsula con NaHCO3 durante 10 min. 4. Una vez que se haya enfriado la cápsula de porcelana vuelvan a pasar la cápsula con la nueva sustancia obtenida. [ 180 ] Prácticas de laboratorio Conclusión a) Al descomponerse en el experimento anterior producen g de Na2CO3. g de NaHCO3, se b) La ley de conservación de la masa afirma que si antes de la reacción el peso del reactivo era de g, entonces el peso total de los productos será de g. c) Por tanto, la suma total de productos que se escaparon en forma de gas y vapor es de g. d) Comparando los resultados numéricos, tenemos que al descomponerse el NaHCO₃ se obtuvieron: Na2CO3 (s) CO2 (g) H2O (vapor) Teóricamente Experimentalmente [ 181 ] Química 2 Práctica 4 Estequiometría Introducción La estequiometría es la rama de la química que se ocupa de las cuantificaciones y relaciones matemáticas de las reacciones químicas. Se fundamenta en cuatro leyes que son: •• Ley de Lavoisier •• Ley de Proust •• Ley de Dalton •• Ley de Richter-Wensell Objetivo Comprobar experimentalmente una de las cuatro leyes en que se basa la estequiometría, como la Ley de Proust. Material y sustancias Material 1 balanza 2 vidrios de reloj 2 cápsulas de porcelana 1 mechero de Bunsen Sustancias KClO3 Carbón vegetal (s) Azufre en polvo (s) Información A partir del KClO₃, carbón y azufre (sólidos) se prepara en forma experimental la materia prima que se usa comúnmente en los juegos pirotécnicos. 1. El KClO₃ en polvo es la sustancia que proporciona el oxígeno para la combustión. 2. El carbón vegetal en polvo es la sustancia combustible. 3. El azufre en polvo también es combustible y sirve para homogeneizar el calor. Si se desea que exista la mayor probabilidad de que la reacción sea completa se tienen dos hipótesis: a) Hay una proporción fija y constante de sustancias reaccionantes. b) Hay cualquier proporción de sustancias reaccionantes. [ 182 ] Prácticas de laboratorio Nota: Con base en lo anterior, se preparan 2 reacciones considerando a) y b) en: •• Reacción a •• Reacción b Experimentación Reacción a). La ecuación de la reacción es: (balancear) KClO3 (s) + C (s) + S (s) KCl (s) + K2S (s) + SO2 (s) + CO2 (g) + Cl2 (g) Los coeficientes de la ecuación balanceada indican que: 1. Para el KClO3: son necesarios a g de KClO3. moles de KClO3, que equivalen 2. Para el carbono: son necesarios g de C. moles de C, que equivalen a 3. Para el azufre: son necesarios g de S. moles de S, que equivalen a Los datos anteriores establecen las relaciones fijas y constantes entre el KClO₃, C y S con base en la ecuación balanceada. Con el fin de utilizar pequeñas cantidades de sustancias, usaremos 4.1 g de KClO₃, y por factor de conversión entonces: Pesamos g de C Pesamos g de S Una vez calculadas las cantidades procedan a: 1. Pesar en la balanza. 2. Mezclar las sustancias perfectamente en un vidrio de reloj. 3. En una cápsula de porcelana coloquen 0.3 g de la mezcla y calienten la cápsula con el mechero hasta que haya una reacción. (¡CUIDADO! ¡PRECAUCIÓN!) Reacción b). 1. Pesen en la balanza, por ejemplo, 0.1 g de KClO3, 0.1 g de C y 0.1 g de S (suma total del peso = 0.3 g). 2. Mézclenlos en un vidrio de reloj (sin golpear, ni presionar). [ 183 ] Química 2 3. Coloquen la mezcla en una cápsula de porcelana y caliéntenla con el mechero hasta que haya reacción. (¡CUIDADO!) Comprobación Se comprueba que la reacción es más completa cuando las sustancias reaccionantes se encuentran: (sí/no) a) En proporción fija y constante. b) En proporción variable. La Ley de Proust dice que dos o más sustancias se unen en la misma proporción para dar lugar a determinados compuestos bien definidos. Utilización Envuelvan el resto de la mezcla preparada en la forma siguiente: 1. Doblen una hoja de papel en 2 partes (a lo largo). 2. Doblen la tira resultante en triángulo. En el primer doblez al centro de la tira coloquen la mezcla y doblen nuevamente. Sigan doblando y peguen. Ahora perforen el triángulo con un alambre y colóquenle una mecha. Quémenla con cuidado y fuera del laboratorio. ¡TEN CUIDADO DE NO QUEMAR A NADIE! Al finalizar la práctica, escribe en el siguiente espacio tus conclusiones. [ 184 ] Prácticas de laboratorio Práctica 5 Preparación de disoluciones Objetivo Comprobar experimentalmente la preparación de algunas sustancias porcentuales con un 100% de eficiencia. Material y reactivos Material 2 matraces aforados de 50 mL 1 cuchara de porcelana 1 pipeta graduada de 5 mL 1 piseta con agua destilada 1 probeta de 50 mL 1 vaso de precipitados de 50 mL 1 vaso de precipitados de 100-150 mL 1 balanza granataria 1 propipeta Agitador de vidrio Reactivos Cloruro de sodio Agua destilada Ácido clorhídrico Hidróxido de sodio Experimentación 1. Preparen 50 mL de una disolución acuosa de cloruro de sodio al 18% (m/v). Al realizar el cálculo estequiométrico correspondiente, pesen en el vaso de precipitado de 50 mL exactamente gramos de cloruro de sodio, agréguenle alrededor de 20 mL de agua destilada y disuelvan el soluto con ayuda de un agitador de vidrio. una vez que esté todo disuelto pónganlo cuidadosamente en un matraz aforado de 50 mL, enjuaguen 1 o 2 veces el vaso donde pesaron y el agua con la que enjuagaron pásenla al matraz aforado, agreguen agua destilada hasta la marca de aforo del matraz. Tapen con cuidado el matraz y agiten suavemente para uniformar la disolución. 2. Prepararen 50 mL de una disolución acuosa de ácido clorhídrico al 10% (v/v). Una vez realizado el cálculo estequiométrico, con precaución y con ayuda de una propipeta midan mL de ácido clorhídrico concentrado en una pipeta y viertan el ácido a un matraz aforado de 50 mL. Con una pipeta agreguen agua al matraz hasta la marca de aforación del recipiente; tapen el matraz y agiten suavemente hasta obtener una disolución homogénea. [ 185 ] Química 2 3. Preparen 50 mL de una disolución de hidróxido de sodio al 22% (m/v); pesen el vaso de precipitado en la balanza granataria y calibren a “cero” para eliminar el peso del vaso de precipitado; midan mililitros de agua destilada con la ayuda de una probeta, y vacíen el agua en el mismo vaso de precipitado en donde se encuentra el NaOH. Comprobación a) De acuerdo con tu experiencia previa, al realizar disoluciones qué es mejor utilizar: ¿un vaso de precipitados o un matraz aforado? . ¿Por qué? . b) Menciona algunos productos en los que sus etiquetas indiquen que se encuentran en disoluciones porcentuales: Al finalizar la práctica, escribe en el siguiente espacio tus conclusiones. [ 186 ] Prácticas de laboratorio Práctica 6 Ácidos y bases Objetivo Conocer algunas propiedades de ácidos, bases y sales comunes mediante la experimentación. Material y sustancias Material Sustancias Disolución problema A Disolución problema B Disolución problema C Disolución problema D Fenolftaleína Naranja de metilo 8 tubos de ensayo de 5 mL 8 portaobjetos 4 goteros 1 cinta adhesiva 1 pipeta graduada de 5 mL 1 propipeta Papel tornasol Papel pH Experimentación 1. En una gradilla coloquen cuatro tubos de ensayo y etiquétenlos con los números 1 al 4. 1 2 3 4 2. Viertan 2 mL de agua destilada en cada uno de los tubos y después agreguen lo que se indica a continuación: •• 2 gotas de disolución A al tubo núm. 1. •• 2 gotas de disolución B al tubo núm. 2. •• 2 gotas de disolución C al tubo núm. 3. •• 2 gotas de disolución D al tubo núm. 4. Agiten vigorosamente los tubos. 3. Con un pedacito de papel indicador, inclinen cada tubo y humedezcan el papel con la disolución. Retírenlo y anoten sus observaciones en la tabla que se muestra enseguida. [ 187 ] Química 2 Número de tubo Papel tornasol-azul Papel pH Papel tornasol-rosa 1 2 3 4 ¿Qué ión causa el cambio de coloración de los papeles indicadores en cada uno de los casos? . 1 2. 3. 4. 4. Coloquen unas gotas de cada uno de los tubos en cuatro portaobjetos, según corresponda: tubo núm. 1 en portaobjetos núm. 1, y así sucesivamente. Añadan unas gotas de fenolftaleína y anoten sus observaciones en la siguiente tabla. Número de tubo Número de portaobjeto Color de la fenolftaleína Observaciones 1 2 3 4 5. Repitan la operación anterior usando, en lugar de fenolftaleína, unas gotas de naranja de metilo. Anoten sus observaciones en la siguiente tabla. Número de tubo Número de portaobjeto Color del naranja de metilo Observaciones 1 2 3 4 6. De acuerdo con las observaciones realizadas, identifiquen cada una de las sustancias problema como ácidos, bases o sales. Número de tubo 1 2 3 4 [ 188 ] Contenido Viraje de indicador Tipo de sustancia Prácticas de laboratorio Comprobación a) Como has podido comprobar, existen diferentes tipos de indicadores, sólidos y líquidos, ¿cuál crees que sea más preciso? . ¿Por qué? . b) Si tuvieras una sustancia sólida y quisieras conocer su pH, ¿cuál sería el procedimiento que seguirías? ¿Podrías (si conocieras su fórmula química) intuir si sería ácida o básica? Al finalizar la práctica, escribe en el siguiente espacio tus conclusiones. [ 189 ] Química 2 Práctica 7 Titulación Introducción La titulación es un procedimiento por medio del cual se calcula la concentración de un volumen X de sustancia problema a partir de la concentración. Objetivo Calcular la concentración de sustancias problema a partir de la concentración y volumen conocidos, mediante la técnica de titulación. Material y reactivos Material 1 soporte universal 1 matraz Erlenmeyer de 50 mL 1 bureta de 25 mL 1 pipeta de 10 mL Papel pH 1 pinzas para sujetar bureta 1 propipeta Reactivos HCl NaOH 0.5 N Fenolftaleína Experimentación 1. En un matraz Erlenmeyer, agreguen 10 mL de HCl (ácido clorhídrico) y añadan 5 gotas de fenolftaleína (indicador). 2. En una bureta coloquen 20 mL de NaOH (hidróxido de sodio) 0.5 N y colóquenla en un soporte universal, como se muestra en la figura. 3. Abran la válvula de la bureta para que la disolución NaOH de 0.5 N caiga poco a poco en el matraz que contiene al HCl (concentración desconocida). Agiten el matraz, en forma circular, después de cada gota adicionada de disolución de NaOH hasta el momento en que se observe un cambio o vire en coloración la sustancia que contiene el matraz. [ 190 ] Prácticas de laboratorio 4. Cierren la válvula de la bureta al momento de que observen el viraje de color. 5. Observen en la bureta el volumen gastado y anótenlo: mL. 6. Efectúen los cálculos, sustituyendo valores en la siguiente ecuación: V1N1 V2N2 V1 Volumen del ácido N1 Concentración del ácido V2 Volumen de la base N2 Concentración de la base Si despejamos N1 la ecuación queda como sigue: N1 V2 N2 V1 Conclusión La concentración del HCl es: N. [ 191 ] Química 2 Práctica 8 El carbono Introducción El carbono es uno de los elementos más abundantes de la naturaleza, se encuentra en estado libre (con estructuras cristalinas y amorfas) o combinado formando compuestos (como el dióxido de carbono, los carbonatos y los compuestos orgánicos derivados del petróleo). Objetivo Identificar algunas propiedades físicas y químicas del carbono. Material y sustancias Material 1 cápsula de porcelana 1 mechero de Bunsen 1 pinzas para crisol 4 vidrios de reloj 4 tubos de ensayo de 5 mL Abatelenguas Trozo de plástico Hueso de pollo Hoja de papel Sustancias Aceite Alcohol etílico Agua de la llave Experimentación 1. Toma la hoja de papel con las pinzas y quémala con la flama del mechero. Recibe el residuo en un vidrio de reloj. 2. Realiza cuidadosamente la misma operación con el abatelenguas, el trozo de plástico y el hueso de pollo. 3. Toma un trozo pequeño de cada uno de los residuos carbonizados obtenidos y compara su dureza. 4. Anota el resultado de tus observaciones en la tabla de resultados. 5. Observa el color de cada una de las muestras: •• Carbón vegetal (papel y abatelenguas) •• Negro de humo (plástico) •• Carbón animal (hueso de pollo). 6. Registra tus observaciones en el cuadro correspondiente. [ 192 ] Prácticas de laboratorio 7. Deposita en cada uno de los tubos de ensayo una muestra de los diferentes carbonos obtenidos, agrégales agua y agita los tubos. Comprueba la solubilidad de los diferentes residuos de carbones en agua y registra tus observaciones. 8. Repite el procedimiento anterior usando como disolvente el alcohol. 9. Repite el procedimiento anterior esta vez usando como disolvente el aceite. Verificación Carbón obtenido Blando/ duro Color Soluble en agua Soluble en alcohol Soluble en aceite Vegetal (papel) Vegetal (abatelenguas) Negro de humo (plástico) Animal (hueso de pollo) Conclusión 1. El color característico de los carbonos artificiales amorfos es: a) Gris b) Negro c) Café d) Rojo 2. L as sustancias que contienen carbono al calentarse en presencia de aire arden porque son: a) Inertes b) Detonantes c) Combustibles d) Comburentes 3. La solubilidad del carbono es una propiedad: a) Física b) Química c) Biológica d) Propia [ 193 ] Química 2 Práctica 9 Grupos funcionales Introducción Al grupo de átomos que define la estructura de una familia específica de compuestos orgánicos y que determina la semejanza de sus propiedades, se le llama grupo funcional. Nombre Grupo funcional Compuesto Alcoholes Hidroxilo Etanol Aldehídos Carbonilo Metanal Cetonas Carbonilo Propanona Ácidos carboxílicos Carboxilo Ácido etanóico Ésteres Carboxilato Etanoato de etilo Éteres Éter Dietiléter Aminas Amino Metilamina Haluros Halógeno Triclorometano Objetivo Verificar las propiedades de algunas sustancias representativas de compuestos. Material y sustancias Material 8 tubos de ensayo de 10 mL 1 gradilla 1 pipeta de 10 mL 8 etiquetas 1 propipeta Sustancias 10 mL de acetona 10 mL de formol 50 mL de alcohol etílico 10 mL de vinagre 40 mL de agua 10 mL de éter etílico 10 mL de disolución de acetato de sodio 10 mL de metilamina 10 mL de cloroformo Desarrollo 1. Numera los tubos y colócalos en la gradilla. 2. Vierte en los tubos de ensayo 4 mL de cada una de las sustancias orgánicas, auxíliate con la pipeta y límpiala al cambiar de sustancia para no contaminar las muestras. 3. Observa el color, olor, estado de agregación y textura de cada muestra y completa el cuadro correspondiente. [ 194 ] Prácticas de laboratorio 4. Agrega a cada tubo 4 mL de agua, agítalos y déjalos reposar durante 1 minuto, fíjate en lo que ocurre y registra tus observaciones. 5. L ava perfectamente cada uno de los tubos de ensayo, sécalos y vuélvelos a colocar en la gradilla. 6. Adiciona nuevamente a cada uno de los tubos 4 mL de cada sustancia, vacía en cada tubo 4 mL de alcohol y agita vigorosamente. Espera 1 minuto y observa si ocurre algún cambio en ellos. Registra tus observaciones en el espacio indicado. Verificación Sustancia Grupo funcional Color Olor Textura Soluble en agua Soluble en alcohol Conclusión 1. El vinagre pertenece a la familia o función química de los: a) alcoholes b) ésteres c) ácidos d) aldehídos 2. El formol es un compuesto que tiene el grupo funcional: a) hidroxilo b) carbonilo c) carboxilo d) éter 3. ¿Cuál inciso representa al grupo funcional éter? a) −OH b) ) −O− c) −COOH d) −CO− [ 195 ] Glosario Ácido: Sustancia que en disolución libera iones H. Alcano: Hidrocarburo saturado con enlaces covalentes C – C sencillos Alcohol: Compuesto aromático que contiene el grupo OH en su molécula. Alqueno: Hidrocarburo insaturado con enlace doble C – C. Alquino: Hidrocarburo insaturado con enlace triple C ≡ C. Autótrofo: Organismo capaz de producir su propio alimento. Biodegradable: Materiales atacados por bacterias y hongos descomponedores y degradados a sustancias simples del tipo del dióxido de carbono y agua. Biología: Ciencia que estudia la vida en general, los seres vivos, los fenómenos vitales, las causas que los provocan y las leyes que rigen la existencia. Catalizador: Sustancia que aumenta o disminuye la velocidad de las reacciones, sin formar parte de ellas. Celulosa: Polímero biológico de la glucosa. Combustible: Sustancia que como fuente de energía genera calor, que arde o prende. Covalente: Tipo de enlace entre átomos donde existe compartición de electrones. Desarrollo sustentable o sostenible: Modelo de crecimiento económico global que satisface las necesidades actuales de la humanidad sin comprometer la capacidad de las futuras generaciones para satisfacer sus propias necesidades. Destilación fraccionada: Método de separación de sustancias en diversos componentes. Enzima: Proteína con función catalizadora. Fotosíntesis: Reacción bioquímica donde las plantas fabrican glucosa, mediante el CO2 del aire, el agua y los rayos del Sol. Hidrofóbico: Que no se combina con el agua. Metabolismo: Conjunto de reacciones biológicas de transformación de sustancias precursoras a derivados. Miscible: Que se puede mezclar. Reciclar: Volver a aprovechar distintos tipos de residuos. Recursos naturales: Totalidad de las materias primas y/o medios de producción, que proceden de la naturaleza, aprovechables por el ser humano. Saponificación: Término que significa generación de jabón. Transgénico: Se dice de un ser vivo en el que se ha introducido material genético de otra especie para provocar la aparición de caracteres nuevos. [ 196 ] Bibliografía Carballo, C., Ibáñez, S. y B. Varela (1999). Documento base de la estrategia nacional de educación ambiental para la República Argentina. Buenos Aires: Programa de Desarrollo Institucional Ambiental. Componente Educación Ambiental, Secretaría de Recursos Naturales y Desarrollo Sustentable. Choppin, G. R. et al. (1994). Química. México: Publicaciones Cultural. Dickson, T. R. (2003). Química. Enfoque ecológico. México: Limusa. Diccionario Actual de la Lengua Española. Barcelona: Biblograf. Fernández, S. in litt. Definiciones sobre medio ambiente. Garzón, G. (1997). Fundamentos de química general. México: McGraw-Hill. Holum, J. R. (1996). Introdución a los principios de química. México: Limusa. Microsoft (1998). Enciclopedia Microsoft Encarta. Miller, A. (1993). Química básica. México: Harla. Maron, Samuel H. y Carl F. P. (1980). Fundamentos de fisicoquímica. México: Limusa. Morrison, B. (1976). Química orgánica. Bogotá: Fondo Educativo Interamericano. Mosqueira R. S. (2004). Introducción a la química y el ambiente. México: Editorial Patria. Recio del Bosque, F. (2005). Química inorgánica, 3a. ed. México: McGraw-Hill Interamericana/(1977). Seese, William, y William Daub, (1996). Química. México: Prentice-Hall. Sienko, M. J. y Plane R. (1965). Química. España: Aguilar. Sonnessa, A. J. y Ander P. (2000). Principios de química. Introducción a los conceptos teóricos. México: Limusa-Noriega. T. Flores, García, Ramírez. (1990). Química. México: Publicaciones Cultural. Williamson, M. (1996). Biological Invasions. Londres: Chapman y Hall. Sitios electrónicos http://es.wikipedia.org/wiki/Petr%C3%B3leo http://ocwus.us.es/quimica-organica/quimica-organica-i/temas/3_conformaciones_de_ alcanos_y_ciclo_alcanos/leccion_4/page_03.htm http://www.insht.es/InshtWeb/Contenidos/Documentacion/TextosOnline/EnciclopediaOIT/ tomo4/104_07.pdf http://www.sinorg.uji.es/Docencia/APMQ/TEMA2AQO.pdf http://www.sinorg.uji.es/Docencia/QO/tema1QO.pdf http://www.sinorg.uji.es/Docencia/QO/tema6QO.pdf http://www.hiru.com/es/kimika/kimika_02800.html http://www.rena.edu.ve/cuartaEtapa/quimica/Tema14.html http://books.google.co.ve/books?id=j-j6oO02-iMC&pg=PA92&lpg=PA92&dq=haluro+primari o+mas+nitrato+de+p... http://www.monografias.com/trabajos74/hidrocarburos-alifaticos-saturados-insaturados/ hidrocarburos-alifaticos-saturados-insaturados2.shtml#ixzz2hdi5rtCt [ 197 ] Tabla periódica de los elementos Química 2 [ 198 ]