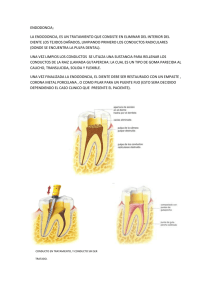
Regenerative-endodontics-a-review-of-current-status-and-a-call-for-action-Murray-2007 (1)
Anuncio

Machine Translated by Google Artículo de revisión Endodoncia regenerativa: una revisión del estado actual y un llamado a la acción Peter E. Murray, BSc(Hons), PhD,* Franklin Garcia-Godoy, DDS, MS,† y Kenneth M. Hargreaves, DDS, PhD‡ Resumen Cada año se salvan millones de dientes gracias a la terapia de conducto. Aunque las modalidades de tratamiento actuales ofrecen una alta Cada se gastan aproximadamente mil millones el tratamiento de estadounidenses que sufren algún tipo deaño pérdida de tejido o insuficiencia $400 orgánica terminal.en Esto incluye 20.000 trasplantes de órganos, niveles de éxito para muchas condiciones, una forma ideal de 500,000 reemplazos articulares y millones de procedimientos craneofaciales dentales y orales, terapia podría consistir en enfoques regenerativos en los que que van desde restauraciones dentales hasta reconstrucción mayor de faciales blandos y mineralizados los tejidos pulpares enfermos o necróticos se eliminan y se reemplazan con tejidos (1). Se espera que la regeneración o reposición de los tejidos orales afectados por enfermedades hereditarias, tejido pulpar sano para revitalizar los dientes. Los investigadores están traumatismos y enfermedades neoplásicas o infecciosas resuelvan muchos problemas dentales. trabajando para alcanzar este objetivo. Regenerador problemas. En los próximos 25 años, avances sin precedentes en odontología y endodoncia La endodoncia es la creación y entrega de tejidos a están programados para llevarse a cabo, con la disponibilidad de dientes, huesos, órganos y tejidos orales artificiales reemplazar la pulpa enferma, faltante y traumatizada. Esta revisión (2, 3); así como la capacidad de estimular la regeneración endodóntica (4), reemplazar proporciona una descripción general de la endodoncia regenerativa. tejidos (5) producen vacunas contra virus (6) y alteran genéticamente enfermedades y sus objetivos, y describe posibles técnicas que patógenos para ayudar a erradicar la caries y la periodontitis (7). Demanda de tejido por parte del paciente permitir que la endodoncia regenerativa sea una realidad. Estas la terapia de ingeniería es asombrosa tanto en alcance como en costo. La especialidad de endodoncia puede enfoques potenciales incluyen la revascularización del conducto radicular, ser capaz de adoptar muchos de estos nuevos avances científicos que surgen de la regeneración terapia postnatal (adulta) con células madre, implante pulpar, andamio medicina, desarrollando así procedimientos de endodoncia regenerativa y mejorando la atención al paciente. implante, impresión celular tridimensional, andamios inyectables y terapia génica. Estas endodoncias regenerativas Los procedimientos de endodoncia regenerativa pueden definirse como procedimientos de base biológica las técnicas posiblemente incluirán alguna combinación de desinfección o diseñados para reemplazar estructuras dañadas, incluidas la dentina y las estructuras radiculares, así como desbridamiento de los sistemas de conductos radiculares infectados así como células del complejo pulpa-dentina. Los procedimientos dentales regenerativos tienen una larga con agrandamiento apical para permitir la revascularización y historia, que se originó alrededor de 1952, cuando el Dr. BW Hermann informó sobre la aplicación uso de células madre adultas, andamios y factores de crecimiento. de Ca(OH)2 en un reporte de caso de amputación pulpar vital (8). Regenerativo posterior Aunque los desafíos de introducir tejido endodóntico Los procedimientos dentales incluyen el desarrollo de tejido guiado o regeneración ósea. las terapias de ingeniería son sustanciales, los beneficios potenciales para (GTR, GBR) procedimientos y distracción osteogénica (9); la aplicación de plaquetas los pacientes y la profesión son igualmente fundamentales rico en plasma (PRP) para el aumento óseo (10), Emdogain para la regeneración del tejido periodontal (11) y rotura. La demanda de los pacientes es asombrosa tanto en alcance como en proteína morfogénica ósea humana recombinante (rhBMP) para costo, porque la terapia de ingeniería de tejidos ofrece la posibilidad de aumento óseo (12); y ensayos preclínicos sobre el uso del factor de crecimiento de fibroblastos 2 restaurar la función natural en lugar de cirugía (FGF2) para la regeneración del tejido periodontal (13). A pesar de estas aplicaciones y la colocación de una prótesis artificial. Al proporcionar una visión general de considerable evolución de ciertos procedimientos médicos de regeneración tisular, en particular los trasplantes de las cuestiones metodológicas necesarias para desarrollar médula ósea, no ha habido traslación significativa de ninguno de estos posibles terapias de endodoncia regenerativa, esperamos terapias en la práctica clínica endodóntica. presentar un llamado a la acción para desarrollar estas terapias para uso clínico. (J Endod 2007;33:377–390) Los objetivos de los procedimientos de endodoncia regenerativa son regenerar pulpa-como tejido, idealmente, el complejo pulpa-dentina; regenerar la dentina coronal dañada, como después de una exposición cariosa; y regenerar la dentina radicular, cervical o apical reabsorbida. Palabras clave La importancia del aspecto endodóntico de la ingeniería de tejidos ha sido destacada por Factores de crecimiento, regeneración pulpar, andamios, células madre, el Instituto Nacional de Investigación Dental y Craneofacial (http://www.nidr.nih.gov/ Ingeniería de tejidos espectro/NIDCR4/4menu.htm). Una visión general de la medicina regenerativa Del *Departamento de Endodoncia, Facultad de Odontología La medicina regenerativa es prometedora para la restauración de tejidos y órganos Medicina, Universidad Nova Southeastern, Fort Lauderdale, Florida; † Decano Asociado de Investigación, Facultad de Medicina Dental, dañado por enfermedad, trauma, cáncer o deformidad congénita. Medicina regenerativa Universidad del Sudeste de Nova, Fort Lauderdale, Florida; y y factores bioquímicos adecuados para mejorar o reemplazar las funciones biológicas en un esfuerzo ‡ Departamento de Endodoncia, Centro de Ciencias de la Salud de la Universidad de Texas, San Antonio, Texas. Dirija las solicitudes de reimpresiones al Dr. Peter Murray, Department of Endodontics, College of Dental Medicine, Nova South tal vez se puede definir mejor como el uso de una combinación de células, materiales de ingeniería, para lograr el avance de la medicina. La base de la medicina regenerativa es la utilización de terapias de ingeniería de tejidos. Probablemente la primera definición de ingeniería de tejidos fue de Langer y Vacanti (14) quienes afirmaron que era “un campo interdisciplinario que Eastern University, Fort Lauderdale, FL 33328. Dirección de correo electrónico: aplica los principios de la ingeniería y las ciencias de la vida hacia el desarrollo de [email protected]. sustitutos biológicos que restauran, mantienen o mejoran la función de los tejidos”. macarthur 0099-2399/$0 - ver el asunto inicial y Oreffo (15) definieron la ingeniería de tejidos como “comprender los principios de la Copyright © 2007 por la Asociación Americana de crecimiento, y aplicar esto para producir tejido de reemplazo funcional para uso clínico”. Endodoncistas. doi:10.1016/j.joen.2006.09.013 JOE — Volumen 33, Número 4, abril de 2007 Nuestra propia descripción continúa diciendo que “la ingeniería de tejidos es el empleo de Endodoncia Regenerativa 377 Machine Translated by Google Artículo de revisión Se cree que muchos aspectos de la endodoncia regenerativa son recientes. inventos; sin embargo, la larga historia de investigación en estos campos puede ser sorprendente. En esta revisión se proporciona una breve descripción de los posibles tipos de terapias de odontología final regenerativa. Células madre adultas La medicina regenerativa resuelve problemas médicos utilizando Las células como materiales de ingeniería. Las aplicaciones potenciales incluyen artificial piel compuesta de fibroblastos vivos (22), cartílago reparado con condrocitos (23), u otros tipos de células utilizadas de otras maneras. lo mas Las células valiosas para la medicina regenerativa son las células madre, con un énfasis traslacional en el uso de células madre posnatales o adultas. Células madre son muy prometedores en la medicina regenerativa, pero todavía hay muchos preguntas sin respuesta que tendrán que ser abordadas ante estas células Figura 1. Los principales dominios de investigación requeridos para desarrollar regenerativos procedimientos de endodoncia. se puede utilizar de forma rutinaria en los pacientes, especialmente en lo que respecta a la seguridad de la procedimiento. El potencial para la regeneración del tejido pulpar a partir de implantes Las células madre aún no se han probado en animales ni en ensayos clínicos. Extenso estrategias terapéuticas biológicas dirigidas al reemplazo, reparación, mantenimiento y/o mejora de los ensayos clínicos para evaluar la eficacia y la seguridad están por venir antes de que sea probable la función tisular”. Los cambios a la la Administración de Drogas y Alimentos (FDA) aprobará regenerativos definición de ingeniería de tejidos a lo largo de los años son impulsadas por científicos Procedimientos de endodoncia con células madre. Progreso. Aunque puede haber muchas definiciones diferentes de medicina regenerativa, en la Todos los tejidos se originan a partir de células madre (24). Una célula madre es comúnmente práctica el término ha llegado a representar aplicaciones definida como una célula que tiene la capacidad de dividirse y producir continuamente que reparan o reemplazan tejidos estructurales y funcionales, incluidos huesos, células progenie que se diferencian (desarrollan) en varios otros tipos de cartílago y vasos sanguíneos, entre órganos y tejidos (16). células o tejidos (25). Las células madre se definen comúnmente como embrionarias/fetales o El contraargumento al desarrollo de los procedimientos odontológicos finales regenerativos adultas/postnatales (26). Preferimos el término embrionario, es que la pulpa en un diente completamente desarrollado no juega ningún papel. en lugar de fetal, porque la mayoría de estas células son embrionarias. Nosotros papel principal en la forma, función o estética, y por lo tanto su sustitución por una También prefiero el término postnatal, en lugar de adulto, porque estos mismos El material de obturación en la terapia de conducto radicular convencional es el más práctico. Las células están presentes en bebés, bebés y niños. La razón por la que es tratamiento; respetuosamente, no estamos de acuerdo con esta opinión. En cuanto a la estética, importante distinguir entre células madre embrionarias y posnatales es existe un riesgo potencial de que los materiales de obturación y selladores endodónticos porque estas células tienen un potencial diferente para convertirse en varios decolorar la corona del diente (17, 18). Además, un estudio in vitro de células especializadas (es decir, plasticidad). Los investigadores han encontrado tradicionalmente los dientes humanos tratados endodónticamente encontraron el intracanal a largo plazo la plasticidad de las células madre embrionarias sea mucho mayor que la de la colocación de hidróxido de calcio puede reducir la resistencia a la fractura de células madre posnatales, pero estudios recientes indican que las células madre posnatales dentina radicular (19). Un estudio retrospectivo de los tiempos de supervivencia de los dientes después de son más plásticos de lo que se imaginaba (27). La plasticidad de la célula madre el relleno del conducto radicular versus la restauración del diente encontró que aunque el tratamiento del conducto radicular define su capacidad para producir células de diferentes tejidos (28). Las células madre son terapia prolonga la supervivencia del diente, la eliminación de la pulpa en un compromiso también comúnmente subdividido en totipotente, pluripotente y multipotente el diente todavía puede conducir a la pérdida del diente en comparación con los dientes normales categorías según su plasticidad, como se muestra en la Tabla 1. tejidos (20). Por otro lado, aunque la pulpa de reemplazo tiene la La mayor plasticidad de las células madre embrionarias hace que estas células potencial para revitalizar los dientes, también puede volverse susceptible a más más valioso entre los investigadores para desarrollar nuevas terapias (29). enfermedad de la pulpa y puede requerir un nuevo tratamiento. La implantación de tejidos Sin embargo, el origen de las células madre embrionarias es controvertido y es modificados también requiere métodos mejorados de control microbiológico necesarios para una rodeado de cuestiones éticas y legales, lo que reduce el atractivo adecuada regeneración de tejidos. Por lo tanto, se deben realizar investigaciones adicionales en de estas células para el desarrollo de nuevas terapias. Esto explica por qué muchos terapias regenerativas para establecer los investigadores ahora están centrando su atención en el desarrollo de terapias con células madre y métodos seguros para todos los dientes que requieren tratamiento de conducto. En el utilizando células madre posnatales donadas por los propios pacientes o En el futuro, el alcance de la endodoncia regenerativa puede ampliarse para incluir el reemplazo de sus parientes cercanos. La aplicación de la terapia postnatal con células madre fue tejidos periapicales, ligamentos periodontales, encía e incluso dientes completos. Esto daría a los lanzado en 1968, cuando se realizó el primer trasplante alogénico de médula ósea. pacientes una clara alternativa a utilizado con éxito en el tratamiento de la inmunodeficiencia combinada grave (30). Desde la década los implantes dentales artificiales que están actualmente disponibles (21). Por lo tanto, la de 1970, los trasplantes de médula ósea se han utilizado El potencial para esta área es realmente enorme. para tratar con éxito la leucemia, el linfoma, diversas anemias y trastornos genéticos Los principios de la medicina regenerativa se pueden aplicar para acabar con la ingeniería trastornos (31). Las células madre posnatales se han obtenido de umbilical de tejidos odontológicos. La endodoncia regenerativa comprende la investigación en células madre sangre del cordón umbilical, médula ósea, sangre periférica, grasa corporal, adultas, factores de crecimiento, cultivo de órganos y tejidos y y casi todos los tejidos corporales (32), incluido el tejido pulpar de los dientes (33). materiales de ingeniería de tejidos (Fig. 1). A menudo, estas disciplinas se combinan, en lugar de usarse individualmente para crear terapias regenerativas. Uno de los primeros investigadores de células madre fue el Dr. John Enders, quien recibió el Premio Nobel de Medicina en 1954 por cultivar el virus de la poliomielitis en TABLA 1. Tipos de células madre Tipo de célula madre plasticidad celular Fuente de células madre Totipotente Cada célula puede convertirse en un nuevo individuo. Células de embriones tempranos (1 a 3 días) Pluripotente Las células pueden formar cualquier tipo de célula (más de 200) Algunas células de blastocisto (5 a 14 días) Multipotente Células diferenciadas, pero pueden formar un número de otros tejidos Tejido fetal, sangre del cordón umbilical y células madre posnatales, incluidas 378 Murray et al. células madre de la pulpa dental JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión células de riñón embrionario humano (34). En 1998, el Dr. James Thomson aisló células líneas y cultivos de órganos celulares elimina los problemas de recolectar células del de la masa celular interna del embrión temprano y desarrolló las primeras líneas de células paciente y esperar semanas para que se formen tejidos de reemplazo en cultivos de madre embrionarias humanas (35). En 1998, el Dr. John Gearhart derivó células germinales tejidos de órganos celulares (57). Sin embargo, las desventajas más serias de usar líneas embrionarias humanas a partir de células del tejido gonadal fetal (células germinales celulares preexistentes de donantes para tratar pacientes son los riesgos de rechazo primordiales) (36). Se desarrollaron líneas de células madre pluripotentes a partir de inmunológico y transmisión de patógenos (45). Se ha demostrado que el uso de células células embrionarias donadas. En 2001, el presidente de los Estados Unidos, George W. alogénicas donadas, como los fibroblastos dérmicos de la piel delantera humana, es Bush, restringió la financiación federal a líneas de células embrionarias preexistentes. De inmunológicamente seguro y, por lo tanto, una opción viable para la ingeniería de tejidos estas 78 líneas de células embrionarias preexistentes, 7 eran duplicados, 31 no estaban de la piel de las víctimas de quemaduras (58). La FDA ha aprobado varias empresas que disponibles, 16 murieron después de la descongelación y 2 se retiraron o aún están en producen piel para víctimas de quemaduras utilizando fibroblastos dérmicos donados (59). desarrollo, y las 22 líneas celulares restantes disponibles no demostraron ser muy útiles La misma tecnología se puede aplicar para reemplazar los tejidos pulpares después de la para muchos científicos ( 37). Esto restringió a la mayoría de los investigadores terapia del conducto radicular, pero aún no se ha evaluado ni publicado. estadounidenses de trabajar con células madre embrionarias. Las limitaciones legales y el gran debate ético relacionado con el uso de células madre embrionarias deben resolverse antes de que el gran potencial de las células madre embrionarias donadas Las células xenogénicas son aquellas aisladas de individuos de otra especie. Se han trasplantado células de pulpa dental de cerdo a ratones, y éstas han formado pueda usarse para regenerar tejidos enfermos, dañados y faltantes como parte de futuros estructuras de corona dental (60, 61). Esto sugiere que es factible lograr la terapia inversa, tratamientos médicos. En consecuencia, existe un mayor interés en las células madre eventualmente utilizando células madre de pulpa animal donadas para crear tejidos posnatales autógenas como una fuente alternativa para aplicaciones clínicas, porque estas dentales en humanos. En particular, las células animales se han utilizado bastante en células están fácilmente disponibles y no tienen problemas de inmunogenicidad, aunque experimentos destinados a la construcción de implantes cardiovasculares (62). La pueden tener una plasticidad reducida. recolección de células de animales donantes elimina la mayoría de los problemas legales y éticos asociados con la obtención de células de otros humanos. Sin embargo, persisten Las células madre a menudo se clasifican según su origen: la aplicación clínica más práctica de una terapia con células madre sería usar las propias células del donante del muchos problemas, como el alto potencial de rechazo inmunitario y transmisión de patógenos del animal donante al receptor humano (46). El uso futuro de las células madre paciente. Las células madre autólogas se obtienen del mismo individuo al que se le xenogénicas es incierto y depende en gran medida del éxito de las otras terapias con implantarán. La extracción de médula ósea de las propias células madre de un paciente y células madre disponibles. Si los resultados de la regeneración tisular con células madre su reimplantación en el mismo paciente representa una aplicación clínica de las células pulpares alogénicas y autólogas son decepcionantes, entonces el uso de células madre postnatales autógenas. endodónticas xenogénicas sigue siendo una opción viable para desarrollar una terapia de Las células madre podrían tomarse de la médula ósea (38), sangre periférica (39), grasa regeneración endodóntica. extraída por liposucción (40), ligamento periodontal (41), mucosa oral o piel. Un ejemplo de banco de células autólogas es el que almacena células madre de cordón umbilical (42). Desde una perspectiva médica, entre las células madre más valiosas se encuentran aquellas capaces de diferenciación neuronal, porque estas células tienen el potencial de Células madre pulpares La pulpa dental contiene una población de células madre, llamadas células transformarse en diferentes morfologías celulares in vitro, utilizando factores de inducción madre pulpares (63, 64) o, en el caso de dientes inmaduros, células madre de dientes específicos de linaje; estos incluyen células neuronales, adipogénicas, condrogénicas, deciduos exfoliados humanos (SHED) (65, 66). A veces, las células madre pulpares se miogénicas y osteogénicas (43, 44). Puede ser posible utilizar células madre neuronales denominan células odontoblastoides, porque estas células parecen sintetizar y secretar de la grasa adiposa (43, 44) como parte de la medicina regenerativa en lugar de células matriz de dentina como las células odontoblásticas a las que reemplazan (67). Después de la médula ósea, lo que posiblemente brinde un método alternativo de recolección de un daño pulpar severo o una exposición mecánica o de caries, los odontoblastos a menos doloroso y menos amenazante. Una empresa llamada MacroPore Biosurgery/Cytori menudo se lesionan irreversiblemente debajo del sitio de la herida (68, 69). Los Therapeutics Inc. está comercializando este enfoque, utilizando un proceso de 1 hora para odontoblastos son células diferenciadas terminalmente posmitóticas y no pueden proliferar la purificación de células madre humanas. Las células madre autólogas tienen la menor para reemplazar a los odontoblastos subyacentes irreversiblemente lesionados (70). La cantidad de problemas con el rechazo inmunitario y la transmisión de patógenos (45). fuente de las células odontoblastoides que reemplazan a los odontoblastos y secretan Recolectar las propias células del paciente las hace menos costosas de obtener y evita puentes de dentina reparadora ha resultado ser controvertida. Inicialmente, se sugirió el preocupaciones legales y éticas (46). reemplazo de odontoblastos dañados irreversiblemente por células odontoblastoides predeterminadas que no replican su ADN después de la inducción. Se propuso que las Sin embargo, en algunos casos, es posible que no se disponga de células de donantes adecuadas. Esta preocupación se aplica a personas muy enfermas o de edad avanzada. Una células dentro de la capa rica en células subodontoblásticas o zona de Hohl adyacente a los odontoblastos (71) se diferencian en odontoblastoides. Sin embargo, el propósito de posible desventaja de la recolección de células de los pacientes es que las operaciones estas células parece estar limitado a un papel de apoyo a los odontoblastos, ya que la quirúrgicas pueden provocar secuelas posoperatorias, como la infección del sitio donante (47). supervivencia de estas células estaba vinculada a la supervivencia de los odontoblastos y Las células madre postnatales autólogas también deben aislarse de tejidos mixtos y no se observó actividad proliferativa o regenerativa (68, 69). El uso de timidina tritiada para posiblemente expandirse en número antes de que puedan usarse. Esto lleva tiempo, por estudiar la división celular en la pulpa mediante autorradiografía después del daño (72) lo que algunas soluciones de medicina regenerativa autóloga pueden no ser muy rápidas. reveló un pico en la actividad de los fibroblastos cerca del sitio de exposición Para lograr la regeneración endodóntica, las células más prometedoras son las células aproximadamente 4 días después del éxito del recubrimiento pulpar de los dientes de madre posnatales autólogas (48-51), porque parecen tener las menores desventajas que mono (73). Un estudio autorradiográfico adicional de la formación de puentes de dentina impedirían su uso clínico. en dientes de mono, después de un recubrimiento pulpar directo con hidróxido de calcio durante hasta 12 días (74), ha revelado diferencias en el marcado celular según la Las células alogénicas se originan a partir de un donante de la misma especie (52). Los ejemplos de células alogénicas de donantes incluyen células sanguíneas utilizadas ubicación del sitio de la herida. El etiquetado de células específicas entre los fibroblastos y las células perivasculares cambió de bajo a alto con el tiempo si la exposición se limitaba para una transfusión de sangre (53), células de médula ósea utilizadas para un trasplante a la capa odontoblástica y la zona libre de células, mientras que el etiquetado cambiaba de médula ósea (54) y óvulos donados utilizados para trasplante in vitro (55). Estas células de alto a bajo si la exposición era profunda en el tejido pulpar. . Se marcaron más células donadas a menudo se almacenan en un banco de células, para que las utilicen los cerca del puente de dentina reparadora que en el núcleo pulpar. Los hallazgos pacientes que las necesitan. En contraste con la aplicación de células donadas, existen autorradiográficos no mostraron ningún marcaje en el existente algunas restricciones éticas y legales para el uso de líneas celulares humanas para lograr la medicina regenerativa (56). El uso de células preexistentes JOE — Volumen 33, Número 4, abril de 2007 Endodoncia Regenerativa 379 Machine Translated by Google Artículo de revisión capa de odontoblastos, o en una ubicación pulpar específica. Esto apoyó la teoría de los factores de crecimiento a menudo tienen poco que ver con sus funciones más que las células madre progenitoras de las células odontoblastoides son células importantes y existen debido a las circunstancias históricas en las que surgieron. Por mesenquimales indiferenciadas residentes (75). Los orígenes de estas células pueden ejemplo, Gospadarowicz y colegas (85) encontraron el factor de crecimiento de estar relacionados con los odontoblastos primarios, porque durante el desarrollo del fibroblastos (FGF) en un extracto de cerebro de vaca y lo probaron en un bioensayo diente, solo la población de células derivadas de la cresta neural de la papila dental es que provocó la proliferación de fibroblastos. En la actualidad, se ha identificado una capaz de responder específicamente a la señal inductiva mediada por la membrana variedad de factores de crecimiento, con funciones específicas que se pueden utilizar basal para la diferenciación de odontoblastos (76, 77). La capacidad de los dientes como parte de las terapias de ingeniería tisular y de células madre (86 - 88). jóvenes y viejos para responder a la lesión mediante la inducción de dentinogénesis Se pueden usar muchos factores de crecimiento para controlar la actividad de las reparadora sugiere que una pequeña población de células madre pulpares progenitoras células madre, como aumentar la tasa de proliferación, inducir la diferenciación de las competentes puede existir dentro de la pulpa dental durante toda la vida. Sin embargo, células en otro tipo de tejido o estimular las células madre para sintetizar y secretar el debate sobre la naturaleza de las células madre precursoras de la pulpa que dan matriz mineralizada (89-91). En la Tabla 2 se muestra un resumen de la fuente, la origen a las células odontoblastoides, así como las cuestiones relativas a la actividad y la utilidad de los factores de crecimiento comunes . Si la endodoncia regenerativa va a tener un efecto significativo en la práctica heterogeneidad de la población de la pulpa dental en los dientes adultos, siguen sin resolverse (78). La información sobre los mecanismos por los cuales estas células son clínica, debe centrarse principalmente en proporcionar terapias eficaces para regenerar capaces de detectar y responder a las lesiones dentales es escasa, pero esta información el tejido pulpar funcional e, idealmente, restaurar la estructura dentinaria perdida. Con será valiosa para su uso en el desarrollo de ingeniería de tejidos y terapias de este objetivo, una mayor comprensión de los procesos biológicos que intervienen en la endodoncia regenerativa. reparación de tejidos ha permitido a algunos investigadores imitar o complementar las Uno de los obstáculos más significativos a superar en la creación de tejido respuestas de reparación dental. La dentina contiene muchas proteínas capaces de pulpar de reemplazo para su uso en endodoncia regenerativa es obtener células estimular las respuestas de los tejidos. La desmineralización de los tejidos dentales pulpares progenitoras que se dividan continuamente y produzcan células o tejidos puede dar lugar a la liberación de factores de crecimiento tras la aplicación de agentes pulpares que puedan implantarse en sistemas de conductos radiculares. Las de grabado de cavidades, materiales de restauración e incluso caries (92). De hecho, posibilidades son el desarrollo de una línea autógena de células madre de pulpa es probable que gran parte del efecto terapéutico del hidróxido de calcio se deba a su humana que esté libre de enfermedades y patógenos, y/o el desarrollo de una técnica extracción de factores de crecimiento de la matriz dentinaria (93). Una vez liberados, de trasplante de biopsia de tejido utilizando células de la mucosa oral, como ejemplos. estos factores de crecimiento pueden desempeñar un papel clave en la señalización de El uso de una línea de células madre de pulpa humana tiene la ventaja de que los muchos de los eventos de la dentinogénesis terciaria, una respuesta de la reparación pacientes no necesitan proporcionar sus propias células a través de una biopsia, y que de la pulpa y la dentina (94, 95). las construcciones de tejido pulpar se pueden prefabricar para una implantación rápida cuando se necesiten. Si un paciente proporciona su propio tejido para utilizarlo en la Los factores de crecimiento, especialmente los de la familia del factor de crecimiento transformante beta (TGF), son importantes en la señalización celular para creación de una construcción de tejido pulpar, es posible que el paciente tenga que la diferenciación de odontoblastos y la estimulación de la secreción de matriz de dentina. esperar algún tiempo hasta que las células se hayan purificado y/o aumentado en Estos factores de crecimiento son secretados por los odontoblastos y depositados número. Este último punto se basa en el hallazgo de que muchos tejidos adultos dentro de la matriz de dentina (96), donde permanecen protegidos en forma activa a contienen solo del 1 al 4% de células madre (79), por lo que se necesita purificación y través de la interacción con otros componentes de la matriz de dentina (97). La adición la expansión del número de células permitiría la recolección de biopsias de tejido más de fracciones de proteína de dentina purificada ha estimulado un aumento en la pequeñas. Alternativamente, podrían requerirse fuentes más grandes de tejido autólogo. secreción de matriz de dentina terciaria (98). Otra familia importante de factores de crecimiento en el desarrollo dental (99) y La obtención de células madre para su uso en terapias endodónticas, dentales y médicas es un factor limitante significativo en el desarrollo de nuevas terapias y debería la regeneración (100) consiste en las proteínas morfogénicas óseas (BMP). La BMP2 ser una prioridad importante en la investigación. humana recombinante estimula la diferenciación de células madre pulpares adultas en una morfología odontoblastoide en cultivo (101–103). Los efectos similares de TGF Identificación de células madre Las células madre pueden identificarse y aislarse de poblaciones de células mixtas mediante cuatro técnicas comúnmente utilizadas: (a) teñir las células con B1-3 y BMP7 se han demostrado en cortes de dientes cultivados (104, 105). Las BMP-2, -4 y -7 recombinantes inducen la formación de dentina reparadora in vivo (106-108). Se ha descubierto que la aplicación del factor de crecimiento 1 similar a la insulina humana marcadores de anticuerpos específicos y usar un citómetro de flujo, en un proceso recombinante junto con colágeno induce la formación de puentes de dentina y de llamado clasificación de células con anticuerpos fluorescentes (FACS); (b) selección de dentina tubular completos (109). Esto indica el potencial de agregar factores de perlas inmunomagnéticas; (c) tinción inmunohistoquímica; y (d) criterios fisiológicos e crecimiento antes del recubrimiento pulpar, o incorporarlos en materiales de restauración histológicos, incluyendo fenotipo (apariencia), quimiotaxis, proliferación, diferenciación y endodoncia para estimular la regeneración de la dentina y la pulpa. A más largo plazo, y actividad mineralizante. FACS junto con el marcador proteico CD34 se usa es probable que los factores de crecimiento se utilicen junto con las células madre ampliamente para separar células madre humanas que expresan CD34 de sangre posnatales para lograr el reemplazo de la pulpa dental enferma mediante ingeniería periférica, sangre de cordón umbilical y cultivos celulares (80). Diferentes tipos de tisular. células madre a menudo expresan diferentes proteínas en sus membranas y, por lo tanto, no se identifican con el mismo marcador de proteína de células madre. Las células madre dentales más estudiadas son las de la pulpa dental. Las células madre Una visión general de las tecnologías potenciales para Endodoncia Regenerativa de la pulpa humana expresan el factor de von Willebrand CD146, actina de músculo liso alfa y proteínas 3G5 (81). Las células madre de la pulpa humana también tienen un Hemos identificado varias áreas importantes de investigación que podrían tener fenotipo de fibroblastos, con patrones específicos de actividad de proliferación, diferenciación y mineralización (82). aplicación en el desarrollo de técnicas de endodoncia regenerativa. Estas técnicas son (a) revascularización del conducto radicular a través de la coagulación de la sangre, (b) terapia postnatal con células madre, (c) implantación de Factores de crecimiento Los factores de crecimiento son proteínas que se unen a los receptores de la pulpa, (d) implantación de andamios, (e) entrega de andamios inyectables, (f) impresión de células tridimensionales y (g) administración de genes. Estas técnicas de endodoncia célula e inducen la proliferación y/o diferenciación celular (83). Muchos factores de regenerativa se basan en los principios básicos de la ingeniería tisular ya descritos e crecimiento son bastante versátiles y estimulan la división celular en numerosos tipos incluyen la consideración específica de células, factores de crecimiento y estructuras. de células, mientras que otros son más específicos de células (84). Los nombres de los individuos 380 Murray et al. JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión TABLA 2. Fuente, actividad y utilidad de los factores de crecimiento comunes Abreviatura Factor BMP Proteínas morfogenéticas óseas Fuente principal Matriz ósea osteoblastos y mineralización del hueso LCR Factor estimulante de colonias Una amplia gama de celdas. Utilidad Actividad BMP induce la diferenciación de Los LCR son citocinas que estimulan la proliferación de células BMP se utiliza para hacer que las células madre sinteticen y secreten matriz mineral El LCR se puede utilizar para aumentar el número de células madre madre óseas pluripotentes específicas FEAG Factor de crecimiento epidérmico Glándulas submaxilares EGF promueve la proliferación de células mesenquimales, gliales y epiteliales El EGF se puede utilizar para aumentar el número de células madre FGF IGF ILLINOIS FGF promueve la proliferación de muchas factor de crecimiento de fibroblastos Una amplia gama de celdas. Factor de crecimiento similar a la insulina I o II I - hígado II-variedad de células IGF promueve la proliferación de muchos Interleucinas IL-1 a leucocitos Las IL son citocinas que estimulan las respuestas inmunitarias humoral y células tipos de células IL-13 FGF se puede utilizar para aumentar el número de células madre El IGF se puede utilizar para aumentar el número de células madre Promueve la actividad de las células inflamatorias. celular. PDGF Factor de crecimiento Plaquetas, células endoteliales, placenta derivado de plaquetas TGF- Transformando el factor de crecimiento PDGF promueve la proliferación de tejido conectivo, células musculares lisas y gliales Macrófagos, células cerebrales y queratinocitos TGF- puede ser importante para la cicatrización normal de heridas PDGF se puede utilizar para aumentar el número de células madre Induce el desarrollo de estructuras epiteliales y tisulares. alfa TGF- Transformando el factor de crecimiento-beta Matriz de dentina, activada TGF- es antiinflamatorio, promueve la Células TH1 (T-helper) y células cicatrización de heridas, inhibe la asesinas naturales (NK) proliferación de macrófagos y linfocitos TGF-1 está presente en la matriz de dentina y se ha utilizado para promover la mineralización del tejido pulpar NGF Factor de crecimiento nervioso Proteína secretada por el tejido diana de una neurona El NGF es fundamental para la supervivencia y el mantenimiento de las neuronas simpáticas y sensoriales. Revascularización del conducto radicular a través de la Promueve el crecimiento de las neuronas y la supervivencia de las células neurales se asemeja a la pulpa dental; sin embargo, los informes de casos publicados hasta la coagulación de la sangre Varios informes de casos han documentado la fecha demuestran la formación continua de raíces y la restauración de una respuesta revascularización de los sistemas de conductos radiculares necróticos mediante positiva a la prueba pulpar térmica (110). Otro punto importante es que los pacientes desinfección seguida del sangrado en el sistema de conductos mediante una adultos más jóvenes generalmente tienen una mayor capacidad de curación (120). instrumentación excesiva (110-112). Un aspecto importante de estos casos es el uso de irrigantes intracanales (NaOCl y clorhexdina) con colocación de antibióticos (p. ej., Hay varias ventajas en un enfoque de revascularización. una mezcla de cip rofloxacina, metronidazol y pasta de minociclina) durante varias semanas.En primer lugar, este enfoque es técnicamente simple y puede completarse utilizando Esta combinación particular de antibióticos desinfecta eficazmente los sistemas de los instrumentos y medicamentos actualmente disponibles sin biotecnología costosa. conductos radiculares (113-115) y aumenta la revascularización de los dientes En segundo lugar, la regeneración de tejido en los sistemas de conductos radiculares avulsionados y necróticos (116, 117), lo que sugiere que este es un paso crítico en la mediante las propias células sanguíneas del paciente evita la posibilidad de rechazo revascularización. La selección de diversos irrigantes y medicamentos merece inmunitario y transmisión de patógenos al reemplazar la pulpa con una construcción investigación adicional, ya que estos materiales pueden conferir varios efectos de ingeniería tisular. Sin embargo, varias preocupaciones deben abordarse en la importantes para la regeneración además de sus propiedades antimicrobianas. Por investigación prospectiva. En primer lugar, los informes de casos de un coágulo de ejemplo, la tetraciclina mejora el crecimiento de las células huésped en la dentina, no sangre que tiene la capacidad de regenerar tejido pulpar son emocionantes, pero se mediante una acción antimicrobiana, sino mediante la exposición de fibras de requiere precaución, porque no se ha identificado la fuente del tejido regenerado. colágeno incrustadas o factores de crecimiento (118). Sin embargo, aún no se sabe Se requieren estudios en animales y más estudios clínicos para investigar el potencial si la minociclina comparte este efecto y si estas propiedades adicionales podrían de esta técnica antes de que pueda recomendarse para uso general en pacientes. contribuir a una revascularización exitosa. Aunque estos informes de casos son en gran parte de dientes con cierres Generalmente, la ingeniería de tejidos no se basa en la formación de coágulos de sangre, porque la concentración y composición de las células atrapadas en el coágulo apicales incompletos, se ha observado que la reimplantación de dientes avulsionados de fibrina es impredecible. Esta es una limitación crítica para un enfoque de con una apertura apical de aproximadamente 1,1 mm demuestra una mayor revascularización de coágulos sanguíneos, porque la ingeniería de tejidos se basa en probabilidad de revascularización (119). Este hallazgo sugiere que la revascularización la entrega de concentraciones y composiciones efectivas de células para restaurar la de pulpas necróticas con ápices completamente formados (cerrados) podría requerir función. Es muy posible que las variaciones en la concentración y composición de las la instrumentación del ápice del diente hasta aproximadamente 1 a 2 mm de diámetro células, particularmente en pacientes de edad avanzada (donde las concentraciones apical para permitir el sangrado sistémico en los sistemas de conductos radiculares. de células madre circulantes pueden ser más bajas), puedan dar lugar a variaciones Claramente, el desarrollo de procedimientos de endodoncia regenerativa puede en el resultado del tratamiento. Por otro lado, algunos aspectos de este enfoque requerir un reexamen de muchos de los preceptos estrechamente arraigados de los pueden ser útiles; Los coágulos de fibrina derivados del plasma se están utilizando procedimientos de endodoncia tradicionales. El método de revascularización asume para el desarrollo como andamios en varios estudios (121). En segundo lugar, es que el espacio del conducto radicular ha sido desinfectado y que la formación de un necesario agrandar el foramen apical para promover la vascularización y mantener la coágulo de sangre produce una matriz (p. ej., fibrina) que atrapa células capaces de viabilidad celular inicial a través de la difusión de nutrientes. Relacionado con este iniciar la formación de tejido nuevo. No está claro que el fenotipo del tejido regenerado punto, las células deben tener un suministro disponible de oxígeno; por lo tanto, es probable que las JOE — Volumen 33, Número 4, abril de 2007 Endodoncia Regenerativa 381 Machine Translated by Google Artículo de revisión la porción coronal del sistema de conductos radiculares no sobreviviría o sobreviviría mediante inyección en sistemas de conductos radiculares vacíos. Los problemas en condiciones hipóxicas antes de la angiogénesis. Curiosamente, las células potenciales asociados con la implantación de láminas de tejido pulpar cultivado es que endoteliales liberan factores solubles en condiciones hipóxicas que promueven la pueden requerirse procedimientos especializados para garantizar que las células se supervivencia celular y la angiogénesis, mientras que otros tipos de células muestran adhieran correctamente a las paredes del conducto radicular. Las láminas de células respuestas similares a la baja disponibilidad de oxígeno (122–126). carecen de vascularización, por lo que solo la porción apical de los sistemas de canales recibiría estas construcciones celulares, con sistemas de canales coronales llenos de Terapia postnatal con células madre El método más simple para administrar células con potencial regenerativo apropiado es inyectar células madre posnatales en sistemas de conductos radiculares desinfectados después de abrir el ápice. Las células madre posnatales pueden derivarse andamios capaces de soportar la proliferación celular (132). Debido a que los filtros son capas muy delgadas de células, son extremadamente frágiles y esto podría dificultar su colocación en los sistemas de conductos radiculares sin que se rompan. En la implantación pulpar, el tejido pulpar de reemplazo se trasplanta a sistemas de múltiples tejidos, incluidos la piel, la mucosa bucal, la grasa y los huesos (127). Un de conductos radiculares limpios y moldeados. La fuente de tejido pulpar puede ser una obstáculo importante para la investigación es la identificación de una fuente de células línea de células madre pulpares purificadas que esté libre de enfermedades o madre postnatales capaz de diferenciarse en la diversa población celular que se patógenos, o que se cree a partir de células extraídas de una biopsia, que se haya encuentra en la pulpa adulta (p. ej., fibroblastos, células endoteliales, odontoblastos). cultivado en el laboratorio. El tejido pulpar cultivado se cultiva en láminas in vitro sobre Los obstáculos técnicos incluyen el desarrollo de métodos para la recolección y nanofibras poliméricas biodegradables o sobre láminas de proteínas de matriz cualquier método ex vivo necesario para purificar y/o expandir el número de células lo extracelular como el colágeno I o la fibronectina (133, 134). Hasta ahora, el cultivo de suficiente para las aplicaciones de endodoncia regenerativa. células de la pulpa dental en colágenos I y III no ha tenido éxito (135), pero otras Un enfoque posible sería utilizar células madre de la pulpa dental derivadas de matrices, como la vitronectina y la laminina, requieren investigación. La ventaja de células autólogas (propias del paciente) que se hayan tomado de una biopsia de la tener las células agregadas juntas es que localiza las células madre posnatales en el mucosa bucal, o células madre del cordón umbilical que se hayan almacenado sistema de conductos radiculares. La desventaja de esta técnica es que la implantación criogénicamente después del nacimiento; una línea de células madre de pulpa purificada de láminas de células puede resultar técnicamente difícil. Las láminas son muy finas y alogénica que está libre de enfermedades y patógenos; o células madre de pulpa frágiles, por lo que se necesita investigación para desarrollar técnicas de implantación xenogénicas (animales) que se han cultivado en el laboratorio. Es importante tener en fiables. Las láminas de células también carecen de vascularización, por lo que se cuenta que actualmente no hay disponibles líneas de células madre pulpares purificadas implantarían en la parte apical del sistema de conductos radiculares con el requisito de y que los tejidos de la mucosa aún no se han evaluado para la terapia con células suministro coronal de un andamiaje capaz de soportar la proliferación celular. Las madre. Aunque se anuncia que la recolección de células madre del cordón umbilical se células ubicadas a más de 200 m de la distancia máxima de difusión de oxígeno desde utilizará principalmente como parte de una futura terapia médica, estas células aún no un suministro de sangre capilar corren el riesgo de anoxia y necrosis (136). El desarrollo se han utilizado para diseñar construcciones de tejido para terapias médicas regenerativas. de esta terapia de ingeniería tisular endodóntica parece presentar pocos riesgos para Hay varias ventajas en un enfoque que utiliza células madre posnatales. En la salud de los pacientes, aunque las preocupaciones sobre las respuestas inmunitarias primer lugar, las células madre autógenas son relativamente fáciles de recolectar y y la posible falla en la formación de tejido pulpar funcional deben abordarse mediante administrar con jeringa, y las células tienen el potencial de inducir una nueva una cuidadosa investigación in vivo y ensayos clínicos controlados. regeneración pulpar. En segundo lugar, este enfoque ya se usa en aplicaciones médicas regenerativas, incluido el reemplazo de médula ósea, y una revisión reciente ha descrito varias aplicaciones endodónticas potenciales (4). Sin embargo, hay varias desventajas en un método de administración de inyección de células. Primero, las células pueden tener bajas tasas de supervivencia. En segundo lugar, las células pueden migrar a Implantación de andamios Para crear una terapia de ingeniería tisular endodóntica más práctica, las células diferentes lugares dentro del cuerpo (128), lo que posiblemente lleve a patrones madre pulpares deben organizarse en una estructura tridimensional que pueda respaldar anómalos de mineralización. Una solución para este último problema puede ser aplicar la organización celular y la vascularización. Esto se puede lograr utilizando un andamiaje las células junto con un coágulo de fibrina u otro material de andamiaje. Esto ayudaría de polímero poroso sembrado con células madre de pulpa (137). Un andamio debe a posicionar y mantener la localización celular. En general, se necesitan andamios, contener factores de crecimiento para ayudar a la proliferación y diferenciación de células y moléculas de señalización bioactivas para inducir la diferenciación de células células madre, lo que conduce a un desarrollo de tejido mejorado y más rápido (138). madre en un tipo de tejido dental (129). Por lo tanto, la probabilidad de producir nuevo Los factores de crecimiento se describieron en la sección anterior. El andamio también tejido pulpar funcional mediante la inyección de células madre en la cámara pulpar, sin puede contener nutrientes que promueven la supervivencia y el crecimiento celular un andamio o moléculas de señalización, puede ser muy baja. En cambio, la (139), y posiblemente antibióticos para prevenir cualquier crecimiento bacteriano en los regeneración pulpar debe considerar los tres elementos (células, factores de crecimiento sistemas de canales. La ingeniería de nanoscaffolds puede resultar útil en la y armazón) para maximizar el potencial de éxito. administración de fármacos a tejidos específicos (140). Además, el andamio puede ejercer funciones mecánicas y biológicas esenciales que necesita el tejido de reemplazo (141). En los dientes expuestos a la pulpa, se ha Implantación de pulpa La mayoría de los cultivos celulares in vitro crecen como una monocapa unida a descubierto que las virutas de dentina estimulan la formación de puentes de dentina reparadores (142). Los chips de dentina pueden proporcionar una matriz para la unión la base de los frascos de cultivo. Sin embargo, algunas células madre no sobreviven a de células madre pulpares (143) y también ser un reservorio de factores de crecimiento menos que crezcan sobre una capa de células alimentadoras (130). En todos estos (144). La actividad reparadora natural de las células madre de la pulpa en respuesta a casos, las células madre se cultivan en dos dimensiones. En teoría, para tomar cultivos de células bidimensionales y hacerlos tridimensionales, las células de la pulpa se los fragmentos de dentina brinda algún apoyo para el uso de andamios para regenerar pueden cultivar en filtros de membrana biodegradables. Será necesario enrollar muchos filtros para formar un tejido pulpar tridimensional, que el complejo de pulpa y dentina. Para lograr el objetivo de la reconstrucción del tejido pulpar, los andamios deben cumplir con algunos requisitos específicos. La biodegradabilidad es esencial, ya que se puede implantar en sistemas de conductos radiculares desinfectados. Las ventajas los andamios deben ser absorbidos por los tejidos circundantes sin necesidad de de este sistema de administración son que las células son relativamente fáciles de extirpación quirúrgica (145). Una alta porosidad y un tamaño de poro adecuado son cultivar en filtros en el laboratorio. El crecimiento de células en filtros se ha logrado necesarios para facilitar la siembra y difusión celular a través de toda la estructura tanto durante varias décadas, ya que así es como se evalúa la citotoxicidad de muchos de las células como de los nutrientes (146). La velocidad a la que se produce la materiales de prueba (131). Además, las láminas de células agregadas son más degradación tiene que coincidir tanto como sea posible con la velocidad de formación estables que las células disociadas administradas de tejido; esto significa que mientras las células fabrican sus 382 Murray et al. JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión propia estructura de matriz natural a su alrededor, el andamio es capaz de se requeriría asimetría durante la colocación en sistemas de conductos radiculares proporcionar integridad estructural dentro del cuerpo, y eventualmente se romperá, limpios y moldeados. Sin embargo, las primeras investigaciones aún tienen que dejando el tejido recién formado que asumirá la carga mecánica (147). demostrar que la impresión celular tridimensional puede crear tejido funcional in vivo (163). La mayoría de los materiales de andamiaje utilizados en la ingeniería de tejidos tienen una larga historia de uso en medicina como suturas biorreabsorbibles y como mallas utilizadas en apósitos para heridas (148). Los tipos de materiales de andamiaje disponibles son naturales o sintéticos, biodegradables o permanentes. Los materiales sintéticos incluyen ácido poliláctico (PLA), ácido poliglicólico (PGA) y policaprolactona (PCL), que son materiales de poliéster comunes que se degradan dentro del cuerpo humano (149). Todos estos andamios se han utilizado con éxito para aplicaciones de ingeniería de tejidos porque son estructuras fibrosas degradables con la capacidad de soportar el crecimiento de varios tipos diferentes de células madre. Los principales inconvenientes están relacionados con las dificultades para obtener una alta porosidad y un tamaño de poro regular. Esto ha llevado a los investigadores a concentrar esfuerzos para diseñar andamios a nivel nanoestructural para modificar las interacciones celulares con el andamio (150). Los andamios también pueden construirse con materiales naturales; en particular, se han estudiado diferentes derivados de la matriz extracelular para evaluar su capacidad para apoyar el crecimiento celular (151). Varios materiales proteicos, como el colágeno o la fibrina, y los materiales polisacáridos, como el quitosano o los glicosaminoglicanos (GAG), no han sido bien estudiados. Sin embargo, los primeros resultados son prometedores en términos de apoyo a la supervivencia y función celular (152, 153), aunque algunas reacciones inmunitarias a este tipo de materiales pueden amenazar su uso futuro como parte de la medicina regenerativa. Terapia génica El año 2003 marcó un hito importante en el campo de la genética y la biología molecular. Ese año marcó el 50 aniversario del descubrimiento de la estructura de doble hélice del ADN por Watson y Crick. El 14 de abril de 2003, 20 centros de secuenciación en cinco países diferentes declararon completo el proyecto del genoma humano. Este hito posibilitará nuevos tratamientos médicos con terapia génica (164). Todas las células humanas contienen una hebra de ADN de 1 m que contiene 3 000 millones de pares de bases, con la única excepción de las células no nucleadas, como los glóbulos rojos. El ADN contiene secuencias genéticas (genes) que controlan la actividad y función celular; uno de los genes más conocidos es p53 (165). Las nuevas técnicas que involucran vectores virales o no virales pueden entregar genes para factores de crecimiento, morfógenos, factores de transcripción y moléculas de matriz extracelular en poblaciones de células diana, como la glándula salival (166). Los vectores virales se modifican para evitar la posibilidad de causar enfermedades, pero aún conservan la capacidad de infección. Varios virus han sido modificados genéticamente para entregar genes, incluidos retrovirus, ad enovirus, virus adenoasociados, virus del herpes simple y lentivirus (167, 168). Los sistemas de administración de genes no virales incluyen plásmidos, péptidos, pistolas de genes, complejos de ADN-ligando, electroporación, sonoporación y liposomas catiónicos (169, 170). La elección del sistema de administración de genes depende de la Entrega de andamios inyectables accesibilidad y las características fisiológicas de la población de células diana. Las estructuras rígidas de andamiaje diseñadas por ingeniería tisular brindan un soporte excelente para las células que se usan en los huesos y otras áreas del cuerpo donde se requiere que el tejido diseñado brinde soporte físico (154). Sin embargo, en los sistemas de conductos radiculares no se requiere una pulpa de ingeniería tisular para proporcionar soporte estructural al diente. Esto permitirá que el tejido pulpar diseñado por ingeniería tisular se administre en una matriz de andamiaje tridimensional suave, como un hidrogel de polímero. Los hidrogeles son armazones inyectables que se pueden administrar con una jeringa (155, 156). Los hidrogeles tienen el potencial de ser no invasivos y fáciles de administrar en los sistemas de conductos radiculares. En teoría, el hidrogel puede promover la regeneración de la pulpa proporcionando un sustrato para la proliferación y diferenciación celular en una Una revisión reciente ha discutido el uso de la entrega de genes en la endodoncia regenerativa (4). Un uso de la entrega de genes en endodoncia sería entregar genes mineralizantes en el tejido pulpar para promover la mineralización del tejido. Sin embargo, una búsqueda bibliográfica indica que ha habido poca o ninguna investigación en este campo, a excepción del trabajo de Rutherford (171). Transfectó pulpas de hurón con BMP-7 de ratón transfectado con ADNc que no logró producir una respuesta reparadora, lo que sugiere que se necesita más investigación para optimizar el potencial de la terapia génica pulpar. Nuestras propias observaciones no publicadas (PM) de la inserción de genes mineralizantes mediante electroporación en cultivos de células madre pulpares aún no han tenido éxito, lo que sugiere que aún estructura tisular organizada (157). Los problemas anteriores con los hidrogeles queda mucho por hacer para utilizar la terapia génica como parte del tratamiento de incluían un control limitado sobre la formación y el desarrollo de tejidos, pero los endodoncia. Además, existen peligros para la salud potencialmente graves con el uso avances en la formulación han mejorado drásticamente su capacidad para apoyar la de la terapia génica; estos surgen del uso del sistema de vector (transferencia de supervivencia celular (158). A pesar de estos avances, los hidrogeles se encuentran genes), en lugar de los genes expresados (167). en una etapa temprana de investigación, y este tipo de sistema de administración, La FDA aprobó la investigación sobre la terapia génica en humanos con enfermedades aunque prometedor, aún no se ha demostrado que sea funcional in vivo. Para hacer terminales, pero la aprobación se retiró en 2003 después de que se descubrió que un que los hidrogeles sean más prácticos, la investigación se centra en hacerlos niño de 9 años que estaba recibiendo terapia génica había desarrollado tumores en diferentes fotopolimerizables para formar estructuras rígidas una vez que se implantan en el sitio del tejido (159). partes de su cuerpo (172). Los investigadores deben aprender a controlar con precisión la terapia génica y hacer que sea muy específica para cada célula a fin Impresión de celdas tridimensionales El enfoque final para crear tejido pulpar de reemplazo puede ser crearlo de desarrollar una terapia génica que sea segura para su uso clínico. Debido al aparente alto riesgo de peligros para la salud, el desarrollo de una terapia génica para mediante una técnica de impresión de células tridimensionales (160). En teoría, se llevar a cabo el tratamiento de endodoncia parece muy poco probable en un futuro usa un dispositivo similar a un chorro de tinta para dispensar capas de células próximo. Las ventajas y desventajas de estos problemas de desarrollo para las suspendidas en un hidrogel (161) para recrear la estructura del tejido de la pulpa del técnicas de endodoncia regenerativa se resumen en la Tabla 3. La terapia génica es diente. La técnica de impresión de células tridimensionales se puede utilizar para un campo relativamente nuevo y falta evidencia para demostrar que esta terapia tiene colocar las células con precisión (162), y este método tiene el potencial de crear el potencial para rescatar la pulpa necrótica. En este momento, los posibles beneficios construcciones de tejido que imitan la estructura natural del tejido de la pulpa del y desventajas son en gran parte teóricos. diente. El posicionamiento ideal de las células en una construcción de ingeniería de tejidos incluiría la colocación de células odontoblastoides alrededor de la periferia para mantener y reparar la dentina, con fibroblastos en el núcleo de la pulpa que sostienen una red de células vasculares y nerviosas. Teóricamente, la desventaja de usar la técnica de impresión de células tridimensionales es que la orientación cuidadosa de la construcción del tejido pulpar de acuerdo con su posición apical y coronal JOE — Volumen 33, Número 4, abril de 2007 Un llamado a la acción: Prioridades de investigación para el desarrollo Técnicas de Endodoncia Regenerativa Lo siguiente representa un marco inicial para identificar las principales prioridades de investigación en el desarrollo de técnicas de endodoncia regenerativa. Endodoncia Regenerativa 383 Machine Translated by Google Artículo de revisión 384 Murray et al. JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión han observado que las células madre pulpares, las células madre periodontales y los fibroblastos no se adhieren ni crecen en sistemas de conductos radiculares infectados; la presencia de infección hace que el tratamiento no tenga éxito (observaciones no publicadas). Esto indica que para que la endodoncia regenerativa sea exitosa, la desinfección de los sistemas de conductos radiculares necróticos debe lograrse de una manera que no impida la cicatrización y la integración de la pulpa modificada por ingeniería tisular con las paredes del conducto radicular. Además, el puede ser necesario considerar la inclusión de una pequeña cantidad local de antibióticos en el desarrollo de estos andamios biodegradables. Se han identificado cantidades sustanciales de especies bacterianas como habitantes de la cavidad bucal. Sin embargo, debido a las interacciones bacterianas, la disponibilidad de nutrientes y los bajos potenciales de oxígeno en los sistemas de conductos radiculares, el número de especies bacterianas presentes en las infecciones endodónticas están restringidas (175). Estas condiciones selectivas conducen al predominio de microorganismos facultativos y estrictamente anaerobios que sobreviven y se multiplican, provocando infecciones que estimulan la reabsorción ósea local (176). La desinfección es uno de los principales objetivos de la preparación del conducto radicular. La desinfección a fondo elimina los microorganismos, permite una mejor adaptación de los materiales de obturación, y potencia la acción del intracanal medicamentos La elección de un irrigante es de gran importancia, porque el irrigante actúa como lubricante durante la instrumentación, limpia los desechos y microorganismos fuera del canal, y reacciona con pulpa, necrótica tejidos, y microorganismos y sus subproductos. El hipoclorito de sodio se ha utilizado ampliamente durante varias décadas para este propósito. (177). Sus excelentes propiedades de disolución de tejidos y antimicrobianas actividad lo convierten en el irrigante de elección para el tratamiento de dientes con pulpa necrosis, aunque tiene varias características indeseables, como toxicidad tisular a altas concentraciones, etc. (178, 179). Además, el hipoclorito de sodio no limpia totalmente las superficies de la raíz. sistemas de canales (180). El gluconato de clorhexidina ha sido estudiado por su Figura 2. Obturación de conductos radiculares con células madre después de irrigación de dentina radicular con 6% NaOCl y EDTA al 17%. Se sembraron células madre periodontales en matriz de dentina durante 1 semana en una incubadora de cultivo de tejidos en ausencia de un andamio. Este diversas propiedades, actividad antimicrobiana (181, 182) y biocompatibilidad (182), con el objetivo de evaluarlo como alternativa a hipoclorito de sodio (183, 184). La desinfección de bacterias es clínicamente tratamiento imita el uso de células de la mucosa oral para el reemplazo de tejido pulpar después Limpieza y modelado (inédito). importante, particularmente Enterococcus faecalis, porque ha sido aislado de sistemas de conductos radiculares infectados y aparece con más frecuencia en casos de tratamiento endodóntico de revisión (185, 186). No se enumeran en orden de prioridad, sino en el aproximado secuencia que podrían ser aplicados en un caso particular. La endodoncia regenerativa se beneficiaría de una nueva generación de irrigantes que son tan efectivos como los irrigantes actuales, pero no son peligrosos a los tejidos del paciente. Una de estas soluciones de riego en desarrollo es Métodos mejorados para desinfectar y dar forma a la raíz basado en un extracto de planta por nosotros (PM), lo que sugiere que hay Sistemas de canales muchos compuestos naturales (187) capaces de limpiar y desinfectar el conducto radicular El enfoque más simple para la regeneración del tejido pulpar sería sistemas, con un riesgo muy reducido de toxicidad tisular. Esta es una importante regenerar la pulpa sobre el tejido pulpar restante. Sin embargo, los intentos de regenerar el área de investigación, porque el desarrollo del agente desinfectante, irrigante y quelante ideal tejido pulpar en condiciones de inflamación o necrosis parcial beneficiaría a los pacientes y a la profesión. no han tenido éxito (173), y en general se reconoce que la El pronóstico a largo plazo del tejido infectado directo del recubrimiento pulpar es pobre y no recomendado (174). En presencia de infección, el tallo pulpar Eliminación de la capa de frotis La presencia de una capa de barrillo dentinario en las paredes del conducto radicular puede inhibir la las células que sobreviven parecen ser incapaces de mineralización y depósito de un puente adherencia de las células madre pulpares implantadas, lo que podría provocar el fracaso del de dentina terciaria. Por lo tanto, la mayoría de los disponibles tratamiento de endodoncia regenerativa. Métodos mejorados para eliminar el la evidencia sugiere que la pulpa dental necrótica e infectada no cicatriza. la capa de barrillo dentinario de las paredes del conducto radicular parece ser necesaria para ayudar Por lo tanto, en un futuro previsible, será necesario desinfectar el promover el éxito de la endodoncia regenerativa. La capa de barrillo es una sistemas de conductos radiculares y eliminar los tejidos duros y blandos infectados antes Capa de 1 a 5 m de espesor (188) de residuos de corte desnaturalizados producidos en mediante tratamientos de endodoncia regenerativa. superficies de la cavidad instrumentada, y se compone de dentina, odontoblástica La literatura contiene pocos o ningún informe sobre la unión de células madre pulpares procesos, contaminantes inorgánicos no específicos y microorganismos y la adherencia a la dentina del conducto radicular. Uno de nosotros (PM) ha completado varias (189, 190). La eliminación de la capa de barrillo dentinario de la raíz instrumentada investigaciones inéditas de las interacciones entre paredes del canal se está volviendo menos controvertida en la práctica clínica (191). Su células madre periodontales y la superficie dentinaria. Nuestro inédito inicial la eliminación proporciona un mejor sellado del material de obturación endodóntica para Los resultados muestran que relativamente pocas células madre periodontales naturalmente dentina, y evita la fuga de microorganismos a los tejidos orales adherirse y crecer en sistemas de conductos radiculares limpios y moldeados, como puede ser (192). Se utilizan agentes quelantes químicos para eliminar el barrillo dentinario. como se ve en la Fig. 2, e incluso menos células se adhieren a una capa de barrillo dentinario. A de las paredes del conducto radicular, más comúnmente una solución al 17% de ácido adherirse con éxito a la dentina del conducto radicular, las células madre deben etilendiaminotetraacético (EDTA) que se aplica como lavado final (193). Se han investigado apoyarse dentro de un andamio de polímero o hidrogel. Además, nosotros varias otras soluciones para eliminar las capas de barrillo dentinario, JOE — Volumen 33, Número 4, abril de 2007 Endodoncia Regenerativa 385 Machine Translated by Google Artículo de revisión incluyendo doxiciclina, un congénere de tetraciclina (194); ácido cítrico (195); y, más recientemente, MTAD (196). MTAD es una solución acuosa de doxiciclina al 3 %, ácido cítrico al 4,25 % y detergente polisorbato 80 al 0,5 % (197). Este irrigante intracanal biocompatible (198) está disponible comercialmente como un juego de dos partes que se mezcla a pedido (BioPure MTAD, DentsplyTulsa, Tulsa, OK). En este producto, se usa hiclato de doxiciclina en lugar de su base libre, monohidrato de doxiciclina, para aumentar la solubilidad en agua de este antibiótico de amplio espectro (199). Se ha informado que MTAD es eficaz para eliminar las capas de barrillo dentinario (200), eliminar los microbios que son resistentes a los apósitos y irrigantes endodónticos convencionales (201) y proporcionar una actividad antimicrobiana sostenida a través de la afinidad de la doxiciclina para unirse a los tejidos dentales duros ( 202, 203). Sin embargo, se desconoce su interacción con el tejido pulpar en regeneración. Ingeniería de un tejido pulpar funcional El éxito de la terapia de endodoncia regenerativa depende de la capacidad de los investigadores para crear una técnica que permita a los médicos crear un tejido pulpar funcional dentro de sistemas de conductos radiculares limpios y moldeados. La fuente de tejido pulpar puede provenir de la revascularización del conducto radicular, que implica agrandar el ápice del diente a aproximadamente 1 a 2 mm TABLA 4. Resumen de las barreras a abordar para permitir la introducción de la endodoncia regenerativa Desinfección y modelado de conductos radiculares de manera que permitan la endodoncia regenerativa. Desbridamiento quimiomecánico: limpieza y modelado de la raíz canales Irrigantes: hipoclorito de sodio al 6% y gluconato de clorhexidina al 2% y alternativas Medicamentos: hidróxido de calcio, antibióticos triples, MTAD y alternativas Creación de tejidos pulpo-dentinarios de reemplazo Revascularización pulpar por instrumentación de ápice Células madre; alogénico, autólogo, xenogénico, cordón umbilical fuentes factores de crecimiento; BMP-2, -4, -7; TGF-B1,-B2,-B3 entre otros Terapia de genes; identificación de genes mineralizantes Ingeniería de tejidos; cultivo celular, andamios, hidrogeles Entrega de tejidos de pulpa-dentina de reemplazo Métodos de implantación quirúrgica sitio de inyección Materiales de restauración dental Mejorar la calidad del sellado entre los materiales de restauración y dentina Asegure el sellado a largo plazo para prevenir la pulpitis recurrente Medición de resultados clínicos apropiados Flujo sanguíneo vascular para permitir el sangrado en los conductos radiculares y la generación de tejido Células odontoblastoides mineralizantes Inervaciones aferentes intactas vital que parece capaz de formar tejido duro bajo ciertas condiciones; terapia con Ausencia de signos o síntomas. células madre, que implica la administración de células madre autólogas o alogénicas en los conductos radiculares; o implantación pulpar, que implica la implantación quirúrgica de tejido pulpar sintético cultivado en el laboratorio. Cada una de estas técnicas para regenerar tejido pulpar tendrá ventajas y limitaciones que aún deben definirse a través de la ciencia básica y la investigación clínica. Medición de resultados clínicos apropiados Una vez que se ha implantado una pulpa de ingeniería tisular, no es ético extraer tejidos funcionales para realizar un análisis histológico. Por lo tanto, no será posible investigar histológicamente el funcionamiento de las células odontoblastoides mineralizantes o la inervación nerviosa. Los médicos tendrán que confiar en las Realización de procedimientos de endodoncia regenerativa Idealmente, la realización de procedimientos de endodoncia regenerativa pruebas no invasivas que se utilizan hoy en día, como la flujometría de sangre con láser Doppler en los dientes (205); pruebas de pulpa que involucran calor, frío y debe ser clínicamente más eficaz que los tratamientos actuales. El método de electricidad (206); y falta de signos o síntomas. La resonancia magnética nuclear administración también debe ser eficiente, rentable y libre de riesgos para la salud (RMN) ha demostrado el potencial para distinguir entre pulpas dentales vitales y no o efectos secundarios para los pacientes. Una fuente celular prometedora para los vitales (207), pero las máquinas de resonancia magnética son muy costosas y procedimientos de endodoncia regenerativa son las células madre autógenas de la deben reducirse mucho en precio para generalizarse. El resultado clínico ideal es mucosa oral. Las células de la mucosa oral son fácilmente accesibles como fuente de células orales, lo que evita el problema de que los pacientes deban almacenar sangre del cordón umbilical o terceros molares inmediatamente después de la extracción. También evita la necesidad de biopsias óseas. Las células de la mucosa un diente asintomático que nunca necesita retratamiento, pero los métodos de evaluación de la vitalidad no subjetivos son esenciales para validar que las técnicas de endodoncia regenerativa son realmente efectivas. En la Tabla 4 se muestra un resumen de los desafíos para la introducción de la endodoncia regenerativa . oral se pueden mantener utilizando cultivos celulares in vitro con antibióticos para eliminar la infección (204). A continuación, las células se pueden sembrar en los 1 a 3 mm apicales de un armazón de ingeniería de tejidos y los 15 mm coronales restantes contienen un armazón acelular que favorece el crecimiento celular y la vascularización. Esta construcción de tejido puede implicar una suspensión inyectable de [células de hidrogel X (factores de crecimiento, etc.)] o [hidrogel X (factores de crecimiento, etc.)], entonces este método de dos capas sería bastante fácil de lograr. Además, al sembrar células sólo en la región apical, se reduce la demanda de un gran número de células derivadas del huésped. En cambio, la mayor parte de la proliferación celular ocurriría naturalmente en el paciente. Esto reduciría la necesidad de cultivar grandes cantidades de células en el laboratorio. Conclusiones Las tasas de éxito clínico de los tratamientos de endodoncia pueden superar el 90% (208-210). Sin embargo, muchos dientes no tienen la oportunidad de ser salvados por el tratamiento de endodoncia y en su lugar son extraídos, con la colocación posterior de una prótesis artificial, como un implante. Los métodos de endodoncia regenerativa tienen el potencial de regenerar los tejidos de la pulpa y la dentina y, por lo tanto, pueden ofrecer un método alternativo para salvar los dientes que pueden haber comprometido la integridad estructural. Se han descrito varios problemas de desarrollo para lograr la regeneración endodóntica. Cada una de las técnicas regenerativas tiene ventajas y desventajas, Estos dos métodos de administración reducen la necesidad de una población y algunas de las técnicas son hipotéticas o se encuentran en una etapa temprana autógena de células madre pulpares que no estará fácilmente disponible para los de desarrollo. Los informes de casos disponibles de revascularización pulpar endodoncistas, porque los dientes que requieren tratamiento probablemente estén generalmente se informaron en pacientes jóvenes (con altas poblaciones de células infectados y necróticos. Este método de administración propuesto ayudaría a evitar madre) y dientes con ápices abiertos. Sin embargo, para que los procedimientos la posibilidad de problemas inmunitarios y de infección relacionados con el uso de una línea células madre pulparesestén alogénicas. dede endodoncia regenerativa ampliamente disponibles y sean predecibles, los Por supuesto, estos métodos alternativos deben investigarse utilizando estudios endodoncistas tendrán que depender de las terapias de ingeniería de tejidos para preclínicos in vitro, estudios de uso en animales y, eventualmente, ensayos clínicos. regenerar el tejido de la dentina pulpar. Las terapias propuestas que involucran células madre, factores de crecimiento e ingeniería de tejidos requieren pulpa re 386 Murray et al. JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión vascularización, en sí mismo un enorme desafío. Uno de los aspectos más desafiantes del desarrollo de una terapia de endodoncia regenerativa es comprender cómo se pueden optimizar e integrar los diversos procedimientos de componentes para producir el resultado de un complejo pulpa-dentina regenerado. El desarrollo futuro de los procedimientos de endodoncia regenerativa requerirá un programa de investigación integral dirigido a cada 28. Martin-Rendon E, Watt SM. Explotación de la plasticidad de las células madre. Transfus Med 2003;13:325– 49. 29. Gardner RL. Células madre: potencia, plasticidad y percepción pública. J Anat 2002; 200 (Pt. 3): 277–82. 30. Kenny AB, Hitzig WH. Trasplante de médula ósea para la enfermedad de inmunodeficiencia combinada grave. Reportado de 1968 a 1977. Eur J Pediatr 1979;131:155–77. 31. Barrett J, McCarthy D. Trasplante de médula ósea para trastornos genéticos. Sangre Rev 1990;4:116 –31. uno de estos componentes y su aplicación a nuestros pacientes. Los autores creen que la endodoncia regenerativa es una terapia inevitable y hacen un llamado a la acción de los científicos, las agencias de financiación y la profesión de endodoncia para unir recursos para acelerar su desarrollo. El potencial desatado de la endodoncia regenerativa puede beneficiar a millones de pacientes cada año. 32. Gimble J, Guilak F. Células madre adultas derivadas de tejido adiposo: aislamiento, caracterización, y potencial de diferenciación. Citoterapia 2003;5:362–9. 33. Tsukamoto Y, Fukutani S, Shin-Ike T, et al. Formación de nódulos mineralizados por cultivos de fibroblastos derivados de pulpa dental humana. Arch Oral Biol 1992;37:1045–55. 34. Ligon BL, Weller TH. Premio Nobel y pionero de la investigación en poliomielitis, virus varicela-zóster, citomegalovirus, rubéola y otras enfermedades infecciosas. Semin Pediatr Infect Dis 2002;13:55–63. 35. Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Líneas de células madre embrionarias derivadas de Referencias 1. Instituto Nacional de Investigaciones Dentales y Craneofaciales. Biomimética y tejido blastocistos humanos. Ciencia 1998; 282: 1145–7. Fe de erratas en: Science 1998;282:1827 36. Shamblott MJ, Axelman J, Wang S, et al. Derivación de células madre pluripotentes a partir de células germinales primordiales humanas cultivadas. Proc Natl Acad Sci USA 1998;95:13726 –31. ingeniería. Institutos Nacionales de Salud, 2002. 2. Baum BJ, Mooney DJ. El impacto de la ingeniería de tejidos en la odontología. J Am Dent Assoc 2000;131:309 –18. 3. Baum BJ. Investigación biomédica, medicina oral y el futuro. Cirugía oral Medicina oral Oral Pathol Oral Radiol Endod 2002;94:141–2. 4. Nakashima M, Akamine A. La aplicación de la ingeniería de tejidos a la regeneración de pulpa y dentina en endodoncia. J Endod 2005;31:711–8. 5. Kaigler D, Mooney D. El impacto de la ingeniería de tejidos en la odontología. J Dent Educ 2001;65:456 – 62. 6. Baum BJ, O'Connell BC. El impacto de la terapia génica en la odontología. J Am Dent Assoc 1995; 126: 179 – 89. 7. Hillman JD. Streptococcus mutans modificado genéticamente para la prevención de la caries dental. Antonie Van Leeuwenhoek 2002;82:361–6. 8. Herman BW. Sobre la reacción de la pulpa dental a la amputación vital y calxyl tapando Dtsch Zahnarztl Z 1952;7:1446 –7 [en alemán]. 9. Bloque MS, Cervini D, Chang A, Gottsegen GB. Avance maxilar anterior mediante osteogénesis por distracción dentosoportada. J Oral Maxillofac Surg 1995;53:561–5. 10. Kassolis JD, Rosen PS, Reynolds MA. Aumento de la cresta alveolar y del seno utilizando plasma rico en Fe de erratas en: Proc Natl Acad Sci USA 1999;96:1162 37. Guenin LM. Un esquema fallido de no complicidad. Stem Cells Dev 2004;13:456 –9. 38. Badorff C, Dimmeler S Neovascularización y reparación cardíaca por células madre derivadas de médula ósea. Manual Exp Pharmacol 2006;283–98. 39. Jansen J, Thompson JM, Dugan MJ, et al. Trasplante de células progenitoras de sangre periférica. Ther Apher 2002;6:5–14. 40. Mizuno H, Hyakusoku H. Potencial mesengénico y perspectiva clínica futura de las células lipoaspiradas procesadas en humanos. J Nippon Med Sch 2003;70:300 – 6. 41. Seo BM, Miura M, Sonoyama W, Coppe C, Stanyon R, Shi S. Recuperación de células madre del ligamento periodontal criopreservado. J Dent Res 2005;84:907–12. 42. Korbling M, Robinson S, Estrov Z, Champlin R, Shpall E. Células derivadas de sangre del cordón umbilical para la reparación de tejidos. Citoterapia 2005;7:258 – 61. 43. Zuk PA, Zhu M, Mizuno H, et al. Células multilinaje del tejido adiposo humano: implicaciones para las terapias basadas en células. Tejido Engl 2001;7:211–28. 44. Safford KM, Hicok KC, Safford SD, et al. Diferenciación neurogénica de células estromales derivadas de tejido adiposo murino y humano. Biochem Biophys ResCommun 2002; 294:371–9. plaquetas en combinación con aloinjerto óseo liofilizado: serie de casos. J Periodontol 2000;71:1654-61. 45. Le Blanc K, Ringden O. Inmunobiología de células madre mesenquimatosas humanas y uso futuro en el 11. Heijl L, Heden G, Svardstrom G, Ostgren A. Derivado de matriz de esmalte (EMDOGAIN) en el tratamiento trasplante de células madre hematopoyéticas. Biol Blood Marrow Transplant 2005;11:321–34. de defectos periodontales intraóseos. J Clin Periodontol 1997;24 (Pt 2):705–14. 46. Taylor PL. La brecha entre la ley y la ética en la investigación con células madre de embriones humanos: 12. Fujimura K, Bessho K, Kusumoto K, Ogawa Y, Iizuka T. Estudios experimentales sobre la actividad inductora de hueso de compuestos de colágeno atelopéptido tipo I como portador de osteoinducción ectópica por rhBMP-2. Biochem Biophys ResCommun 1995; 208:316 –22. superación del efecto de la política federal de EE. UU. en los avances de la investigación y el beneficio público. Sci Engl Ética 2005;11:589 – 616. 47. Bello YM, Falabella AF, Eaglstein WH. Piel diseñada por tejido. Estado actual en la cicatrización de heridas. Am J Clin Dermatol 2001;2:305–13. 13. Takayama S, Murakami S, Shimabukuro Y, Kitamura M, Okada H. Regeneración periodontal por FGF-2 (bFGF) en modelos de primates. J Dent Res 2001;80:2075–9. 14. Langer R, Vacanti JP. Ingeniería de tejidos. Ciencia 1993; 260: 920 - 6. 15. MacArthur BD, Orefo ROC. Cerrando la brecha. Naturaleza 2005; 433:19. 16. Rahaman MN, Mao JJ. Construcciones de tejido compuesto basadas en células madre para regeneración medicamento. Biotecnología Bioeng 2005;91:261–84. 17. van der Burgt TP, Plasschaert AJ. Decoloración de los dientes inducida por materiales dentales. Cirugía oral Oral Med Oral Pathol 1985;60:666 –9. 18. van der Burgt TP, Mullaney TP, Plasschaert AJ. Decoloración dental inducida por selladores endodónticos. Cirugía Oral Oral Med Oral Pathol 1986;61:84 –9. 19. Doyon GE, Dumsha T, von Fraunhofer JA. Resistencia a la fractura de la dentina radicular humana expuesta al hidróxido de calcio intracanal. J Endod 2005;31:895–7. 20. Caplan DJ, Cai J, Yin G, White BA. Dientes con endodoncia versus dientes sin endodoncia: una comparación retrospectiva de los tiempos de supervivencia. J Public Health Dent 2005;65:90 – 6. 21. Murray PE, García-Godoy F. Las perspectivas de los implantes y la endodoncia: una revisión de las estrategias de ingeniería de tejidos para crear dientes de reemplazo para los pacientes. Dent Clin North Am 2006;50:299 –315. 22. Raguse JD, Gath HJ. Un reemplazo dérmico metabólicamente activo (Dermagraft) para vestibuloplastia. J Oral Rehabil 2005;32:337–40. 23. Song SU, Cha YD, Han JU, et al. Regeneración de cartílago hialino utilizando condrocitos humanos mixtos y condrocitos productores de factor de crecimiento transformante beta1. Tissue Engl 2005;11:1516 –26. 48. Gronthos S, Brahim J, Li W, et al. Propiedades de las células madre de las células madre de la pulpa dental humana. J Dent Res 2002;81:531–5. 49. Shi S, Gronthos S. Nicho perivascular de células madre mesenquimales posnatales en médula ósea humana y pulpa dental. J Bone Miner Res 2003;18:696 –704. 50. Nakashima M, Iohara K, Ishikawa M, et al. Estimulación de la formación de dentina reparadora mediante terapia génica ex vivo utilizando células madre de pulpa dental electrotransfectadas con factor de crecimiento/diferenciación 11 (Gdf11). Hum Gene Ther 2004;15:1045–53. 51. Tecles O, Laurent P, Zygouritsas S, Burger AS, Camps J, Dejou J, About I. Activación de células madre/ progenitoras de pulpa dental humana en respuesta a la lesión de odontoblastos. Arch Oral Biol 2005;50:103–8. 52. Pettengell R. Autotrasplante de células madre en el linfoma folicular no Hodgkin. Bone Marrow Transplant 2002;29(Suppl 1):S1– 4. 53. Amin M, Fergusson D, Aziz A, Wilson K, Coyle D, Hebert P. El costo de los glóbulos rojos alogénicos: una revisión sistemática. Transfus Med 2003;13:275–85. 54. Murphy WJ, Blazar BR. Nuevas estrategias para prevenir la enfermedad de injerto contra huésped. Curr Opin Immunol 1999;11:509-15. 55. Leeton J, Caro C, Howlett D, Harman J. La búsqueda de óvulos de donantes: un problema de oferta y demanda. Clin Reprod Fertil 1986;4:337–40. 56. Cameron Nuevo México. Ética de la investigación, política científica y cuatro contextos para el debate sobre las células madre. J Investig Med 2006;54:38 – 42. 57. Hu D, Helms J. Cultivo de órganos de primordios craneofaciales. Métodos 2001;24:49 –54. 58. Slifkin M, Doron S, Snydman DR. Profilaxis viral en pacientes trasplantados de órganos. 24. Smith AG. Células madre derivadas de embriones: de ratones y hombres. Annu Rev Cell Dev Biol 2001;17:435–62. 25. MS Rao. Stem sense: una propuesta para la clasificación de las células madre. Stem Cells Dev 2004;13:452– 5. 26. Fortier LA. Células madre: clasificaciones, controversias y aplicaciones clínicas. Vet Surg 2005;34:415–23. 27. Menasche P. El potencial de las células madre embrionarias para tratar enfermedades del corazón. Curr Opin Mol Ther 2005;7:293–9. JOE — Volumen 33, Número 4, abril de 2007 Drogas 2004;64:2763–92. 59. Atiyeh BS, Hayek SN, Gunn SW. Nuevas tecnologías para el cierre de heridas por quemadura y curación: revisión de la literatura. Burns 2005;31:944-56. 60. Young CS, Terada S, Vacanti JP, Honda M, Bartlett JD, Yelick PC. Ingeniería tisular de estructuras dentales complejas sobre andamios de polímeros biodegradables. J Dent Res 2002;81:695–700. 61. Duailibi MT, Duailibi SE, Young CS, Bartlett JD, Vacanti JP, Yelick PC. Dientes creados con bioingeniería a partir de células cultivadas de brotes dentales de rata. J Dent Res 2004;83:523–8. Endodoncia Regenerativa 387 Machine Translated by Google Artículo de revisión 62. Chang Y, Chen SC, Wei HJ, et al. Regeneración tisular observada en un pericardio bovino acelular poroso utilizado para reparar un defecto miocárdico en el ventrículo derecho de un modelo de rata. J Thorac Cardiovasc Surg 2005;130:705–11. 63. Murray PE, García-Godoy F. Respuestas de células madre en la regeneración dental. Stem Cells Dev 2004;13:255–62. 64. Laino G, Graziano A, d'Aquino R, et al. Una fuente accesible de células madre adultas humanas para la ingeniería de tejidos duros. J Cell Physiol 2006;206:693–701. 65. Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey PG, Shi S. SHED: células madre de dientes deciduos exfoliados humanos. Proc Natl Acad Sci USA 2003; 100:5807–12. 93. Smith AJ, Cassidy N, Perry H, Begue-Kirn C, Ruch JV, Lesot H. Reactionary dentino génesis. Int J Dev Biol 1995;39:273–80. 94. Tziafas D. Mecanismos básicos de citodiferenciación y dentinogénesis durante den reparación pulpar tal. Int J Dev Biol 1995;39:281–90. 95. Tziafas D, Alvanou A, Panagiotakopoulos N, et al. Inducción de la diferenciación de células similares a odontoblastos en pulpas dentales de perros después de la implantación in vivo de componentes de matriz de dentina. Arch Oral Biol 1995;40:883–93. 96. Roberts-Clark DJ, Smith AJ. Factores de crecimiento angiogénicos en la matriz de dentina humana. Arch Oral Biol 2000;45:1013– 6. 97. Smith AJ, Matthews JB, Hall RC. Transformando el factor de crecimiento-beta1 (TGF-beta1) en matriz de 66. Shi S, Bartold PM, Miura M, Seo BM, Robey PG, Gronthos S. La eficacia de las células madre mesenquimales para regenerar y reparar estructuras dentales. Orthod Craneofac Res 2005;8:191–9. dentina. Activación de ligandos y expresión de receptores. Eur J Oral Sci 1998; 106 (Suplemento 1): 179 – 84. 98. Smith AJ, Murray PE, Sloan AJ, Matthews JB, Zhao S. Estimulación transdentinal de la dentinogénesis 67. Kitasako Y, Shibata S, Pereira PN, Tagami J. Puente de dentina a corto plazo de pulpas expuestas mecánicamente cubiertas con sistemas de resina adhesiva. Oper Dent 2000; 25:155–62. terciaria. Adv Dent Res 2001;15:51–4. 99. Aberg T, Wozney J, Thesleff I. Los patrones de expresión de proteínas morfogenéticas óseas (Bmps) en el diente de ratón en desarrollo sugieren funciones en la morfogénesis y la diferenciación celular. Dev Dyn 68. Murray PE, About I, Lumley PJ, Franquin JC, Remusat M, Smith AJ. Espesor de la dentina remanente de la cavidad y actividad pulpar. Am J Dent 2002;15:41–46. 69. Murray PE, Hafez AA, Smith AJ, Windsor LJ, Cox CF. Análisis histomorfométrico del número de células similares a odontoblastos y la actividad secretora del puente de dentina después de la exposición de la pulpa. Int Endod J 2003;36:106 –16. 70. Murray PE, Lumley PJ, Ross HF, Smith AJ. Cultivo de órganos de cortes de dientes para la evaluación de la 1997;210:383–96. 100. Nakashima M, Reddi AH. La aplicación de proteínas morfogenéticas óseas a la odontología Ingeniería de tejidos. Nat Biotechnol 2003;21:1025–32. 101. Nakashima M, Nagasawa H, Yamada Y, Reddi AH. Papel regulador del factor de crecimiento transformantebeta, proteína morfogenética ósea-2 y proteína-4 en la expresión génica de proteínas de la matriz extracelular y la diferenciación de las células de la pulpa dental. Dev Biol 1994; 162: 18-28. citotoxicidad de los materiales dentales. Biomat 2000;21:1711–1721. 71. Höhl E. Beitrag zur Histologie der Pulpa und des Dentins. Archivos Anatómicos Physiologie 1896; 32: 31–54 [en alemán]. 72. Feit J, Metelova M, Sindelka Z. Incorporación de timidina 3H en pulpa dañada de incisivos de rata. J Dent Res 1970;49:783–6. 73. Fitzgerald M. Mecánica celular de reparación de puentes de dentina usando 3H-timidina. J Dent Res 1979;58 (Spec Iss D): 2198 –206. 74. Fitzgerald M, Chiego DJ Jr, Heys DR. Análisis autorradiográfico del reemplazo de odontoblastos después de la exposición pulpar en dientes de primates. Arco Oral Biol 1990; 35:707–15. 75. Ruch JV. Distribución modelada de diferenciación de células dentales: hechos e hipótesis. J Biol Buccale 1990;18:91–8. 76. Ruch JV, Lesot H, Karcher-Djuricic V, Meyer JM, Olivie M. Hechos e hipótesis sobre el control y la diferenciación. Diferenciación 1982;21:7–12. 102. Saito T, Ogawa M, Hata Y, Bessho K. Efecto de aceleración de la proteína morfogenética ósea recombinante humana-2 en la diferenciación de células pulpares humanas en odontoblastos. J Endod 2004;30:205–8. 103. Iohara K, Nakashima M, Ito M, Ishikawa M, Nakasima A, Akamine A. Regeneración de dentina mediante terapia con células madre de pulpa dental con proteína morfogenética ósea humana recombinante 2. J Dent Res 2004;83:590 –5. 104. Sloan AJ, Smith AJ. Estimulación del complejo dentina-pulpa de los dientes incisivos de rata mediante la transformación de las isoformas 1–3 del factor de crecimiento beta in vitro. Arco Oral Biol 1999; 44:149 –56. 105. Sloan AJ, Rutherford RB, Smith AJ. Estimulación del complejo dentina-pulpa de rata por proteína morfogenética ósea-7 in vitro. Arch Oral Biol 2000;45:173–7. 106. Nakashima M. Inducción de la formación de dentina en pulpa canina amputada por proteínas morfogenéticas óseas humanas recombinantes (BMP) -2 y -4. J Dent Res 1994; 73:1515–22. 77. Yamamura T. Diferenciación de células pulpares e influencias inductivas de varias matrices con referencias a la cicatrización de heridas pulpares. J Dent Res 1985; 64 (Spec Iss): 530 - 40. 107. Nakashima M. Inducción de dentina en pulpa amputada de perros mediante proteínas morfogenéticas de hueso humano recombinante-2 y -4 con matriz de colágeno. Arch Oral Biol 1994;39:1085–9. 78. Goldberg M, Lasfargues JJ. Revisión del complejo pulpo-dentinario. J Dent Res 1995;23:15–20. 108. Six N, Decup F, Lasfargues JJ, Salih E, Goldberg M. Proteínas osteogénicas (sialoproteína ósea y proteína 79. Poulsom R, Alison MR, Forbes SJ, Wright NA. Plasticidad de células madre adultas. J. Pathol. 2002; 197:441– morfogenética ósea-7) y mineralización de la pulpa dental. J Mater Sci Mater Med 2002;13:225–32. 56. 80. Gajkowska A, Oldak T, Jastrzewska M, et al. Recuento de citometría de flujo de células madre y progenitoras hematopoyéticas CD34 en producto de leucoaféresis y médula ósea para trasplante clínico: una comparación de tres métodos. Folia Histochem Cytobiol 2006;44:53–60. 109. Lovschall H, Fejerskov O, Flyvbjerg A. Pulp-capping with recombinant human insu lin-like growth factor I (rhIGF-I) in rat molars. Adv Dent Res 2001;15:108 –12. 110. Banchs F, Trope M. Revascularización de dientes permanentes inmaduros con periodontitis apical: ¿nuevo protocolo de tratamiento? J Endod 2004;30:196 –200. 81. Shi S, Gronthos S. Nicho perivascular de células madre mesenquimales posnatales en médula ósea humana y pulpa dental. J Bone Miner Res 200;18:696 –704. 82. Liu J, Jin T, Ritchie HH, Smith AJ, Clarkson BH. Diferenciación y mineralización in vitro de células de pulpa dental humana inducidas por extracto de dentina. In Vitro Cell Dev Biol Anim 2005;41:232–8. 111. Rule DC, Winter GB Crecimiento de la raíz y reparación apical posterior a la necrosis pulpar en niños. Br Dent J 1966;120:586-90. 112. Iwaya S, Ikawa M, Kubota M. Revascularización de un diente permanente inmaduro con periodontitis apical y tracto sinusal. Dent Traumatol 2001;17:185–7. 113. Sato I, Ando-Kurihara N, Kota K, Iwaku M, Hoshino E. Esterilización de la dentina del conducto radicular 83. Wingard JR, Demetri GD, eds. Aplicaciones clínicas de citocinas y factores de crecimiento. Nueva York, NY: Springer, 1999. 84. Bazley LA, Gullick WJ La familia de receptores del factor de crecimiento epidérmico. Endocr Relat Cancer 2005;12(Suppl 1):S17–27. 85. Gospodarowicz D. Purificación de un factor de crecimiento de fibroblastos de pituitaria bovina. J Biol Chem 1975;250:2515–20. 86. Ramoshebi LN, Matsaba TN, Teare J, Renton L, Patton J, Ripamonti U. Ingeniería de tejidos: miembros de la superfamilia TGF-beta y sistemas de administración en la regeneración ósea. Experto Rev Mol Med 2002;2002:1–11. 87. Tabata Y. Regeneración de tejidos basada en la liberación de factores de crecimiento. Tejido Engl 2003; 9 (suplemento 1): S5–15. infectado mediante la aplicación tópica de una mezcla de ciprofloxacina, metronida zol y minociclina in situ. Int Endod J 1996;29:118-24. 114. Hoshino E, Kurihara-Ando N, Sato I, et al. Susceptibilidad antibacteriana in vitro de bacterias extraídas de dentina radicular infectada a una mezcla de ciprofloxacina, metronida zol y minociclina. Int Endod J 1996;29:125–30. 115. Sato T, Hoshino E, Uematsu H, Noda T. Susceptibilidad antimicrobiana in vitro a combinaciones de fármacos en bacterias de lesiones cariosas y endodónticas de dientes deciduos humanos. Oral Microbiol Immunol 1993;8:172–6. 116. Ritter AL, Ritter AV, Murrah V, Sigurdsson A. Trope M revascularización pulpar de dientes de perro inmaduros reimplantados después del tratamiento con minociclina y doxiciclina evaluada mediante flujometría láser Doppler, radiografía e histología. Dent Traumatol 2004;20:75–84. 88. Vasita R, Katti DS. Sistemas de suministro de factor de crecimiento para la ingeniería de tejidos: una perspectiva de los materiales. Expert Rev Med Devices 2006;3:29 – 47. 89. Stevens MM, Marini RP, Schaefer D, Aronson J, Langer R, Shastri VP. Ingeniería in vivo de órganos: el biorreactor óseo. Proc Natl Acad Sci USA 2005;102:11450 –5. 90. Murphy WL, Simmons CA, Kaigler D, Mooney DJ. Regeneración ósea mediante sustrato mineral y angiogénesis inducida. J Dent Res 2004;83:204 –10. 91. Martín I, Padera RF, Vunjak-Novakovic G, Freed LE. Diferenciación in vitro de células estromales de médula ósea de embrión de pollo en tejidos cartilaginosos y óseos. 117. Yanpiset K, Trope M. Revascularización pulpar de dientes de perro inmaduros reimplantados después de diferentes métodos de tratamiento. Endod Dent Traumatol 2000;16:211–7. 118. Vicepresidente de Terranova, Odziemiec C, Tweden KS, Spadone DP. Repoblación de superficies de dentina por células del ligamento periodontal y efecto de células endoteliales del factor de crecimiento de fibroblastos básico. J Periodontol 1989;60:293–301. 119. Kling M, Cvek M, Mejare I. Tasa y previsibilidad de la revascularización pulpar en incisivos permanentes reimplantados terapéuticamente. Endod Dent Traumatol 1986;2:83–9. J Orthop Res 1998;16:181–9. 92. Murray PE, Smith AJ. Ahorro de pulpas: una base biológica. Una visión general. Cuidado de abolladuras Prim 2002;9:21–6. 388 Murray et al. 120. Amler MH. El factor de la edad en la cicatrización de heridas por extracción humana. J Oral Surg 1977;35:193– 7. JOE — Volumen 33, Número 4, abril de 2007 Machine Translated by Google Artículo de revisión 121. Llames SG, Del Rio M, Larcher F, et al. Plasma humano como andamio dérmico para la generación de una piel bioingeniería completamente autóloga. Trasplante 2004;77:350 –5. 150. Tuzlakoglu K, Bolgen N, Salgado AJ, Gomes ME, Piskin E, Reis RL. Andamios combinados de nano y microfibra: una nueva arquitectura para la ingeniería de tejido óseo. J Mater Sci Mater Med 2005;16:1099 – 104. 122. Frye CA, Wu X, Patrick CW. Las células endoteliales microvasculares mantienen la viabilidad de los preadipocitos en condiciones hipóxicas. In Vitro Cell Dev Biol Anim 2005;41:160 – 4. 123. Risbud MV, Albert TJ, Guttapalli A, et al. Diferenciación de células madre mesenquimales hacia un fenotipo similar al núcleo pulposo in vitro: implicaciones para la terapia de trasplante basada en células. Columna 2004;29:2627–32. 124. Hofer SO, Mitchell GM, Penington AJ, et al. El uso de pimonidazol para caracterizar la hipoxia en el ambiente interno de una cámara de ingeniería de tejidos in vivo. Br J Plastic Surg 2005;58:1104 –14. 151. van Amerongen MJ, Harmsen MC, Petersen AH, Kors G, van Luyn MJ. La degradación enzimática de andamios y su reemplazo por matriz extracelular vascularizada en el miocardio murino. Biomateriales 2006;27:2247– 57. 152. Griffon DJ, Sedighi MR, Sendemir-Urkmez A, Stewart AA, Jamison R. Evaluación de la siembra de células dinámicas y al vacío de andamios de ácido poliglicólico y quitosano para la ingeniería del cartílago. Am J Vet Res 2005;66:599 – 605. 153. Guo T, Zhao J, Chang J, Ding Z, Hong H, Chen J, Zhang J. Andamio poroso de quitosano y gelatina que contiene ADN plasmídico que codifica el factor de crecimiento transformante beta1 para la proliferación de 125. Lembert N, Wesche J, Petersen P, et al. La encapsulación de islotes en capilares de polisulfona hidroximetilada de superficie rugosa estimula la liberación de VEGF y promueve la vascularización después del trasplante. Trasplante celular 2005;14:97–108. 126. Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaillie CM. Purificación y expansión ex vivo de células progenitoras mesodérmicas de médula humana posnatal. Sangre 2001;98:2615–25. condrocitos. Biomateriales 2006;27:1095–103. 154. Elisseeff J, Puleo C, Yang F, Sharma B. Avances en la ingeniería de tejidos esqueléticos con hidrogeles. Orthod Craneofac Res 2005;8:150 – 61. 155. Trojani C, Weiss P, Michiels JF, et al. Cultivo tridimensional y diferenciación de células osteogénicas humanas en un hidrogel de hidroxipropilmetilcelulosa inyectable. Biomateriales 2005;26:5509 –17. 127. Kindler V. Supervivencia postnatal de células madre: ¿el nicho, un puerto raro donde resistir la marea baja de la diferenciación, también proporciona instrucciones específicas del linaje? J Leukoc Biol 2005;78:836-44. 128. Brazelton TR, Blau HM. Técnicas de optimización para el seguimiento de células madre trasplantadas in vivo. Stem Cells 2005;23:1251–65. 129. Nakashima M. Proteínas morfogenéticas óseas en la regeneración de la dentina para su uso potencial en la 156. Dhariwala B, Hunt E, Boland T. Creación rápida de prototipos de construcciones de ingeniería de tejidos, utilizando hidrogeles fotopolimerizables y estereolitografía. Tejido Engl 2004; 10:1316 –22. 157. Alhadlaq A, Mao JJ. Construcciones osteocondrales de ingeniería tisular en forma de cóndilo articular. J Bone Joint Surg Am 2005;87:936 – 44. 158. Desgrandchamps F. Biomateriales en reconstrucción funcional. Curr Opin Urol 2000;10:201– 6. terapia de endodoncia. Factor de crecimiento de citoquinas Rev 2005;16:369 –76. 130. Ulloa-Montoya F, Verfaillie CM, Hu WS. Sistemas de cultivo de células madre pluripotentes. J Biosci Bioeng 2005;100:12–27. 131. Schmalz G. Uso de cultivos celulares para pruebas de toxicidad de materiales dentales: ventajas y limitaciones. J Dent 1994;22(Suplemento 2):S6 –11. 132. Peter SJ, Miller MJ, Yasko AW, Yaszemski MJ, Mikos AG. Conceptos de polímeros en ingeniería de tejidos. J Biomed Mater Res 1998;43:422–7. 133. Venugopal J, Ramakrishna S. Aplicaciones de nanofibras poliméricas en biomedicina y biotecnología. Appl Biochem Biotechnol 2005;125:147–58. 134. Fukuda J, Khademhosseini A, Yeh J, Engl G, Cheng J, Farokhzad OC, Langer R. Cocultivos de células con micropatrones que utilizan la deposición capa por capa de componentes de la matriz extracelular. Biomateriales 2006;27:1479 – 86. 159. Luo Y, Shoichet MS. Un hidrogel fotolábil para el crecimiento y la migración de células tridimensionales guiadas. Nat Mater 2004;3:249-53. 160. Dusseiller MR, Schlaepfer D, Koch M, Kroschewski R, Textor M. Un método de impresión de microcontacto invertido en chips de poliestireno estructurados topográficamente para el cultivo micro-3-D en matriz de células individuales. Biomateriales 2005;26:5917–25. 161. Sanjana NE, Fuller SB. Un método de impresión de chorro de tinta rápido y flexible para modelar neuronas disociadas en cultivo. J Neurosci Methods 2004;136:151–63. 162. Barron JA, Krizman DB, Ringeisen BR. Impresión láser de células individuales: análisis estadístico, viabilidad celular y estrés. Ann Biomed Engl 2005;33:121–30. 163. Barron JA, Wu P, Ladouceur HD, Ringeisen BR. Impresión láser biológica: una técnica novedosa para crear patrones celulares tridimensionales heterogéneos. Microdispositivos biomédicos 2004;6:139 – 47. 135. Huang GT, Sonoyama W, Chen J, Park SH. Caracterización in vitro de células de pulpa dental humana: diversos métodos de aislamiento y entornos de cultivo. Cell Tissue Res 2006;27:1–12. 136. Helmlinger G, Yuan F, Dellian M, Jain RK. Gradientes intersticiales de pH y pO2 en tumores sólidos in vivo: las mediciones de alta resolución revelan una falta de correlación. Nat Med 1997;3:177–82. 164. Mattick JS. El genoma humano y el futuro de la medicina. Med J agosto de 2003; 179: 212–6. 165. Morgunkova AA. La familia de genes p53: control de la proliferación y desarrollo celular programas tales. Bioquímica (Mosc) 2005;70:955–71. 166. Li J, Zheng C, Zhang X, et al. Desarrollo de un modelo animal grande conveniente para la transferencia de 137. Nakashima M. Ingeniería de tejidos en endodoncia. Aust Endod J 2005;31:111–3. 138. Oringer RJ Mediadores biológicos para la regeneración periodontal y ósea. compendio genes a las glándulas salivales in vivo. J Gene Med 2004;6:55–63. 167. Jullig M, Zhang WV, Stott NS. Terapia génica en cirugía ortopédica: estado actual. ANZ J Surg 2004;74:46 –54. Contin Educación Den. 2002;23:501–4, 506–10. 139. Karande TS, Ong JL, Agrawal CM. Difusión en andamios de ingeniería de tejidos musculoesqueléticos: problemas de diseño relacionados con la porosidad, la permeabilidad, la arquitectura y la mezcla de nutrientes. Ann Biomed Engl 2004;32:1728 – 43. 140. Tabata Y. Nanomateriales de sistemas de administración de fármacos para la regeneración de tejidos. Métodos Mol Biol 2005;300:81–100. 141. Boccaccini AR, Blaker JJ. Materiales compuestos bioactivos para andamios de ingeniería de tejidos. Expert Rev Med Devices 2005;2:303–17. 142. Kitasako Y, Shibata S, Pereira PN, Tagami J. Puentes de dentina a corto plazo de pulpas expuestas mecánicamente cubiertas con sistemas de resina adhesiva. Oper Dent 2000; 25:155–62. 168. Heller LC, Ugen K, Heller R. Electroporación para la transferencia de genes dirigida. Opinión de expertos Drug Deliv 2005;2:255–68. 169. Naldini L, Blomer U, Gallay P, et al. Entrega de genes in vivo y transducción estable de células que no se dividen por un vector lentiviral. Ciencia 1996; 272: 263–7. 170. Nakashima M, Reddi AH. La aplicación de proteínas morfogenéticas óseas a la odontología Ingeniería de tejidos. Nat Biotechnol 2003;21:1025–32. 171. Rutherford RB. Transferencia del gen BMP-7 a pulpas dentales de hurón inflamadas. Eur J Oral Sci 2001;109:422– 4. 172. Stolberg SG. Los ensayos se detienen en la terapia génica: el niño en el experimento se enferma: nuevo revés para la investigación. NY Times 2002; A1, A25. 143. Mayor IA, Dahl E, Cox CF. Curación de exposiciones pulpares: un estudio ultraestructural. J Oral Pathol Med 1991;20:496 –501. 144. Silva TA, Rosa AL, Lara VS. Proteínas de la matriz dentinaria y factores solubles: ¿señales reguladoras intrínsecas para la cicatrización y reabsorción de los tejidos dentales y periodontales? Oral Dis 2004;10:63– 173. Rutherford RB, Gu K. Tratamiento de pulpas dentales de hurón inflamadas con proteína morfogenética ósea recombinante-7.1. Eur J Oral Sci 2000;108:202–6. 174. Barthel CR, Rosenkranz B, Leuenberg A, Roulet JF. Recubrimiento pulpar de exposiciones cariosas: resultado del tratamiento después de 5 y 10 años: un estudio retrospectivo. J Endod 2000;26:525–8. 74. 145. Schopper C, Ziya-Ghazvini F, Goriwoda W, et al. La composición HA/TCP de un biomaterial CaP poroso mejora la formación ósea y la degradación del andamio: un estudio histológico a largo plazo. J Biomed Mater Res B 175. Sedgley CM, Molander A, Flannagan SE, et al. Características de virulencia, fenotipo y genotipo de Enterococcus spp endodóntico. Oral Microbiol Immunol 2005;20:10 –9. Appl Biomater 2005;74:458 – 67. 146. Sachlos E, Czernuszka JT. Hacer que los andamios de ingeniería de tejidos funcionen. Revisión: la aplicación de la tecnología de fabricación sólida de forma libre a la producción de andamios de ingeniería de tejidos. 176. Goldman LB, Goldman M, Kronman JH, Lin PS. La eficacia de varias soluciones de irrigación para endodoncia: un estudio con microscopio electrónico de barrido. Cirugía oral Oral Med Oral Pathol 1981;52:197–204. Eur Cell Mater 2003;30:29 –39. 147. Freed LE, Vunjak-Novakovic G, Biron RJ, et al. Andamios de polímeros biodegradables para ingeniería de tejidos. Biotecnología 1994;12:689 –93. 148. Athanasiou KA, Niederauer GG, Agrawal CM. Esterilización, toxicidad, biocompatibilidad y aplicaciones clínicas de copolímeros de ácido poliláctico/ácido poliglicólico. Biomateriales 1996;17:93–102. 149. Taylor MS, Daniels AU, Andriano KP, Heller J. Seis polímeros bioabsorbibles: toxicidad aguda in vitro de los productos de degradación acumulados. J Appl Biomater 1994;5:151–7. JOE — Volumen 33, Número 4, abril de 2007 177. Kaufman AY, Keila S. Hipersensibilidad al hipoclorito de sodio. J Endod 1989; 15:224 – 6. 178. Oncag O, Hosgor M, Hilmioglu S, Zekioglu O, Eronat C, Burhanoglu D. Comparación de los efectos antibacterianos y tóxicos de varios irrigantes del conducto radicular. Int Endod J 2003;36:423–32. 179. Takeda FH, Harashima T, Kimura Y, Matsumoto K. Un estudio comparativo de la eliminación del barrillo dentinario mediante tres irrigantes endodónticos y dos tipos de láser. Int Endod J 1999;32:32–9. Endodoncia Regenerativa 389 Machine Translated by Google Artículo de revisión 180. Jeansonne M, Blanco RR. Una comparación de gluconato de clorhexidina al 2,0 % e hipoclorito de sodio al 5,25 % como irrigantes endodónticos antimicrobianos. JEndod 1994; 20:276 – 8. 195. Zehnder M, Schmidlin P, Sener B, Waltimo T. Quelación en la terapia del conducto radicular reconsiderado. JEndod 2005;31:817–20. 196. Torabinejad M, Khademi AA, Babagoli J, et al. Una nueva solución para la eliminación del barrillo 181. Leonardo MR, Tanomaru Filho M, Silva LAB, Nelson Ffilho P, Bonifacto KC, Ito IY. Actividad antimicrobiana in vitro de clorhexidina al 2,0% utilizada como solución de irrigación del conducto radicular. J Endod 1995;25:167–71. dentinario. J Endod 2003;29:170-5. 197. Torabinejad M, Johnson WB. Solución de riego y métodos de uso. Oficina de Patentes y Marcas de EE.UU. Solicitud de Patente de Estados Unidos 20030235804; 25 de diciembre de 2003. 182. Yesilsoy C, Whitaker E, Cleveland D, Phillips E, Trope M. Efectos antimicrobianos y tóxicos de irrigantes de conducto radicular establecidos y potenciales. JEndod 1995;21:513–5. 183. Yamashita JC, Tanomaru Filho M, Leonardo MR, Rossi MA, Silva LAB. Estudio con microscopio electrónico de barrido de la capacidad de limpieza de la clorhexidina como irrigante del conducto 198. Zhang W, Torabinejad M, Li Y. Evaluación de la citotoxicidad de MTAD usando el MTT método de tetrazolio. J Endod 2003;29:654-7. 199. Bogardus JB, Blackwood RK Jr. Solubilidad de doxiciclina en solución acuosa. J Parm Sci 1979;68:188-94. radicular. Int Endod J 2003;36:391– 4. 184. Estrela CR, Estrela C, Reis C, Bammann LL, Pecora JD. Control de microorganismos in vitro mediante irrigantes endodónticos. Braz Dent J 2003;14:187–92. 185. Fouad AF, Zerella J, Barry J, Spangberg LS. Detección molecular de especies de Enterococcus en conductos radiculares de infecciones endodónticas resistentes a la terapia. Cirugía Oral Oral Med Oral Patol Oral Radiol Endod 2005;99:112– 8.; Fe de erratas en: Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;99:254. 186. Stuart CH, Schwartz SA, Beeson TJ, Owatz CB. Enterococcus faecalis: su papel en el fracaso del 200. Torabinejad M, Cho Y, Khademi AA, Bakland LK, Shabahang S. El efecto de varias concentraciones de hipoclorito de sodio en la capacidad de MTAD para eliminar el barrillo dentinario. J Endod 2003;29:233– 9. 201. Shabahang S, Torabinejad M. Efecto de MTAD en conductos radiculares contaminados con Enterococcus faecalis de dientes humanos extraídos. J Endod 2003;29:576-9. 202. Baker PJ, Evans RT, Coburn RA, Genco RJ. La tetraciclina y sus derivados se unen fuertemente a la superficie del diente y se liberan de ella en forma activa. J Periodontol 1983;54:580 –5. tratamiento de conducto y los conceptos actuales en el retratamiento. J Endod 2006; 32:93–8. 203. Bjorvatn K, Skaug N, Selvig KA. Esmalte y dentina impregnados de tetraciclina: duración de la capacidad antimicrobiana. Scand J Dent Res 1985;93:192–7. 187. Jacobsen PL, Epstein JB, Cohan RP. Comprender los productos dentales "alternativos". Gen Dent 2001;49:616-20. 188. Brannstrom M. Smear layer: consideraciones patológicas y de tratamiento. Oper Dent Suppl 1984;3:35– 42. 189. Czonstkowsky M, Wilson EG, Holstein FA. El barrillo dentinario en endodoncia. abolladura clin 204. Costea DE, Dimba AO, Loro LL, Vintermyr OK, Johannessen AC. El fenotipo del epitelio oral humano normal reconstituido in vitro está determinado esencialmente por el medio de cultivo. J Oral Pathol Med 2005;34:247–52. 205. Strobl H, Gojer G, Norer B, Emshoff R. Evaluación de la revascularización de incisivos superiores permanentes avulsionados mediante flujometría láser Doppler. J Am Dent Assoc 2003; 134:1597–603. North Am 1990;34:13–25. 190. Takeda FH, Harashima T, Kimura Y, Matsumoto K. Un estudio comparativo de la eliminación del barrillo dentinario mediante tres irrigantes endodónticos y dos tipos de láser. Int Endod J 1999;32 32–9. 191. Torabinejad M, Handysides R, Khademi A, Bakland L. Implicaciones clínicas del barrillo dentinario en endodoncia: una revisión. Cirugía oral Oral Med Oral Path Oral Rad Endo 2002;94:658 – 66. 206. Petersson K, Soderstrom C, Kiani-Anaraki M, Levy G. Evaluación de la capacidad de las pruebas térmicas y eléctricas para registrar la vitalidad de la pulpa. Endod Dent Traumatol 1999;15:127–31. 207. Kress B, Buhl Y, Anders L, Stippich C, Palm F, Bahren W, Sartor K. Análisis cuantitativo de la intensidad de la señal de resonancia magnética como herramienta para evaluar la vitalidad de la pulpa dental. Dentomax illofac Radiol 2004;33:241– 4. 192. Sen BH, Wesselink PR, Turkun M. El barrillo dentinario: un fenómeno en la terapia del conducto radicular. Int Endod J 1995;28:141–8. 193. Menezes AC, Zanet CG, Valera MC. Capacidad de eliminación del barrillo dentinario de las soluciones desinfectantes utilizadas con y sin EDTA para la irrigación de canales: un estudio SEM. Pesqui Odontol Bras 2003;17:349 –55. 194. Riond JL, Riviére JE. Farmacología y toxicología de la doxiciclina. Vet Hum Toxicol 1988;30:431–43. 208. Friedman S, Mor C. El éxito de la terapia endodóntica: curación y funcionalidad. J California Dent Assoc 2004;32:493–503. 209. Lazarski MP, Walker WA, 3.°, Flores CM, Schindler WG, Hargreaves KM. Evaluación epidemiológica de los resultados del tratamiento de conducto no quirúrgico en una gran cohorte de pacientes dentales asegurados. J Endod 2001;27:791–6. 210. Salehrabi R, Rotstein I. Resultados del tratamiento endodóntico en una gran población de pacientes en los EE. UU.: un estudio epidemiológico. J Endod 2004;30:846 –50. 390 Murray et al. JOE — Volumen 33, Número 4, abril de 2007