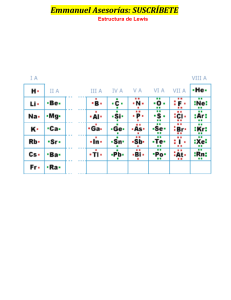
GUIA No. 6 ENLACE QUÍMICO 1. Defina el término enlace químico. 2. Describa dos formas en que los átomos adquieren estabilidad al combinarse unos con otros. ¿Qué clase de compuesto resulta de esas combinaciones? 3. ¿Qué son los electrones de valencia? ¿Por qué son tan importantes? 4. Explique las reglas del dueto y del octeto. 5. ¿Por qué los gases nobles no forman compuestos? 6. ¿Por qué la mayoría de los elementos no se encuentran puros, en estado libre, en la naturaleza? 7. Describa lo que ocurre cuando un átomo se oxida y cuando un átomo se reduce. ¿Cómo se llaman a los iones positivos y a los iones negativos? 8. ¿Cómo se forma el enlace iónico? ¿Cómo se forma el enlace covalente? 9. ¿Cuáles son los elementos diatómicos? 10.¿Cómo se forma un enlace sencillo? ¿Uno doble? Y ¿Uno triple? 11.Explique brevemente ¿Cuál es la diferencia entre el enlace covalente polar y el no polar? 12.Elabore un cuadro comparativo entre propiedades de los enlace covalente y un enlace iónico. Enliste al menos 4. 13.¿Cómo se sabe si un compuesto es iónico o covalente con solo ver su fórmula? Observe los elementos que lo forman. 14.Describa el enlace metálico. 15.Elabore la configuración electrónica de cada elemento y usando la estructuras de Lewis determine los iones que se forman cuando se combinan los elementos. Proporcione la formula del compuesto que resultaría al combinar • Yodo y magnesio • Calcio y flúor • Zinc y bromo • Sodio y fosforo • Aluminio y oxigeno • Berilio y cloro 16.Elabore la configuración electrónica de cada elemento y a partir de la estructuras de Lewis calcule la cantidad de electrones que debe distribuir. Luego dibuje las estructuras de Lewis para las partículas. Deje planteado el procedimiento. • SO3 2• H3PO4 • CF4 • ClO2 1• C2H6 • HBrO3 1– • NO3 • NH4 1+ • C2H4 PBr3 • • SCl2 17.Determinar el estado o número de oxidación de cada elemento presente en cada inciso: • HIO2 • HClO2 • Cr 2O3 • O2 • S2O3 2• KH 1• HS • CaH2 2• B4O7 18. Indique el número de protones y electrones que posee cada partícula. • 26Fe 3+ • 53 I 1• 7 N 3• 56Ba 2+ • 37Rb 1+ • 52Te 2- 19. Calcular el ∆E (Diferencia de Electronegatividad) y establecer qué tipo de enlace hay en cada compuesto de acuerdo a esa diferencia. Hacer uso de los datos de la Tabla Periódica con valores de Electronegatividad de cada elemento. Tome en cuenta: • Restar siempre el valor numérico mayor de Electronegatividad del menor para cada compuesto. El valor de la ∆E no puede dar valores negativos. • Para compuesto que tenga un sub índice mayor de (1) su valor de ∆E solo se resta una vez. • Para elementos en estado molecular cuyo sub índice es 2 se resta dos veces (el mismo valor) Ejemplo Cl2, Br2, I2, H2, O2, N2) o poliatómica (S8, P4, etc.) se forma un Enlace covalente No Polar. TABLA DE ELECTRONEGATIVIDAD No. Compuesto 1 CaCl2 2 SO2 3 HF 4 HBr 5 Cl2 6 F2 7 NaCl 8 H2S 9 CO2 10 KI Electronegatividades de cada elemento Diferencia Electronegatividad (∆E) Tipo de Enlace Químico Observaciones: 1) Restar siempre el valor numérico mayor de Electronegatividad del menor para cada compuesto. El valor de la ∆E no puede dar valores negativos. 2) Para compuestos que tienen un sub índice mayor de (1) su valor de ∆E solo se resta una vez. 3) Para elementos en estado molecular cuyo sub índice es (2) se resta dos veces (el mismo valor) Ejemplo Cl2, Br2, I2, H2, O2, N2) o poliatómica (S8, P4, etc.) se forma un Enlace covalente No Polar.