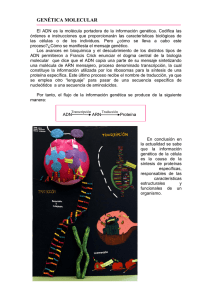
RESUMEN-PB2 SEMANA 1 • Transportadores o Bombas impulsadas por ATP, o Canales iónicos o Transportador proteína que transporta moléculas a través de la gradiente ▪ Uniportador transporta una molécula a favor de la gradiente. ▪ Simportador transporta 2 moléculas a favor de la gradiente ▪ anti portador transporta 1 molécula a favor de la gradiente y otra contra gradiente o GLUT transportador de glucosa o SGLT 1 enterocito (ABSORCION) y nefrona ▪ 2 moléculas de sodio por 1 molécula de glucosa (260 moléculas de H2O) o SGLT 2 nefrona (REABSORCION) ▪ 1 molécula de sodio por 1 molécula de glucosa • Transportador antiporte GLUT 1: o Requiere un cambio conformacional en el transportador, pero no requiere de energía • Eritrocito desoxigenado o el co2 entra a la célula. El agua se separa en h+ y oh-. el oh- se une con el co2 para formar hco3- y luego es liberado por la proteína AE1 mientras el cl- ingresa a la célula. el h+ se une con la histidina que esta con la hemoglobina y luego se libera el oxígeno. o Proteína AE1 antiporte de Cl-/HCO3• Eritrocito oxigenado o ingresa el hco3- a la célula mientras el cl- sale de la célula. el hco3- se separa en co2 y oh-. o2 entra a la célula y se une a la hemoglobina y la hemoglobina se une a la histidina que libera un h+. el h+ y el oh forman agua. • Bombas ATPasas o Clase P bomba na/k, bomba h, bomba ca, bomba, h/k, en vegetales y hongos o Clase V saca H, degrada ATP, hongos, endosomas, lisosomas, osteoclastos, vegetales o Clase F captura h+ para formar atp en mitocondria, atp sintasa, bacterias, mitocondrias y cloroplastos o Superfamilia ABC degrada ATP y bombea fármacos en bacterias • Bomba ATPasa en el enterocito (glut 2 y SGLT 1) o ingresa glucosa y sodio por Simportador SGLT1 a la célula. la glucosa se libera por un glut 2. el sodio se libera por una bomba ATPasa na/k e ingresa un potasio, el potasio es liberado por su canal. • HCl en el estomago o ingresa co2, el h2o se degrada en oh- y h+. el co2 y oh- forman el hco3- por la anhidrasa carbónica. el anti portador cl-/hco3- libera un hco3 e ingresa un cl a la célula y es liberado al estómago por su canal. el h+ es liberado por una bomba ATPasa de h/k que saca un h y libera un k y el k es liberado por su canal. fuera de la célula el h y el cl se unen y forman HCl. • Osteoclasto o ingresa co2, el h2o se degrada en oh- y h+. el co2 y oh- forman el hco3- por la anhidrasa carbónica. el anti portador cl-/hco3- libera un hco3 e ingresa un cl a la célula y es liberado al estómago por su canal. el h+ es liberado por una bomba ATPasa de h/k que saca un h y libera un k y el k es liberado por su canal. fuera de la célula el h y el cl se unen y forman HCl. el HCl degrada ca3(po4)2 en ca+ y po4. • Acuaporinas transportadores de agua • Canales iónicos voltaje dependiente, asociados a ligando, asociados a señales, canales de k+, ca+2, cl- y na+ • Contracción muscular o neurona tiene neurotransmisora acetilcolina y se une a su receptor colinérgico muscarimico, abre el canal na/k y favorece el ingreso de sodio a la célula muscular mientras que sale potasio. luego por tener mucho sodio en la célula muscular se abre otro canal de sodio e ingresa más sodio. por el ingreso de más sodio se abre el canal de ca+2 regulado por voltaje y además se libera el canal de calcio del retículo sarcoplasmático para ser liberado de la célula muscular para la contracción muscular. • glut asociado al musculo (mecanismo molecular de la insulina) o primero el páncreas libera insulina, la insulina se va al músculo y entra a su célula por el receptor de insulina (tirosina quinasa) que dispara una señal y activa el PI3K y activa el mTORC2 y convierte el pip2 en pip3 que activa el pdk1 y fosforera el pkb. el pkb fosforera al AS160 y al TBC1D1 y se unen para favorecer la translocación de glut 4 para que glucosa pueda ingresar a la célula. el pkb fosforera la GSK3 y ese hiperfosforila al glucógeno sintasa y sintetiza glucosa. o la glucosa no utilizada entra a la célula y se almacena en forma de glucógeno. • Glut asociado al hígado o Gluconeogénesis ▪ Síntesis de glucosa a partir de compuestos no glucosídico (aminoácidos, piruvato, lactato) o Glucolisis ▪ Degradación de glucosa para formar 2 moléculas de piruvato (no utiliza oxigeno) o Gluconeogénesis ▪ Síntesis de glucógeno a partir de glucosa o Glucogenólisis ▪ Degradación de glucógeno para sintetizar glucosa • Gluts GLUT Donde se expresa Afinidad a glucosa GLUT 1 Cerebro, placenta, tejidos fetales +++ (afinidad alta) GLUT 2 Hígado, páncreas, intestino + GLUT 3 Neuronas, riñón, testículo, retina, células tubulares, placenta ++++ (máxima afinidad) GLUT 4 Tejido adiposo, músculo esquelético, musculo cardiaco ++ GLUT 5 Intestino delgado, testículos, riñón + fructosa GLUT 6 Cerebro, bazo, leucocitos + GLUT 7 Hígado, intestinos, testículo, próstata +++ (fructosa y glucosa) GLUT 8 Testículo, cerebro +++ glucosa (y fructosa/galactosa) GLUT 9 Hígado, riñón, intestino Ácido úrico GLUT 10 Ubicuo GLUT 11 Páncreas, riñón, placenta + glucosa, +++ fructosa GLUT 12 Corazón, próstata • Galactosa ingresa a la célula por un SGLT • Glut 1 patología o La falla en el transportador de GLUT 1 (en el cerebro) hace que el cerebro no reciba glucosa y puede causar microcefalia, retraso mental, epilepsia, s cereboloso disfonías espasticidad, y problemas del movimiento • Receptores transmembrana o La unión de moléculas de señalización activa receptores sobre células diana. o Las diferentes moléculas extracelulares de señalización interaccionan con proteínas receptoras localizadas en la superficie de la célula diana. o La molécula de señalización o ligando se une a un sitio sobre el dominio extracelular del receptor con alta especificidad y afinidad. • Segundo mensajero AMPc, GMPc, DAG, IP3 o Proteínas o moléculas implicadas en la cascada de señalización TEJIDO HROMONA QUE INDUCE RESPUESTA CELULAR LA ELEVASION DE AMPc Adiposo Adrenalina, ACTH, Aumento en la hidrólisis de triglicéridos y disminuye la glucagón incorporación de aminoácidos Hepático Adrenalina, Incremento en la conversión de glucógeno a glucosa, inhibición noradrenalina, glucagón de la síntesis de glucógeno, aumento en la incorporación a aminoácidos, aumento en gluconeogénesis (síntesis de glucosa a partir de aminoácidos) Folículo ovárico FSH, LH Aumento en la síntesis de estrógeno, progesterona Corteza suprarrenal ACTH Aumento en la síntesis de aldosterona, cortisol Musculo cardiaco Adrenalina Aumento de la velocidad de contracción Tiroides TSH Secreción de tiroxina Óseo Hormona parotídea Aumento en la reabsorción de calcio a partir de los huesos Musculo esquelético Adrenalina Conversión de glucógeno a glucosa 1 fosfato Intestinal Adrenalina Secreción de liquido Renal Vasopresina Reabsorción de agua Plaquetas sanguíneas Prostaglandina I Inhibición de la agregación y la secreción • Clases de proteína g Tipo de proteína g Efector asociado Segundo mensajero Ejemplo de receptor G alfa s Adenilciclasa AMPc (aumentado) G alfa i Canal de K+ Adenilciclasa Adenilciclasa Fosfolipasa c Fosfolipasa c AMPc (disminuido) g G alfa q G alfa q G AMPc (aumentado) IP3, DAG (aumentado) IP3, DAG (aumentado) Receptor beta-adrenérgico (adrenalina), receptor para glucagón, serotonina, vasopresina Receptor a2-adrenergico, receptor muscarimico de acetilcolina Receptor de olor en la nariz Receptor a1-adrenergico Receptor de acetilcolina en células endoteliales Rodopsina (receptor de luz) en bastones cGMP GMPc (reducido) fosfodiestarasa • Receptor acoplado a proteína G o Los receptores que se unen a la proteína G están conformados por 7 dominios transmembrana unidos al extremo amino terminal en el exterior y el carboxilo en el citosol, actuando como traductores de señales a través de la membrana celular o el mecanismo de acción del receptor actúa cuando el ligando se une al receptor lo que permite la activación de la proteína G, mientras que la molécula de GDP que se encuentra unida a la subunidad alfa se disocia de las subunidades tanto beta como gamma respectivamente con el propósito de transformarse en una molécula de GTP con mayor energía lo que permite traducir la señal. • Mecanismo de activación de proteínas efectoras a partir de proteína G o Un ligando se une a un receptor de proteína G y consecuentemente lo activa, generando un cambio conformaciones en el receptor. o Después el receptor de proteína G se une a una subunidad alfa y se disocia GDP o GTP se une a la subunidad alfa, y en consecuencia las subunidades beta y gamma y el receptor de proteína G se disocian de la subunidad alfa. o La hormona se separa del receptor y la subunidad alfa se une al efector y queda activado. o Ocurre el hidrolisis de GTP a GDP y la subunidad alfa se separa del efector, y se vuelve a unir con las subunidades beta y gamma. o La subunidad alfa usa su actividad GTPasa para separarse del complejo beta/gamma o GEF factor de intercambio de nucleótidos de guanina proteína activadora o GAP proteína desaceleradora de ATPasa proteína inactivadora • Gq o el ligando se une al receptor acoplado de proteína g y activa al efector fosfolipasa C el cual activa al pip2 en la membrana y activa al DAG y al IP3 el cual abre canal de calcio del retículo sarcoplasmático y sale calcio. el calcio se une al PKC lo que permite la movilización hacia la membrana y se una con el DAG y forme el complejo y realice su acción de fosforila la proteína generando una respuesta celular. • Gs o la hormona se une al receptor acoplado de proteína g y activa la proteína g estimuladora el cual activa al efector (adenilato ciclasa) lo que hace que se produzca AMPc y por ello se fosforila la proteína y genere una respuesta celular. o Hormonas estimuladoras adrenalina, glucagón, ACTH • Gi o cuando la hormona inhibitoria se une con su receptor inhibe al complejo de proteína g inhibidos e inhibe al adenilato ciclasa lo cual hace que no haya una descontrolada producción de AMPC. o Hormonas inhibidoras PGE1, adeonsina • Escherichia coli (proteína Gs) o E coli llega al epitelio y su toxina será implantada y endocitado mediante una vesícula donde ingresa al aparato de Golgi y se libera la subunidad A y se libera mediante un exosoma para ser convertida en ADPribosa por efecto del NAD+ que activa la proteína g que cambie el GDP a GTP y activa el efector adenilato o ciclasa el cual activa al segundo mensajero de AMPc. Otra vía por la que entra la toxina es asociándose al receptor guanilil ciclasa el cual convierte el GTP a GMPc y activa a la proteína quinasa a y permite la liberación de cloro al exterior de la célula haciendo que sodio y agua se liberen al exterior de la célula generando diarrea o 1 Na -> 120 H2O o por la salida de cloro sale Na DPG1 Toxina pertussis: • la Bordetella pertussis es una bacteria gran negativa en forma de cocobacilos • la célula diana (objetiva) de la toxina pertussis es el epitelio respiratorio (epitelio pseudo-estratificado cilíndrico ciliado) • Bordetella se adhiere al epitelio y forma la toxina • factores de virulencia (adhesina/percatina) que favorece la adhesión de la bacteria al epitelio • la toxina es una toxina alfa beta o alfa cumple la función de inhibir al adenilato ciclasa o beta protege a la subunidad alfa de que se degrade. • la toxina aumenta la producción de moco y disminuye su eliminación porque los ciclos se pararon de mover • efecto final: acumulación de moco en las vías aéreas inferiores (tos ferina) • protómero a o responsable de la ADP-ribosilación canalizando la ribosilación del residuo de cisteína dentro de la proteína g o s1: compuesto por 235 residuos ▪ 195-204 optima la ribosilación de la subunidad alfa de la propina g ▪ 205-219 lugar de vinculación entre región catalítica de s1 y oligómero b ▪ 220-235 hidrofobias, interacción entre sí y oligómero b ▪ 41, 20 residuo de cisteína (forma el enlace di sulfuro entre la subunidad alfa de la proteína Gi y el NAD+) • oligómero b o responsable de la unión de específicos receptores de la superficie celular y la entrega del protómero a la célula recipiente. o sus 5 subunidades están unidas por enlaces no covalentes o s2-s3: 75% nucleótido, 70%homologia de nucleótido o s2: media la unión a galicanos no ciliados o s3: se une selectivamente a disacáridos ciliados. • RIBOSILACION: o la toxina pertussis cataliza la ribosilación de ADP de la subunidad alfa de la proteína Gi, previniendo que la proteína G interactúe con su efector o la ribosilación de ADP de la subunidad alfa del Gi inactiva a la subunidad alfa su unión de ADP ribosa o el AMPc se encarga de evitar el movimiento de los cilios o cuando la toxina inhibe al inhibidor, hay una producción de AMPc evitando el movimiento de los cilios para que se acumule el moco y cause la tos ferina. o la ribosilación ocurre porque la toxina pertussis que actúa como un ADP-ribosa transferasas el cual transfiere el ADPribosa para que se una con la subunidad alfa de la proteína de Gi en el residuo de cisteína y se unen por un enlace disulfuro. • A NIVEL CELULAR: • VIA DEPENDIENTE DE AMPC. o la subunidad alfa de la toxina inhibe a la subunidad alfa del Gi. (normalmente la Gi inhibe al adenilato ciclasa para que no se produzca AMPc) pero la toxina genera la liberación del adenilato ciclasa y el aumento descontrolado de AMPc. • VIA INDEPENDIENTE DE AMPC o el oligómero beta se une a los TLR4 (toll like receptors que son mediadores de la respuesta inmune innata) y causa hiperleucositosis (aumento de IL1beta y activa al NFkB) • fase paroxística o la segunda etapa de la tos ferina. la tos ferina tiene 3 etapas. las tres fases duran 3 meses o la etapa de mayor duración, puede durar entre 5-6 semanas o paroxismos de tos ▪ accesos de tos, pero es tos exigente, cianotizante, emetizante, deja físicamente agotado al paciente, ▪ puede haber hasta 100 paroxismos por día SEMANA 2 • enzima o proteínas que actúan como catalizadores biológicos, compuestos que incrementan la velocidad de las reacciones químicas por disminuir la energía de activación o la mayoría de enzimas son proteínas, pero algunas moléculas de ácido ribonucleico (ribozimas) también presentan actividad catalítica. • catalizador o proteína que incrementa la velocidad de reacciones químicas y disminuye la energía libre, tiene pH y temperaturas optimas • propiedades de enzimas o mejor velocidad de reacción o condiciones de reacción moderadas ▪ 37ºC, presión atmosférica, pH neutro. o mayor especificidad de reacción ▪ se une el sitio activo con el sustrato o capacidad de regulación ▪ se regula por inhibidores y sustratos • anhidrasa carbónica o captura el co2 en el eritrocito y la histidina captura el co2 y el oxigeno o La anhidrasa carbónica, abundante en las paredes de los alvéolos pulmonares y túbulos renales. o Hidrata al CO2: CO2 + H2O H2CO3 o Cuando se utiliza la enzima, la reacción es de 5000 a 10^7 veces más rápida. Cada molécula de enzima puede hidratar 10^5 moléculas de CO2 por segundo • clasificación de enzimas EJEMPLOS o oxidoreductasas ▪ reacción de óxido reducción ▪ deshidrogenasas y peroxidasas, catalasa o transferasas ▪ transferencias de grupos funcionales ▪ hexoquinasa y transaminasa o hidrolasas ▪ reacciones de hidrólisis ▪ alcalina fosfatasa y tripsina o liasas ▪ eliminación de grupos para formar doble enlace ▪ fumarasa y deshidratasa o isomerasa ▪ isomerización ▪ triosa fosfato isomerasa y fosfoglucomutasa o ligasas ▪ formación de enlaces, acoplados con la hidrólisis de ATP ▪ piruvato carboxilasa y ADN ligasa • apoenzima o parte proteica de una enzima inactiva • coenzima o parte no proteica que activa a la apoenzima, también puede ser una vitamina o provienen de las vitaminas (NAD+/NADP+)se deben regenerar, con el fin de completar el ciclo catalítico volviendo a su estado original o tiene afinidad por la enzima similar a la del sustrato o se encuentra unida covalentemente al sitio activo de la enzima en un lugar próximo a el o la mayoría de las • • • • • • • • coenzimas derivan de las vitaminas holoenzima o coenzima + apoenzimas que está activada cofactores o elementos no proteínicos que regulan o activa a las apoenzimas o 3 tipos ▪ activadores (inorgánicos) • cu+2 citocromo oxidasa • fe+2, fe+3 citocromo oxidasa, catalasa • k+ piruvato quinasa • mg+2 hexoquinasa, piruvato quinasa o el magnesio se une al atp (en 2 fosfatos) para estabilizarlo y el fosfato que no está unido al magnesio se une a la glucosa. • mn+2 argamasa • mo dinitrogenasa • ni+2 ureasa • se glutatión (antioxidante) • zn+2 anhidrasa carbónica, alcohol deshidrogenasa ▪ grupo prostético • esta unido a la apoenzima desde su creación • asociados a la estructura proteica de las enzimas mediante uniones covalentes o no covalentes ▪ coenzimas especificidad de enzima o modelo llave cerradura ▪ el sustrato debe encajar en la enzima, se une perfectamente a su sitio activo ▪ se unen los grupos funciones del sustrato y los grupos funcionales del sitio activo por enlaces no covalentes (interacciones van der Waals, electrostáticas y puentes de hidrogeno (más comunes)) o ajuste inducido ▪ el sitio activo se adapta a la forma del sustrato de manera inducido sitio activo o una hendidura o fisura en la enzima formada por una o más regiones de la cadena polipepldica donde ocurre la catálisis leucotrieno b4 o enzima leucotrieno a4 hidrolasa, el sitio activo está formado en el centro del tripéptido. energía de activación o energía libre del estado de transición menos la de los reactivos en una reacción o energía mínima necesaria para iniciar una reacción o catalizadores reducen la energía de activación isoformas o Una de las varias formas de la misma proteína cuyas secuencias de los aminoácidos difieren ligeramente y cuyas ac6vidades generales son similares. o Una alteración en la secuencia de aminoácidos, haciendo que sean diferentes. izoenzimas o enzimas que comparten el mismo sustrato y catalizan la misma reacción. o Están codificadas por el mismo gen y se forman a partir del splicing alternativo. o Diferente km, diferente temperatura y pH óptimos, diferente peso molecular o Estructura química similar alteración en la secuencia de aminoácidos haciendo que sean diferente o Cumplen su función en diferentes órganos o LDHs ▪ LDH1 elevado puede indicar un infarto agudo de miocardio ▪ LDH5 puede indicar una hepatitis aguda ▪ Ninguna LDH está a niveles altos en sangre o Creatinina quinasa ▪ Creatina Fosfocreatina ▪ MM musculo • • • • • • • • • • ▪ MB corazón ▪ BB cerebro Lisozimas o una enzima que destruye la pared celular bacteriana por hidrólisis de enlaces glucosídico beta1,4 del NAM y NAG o NAM ▪ acido n-acetilmurámico o NAG ▪ n-acetilglucosamina Serina proteasas o Enzimas proteolíticas que tiene un mecanismo catalítico común que involucra un residuo Ser con reactividad particular. o Enzimas que degradan proteínas o Ejemplos: quimiotripsina, tripsina, elastasa, pepsina, secretina. Ataque nucleofílico o El rompimiento de enlace por radical oxidrilo ubicado en el sitio activo de la enzima proteasa. Efectos del pH sobre la actividad enzimática o Mayoría de enzimas trabajan con pH neutro (7) o Si el pH cambia bruscamente desnaturalización Efectos de la temperatura sobre la actividad enzimática o Mayor temperatura, mayor velocidad de reacción Efectos de la concentración del sustrato sobre la actividad enzimática o Si hay menor concentración de sustratos, la enzima no está saturada, y hay mayor velocidad o Menor concentración, más velocidad (actividad enzimática), menor Km Factores de inhibidores sobre la actividad enzimática o El sustrato no puede unirse con el sitio activo porque el inhibidor lo está bloqueando Km o Concentración del sustrato necesaria para llegar a la mitad de la velocidad máxima o ^Km ^afinidad o glucoquinasa vs hexoquinasa ▪ glucoquinasa (hexoquinasa iv) funciona en el hígado y tiene un km de 10 mientras la hexoquinasa funciona en el cerebro y tiene un km de 0.2 ▪ ambas compiten para degradar glucosa a glucosa 6 fosfato. o anhidrasa carbónica ▪ el co2 es más agresivo que el hco3, y el co2 necesita ser degradado con mayor velocidad, por eso el Km del co2 es más alto. Reacciones bisustrato o Reacciones de transferencia, en la que se cataliza la transferencia de grupo funcional de una molécula a otra inhibidores o reversible ▪ competitivo • si el inhibidor se une al sitio activo, no se formará el producto • succinato deshidrogenasa o succinato fumarato ▪ se necesita d la enzima succinato deshidrogenasa para catalizar la reacción o malonato no reacción ▪ el succinato deshidrogenasa no cataliza ninguna reacción • alcohol deshidrogenasa o intoxicación por metanol ▪ si una persona toma metanol, se debe aplicar etanol para que el paciente se pueda desintoxicar porque compite con el alcohol deshidrogenasa ▪ no competitivo • el inhibidor no se une al sitio activo, se une a un lugar que está cerca al sitio activo. • cuando el inhibidor no competitivo se une a su posición, modifica el sitio activo para que el sitio activo no reciba al sustrato y no se forme el producto. • No permite que se produzca la reacción ▪ A competitivo • no modifica el sitio activo, modifica la parte funcional de la enzima para que no se produzca la reacción ▪ resistencia de la penicilina: • penicilina rompe la pared celular de las bacterias, pero en las bacterias, la enzima beta lactamasa rompe el enlace del anillo beta-lactámico de la penicilina para inactivarla o irreversible ▪ el inhibidor queda, covalentemente o no, unido a la enzima o ligado tan fuertemente a el que su disociación es más lenta ▪ ejemplos reactivo de grupo –SH, metales pesados, inhibidores suicidas, organofosforados, ligando de metal • regulación enzimática o regulación a nivel de sustrato ▪ el propio producto de la reacción puede inhibir competitivamente a la enzima ▪ si hay exceso de glucosa, se activa la hexoquinasa iv ▪ si hay exceso de glucosa 6 fosfato se inhibe la hexoquinasa i o regulación por retroalimentación ▪ El producto actúa como inhibidor de la primera enzima. ▪ Esto impide: • La utilización innecesaria del primer sustrato • La acumulación del producto final • Se evita la acumulación de intermedios o Regulación alostérico ▪ Una efector alostérico se fija a la enzima en un si1o distinto y físicamente alejado del centro de fijación del sustrato. ▪ Positiva • Un regulador alostérico positivo se une con la enzima y abre un sitio activo para que se una el sustrato ▪ Negativa • Un regulador alostérico negativo se une con la enzima y cierra el sitio activo y evita que el sustrato se una. o Regulación por modificación covalente ▪ Fosforilación / desfosforilación • Existen enzimas que están inactivas hasta que se activan por unión covalente con otras moléculas y viceversa. ▪ Activación por ruptura proteolítica • Zimógeno o Enzima con una proteína extra que se encuentra inactiva o Pepsina: ▪ Pepsinogeno contiene a la pepsina y la proteína extra y con el HCl se remueve la proteína extra • Enzima de importancia medica o Citocromo p450 ▪ Conjunto de enzimas que son oxidoreductasa y produce color ▪ Detoxifica sustancias mediante reacciones de óxido-reducción, tiene mayor actividad en el hígado. ▪ Participa en la detoxificación de medicamentos en la etapa 1. o Ciclooxigenasa ▪ ácido araquidónico se encuentra en la membrana celular, cuando se libera de la célula puede ser atacada por la ciclooxigenasa (COX) 1 para regular la homeostasis y COX 2 causa daño en el organismo como dolor inflamación y altera la homeostasis. ▪ Producción de moco en el estómago • Enzimas de importancia medica Enzima Donde se encuentra Uso diagnostico AST – aspartato amino transferasa (transaminasa) (TGO) ALT – alanina amino transferasa (transaminasa) (TGP) Amilasa CK (creatinina quinasa) GGT – gamma glutamil transpeptidasa LDH Lipasa Fosfatasa alcalina Hígado, musculo esquelético, cerebro, corazón Hígado Daño hepato-celular Páncreas, y glándulas salivales Musculo esquelético, corazón, cerebro Hígado Pancreatitis aguda y obstrucción biliar Infarto agudo de miocardio y distrofia muscular, destrucción muscular Hepatitis, cirrosis, problemas en las vías biliares Linfoma y hepatitis, hemolisis Pancreatitis aguda y obstrucción biliar Enfermedades de hueso y cáncer óseo, intestinal Cáncer de próstata Corazón, glóbulos rojos Páncreas osteoblasto Daño hepato-celular Fosfatasa acida Próstata LABORATORIO: alfa-amilasa y catalasa • la secuencia de PTS1 marca la vesícula para dirigirla al peroxisoma • Los peroxisomas son orgánulos pequeños limitados por una sola membrana. • importancia de las enzimas o catalizadores biológicos o aumentan la velocidad de una reacción o disminuye energía de activación o son especificas -> solo actúan para una reacción • factores que afectan la actividad enzimática o dependiente de pH o dependiente de temperatura o concentración de sustrato o a menor velocidad de reacción, menor concentración del sustrato o inhibidores o reducen, inactivan la actividad enzimática • peroxisoma: o organela celular que consta de una membrana o tiene una matriz peroxisomal o no tiene ADN ni ribosomas o codificado por genes nucleares o sintetizado en ribosomas libres del citosol o contiene enzimas que canalizan reacciones de síntesis y degradación o la entrada de proteínas a la matriz del peroxisoma es dirigida por la secuencia de direccionamiento de PTS1 o PST1 (serina, lisina, leusina) -> Pex 5 o PTS2 -> pex 7 o funciones: ▪ oxidación de ácidos grasos solo el 25% ▪ síntesis de lípidos ▪ síntesis de pasmalógenos ▪ oxidación de ácido úrico y de aminoácidos ▪ intervienen en procesos de detoxificacion en células animales • enzima catalasa o enzima presente en peroxisomas o cataliza la conversión de peróxido de hidrógeno en agua y oxigeno o degrada etanol a acetaldehído • síndrome de zellweger o ocurre: ▪ trastorno de la biogénesis peroxisomal ▪ alteración en la estructura y en múltiples funciones de peroxisomas ▪ ausencia de peroxisomas normales ▪ mutación de genes PEX 15 genes • glándulas salivales glandular exocrinas en el sistema digestivo superior que produce saliva saliva liquido incoloro de consistencia acuosa o mucosa que contiene proteínas, enzimas, mucoproteinas, seroproteinas, carbohidratos, urea, aminoácidos amoniaco, vitaminas, etc. • enzima alfa-amilasa (ptialina): o es la enzima de la saliva o también llamada ptialina o enzima hidrológica ya que rompe los enlaces de hidrogeno hidrolizando cualquier enlace alfa 1,4 transformando las cadenas de almidón en azúcar simples • La prueba de lugol o para identificar la presencia de almidón, con este reactivo se obtiene un color azul-violeta característico. Se toma 1 mL de cada una de las muestras y se le agregan 4 gotas de lugol. Si se obtiene un resultado positivo no se realiza la prueba de Benedict. • La prueba de Benedict o permite identificar a los azucares reductores. Toma 1 ml de cada uno de las disoluciones de los tubos y agrégales 1 ml del reactivo de Benedict, enseguida coloca ambos tubos en baño María, si existe hidrólisis del almidón se formará un precipitado rojo ladrillo que indica la presencia de azúcares como la glucosa y la maltosa. DPG GLUCOSA 6 FOSFATO DESHIDROGENASA • Paciente mujer de 3 años de edad, hospitalizada por presentar fiebre, dificultad respiratoria y tos no productiva. • Al realizarle los exámenes correspondientes se le diagnostica Neumonía Viral y se le instaura tratamiento antipirético y antinflamatorio, así como hidratación endovenosa de soporte. • Un día después del ingreso presenta de forma abrupta decaimiento, palidez progresiva, dolor abdominal y torácico. • Ante este hecho se amplía la anamnesis a la madre y se descubre que la paciente tuvo una hospitalización de 8 días en el periodo neonatal por hiperbilirrubinemia (25,1 mg/dL) sin causa determinada. Se le solicitan exámenes auxiliares: o Hematocrito: 15,8% bajo o Hemoglobina: 5,8 gr/dL bajo o Glóbulos rojos: 2,0 x millón/uL bajo o Poiquilocitosis leve alteración en la forma de los glóbulos rojos o Policromatofilia leve a moderada cada glóbulo rojo tiene un tono distinto de rojo, por una tener una concentración distinta de hemoglobina o Leucocitos: 16,200 x mm3 elevados o Plaquetas: 399 000 x mm3 normal o Bilirrubina Total: 4,9 mg/dL elevada (debe ser soluble en agua para su eliminación) o Función renal y hepática conservada. elimina la posibilidad de que sea un problema hepático, • La paciente presentó de forma repentina una sintomatología diferente al cuadro característico de la patología por la que fue hospitalizada (Neumonía viral). o ¿Existe alguna relación entre el proceso infeccioso inicial y el consumo de fármacos usados en su tratamiento con el cuadro de descompensación que presento la paciente? ▪ paracetamol 10-15mg/kilo/dosis (máx. 60mg/kg/día) ▪ descompensación -> crisis hemolítica (causa más frecuente es la deficiencia de G6PD) ▪ algunos fármacos son capaces de desestabilizar o causar crisis hemolítica por el aumento de radicales libres. ▪ en una paciente con deficiencia de G6PD, no se produce el suficiente NADPH + H para regenerar el glutatión y que este neutralice a los radicales libre. ▪ los fármacos pueden conllevar a un incremento de ROS que causan el estrés oxidativo el cual causa que se acumule en el eritrocito y conlleve al hemólisis (la célula explota) antes de completar su ciclo de vida. ▪ hay fármacos que pueden causar la anemia hemolítica • De ser relevante la información aportada por la madre, ¿podríamos sospechar que la paciente presenta alguna enfermedad de fondo? o si, padece de anemia hemolítica por la deficiencia de glucosa 6 fosfato deshidrogenasa • ¿Podrá presentarse la deficiencia de alguna enzima? deficiencia de G6PD o o o • Si la respuesta es afirmativa, ¿en qué vías bioquímicas participa? vía de las pentosas fosfato • ¿Cómo se ven estas vías afectadas en el caso del paciente? o al disminuir la cantidad de la primera enzima, todo el ciclo se ve disminuido, con la consecuente disminución de NADPH + H. • ¿Por qué esta alteración tendría como consecuencia la hemólisis? o porque al disminuir el NADPH +H disminuye la tasa de regeneración del glutatión, y disminuye la eliminación de radicales libres y se incrementa el estrés oxidativo y la muerte celular o la enzima glutatión peroxidasa no se ve alterada, pero si disminuye su uso porque no hay glutatión reducido y no se puede neutralizar el h2o2 (radical libre) • VIA DEL GLUTATIÓN: o glutatión evita la acumulación de ROS o para regenerarlo, necesitas NADPH + H o si hay una deficiencia de G6PD o se disminuye la vía de las pentosas fosfato o se disminuye la producción de NADPH o causa que haya una baja producción de glutatión reducido o causa que los ROS no estén neutralizados o disminuye la eliminación de ROS por vía del glutatión y causa estrés oxidativo y muerte celular o la célula más afectada son los eritrocitos ya que necesitan más producción e glutatión para poder neutralizar los radicales libres o por ello se rompen y causan anemia hemolítica (bilirrubina elevada por la degradación de hemoglobina) SEMANA 3 • Carbohidratos o Clasificación -> aldosas (con un grupo aldehído) y cetosas (con un grupo cetona) o Monosacáridos -> glucosa, fructosa, galactosa o Disacáridos ▪ Maltosa = glucosa + glucosa ▪ Sacarosa = glucosa + fructosa ▪ Lactosa = galactosa + glucosa o Polisacáridos ▪ De almacenamiento • Almidón Polisacárido de reserva en vegetales (papa, arroz) enlace alfa 1,4 y alfa 1,6 • Glucógeno polisacárido de reserva en animales enlace alfa 1,4 y alfa 1,6 ▪ estructurales • celulosa pared celular vegetal enlace beta 1,4 • quitina pared celular de insectos enlace beta 1,4 ▪ las enzimas humanas solo pueden degradar enlaces alfa, no degradan enlaces beta. • digestión de carbohidratos o boca alfa amilasa degrada enlaces alfa 1,4 del almidón y se libera maltosa glucosa y dextrinas o estomago no se degradan carbohidratos por el pH acido o páncreas libera alfa amilasa pancreática o intestino usa alfa amilasa para degradar disacáridos a monosacáridos • absorción de carbohidratos en el enterocito o fructosa entra por glut 5 o glucosa entra por el SGLT 1 junto con dos sodios o glucosa sale por un glut 2 y se va al torrente sanguíneo para ser utilizado • índice glicémico o FPG determinación de glucosa en sangre en ayunas o HBa1C hemoglobina glicosilada o OGTT tolerancia oral a la glucosa • Sorbitol o Formado a partir de glucosa y es catalizado por la enzima aldosa reductasa y utiliza al NADPH como cofactor • Vía del sorbitol o Se activa cuando hay una hiperglicemia o La hexoquinasa se satura y degrada glucosa a glucosa 6 fosfato con menor velocidad o La glucosa se degrada a sorbitol por la enzima aldosa reductasa utilizando NADPH como cofactor. o El sorbitol se puede degradar a fructosa utilizando NADH como cofactor o La fructosa puede reingresar al glucolisis por la hexoquinasa utilizando ATP como cofactor o El NADH es dañino para la célula y se degrada por el NADH oxidasa y a su vez produce ROS o El aumento de ROS en la célula causa una disfunción mitocondrial o Por la vía del glucolisis si hay un aumento de gliceraldehído 3 fosfato puede formar un aumento de DAG el cual puede activar la vía del PKC en tejidos insulina dependientes el cual fosforila los residuos treoinina del IRS1 y inhibe los residuos de serina haciendo que no haya una translocación de los glut 4 y que glucosa no entre a la célula puede causar una resistencia a la insulina o El gliceraldehído 3 fosfato se degrada a metilglioxal el cual aumenta la producción de AGEs • Sorbitol y producción de ROS o La mielina se forma en los oligodendrocito (SNC) y en las células de Shwann o El ROS altera la producción de mielina y evita que haya una sinapsis nerviosa o El aumento de ROS produce una alteración en los factores de transcripción y pueden llevar a una vasoconstricción arterial y activa los factores pro-apoptóticos e induce la muerte celular programada • Galactosemia o fallo en enzimas galactoquinasa y galactosa1fosfato uridil transferasa (GALT) o hepato megalia -> hígado agrandado o hepato espleno megalia -> acumulación de galactitol o (deficiencia de galactoquinasa) ▪ La galactosa se degrada a galactosa 1 fosfato por la galactoquinasa para degradarse a UDP-galactosa para degradarse a UDP-glucosa ▪ causa galactosemia y galactosuria y un aumento de galactitol que causa cataratas o Galactosemia clásica ▪ Galactosa 1 fosfato uridil transferasa (GALT) no degrada galactosa 1 fosfato a UDP-galactosa ni UDPglucosa a glucosa 1 fosfato ▪ Causa galactosemia, galactosuria, vómitos, diarrea ▪ Causa disfunción del hígado, retardo mental y cataratas • Polisacáridos de importancia medica: glucógeno Tipo Enzima defectiva Órgano afectado Glucógeno en el Aspectos clínicos órgano I Von Glucosa 6 fosfatasa o Hígado y riñones Hepatomegalia, hipoglicemia, Glucógeno, Gierke cadena transportadora cetosis, hiperuricemia, hiperlipidemia estructura normal II Pompe Alfa 1,4 glucosidasa Todos los órganos Paro cardio-respiratorio y causa Glucógeno, (lisosomal) estructura normal muerte antes de los 2 años de edad III Cori Amilo 1,6 glucosidasa Musculo y hígado Hepatomegalia, hipoglucemia Glucógeno, estructura corta IV Enzimas (alfa 1,4 y alfa Hígado y bazo Cirrosis hepática, fallo del hígado, Glucógeno, Andersen 1,6) muerte estructura larga V Fosforilasa Músculo Calambres dolorosos Glucógeno, McArdele estructura normal VI Hers Fosforilasa Hígado Hepatomegalia hipoglucemia, cetosis Glucógeno VII Fosfo fructo quinasa Músculo Calambres dolorosos Glucógeno, estructura normal VIII Fosforilasa quinasa Hígado Hepatomegalia, hipoglucemia Glucógeno, estructura normal • • • • • • • • • • • Glucolisis o Via bioquímica de 10 reacciones enzimáticas en la que una molécula de glucosa se convierte en 2 moléculas de piruvato o Etapa 1: inversión de energía, perdida de 2 moléculas de APT. Paso 1-3 o Etapa 2: recuperación de energía, ganancia de 4 moléculas de ATP. Paso 4-10 o el Mg+2 es usado como cofactor en las enzimas quinasas el cual ayuda a fosforila y desfosforilar ▪ hexoquinasa, fosfofructoquinasa, fosfoglicerato quinasa, enolasa y piruvato quinasa glucosa -> glucosa-6-fosfato • gliceraldehido-3-fosfato -> 1,3difosfoglicerato o ATP -> ADP (Mg+2) o NAD+ -> NADH glucosa-6-fosfato -> fructosa-6-fosfato • 1,3difosfoglicerol -> 3fosfatoglicerato o ADP -> ATP fructosa-6-fosfato -> fructosa-1,6-difosfato o ATP -> ADP (Mg+2) • 3fosfatoglicerato -> 2fosfatoglicerato fructosa-1,6-fosfato se divide en: • 2fosfatoglicerato -> fosfoenolpiruvato o dihidroxiacetonafosfato o libera H2O (Mg+2) o gliceraldehido-3-fosfato • fosfoenolpiruvato -> piruvato dihidroxiacetonafosfato -> gliceraldehido-3-fosfato o ADP -> ADP (Mg+2) Regulación de glucolisis o El fosfofructoquinasa se encarga de regular la velocidad del glucolisis o enzimas reguladoras: ▪ hexoquinasa • inhibidores glucosa 6 fosfato ▪ fosfofructoquinasa • activadores AMPc, F1,6biP, AMP, ADP • inhibidores ATP, citrato ▪ piruvato quinasa • activadores AMP, F1,6biP • inhibidores ATP, acetil CoA o Si se necesita ATP, AMP y ADP se utilizan como activadores para poder formar ATP ▪ siempre serán inversos Fermentación láctica o Piruvato lactato por la enzima lactato deshidrogenasa (LDH) y utiliza al NADH como cofactor o Utiliza NADH liberando del glucolisis y luego NAD formado se vuelve a consumir o el eritrocito hace fermentación láctica porque no tiene mitocondria y necesita producir energía Fermentación alcohólica o Piruvato acetaldehído ▪ Por la enzima piruvato descarboxilasa y se libera CO2 o acetaldehído etanol ▪ por la enzima alcohol deshidrogenasa (ADH) y utiliza al NADH como cofactor Galactosa y fructosa o Galactosa puede convertirse en glucosa 6 fosfato o Manosa y fructosa (en musculo) se pueden convertir en fructosa 6 fosfato o Fructosa (en hígado) se puede convertir en gliceraldehído 3 fosfato o La afinidad de la hexoquinasa por la glucosa es 20 veces más que por la fructosa Complejo piruvato deshidrogenasa o Piruvato acetil CoA ▪ CoA-SH entra ▪ NAD+ NADH ▪ Co2 sale o TPP tiamina pirofosfato o E1 Piruvato deshidrogenasa o SS complejo disulfuro o E2 Dihidrolipoil transacetilasa o FAD flavin adenine dinucleótido o E3 Dihidrolipoil deshidrogenasa. 1. Descarboxilación del piruvato en c1 2. Piruvato se une a la tiamina 3. Tiamina transfiere grupo acetilo al E2 (une acetilo con CoA) se libera el ACETIL COA 4. Azufre se reduce en el E2 5. FADH2 recoge H de los dos grupos SH y se los da al NAD para formar NADH +H 6. Enzima queda oxidada para que se pueda unir con otro piruvato 7. arsénico y mercurio inhiben al complejo disulfuro • Ciclo de Krebs o Recupera energía a partir de varios combustibles metabólicos (NADH, FADH2, GTP) o Anfibólico (catabólico y anabólico) o acetil-coA + oxalacetato -> citrato (6c) ▪ acetoglutarato deshidrogenasa ▪ gana H2O o succinil-coA -> succinato ▪ pierde CoA ▪ GDP -> GTP ▪ citrato sintetasa ▪ pierde CoA o citrato -> isocitrato (5c) ▪ succinil-CoA-sintetasa ▪ pierde y gana H2O o succinato -> fumarato ▪ aconitasa ▪ FAD -> FADH2 o isocitrato -> α-cetoglutarato ▪ succinato deshidrogenasa ▪ NAD -> NADH o fumarato -> malato ▪ pierde CO2 ▪ gana H2O ▪ isocitrato deshidrogenasa ▪ fumarasa o α-cetoglutarato -> succinil-coA (4c) o malato -> oxalacetato ▪ NAD -> NADH ▪ NAD -> NADH ▪ pierde CO2 ▪ malato deshidrogenasa ▪ gana CoA Molécula Enzima Tipo de reacción Reactivo, coenzima Producto, coenzima Citrato Aconitasa Deshidratación H2O Cis- aconitato Aconitasa Hidratación H2O Isocitrato Isocitrato deshidrogenasa Oxidación NAD+ NADH + H+ Oxalsuccinato Isocitrato deshidrogenasa Descarboxilación Alfa- cetoglutarato Alfa- cetoglutarato Descarboxilación NAD+ + CoA-SH NADH + H+ + CO2 deshidrogenasa oxidativa Succinil coa Succinil-CoA sintetasa Hidrólisis GDP + P CoA-SH Succinato Siccinato deshidrogenasa Oxidación FAD FADH2 Fumarato Fumarato hidratasa Adición (H2O) H2O L malato Malato deshidrogenasa Oxidación NAD+ NADH + H+ oxalacetato Citrato sintetasa Condensación • Regulación del ciclo de Krebs o Piruvato Deshidrogenasa (activada Ca2+) o Enzimas determinantes de la velocidad del ciclo: ▪ Citrato sintasa ▪ Isocitrato deshidrogenasa (activada Ca2+) ▪ α-cetoglutarato deshidrogenasa (activada Ca2+) o Control flujo por 3 mecanismos: ▪ Disponibilidad del sustrato ▪ Inhibición del producto ▪ inhibición por retroalimentación competitiva por intermediarios a lo largo del ciclo o el NADH es un inhibidor o reacciónanapleroticas reacción directas e inmediata para obtener oxalacetato • Metabolismo del alcohol o Alcohol deshidrogenasa ▪ Citosol degrada etanol a acetaldehído utilizando NAD+ como cofactor ▪ Mitocondria acetaldehído es degradado a acetato por el aldehído deshidrogenasa (ADH) utilizando NAD+ como cofactor o Catalasa ▪ Degrada etanol a acetaldehído ▪ degrada H2O2 en H20 o CYP2E1 ▪ Degrada alcohol a acetaldehído utilizando NADPH como cofactor ▪ si tomas un fármaco, el cyp2e1 no puede degradar el fármaco causando intoxicación si tomas alcohol mientras tomas pastillas, no se puede degradar ninguno correctamente causando intoxicación • Beriberi y alcohol o Beriberi deficiencia de vitamina b1 o Síntomas perdida de reflejos, disnea, síndrome de Wernicke (confusión, coma, muerte) • Deficiencia de vitamina B1 o Insomnio, muerte en bebes, ataxia, baja presión sanguínea, falla del corazón, músculos adoloridos, retinopatía diabética, nefropatía, no poder escuchar, pérdida de memoria (alzhéimer), diabetes, acidosis. PORTAFOLIO 2: • explica los procesos bioquímicos de la vía de la aldosa reductasa. porque se activa la vía en la diabetes? o en pacientes con niveles glicémicos normales (entre 70-110 mg/dL), el metabolismo de la glucosa es dado por la hexoquinasa (km = 0.1) el cual convierte la glucosa a glucosa 6 fosfato usando como cofactor al ATP. o si un paciente con niveles de glucosa en sangre elevados, la hexoquinasa se va a saturar, lo que significa que no podrá incrementar su velocidad de reacción por el aumento de glucosa. o en ese caso, el exceso de glucosa se dirige a la vía de la aldosa reductasa. o la aldosa reductasa es una enzima clave para la ruta del Poliol. se encarga de catalizar la reducción de la glucosa a sorbitol mediante la conversión de nicotinamida adenosina dinucleótido fosfato (NADPH) a nicotinamida adenosina dinucleótido (NADP+). o esta enzima se encuentra dentro del citoplasma dentro de las células del riñón, ojo, hígado, corazón, cerebro, músculo esquelético, placenta y testículos. o la aldosa reductasa perteneces a la familia de aldocetoreductasas y tiene una baja afinidad por tener un km de 100-200, mientras que la hexoquinasa tiene mayor afinidad por tener un km de 0.1 y por ello, la AR tendrá menor actividad con niveles de glicemia normales. o la diabetes mellitus es una enfermedad crónica producida por la desregulación de los mecanismos que mantienen la glucosa sanguínea dentro de los rangos normales. o la vía de la aldosa reductasa se puede activar en pacientes con diabetes porque estos manejan niveles de glicemia más altos que los pacientes sanos y esos niveles de glucosa elevados saturan a la hexoquinasa y el exceso de glucosa se dirige a la vía de la aldosa reductasa o la vía del poliol. o otra vía que se compromete en los pacientes diabéticos, es la del óxido nítrico sintasa (NOS). esta vía cataliza la formación de óxido nítrico a partir de arginina usando como cofactor el NADPH. El NADPH estará siendo utilizado por la vía del Poliol por lo que se produce un desbalance entre las sustancias vasodilatadoras y las vasoconstrictoras lo que genera una vasoconstricción micro vascular. o el sorbitol no tiene una facilidad para atravesar la membrana por lo que se convierte en un agente osmóticamente activo (aumenta la osmolaridad del medio) lo que ocasiona el paso de agua del extracelular al intracelular, generando un edema celular. o vía del glutatión: ▪ disminuye la cantidad NADPH y eso no hace que haya una disminución de glutatión reducido y no va a poder neutralizar los ROS o vía del NADH oxidasa ▪ como el NADH es dañino para la célula, tiene que ser degradado y cuando ese degrada por el NADH oxidada se produce un aumento de ROS que trae como consecuencia una disfunción mitocondrial • que es el estrés oxidativo? ¿que procesos pueden originarlo? o el estrés oxidativo se define como el desequilibrio entre las sustancias pro-oxidantes (radicales libres de oxigeno (ROS)) y los antioxidantes (glutatión reducido (GSH)). o los niveles de glicemia elevados conducen a una mayor producción de radicales libres por un aumento de la ruta del poliol y la disminución de sustancias antioxidantes como el glutatión. o El glutatión (GSH) es un tripéptido no proteínico constituido por 3 aminoácidos: cisteína, glutamato y glicina. Contiene un enlace peptídico inusual entre el grupo amino de la y el grupo carboxilo de la cadena lateral del glutamato formando un grupo tiol (-SH) o cuando la glucosa se convierte en sorbitol a través de la aldosa reductasa, esta enzima también reduce el NADPH a NADP. El NADPH es utilizado para el sistema antioxidante del glutatión oxido reductasa que regenera glutatión reducido (GSH) a partir de glutatión oxidado (GSSG). si no hay NADPH, el glutatión no podrá reducir a los radicales libres de tal manera que estos se neutralicen, el cual trae como consecuencia la producción de estrés oxidativo. o por otro lado, el sorbitol puede convertirse en fructosa por la enzima sorbitol deshidrogenasa usando NAD como un cofactor por los siguientes motivos ▪ primero, es que las altas concentraciones de sorbitol intracelular aumentan la presión osmótica del ▪ citosol generando el ingreso d agua a la célula y produciendo un edema celular. ▪ segundo, el exceso de NADH producido por la enzima sorbitol deshidrogenasa, se elimina por la vía de la NADH oxidada con la producción de radicales libres durante el proceso ▪ tercero, la fructosa resultante del metabolismo del sorbitol puede volver a ingresar a las rutas catabólicas del glucólisis mediante su transformación por la hexoquinasa en fructosa 6 fosfato utilizando una molécula de ATP o el estrés oxidativo puede traer como consecuencia daños irreversibles dentro de la célula como los siguientes: ▪ causa una disfunción mitocondrial afectando la fosforilación oxidativa en la producción de ATP ▪ a nivel de los lípidos de membrana, puede causar una peroxidación lipídica el cual produce una inestabilidad en la membrana celular. ▪ a nivel del ADN, el estrés oxidativo puede alterar la información contenida en el ADN y modificar su unión a factores de transcripción específicas como el JACK/STAT, NFkB entre otros. • antioxidantes o catalasa o citocromo p450 o NOS ▪ disminuye la producción de óxido nítrico (que es un vaso dilatador) y aumenta la producción de endotelial, el cual actúa como un vasoconstrictor y puede ocasionar hiposa tisular. ▪ no es un sistema antioxidante o glutatión • la disminución de NADPH afecta a o la catalasa o glutatión peroxidasa y reductasa o citocromo p450 o NADH oxidasa (forma anión superóxido) o HMGCoA reductasa o Superoxido Dimutasa DPG3: aldosa reductasa, estrés oxidativo y diabetes mellitus • Paciente mujer de 46 años de edad acude a consulta por presentar polidipsia (aumento de sed), poliuria (aumento de orina), polifagia (aumento de hambre) y sobrepeso. Antecedentes familiares: madre y abuela materna con Diabetes Mellitus de tipo 2. • Antecedentes patológicos, a la paciente se diagnosticó sobrepeso a los 21 años de edad. • Inicialmente se le indicó dieta y ejercicio lo que realizó de manera irregular. • El examen físico mostró, aumento del panículo adiposo, mucosa oral poco hidratada, índice de masa corporal (IMC: 33.6) y acantosis nigricans severa a nivel del cuello y otros pliegues cutáneos. • Cardiovascular: Ruidos cardiacos rítmicos, buena intensidad, no se auscultan soplos • Respiratorio: Murmullo vesicular pasa bien en ambos hemitórax, no rales. • Abdomen: Aumento del panículo adiposo, blando, depresible, no doloro a la palpación. • Genito Urinario: Puño percusión lumbar: negativo bilateral, puntos reno ureterales: negativo bilateral • Sistema Nervioso: Despierta, orientada en tiempo espacio y persona. No signos meníngeos • Resto del examen aparentemente sin alteraciones. Los exámenes auxiliares en ayunas mostraron: Exámenes En la Paciente Valores normales Glicemia 209 mg/dL hiperglicemia 70-110 mg/dL Insulina 31 mIU/mL hiperinsulinemia 5-20 mg/dL Hemoglobina glicosilada A1c (HbA1c) 9,2% alto ≤ 5,7% Colesterol 254 mg/dL alto ≤ 200 mg/dL HDL colesterol 38 mg/dL normal 40-60 mg/dL LDL colesterol 94 mg/dL normal ≤190 mg/dL Triglicéridos 109 mg/dL normal ≤150 mg/dL • ¿Qué información nos brindarán los antecedentes familiares? Teniendo en cuenta los exámenes auxiliares, responde: ¿Qué diagnostico presentará la paciente? Explicar todos los mecanismos bioquímicos asociados al diagnóstico. o diabetes mellitus tipo 2, ya que tiene antecedentes de la enfermedad en su familia y tiene niveles de glicemia elevados (209 mg/dL) y tiene una hemoglobina glicosilada de 9,2%. Además, presenta una hiperinsulinemia (31 mIU/mL) ▪ la insulina no está dejando ingresar la glucosa entrar a la célula o las vías bioquímicas asociadas a esta enfermedad son las siguientes: ▪ vía del poliol ▪ por tener niveles de hiperglicemia, el 30% de la glucosa se dirige a la vía metabólica de la aldosa reductasa (normoglicemia: 3%) o saturación cuando una enzima llega a su velocidad máxima y no puede • ¿Qué relación tiene la enzima Aldosa reductasa con la Diabetes mellitus y la enfermedad cardiovascular? Explica o el sorbitol conlleva al aumento de la presión osmótica por una disminución de NADPH SEMANA 4 • Lanzadera de glicerofosfato o cuando la dihidroxiacetona fosfato se transforma en 3 fosfoglicerol reduce el NAD por la 3 fosfoglicerol 3 deshidrogenasa o cuando el 3 fosfoglicerol se transforma a dihidroxiacetona fosfato hay una oxidación de FAD a FADH2 por la flavoproteína deshidrogenada que permite la liberación de electrones a través del canal transportadores de electrones • Lanzadera de malato – aspartato o PEP se transporta directamente entre la membrana interna a la mitocondria o oxalacetato se debe convertir en aparato por acción de aspartato aminotransferasa o en malito por la malato deshidrogenasa lo que involucra la oxidación mitocondria del NADH seguida de la reducción citosólica del NAD o el malato entra al citosol y se transforma en oxalacetato y eso lleva al gluconeogénesis o el NADH tiene que estar así para poder donar sus electrones a la cadena transportadora de electrones • Fosforilación oxidativa o PASOS: ▪ Complejo 1 NADH deshidrogenasa • 2H+ se transporta al espacio intermembrana • e- se transporta al succinato deshidrogenasa ▪ complejo 2 succinato deshidrogenasa • FADH2 -> FAD • e- se transporta al complejo citocromo BC1 ▪ complejo 3 complejo citocromo BC1 • 2H+ se transporta al espacio intermembrana • e- se transporta al complejo citocromo c oxidasa ▪ complejo 4 citocromo c oxidasa • 1/2 O2 + 2H -> H2O • 2H+ se transporta al espacio intermembrana • e- se transporta a la matriz mitocondrial ▪ complejo 5 ATP sintasa • ADP + p -> ATP • 6H+ se transportan a la matriz mitocondrial o cuando se libera el citocromo c puede induce la apoptosis • Síntesis de glucógeno o glucosa 6 fosfato se degrada a glucosa 1 fosfato + UTP o luego se libera un fosfato y se vuelve UDP glucosa o glicogenina (que se une a la tirosina y se une a la UDP glucosa la glucógeno sintasa forma la cadena 1,4 una enzima separa la cadena y se forma un enlace 1,6 entre las dos cadenas y luego se convertirá en glucógeno por la glucógeno sintasa Degradación de glucógeno o En el hígado, es donde se degrada la mayor cantidad de glucógeno. o Glucógeno -> glucosa 1 fosfato ▪ Glucógeno Fosforilasa es activada por adrenalina para degradar glucógeno o Glucosa 1 fosfato glucosa 6 fosfato ▪ Fosfoglucomutasa para que luego ingrese a la glucolisis o sea utilizado en otros tejidos o entre a la via de las pentosas fosfato Control hormonal de glucógeno o hormonas anabólicas (insulina) aumentan la gluconeogénesis e inhiben la glucogenólisis, aumenta la síntesis de glucógeno o hormonas catabólicas (glucagón) disminuyen la gluconeogénesis e aumenta la glucogenólisis o epinefrina activa a su receptor beta-adrenérgico activa al AMPc aumenta la degradación de glucógeno para que ingrese a la glucolisis o epinefrina activa a su receptor alfa-adrenérgico para la liberación de calcio y para la degradación de glucógeno o glucagón aumenta la degradación de glucógeno. Enfermedad de Pompe o afecta el músculo, el lisosoma no tiene alfa 1,4 glucosidasa o maltasa acida y se acumula el glucógeno y hay muerte celular. Puede causar dolor muscular, dificultad para subir escaleras, disfunción muscular, caídas, Enfermedad de Lafora o en la neurona no hay glucógeno, pero en el astrocito si hay pero pocas cantidades (tejido de sostén y soporte y nutre a la neurona) o normal -> en la neurona, el glucógeno sintasa esta hiperfosfoilada para que no trabaja y el complejo Malina/Laforina lo hiperfosforila o enfermedad una fosfatasa le quita los fosfatos al glucógeno sintasa y forma glucógeno el cual es dañino en cantidades elevadas Gluconeogénesis síntesis de glucosa a partir de compuestos no glucosídico Ciclo de cori o Lactato glucosa ▪ En el hígado, se degrada por medio de gluconeogénesis ▪ ATP + GTP ADP + GDP + pi o Glucosa glucógeno ▪ En el musculo, formación de glucógeno o Glucógeno lactato ▪ En el musculo, hace glucogenólisis y glucolisis, mecanismo de energía inmediata ▪ ADP + Pi ATP Ciclo de la alanina o Piruvato alanina ▪ Glutamato alfa cetoglutarato ▪ Alanina aminotransferasa, en el musculo o Alanina ingresa al hígado o Alanina piruvato ▪ Alfa-cetoglutarato glutamato NH4 urea (ciclo de la urea) ▪ Alanina aminotransferasa, en el hígado o Piruvato glucosa ▪ Por gluconeogénesis, en el hígado o Glucosa se transporta al musculo o Glucosa piruvato ▪ Por glucolisis en el musculo Regulación del metabolismo de carbohidratos o ingresa glucosa por el Glut 2, o glucosa forma g6p por glucolisis o g6p forma glucosa por gluconeogénesis y enzima g6pasa o o • • • • • • • • • • • • • • o favorece PEPCK que ese para la gluconeogénesis o biguadina -> medicamento antidiabético Via de las pentosas fosfato o Glucosa 6 fosfato 6 fosfoglucono delta lactona ▪ Por la enzima glucosa 6 fosfato deshidrogenasa ▪ Degrada NADPH a NADH o Forma ribulosa 5 fosfato o Ribulosa 5 fosfato ribosa 5 fosfato ▪ Ribulosa 5 fosfato deshidrogenasa Glutatión o Glutatión reducido glutatión oxidado ▪ h2o2 2h2o ▪ glutatión peroxidasa ▪ NADP+ NADPH o Glutatión oxidado glutatión reducido ▪ NADPH +H NADP+ ▪ Glutatión reductasa Pentosa fosfato en eritrocito y función antioxidante –anemia hemolítica o glutatión evita la acumulación de ROS o para regenerarlo, necesitas NADPH + H 1. si hay una deficiencia de G6PD 2. se disminuye la vía de las pentosas fosfato 3. se disminuye la producción de NADPH 4. causa que haya una baja producción de glutatión reducido 5. causa que los ROS no estén neutralizados o disminuye la eliminación de ROS por vía del glutatión y causa estrés oxidativo y muerte celular ▪ en los eritrocitos no hay mitocondria, entonces tendrán que utilizar a la fermentación láctica ▪ ROS desestabiliza la membrana del eritrocito y causa que explote Regulación hormonal del metabolismo de carbohidratos o cerebro es el que está en control ▪ libera ACTH y estimula al corazón ▪ el corazón estimula a la adrenalina y la noradrenalina para la degradación de glucógeno a gucosa o acth -> hormona adenocorticotropica o adrenalina y noradrenalina degradan glucógeno o medula suprarrenal libera cortisol, que degrada la proteína (en gluconeogénesis) o cortisol en exceso daña el tejido muscular (cortisol en torrente sanguíneo es un problema) o tension y peligro = estrés o Insulina ▪ Inhibe la gluconeogénesis y la glucogenólisis hepática (degradación de glucógeno). Aumenta la síntesis de glucógeno a nivel muscular. Aumenta la captación de glucosa en tejido adiposo e inhibe la liberación de ácidos grasos. o Adrenalina ▪ Actúa sobre receptores α de las células β del páncreas e inhibe la secreción de insulina. Activa la glucogenólisis hepática y el glucólisis muscular. ▪ Actúa sobre receptores β de las células α del páncreas liberando glucagón. o Glucagón ▪ Secreción de glucagón: Por una baja [glucosa] en sangre. Por acción de la adrenalina. ▪ Inhibición de glucagón: Por alto nivel de glucosa. Por incremento de la insulina. Actúa sobre RG que se acopla a la PGs y activa la gluconeogénesis y la glucogenólisis hepática. Mecanismo molecular de la insulina o Incrementan la secreción de insulina: alimento rico en glucosa, hormonas GI, incremento de AA o Disminuye la secreción de insulina: disminuye la glucosa, estrés. o Secreción de glucagón: por una baja concentración de glucosa en sangre y por acción de la adrenalina. o p85-p110 cambia PIP2 a PIP 3, el PDK1 activa el AKT y activa el MTORC1 el cual inhibe la autofagia, el AKT favorece la translocación de transportadores glut. e inhibe el GSK3 beta el cual inhibe la síntesis de glucógeno, y también inhibe a la síntesis de glucógeno. Formación de la insulina Pre-proinsulina pro insulina ▪ Peptidasa y libera la secuencia de señal o Proinsulina -> forma enlaces disulfuro entre cadena a y b o Pro insulina insulina ▪ Se separa el péptido c y se quedan unidas la cadena a y b el cual será la insulina madura Liberación de insulina (en células beta del páncreas) o Glucosa ingresa a la célula y hace glucolisis y luego por la respiración celular libera ATP. El ATP activa a una ATPasa de K+ el cual se despolarizará y hará que el canal de calcio voltaje dependiente libere calcio y haga que la insulina en vesículas se transloquen hacia la membrana celular para ser activadas Mecanismo molecular del glucagón o el glucagón se une con su receptor acoplado de proteína G del hígado y activa 2 vías: ▪ GQ activa a la fosfolipasa c y transforma PIP2 en IP3 y hace que salga calcio del retículo sarcoplasmático ▪ GS activa al adenilato ciclasa el cual transforma ATP en AMPc el cual aumenta PKC que favorece la expresión de genes en el núcleo o El glucagón activa la degradación de glucógeno a glucosa 1 fosfato el cual puede ingresar al glucólisis para entrar al ciclo de Krebs para luego formar ATP en la cadena transportadora de electrones o transformarse en glucosa para ser utilizado en otros tejidos. El glucagón activa la glucogenólisis, y gluconeogénesis (formación de acetil coA por beta oxidación) e inhibe el glucólisis y la glucogenogénesis. Mecanismo molecular de la adrenalina o Adrenalina favorece la degradación de glucógeno -> más energía 1. receptor acoplado Gs (beta adrenérgica) se activa por la adrenalina 2. activa el adenilato ciclasa que degrada app a cAMP 3. cAMP activa el PKA 4. AKT activa el calmodulin fosforilasa quinasa y se fosforila 5. una molécula de ca se une al CM fosforilasa 6. el CM fosforilasa activa la fosforilasa que activa la degradación de glucógeno a G6P. Grelina y leptina o Grelina: hormona sintetizada principalmente por el estómago, cuya función es: o Informar al hipotálamo de que el cuerpo debe alimentarse. Estimula la secreción de hormona del crecimiento (GH) en la hipófisis. Favorece la regulación del metabolismo energético. o Desacil-grelina (isoforma de grelina, forma activa) altera la motilidad en ayunas. o Leptina (proteína OB): hormona producida por los adipocitos; también se expresa en el hipotálamo, el ovario y la placenta. Señal de saciedad. o Obestatina: hormona producida en las células de la mucosa del estómago y el intestino. Su efecto es disminuir el apetito. Mecanismo molecular de grelina (aumenta apetito) o La grelina interacciona con el receptor (GHSR) que se acopla con la PGq que activa a la fosfolipasa C, la cual hidroliza al PIP2 generando DAG e IP3 que se une al PIP3 del RS para aumentar la [Ca++]i y la entrada a la célula de Ca++ proveniente del LEC a través de canales de calcio tipo L. Grelina se une receptor GHSR que se acopla con la PGq que activa a la fosfolipasa C, que hidroliza al PIP2 generando DAG e IP3 que se une al PIP3 del RS para aumentar Ca++( se estimula la entrada de Ca++ al aperturarse los canales de calcio L),que se una a la calmodulina (Ca++-calmodulina), se activa AMPK que fosforila al complejo de esclerosis tubular 2 (TSC2), para que se active el intercambio del GDP por el GTP que va a fosforilar al mTOR (Mammamlian target of rapamycin ) produciendo la señal orexígena (incremento del apetito). o ca se une a la calmodulina (activa caMkk o activa al AMPK y fosforila el TSC2 y TSC1 y activa la actividad GTPasa (gtp -> gdp) y activa el Rhebgef o Rhebgef activa el MTOR raptor y causa la señal orexígena (mucho apetito) Mecanismo molecular de leptina (disminuye apetito) o La leptina (proteína OB) es una hormona producida en su mayoría por los adipocitos; también se expresa en el hipotálamo, el ovario y la placenta. Actúa en el núcleo arqueado promoviendo una señal de saciedad en el cerebro. La deficiencia y resistencia a la leptina conducen a la hiperfagia, disminuye el gasto E°lo cual condiciona a la obesidad. Hay 06 isoformas de receptor de leptina (ObRa-f) pero solo el lepRb activa a las quinasas. o La leptina se une a lepRb y se dimeriza, para unirse a las JAK que fosforila a la tirosina y que es reconocida por las proteínas SAT3 (Transductor de señal y activador de la transcripción 3) para la autofosforilación y la o • • • • • • transcripción. o La leptina se une al lepRb y acoplándose a la IRS2 y esto activa a la enzima PI3-K (tiene dos subunidades p85 y p110), que activa a la proteína cinasa B (PKB) que fosforila al factor de transcripción FOXO1 y al complejo de esclerosis tubular 2 (TSC2), para que se active al intercambiar el GDP por el GTP que va a fosforilar al MTOR (Mammamlian target of rapamycin ) produciendo la señal anorexígena. • Incretinas o incretina -> hormonas que se liberan debido a los movimientos peristálticos cuando se consume alimentos. o se liberan del intestino de las células enteroincretinas. glp1 -> péptido parecido al glucagón GIP -> péptido inductor de glucagón dpp4 -> dipeptidil Peptidasa, degrada incretinas inhibidor de dpp4 inhibe la ddp4 y activa la liberación de insulina. o GIP se unen a RGIP de los islotes pancreáticos. GLP-1 se unen a RGLP-1 de células alfa y beta de los islotes del páncreas. o Ambos se acoplan a la PGs, ADC, AMPc y activan a la proteína quinasa A, la cual cierra los canales de K+ sensibles al ATP e induce al incremento de Ca++, que cumple las acciones antidiabetogénicas. o Se tiene dos tipos: ▪ GIP (polipéptido insulinotrópico dependiente de glucosa), liberado por las células K del duodeno y yeyuno. ▪ GLP-1 (péptido relacionado al glucagón tipo 1), liberada por células L del duodeno, íleon e intestino grueso. o Son liberadas al torrente circulatorio en respuesta a la ingestión de nutrientes, regula la secreción de insulina y glucagón de manera dependiente de la glucosa. o GLP-1 y GIP tienen una vida media muy corta, siendo degradadas por la DPP-4 (dipeptidil peptidasa 4) generando péptidos inactivos. LAB – determinación de glucosa en sangre • Fotocolorimetría o Método de análisis óptico que permite hallar concentraciones de diferentes muestras coloreadas. Capacidad de las moléculas para absorber radiaciones. o se fundamenta en la mayor o menor absorción de luz de acuerdo al mayor número de moléculas en una solución, donde la tonalidad dependerá de la capacidad de absorber un rayo de luz de determinada longitud de onda o manipula las variables de este fenómeno controlando la luz incidente proveniente de un foco luminoso y su pureza, de modo tal que sólo incida aquella luz que es específicamente adsorbida por la partícula que deseamos analizar (analito). • ¿Qué es un fotocolorímetro? o Instrumento que compara la radiación absorbida o transmitida por una solución que contiene una cantidad desconocida de soluto, y una que contiene una cantidad conocida de la misma sustancia • tramitancia: o si la luz pasa por el tubo, o inversamente proporcional a la absorbancia • absorbancia: o de 0 - 1 o la densidad óptica • [ ] problema = Densidad Óptica del problema x Factor de Calibración • factor de calibración: o Es la concentración de una sustancia que corresponde a una unidad de medida generalmente 0,001 de absorbancia. • [ ] = Aborbancia. x Factor de calibración • FC = Concentración del patrón / Lectura del patrón (absorbancia) (siempre te lo dan) • transportadores de glucosa • absorción de glucosa • liberación de insulina de las células beta del páncreas • función de la insulina • diabetes o tipo 1 o tipo 2 o enfermedades asociadas • Determinar los Valores de Glucosa en suero o Mezclar, sellar los tubos con láminas de parafina e incubar por 5 minutos a 37 °C o a temperatura ambiente (20 °C a 25 °C) por 10 minutos. o Leer la absorbancia (longitud de onda: 505 nm) llevando a cero el espectrofotómetro con el blanco de reactivo. • Conociendo la longitud de onda óptima a la que absorben los analitos o especies directamente relacionadas con ellos, se pueden realizar las pruebas analíticas en los laboratorios clínicos aplicando las leyes de fotocolorimetría. • Las técnicas espectroscópicas se basan en la medida de los efectos de la interacción de las radiaciones electromagnéticas con la materia. Al incidir sobre el material biológico con una intensidad inicial (I0), las moléculas y/o átomos del mismo absorben parte de esa radiación (Ia), otra parte la dispersa (Id) y otra atraviesa la muestra (It). “La cantidad de radiación absorbida se ajusta a leyes físicas concretas dependientes de las características tanto de la radiación como de la materia sobre la que se irradia.” • Ley de Lambert-Beer: o Es el resultado de la combinación de las leyes de absorción de ambos e indica la relación directamente proporcional que existe entre la absorbancia de una muestra y su concentración, al ser constantes los valores de trayecto óptico (b=1 cm), la longitud de onda de la radiación incidente y absorbida, expresada como absortividad molar con el coeficiente de absortividad molar “ε” (épsilon). o A= log I0/I = ε.b.c o Siendo: ▪ I0 e I = Intensidad de la radiación e intensidad de la radiación final, después de haber travesado la cubeta de la muestra, respectivamente. o Concentración problema [ ] = Absorbancia del problema (DO) x Factor de Calibración (FC) o A = Absorbancia, Medida de la absorción de la radiación. También se conoce como densidad óptica o extinción. Es una magnitud adimensional. Generalmente los espectrofotómetros expresan la absorbancia hasta las milésimas. Suelen ser magnitudes que oscilan entre 0 y 1, aunque en determinados análisis en los que se mide la variación de absorbancia con el tiempo pueden obtener valores superiores. o b = Trayecto óptico, su valor está estandarizado en 1 cm. Es la longitud de la muestra que atraviesa la radiación cuando ésta se encuentra depositada en una cubeta. Es una medida estandarizada para todos los espectrofotómetros. (1 cm). o c = Concentración de la sustancia (analito) de la muestra. Suele expresarse en moles/L (con la absortividad molar) o g/L (si se emplea la absortividad): Si se despeja de la ecuación de la ley de Lambert-Beer. • curva patrón o Marco de referencia que se construye de can3dades conocidas de una sustancia (por ejemplo la albúmina sérica bovina) que se u3liza para determinar la can3dad de proteínas presente en una muestra incógnita o Absorbancia= a+b (concentración) • Cálculo de Concentraciones o Para obtener la concentración de una muestra problema se pueden utilizar dos procedimientos: ▪ Factor de calibración. ▪ Curva de calibración. • Factor de calibración: o Es la concentración de una sustancia que corresponde a una unidad de medida, generalmente 0,001 de absorbancia. • Curva de Calibración: o La curva de calibración consiste en la obtención de la lectura de absorción o de porcentaje de transmitancia que corresponde a una secuencia creciente de concentraciones, estas son graficadas en un papel milimétrico si se trata de absorbancia o densidad óptica y de papel semi-logarítmico si se trata de % de transmitancia. • Glucosa en sangre o La glucosa es la forma principal en la que los glúcidos que provienen del tracto intestinal son presentados al resto de las células corporales. La glucosa es el único combustible universal para las células humanas. Cada tipo celular del ser humano es capaz de generar adenosina trifosfato (ATP) en el proceso de glucólisis, la vía que oxida y descompone glucosa para formar piruvato o La sangre es el vehículo por el cual la glucosa es distribuida a los tejidos y esta puede provenir de fuentes exógenas (realimentación) o de la reserva de carbohidratos. El glucógeno (en animales, hongos y bacterias) y el almidón (en plantas) sirven de reservas de glucosa para uso metabólicos posteriores. En los animales, una provisión constante de glucosa es esencial para los tejidos como el cerebro y los eritrocitos, los cuales dependen casi por completo de glucosa como fuente de energía. o La movilización de glucosa desde los depósitos, en principio del hígado, proporciona un suministro constante de glucosa. Cuando ésta es abundante, como por ejemplo, inmediatamente después de una comida, se acelera la síntesis de glucógeno. Cuando es requerido por el organismo, estas reservas pueden ser movilizadas y degradadas rápidamente, lo que permite una autonomía máxima de 4 a 8 horas dependiendo de la actividad realizada. Por ello, el ser humano es altamente dependiente de la ingestión de carbohidratos de forma periódica o Durante la actividad física, los músculos del cuerpo utilizan mayor cantidad de glucosa, que cuando el cuerpo está en reposo y esto hace que los niveles de glucosa en la sangre bajen. Por lo cual, se puede evaluar la eficiencia del metabolismo de glucosa cuantificando sus niveles en sangre. o La diabetes mellitus es un trastorno metabólico generalizado que se caracteriza por una tendencia a la hiperglicemia crónica con alteraciones en el metabolismo de carbohidratos, lípidos y proteínas, que se origina en un defecto de secreción o de acción de la insulina, o ambas. o Uno de los métodos para determinar glucosa es el de la oxidación enzimática dela misma para la obtención de ácido glucónico y peróxido de hidrógeno. Paso seguido, se estima el peróxido en base a un cromógeno que es oxidado en presencia de una peroxidasa para formar un compuesto colorado. o Otro procedimiento enzimático usa la conversión de glucosa a glucosa-6-fosfato (G6P) catalizada por la hexoquinasa y luego a 6-fosfogluconato y NADPH en presencia de NADP y G6P deshidrogenasa. El NADPH así formado equivale a la cantidad de glucosa presente y se estima espectrofotométricamente a 340 a 366nm. o Los valores normales de glucemia en personas en ayunas oscilan entre 70 a 110mg/dL. Cuando los valores de glucosa en sangre exceden los 110mg/dL (Hiperglucemia) debe sospecharse la presencia de diabetes mellitus, la cual puede confirmarse mediante una prueba de tolerancia disminuida a los hidratos de carbono. DPG -AGEs • teniendo en cuenta los exámenes auxiliares, explica el mecanismo implicado en la formación de Hemoglobina glucosilada. ¿Cómo son metabolizados los AGEs? ¿qué fuentes de AGEs existen? o vía endógena ▪ todo lo que ocurre dentro del organismo a través de un metabolismo normal y por la edad o vía exógena ▪ muchas células del organismo presentan RAGE de los cuales cuando se unen con los AGEs contribuyen • ¿Cuáles son los efectos vasculares de los AGEs? o • ¿Qué relación tienen los AGEs con el desarrollo y progreso de la enfermedad (pie diabético)? Explica o Llamamos PIE DIABÉTICO a aquel pie que presenta una alteración anatómica o funcional, determinada por • • • anomalías neurológicas y/o diversos grados de enfermedad vascular periférica en un paciente diabético, que le confiere a éste una mayor susceptibilidad de presentar infección, ulceración y/o destrucción de tejidos profundos o La hiperglicemia crónica lleva a un aumento en la actividad de la vía de los polioles, con incremento de sorbitol (reducción de NADPH) generando estrés oxidativo. o Así, aumenta la producción de superóxidos en la mitocondria que inactivan el óxido nítrico y contribuyen a disfunción vascular, impidiendo una correcta reparación y promoción de la angiogénesis, migración y proliferación de fibroblastos, células epiteliales, endoteliales y queratinocitos. o Por otro lado, favorece la acumulación de productos de glicación avanzada (AGEs), implicados en la patogénesis de las complicaciones diabéticas incluyendo alteración de la cicatrización de heridas. ▪ Estos AGEs se acumulan en las heridas diabéticas y conducen a la expresión de pro moléculas inflamatorias (endotelina-1, factor de necrosis tumoral alfa y metaloproteasas). ▪ Esta condición de estrés oxidativo en diabéticos a nivel vascular puede aumentar diacilglicerol y proteína quinasa C, todo lo cual contribuye a mayor disfunción vascular, inflamación e injuria celular o estrés oxidativo producción de LDL y HDL oxidados producción de AGEs y ROS o NOS ▪ el NOS no produce óxido nítrico (por la disminución de NADPH) y por ello, se disminuye la producción de óxido nítrico y aumenta la producción de endotelina el cual produce una vasoconstricción ▪ esto causa que haya una falta de irrigación en las extremidades y no se irrigué la herida para que se cure. o proceso inflamatorio ▪ citoquinas, NFkB y causan una necrosis debido al estrés oxidativo ▪ el estrés en el retículo endoplasmático hace que CHOP este plegado incorrectamente y eso causa una sobre-expresión del CHOP que promueve la apoptosis. o NADH oxidasa se activa por la vía del sorbitol para reducir la cantidad de NADH y eso puede generar un estrés oxidativo, el cual promueve la producción de AGEs. o neuropatía diabética (la mielina) los AGEs afectan en la mielinización de las células de Shwann, por lo tanto, no habrá una conducción nerviosa en el sistema nervioso periférico y el paciente perderá la sensibilidad de su pie el cual hace que no sienta dolor. SEMANA 5 función de los lípidos o forman bicapas lipídicas, regulación hormonal (sexuales y normales) [grasa parda], forman vitaminas [esteroides] (liposolubles), dan energía de almacenamiento, aceites esenciales Ácidos grasos saturados e insaturados (cis y trans) o Saturados contienen solo enlaces simples y son sólidos porque son más difíciles de romper ▪ Animales mantequilla, carne, lácteos, ▪ Vegetales aceite de coco, palma y alimentos procesados o Insaturados contienen 10 o más enlaces cis y son más fáciles de romper, son líquidos porque sus enlaces son más débiles ▪ Trans hidrogenado, sus fuerzas son mayores, solidos a temperatura ambiente, margarina ▪ Cis • Monoinsaturados o Omega 9 ácido oleico ▪ Vegetales aceitunas, aceite de oliva, palta, frutos secos ▪ Animales ternera, cordero, productos • Poliinsaturados Omega 3 ▪ Ácido linolénico, (frutos secos, aceites de linaza, nuez canola chía) ▪ Animales marinos (DHA y EPA) pescados marinos y aceite de pescado o Omega 6 ▪ Ácido oleico vegetales (aceituna, aceite de oliva, palta, frutos secos), animales (ternera, cordero y lácteos) Ácidos grasos de importancia: o ácido palmítico abundante en animales o ácido estuario mantequilla o ácido linoleico aceites (omega 6) o ácido araquidónico omega 6 (huevo) o EPA y DHA pescado (omega 3) Mecanismo molecular del ácido araquidónico o el ácido araquidónico está en la membrana y por la fosfolipasa a2 sale de la membrana o también puede salir por la fosfolipasa c y se forma el 1,2 diacilglicerol y se obtiene el ácido araquidónico o el ácido araquidónico se forma a partir de linolato o se puede degradar por las ciclooxigenasa y por las lipooxigenasas o corticoides inhiben a la fosfolipasa A2 o aspirina / AINES inhiben a las ciclooxigenasa (Cox1 y Cox2) alteran la homeostasis no produces HCl gastritis o El precursor del ácido araquidónico (ARA, ácido poliinsaturado) que se esterifica con fosfolípidos ubicados en la bicapa lipídica de la MB), es el ácido graso esencial linolato que ésta presente en aceites vegetales. o El ARA es el precursor de los eicosanoides, que se libera de la bicapa como consecuencia de la activación de la fosfolipasa A2 o C. o La histamina y la citoquinas se adhieren a los receptores y activan fosfolipasas que cortan ácidos grasos para obtener ARA el cual es enzimáticamente degradado a eucotrienos, tromboxanos y prostranglandinas. Omega 3 y 6 o Omega 6 ▪ Ac linoleico delta 6 desaturasa acido gamma linoleico ácido dihomo gamma linoleico delta 5 desaturasa acido araquidónico COX 1 -> PGE2 / lipooxigenasa -> lbt4 pro inflamación o Omega 3 ▪ Ac alfa linoleico delta 6 desaturasa ácido eicosatetiaenoico delta 5 desaturasa EPA / DHA COX -> PGE3 / lipooxigenasa -> lbt 5 anti inflamatorios Mecanismo molecular de DHA o neuroproctectina activa proteínas apoptoticos (evita que la célula se muera), inhibe a los genes pro o inflamatorios, inhibe a la infiltración leucocitaria, activa la regeneración en el nervio corneal, y activa la o Akt1 (Akt/OKB) y mTor en la vía de señalización de supervivencia celular (insulina) o interviene en sinapsis neuronal, inhibe liberación de glutamato (neurotransmisor excitador: genera convulsiones) o la neuroproctectina D1 inhibe la inflamación, estrés oxidativo, y apoptosis o el DHA está en la bicapa lipídica y por la enzima fosfolipasa a2 hace que salga de la membrana y por lipoxigenación se forma o Omega-3: DHA y EPA aceite de pescado. o Derivados DHA: Resolvinas D1 (RvD1 y RvD2). Protectina D1 (neuroprotectina NPD1). o EPA: RvE1 o COX2, 5 -lipoxigenasa ( 5 -LO , 15 -LO son responsables de la síntesis de los mediadores pro-resolución de lípidos (PRLMs). o Neuroprotectina D1: actúa sobre las células inmunes y gliales para controlar la neuroinflamación y la neuroplasticidad. o Ácido 17S-hidroxiperoxidocohexaenoico (17S-Hp-DHA). o NMDA (N -metil- D- aspartato), NMDAR o TNF (factor de necrosis tumoral. o TRPV1 (receptor de potencial transitorio canal catiónico miembro de la subfamilia V 1). o El factor neurotrófico derivado del cerebro (BDNF) y el factor de crecimiento similar a la insulina 1 (IGF1), actúan sobre receptores IGFR que activan al fosfatidilinositol-3-cinasa (PI3K), AKT, MTOR, proteína ribosomal S6 quinasa (p70S6K) y proteína ligadora 4E (4EBP), generando trascripción de genes que o • • • • • • • • • • • • participan en la neuroplasticidad, mantiene la función de los receptores, la transmisión sináptica y las capacidades cognitivas. o BDNF y IGF1 actúan sobre IGFR, que activa a la proteína quinasa activada por mitógenos (MAPK) y al sistema de Ca++-calmodulina dependiente de la proteína quinasa II (CaMKII), activando CREB que facilitan la transmisión sináptica, el aprendizaje y la memoria. o IGF1 es producido por el hígado, músculo esquelético, cerebro. o La vía de señalización de MTOR y AKT también son moduladas por la insulina y leptina. Síntesis de fosfogliceridos o El fosfolípido, está compuesto de una cabeza hidrofílica (la cual contiene glicerol-3-fosfato) y una cola hidrofóbica que incluye dos ácidos grasos. o Función: forma parte de las membranas de los diferentes tipos de células, como por ejemplo de un eritrocito. o Ruta 1: ácido fosfatídico se hidroliza a DAG, la cual se une con citidina difosfato (CDP, generando glicerolfosfolípido y liberando CMP. o Ruta 2: ácido fosfatídico se convierte en CDP-DAG, por acción de la citidina trifosfato (CTP), luego se libera CMP para originar glicerolfosfolípido. Síntesis de fosfatidilcolina o Ruta A: El DAG se une con CDP-etanolamina para formar etanolamina, liberando CMP. A la vez la etanolamina por acción de la S-adenosilmetionina (SAM) se forma fosfatidilcolina. o Ruta B: El DAG se une con CDP-colina para formar fosfatidilcolina, liberando CMP. o Ruta A: La fosfatidiletanolamina se conjuga con la serina, para formar fosfatidilserina, liberando etanolamina. o Ruta B: La fosfatidilserina se descarboxila para formar fosfatidiletanolamina. Esfingolipidos o Glucoesfingolípidos: ▪ Principal componente MB. ▪ 6% lípidos cerebrales. ▪ Actúan como receptores de la hipófisis. ▪ Actúa como receptor de la toxina del cólera. Surfactante pulmonar o La vía de novo requiere la fosforilación de colina y la posterior acilación con palmitoil-CoA. o Surfactante pulmonar es una sustancia presente en los pulmones (alvéolos), producido por neumocitos II,. o Predominantemente de fosfolípidos como dipalmitoilfosfatidilcolina (DPPC). o Proteínas hidrofílicas surfactante A (SP-A) y proteína surfactante D (SP-D), actúan contra patógenos inhalados. o Proteínas hidrofóbicas, SP-B y SP-C, mejoran la extensión de los fosfolípidos en los espacios aéreos. Enfermedad de Tay-Sachs o deficiencia de hexosaminidasa la cual degrada gangliósidos o Tay-Sachs enfermedad rara que afecta al SNC (hereditario, autosómico recesivo común en descendientes de hebreos). o No se produce la enzima hexosaminidasa-A que degrada gangliósidos, que se acumula y degenera el SNC (ciegos, sordos, mentalmente retrasados y paralizados solo en uno o dos años y la mayoría no viven más allá de los cinco años). Esclerosis múltiple o destrucción de mielina el cual ayuda para la sinapsis nerviosa y protege los axones o Recuperación de mielina en la esclerosis múltiple: El desafío de la remielinización. o Gangliósidos GM4 (glicoesfingolípidos) se expresa en cerebro y eritrocitos, sintetizado por la sialilación de galactosilceramida (GalCer). Las células gm4 regulan la síntesis de GM4. o GalCer sintasa (GalCerS). Picadura de mosquito fosfolipasa a2 o La PLA2 del veneno de la abeja se introduce en la piel humana, y se une a los fosfolípidos generando lisofosfolípidos que funcionan como neoantígenos. o Los neoantígenos en las células de Langerhans de la epidermis, se cargan en proteínas CD1a y presentarlos en su superficie de las células T reactivas con CD1a-residente de la piel. o Estas células T producen citoquinas (IL-22) que contribuyen a la respuesta inflamatoria. Síntesis de triglicéridos -> lipogénesis Las micelas son gotas esféricas y cilíndricas de 3-6 nm de diámetro compuestas de 20 a 40 moléculas de sales biliares. o Las sales biliares forman micelas mixtas con los lípidos; sobre las micelas actúan las enzimas digestivas. o TGC + H2O + lipasa se forma MAG + Ácido esteárico. o TGC + H2O + hidrólisis se forma glicerol + ácido graso o En el hígado y tejido adiposo los triglicéridos son producidos por una vía que contiene el intermediario ácido fosfatídico. o Derivado del proceso de glucólisis • Lipoproteínas Lipoproteína Función fisiológica Contenido (%) Apo lipoproteínas TG Ch PL pr Quilomicrón Trasportar TG de la dieta del intestino a los tejidos 90 5 3 2 B48, C2, C3, A4, periférico y el hígado A1, E VLDL Transportar TG endógenos del hígado a tejidos periféricos 60 20 14 6 B100, C2, C3, E IDL Intermediario de VLDL, presente en bajas concentraciones 20 40 22 18 B100, E en plasma, pero elevado en el fallo del riñón LDL Transporte de colesterol del hígado a tejidos periféricos 7 50 22 21 B100 HDL Transporte reverso de colesterol de tejidos periféricos al 5 45 20 26 A1, A2, A4 hígado • Rol de lipoproteínas o éster de colesterol colesterol + ácido graso unido por enlace éster fácilmente oxidable más malo que el colesterol o La enfermedad de Tangier (ET) se caracteriza por una ausencia casi completa de HDL en plasma. Hay crecimiento del hígado, bazo, nódulos linfáticos, amígdalas y neuropatía periférica. o Lipasa lipoproteína periférica (LPL): cataboliza quilomicrones y VLDL. Lipasa lipoprotéica hepática (LH): cataboliza remanentes de quilomicrones, VLDL y HDL2. Lecitin colesterol acil transferasa (LCAT), esterifica el colesterol libre en las HDL, transfiriendo ácidos grasos desde los fosfolípidos al colesterol libre. Proteína transportadora de colesterol éster (CEPT): transporta colesterol éster desde las HDL a VLDL, IDL y LDL y de triglicéridos desde las VLDL a HDL y LDL. Proteína de transferencia de fosfolípidos (PLTP). HDL colesterol se une al transportador ABCA1. o Quilomicrón ▪ Quilomicrones (lipoproteínas) sintetizadas en el epitelio del intestino formado por 90% TGC, fosfolípidos y colesterol. Se absorben y se transportan a través del sistema linfático. 2% de proteínas especializadas, llamadas apoproteínas (Apo B48) que estabilizan a las moléculas de lípidos. ▪ REL (TAG, CL, FL), RER (apo B48) son transferidos por la acción de la MTP (proteína de transferencia microsomal) y el quilomicrón naciente (Apo B48) va al Ap. Golgi y madura y va por el sistema linfático. Quilomicrones (TGC, fosfolípidos, colesterol, AG, Vit A,D, E, K) en la linfa se añade Apo E y Apo CII procedente de la lipoproteína HDL. Unión de un quilomicrón a la lipoproteína lipasa en la superficie interior de un capilar. ▪ Puede recibir colesterol del ABCA1 o puede formarse a partir de una HDL naciente que recibe fosfolípidos y la APO A1 del quilomicrón y se puede unir con su receptor SRB1 en el hígado. o VLDL o ▪ ▪ IDL ▪ Se forma a partir de VLDL (donde recibe el APO-B100 y E y luego puede ingresar al hígado uniéndose con el receptor APO B/E o LDL ▪ Se forma a partir de IDL por la HTGL (lipasa pancreática) y recibe a la APO-B100 y los esteres de colesterol. Puede ingresar a los tejidos periféricos por el receptor APO B/E o HDL ▪ Macrófagos El LDLox es reconocido por los receptores Scavenger (CD36, SR-A1, LOX-1) los cuales transportan hacia el interior del macrófago por endosomas hacia el lisosoma donde es hidrolizado por LAL en esteres de colesterol, los cuales en el RE son catalizadas por la ACAT-1 en gotas lipídicas que se almacenan. Por acción de la nCEH y NCH-1 se genera una segunda hidrólisis para liberar colesterol y ApoA1. El LDL sale por las proteínas de membrana ABCG1 y el ApoA1 sale por el ABCA1. aumenta el Colesterol Acil Transferasa (ACAT), absorción de colesterol mediada por HDL. ▪ Disminución de Lecitin colesterol acil transferasa (LCAT), impide la maduración HDL. ▪ Aumento de Proteína transportadora de colesterol éster (CEPT), causa disminución de HDL colesterol y aumenta TAG del HDL. Síntesis de VLDL o La glucosa ingresa al hepatocito y se degrada por glucolisis para formar piruvato. El piruvato ingresa a la mitocondria y se transporta en acetil coA. Para liberar el acetil coA de la mitocondria, ese sale como citrato. El citrato regresa a acetil coA que luego se degrada a malonil coA para formarse en palmitato por la AG sintasa que utiliza NADPH. Luego el palmitato se degrada a AGcoA que luego formara triglicéridos que se unirán con la proteína APO B100 para formar el VLDL o Por otro lado el DHAP puede degradarse a glicerol 3 fosfato el que puede formar triglicéridos VLDL – IDL – LDL o La glucosa se transforma en AG que luego se transformara en un TG para formar un VLDL en el hígado o El hígado libera el VLDL y el VLDL se une a su receptor LPL (lipoprotein lipasa) el cual libera AG y glicerol. o El AG ingresa el musculo para formar energía y en el tejido adiposo se almacena como triglicéridos o El IDL le dona sus triglicéridos al musculo por el HTGL y al tejido adiposo y el IDL se une con sus receptores en el hígado para degradar su contenido en un lisosoma y almacenarse o El IDL se transforma en LDL y el LDL se oxida para ingresar al macrófago para convertirse en una célula espumosa en la íntima del endotelio. o El LDL también se puede unir con sus receptores en los tejidos periféricos y por un lisosoma se degrada y libera su contenido. Endocitosis de LDL en el macrófago o El LDLox es reconocido por los receptores Scavenger (CD36,SR-A1, LOX-1) de la membrana, la misma que se invagina para formar una vesícula recubierta con clatrina. La unión al CD36 activa una vía dependiente de balsas lipídicas que genera endocitosis y fagocita el complejo CD3- LDL ox. o Los macrófagos en el subendotelio expresan los receptores scavenger, cuyo número aumenta por acción del M-CSF. o La vesícula libera la clatrina para forma un endosoma en la cual se libera el LDL y el endosoma lleva a los receptores nuevamente a la membrana. El LDL pasa al lisosoma del macrófago y es hidrolizado por LAL en colesterol libre, AA y AG. o Una cantidad de colesterol libre forma las gotitas lipídicas y otra cantidad ingresa al RE donde el Colesterol Acil Transferasa (ACAT-1) generan ésteres de colesterol. Por acción de las hidrolasas de ésteres de colesterol neutral (nCEH y NCH-1) se genera una segunda hidrólisis para liberar colesterol y ApoA1. o El colesterol LDL sale a la íntima del endotelio por las proteínas transportadoras de membrana ABCG1, SRB1. El ApoA1 sale del macrófago por medio de la proteína ABCA1. HDL o El colesterol liberado al macrófago ingresa al pre-HDL y por la LCAT (lecitil colesterol aciltransferasa) se convierte en HDL y por la LCAT se vuelve a esterificar. o El HDL puede intercambiar triglicéridos y esteres de colesterol con el IDL y el IDL le donará sus esteres de colesterol al LDL por una hidrólisis por la lipoproteína lipasa que luego se volverá a transformar al HDL. El o HDL se une al hígado con el receptor SRB1 y luego puede salir del hígado la APO A1 para formar el pre-HDL. Aterogenesis o • • • • • Sale del hígado y se puede convertir en IDL (dándole APO-B100 y E) o en HDL (dándole APO E) e intercambia triglicéridos y esteres de colesterol con el HDL Puede transferir sus ácidos grasos al tejido periférico uniéndose con el receptor CD36. o o o o o o El depósito de lípidos (LDL pequeñas y densas) en la pared vascular, generan flujo turbulento en la circulación lo que desestabiliza a la membrana del endotelio, se genera una ciclación entre la glucosa con el NH3 del ApoB100 del LDL, por lo que la arginina y la lisina se cargan positivamente (-NH+4) que son atraídas por las cargas negativas del proteoglicanos de la pared vascular, por lo que ingresa el LDL. El LDL por ser pequeño pasa al subendotelio dañado y desestabilizado por una disminución de NO, en donde es oxidado: La lipoxigenasa cataliza al ácido graso generando hidroperóxidos (ROS) que oxida a la LDL (LDL ox), la cual se ve favorecido debido a un deficiente contenido de alfa-tocoferol (antioxidante lipofílico), los LDL oxidados genera: A nivel de lípidos, los ácidos grasos poliinsaturados que esterifican al colesterol, triglicéridos y fosfolípidos dan origen a hidroxiácidos, peroxiácidos y aldehidos. A nivel proteico, las mieloperoxidasas generan aldehidos (malondialdehído-CHO) que actúan sobre los grupos amino de la lisina del Apo B100 formando un enlace covalente, neutralizando las cargas positivas de la cadena peptídica, de manera que ésta se torna más frágil y finalmente se fragmenta. A partir de ese momento la LDL deja de ser reconocida por los receptores B:E y pasa a ser catabolizada por los macrófagos a través de los receptores barredores o scavenger. Activación de las células del endotelio vascular: ▪ La lisofosfatidilcolina (componente de las LDLox) se forma por oxidación de la fosfatidilcolina presente en las LDL, produce la activación de las células del endotelio vascular, liberando citocinas (ICAM-1 y VCAM-1) que favorece la fijación de los monocitos a la pared arterial, al ser atraídos por la secreción de la proteína-1 quimiotáctica de los monocitos (MCP-1), posteriormente penetran al espacio subendotelial, donde el factor estimulante de colonias de macrófagos (M-CSF) estimula su proliferación y diferenciación en macrófagos; mientras que los linfocitos T son fijados al endotelio por acción del ICAM y la selectina-E y permite su ingreso a la íntima por la secreción de factores quimiotácticos. Los linfocitos T en el ambiente subendotelial producen citoquinas como M-CSF, TNF-alfa) y fundamentalmente IFN-gamma. ▪ Producida la activación endotelial, las plaquetas se fijan a las células endoteliales segregando citoquinas como el factor de crecimiento derivado de plaquetas (PDGF) que participan en la proliferación y migración de las células musculares lisas (CML) hacia la íntima. Se pierde la vasodilatación mediada por el NO, se incrementa el efecto vasoconstrictor de la endotelina-1 por aumento de su síntesis, se inicia la coagulación por la vía extrínseca por la expresión de un factor tisular, y se frena la fibrinolisis por un aumento en la producción del inhibidor del activador del plasminógeno (PAI-1). Acumulación de lípidos en la pared vascular ▪ Se incorpora grandes cantidades de lípidos formando inclusiones citoplasmáticas que le dan un aspecto espumoso cuando se observan al microscopio electrónico (células espumosas). Cuando estas células mueren su alto contenido de lípidos pasa a formar el núcleo o core lipídico del ateroma. Proliferación y migración hacia la íntima de las células musculares lisas ▪ Los macrófagos segregan enzimas hidrolíticas (colagenasas, gelatinasas, elastasas) que remodelan la matriz extracelular. Al producirse la degradación de los proteoglicanos heparan sulfato de dicha matriz, las células musculares lisas inician la diferenciación hacia un estado activado caracterizado por la síntesis elevada de colágeno tipo 1, elastina y proteoglicanos que se acumulan en la matriz durante el desarrollo de la placa; también expresan moléculas del complejo mayor de histocompatibilidad, citoquinas y factores de crecimiento; y presentan receptores scavenger en su membrana en respuesta al TNF-alfa e IFN-gamma producidos por los macrófagos y los linfocitos T, transformándose en células espumosas. ▪ La proliferación de las células musculares lisas y su migración desde la capa media arterial a la íntima está regulada por un complejo sistema de citoquinas: Regulación paracrina (citoquinas producidas por otros tipos celulares, macrófagos): IL-1 que interviene en la activación celular, factor de crecimiento fibroblástico (FGF) que induce la síntesis proteica y la división celular, PDGF y el factor de crecimiento epidérmico (EPG) que estimulan la proliferación y migración celular; los linfocitos T, inducen la expresión de receptores para PDGF en las células musculares lisas mediante la acción del IFN-gamma y estimulan a los macrófagos a producir IL-1 y PDGF; y las plaquetas, producen PDGF. Regulación autocrina (citoquinas producidas por las mismas células musculares y por la presencia de las LDLox): producen FGF, IL-1, factor de crecimiento endotelial vascular (VEGF), factor transformador del crecimiento tipo alfa (TGF-alfa), FGF y TNF-alfa, como citoquinas que activan la proliferación y migración de las células hacia la íntima vascular. La placa ateromatosa aumenta de tamaño a medida que ocurren estos eventos, llegando a provocar la estenosis vascular; su estabilidad depende del aumento en la actividad de las enzimas hidrolíticas producidas por los macrófagos que van degradando la matriz celular, y de la inhibición en la producción de colágeno por parte de las células musculares lisas inducida por IFN-gamma o de la inducción de su muerte celular por apoptosis, ya que estos acontecimientos pueden debilitar la capa fibrosa del ateroma, haciéndola más frágil y propensa a una ruptura, de manera que cualquier fuerza mecánica puede fragmentarla con la consiguiente formación de un trombo. • Mecanismo de modificación y oxidación de LDL o El LDL se puede modificar antes de entrar al macrófago o después de entrar. o Modificación macrófago -> mieloperoxidasa hace que el LDL en el aminoácido lisina de la APO B100 se una al malodialdehido o Glicación glucosa se une con un NH3 del APO B100 del LDL o Lipooxigenasa -> por los radicales libres los colesteroles se oxidan. o La fosfatidilcolina en la membrana del LDL se modifica a lisofosfatidilcolina por el ROS. PORTAFOLIO • que relacione existe entre el metabolismo de carbohidratos y el proceso de aterosclerosis. explica o cuando hay niveles elevados de glucosa en sangre (hiperglicemia) la glucosa puede saturar a la enzima hexoquinasa para que este carbohidrato se metabolice para formar 2 moléculas de carbohidrato. o por ello la glucosa se metaboliza por la vía del sorbitol mediante la enzima aldosa reductasa el cual cataliza la reducción de la glucosa a sorbitol mediante la conversión de NADPH + H+ a NADP+ ▪ El NADPH es utilizado para el sistema antioxidante del glutatión oxido reductasa que regenera glutatión reducido (GSH) a partir de glutatión oxidado (GSSG). ▪ si no hay NADPH, el glutatión no podrá reducir a los radicales libres de tal manera que estos se neutralicen, el cual trae como consecuencia la producción de estrés oxidativo y especies reactivas de oxigeno (ROS) o luego el sorbitol se reduce a fructosa por acción de la enzima sorbitol deshidrogenasa el cual usa como cofactor al NAD+ para convertirlo en NADH ▪ como el NADH es dañino para la célula, tiene que ser degradado y cuando ese degrada por el NADH oxidada se produce un aumento de ROS que trae como consecuencia una disfunción mitocondrial o por otro lado, en pacientes con hiperglicemia, habrá una disminución de la formación de óxido nítrico el cual es importante al ser un vasodilatador. el óxido nítrico sintasa (NOS) no produce óxido nítrico (por la disminución de NADPH utilizada por la aldosa reductasa) y por ello, habrá como consecuencia una disminución de la producción de óxido nítrico y aumenta la producción de endotelina el cual produce una vasoconstricción ▪ este mecanismo molecular relación con la aterosclerosis porque afecta al vaso porque lo contrae haciendo que haya dificultad para transportar nutrientes al cuerpo. o por el aumento de estrés oxidativo y ROS habrá una mayor producción de LDL a LDL oxidados (LDLox) el cual ingresará al macrófago y formará una célula espumosa, un paso fundamental en la formación de una placa de ateroma en la aterosclerosis. • explica los procesos bioquímicos y moleculares implicados en la aterosclerosis. ten en cuenta el metabolismo de lípidos o la aterosclerosis es una alteración patológica de las arterias coronarias caracterizada por el depósito anormal de lípidos y tejido fibroso en la pared arterial, que desorganiza la arquitectura, la función de los vasos y reduce en forma variable, el flujo sanguíneo al miocardio. 1. factores -> tabaco, colesterol, hiperglicemia -> disfunción endotelial 2. el exceso de glucosa -> sea más espesa y causa una disfunción endotelial y exceso de colesterol en la dieta causa un aumento de la presión plasmática y aumenta la permeabilidad de los vasos, haciendo que sea más fácil que LDL ingrese al endotelio 3. LDL ingresa: a. ingresa por la diferencia de cargas entre las capas del endotelio b. puede ingresar de manera oxidada c. se puede oxidar por el aumento de ROS y radicales libres después de ingresa. 4. LDL ox -> monocitos ingresan para eliminarlos y se diferencian de macrófagos (convierten en macrófagos) a. MCP1 -> factor quimiotácticos de monocitos -> atraen monocitos al endotelio 5. LDL ox -> ingresa al macrófago por fagocitosis y debe ser reconocido por los receptores scavenger (CD36 es la más afín al LDLox) y el LOX 1 6. el sistema inmune reconoce al LDL ox y por eso, los monocitos producen citoquinas como la ICAM y VCAM y Selectina E (por activación del endotelio) el cual los atraen más monocitos al endotelio 7. los monocitos entran por diapédesis. 8. los macrófagos tienen exceso de LDLox y se saturan con gotas lipídicas y se convierten en células espumosas por necrosis o apoptosis y se lisa a. (por el MCSF -> factor estimulante de colonia de macrófagos) 9. macrófago libera enzimas hidrolítica y factores quimiotácticos como colagenasa y elastasas las cuales son dañinas al endotelio 10. las colagenasa y elastasas atraen linfocitos y colágeno y juntan las células espumosas. 11. células musculares lisas migra de túnica media hacia la íntima para encerrar el problema 12. se forma el núcleo lípido y se pegan a la parte superior del endotelio y esta necrótico y contagia la pared del endotelio y lo convierte necrótico y se rompe la pared del endotelio 13. eso atrae plaquetas -> se forma tapón planetario para reparar los daños -> tapan el daño 14. se desprende la masa y se forma un trombo o ↑ mal de adhesión o ↑ factores quimiotácticos o ↑ vasoconstricción o ↑ coagulación o ↑ fibrinoliso DPG – Macrophage-mediated cholesterol handling in atherosclerosis • ¿Qué relación tiene el metabolismo del colesterol por macrófagos y progreso de la enfermedad(Ateroesclerosis)? Explique. ▪ El LDLox es reconocido por los receptores Scavenger (CD36, SR-A1, LOX-1) los cuales transportan hacia el interior del macrófago por endosomas hacia el lisosoma donde es hidrolizado por LAL en esteres de colesterol, los cuales en el RE son catalizadas por la ACAT-1 en gotas lipídicas que se almacenan. ▪ Por acción de la nCEH y NCH-1 se genera una segunda hidrólisis para liberar colesterol y ApoA1. ▪ El LDL sale por las proteínas de membrana ABCG1 y el ApoA1 sale por el ABCA1. ▪ aumenta el Colesterol Acil Transferasa (ACAT), absorción de colesterol mediada por HDL. ▪ Disminución de Lecitin colesterol acil transferasa (LCAT), impide la maduración HDL. ▪ Aumento de Proteína transportadora de colesterol éster (CEPT), causa disminución de HDL colesterol y aumenta TAG del HDL. 1. el colesterol (LDLox) es fagocitado cuando se une al receptor scavenger (CD36, SR-A1, LOX-1) 2. LDLox se va a la endosoma tardía o lisosoma y por tener un PH=5 el LDL se degrada y libera los esteres de colesterol el cual puede ser catalizado por la lipasa acida lisosomal (LAL) y se vuelve colesterol. 3. el colesterol sale del lisosoma y se dirige al retículo endoplasmático por la ACAT1 4. en el retículo endoplasmático se vuelve un ester de colesterol 5. hidrolasas de esteres de colesterol (nCEH y NCEH1) liberan el colesterol libre fuera de los macrófagos a través de tres proteínas de membrana (SR-B1, ABCG1 y ABCA1). 6. el SR-B1 y el ABCG1 liberan los colesteroles al HDL mientras que el ABCA1 libera los colesteroles a la apolipoproteína (ApoA1). 7. En la aterosclerosis, el aumento de ésteres de colesterol, hace que haya un aumento de LDL el cual se oxida para ingresar al macrófago para degradarse. El ACAT1 transporta los colesteroles al retículo endoplasmático, pero en la enfermedad, como hay un aumento de colesterol, el ACAT1 formara las gotitas lipídicas, que luego puede conllevar a la formación de la célula espumosa el cual puede lisarse. SEMANA 6 • Lipogénesis en adipocito o aumenta insulina, aumenta LPL y favorece el transporte de glucosa por el glut 4 para que se degrade a glicerol 3 fosfato y se une con el ácido graso para formar un triglicérido o el VLDL y el quilomicrón depositan sus ácidos grasos el cual ingresa al adipocito por su transportador para que luego formar triglicéridos. o el LPL hace que el quilomicrón libere MAG y AG para formar triglicéridos en el adipocito o la insulina favorecerá la degradación de glucosa para formar glicerol 3 fosfato a partir de DHAP • Lipogénesis en el hígado o La glucosa ingresa al hepatocito y se degrada por glucolisis para formar piruvato. El piruvato ingresa a la mitocondria y se transporta en acetil coA. Para liberar el acetil coA de la mitocondria, ese sale como citrato. El citrato regresa a acetil coA que luego se degrada a malonil coA para formarse en palmitato por la AG sintasa que utiliza NADPH. Luego el palmitato se degrada a AGcoA que luego formara triglicéridos o Por otro lado, el DHAP puede degradarse a glicerol 3 fosfato el que puede formar triglicéridos • Lipolisis o Lipolisis degradación de triglicéridos en el adipocito o HSL o LSH o TAG triacil glicerol lipasa o lipasa sensible a hormonas enzima que degrada ácidos o albumina proteína mas abundante en el plasma sanguíneo y transporta ácidos grasos (7-10 AG) o adrenalina entra al adipocito y por el HSL o LSH el triglicérido se degrada a ácido graso y glicerol. el ácido graso se va al torrente sanguíneo y se une a la albumina y libera los acido grasos al músculo grasos a glicerol donde el acido graso entra a la mitocondria se forma acylCoA acido graso y por la enzima beta oxidada se degrada a aceite coa que entra al ciclo de Krebs para formar ATP o Acuaporina 7 permite la salida del glicerol y este se puede ir al hígado para formar glucosa o catecolamina: adrenalina y noradrenalina • Oxidación ácidos grasos – lanzadera de carnitina 1. Ácido graso + CoA + ATP acil-CoA AG + AMP + Pi a. Acil coA sintetasa y sucede en el citosol. 2. Acil-CoA AG se difunde a través de la membrana 3. Acil-CoA AG + carnitina coA + acil carnitina AG a. Carnitina palmitoil transferasa 1 (CPT1). Sucede en el espacio intermembrana de la mitocondria 4. acil carnitina AG entra a la matriz mitocondrial a. carnitina acilcarnitina translocasa 5. acil carnitina AG + coA acil-CoA AG + carnitina a. Carnitina palmitoil transferasa 2 (CPT2). 6. Carnitina regresa al espacio intermembrana a. carnitina acilcarnitina translocasa • Beta oxidación mitocondrial o Acil-coA AG -> acil coA AG + Acetil coA o Acil-coA AG -> trans Enolil coA ▪ Acil-coA deshidrogenasa ▪ FAD FADH2 o Trans Enolil coA 3 hidoxi acetil coA ▪ Enolil coA hidratasa ▪ Entra agua o 3 hidoxi acetil coA beta ketoacil coA ▪ 3 hidoxi acil CoA deshidrogenasa ▪ NAD NADH beta ketoacil coA acil coA AG + acetil coA ▪ beta ketoacil coA triolasa ▪ entra CoASH Beta oxidación peroxisomal o Se da en cadenas muy largas de ácidos grasos (+22 carbonos) Cuerpo cetónicos -> acetoacetato, betahidroxibutirato, acetona o 2 acetil coA aceto acetil CoA ▪ triolasa ▪ sale coASH o aceto acetil coA 3 hidoxi 3 metil glutaril coA (HMG CoA) ▪ HMG coA sintasa ▪ Libera coA o 3 hidoxi 3 metil glutaril coA (HMG CoA) acetoacetato ▪ HMG coA liasa o Aceto acetato beta-hidroxibutirato ▪ Beta-hidroxibutirato deshidrogenasa ▪ NADH NAD o Aceto acetato acetona ▪ Sucede de manera espontánea y libera co2 Metabolismo de cuerpo cetónicos (síntesis de acetil coA) o beta-hidroxibutirato aceto acetato ▪ beta-hidroxibutirato deshidrogenasa ▪ NAD NADH o aceto acetato aceto acetil coA ▪ 3 ketoacil coA transferasa ▪ Succinil coA succinato o aceto acetil coA acetil coA ▪ triolasa ▪ entra COASH cetoacidosis diabética (olor a fruta) o el aumento de lipolisis a causa de una disminución del transporte de glucosa al interior de las células, origina que los excesos de ácidos grasos se conviertan a cuerpos cetónicos, dando lugar a cetonemia, acidosis metabólica y cetoinuria o se debe a una serie de desajustes metabólicos provocados por un déficit de insulina o el tratamiento consiste de la administración de líquidos por vía intravenosa, insulina y potasio o el bicarbonato de sodio solamente debe ser utilizado en casos más graves o la acetona es volátil y le da un color característico que es importante para el diagnostico o en ayuno prolongado se produce cetosis, exceso de cuerpos cetónicos en la sangre y orina o la cetosis produce una disminución de pH en la sangre originando una cetoacidosis que puede inducir una coma y en algunos casos la muerte o diabetes 40-400 de acetoacetato y beta hidroxi butirato Síntesis de colesterol o HMG coA reductasa (izoenzimas) ▪ Citosol síntesis de colesterol ▪ Mitocondria síntesis de cuerpo cetónicos ▪ diana terapéutica en las estatinas inhibe a la enzima para que no se forme colesterol o 2 acetil coA aceto acetil CoA ▪ triolasa ▪ sale coASH o aceto acetil coA 3 hidoxi 3 metil glutaril coA (HMG CoA) ▪ HMG coA sintasa ▪ Libera coA o • • • • • 3 hidoxi 3 metil glutaril coA (HMG CoA) mevalonato ▪ HMG coA reductasa ▪ 2 NADPH 2 NADP ▪ libera CoASH o mevalonato luego de varias reacciones se transformará en escualeno o escualeno se transformará en colesterol después de varias reacciones o se utiliza para formar una molécula de colesterol 3 acetil coA, 3 NADPH, 3 ATP, O2 y H2O • productos derivados del colesterol o taurocolato, pregnenolona, hormonas esteroideas (progesterona, cortisol, aldosterona, estrógenos, testosterona) • Regulación síntesis de colesterol o Por fosforilación ▪ fosfatasa por la insulina le quita un Pi a la enzima HMG-CoA reductasa que esta inactiva y la convierte en activa para que produzca colesterol. ▪ proteína quinasa activada por AMP el glucagón a activa a esta enzima que degrada un ATP -> ADP para darle un Pi al HMG-CoA reductasa para inactivarla para que no produzca colesterol o Por proteólisis o Estatinas Inhibidores competitivos de la HMG-CoA reductasa usados para el tratamiento contra el hipercolesterolemia. • Mecanismo molecular de leptina o La leptina (hormona producida adipocitos, hipotálamo, ovario y placenta), actúa sobre el receptor lepRb del núcleo arqueado, generando dos vías: Se activa la JAK2 que fosforila a la tirosina y se activa a las proteínas SAT3 (Transductor de señal y activador de la transcripción 3) para la transcripción de ARNm de leptina promoviendo la señal de saciedad. Es inhibida por SOCS3. o Al acoplarse a la IRS2, se activa a la PI3-K (tiene dos subunidades p85 y p110), que activa a la proteína cinasa B (PKB) que fosforila al factor de transcripción FOXO1 y al complejo de esclerosis tubular 2 (TSC2), para que se active al intercambiar el GDP por el GTP que va a fosforilar al mTOR (Mammamlian target of rapamycin ) produciendo la señal anorexígena. o La insulina y la leptina por medio de FOXO1 aumenta la expresión del POMC y disminuye la síntesis de NPY o AgRP. o El NPY aumenta la ingesta de alimentos y disminuye la termogénesis. o El SIRT1 reprime la expresión FOXO1 dependiente del neuropéptido AgRPorexigénica. o leptina -> saciedad leptina induce POMC (promecio melacotrina) y CART, se libera del tejido adiposo se val al SNC (en el hipotálamo en el núcleo arcuato) receptor de leptina es tirosina quinasa que activa al JACK2 que activa al STAT y quitan al FOXO del núcleo y se une al ADN y favorece la síntesis de POMC o germina -> hambre -> activa NPY y AgRP o La deficiencia y resistencia a la leptina conducen a la hiperfagia, disminuye el gasto E°lo cual condiciona a la obesidad. Hay 06 isoformas de receptor de leptina (ObRa-f) pero solo el lepRb activa a las cinasas. • Leptina – adiponectina • Patologías relacionadas al metabolismo de lípidos Enfermedad Defecto genético Fredrickson Riesgo Hipercolesterolemia Menor número de receptores de IIa, IIb Ecc familiar LDL funcionales Hipertrigliceridemia Defecto en un solo gen IV, V familiar Hiperlipidemia Defecto en un solo gen IIa, IIb, IV, V Ecc familiar combinada Déficit de lipoproteína Concentraciones reducidas de LPL I Pancreatitis lipasa (LPL) funcional Déficit de apo CII Incapacidad de sintetizar Apo CII I Pancreatitis (cofactor de LPL) abetalioproteinemia Incapacidad de sintetizar Apo B normal Déficit de vitaminas liposolubles, alteraciones neurológicas Analfalipoproteinemia Incapacidad de sintetizar Apo A normal Alteraciones neurológicas, depósitos (enfermedad de de esteres de colesterol en lugares tangier) anómalo o • • Hiperlipidemia causas Condición Anormalidad de lípidos Hipercolesterolemia HDL LDL triglicéridos o Elevación de colesterol en sangre (valor normal: Obesidad N <150mg/100mL) Ingesta excesiva de N o Causa defecto del gen del receptor de LDL que alcohol conduce a una cancelación completa o a una disfunción Diabetes mellitus N del receptor. Hipertiroidismo N/ N/ o Consecuencia Restringe la capacidad de recepción de Síndrome nefrótico LDL a las células periféricas y se acumulan en la sangre Fallo renal crónico N/ o Se acumula el colesterol en la piel y los tendones, y en la Colastasis N pared de los vasos. Se puede presentar en niños y jóvenes. Tipo Sintomatología Defecto molecular Hiperlipoproteinemia tipo I Hipertrigliceridemia Gen de la lipoproteína lipasa (LPL) Hipercolesterolemia familiar tipo II Hipercolesterolemia Gen del receptor del LDL, apolipoproteína B Hiperlipoproteinemia tipo III Hipertrigliceridemia o Apolipoproteína B hipercolesterolemia • Hipertrigliceridemia o En la luz intestinal se forma la micela y en el enterocito se produce los quilomicrones. o El TAG de los quilomicrones se elimina por la lipoproteína lipasa (LPL) que se encuentra en el endotelio vascular de los músculos, del miocardio y del tejido adiposo. o Los quilomicrones remanentes se eliminan de la circulación por los receptores hepáticos que reconocen la apo E. o Los hepatocitos exportan TAG en el núcleo de las VLDL hacia la circulación. • Hiperquilomicronemia familiar o Trastorno lipídico autosómico recesivo causado por mutaciones en el gen de la lipoproteína lipasa (LPL) o La deficiencia de LPL se manifiesta en la infancia con los siguientes síntomas clínicos: Hepatoesplenomegalia, dolor abdominal intenso, pancreatitis aguda, xantomas eruptivos, lipemia retinalis. • deficiencia del surfactante pulmonar: enfermedad de membrana hialina o Surfactante pulmonar es una sustancia presente en los pulmones (alvéolos), producido por neumocitos II,. Consta de: Dipalmitoilfosfatidilcolina (DPPC), o Proteínas hidrofílicas surfactante A (SP-A) y proteína surfactante D (SP-D), actúan contra patógenos inhalados. Proteínas hidrofóbicas, SP-B y SP-C, mejoran la extensión de los fosfolípidos en los espacios aéreos. • Mecanismo molecular de hormonas sexuales o las hormonas esteroideas se difunden a través de la membrana y se pueden unir a su receptor dentro de las células. Las hormonas ingresan al núcleo donde se unen al ADN y pueden modificar la expresión genética o pueden interactuar con los factores de transcripción que modifican la expresión de genes. o Hormonas esteroideas pueden activar los mecanismos independientes al fosforilar los receptores de hormonas y desencadenando la cascada de las proteínas quinasa que se une con el ADN y regula los factores de transcripción. o Las hormonas esteroideas se difunden a través de la membrana y se unen a su receptor dentro de la célula fosforilando los factores de transcripción mediante la cascada de señalización de las proteínas quinasas. o Hormonas esteroideas activan la vía de proteína G ▪ GS activando al adenilato ciclasa el cual forma AMPc y activa al PKA que modifica al ADN. ▪ GQ activa a la fosfolipasa c que activa diacil glicerol el cual activa al PKC y activa al IP3 el cual libera calcio del retículo sarcoplasmático o La HE interacciona con el receptor (ERα), la HS ingresa a la célula y se une a los receptores intracelulares específicos, formando el complejo hormona-receptor, que se translocan al núcleo. o En el núcleo, los RH interactúan con factores de transcripción, que a su vez se unen a sus elementos de respuesta en el ADN, controlando de este modo la expresión de genes. o Por un mecanismo independiente de hormonas se fosforila a los RE desencadenando una cascada de proteína-quinasa que activa factores de transcripción que se unen a sus propios elementos de respuesta en el genoma, controlando de este modo la expresión de genes. o La HE interacciona con la PGq y a la PGs. o Estrógenos y fitoestrógenos: ▪ Disminuyen a los ROS (actividad antioxidante) ▪ Inducen la liberación de IkBα que inhiben a los NFkB, reduciendo la inflamación. ▪ Disminuyen la producción de citoquinas (TNFα, IL-6, NFkB) ▪ Disminuye CREBS y PPARγ, por lo que disminuye la adipogénesis. o La HE interacciona con el receptores (ERα). ▪ Por un mecanismo independiente de hormonas se fosforila a los RE desencadenando una cascada de proteína-quinasa. o La HE interacciona con la PGq y a la PGs. o meloncito -> dan pigmentación de la piel, se encuentran en la piel. acantosis nigricans -> mucha proliferación y no hay apoptosis por exceso de meloncitos o NALFD -> enfermedad hepática grasa no alcohólica -> hígado graso -> grave lleva al NASH -> esteatosis hepática no alcohólica (hígado está recibiendo muchos ROS y se oxida y induce apoptosis) LAB 3 Índice lipídico • Los lípidos son un grupo de biomoléculas que se caracterizan por ser poco o nada solubles en agua y, por el contrario, muy solubles en disolventes orgánicos no polares. Aunque químicamente heterogéneos, todos presentan un denominador común estructural: la totalidad o al menos una parte significativa de su molécula es de naturaleza hidrocarbonada, por lo tanto apolar. Este rasgo estructural común es el responsable de su insolubilidad en agua y de su solubilidad en disolventes no polares. Los lípidos constituyen el material fundamental de todas las membranas celulares y subcelulares; forman la mayor reserva de energía de los organismos (depósitos energéticos); funcionan como aislante térmico, precursores de hormonas de gran relevancia para la fisiología humana; utilizados como cofactores en reacciones enzimáticas y tienen una función nutricional importante aportando alrededor del 30 % de las kilocalorías de la dieta siendo fuente de ácidos grasos indispensables. • Dentro de este grupo encontramos el colesterol, una sustancia cerosa y requerida por el cuerpo en determinada cantidad para funcionar adecuadamente. El colesterol interviene en la formación de ácidos biliares, vitales para la digestión de las grasas, los rayos solares lo transforman en vitamina D para proteger la piel de agentes químicos y evitar la deshidratación, a partir de él se forman ciertas hormonas, como las sexuales y las tiroideas. • La digestión de las grasas es más compleja en comparación con los carbohidratos o las proteínas debido a que no son solubles en agua. Los triglicéridos de la dieta se emulsifican en el intestino por efectos de las sales biliares, que se sintetizan en el hígado y se almacenan en la vesícula biliar. La lipasa pancreática convierte los triglicéridos en el lumen del intestino en la forma de ácidos grasos y 2-monoacilglicreoles, que interactúan con las sales biliares para formar micro gotas delgadas llamadas micelas. Los ácidos grasos y los 2- monoacilgliceroles se absorben en el intestino, en donde se re-sintetizan en triglicéridos. • Las grasas deben transportarse en la sangre unidas a proteínas o en complejos de lipoproteínas, debido a que no son solubles en agua. De esta manera, tanto los triglicéridos como el colesterol se encuentran en complejos de lipoproteínas. • El exceso de colesterol en la sangre, combinado con otras sustancias, puede adherirse a las paredes de las arterias formando placas, las cuales pueden estrechar las arterias o incluso obstruirlas. Los niveles de colesterol elevados en la sangre pueden aumentar el riesgo de enfermedades cardíacas. El aumento de colesterol no suele tener signos ni síntomas, pero puede detectarse con un análisis de sangre. • La cuantificación de colesterol y triglicéridos en suero es también llamada perfil lipídico, es un procedimiento analítico básico en el diagnóstico y seguimiento de enfermedades metabólicas, primarias o secundarias. • Para la determinación de colesterol se utilizan las siguientes reacciones o CHE: Colesterol éster hidrolasa o CHOD: Colesterol oxidasa o POD: Peroxidasa • Para la determinación de triglicéridos se utilizan las siguientes reacciones: o Donde GK: Glicerol quinasa o GPOD: Glicerolfosfato oxidasa, o POD: Peroxidasa • Colesterol total o FC = 200/ Absorbancia del Standard • Colesterol (mg/dl) = FC x Absorbancia de la muestra • Triglicéridos total o FC = 200/ Absorbancia del Standard Triglicéridos (mg/dl) = FC x absorbancia de la muestra • Colesterol HDL o FC = 76,5/ Absorbancia del Standard Colesterol HDL (mg/dl) = FC x absorbancia de la muestra • Colesterol LDL o FACTOR = 240/ Absorbancia del Stándard o Colesterol sobrenadante (mg/dl) = FC x absorbancia de la muestra Colesterol LDL (mg/dl) = Colesterol Total – Colesterol de la muestra DPG 6 microbiota y aterosclerosis • ¿Qué es Microbiota? ¿qué rol cumple en nuestro organismo? Explica o La microbiota es un conjunto de microorganismos que se localizan de manera normal en distintos sitios del cuerpo humano o está en relación simbiótica comensal con el hospedador ya que también se obtiene ventajas de ellos tanto como ellos la obtienen del individuo o funciones: ayudan a la digestión de los alimentos, producen vitaminas, protegen contra la colonización de otros microorganismos que puede ser patógenos. • ¿Nuestro cuerpo tiene la capacidad de sintetizar carnitina? o TML -> trimetil lisina o TML DO -> trimetil lisina dioxigenasa o HTML -> hidroxi trimetil lisina o TMABA -> trimetil amino butiladlehido o HTMLA -> hidroxi trimetil lisina aldolasa o TMABA DH -> trimetil amino butiladlehido deshidrogenasa o y-BB -> y butirobetaina o y-BB-DO -> y butirobetaina dioxigenasa o hígado y riñones a partir de aminoácidos como la lisina y metionina o lisina y metionina son hidrolizados para formar trimetil lisina (TML) o trimetil lisina (TML) -> hidroxila trimetil lisina (HTML) ▪ trimetil lisina dioxigenasa (TML-DO) ▪ alfa-cetoglutarato + o2 -> succinato + co2 ▪ cofactores: hierro, ácido ascórbico ▪ hidroxilación o HTML (hidroxi trimetil lisina) -> TMABA (trimetil amino butiladlehido) ▪ HTMLA (hidroxi trimetil lisina aldolasa) ▪ libera glicina ▪ condensación aldosolica inversa o TMABA (trimetil amino butiladlehido) -> y-BB (y butirobetaina) ▪ TMABA DH (trimetil amino butiladlehido deshidrogenasa) ▪ NAD+ + H2O -> NADH ▪ Hidroxilación o y-BB (y-butirobetaina) -> carnitina ▪ y-BB DO ▪ hidroxilación ▪ cofactores: fe+3, alfa-cetoglutarato, ácido ascórbico • ¿cuál es la función de la carnitina en nuestro organismo? Explica. o Ácido graso + CoA + ATP acil-CoA AG + AMP + Pi ▪ Acil coA sintetasa y sucede en el citosol. o Acil-CoA AG se difunde a través de la membrana o Acil-CoA AG + carnitina coA + acil carnitina AG ▪ Carnitina palmitoil transferasa 1 (CPT1). Sucede en el espacio intermembrana de la mitocondria o acil carnitina AG entra a la matriz mitocondrial ▪ carnitina acilcarnitina translocasa o acil carnitina AG + coA acil-CoA AG + carnitina ▪ Carnitina palmitoil transferasa 2 (CPT2). o Carnitina regresa al espacio intermembrana ▪ carnitina acilcarnitina translocasa • Teniendo en cuenta la dieta de la paciente, responde: ¿Qué relación tiene el consumo de carnitina y progreso de la enfermedad (Ateroesclerosis)? Explica los procesos bioquímicos que ocurren. o SEMANA 8 • núcleo o Orgánulo más grande de las células eucariotas. o Está rodeado por membranas, cada una de las cuales es una bicapa fosfolipídica que contienen diferentes tipos de proteínas. • membrana nuclear o lamina: estructura que rodea el núcleo en forma de malla, le da soporte al poro nuclear, unida a proteínas de membrana, SUN1 y SUN2 y se unen a la nesprina (conecta proteínas citoplasmáticas a la lámina nuclear) para darle soporte y estabilidad al núcleo. o complejo poro nuclear: NPC: transporte de proteínas, ADN y ARN • poro nuclear o Permiten el transporte de moléculas solubles en agua a través de la envoltura nuclear: o Movimiento de ARN y ribosomas desde el núcleo al citoplasma. o Movimiento de proteínas ( ADN polimerasas y laminas), carbohidratos, moléculas de señal y lípidos del citoplasma hacia el núcleo. • Hutchinson – Glilford Síndrome de Progeria (envejecimiento acelerado) o una falla en la lámina A de la membrana nuclear o evita que haya un daño en el ADN farnesilación: agregar un grupo farnesilo (acido graso) y sirve de marca para que una enzima corte la enzima o en la enfermedad, hay una mutación en la secuencia y la enzima no lo puede cortar progerina pre lamina A mutada • Transporte nuclear o nucleoporina fg: reconocen sustancias que pueden entrar o salir, tienen parte hidrofílica y parte hidrofóbica y le da selectividad al poro nuclear SNL: señal de localización nuclear (marca la información) importina reconoce la carga gap: proteína aceleradora de hidrólisis de fosfato gef: proteína intercambiado de nucleótidos de guanina ran GTP: activa ran GDP: inactiva ran es proteína G que solo tiene subunidad alfa SEN: señal de exportación nuclear Importación ▪ En el citoplasma la proteína con señal de importación se asocia a la importina (dímero βα): la importia α reconoce a la proteína de importación nuclear NLS (señal nuclear de localización). La importia β se une al α. ▪ La subunidad β conduce el complejo importia α y a la proteína a importar a través del poro nuclear facilitando la traslocación hacia el núcleo. ▪ La interacción de la importia β con las FG nucleoporinas lleva a cabo el transporte a través del poro en un proceso que requiere ATP. ▪ En el nucleoplasma el complejo Ran-GDP interactúa con RCC1, un intercambiador de nucleótidos de guanina (GEF), causando que Ran libere GDP y se una a GTP. ▪ Ran en su forma GTP se une al complejo de importación (importia β) causando una disminución de afinidad del complejo hacia el NLS. El complejo importia–Ran-GTP libera el cargo dentro del núcleo. El complejo importia-Ran-GTP es devuelto al citoplasma a través del poro mediante difusión siguiendo los gradientes de concentración. ▪ En el lado citoplasmático Ran-GAP convierte Ran-GTP a Ran-GDP disociando el complejo y liberando la importia. o Exportación ▪ Citoplasma: se forma el complejo de exportación mediante el acoplamiento de la exportina 1 a la proteína con la señal de exportación nuclear mediante el reconocimiento de esta y después sucede la unión a Ran-GTP. ▪ Ran en su forma GTP adquiere afinidad para con la NES de la proteína y la exportina, así el complejo carga está listo para la exportación. ▪ El complejo se difunde a través del poro nuclear mediante su interacción con las FG-nucleoporinas. ▪ Una vez en el citoplasma, el complejo interactúa con Ran-GTP con la exportina 1 liberando así el cargo. Pero, también se puede separar de Ran y la exportina/cargo se debe directamente a la interacción con Ran-GTP. ▪ Ran-GTP asociada con los filamentos del complejo de poro nuclear interactúa con Ran-GTP y este último libera un fosfato para terminar convirtiéndose en Ran-GDP. ▪ La proteína con señal NES y la exportina 1 se disocian y la proteína queda liberada en el citoplasma. Para continuar con el ciclo Ran-GDP y la exportina son devueltas al núcleo mediante un gradiente de concentración a través del complejo de poro nuclear. Condensación del ADN y empaquetamiento o primer nivel nucleosomas: ▪ histonas enrolladas en ADN ▪ tipos de histonas: • h1 (verde) h2a, h2b, h3, • h4 (gris) o segundo nivel solenoide 6 nucleosomas juntas o tercer nivel hebra de solenoides / bucles / loops o cuarto nivel enrollamiento de la hebra de solenoides (rodillos) o quinto nivel cromosoma Replicación del ADN o Replicación de ADN: mecanismo que permite al ADN duplicarse (sintetizar una copia idéntica). De una molécula de ADN única, se obtienen dos o más "réplicas" de la primera. o La duplicación del material genético se produce de acuerdo con un mecanismo semi-conservador, lo que indica que las dos cadenas complementarias del ADN original, al separarse, sirven de molde cada una para la síntesis de una nueva cadena complementaria de la cadena molde, de forma que cada nueva doble hélice contiene una de las cadenas del ADN original. o Origen de replicación: La cantidad de ADN que se puede sintetizar a partir de un único origen de replicación se denomina replicón o unidad funcional de replicación. o o o o o o o o • • La replicación de la hebra conductora y retardada son antiparalelas. La replicación del ADN ocurre en sentido 5 á 3 .́ En la horquilla de replicación, la hebra conductora se sintetiza en forma continua y en la misma dirección que el movimiento de la horquilla de replicación. o La hebra rezagada se sintetiza discontinuamente en forma de fragmentos cortos de ADN denominados fragmentos de OKASAKI. o Un origen de replicación es el lugar del cromosoma donde se inicia la replicación de la cadena de ADN. Es una determinada secuencia de nucleótidos a partir de la cual se desarrolla una horquilla de replicación que dará lugar a las dos cadenas idénticas de ADN. o Proteína de replicación A (RPA)o factor de replicación A (RFA): estimula las ADN polimerasa, facilita la carga de helicasa. o Antígeno nuclear de proliferación celular (PCNA): estimula las ADN polimerasa y al RFC. o Factor de replicación C (RFC) ADN polimerasa δ (Pol δ): síntesis del primer ARN, primer ADN. o ARN primasa sintetiza al primer o cebador de ARN. o FEN1: Endonucleasa flap 1, elimina estructuras ramificadas (flap) durante la maduración de los fragmentos de Okazaki, y en los procesos de reparación del DNA. o RNasa HI1: Ribonucleasa de híbridos 1 o Es el mecanismo que permite al ADN duplicarse (sintetizar una copia idéntica). ▪ Proteína de replicación A (RPA) o factor de replicación A (RFA) equivalente a proteínas SSB que estabilizan las cadenas abiertas y las mantienen separadas una de otra. ▪ ADN girasa (topoisomerasa II) corta ambas cadenas del ADN para reducir la tensión molecular causada por el superenrrollamiento del ADN al abrirse las dos hebras. ▪ Helicasa (asociada con la ADN polimerasa δ) rompe los puentes de hidrógeno (P.H.) de la doble hélice, abriendo las dos hebras, lo que permite el avance de la horquilla de replicación. ▪ El factor de replicación C (RFC) interacciona con el ADN polimerasa δ. ▪ ARN primasa sintetiza al primer o cebador de ARN necesario para la síntesis de la cadena complementaria a la cadena rezagada. Permite la síntesis de los fragmentos de Okazaki en dirección 5' 3'. o En el proceso general participa: ▪ El primer ARN se unen a la cadena molde por P.H. para que la ADN polimerasa III reconozca donde debe unirse para empezar a añadir nucleótidos. ADN polimerasa III (equivalente el antígeno nuclear de proliferación celular, PCNA) sintetiza la cadena complementaria de forma continua en la hebra adelantada y de forma discontínua en la hebra rezagada, ya que solo puede sintetizar en dirección 5'→ 3'. ▪ ADN polimerasa I reemplaza los primer ARN por nucleótidos de ADN. Corta solo una de las dos cadenas de la doble hélice del ADN; y actúa en la transcripción del ADN. ADN ligasa une los fragmentos de Okazaki. Inicio de replicación en procariotas Replicación de ADN en procariotas (bacterias) o oriC define el punto de iniciación en bacterias o DnaA proteína que se dirige al punto de origen o DnaG y DnaB tienen actividad helicasa que cortan el ADN 1. acerca proteína iniciadora y reconoce el punto de origen (oriC) y se acerca el helicasa y rompe el ADN 2. SSB proteínas de unión a cadena simple, evitan la unión de la doble hebra y la topoisomerasa (favorece el giro para que la helicasa desenrolle el ADN) primasa lleva y coloca el cebador (iniciador) (segmento de ARN) 3. ADN polimerasa 3 extiende la cadena de 3' a 5' y le agrega nucleótidos (fragmentos de okazaki) 4. el ADN polimerasa 1 saca los cebadores 5. el ADN ligasa calla los huecos con los nucleótidos correspondientes. Complejo de pre iniciación 1. ORC complejo de reconocimiento del origen y se une la CDT1-geminina 2. 2. MCM proteína del mantenimiento del mini cromosoma Inicio de replicación en eucariota o Un origen de replicación es el lugar del cromosoma donde se inicia la replicación de la cadena de ADN. o Es una determinada secuencia de nucleótidos a partir de la cual se desarrolla una horquilla de replicación que dará lugar a las dos cadenas idénticas de ADN. Proteínas de horquilla del ADN en eucariotas: o Proteína de replicación A (RPA) o factor de replicación A (RFA): estimula el ADN polimerasa, facilita la o • • • • • carga de helicasa. o Antígeno nuclear de proliferación celular (PCNA): estimula el ADN polimerasa y al RFC. o Factor de replicación C (RFC) o ADN polimerasa δ (Pol δ): síntesis del primer ARN, primer ADN. o ARN primasa sintetiza al primer o cebador de ARN. o FEN1: Endonucleasa flap 1, elimina estructuras ramificadas (flap) durante la maduración de los fragmentos de Okazaki, y en los procesos de reparación del DNA. o RNasa HI1: Ribonucleasa de híbridos 1 • Replicación de ADN en eucariotas mecanismo que permite al ADN duplicarse (sintetizar una copia idéntica). o Proteína de replicación A (RPA) o factor de replicación A (RFA) equivalente a proteínas SSB que estabilizan las cadenas abiertas y las mantienen separadas una de otra. o ADN girasa (topoisomerasa II) corta ambas cadenas del ADN para reducir la tensión molecular causada por el superenrrollamiento del ADN al abrirse las dos hebras. o Helicasa (asociada con la ADN polimerasa δ) rompe los puentes de hidrógeno (P.H.) de la doble hélice, abriendo las dos hebras, lo que permite el avance de la horquilla de replicación. o El factor de replicación C (RFC) interacciona con el ADN polimerasa δ. o ARN primasa sintetiza al primer o cebador de ARN necesario para la síntesis de la cadena complementaria a la cadena rezagada. Permite la síntesis de los fragmentos de Okazaki en dirección 5' 3'. o En el proceso general participa: ▪ El primer ARN se unen a la cadena molde por P.H. para que la ADN polimerasa III reconozca donde debe unirse para empezar a añadir nucleótidos. ▪ ADN polimerasa III (equivalente el antígeno nuclear de proliferación celular, PCNA) sintetiza la cadena complementaria de forma continua en la hebra adelantada y de forma discontínua en la hebra rezagada, ya que solo puede sintetizar en dirección 5'→ 3'. ▪ ADN polimerasa I reemplaza los primer ARN por nucleótidos de ADN. Corta solo una de las dos cadenas de la doble hélice del ADN; y actúa en la transcripción del ADN. ▪ ADN ligasa une los fragmentos de Okazaki. • Mutaciones o Espontaneas condiciones normales de crecimiento y ambiente: metabolismo celular, replicación de ADN o Inducidas provocadas por factores externos (múgatenos) ▪ Agentes físicos rayos UV, rayos x, rayos alfa, rayos beta, rayos gamma, rayos cósmicos, choque térmico ▪ Agentes químicos cafeína, agentes que atacan al ADN (formalina), nitrógeno, gas mostaza, colorantes de acridina (proflavina, acridina), carcinógenos (benzopireno), sulfato de cobre, ácido bórico, ácido fórmico, colchicina, uretano, bromuro de etidio ▪ Agente biológico virus o bacteria o Desanimación consiste en la pérdida de grupos amino. ▪ La C se desamina en U que se empareja con A produciéndose transiciones: GC→TA. El U no forma parte del ADN, por lo que la glucosidasa de uracilo detecta al U en el ADN y lo retira generándose la apirimidínica. ▪ La 5-Metil-Citosina (5-Me-C) por desaminación se convierte en T, la cual es una base normal en el ADN y no se retira, por tanto estos errores no se reparan. Este tipo de mutación también genera transiciones. o Dímeros de timina o Polimorfismo diferentes formas de un mismo gen, menos sensibles a mutaciones ▪ A) Una mutación se convierte en un polimorfismo ▪ B) ADN dañado causa una mutación, y si es en una célula germinal es transmitida a un niño, y por lo tanto en la población. ▪ Una vez que un polimorfismo se estableció en la población los hijos de los portadores heterocigotos (que tienen una copia de cada alelo) pueden tener ninguno, uno o dos alelos deletéreos que causan una enfermedad grave. Los descendentes heterocigotos no se afectan en gran parte. Tipo de mutación Cambios efectos Mutuaciones puntuales Sustituciones: Depende del codón de una sola base Diferente AA proteína Transiciones A G no funcional T C Stop mutación nonTransversiones A T sense proteína G Mutación de muchas bases Microinserciones ATG GCT GTC ATC AGC TGT C Midrodeleciones ATG GCT GTC ATG CTG TC Perdida de muchas bases Deleciones Inserciones Inversiones Translocaciones • • C transposones Cambio de sentido de un fragmento Cambio de lugar de un fragmento incompleta Mismo AA mutación silenciosa (proteína normal) Mutación de corrimiento de las pautas de lectura Perdida de función de los genes Diversos efectos Perdida de función de los genes Diversos efectos Reparación de ADN o Reparación por escisión de bases: ▪ Se elimina el nucleótido con la base mutada (mutada por alquilación o por radiación ionizante) y se introduce el nucleótido correcto uniéndolo con los nucleótidos adyacentes. ▪ ADN glicosilasa específica para cada una de las bases alteradas. ▪ AP endonucleasas (APE1 específica de humanos). ▪ Fosfodiesterasas, la ADN polimerasa beta o Mecanismo de reparación de errores de apareamiento (MMR) en eucariotas y en bacterias: ▪ La lesión es reconocido por MutSα, compuesto por la unión de dos proteínas homólogas que forman un dímero (MSH2-MSH6), el cual se une al sitio del apareamiento erróneo. ▪ El complejo MutL (MLH1-PMS2) en presencia de ATP, reconoce la secuencia de ADN hemimetilado generando un rompimiento de la cadena debido a su actividad de endonucleasa. ▪ El segmento lesionado es removido por el ADN helicasa UvrD y degradado por una ADN exonucleasa. o La síntesis y ligación es realizada por ADN polimerasa III y el ADN ligasa. o En eucariotas: ▪ El daño es reconocido por el complejo (XPC, DDB, XPA y RPA). ▪ Las helicasas (XPB y XPD) apertura la doble hélice. ▪ Las endonucleasas (XPG y ERCC1-XPF), realizan la escisión de la hebra dañada. ▪ La síntesis y unión son realizadas por el ADN polimerasa I y la ligasa. ▪ Repara daños en el ADN causado por la radiación UV, agentes mutagénicos, quimioterapia. o En procariotas: ▪ El UvrABC actúa como endonucleasa, localizando la lesión y removiendo los nucleótidos con daño. ▪ La UvrA es la primera en unirse y reconocer el daño en el ADN. UvrD (helicasa II) remueve el segmento de oligonucleótidos lesionados y la ADN polimerasa I sintetiza los correctos que son unidos por la ligasa. o RH: Intercambio genético entre dos moléculas de DNA que comparten una región de secuencias homólogas. o Las células la utilizan para: o Reparar roturas nocivas que se producen en ambas hebras de ADN (rupturas de doble hebra). Producir nuevas combinaciones de secuencias de ADN durante la meiosis. o Estas nuevas combinaciones de ADN representan la variación genética en la descendencia y permite que las poblaciones se adapten durante el curso de la evolución. o Modelos para repara las rupturas de doble cadena en el ADN: o Vía de reparación de la ruptura de cadena doble (DSBR) (modelo de doble cruce Holliday) Vía de síntesis que depende de la línea del recocido (SDSA) o El complejo ADN-PK (DNAPK), es una serina/treonina kinasa nuclear que consta de una subunidad catalítica (DNAPKcs) y de un heterodímero de unión a ADN llamado KU (KU70 y KU80). El complejo ADN-PK se asocia a los extremos rotos, ayuda al alineamiento de los extremos y facilita su ligación. Recombinación homóloga y reparación de ADN o RH: Intercambio genético entre dos moléculas de DNA que comparten una región de secuencias homólogas. o Las células la utilizan para: Reparar roturas nocivas que se producen en ambas hebras de ADN (rupturas de doble hebra). Producir nuevas combinaciones de secuencias de ADN durante la meiosis. o Estas nuevas combinaciones de ADN representan la variación genética en la descendencia y permite que las poblaciones se adapten durante el curso de la evolución. o Modelos para repara las rupturas de doble cadena en el ADN: o Vía de reparación de la ruptura de cadena doble (DSBR) (modelo de doble cruce Holliday) Vía de síntesis que depende de la línea del recocido (SDSA) o El complejo ADN-PK (DNAPK), es una serina/treonina kinasa nuclear que consta de una subunidad catalítica (DNAPKcs) y de un heterodímero de unión a ADN llamado KU (KU70 y KU80). El complejo ADN-PK se asocia a los extremos rotos, ayuda al alineamiento de los extremos y facilita su ligación. o Un corte de doble cadena en uno de los dos homólogos se convierte en un hueco de cadena doble por la acción de exonucleasas. Las hebras con extremo 3 ́se degradan menos que las hebras con extremo 5 ,́ formándose extensiones 3 d ́ e cadena sencilla. o Un extremo 3 é xpuesto se aparea con su complementario en el homólogo intacto. La otra hebra del dúplex se desplaza. o El extremo 3 é ntrante es extendido por la ADN polimerasa, simultáneamente que la migración de la rama, formándose finalmente el ADN con un entrecruzamiento, denominada intermedio de Holliday. o la replicación reemplaza el ADN ausente en el lugar del corte original o El corte del intermedio de Holliday por nucleasas especializadas genera cualquiera de los dos productos de recombinación. En el grupo de productos 2, el ADN a ambos lados de la región reparada es recombinado Elementos transponibles o Transposición de ADN: Inserción de elementos de ADN que se mueven de un lugar a otro, usualmente tienen poca similaridad en su secuencia (transposón) ALU o Una secuencia Alu es un fragmento de ADN (aprox. 300 pares de bases) que se encuentran en el genoma de los primates. Las primeras secuencias de este tipo se identificaron mediante la endonucleasa Alu, de la cual han recibido su nombre, actualmente se analizan por PCR (reacción en cadena de la polimerasa) y electroforesis). Los Alu se vinculan con enfermedades hereditarias y varias formas de cáncer. o Alu se inserta en intrones por retrotransposición. o Durante las mutaciones (por evolución) los Alu activan sitios de pseudo-empalme del intron (flechas negras). Las mutaciones cambian empalme (flecha verde). o A raíz de estas mutaciones, parte de la secuencia Alu se reconoce como un nuevo exón y empalmado en la transcripción. Ciclo celular o Es un conjunto ordenado de sucesos que conducen al crecimiento de la célula y la división en dos células hijas. o Las células que se encuentran en el ciclo celular se denominan proliferantes y las que se encuentran en fase G0 se llaman células quiescentes. o La célula puede encontrarse en dos estados muy diferenciados: o Estado de no división o interfase (período comprendido entre dos mitosis y consta de tres etapas: ▪ Fase G1 (Gap 1 o intervalo 1) Existe crecimiento celular con síntesis de proteínas y de ARN. Es el período que trascurre entre el fin de una mitosis y el inicio de la síntesis de ADN. Dura de 6 y 12 horas, y durante este tiempo la célula duplica su tamaño y masa debido a la continua síntesis de todos sus componentes, como resultado de la expresión de los genes que codifican las proteínas responsables de su fenotipo particular. ▪ Fase S Se produce la replicación o síntesis del ADN, como resultado cada cromosoma se duplica y queda formado por dos cromátidas idénticas. Con la duplicación del ADN, el núcleo contiene el doble de proteínas nucleares y de ADN que al principio. Dura unas 10-12 horas. ▪ Fase G2 (Gap 2 o intervalo 2) Continúa la síntesis de proteínas y ARN. Al final de este período se observa cambios en la estructura celular, que indican el principio de la división celular. Dura de 3 y 4 horas. Termina cuando la cromatina empieza a condensarse al inicio de la mitosis. o MITOSIS Y CITOCINESIS (fase m estado de división) ▪ Proceso que ocurre en el núcleo de las células eucariotas y que precede inmediatamente a la división celular. Hay reparto equitativo del material hereditario (ADN). ▪ Ocurre en las células somáticas y normalmente concluye con la formación de dos núcleos separados (cariocinesis), seguido de la separación del citoplasma (citocinesis), para formar dos células hijas ▪ PROFASE o • • • o • fibras de cromatina se enrollan y se condensan en cromosomas separados • nucléolos desaparece • cada cromosoma duplicado aparece como 2 cromátides hermanas • el huso mitótico comienza a formarse. • los centrosomas se alejan unos de otros impulsados por el alargamiento de microtúbulos ▪ PROMETAFASE • la envoltura nuclear se fragmenta • microtúbulos del huso invaden el área nuclear e interactúan con los cromosomas condensados • microtúbulos se extienden desde el centrosoma hacia el centro de la célula • cinetocoro -> centro del centrómero o microtúbulos se unen a los cinetocoro y interactúan con los polos opuestos del huso o fosforila (degradación de la lámina nuclear) ▪ METAFASE • etapa más larga de la mitosis • centrosomas se encuentran en los extremos opuestos de la célula • los cromosomas se unen en la placa ecuatorial (placa metafásica) • el conjunto de microtúbulos se llama huso debido a su forma ▪ ANAFASE • la más corta de la mitosis • comienza cuando las cromátides se separan (se convierten en un cromosoma completo) • los cromosomas liberados se mueven hacia los polos opuesto • la célula se alarga cortando los microtúbulos • al final, ambos extremos tienen la misma cantidad de cromosomas ▪ TELOFASE • 2 núcleos hijos se forman • la envoltura nuclear surge de los fragmentos de la envoltura progenitora • cromosomas se vuelven menos condensados • finalización de la mitosis • desfosforilar (formación de lámina nuclear) MEIOSIS ▪ Interfase • cromosomas se replican en fase S, pero no se condensa • cada cromosoma tiene 2 cromatinas hermanas genéticamente idénticas conectadas al centrómero • el centrosoma se replica formando 2 centrosoma ▪ profase I • ocupa el 90% del tiempo de la meiosis • cromosomas se condensa • cromosomas homólogos se aparecen holgadamente en toda su longitud, alineados con presión gen por gen • en el entrecruzamiento las moléculas de ADN de las cromatinas no hermanas se rompen en lugares correspondientes y se unen con el ADN de la otra • en la sinapsis se forma entre los homólogos una estructura proteica llamada complejo sinaptonémico o mantiene unidos fuertemente (alineados) en toda su longitud • en la profase tardía se deshace el complejo sinaptonémico y cada par de cromosomas se hace visible en el microscopio como un tetrada (grupo de 4 cromátides) • cada tetrad tiene uno o más quiasmas • regiones donde se han producidos entrecruzamientos que mantiene unidos los homólogos juntos hasta el anafase I • mismo que mitosis: o movimiento de centrosoma o formación de los husos con microtúbulos o ruptura de la envoltura nuclear o dispersión de los nucléolos • en la profase I tardía los cinetocoro se adhieren a los microtúbulos desde un polo o otro. los pares • de homólogos se mueven hacia la placa metafísica ▪ metafase I • los pares de cromosomas homólogos en forma de tétradas se encuentran dispuestos sobre la placa metafísica, con un cromosoma de cada par dispuesto hacia cada polo • ambas cromatinas de un homologo se adhieren a los microtúbulos del cinetocoro y un polo y las de un homologo se adhieren a los microtúbulos del polo opuesto ▪ anafase I • los cromosomas se mueven hacia los polos guiados por el huso mitótico • los cromosomas homólogos compuestos por dos cromatinas hermanas se mueven hacia los polos opuesto ▪ telofase I y citocinesis • al comienzo de telofase I cada mitad de la célula tiene un conjunto haploide completo de cromosomas, pero cada cromosoma está compuesto por 2 cromatinas hermanas • la citocinesis se produce de forma simultánea a la telofase I para formar 2 células hijas haploides • en células animales se forma un surco de segmentación y en células vegetales se forma una placa celular • no se produce ninguna replicaron cromosómica en el final de meiosis I y al comienzo de meiosis II porque los cromosomas ya están replicados ▪ profase II • se forma un aparato del uso • los cromosomas (cada uno compuesto de 2 cromátides) y se mueven hacia la placa metafísica ▪ metafase II • los cromosomas se posiciones sobre la placa metafísica • los cinetocoro de la cromátides hermanas están adheridos a los microtúbulos que se extienden desde los polos opuestos. ▪ anafase II • se separan los centrómeros de cada cromosoma y las cromátides hermanas se separan • las cromatinas hermanas de cada cromosoma se puede como dos cromosomas separados hacia polos opuestos ▪ telofase II y citocinesis • se forma el núcleo, los cromosomas comienzan a perder su condensación y se produce la citocinesis • la división meiótica produce 4 célula hijas cada una con un conjunto haploide (no replicado) de cromosomas • cada una de las 4 células hijas es genéticamente distinta de las otras y de la célula progenitora o Gametogénesis solo se da en células reproductoras ▪ Ovogénesis formación de ovocitos primarios ▪ Espermatogénesis formación de espermatozoides Control del ciclo celular o Ciclinas proteínas regulan ciclo celular, forman complejo quinasa dependiente de ciclina ▪ familia de proteínas involucradas en la regulación del ciclo celular ▪ forman complejos con enzimas quinasas dependientes de ciclinas (Cdks) activando en estas últimas su función quinasa. o Complejo cdk-ciclina ▪ La cinasa dependiente de ciclina (Cdk) son enzimas que regulan el desarrollo del ciclo celular. ▪ Las ciclinas (que pasan por un ciclo de síntesis y degradación) dota de especificidad a las Cdk. ▪ Después de la mitosis, las ciclinas se degradan por la vía de la ubiquitina-proteasoma. ▪ Activación: 1 fosfato lo activa, 2 lo inhibe. ▪ La ciclina B/CDK1 controla el paso de la fase G2 a la fase M. ▪ Cuando la célula entra en fase G2, se sintetiza ciclina B y se une a CDK1, formándose el complejo ciclina B/CDK1, cuya actividad es indispensable para que las células pasen a la fase M. ▪ El complejo ciclina B/CDK1 se activa por fosforilación y la cinasa activa (Cdk) fosforila a varias proteínas de la mitosis. o Mitógenos 1. el mitógenos se une a su receptor y forma RAS • • • • 2. RAS activa el MAP-quinasa y promueve la expresión de genes temprano inmediato y se expresa la proteína reguladora de genes (Myc) que conlleva a una expresión de genes de respuesta tardía 3. activa a la CDK/ciclina y lo fosforila y eso hace que la proteína Rb activa se separe de la proteína E2F inactiva. el Rb se fosforila 2 veces y la proteína e2f queda activa por la retroalimentación positiva y conlleva a la transcripción de genes de fase S que conlleva a activar al CDK para la síntesis de ADN. o Proteínas inhibidoras del complejo cdk-ciclina 1. se genera un daño en el ADN por un rayo x activación de quinasas ATM/ATR activa las quinasas Chk1/Chk2 2. El Mdm2 se separa del p53 y lo fosforila y activa. • Si no se separa el Mdm2 del p53, se ubiquitina y se degrada en los proteosomas. 3. El p53 se une al gen p21 y transcribe el gen y traduce la proteína p21 4. Si la proteína p21 se une al complejo CDK/ciclina lo inactiva. Puntos de regulación del ciclo celular (puntos de control) o g1 - al final: asegura que la célula esté suficientemente grande y en un ambiente favorable ▪ Punto de restricción: cuando la molécula se le restringe continuar si hay un daño • Los responsables intracelulares del paso a través de este punto son: o complejos Cdk4 y Cdk6 –ciclina D “liberan” al factor de transcripción E2F de la proteína Rb (proteína del Retinoblastoma). o Las Cdk-ciclasa fosforila al Rb para que libere al factor de transcripción E2F (del complejo RbE2F) • INK4 o p16: Inhibidoras de las quinasas • La p16 inhibe la unión de la Cdk y la ciclina → por lo que son inactivos → El E2F no se puede liberar y en consecuencia no se pasa el punto de restricción. • La acción de la p16 tiene que ver con el medio extracelular → si no existen señales del exterior (mitógenos, factores de crecimiento, nutrientes........p16 y p27 tienden a acumularse (por lo que se hacen muy activos). ▪ Punto de control (después del punto de restricción: • revisar las condiciones del medio, buscando factores externos que induzcan el progreso del ciclo celular. • Revisar que la célula haya crecido lo suficiente y que el material genético esté intacto o g2 - antes de mitosis: asegura que todo el ADN este replicado ▪ complejos Cdk1- ciclina A y ciclina B permiten el paso a través de este punto. ▪ Actividad de estos dos complejos = Factor Promotor de la Mitosis (MPF). ▪ Se encargan de inducir el ensamble del huso mitótico y de asegurarse que los cromosomas se unan a éste. ▪ La p53, detecta alteraciones en el ADN y desencadena a la activación de la CIP p21. o mitosis - entre metafase y anafase encarga de que los cromosomas se unan al huso mitótico ▪ cohesina une a las cromatinas hermanas ▪ en el punto de control se degrada la cohesina que es hecho por la separasa ▪ la separada es activada por el APC (complejo promotor de anafase) ▪ la proteína securina inactiva a la separada. ▪ el APC degrada la securina. SEMANA 9 ARN adenosina ribonucleótido / Estructura del ARN o E. SECUNDARIA El ARN se pliega como resultado de la presencia de regiones cortas con apareamiento intra molecular de bases. ▪ Tallo bucle Este tipo de estructuras se origina cuando dos regiones de una misma cadena, generalmente con una secuencia de nucleótidos complementaria si la leemos en sentidos opuestos, se empareja base a base para formar una doble hélice (o tallo) que acaba en un lazo (o bucle) de bases desemparejadas. o E. TERCIARIA Es el resultado de las interacciones en el espacio entre los átomos que conforman la molécula. ▪ Seudónudo contiene al menos dos estructuras del lazo del tallo en las cuales la mitad de un tallo se intercala entre las dos mitades de otro tallo. Tipos de ARN -> PreARN, mARN, rARN, tARN o PreARN Es una sola hebra inmadura de ARNm, son transcritas directamente del DNA en el núcleo de la célula, y que codifican para una proteína determinada. El pre-ARN es transcrito por la polimerasa I. ▪ Presentan dos tipos diferentes de segmentos, exones e intrones. Los exones se mantienen hasta el final de la síntesis del ARNm. Adición a 5' de la caperuza o casquete (CAP), que es un nucleótido modificado de guanina, la 7-metilguanosina trifosfato. ▪ Poliadenilación es la adición al extremo 3' de una cola poli- A (secuencia larga de poliadenilato (un tramo de ARN cuyas bases son todas adenina). Su adición está mediada por una señal de poliadenilación (AAUAAA), situada unos 11-30 nucleótidos antes del extremo 3' original. Esta cola protege al ARNm frente a la degradación, y aumenta su vida media en el citosol, de modo que se puede sintetizar mayor cantidad de proteína. ▪ Los intrones se eliminan en un proceso llamado empalme (splicing), que se realiza por el spliceosome (El ARNsn se asocia a una proteína formando a la ribonucleoproteína pequeña nuclear (RNPsn) que se encarga de eliminar a los intrones). o mARN ARN mensajero ▪ El ARNm maduro es trasladado al citosol de la célula, en el caso de los organismos eucariontes, a través de poros de la membrana nuclear, donde se hallan los ribosomas. ▪ Son procesadas del hnRNA que codifican para una proteína determinada. ▪ Existe una molécula de mRNA para cada gen o grupo de genes que vayan a expresarse. En las células eucariotas la polimerasa II es la responsable de transcribir los ARNm en el nucleoplasma. o rARN ARN ribosómico ▪ ARN más abundante en la célula. Principal componente de los ribosomas. ▪ rARN: formado por una sola cadena de nucleótidos (puede presentar regiones de doble hélice intracatenaria). ▪ Tienen una función catalítica y estructural en la síntesis de proteínas, según la secuencia de nucleótidos presente en el ARNm. ▪ Subunidades se nombran de acuerdo a su coeficiente de Sedimentación, medido en svedbergs (S). o tARN ARN de transferencia ▪ Es el RNA más pequeño (75 nucleótidos en promedio). ▪ Función Transportar los aminoácidos a los ribosomas y ordenarlos a lo largo de la molécula de ARNm, a la cual se unen por medio de enlaces peptídicos para formar proteínas durante el proceso de síntesis proteica. ▪ Existe una molécula de tARN para cada uno de los 20 AA, con un triplete específico de bases no apareadas, el anticodón. ▪ Cada ARNt "cargado" con su correspondiente aminoácido se une al ARNm, mediante la región del anticodón, con tripletes de bases del ARNm (cada tres bases del ARNm definen un triplete o codón) en el proceso de la traducción de la información genética que conduce a la síntesis de las proteínas. ▪ En las células eucariotas la polimerasa III es la responsable de transcribir los ARNt en el nucleoplasma. o snARN ARN pequeño nuclear ▪ El espliceosoma es un complejo formado por cinco ribonucleoproteínas nucleares pequeñas, que se encargan de eliminar los intrones, corte y empalme de ARN. o scARN ARN citoplasmático pequeño ▪ Es un RNA de unos 300 nucleótidos que forma parte del SRP (Signal Recognition Particle). Ejerce una función específica en el envío de proteínas recién sintetizadas hacia compartimentos intra o extracelulares. • Tipos de ARN Polimerasa Polimerasa ARN transcrito Función del ARN ARN Polimerasa I PreARN (rARN 28S, 18S, 8.5S) Componente de ribosoma, síntesis de proteína ARN Polimerasa II mARN Codifica proteínas snARN Corte y empalme de ARN siARN Represión mediada por cromatina, control de la traducción miARN Control de la traducción ARN Polimerasa II tARN Síntesis de proteína 5S rARN Componente de ribosoma, síntesis de proteína snARN U6 Corte y empalme de ARN 7S ARN Partícula de reconocimiento de la señal para la inserción de polipéptidos en el retículo endoplasmático ▪ • • • • • • Otros ARN cortos estables Diversas funciones, desconocidas por muchos Splicing ->se agrega cap5 y poliA, splicing quita intrones, y luego se trasporta el mARN al citoplasma Transcripción en procariotas o Consiste en hacer una copia complementaria de un trozo de ADN. Mecanismo: ensamblaje, iniciación, elongación y terminación. o Secuencia de ARNm: 5'...AUGCGA...3‘ o En una primera etapa, la ARN-polimerasa se asocia a una región del ADN, denominada promotor, la enzima pasa de una configuración cerrada a abierta, y desenrolla una vuelta de hélice, permitiendo la polimerización del ARN a partir de una de las hebras de ADN que se utiliza como patrón. o La ARN-polimerasa, se desplaza por la hebra patrón, insertando nucleótidos de ARN, siguiendo la complementariedad de bases. Cuando se ha copiado toda la hebra, al final del proceso, la cadena de ARN queda libre y el ADN se cierra de nuevo, por apareamiento de sus cadenas complementarias. De esta forma, las instrucciones genéticas copiadas o transcritas al ARN están listas para salir al citoplasma. o Unidades de transcripción en procariotas. o Una unidad de transcripción se compone de un sitio de inicio de la transcripción (o sitio de iniciación): Una región -10 de ADN, que se encuentra a diez nucleótidos del sitio de inicio de transcripción. o Una región -35 de ADN, se encuentra a 35 nucleótidos del sitio de inicio de transcripción. Secuencias compartidas o secuencias de consenso, es una secuencia común de las regiones -35 y -10 para el inicio de la transcripción. o La ARN polimerasa, conformado por cuatro subunidades proteicas (α2ββ0 ) y un factor sigma σ dirige el pegado de la RNAP a un promotor específico. o Existen factores sigma de acuerdo a las condiciones sobre las cuales se ha observado su actividad. Operon lac en E. coli -> o El operón lac es requerido para el transporte y metabolismo de la lactosa en las bacterias entérica, como la E. coli. El operón lactosa consta de: Genes estructurales: o Gen lac z: codifica la enzima β-galactosidasa, que hidroliza a la lactosa. Gen lac y: codifica la proteína galactósido permeasa, que facilita el transporte de la lactosa al interior de la bacteria colocándose en la membrana plasmática y formando un carrier. o Gen lac a: codifica la enzima tiogalactósido transferasa, que cataliza la transferencia del grupo acetil del acetil Coenzima A al 6-OH de un aceptor tiogalactósido. o Promotor: región del DNA, que reconoce a la ARN polimerasa para llevar a cabo la transcripción. o Operador: región del DNA localizada entre el promotor y el comienzo de los genes estructurales, que es reconocida por la proteína represora Lac I. o Gen represor (lac I): codifica la proteína represora Lac I, que reconoce la región operadora, donde se une. Impide la transcripción de los genes bajo el control de este promotor pero estimula la unión de la ARN polimerasa formando el Complejo Cerrado. o Cuando el represor se retire (en presencia de inductor: lactosa o IPTG), la ARN polimerasa estará lista para formar Complejos Abiertos y empezar la transcripción. Terminación – Rho o La terminación mediada por proteínas: ▪ la proteína RHO reconoce la señal de terminación. Rho es un hexámero formado por seis subunidades idénticas que aprovecha la hidrólisis de ATP para desencadenar la reacción de terminación. ▪ En primer lugar rho se une a un sitio específico del ARN llamado RUT, tras unirse a él rho viaja en dirección 5′-3′ hasta que encuentra a la ARN pol y desenrolla el segmento bicatenario RNA-DNA formado, por lo que se libera el RNA y la RNA pol cesando la transcripción. Promotor en el ADN eucariota o Un promotor es una región de ADN que controla la iniciación de la transcripción de una determinada porción del ADN a ARN (promueve la transcripción de un gen). o Los procariotas, solo tienen una polimerasa. o Los eucariotas tienen tres ARN polimerasa distintas, y cada una de las polimerasas tiende a reconocer secuencias de promotores específicas. o Los promotores tienen secuencias de nucleótidos definidas, como la cajas "TATA" y "TTGACA, que se localizan en los extremos 5'- terminales de los genes. La ARN polimerasa se une a las secuencias de dichos promotores iniciando el proceso de la transcripción. La secuencia mínima con capacidad promotora de la transcripción recibe el nombre de promotor mínimo. Complejo de pre-iniciación o Complejo de pre-iniciación en promotores con cajas TATA: • • • • • • 1. Proteína de unión a TATA (TBP, una subunidad de TFIID) se une al promotor, generando un fuerte plegamiento en el ADN. 2. Este plegamiento hace que el ADN se une al dominio C- terminal de TFIIB. 3. El ADN envuelve a la ARN polimerasa II. 4. El TFIIE se une al complejo creciente, luego, 5. Se recluta a TFIIH. Las subunidades de TFIIH tienen actividad ATP-asa y helicasa generando una tensión helicoidal negativa en el ADN. 6. Dicha tensión causa la desnaturalización del ADN y permite la formación de la burbuja de transcripción. La hebra no codificante del ADN puede entonces plegarse y entrar en el sitio activo de la ARN polimerasa II o 6 factores de transcripción TFIIA, TFIIB, TFIID, TFIIE, TFIIF, TFIIH Transcripción en eucariotas o Iniciación ▪ Una vez que el factor sigma se ha unido al promotor, se une el resto de la ARN polimerasa y se forma el “complejo del promotor cerrado; y se desarrolla un tramo de ADN. La ARN polimerasa se fija fuertemente formando el complejo del promotor abierto. ▪ Cuando entra el segundo nucleótido se forma el enlace fosfodiéster. o Elongación ▪ La ARN polimerasa sintetiza ARN en dirección 5′-3′, para ello, se desenrolla el ADN en una corta distancia llamada “burbuja de replicación”. Laelongaciónpresentadosproblemas: El dúplex debe enrollarse por detrás y desenrollarse por delante. Así la ARN sigue el sentido de desenrollado y el ARN se enrolla alrededor del dúplex con lo que no se produce superenrrollamiento. Las topoisomerasas eliminan los superenrollamientos. o Terminación ▪ La ARN polimerasa reconoce señales de terminación de la cadena. Se dan dos tipos de terminación: • A) Directa genera secuencias palindrómicas: El ARN se transcribe se enrollan en forma de horquilla y pierde estabilidad con lo que la cadena se disocia. Después de la horquilla viene una región de poli(U) que parece actuar como señal para que se suelte la ARN polimerasa y termina la transcripción. • B) Mediada por proteínas: la proteína RHO reconoce la señal de terminación. splicing alternativo en eucariotas o El splicing o empalme de ARN, es un proceso post-transcripcional de maduración del ARN del cual eliminan ciertos fragmentos secuenciales. Este proceso es muy común en eucariotas, pudiéndose dar en cualquier tipo de ARN aunque es más común en el ARNm. mecanismos que afectan los factores de unión de transcripción o Especificidad latente de unión de ADN novel por interacciones de proteína. o Arquitectura específica que facilitan la regulación a través de las interacciones con proteína. o Los pares de bases que flanquean un TFBS influye en la unión del TF. o La secuencia puede influir en TF de unión a través de efecto sobre la formación nucleosomas. epigenética o estudia los factores genéticos que son determinados por el ambiente celular en lugar de la herencia. Las modificaciones epigenéticas que regulan la transcripción o traducción. La metilación del ADN es un fenómeno epigenético. Desacetilasas de histonas (HDAC), MBD2b tiene actividad de desmetilasa. Digestión de ácidos nucleicos o boca ingresa como ADN y ARN o estomago el pH ácido desnaturaliza el ADN y el ARN o intestino (páncreas libera nucleasas) que degradan el ADN y ARN desnaturalizado en oligonucleótidos. libera fosfodiestarasa y degrada los oligonucleótidos en mononucleótidos. los mononucleótidos se degradan en nucleósido por la nucleotidasas el cual libera un fosfato que luego liberaran el azúcar que se va al torrente sanguíneo y se forman las purinas y pirimidinas. o enterocito ingresan las purinas y pirimidinas y se van a la circulación o se degradan como ácido úrico para ser eliminados por la orina. Metabolismo de ácidos nucleicos o Síntesis de Novo o Síntesis a partir de productos de degradación de ácidos nucleicos o 3-dioxinucleotido ▪ bases nitrogenadas • • • • • • purinas adenina y guanina • Pirimidinas citosina y timina ▪ azúcar 5-desoxirribosa ▪ grupo fosfato o 5-ribonucleotido ▪ bases nitrogenadas • purinas adenina y guanina • Pirimidinas citosina y uracilo ▪ azúcar 5-ribosa ▪ grupo fosfato o nucleósido base + pentosa o nucleótido nucleósido + fosfato Biosíntesis de purinas AMPc y GMPc Recuperación de purinas Lesch Nyhan o Es una enfermedad hereditaria que se incluye dentro del grupo de los errores congénitos del metabolismo. Se genera por deficiencia de la hipoxantina-guanina fosforribosiltransferasa (HGPRT). o Presencia de cristales de ácido úrico de color naranja en el pañal del niño afectado. o Formación de cristales o cálculos de ácido úrico en riñones, uréteres, o vejiga. o Cristales se depositan en las articulaciones, y con el tiempo provocan una forma de artritis similar a la gota, con inflamación y dolor. o Trastorno del movimiento: torpeza y distonía. o Cognición: falta de atención y reducción del índice de inteligencia. o Comportamiento: autolesión e impulsividad. Catabolismo de purinas o en la síntesis de purinas hay una enzima importante la cual es HPGRTC (hipoxantina fosfato guaina ribosil tranferasa) la cual cataliza 2 reacciones: ▪ hipoxantina IMP • usa como cofactor al PRPP ▪ guanina GMP • usa como cofactor al PRPP o en la enfermedad de Lesch Nyham ▪ es causada por deficiencia de HPGRTC que causa que la hipoxantina y guanina no podrán pasar a IMP y GMP, lo que causa que se acumulen. ▪ hipoxantina xantina • xantina oxidasa y libera h2o2 ▪ guanina xantina • guanina deaminasa y libera nh4 ▪ la xantina ácido úrico • xantina oxidasa y libera h2o2 y ros ▪ el ácido úrico se acumula en el cerebro lo que causa hiperuricemia e insuficiencia renal (por acumulación de sales en el túbulo renal) ▪ además, puede causar gota: • cuando se acumulan el ácido úrico en el cerebro, éstos precipitan formándose cristales que serán • • • captados por los macrófagos ocasionando su ruptura y liberación de ROS lo cual causa un daño tisular, lo que se expresa a través de una inflamación aguda de las articulaciones considerado como edema. Gota Regulación de biosíntesis de purinas Biosíntesis de Pirimidinas o glutamina + co2 + 2 ATP carbomoil fosfato ▪ PRPP • Recuperación de Pirimidinas • Catabolismo de Pirimidinas • Regulación de biosíntesis de Pirimidinas • Metabolismo de purinas y Pirimidinas Enfermedad Defecto en el gen Gota Múltiples causas SCID (inmunodeficiencia Adenosin deaminasa combinada grave) (recuperación de purinas) Enfermedad inmunodeficiente Lesch-Nyham Purina nucleósido fosforilasa Hipoxantina guanina fosforibosil transferasa (HGPRT) UMP sintasa producto que se acumula Ácido úrico Deoxiadenosina Nucleósidos de purina Purinas y ácido úrico Síntomas clínicos Dolor en las articulaciones Falla del sistema inmune incluyendo falta de células BoT Pérdida parcial de sistema inmune. Retardo mental, automutilación. Aciduria orótica Ácido orotico Retardo de crecimiento hereditaria • Biosíntesis de novo de timina o di hidro folato tetra hidro folato ▪ di hidro folato reductasa inhibida por metotextrato, aminopterina, trimetoprima ▪ NADPH NADP o tetra hidro folato 5,10 metil en tetra hidro folato ▪ serina hidorximetil transferasa ▪ serina glicina o 5,10 metilen tetra hidro folato di hidro folato ▪ timidilato sintasa inhibida por FdUMP ▪ dUMP dTMP • Deficiencia de tubo neural o Craneorraquitismo cerebro y médula espinal completamente abierto. o Anencefalia cerebro abierto y falta de bóveda craneal. o Encefalocele Hernia de los meninges y del cerebro. o Iniencefalia occipital del cráneo y de la columna vertebral con defectos retroflexión extrema de la cabeza. o Espina bífida oculta defectos del tubo neural en el que algunas de las vértebras no está completamente cerrada. o Espina bífida cerrada con un lipoma. o Meningocele protrusión de las meninges (llenos de LCR) a través de un defecto en el cráneo o la columna vertebral. o Mielomeningocele espina dorsal abierta (con un quiste meníngea). PORTAFOLIO – Folato //DPG – Folato y deficiencia de tubo neural Folato Acido fólico • Se obtiene de la dieta: hígado de res, hojas verdes, • suplemento o alimento fortificado legumbres • forma inactiva y oxidado • Forma activa y reducida • estable • Inestable • se absorbe como suplemento al 100% y como • se absorbe muy poco alimento fortificado al 85%. • metabolismo del folato o El folato es una vitamina B9 que no se puede sintetizar en el organismo y se encuentra en muchos alimentos como las verduras, los frutos, frijoles, cereales y guisantes. Es importante para el metabolismo de los precursores del ácido nucleico y varios aminoácidos, como también en las reacciones de metilación. o el folato se encuentra abundantemente en los alimentos por lo general en forma de poliglutamatos y existe una gran variedad de alimentos de donde se puede obtener un suministro adecuado del mismo. La principal función de esta vitamina es actuar como coenzima en el transporte de fragmentos simples de carbono, además de participar en la síntesis de bases nitrogenadas (guanina, adenina, pirimidina, timina) esenciales para la división celular. o El AF es la forma monoglutámica completamente oxidadade la vitamina, es sintética y se usa para forti caralimentos y como suplemento vitamínico o absorción ▪ solo los monoglutamatos se absorben por el intestino delgado mientras que el ácido fólico se descompone a la forma de monoglutamato por la folil conjugasa del páncreas y la conjugasa de la mucosa de la pared intestinal. El almacenamiento de folatos en adultos bien nutridos es de 12-28 mg. ▪ Tanto los folatos y el ácido fólico se absorben en el duodeno y el yeyuno siendo los poliglutamatos hidrolizados a monoglutamatos por la enzima glutamato-carboxipeptisdasa II en la pared del intestino. ▪ el acido fólico es una molécula monoglutámica su absorción esta medida por dos proteínas expresadas en la membrana apical del enterocito: • el transportador de folletos reducido (hRFC) con funcionamiento a pH neutro • el transportador de folletos acoplados a protones (hPCFT) dependiente de pH ácido. cuando el ácido fólico es ingerido en altas dosis, la absorción es menos eficiente, debido a la saturación del sistema de transporte acoplado a protones, no obstante, pequeñas cantidades de monoglutamatos son absorbidas por difusión pasiva en pequeñas vesículas o transporte ▪ el folato puede ser transportado por estas formas: • la forma predominante de folatos en el plasma, es unida a la albúmina es el 5-metiltetrahidrofolato (5-MTHF) o almacenamiento ▪ El hígado almacena el folato en forma reducida y conjugada o lo convierte en metil-FH4 que es secretado en la bilis y reabsorbido en la mucosa intestinal, estando disponible para los tejidos extrahepáticos. Los tejidos extrahepáticos acumulan folato a concentraciones por encima del plasma por desmetilación y formación de poliglutamatos.1 o Diversos ácidos pteroilglutámicos poseen un «efecto de ácido fólico». El ácido fólico actúa como transportador de grupos hidroximetilo y formilo. Quizá el uso más importante dentro del organismo sea la síntesis de purinas y timina, necesarias para formar el ADN. Por eso, el ácido fólico, como la vitamina B, 12 se necesitan para la replicación de los genes celulares. Probablemente así se explique una de las funciones capitales del ácido fólico, la estimulación del crecimiento. De hecho, cuando falta ácido fólico en la alimentación, los animales apenas crecen. o El ácido fólico es una vitamina que estimula el crecimiento con mucha más fuerza que la vitamina B12 y, al igual que esta, resulta esencial para la maduración de los eritrocitos, como se expone en el capítulo 32. No obstante, tanto la vitamina B12como el ácido fólico cumplen funciones químicas especiales, pero diferentes, que propician el crecimiento y la maduración delos eritrocitos. Uno de los efectos más importantes de la carencia de ácido fólico es la aparición de una anemia macrocítica, casiidéntica a la perniciosa. Muchas veces esta anemia se corrige sólo con ácido fólico. ciclo del folato 1. el folato de la dieta se reduce a dihidrofolato (DHF) que luego puede ser degradado por la vitamina b12 utilizando a DUMP como su cofactor produciendo tetra-hidrofolato y DTMP. 2. por la serina hidroximetil transferasa (SHMT) el THF se puede transforma a 5,10 metilen tetra hidro folato (5,10 metilen THF). el SHMT utiliza a la vitamina b6 como un cofactor y le dona un grupo metilo al 5,10 metilen THF de la serina el cual luego se degrada a glicina 3. con la ayuda de la enzima metilen tetra hidro folato reductasa (MTHFR) transforma el 5,10 metilen THF a 5 metil THF. esta enzima usa la vitamina b2 como su cofactor. 4. la vitamina b12 remueve un grupo metilo del 5 metil THF y lo degrada a THF. simultáneamente la vitamina b12 le dona el grupo metilo a la homocisteína para que se transforme en metionina. este proceso se lleva a cabo por la enzima metionina sintasa. por otro lado, la vitamina b12 favorece la conversión de betaína a dimetil glicina 5. la metionina se transforma en s adenosil metionina (SAM) por la enzima metionina adenosil transferasa. el SAM se puede transformar a s adenosil homocisteína (SAH) por la enzima metil transferasa la cual le dona un grupo metilo ▪ • a diversos compuestos. luego por la enzima s- adenosil homocisteína hidrolasa, el SAH se transforma nuevamente en homocisteína. El SAM puede inhibir a la MTHF reductasa 6. el 5,10 metilen THF puede irse por otras 2 vías: a. puede llevar a la síntesis de ácidos nucleicos (específicamente en la biosíntesis de Novo de purinas, en donde se utiliza como un cofactor importante b. se puede degradar a metilil THF para luego formar 10 formal THF el cual es necesario para la biosíntesis de purinas. en esta vía, el 10 formal THF es utilizado como un cofactor y es degradado a THF 7. la homocisteína se puede catolizar por una vía de transulfuración el cual convierte homocisteína a cisterna a través de 2 enzimas dependientes de la vitamina b6. la cistationina beta sintasa cataliza la condensación de homocisteína con serina para formar cistationina y luego es convertida en alfa-cetoglutarato y amoniaco por la cistationina y liasa. SEMANA 10 • Métodos de estudio moleculares o búsqueda genética para los mutantes del ciclo de división celular sensible a temperatura 1. se añade mutágena, se distribuye en alícuotas más pequeñas 2. se incuba a 23ºC durante 5 horas 3. se colocan alícuotas individuales en placas 4. se incuba a 23ºC 5. se hacen placas replicas y se incuba a. temperatura sensible para el crecimiento: crecen a 23ºC, no crecen a 36ºC • Enzimas de restricción o Es aquella que puede reconocer una secuencia característica de nucleótidos dentro de una molécula de ADN y cortar el ADN en ese punto, llamado sitio o diana de restricción, o en un sitio no muy lejano a este. o Los sitios de restricción cuentan con 4 y 6 pares de bases, con las que son reconocidos. o El mecanismo del corte de ADN se realiza a través de dos enlaces fosfodiéster en la doble hebra, lo que da lugar a dos extremos de ADN. La enzima de restricción EcoRI reconoce y escinde la secuencia 5'– G·AATTC – 3‘. o Eco: significa que la endonucleasa pertenece a Escherichia coli. o R: corresponde a la cepa RY13. o I: número que corresponde de la primera descubierta en esa forma de vida. o Localización periplasmática, la longitud del producto es 7. o Inhibida por ARNt. o ligamiento de los fragmentos de restricción con extremos: ▪ Los fragmentos producidos mediante la digestión con enzimas de restricción se unen a otras moléculas de ADN que sirven de vectores. ▪ Los vectores pueden replicarse autónomamente en una célula huésped y facilitan la manipulación de la molécula de ADN recombinante recién creada. ▪ Los fragmentos de ADN obtenidos se unen por acción de las enzimas llamadas ADN ligasas. Enzima BamHI Microorganismo fuente Bacillus amyuloliquefaciens Sau3A Staphylococcus aureus EcoRI Escherichia coli HindIII Haemophilus influenzae SmaI Serratia marcescens NotI Nocardia otitidis-cavitarum • Sitio de reconocimiento GGATCC CCTAGG GATC CTAG GAATTC CTTAAG AAGCTT TTCGAA CCCGGG CCCGGG GCGGCCGC CGCCGGCG Extremos producidos Cohesivo Cohesivo Cohesivo Cohesivo Romos cohesivos Clonación de ADN o Es la obtención de múltiples copias de un gen o de su producto génico, usualmente una proteína. o vector + fragmento de ADN ADN recombinante replicación del ADN recombinante dentro de la célula huésped aislamiento secuenciación y manipulación del fragmento de ADN purificado Vectores de clonación: son pequeñas moléculas de ADN autorreplicantes. Deben tener: ▪ Sitios de rotura con enzimas de restricción. ▪ Genes de resistencia a antibióticos, u otro gen que nos resulte útil para distinguir qué bacterias han incorporado el ADN que queremos clonar y cuáles no. o Vectores plásmidos bacterianos: o Partículas virales y cromosomas eucarióticos de levadura (“YAC”). o Vector de expresión, debe tener un promotor fuerte para que haya transcripción de las secuencias insertadas. o Para lograr la unión del fragmento de ADN y el vector, se rompen ambas moléculas con la misma enzima de restricción. Si ésta genera extremos cohesivos, en condiciones de reasociación, ambas moléculas tenderán a juntarse. o La enzima ADN ligasa facilita la formación del enlace fosfodiéster, que asegura la continuidad en cada cadena del ADN híbrido formado. ADN recombinante o 1. Aislamiento del plásmido ADN y el ADN que contiene el gen de interés. o 2. Gen insertado en el plásmido. o 3. El plásmido insertado en la célula bacteriana. o 4. Células clonadas con gen de interés. o 5. Identificación de clon deseado. o Aplicaciones: ▪ Gen para la resistencia de plagas insertada en plantas. Investigación básica sobre el gen. ▪ Genes bacterianos para la limpieza de residuos tóxicos. ▪ proteína disuelve los coágulos de sangre en la terapia de ataque al corazón. golosinas Hormona de crecimiento humano: dulces retrasan el crecimiento. ▪ La investigación básica sobre la proteína. Vacuna recombinante o Pasos a seguir en la preparación de una vacuna de ADN recombinante de la hepatitis B a partir de la levadura. ▪ (A) Clonado de ADN VHBV Aislar el gen de HBsAg del ADNc del virus VHB. ▪ (B) Unión del gen HBsAg con el ADN de la Levadura vector. ▪ (C) Transformación de las células de levadura. ▪ (D) Crecimiento de la levadura en medio selectivo para las células que contienen el plásmido. ▪ (E) Células de cultivo. ▪ (F) Células aisladas por centrifugación. ▪ (G) Lisado de células de levadura y separación de proteínas. ▪ (H) Vacuna HBsAg Secuenciamiento Reacción en cadena de la polimerasa PCR: o El ADN se calienta a 90-100°C separar las dos hebras. o El ADN se enfría rápidamente a 30-65 ° C para permitir la acción de los cebadores. Las hebra única se hibridan a sus secuencias complementarias. o La solución se calienta a 60-70 ° C; ADN polimerasa sintetiza nuevas hebras de ADN, generándose dos nuevas moléculas de doble cadena de ADN. o El ciclo completo se repite. Cada vez que se repite el ciclo, la cantidad de diana de ADN se duplica. o PCR multiplex o PRC convencional o qPCR o PCR – RT -> real time PCR o RT-PCR Electroforesis en gel agarosa o método que se emplea para separar macromoléculas en función del tamaño, la carga eléctrica y otras propiedades físicas. Northern blot o Técnica de detección de moléculas de ARN de una secuencia dada dentro de una mezcla compleja (ARNm para un péptido dado en una muestra de ARN total). o A) Añadir muestras de ARN compleja en el gel, para separar el ARN requerido. Se separan según el tamaño. o B) Colocar el gel en papel de filtro húmedo entre dos espaciadores. o C) Filtro de nitrocelulosa en la parte superior del gel: colocar papel secante sobre el filtro y añadir peso. o • • • • • • ARN se mueve para filtrar por acción capilar. o D) Añadir ADN radiactivo de una sola hebra de la sonda. o E) Preparar autorradiografía y estudiar los resultados. Secuencia de ARN de interés ausente. secuencia de ARN de interés presente. • Southern blot (hibridación) o Permite detectar la presencia de una secuencia de ADN en una mezcla compleja de este ácido nucleico. Para ello, se realiza los siguientes pasos: o Extracción del ADN de cualquier tejido humano. o Digestión del ADN con una endonucleasa de restricción que corta el ADN bicatenario en donde tenga una secuencia característica. o Electroforesis en gel de agarosa: los fragmentos de ADN resultantes se separan según su tamaño mediante electroforesis . o Preparación de un ensayo de Southern ("Southern blot"): el DNA monocatenario resultante se transfiere a la superficie de una membrana de nailon, realizando así una copia . o Hibridación con sonda radioactiva: Una sonda de locus único es una molécula pequeña de ADN o ARN capaz de hibridar (formar un dúplex ADN-ADN o ADN-ARN) con el ADN de un fragmento de restricción concreto en el ensayo de Southern. o Detección de los RFLPs mediante autorradiografía: la membrana de nailon se coloca, una vez lavada, junto a una película de rayos X dentro de una caja que las aísle de la luz. La película registra las posiciones donde hay desintegración radiactiva. Tras su exposición y el revelado fotográfico, el registro resultante de la hibridación de Southern se conoce como autorradiografía • Micromatrices o Un chip de ADN (microarray) es una superficie sólida a la cual se une una colección de fragmentos de ADN. o Se usan para analizar la expresión diferencial de genes, y se monitorean de manera simultánea los niveles de miles de ellos. o Se mide el nivel de hibridación entre la sonda específica (probe), y la molécula diana (target), y se indican generalmente mediante fluorescencia y a través de un análisis de imagen, lo cual indica el nivel de expresión del gen. • Células madre o Son células que se encuentran en todos los organismos pluricelulares y que tienen la capacidad de dividirse (por mitosis) y diferenciarse en diversos tipos de células especializadas, además de autorrenovarse para producir más células madre. o (1) Células madre embrionarias, ES: ▪ A. Embrión en estadio de división: mórula (totipotencial) ▪ B. Blastocito: sección transversal de blastocisto y masa interna de blastocito (pluripotente). ▪ C. Células madre embrionarias, ES. • ARN interferente • ARN mensajero • ARN transferencia (tARN) o El ARNt es encargado de transportar los aminoácidos a los ribosomas y ordenarlos a lo largo de la molécula de ARNm, a la cual se unen por medio de enlaces peptídicos para formar proteínas durante el proceso de síntesis proteica. • Ribosomas Subunidad 50S Subunidad 30S rARN Proteína ribosomal L rARN Proteína lisosomal S rARN 23 s (2904 31 proteínas diferentes rARN 16 s (1541 21 proteínas diferentes nucleótidos) (L1-L31) nucleótidos) (s1-s21) rARN 5 s (120 nucleótidos) Procariotas Eucariotas Ribosoma 70s (50s + 30s) 80s (60s + 40s) mARN Policistrónicos Monocistrónicos caperuza y cola poli A tARN iniciador tARN formil met tARN met Factores de iniciación FI-1, FI-2, FI-3 eFI-2, eFI-2B, eFI-3, eFI-4a, eFI-4B, eFI-4C, eFI-4E, eFI-4G, eFI-5, eFI-6 Factores de elongación Factores de terminación Inhibición • • • • • • FE-T (Ts y Tu), FE-G eFI-1, eFI-2 RF-1, RF-2, RF-3 eRF Puromicina, eritromicina, Puromicina, cicloheximida, estreptomicina, clonafenicol, pactamicina, abrina, ricina, toxina gentamicina, kanamicina, diftérica, etc. neomicina, etc Traducción de información genética o la traducción es el segundo proceso de la síntesis proteica que ocurre tanto en el citoplasma, donde se encuentran los ribosomas, y en el RER. o El ARNm se decodifica para producir un polipéptido específico de acuerdo al código genético. Es el proceso que convierte una secuencia de ARNm en una cadena de aminoácidos para formar una proteína. Universalidad del código genético Activación de aminoácidos iniciación de traducción o La iniciación de la traducción en procariotas y eucariotas requiere de un ARNt iniciador ARNmet que es usado para incorporar el residuo de metionina inicial. o La iniciación de la traducción requiere del reconocimiento de un codon AUG del ARNm. Complejo eIF4: ▪ eIF-4A es una helicasa de ARN dependiente de ATPasa ▪ eIF-4E reconoce el 5 (́ que se encuentra sobre expresada en el cáncer humano, por lo que es un blanco para terapia anticáncer). eIF-4G actúa como una base para el ensamblaje de eIF-4E y 4A en el complejo eIF-4F. o Factores de iniciación: eIF-2, eIF-2B, eIF-3, eIF-4A, eIF-4B, eIF-4C, eIF-4E, IF-4G, eIF-5, eIF-6. o ARNm: monocistrónico con caperuza y cola de poli-A Elongación de la cadena polipeptidica o El centro P (centro peptidil), es donde se sitúa el primer aminoacil-ARNt. o El centro A (centro aceptor) de nuevos aminoacil-ARNt. Las GTP se unen a los ARNt para que se puedan unir al centro A. o Factores de elongación: eIF-1, eFE-1, eIF-2. o El grupo carboxilo terminal (-COOH) del aminoácido iniciado se une con el amino terminal (-NH2) del segundo aminoácido, formando el enlace peptídico. Esta unión es catalizada por la enzima peptidil transferasa. o El centro P queda pues ocupado por un ARNt sin aminoácido. El ARNt sin aminoácido sale del ribosoma. Se produce la translocación ribosomal. o El dipeptil-ARNt queda ahora en el centro P. Todo ello es catalizado por los factores de elongación (EF2) y necesita GTP. o Según la terminación del tercer codón, aparece el tercer aminoacil-ARNt y ocupa el centro A. Luego se forma el tripéptido en A y posteriormente el ribosoma realiza su segunda translocación. Estos pasos se pueden repetir cientos de veces, según el número de aminoácidos que contenga el polipéptido. o La traslocación del ribosoma implica el desplazamiento del ribosoma a lo largo de ARNm en sentido 5' 3'. Terminación de la traducción o La terminación de la traducción requiere de factores específicos (proteínas) llamados eRF3 y eRF1 que se unen al sitio A en los eucariotas. o Las señales para la terminación son las mismas en los procariotas y en los eucariotas. o El factor de terminación eRF3 y eRF1, se une a GTP. o La terminación de la traducción se produce cuando un codón de parada (UAA) se encuentra en el sitio A de la subunidad 60S. o La escisión del peptidil-ARNt, se produce al activarse la ribozima peptidiltransferasa para transferir al polipéptido (proteína), a partir del ARNt que se encuentra en el sitio P. • biosíntesis de proteínas –eucariotas o El factor de iniciación eIF4G (es la principal) de la traducción, a la cual se le unen las proteína de unión a Cap eIF4E, la helicasa eIF4A y su activador eIF4B; se une la proteína de unión a la cola de Poli-A (PABP). • Plegamiento de proteínas mediado por chaperonas o La proteína Hsp70 revierte el proceso de desnaturalización y agregación proteica, facilitar el plegamiento correcto de proteínas sintetizadas y asiste en la translocación de proteínas a través de la membrana. o La actividad ATPasa de las Hsp70 es débil en ausencia de sustrato, por lo que está en conformación abierta interactuando con proteínas. Las proteínas que emergen del ribosoma, son reconocidas por la chaperona Hsp70 que lo estabiliza. La liberación es reversible y fácil debido a la presencia de ATP en Hsp70 y, por tanto, a su estado abierto. o Cuando la proteína ha terminado de sintetizarse, el factor de intercambio de nucleótidos BAG-1 y HspBP1 estimula la liberación del ADP y la recaptura de ATP por parte de Hsp70, lo cual induce la liberación de la proteína. o La proteína, HOP, transfiere la proteína del Hsp70 y a la Hsp90 que continúa con el proceso de plegamiento. • Plegamiento de proteínas mediado por chaperoninas o La subunidad GroEL forma una estructura en forma de barril hueco con un diámetro interno de ~45 Å. o Las proteínas mal plegadas se unen en el dominio apical hidrofóbico (cámara) de GroEL. o Después GroES se une a GroEL induciendo un cambio conformacional que promueve que la proteína sustrato se libere al interior de la cavidad de la estructura de barril, el cual le otorga un microambiente apropiado para que la proteína se pliegue además de aislarla y evitar su agregación con otras proteínas. o La proteína cuenta con ~13 s para plegarse, tiempo en el cual el anillo cis cataliza la hidrólisis de sus 7 ATP. La ausencia del fosfato del ATP debilita la unión de GroES a GroEL. o Una segunda proteína GroES se une al GroEL, posteriormente se libera la proteína plegada adecuadamente, dejando a los ATPs y la proteína sustrato unidos solo al anillo trans de GroEL. • Regulación de biosíntesis de proteínas • Biosíntesis de proteínas – procariotas o Las subunidades 30S y 50S se asocian y se acopla el primer aminoacil-ARNt (fmet-ARNt) con el codón de inicio mediante el emparejamiento de bases anticodón-codón. o El ribosoma consta de tres sitios: el sitio A, el sitio P y el sitio E. Sitio A es el punto de entrada para el aminoacil-ARNt. Sitio P (centro peptidil), es donde se sitúa el primer aminoacil- ARNt. o Sitio E es el sitio de salida del ARNt una vez descargado. El IF-1 (factor de iniciación 1) bloquea el sitio A para asegurar que el fMet-ARNt sólo se puede acoplar al sitio P. El IF-2 es una GTPasa que se asocia con el fmet-ARNt y le ayuda a acoplarse con la subunidad 30S. El IF-3: o Bloquea el sitio E y evita que las dos subunidades se asocien. Ayuda a posicionar el fmet-ARNt en el sitio P. o El ARNr 16S de la subunidad 30S reconoce el sitio de acoplamiento ribosómico del ARNm, por delante del codón de iniciación (AUG). Esto ayuda a posicionar correctamente el ribosoma sobre el ARNm para que el sitio P esté directamente sobre el codón de iniciación AUG. • Inhibidores de la síntesis de proteínas Inhibidor Efecto especifico Efecto solo en bacterias Tetraciclina Bloquea la unión de aminoacil-tARN al citio A del ribosoma Estreptomicina Evita la trascripción del complejo de inicio en la fase de elongación en el ribosoma y también causa mal apareamiento Cloranfenicol Bloquea la reacción de la peptil transferasa de los ribosomas Eritomicina Se une a la salida del túnel de los ribosomas, evita elongación de las cadenas peptídicas Rifampicina Bloquea el inicio de las cadenas de ARN mediante su unión a la ARN polimerasa (evita síntesis de ARN Efectos en bacterias y eucariotas Puromicina Provoca la liberación prematura de las cadenas poli peptídicas nacientes al incorporarse al extremo de crecimiento de la cadena. Actinomicina B Se une al ADN y bloquea el desplazamiento del ARN polimerasa (evita síntesis de ARN) Efecto en eucariotas, pero no en bacterias Cicloheximida Bloquea la reacción de translocación en los ribosomas Anciomicina Bloquea la reacción de la peptidil transferasa de los ribosomas Alfa-amanitina Bloquea la síntesis de mARN mediante su unión preferencial al ARN polimerasa II o o macrólidos (eritromicina, claritromicina, azitromicina) ▪ inhibición de translocación de péptidos desde A a P ▪ ERITROMICINA Indicada en el tratamiento de las siguientes infecciones: • Faringitis/ faringoamigdalitis causada por S.Pyogenes. • Infecciones de piel y tejidos blandos leve o moderada causada por S. pyogenes, Streptococci grupo C y G o S. Aureus. • Enterocolitis y diarrea grave causada por Campylobacter jejuni. • Neumonía adquirida en la comunidad leve. • Tos ferina • Difteria, como adyuvante a la antitoxina diftérica • Uretritis, cervicitis o proctitis no gonocócica cuando los antibióticos normalmente utilizados como primera línea para tratar estas infecciones no están recomendados • Conjuntivis del neonato causada por Chlamydia trachomatis ▪ CLARITROMICINA Indicada en el tratamiento de las siguientes infecciones causadas por micro organismos sensibles a claritromicina: • Faringitis bacteriana • Sinusitis bacteriana aguda • Reagudización bacteriana aguda de bronquitis crónica • Neumonía adquirida en la comunidad de leve a moderada • Infecciones de la piel y tejidos blandos de gravedad leve a moderada, por ejemplo, foliculitis, celulitis y erisipelas. • También puede utilizarse para la erradicación del H. pylori en pacientes con ulceras asociadas a H.pylori, en combinación con un régimen terapéutico antibacteriano adecuado y un medicamento para la curación de úlceras. ▪ AZITROMICINA Indicada para las siguientes infecciones causadas por microorganismos sensibles a la azitromicina: • Sinusitis bacteriana aguda (diagnosticada adecuadamente) • Otitis media aguda bacteriana (diagnosticada adecuadamente) • Faringitis, amigdalitis • Exacerbación aguda de bronquitis crónica (diagnosticada adecuadamente) • Neumonía adquirida de la comunidad de leve a moderadamente grave • Infecciones de la piel y tejidos blandos de gravedad leve a moderada, por ejemplo, foliculitis, celulitis, erisipelas. • Uretritis y cervicitis no complicadas producidas por Chlamydia trachomatis. aminoglucidos (gentamicina, amikalicina, etreptomicina) nefrotoxicicidad y ototoxicdad ▪ GENTAMICINA Indicada en el tratamiento de las infecciones causadas por bacterias sensibles a gentamicina, tales como: • sepsis • infecciones del sistema nervioso central(meningitis) • infecciones complicadas y recidivantes del aparato urinario cuyo tratamiento no sea posible con otros antibióticos más indicados • infecciones gastrointestinales, incluyendo peritonitis • infecciones de las vías respiratorias inferiores • infecciones de la piel, huesos, tejido subcutáneo. • Infecciones en quemados. • Endocarditis ▪ REACCIONES ADVERSAS • Todos los aminoglucósidos tienen el potencial de inducir toxicidad auditiva, vestibular, renal y bloqueo neuromuscular. • Estas reacciones adversas se producen más frecuentemente en pacientes con insuficiencia renal, en pacientes en tratamiento con medicamentos ototóxicos o nefrotóxicos y en pacientes tratados o o durante largos períodos y/o con dosis superiores a las recomendadas. • Estas reacciones son dependientes de la dosis, del espaciado de las mismas y de la duración del tratamiento. • Los síntomas pueden aparecer durante el tratamiento o una vez finalizado el mismo. tetraciclinas (doxiciclina) bloquea 30s clonafenicol (tifoidea) ▪ inhibe enzima peptidil transferasa destruye medula ósea roja en huesos ▪ depresión de la medula osea y anemia aplasica ▪ En general, debe restringirse para infecciones severas en las cuales un antimicrobiano menos tóxico es ineficaz o esté contraindicado. ▪ Fiebre tifoidea y otras infecciones severas por Salmonella sp ▪ Meningitis por organismos susceptibles. ▪ infecciones por bacterias anaerobias, incluyendo Bacteroides fragilis (infecciones intraabdominales: terapia combinada) y mixtas con aeróbicas. ▪ Infecciones por Burkholderia (Pseudomona cepacia), leptospira, rickettsias, Chlamydia. (5) Brucelosis, como alternativa a tetraciclinas. No recomendado en estado de portador de Salmonella typhi. ▪ NOTA: Los productos orales de cloranfenicol se retiraron formalmente del mercado en los EE.UU. en julio del 2012 debido al riesgo de daños graves y potencialmente fatales. El daño más serio y potencialmente mortal asociada con el tratamiento con cloranfenicol es la toxicidad de la medula ósea, que ocurre cuando el cuerpo no produce suficiente cantidad de glóbulos rojos, glóbulos blancos y/o plaquetas. Algunos tipos de toxicidad de medula ósea son reversibles, sin embargo en raras circunstancias puede causar la muerte. Los pacientes con anemia, conteo bajo de glóbulos blancos o rojos o disminución de plaquetas podrían tener un riesgo mayor de muerte o daños a la salud graves. LABORATORIO • reacción de cadena de polimerasa o amplificación enzimática de un segmento específico de ADN o se hace entre 30-40 ciclos. o función: ▪ generar copias (amplificando) de un gen de ADN ▪ tiene un ADN molde ▪ el primer ciclo se realiza en el laboratorio y el resto de ciclos se realizan en el termociclador o componentes ▪ ADN molde segmento que desea amplificar ▪ buffer pH 8, permite: incorporación de dNTPs, actividad polimerasa, temperatura cebador-molde ▪ cebador/primer (2) foward y reverse • Secuencia que flanquean el fragmento a amplificar. • TAMAÑO 18-30 nucleótidos complementarios. • COMPOSICIÓN G+C entre 40% y 75%. ▪ MgCl2 para el uso del ion Mg+2 que es el cofactors del Taq polimerasa, concentración oscila entre 0.5 y 2.5 mili molar ▪ Taq Polimerasa proviene del termus aquatus, termo estable • función: regula cambios drásticos de temperatura y no se desnaturaliza ▪ dNTPs -> nucleótidos para agregar a la cadena • dATP, dGTP, dGTP, dTTP a 100-200mM. • Estos cuatro componentes son los elementos básicos que es necesario incorporar a la reacción para que se complete una PCR. ▪ agua free o pasos: (3 reacciones) ▪ desnaturalización • a 94-96º C • • la hebra se separa ▪ anillamiento / alineamiento / iniciación del cebador • a 54-60ºC • se agregan primers: uno a 5’ y otro a 3’ ▪ extensión de cebador • a 70-74ºC • Taq polimerasa regula la temperatura y el Mg+2 es su cofactor • se agregan dNTPs o tipos de PRC ▪ PCR convencional normal ▪ PCR multiplex • distintos cebadores • distintas bacterias en gel agarosa • Se amplifica en una misma reacción distintos genes del ADN diana o diferentes ADN diana con los mismos o diferentes cebadores obteniendo varios productos de la reacción. ▪ PCR nated / anillado / alineado PCR de PCR • Amplificación doble, donde se utiliza un ADN molde de una segunda PCR el producto de una PCR inicial en la que se ha amplificado una determinada secuencia ▪ qPCR / PCR-RT (real time PCR) es más rápido, pero es más costoso ▪ RT-PCR (retro transcriptasa PCR) • cuando hay ARN y se tiene que transformar a ADN • se copia el ARN y se usa primers y lo cambia a ADN • se usa la retro transcriptasa que convierte ARN de ADN ▪ PCR de Gen rARN 16s ▪ Se trata de una molécula presente en todas las bacterias actuales. ▪ Constituye una diana universal para su identificación ▪ Los ARNr 16S contienen suficiente variabilidad para diferenciar no sólo los organismos más alejados, sino también los próximos ▪ Resulta fácil secuenciar los ARNr 16S Una vez determinada la secuencia de nucleótidos se establecen comparaciones con las bases de datos de secuencias de especies ya conocidas ▪ La identificación basada en la secuenciación del gen que codifica el ARNr 16S se centra en los siguientes casos: ▪ Bacterias no cultivables presentes en muestras clínica ▪ Bacterias cuyas características bioquímicas no se adaptan a las de ningún género o especie reconocida ▪ se hace electroforesis en gel de agarosa en PCR convencional, múltiplex y anillado para ver los resultados. ELECTROFORESIS EN GEL DE AGAROS o método que se emplea para separar macromoléculas en función del tamaño, la carga eléctrica y otras propiedades físicas. o migración de las partículas cargadas bajo la influencia de un campo eléctrico o Agarosa ▪ Polisacáridos, que mezclada con soluciones salinas, se calienta y enfría, adoptando una conformación más ordenada de tipo helicoidal. ▪ Los espacios entre las hélices funcionan como poros. ▪ El tamaño del poro puede controlarse con la concentración de la solución. o tampón de electroforesis ▪ La movilidad electroforética del ADN se ve afectada por la composición y la fuerza iónica del tampón de electroforesis. ▪ Tris 40 mM, ác. acético 19 mM, EDTA 1 mM, pH=7,5 o ADN marcador La distancia de migración depende del peso molecular del material inicial. Se cargar un ADN marcador de tamaño conocido, es decir, un marcador contiene un número determinado de segmentos de ADN conocidos. tampón de carga ▪ Aumenta la densidad de las muestras. Añadir color a la muestra, simplificando de este modo el proceso de carga y hace que la velocidad de corrida sea previsible. bromuro de etidio ▪ Es una sustancia mutágena/carcinógena potente y moderadamente tóxica. Se trata de un compuesto intercalante, es decir, que tiene afinidad para unirse al DNA, pues se introduce entre sus bases apiladas pasos: ▪ o o o DPG – flavivirus • ¿Qué procesos moleculares se producen en la paciente luego de la picadura de un mosquito infectado con flavivirus? Explicar detalladamente (tomar en cuenta el proceso de infección) ¿Qué técnica molecular es utilizada para confirmar la etiología de la enfermedad de la paciente? Explica o el flavivirus ingresa a la célula mediante endocitosis mediada por receptores y se dirige al endosoma donde el ambiente acido desencadena grandes cambios conformaciones en su estructura, específicamente en la glicoproteína de envoltura E que induce la fusión entre la membrana celular viral y la del huésped. o la membrana huésped libera el genoma. luego, se traduce el ARN viral después de procesar la poli proteína por el huésped y las proteínas del virus o después de la traducción, se forma el complejo de replicación y se asocia a las membranas del virus donde se llevará a cabo la replicación del virus. o el complejo de replicación transcribe el ARN molde a ARN, el cual servirá de molde para la nueva síntesis de ARN. o el nuevo ARN puede iniciar una nueva traducción o formar el virus o el empaquetamiento del virus ocurre en la superficie del retículo endoplasmático, y se unen las proteínas estructurales y el ARN sintetizado en el lumen del RE. o los virus inmaduros que quedan son transportados al aparato de Golgi en el lado trans donde se forma una vesícula alrededor del virus o luego la vesícula es liberada por exocitosis. • Ante un proceso de infección el sistema inmune de la paciente responde adecuadamente, pero, ¿qué procesos moleculares se producen en la célula huésped para evadir esta respuesta? Explica. En el contexto de la lectura ¿qué inhibidores se podrían utilizar? ¿cuál sería su mecanismo de acción (que proceso podría evitar)? Explica o interferón -> pro sistema inmunitario o el virus hace que haya un aumento de la síntesis de colesterol aumentando la función del HMGC reductasa o ayuda para la formación de la membrana alrededor del virus para poder salir del RE o se redistribuye el colesterol para formar las balsas lipídicas -> inhibe la señalización de los INF alfa/beta que se encargan de eliminar el virus. o Una consecuencia importante de la redistribución inducida por el virus de colesterol celular es la pérdida de la función balsa de lípidos y la inhibición de la vía de señalización de interferón. o células natural killers (NK) importante para la inmunidad de respuesta innata celular y su función es reconocer destruir las células que están infectadas por los virus o Células NK muestran tanto de activación y receptores inhibidores que reconocen diferentes ligandos. La actividad citolítica de las células NK se determina por la integración de estas señales opuestas Una importante señal se determina mediante el acoplamiento de receptores inhibidores NK con mayor de histocompatibilidad de clase complejo de la célula huésped I (MHC-I) moléculas. o Muchos virus downregulate MHC-I en la superficie celular con el fin de eludir las respuestas de células T citotóxicas (CTL), pero la reducción en los resultados de MHC-I en la activación de la muerte celular NK o En respuesta a la infección por flavivirus, la activación temprana de las células NK se ha observado pero esto es transitorio o A diferencia de muchos otros virus, flavivirus parecen aumentar la expresión de MHC-I en las células infectadas o VNO infección aumenta celular de expresión de MHC-I mediante la mejora de la actividad de los transportadores asociados con el procesamiento de antígenos (TAP) y por dependiente de NF-kB activación transcripcional de genes MHC-I . o La regulación positiva de moléculas MHC-I se puede observar hasta 96 horas después de la infección, y no es debido al efecto de IFN o cualesquiera otras citocinas, lo que sugiere la participación directa de algunos componentes virales. o Lobigs y sus colegas sugirieron que la regulación positiva de la superficie moléculas MHC-I visto en respuesta a la infección DV podría ser una consecuencia accidental de ensamblaje viral en lugar de un mecanismo específico de la evasión inmune, con precursoras del virus de la proteína C-prM no escindida responsable para el fenómenoSin embargo, MHC-I upregulation se puede observar en las células que expresan establemente replicones DV, que sólo expresan proteínas no estructurales DV o Aún no se ha resuelto si MHC-I upregulation es una respuesta a una proteína viral particular, o la replicación del ARN viral en general. o Independientemente del mecanismo, la evidencia reciente sugiere que la regulación al alza de MHC-I tiene potencialmente importantes consecuencias funcionales, la inhibición de la actividad citolítica NK o Incluso mejora moderada de MHC-I de expresión como resultado la inhibición significativa de la actividad citolítica NK. o La agregación inducida por Flavivirus de moléculas de MHC-I en la superficie de las células diana parece resultar en compromiso mucho mayor por los receptores inhibidores NK o Al igual que con WNV, tanto la actividad TAP mejorada y la regulación positiva de la transcripción de MHC-I han sido descritos con DV, dependiendo de las líneas celulares específicas analizadas o Esta última observación sugiere que la sobreexpresión de moléculas MHC-I puede implicar más de un mecanismo, e implica que puede representar un atributo importante de la evolución. o Es intrigante que flavivirus realidad upregulate MHC-I cuando en circunstancias normales los niveles basales de expresión son suficientes para proteger las células de matanza NK. o Es posible que las infecciones por flavivirus como resultado la expresión de la superficie celular de un factor celular o viral que interactúa con los receptores de activación de NK, y el aumento de MHC-I expresión contrarresta las señales de activación de las células NK. • Una de las líneas de defensa de la célula hospedera comienza con una cascada de señalización intracelular que resulta en la producción de IFN-α/β, o promueve respuestas antivirales intracelulares y ayuda a iniciar la respuesta adaptativa durante el curso de la infección por DENV. o DENV retrasa el estrés celular y la apoptosis. o Sin embargo, la presencia de mediadores anti-virales, junto con la replicación viral sugiere mecanismos de evasión viral, que pueden ser mediados por MYD88, TRIF y activaciones de la vía NF-kB. o La producción elevada de IFNα/β indica una respuesta inmunitaria apropiada, de protección contra la infección por DENV. o Sin embargo, el aumento en la replicación viral junto con el aumento de las concentraciones de IFN-α/β sugiere falta de efecto anti-viral de esta citocina. o Se han descrito varios mecanismos de señalización que implican la interferencia con IFN tipo I; inactividad catalítica de IFN por el complejo proteasa NS2B3 activa o la producción de proteínas antagonistas de IFN inducida por flavivirus que actúan a nivel del transductor de señal y activador de la transcripción (STAT), que inducen la degradación STAT o inhiben a las janus quinasas (JAK). o En este sentido, el DENV puede codificar proteínas antagonistas de IFN (VNO E, NS1 y NS2A) dirigidas a cada una de varias vías en diferentes niveles. o o o Por lo tanto, a través de una cuidadosa manipulación de los procesos celulares, tales como la expansión de RE, la autofagia, el metabolismo lipídico y la producción de IFN-α/β el DENV es capaz de secuestrar en sí las respuestas inmunitarias antivirales del hospedador. SEMANA 11 • Digestión y absorción de aminoácidos o Gastrina activada por la masticación estimula activación de HCL, pepsinogeno, pepsina o células parietales (liberan HCL) activan células principales (liberan pepsinogeno) activan la mucosa gástrica (que libera pepsina (funciona enun pH de 1-1.5) que degrada proteínas a aminoácidos como lisina, arginina y fenilalalina) o zimógeno o Una pequeña parte de los péptidos pueden pasar al interior del enterocito a través de un transportador ligado a h+. o Transporte activo secundario acoplado al sodio: ▪ Sistema Bo+ del borde en cepillo para AA básicos. ▪ Sistema xag del borde en cepillo para AA aniónicos. ▪ Sistema Imino del borde en cepillo para AA pro, hypro, gly. ▪ Sistema ATBo del intestino y los riñones para AA en estado de zwitterión. • Degradación de proteínas – lisosomas o Artitis reumatoide enfermedad autoimmune en la cual se degradar el tejido conectivo: cartílagos, colageno, tejido óseo o Regresión del utero por efecto de los lisosomas se degradan y se dirige a torrente sanguíneo y se dirige a la leche materna • Degradación de proteínas ubiquitina-proteosomas o Los proteosomas degradan proteínas en exceso y proteínas mal plegadas que son marcadas con las ubiquitinas. o Ubicuitina Proteína reguladora que dirige y marca el reciclaje o destrucción de las proteínas en el proteosoma (complejo de proteínas). o El proceso de marcar una proteína con ubiquitina (ubiquitinización) consta de una serie de pasos: ▪ El paso inicial implica la producción de un producto intermedio adenilil-ubiquitina. ▪ El segundo paso consiste en transferir la ubiquitina al centro activo del E1 (uniéndose a la cisteína) con la liberación de AMP. Este paso se realiza mediante un acoplamiento tioéster entre el carbono terminal del grupo carboxilo de la ubiquitina y el grupo sulfhidrilo o tiol (-SH) de la cisteína del E1. ▪ Se produce la transferencia de la ubicuitina del E2 al grupo amino terminal del sustrato proteico. Liberación del sustrato ubiquitinizado, marcador que indicará que dicha proteína será degradada • Metabolismo de aminoácidos o Un aminoácido se degrada en 2 partes grupo amino y el esqueleto carbonado o Esqueleto carbonado puede formar: co2 + h2o, glucosa, acetil coa, cuerpo cetonicos o NH3 (grupo amino) ingresa al ciclo de la urea y se degrada como urea. • Transaminación o Todos los amino acido reaccionan con alfa- ketoglutarato y liberan un alfa-keto acido (esqueleto carbonado) y glutamato o los niveles de transaminasa en sangre indican salud hepática: alto = mal o sucede todo en el hígado o alfa-ceto ácido = esqueleto carbonado o Las enzimas denominadas aminotransferasas o transaminasas requieren la coenzima piridoxal-5’- fosfato. o transaminasas: (enzima para reacción) • ▪ GOT / TGO / ASAT / AST transaminasa glutamico oxalacetico ▪ GPT / TGP / ALAT / ALT transaminasa glutamico priuvico o transferencia de grupo amino a un alfa-ceto acido o aminoácido + alfa-cetoglutarato alfa-ceto acido + glutamato o glutamato + oxalacetato alfa-cetoglutarato + aspartato • Desanimación oxidativa o Remover un grupo amino por la enzima glutamato deshidrogenasa (GDH) o El grupo amino del glutamato, puede ser separado por catalizada por la desanimación oxidativa catalizada por la glutamato deshidrogenasa (GDH) utilizando NAD y NADP como coenzimas Se origina amoniaco y se regenera α-cetoglutarato o glutamato alfa-iminoglutarato ▪ NADP NADPH +H o alfa-iminoglutarato alfa-ceto glutarato ▪ h2o nh4 (se va al ciclo de la urea • Ciclo de la urea o NH3 + HCO3 + carbomoil fosfato ▪ carbomoil fosfato sintetasa 1 ▪ 2 ATP 2 ADP o carbomoil fosfato + ornitina citrulina ▪ libera Pi o citrulina + aspartato arginina succinato ▪ ATP ADP o arginina succinato arginina ▪ libera succinato o arginine ornitina ▪ libera urea (se libera por orina) o fumarato malato oxalacetato gluconeogénesis ▪ (formación de glucosa a partir de compuestos no glucosídicos) • Degradación de aminoácidos o alanina, cisteína, glicina, serina y treonina se degradan a piruvato o aspargina y aspartato se degradan a oxalacetato o arginina, glutamato, histidina, prolina se degradan a alfa-cetoglutarato o isoleucina, metionina, valina se degradan a Succinil-CoA o leucina y lisina se degradan a acetil-CoA o acetoacetato o triptófano se degrada a alanina o acetoacetato o fenilalanina y tirosina se degradan a fumarato o acetoacetato • Biosíntesis de aminoácidos o aminoácidos esenciales aquellos que el organismo no puede sintetizar por sí mismo, deben ingresar al organismo por la dieta o aminoácido no esencial se sintetizan en el organismo • Biosíntesis de aminoácidos no esenciales • Biosíntesis de aminas fisiológicamente activas Compuesto Precursor Sitio de percusión Aminoácidos Glutamato Sistema nervioso central Apartato Sistema nervioso central Glicina Medula espinal Derivados de aminoácidos GABA Glutamato Sistema nervioso central Histamina Histidina Hipotálamo Norepinefrina Tirosina Nervios simpáticos, SNC Epinefrina Tirosina Medula adrenal, algunos nervios del SNC Dopamina Tirosina Sistema nervioso central 5 hidroxi triptófano Sistema nervioso central, células intestinales triptófano enterocromaafinas, nervios entericos Derivados de purinas ATP Nervios sensoriales, entéricos, y simpáticos Adenosina ATP Sistema nervioso central, nervios periféricos Gas Oxido nitirco arginina Acetilcolina Colina Nervios parasimpáticos, SNC • Biosíntesis de aminas o triptófano 5 hidroxi triptófano ▪ triptófano hidroxilasa ▪ o2 h2o ▪ bh4 bh2 o 5 hidroxi triptófano serotonina ▪ DOPA descarboxilasa ▪ libera co2 o serotonina n-acetil serotonina ▪ acetil coA coASH o n acetil serotonina melatonina ▪ SAM SAH o serotonina 5 hidoxinodil acetaldehído ▪ MAO-A ▪ libera nh4 o 5 hidroxinodil acetaldehído 5 hidroxinodil ácido acético ▪ NAD+ NADH o fenilalanina tirosina ▪ phe hidolasa ▪ bh4 bh2 o l tirosina dopa ▪ tirosina hidrolasa ▪ bh4 bh2 o dopa dopamina ▪ dopa descarboxilasa ▪ libera co2 o dopamina noreprinefrina ▪ dopamina beta hidrolasa ▪ entra o2 ▪ vitamina c y cu+2 son cofactores o noreprinefrina epinefrina ▪ SAM SAH • Ciclo de los neurotransmissores o • Toxina botulínica o • Receptor de serotonina o • Neurotransmisores de importancia medica Neurotransmisor Mecanismo de acción Ubicación Acetilcolina (ACH) Norepinefrina (NE) Epinefrina Serotonina Glutamato Gamma amino acido buritico (GABA) • Síntesis de grupo hemo o Succinil coA + GLICINA delta acido aminolevulinico (ALA) ▪ sale co2 ▪ delta- acido aminolevulinico sintetasa ▪ en la mitocondria o sale el ALA de la mitocondria o ALA porfobilinogeno (PBG) ▪ profobilinogeno sintasa Aminoácidos esenciales • arginina • histidina • isoleucina • leucina • lisina • metionina • fenilalanina • treonina • triptófano • valina comentario Aminoácidos no esenciales • alanina • aspargina • aspartato • cisteína • glutamato • glutamina • glicina • prolina • serina • tirosina porfobilinogeno (PBG) uroporfirinogeno III ▪ uroporfirinogeno sintasa ▪ sale 4 nh3 o uroporfirinogeno III coproporbilinogeno ▪ coproporbilinogeno descarboxilasa ▪ sale 4 co2 o coproporbilinogeno protoforfilinogeno IX ▪ en la mitocondria ▪ coproporbilinogeno oidasa ▪ libera 2 co2 o protoforfilinogeno IX portofilina IX ▪ protoforfilinogeno oxidasa o portofilina IX hemo ▪ fe+2 2h+ ▪ ferroquelatasa añade hierro (fe+2) y es la ultima enzima para poder obtener un hemo maduro o estructura de la hemoglobina: ▪ conformada por anillos pirrolico, es una estructura tetra pirrolico con un núcleo atómico metalico, ejemplo más importante el grupo hemo dentro de la hemoglobina que contiene hierro ▪ se forma en la medula osea roja ▪ el plomo inhibe la hemoglobina o La succinil-CoA y glicina se convierten en ALA (ácido deltaaminolevulínico), utilizando como cofactor el piridoxal fosfato y a la enzima delta aminolevulínico-sintasa. El ALA es transportado al citosol, en donde se convierte en porfobilinógeno (PBG), por acción de la porfobilinógeno-sintasa. o Cuatro moléculas de PBG se transforma en uroporfirinógeno III por la acción de la uroporfirinógeno III sintasa. o El uroporfirinógeno III, por la uroporfirinógeno descarboxilasa se transforma en coproporfirinógeno III. El coproporfirinógeno III es transportada al interior de la mitocondria, donde la coproporfirinógeno-oxidasa lo transforma en protoporfirinógeno IX, que a su vez, mediante la protoporfirinógeno-oxidasa se convierte en protoporfirina IX. o El ion ferroso por acción de la ferroquelatasa, para dar lugar al grupo hemo. Rol del hierro - absorción en el intestino e ingreso al sistema retículoendotelial o En el estómago parte del Fe+3 se reduce a Fe+2 debido al bajo pH gástrico y a la acción de la vitamina C que favorece esta reacción. Una parte del Fe+3 pasa al duodeno donde se reduce a Fe+2 por acción de la DcytB (ferrorreductasa), para que se absorba como Fe+2 o El Fe+2 se absorbe por acción de la proteína transportadora denominada transportador de metal divalente (DMT1), encargada también del transporte de otros metales como zinc, cobre y cobalto. El hemo proveniente de las carnes (hierro orgánico) es absorbido mediante la proteína transportadora de hemo (HCP1); el hemo en el interior del enterocito es metabolizado por la hemo oxidasa, liberando Fe+2 y porfobilinógeno. o El Fe+2 es transportado hacia la sangre por medio de la ferroportina (IREG1) de la membrana basolateral del enterocito; la hefaestina (ferroxidasa homologa a la ceruloplasmina) oxida al Fe+2 en Fe+3, que es transportado mediante la transferrina al sistema reticuloendotelial y a diversos tejidos. Endocitosis del hierro / Metabolismo del hierro o El Fe+3 es transportado por la transferrina (ferrotransferrina). La transferrina sufre endocitosis en los tejidos, donde el endosoma tiene un pH ácido para que el Fe+3 se reduce a Fe+2 que será utilizado en la eritropoyesis (síntesis de eritrocito y en la Hb), en la mioglobina, en los citocromos y en las enzimas como la catalasa. o El hierro se almacenada en dos formas: ▪ Hemosiderina que es insoluble. ▪ Ferritina (proteína) almacenado intracelularmente se encuentra en el hígado, bazo, mucosa intestinal, médula ósea y músculo esquelético. La ferritina consta de una capa externa de apoferritina y en la parte interior se almacena hierro como hidroxifosfato férrico. ▪ La transferrina libre de hierro se denominada apo-ferritina. Degradación del grupo hemo o Hemo biliverdina ▪ Ingresa o2 ▪ Sale fe+3 y co o • • • Biliverdina bilirrubina ▪ NADPH + H NADP+ o Bilirrubina urobilinogeno ▪ Por enizmas microbiales ▪ Ingresan 8 h+ o Urobilinogeno sercobilina ▪ Ingresan 2 h+ ▪ En el intestino grueso ▪ Catalizado por enzimas microbiales ▪ Le da color a las heces o Urobilinogeno urobilina ▪ En el riñon ▪ Libera 2 h+ ▪ Le da color a la orina Hemocatéresis o Hemocateresis en hígado, bazo y en menor medida en la médula ósea roja: Después de la fagocitosis de los eritrocitos por los macrófagos, la hemoglobina se recicla. o La globina de la Hb es separada del grupo hemo y descompuesta en aminoácidos que pueden volver a utilizarse para la síntesis de proteínas. o El hemo se descompone en hierro (formando ferritina o hemosiderina) y bilirrubina. Hemosiderosis y hemocromatosis o La hepcidina inhibe la expresión de la ferroportina y la DMT1, con lo cual evita la absorción de hierro, tanto inorgánico como orgánico. o Hemosiderosis ▪ enfermedad caracterizada por el exceso de hemosiderina (color amarillo oro, dorado o pardo amarillento) en el hígado, bazo, médula ósea, ganglios linfáticos, piel, páncreas. No produce daño orgánico pero puede evolucionar a hemocromatosis. ▪ Se produce por: Aumento en la absorción de hierro en la dieta. Anemias hemolíticas Transfusiones sanguíneas (porque los eritrocitos constituyen una fuente de hierro exógeno) o Hemocromatosis ▪ enfermedad hereditaria que afecta al metabolismo del hierro, provocando un acúmulo excesivo e incorrecto de este metal en los órganos y sistemas del organismo. ▪ El gen HFE y las dos principales mutaciones asociadas a él en la enfermedad son el C282Y y H63D. Mutaciones del receptor 2 de transferrina (TFR2). Mioglobina o mioglobina aumenta la solubilidad efectiva del O2 en las células musculares y actúa como un tipo de reservorio molecular para aumentar la velocidad de difusión del O2. o Proteína del musculo que capta oxigeno Hemoglobina Hemoproteínas- mioglobina y hemoglobina Flavoproteína Colágeno y vitamina c (síntesis de colágeno) o síntesis de cadena de polipéptidos o hidroxilación de prolinas y lisinas (la vitamina c es un cofactor) o glicosilación de hidroxilisinas o unión de 3 cadenas o formación de un pro colágeno de tripe hélice o secreción (Golgi a exocitosis) o eliminación de pro-péptidos o formación de fibra de colágeno Proteínas de importancia Elastasa o Elastina proteína del tejido conjuntivo con funciones estructurales que, confiere elasticidad a los tejidos de las arterias, ligamentos, pulmones y piel. Proteínas plasmáticas (albumina y alfa-glicoproteina acida) o • • • • • • • • • • o albumina es la proteína mas abundante del plasma sanguíneo • Mecanismo bioquímico en el excesivo consumo de proteínas PORTAFOLIO / DPG - HIERRO • ¿Qué eventos bioquímicos ocurren cuando una persona consume hierro de la dieta o suplementos de hierro? (relaciona los eventos a la absorción, transporte y almacenamiento de éste elemento) Explica y esquematiza o El hierro es un metal con funciones de gran importancia debido a que participa en procesos vitales para el ser humano como la respiración celular, y los sistemas enzimáticos responsables en la integridad celular. o El hierro tiene varias funciones en el cuerpo que se relacionan con el metabolismo del oxígeno y especialmente en el transporte de éste por la hemoglobina. Dentro del cuerpo el hierro existe en dos estados de oxidación: ferroso (Fe+2) (hemo) ó férrico (Fe+3) (no hemo). Debido a que el hierro tiene una afinidad para los átomos electronegativos como el oxígeno, nitrógeno y sulfuro, estos átomos se encuentran en los centros de unión del hierro en las macromoléculas. o El hierro está asociado con proteínas a través de su incorporación a la protoporfirina IX ó a través de su unión con otros ligandos. Cuando la forma ferrosa del hierro y la protoporfirina IX forman un complejo se denomina a esta estructura como hem. o hay un gran número de proteínas que contienen hem que están involucradas en el transporte del oxígeno (hemoglobina), almacenamiento de oxígeno (mioglobina) y catálisis enzimática tales como la sintasa del óxido nítrico (NOS) y la sintasa de prostaglandinas (ciclooxigenasa). o El hierro se puede almacenar dentro de los enterocitos intestinales o transportado a la sangre. Cuando se almacena intracelular en los enterocitos intestinales, así como otras células, el hierro se une a la ferritina en el Fe+3 Estado. o Hierro en la dieta se clasifica como hemo o hierro no hemo. El hierro hemo es muy abundante en las carnes, como un componente de la hemoproteínas, la hemoglobina y la mioglobina. El bajo pH del estómago, junto a las enzimas proteolíticas es responsable de la liberación de hemo hemoproteínas. o absorcion • Sólo se absorbe, aproximadamente, 10% del hierro de la dieta y la absorción depende de factores promotores o inhibidores y puede darse una variación en la absorción de hasta 50%. ▪ El hierro ingerido por vía oral ingresa al tubo digestivo y en su etapa digestiva es degradado inicialmente en el estómago por acción de la pepsina y el ácido clorhídrico, primeros promotores de su solubilización. La absorción el hierro se realiza principalmente en el duodeno y en la parte superior del yeyuno. ▪ Afuera del enterocito, el hierro+3 se reduce a hierro+2 (no hemo a hemo) por la DCYT B y luego ingresa al enterocito mediante el DMT1 que es un transportador de metales divalente 1 y es responsable de la absorción de la forma ionice de los metales. ▪ El hierro hemo es captado por la proteina de membrana HCP1 (proteina portadora de hemo 1) ▪ Dentro del enterocito el hierro se puede dirigir al plasma siendo exportado por la proteína de membrana ferroportina 1 (FPN1) o se puede almacenar en la proteina de almacenamiento ferritina. o transporte y captación celular ▪ Después de la absorción por el enterocito, el hierro debe ser entregado a las células para funciones generales o específicas. ▪ La estabilidad de hierro unido a transferrina (TBI) depende de varios factores, como el estado de oxidación del hierro, la conformación de la proteína y el pH del medio ambiente. ▪ Tf se encuentra en el plasma en tres estados: apo-transferrina (Tf-apo), cuando no hay hierro está unido; transferrina monoferrica (limitado a un único átomo de hierro); y transferrina diférrica, también ▪ • • conocido como holo-transferrina (Tf holo-; acotada a dos átomos de hierro). La existencia concomitante de estos tres estados de la Tf en un individuo sano permite que la respuesta a los aumentos agudos de la absorción de hierro, la prevención de los efectos tóxicos del exceso de hierro en el organismo. ▪ La captación celular de TBI está mediada principalmente por el receptor de la transferrina 1 (TfR1), situada en la membrana de la célula. Tras la unión de la superficie celular, el complejo TBI-TfR1 se somete a una endocitosis dependiente de clatrina. ▪ El pH del endosoma disminuye por la entrada de H+ mediada por una bomba de protones dependiente de ATP, y Fe+3 es liberado, mientras que la apo-Tf permanece unido a TfR1. En el endosoma, el hierro libre se reduce en Steap 3 y se transporta al citoplasma por DMT1. Mientras tanto, el complejo Tf-TfR1 es conducido a la superficie celular donde apo-Tf es liberado al plasma o almacenamiento o reciclamiento ▪ Una de las principales funciones de los macrófagos esplénicos y hepáticos es para barrer los eritrocitos senescentes a fin de liberar el hierro de la hemoglobina, lo que hace que esté disponible para otro ciclo de hemoglobina. El reciclaje en macrófagos contribuye a la gran acumulación de hierro plasmático, superior a la contribución de la absorción de hierro en la dieta. Hay varias alteraciones que son reconocidas por los macrófagos como marcadores de eritrocitos de envejecimiento. Estos incluyen modificaciones en el miembro de eritrocitos soluto familia portador 4 (intercambiador aniónico) 1 (SLC4A1), la presencia de la fosfatidilserina de la membrana, y la disminución de la flexibilidad de la membrana, el ácido siálico y en el grupo de diferenciación del antígeno (CD47). Una combinación de estas modificaciones desencadena la fagocitosis de los eritrocitos por el macrófago. ▪ Una vez en el fagolisosoma, el eritrocito se somete a especies reactivas de oxígeno (ROS) y enzimas hidrolíticas que promueven la liberación de hemo al fluido vacuolar. Entonces, HO1 junto con O2 escinde heme al hierro, monóxido de carbono y biliverdina. Los macrófagos también capturan la hemoglobina liberada al suero por los eritrocitos rotos. Complejos de hemoglobina de plasma con haptoglobina, que es reconocido por el macrófago receptor de superficie celular CD163. ▪ El transporte de hierro dentro de los macrófagos implica: • El movimiento de hierro a través de la membrana fagosoma por los transportadores DMT1 y la proteína de macrófago asociada a la resistencia natural (NRAMP1) • El transporte a través del citoplasma mediada por los chaperonas PCBP y • La entrega de Fe 2 + a la FPN1 para la exportación celular, seguido de la reducción por el glicosilfosfatidilinositol ligada (GPI) Cp y la consiguiente unión al suero Tf. ¿Qué procesos bioquímicos y moleculares regulan el metabolismo del hierro en nuestro organismo? (relaciona los niveles de hierro con la inflamación, infección, hipoxia, anemia y eritropoyesis) Explica y esquematiza o o 4. Regulación del metabolismo del hierro ▪ El organismo humano tiene varios mecanismos mediante los cuales los niveles de hierro se mantienen en la homeostasis. ▪ el proceso de absorción supera las pérdidas en el hierro no específicos a través del sangrado, el sudor y el desprendimiento de las células epiteliales. ▪ Siempre que se requiera más hierro, el organismo aumenta su absorción duodenal y la liberación de los macrófagos y de las células que almacenan. ▪ Por otro lado, cuando las condiciones enfrentadas de sobrecarga de hierro la absorción se inhibe y el almacenamiento incrementa, con el fin de evitar los efectos tóxicos del exceso de hierro libre 4.1. regulación sistémica ▪ El principal regulador de la homeostasis del hierro conocida es la hepcidina, una hormona peptídica 25 aminoácidos (aa) se expresa principalmente en el hígado y en menores cantinas en las células beta del pancreas, riñones, adiosito, macrófago y pulmón. se elimina a través de la orina ▪ La hepcidina se expresa a partir del HAMP gen localizado en el brazo largo del cromosoma 19 ▪ la hepicidina actua estimulando y degradando la FPN1 y si se une al FPN1, provoca su ubiquitinación rápida . ▪ Por lo tanto la hepicidina regula el metabolismo del hierro sistémica mediante la reducción de los niveles de FPN1 y, en consecuencia, la absorción de hierro en la dieta y la liberación de los macrófagos, hepatocitos y otros tipos de células. ▪ la sobrecarga de hierro, la infección y la inflamación hasta de regulan la expresión de HAMP, mientras que la deficiencia de hierro, la hipoxia, anemia y la eritropoyesis suspenden su expresión. ▪ la expresión de hepicidina está regulada por una serie de condiciones fisiológicas como ▪ 4.1.1. Los niveles de hierro • La regulación de la expresión de HAMP por los niveles de hierro es un proceso a través del cual el cuerpo humano evita la vez los efectos tóxicos de la sobrecarga de hierro y las consecuencias fisiológicas negativas de su deficiencia. • Varias proteínas localizadas en la superficie de los hepatocitos se considerarán como sensores de hierro '. Estos son hemojuvelina (hjv), HFE, TfR1, y TfR2 • Una de las vías involucradas en la regulación de la expresión de HAMP por el hierro es el eje de la proteína morfogenética ósea hjv-(BMP) • Hjv es una proteína de membrana unida a GPI que se considera que es el principal regulador de la expresión de HAMP en el hígado. • Hjv actúa en la superficie celular como un co-receptor de BMPs, una subfamilia de citocinas que pertenecen a los del factor de crecimiento transformante β superfamilia • La vía de señalización de BMP-hjv se desencadena sobre las BMP que se unen a los complejos del receptor de BMP (BMPR) y hjv. • Los receptores activados inducen la fosforilación de SMADs citosólicas 1, 5 y 8. Los SMADs fosforilados forman complejos con SMAD4, que se translocan al núcleo donde se unen a los elementos de respuesta BMP (BMP-RE) presentes en HAMP promotor, induciendo su transcripción • Aunque el eje hjv-hepcidina representa el mecanismo más importante para la regulación de HAMP expresión durante la sobrecarga de hierro, hay otros pocos mecanismos que pueden restringir su modo de acción ( Fig. 2 A). • Cuando se libera al medio ambiente extracelular, se cree que sHjv para actuar como un antagonista de HAMP expresión por alta hinca el BMPs, evitando que se unen a la membrana hjv y para activar la vía de señalización • Además de la escisión de furina mediada, hjv es también un objetivo a la escisión por matriptase-2 (MT2), una proteína predominantemente expresado en el hígado y un supresor de la expresión de hepcidina • Otra vía responsable de la regulación de la expresión de hepcidina depende de los niveles de hierro implica las proteínas de la membrana HFE y TFR2 • En condiciones homeostáticas de hierro, HFE se localiza parcialmente en la superficie celular de los hepatocitos unidos a TfR1 • Cada vez que aumentan los niveles plasmáticos de hierro, la transferrina cargada de hierro (Fe +2 -TF) gana una alta afinidad por el mismo receptor. • Desde el TfR1 sitios para HFE y Fe de unión 2 -TF superposición, y como la afinidad para TfR1 Fe ▪ ▪ ▪ +2 -TF es mayor que para HFE, se disocia de este receptor y se convierte en disponible para asociar con TfR2 • El Fe formado 2complejo -TF-TfR2-HFE desencadena la vía de señalización ERK1 / 2 y en última instancia HAMP expresión • HFE -> inhibe TFR1 • TFR1 -> solo se puede unir el holo tf para desencadenar via de señalización ERK1/MAPK para la expresion de HAMP • Por lo tanto, se acepta que tanto HFE y TfR2 pueden desencadenar otras vías de señalización independientes el uno del otro. Ya sea HFE y TfR2 interactúan y forman un complejo que contiene hjv en las balsas de lípidos dentro de la membrana celular también sigue siendo controvertida La infección y la inflamación • Al igual que en otros organismos, agentes patógenos requieren hierro para la supervivencia y la proliferación. Cada vez que el cuerpo humano está infectado, el patógeno se aprovecha del hierro del anfitrión, para sus propias necesidades. • El hipoferremia es comúnmente asociados con la infección es una de las varias respuestas innata y adaptativa del sistema inmunológico • Al reducir los niveles de hierro, el organismo intenta detener la proliferación de patógenos dependientes de hierro evitando un resultado rápido y la septicemia que permiten una eliminación eficaz de la infección. • La inducción de la hipoferremia durante la inflamación e infección está mediada por la hepcidina • Durante la infección, los patógenos son reconocidos como elementos extraños por varios tipos de células, como los macrófagos. • Este reconocimiento desencadena la expresión y secreción de las citocinas pro-inflamatorias interleucina (IL) -6, -22 y de tipo 1 de interferón (INF) • Este citoquinas son reconocidos por los receptores Toll-like superficie expresados por los hepatocitos y leucocitos, lo que provocó el transductor Jak-señal y activadores de la vía de la transcripción 3 (STAT3) por fosforilación. • La translocación del factor de Stat3 al núcleo y su unión al Stat3 sitios de unión de la HAMP promotor desencadenar la expresión de este gen • Por lo tanto, los patógenos extracelulares se ven privados de hierro. La hipoxia • El sistema de factor de hipoxia inducir (HIF) se reconoce como siendo el principal modulador de tanto el metabolismo del hierro y eritropoyesis durante la hipoxia HIF son factores de transcripción que se unen a los elementos de la hipoxia-respuesta (HREs), que controlan la transcripción de genes • Los niveles de proteína HIF están regulados por el oxígeno. En estado de normoxia, todos las subunidades de HIF-alfa son objeto de degradación del proteasoma • Bajo hipoxia, los HIF estabilizadas regulan la expresión de TF , TFR1 , y CP , así como de HMOX , SLC11A2 ,CYBRD1 y EPO (los genes responsables de la expresión de HO1, DMT1, Dcytb y eritropoyetina, respectivamente) • Mientras HIF-2 se ha demostrado que aumenta la expresión de SLC11A2 y CYBRD1 , aunque la mejora de la absorción intestinal de hierro, HIF-1 se ha sugerido que desempeñar un papel en la inhibición de HAMP expresión en el hígado, a través de un mecanismo mediado por HRE. Sin embargo, sigue siendo controvertida la manera cómo actúa sobre 1 HIF-HAMP expresión. • en condiciones hipóxicas, la sobreexpresion de HIF-alfa no afecta la expresion de hepicidina. La anemia y la eritropoyesis • La eritropoyesis es el proceso a través del cual se producen las células rojas de la sangre y, en consecuencia, la hemoglobina transportador de oxígeno. Durante la hipoxia, la eritropoyesis aumenta con el fin de superar los bajos niveles de oxígeno del cuerpo. • Eritropoyesis ineficaz es responsable de un estado hipóxico observado durante anemia. Eritropoyetina (EPO) es una hormona glicoproteína sintetizada principalmente en el riñón adulto • Previene la apoptosis de las células eritroides unidades formadoras de colonias y eritroblastos que no han comenzado la síntesis de hemoglobina • La hipoxia es el estímulo fisiológico primario conocido que controla la producción de eritropoyetina. • de acuerdo con la gravedad de la hipoxia, los niveles séricos de eritropoyetina puede aumentar hasta 100 veces de los niveles encontrados durante la normoxia. • se ha descubierto una nueva hormona, erythroferrone, producido por los eritroblastos en respuesta a la eritropoyetina durante el proceso de la eritropoyesis, que es responsable de la represión de la expresión de hepcidina . Sin embargo, su acción es independiente de la vía de BMP-SMAD, así como, en TfR2 • En la anemia por deficiencia de hierro, en las anemias hereditarias con eritropoyesis ineficaz y en los modelos animales de anemia por sangramiento o hemólisis, se han observado concentraciones bajas de hepcidina. Todo ello indica que existe una señal reguladora de la hepcidina que se origina en los precursores eritroides de la médula ósea. Entre los factores propuestos están el GDF 15 y el TWSG1, ambos miembros de la superfamilia de los factores transformadores de crecimiento ß (TGF-ß). o el BMP y el HJV se encuentran unidos en la matriz extracelular -> no hay cascada de señalización para la expresion de HAMP -> está inhibida o expresion de HAMP -> formación de hepcidina o hepcidina -> inhibe a la ferroportina 1 ubiquitinizandolo y promoviendo su degradación en los proteosomas o hipoxia, anemia y eritropoyesis -> inhiben expresion de HAMP -> hierro sale del enterocito por la ferroportina 1 -> podrá irse a la medula ósea para la eritropoyesis que es la formación de glóbulos rojos y promueve la formación de hemoglobina SEMANA 12 • Síntesis de glutamato o 1. Principalmente el glutamato obtenido por desaminación de la glutamina (proveniente de las glías) mediante la enzima glutaminasa. o 2. El α-cetoglutarato es aminado a partir del aspartato, para convertirse en glutamato + alfa-cetoácido; reacción mediada por una transaminasa o 3. Por aminación directa: α-cetoglutarato por acción de la glutamato deshidrogenasa se convierte en glutamato. o El glutamato no ligado es recaptado tanto por la neurona presináptica como por las células de la glía. En las células gliales, el glutamato es metabolizado a glutamina mediante la glutamina sintetasa. • Metabolismo molecular y bioquímico del glutamato / Rol de glutamato en el cerebro o Neurotransmisor excitatorio del SNC: ▪ Receptores NMDA (N-metil-D-aspartato) y AMPA (ácido α-amino-3-hidroxi-5-metil-4isoxiazolpropiónico), participa en una normal transmisión sináptica, para el desarrollo de la memoria a través de la llamada potenciación a largo plazo (LTP) y para el desarrollo de la plasticidad sináptica cerebral. • Glutamato como un potencial transmisor • Receptores NMDA y AMPA del glutamato o El glutamato se libera y actúa sobre los receptores AMPA, NMDA y KAINATO: ▪ RECEPTOR AMPA (ácido α-amino-3-hidroxi-5-metil-4-isoxiazolpropiónico). Es un canal de cationes que no discrimina entre Na+ y K+, pero lo hace para el Ca+2. La unión del glutamato al receptor AMPA, provoca la apertura del canal de Na+ y salida de K+ provocando una despolarización neuronal (potencial excitatorio postsináptico, EPSP). Esta despolarización permite que se libere Mg++ que bloquea al receptor NMDA. ▪ RECEPTOR NMDA(N-metil-D-aspartato) Está asociado a un canal de Ca+2 Na+, por lo que su activación incrementa calcio intracelular, generando diversos efecto neuronales, como participar en la memoria a largo plazo, al aprendizaje y a la neuroplasticidad. Cuando hay ingreso excesivo de Ca+2 intracelular y salida masiva del retículo endoplásmico al citosol, causando los movimientos involuntarios conocido como enfermedad de Huntington. • Interacciones neurona astrocito en sinapsis excitadora o Células gliales son de soporte estructural, metabólico y trófico de las neuronas. Durante el desarrollo del SN están implicadas en la proliferación, migración y diferenciación de precursores neuronales, así como en la sinaptogenésis y la mielinización. Pueden cambiar el potencial de membrana que ocurre cuando se activan los receptores de neurotransmisores postsinápticos, pueden participar en el procesamiento de la información al coordinar la actividad entre grupos de neuronas. o Existen dos clases de células gliales en el SN: macroglía y microglía (exclusivamente del SNC ). Astrocitos son las células gliales más abundantes en el SNC y se encuentran íntimamente asociados con las neuronas: • • • • • • • • Dan soporte estructural definiendo límites celulares, contribuyen a la formación de la barrera hematoencefálica, circundan las uniones sinápticas y debido a que en el SNC central no hay lámina basal recubriendo los axones mielinizados, en los nodos de Ranvier se encuentran asociados los astrocitos perinodales (o sinantocitos). Rol de glutamato en el cerebro o El glutamato mediante la glutamato descarboxilasa (GAD) y el piridoxal fosfato como cofactor, se convierte en GABA. Metabolismo de GABA (poder inhibitorio) Receptores GABA-A o GABA A: receptores ionotrópicos, activación canales de cloro por medio de un ligando; produce efectos inhibitorios rápidos. Receptores GABA-B o GABA-B: activados por segundos mensajeros y Proteina G; participa en la recepción de potenciales inhibitorios lentos. o Receptores presinápticos GABA-B actúan sobre proteínas G tipo Goα Giα, cuya subunidad βγ inhiben canales de Ca++ y facilitan la salida de K+. o Son dos tipos: Los que controlan la recaptación del GABA (autorreceptores). Los que inhiben la recaptación de otros neurotransmisores (heterorreceptores). o Receptores GABA-B postsinápticos se acoplan a la proteína Go, cuya subunidad βγ apertura a los canales de K+ (GIRK o Kir3), hay salida de K+ generando una hiperpolarización. Síntesis e inactivación de histamina o Neurotransmisor histamina o Incrementa la excitabilidad de las neuronas del sistema nervioso central, regula las funciones hipotalámicas al actuar sobre receptores H1, regula el estado de vigilia e inhiben el apetito. o Histidina histamina ▪ Histamina descarboxilasa ▪ Usa PLP como su cofactor ▪ Libera CO2 o Histamina imiadozol acetaldehído ▪ Diamina oxidasa ▪ Libera NH4 o Imiadozol acetaldehído imiadozol acido acético ▪ NAD NADH o Histamina metil istamina ▪ SAM SAH ▪ Histamina metil transferasa ▪ Sucede en el cerebro o Metil histamina metilimidazole acealdehido ▪ Por MAO-B ▪ Libera NH4 o metilimidazole acealdehido metilimidazole acido acético ▪ NAD NADH Metabolismo de histamina o Mastocitos y basófilos producen histamina o Receptores h1 h2 y h3 para histamina o Plasticidad transmisión de impulso nervioso, h3 es su autorregulador Síntesis de oxido nítrico / Metabolismo de oxido nítrico o Oxido nítrico vasodilatador o Acetilcolina se une al receptor acoplado de la celuala endotelial del vaso sanguíneo y activa a la fosfolipasa c el cual activa al ip3 que estimula la liberación de calcio-calmodulina que activa al NOS (oxido nítrico sintasa o Arginina + o2 citrulina + oxido nitico ▪ Oxido nítrico sintasa ▪ Usa NADPH como su cofactor o El oxido nítrico se une con su reeptor y activa a la GMPc que activa a la proteína quinasa g que estimula la relajcion de la celula muscular del vaso sanguíneo, produciéndose la vasodilatación. Metabolismo de péptidos opioides: endorfina • • • • o se produce endorfinas cuando hay felicidad exagerada o placer o morfina; inhibe el dolor y se vuelve insensible o chemoquinas de dolor: SP, glutamato, CGRP (proteina relacionada con el gen de la calcitonina) o hiperalgesia: dolor exagerado Sintesis de dopamina o bh4: tetra hidro biopterina, añade grupos oxidrilo o anillo bencenico hace que una molécula sea liposoluble y los radicales oxidrilo lo hacen mas hidrosoluble o fenilalanina tirosina ▪ phe hidolasa ▪ bh4 bh2 o l tirosina dopa ▪ tirosina hidrolasa ▪ bh4 bh2 o dopa dopamina ▪ dopa descarboxilasa ▪ libera co2 Receptores de dopamina o PGs acoplados a receptores: ▪ D1 centralespostinapticos: estimulan la actividad locomotora y extrapirimidal ▪ D1 periféricos: vasodilatación e incrementan el flujo sanguíneo, aumenta la tasa de filtración. o PGi acoplados a receptores: ▪ D2 centrales postsinápticos (inhiben canales de Ca+2 y activan canales de K+). ▪ D2 periféricos: inhiben la liberación de catecolaminas terminales simpáticas. o A nivel del SNC (neuronas dopaminérgicas: hipotálamo, sustancia negra, campo retrorubral) participa en procesos cognitivos, emociones, reforzamiento positivo de la conducta, regulación neuroendocrina, en la actividad locomotora, en la ingesta de agua y alimentos. El aumento de DA en el núcleo acumbens se relaciona con la esquizofrenia y las alucinaciones. o En el SNP: modula la función cardíaca, función renal, tono vascular y motilidad gastrointestinal Metabolismo de dopamina o 3 OMD: oxo metil dopamina que no cumple una acción o MAO: mono amino oxidasa degrada la dopamina, el MAOB degrada en mayor cantidad o th: tirosina hidroxilasa o en el torrente sanguíneo so puede formar dopamina, pero no puede salir porque no puede atravesar la barrera hemato-encefalica para la señalización de dopamina. Por eso, se necesita sintetizar en la neurona presinaptica. o la dopamina se sintetiza en la neurona presinaptica y se libera a través de vesículas y se unen a los receptores de dopamina en la celular post sinaptica o L-DOPA es liposoluble y puede ingresar a la barrera hemato- encefalica Síntesis de melatonina o triptófano 5 hidroxi triptófano ▪ triptófano hidroxilasa ▪ o2 h2o ▪ bh4 bh2 o 5 hidroxi triptófano serotonina ▪ DOPA descarboxilasa ▪ libera co2 o serotonina n-acetil serotonina ▪ acetil coA coASH o n acetil serotonina melatonina ▪ SAM SAH o serotonina 5 hidoxinodil acetaldehído ▪ MAO-A ▪ libera nh4 o 5 hidroxinodil acetaldehído 5 hidroxinodil ácido acético ▪ NAD+ NADH fenilalanina tirosina ▪ phe hidolasa ▪ bh4 bh2 o l tirosina dopa ▪ tirosina hidrolasa ▪ bh4 bh2 o dopa dopamina ▪ dopa descarboxilasa ▪ libera co2 o dopamina noreprinefrina ▪ dopamina beta hidrolasa ▪ entra o2 ▪ vitamina c y cu+2 son cofactores o noreprinefrina epinefrina ▪ SAM SAH Metabolismo de melatonina o creb: activa genes de memoria y aprendizaje o glándula pineal: sueño: se activa por el ciclo circadiano o melianopsina: hormona que favorece la liberación de glutamato y PACSP (peptido de pituitaria activador a de adenilato ciclasa o NE: noradrenalina (favorece la formación de melatonina) favorece su union y activa genes clock: y forma proteina clock y inducen el sueño o La melatonina se forma en el pinealocito y se va al torrente sanguíneo para irse a la neurona presinaptica donde se une a un receptor acoplado a proteína g y inhibe al AMPc que activa al pKA para que o La serotonina (5'-hidroxitriptamina) alcanza su máxima concentración en la glándula pineal. o Los mayores picos se originan en la oscuridad y los menores en las horas de luz. o Sucede porque el paso limitante de la síntesis de melatonina es la enzima NAT (N-acetil transferasa). o Esta enzima tiene menores niveles de actividad por el día y mayores por la noche, y es la encargada de pasar la serotonina a N-acetil serotonina. o La HOMT (hidroxil-indol metil transferasa) acaba el ciclo con la síntesis de melatonina. o Una vez que se estimula, el pinealocito segrega melatonina a la sangre, unida a albúmina (65% de las ocasiones) o libre (35%). o La vida media de la serotonina es de 10-15 minutos. o Se metaboliza por la sangre, hígado o cerebro, entre las 23:00 y las 7:00 del día siguiente de la producción. o En el hígado la 6-OH-melatonina pasa a sulfato y glucuronato y va a la orina. o En el cerebro pasa a compuestos derivados de la quinoneimina. o Las señales hormonales acompañan a las señales nerviosas que llegan a las terminaciones nerviosas del ganglio cervical superior Metabolismo de creatinina o CKB creatina quinasa brain o CKBE creatina quinasa, expresión ectopica o CKM creatina quinasa musculo o CKMB creatina quinasa corazon o CKMT1A creatina quinasa mitocrondrial a1 o CKMT1B creatina quinasa mitocondria b2 o CKMT2 creatina quinasa mitocondria 2 (sarcomero Metabolismo de creatinina en el astrocito Mecanismo molecular del parkinson o Cuando la α-sinucleína se produce en exceso, puede bloquear la liberación de la dopamina y otros neurotransmisores almacenados en vesículas . La dopamina puede acumularse hasta niveles tóxicos , formando quinona-dopamina , lo que daña la neurona. o • • • • LAB: creatinina • creatina o Es un ácido orgánico nitrogenado que se encuentra en los músculo y células nerviosas de algunos organismos vivos. Es un derivado de los aminoácidos, tiene una estructura molecular parecido a ellos. estructura: creatina (Cr) - acido alfa-metil guanido acetico otros nombres ▪ acido (alfa-metilguanido acetico) ▪ acido metilguanidino acetico ▪ n-amindinosarcosina o función: precursor energetico de almacenar energía o necesidad diaria -> > 2g/dia fuentes de creatina o exogena ▪ alimentos o suplementos o endogena ▪ síntesis en el organismo ▪ en el hígado o el riñón abosrción de creatina o creatina entra por un transportador de creativa (CrT1) cuando entra 2Na+ y 1 Cldistribución de creatina o creatina entra al cerebro o a una celula muscular pr un transportador de creativa que es dependiente de sodio y cloro y adentro puede transformarse a fosfocreatina por la creatina sintasa. metabolismo de creatina sintesis endogena de creatina o arginina + glicina -> ornitina + guanidinoacetato ▪ AGAT - arginina glicina anódino transferasa o guanidinoacetato -> creatina ▪ GAMT - n-guanidinoacetato metil transferasa ▪ SAM -> SAH fosfocreatina o atp + creatina -> fosfocreatina ▪ creatina quinasa ▪ para la contracción muscular ciclo de la creatina quinasa excreción de creatina o creatina -> creatinina ▪ libera agua ▪ para eliminar la creatina enfermedad renal cronica o Es la pérdida lenta de la función de los riñones con el tiempo. El principal trabajo de estos órganos es eliminar los desechos y elexceso de agua del cuerpo. o Uno de los marcadores para determinar la función renal es la determinación de los niveles de creatinina en suero. o creatinina -> biomarcador para detectar enfermedad renal crónica. experimento: o o o • • • • • • • • • • • conclusion: o el paciente tiene creatinina elevado y puede tener una falla renal, evitando que la creativa este elevada en sangre. DPG: PARKINSON • ¿Qué procesos moleculares se producen en el metabolismo de la dopamina? Explica detalladamente. o vmat -> hace que la dopamina se almacene en vesiculars en la neurona presináptica o dopamina se excita y se podrá unir con sus receptores d1 y d2 y por el mecanismo de señalización (Gs) habra una neuroplasticidad y podrá hacer sinapsis para una conducción nerviosa. o L-DOPA es liposoluble y puedeingresar a la barrera hemato-encefalica o COMT: catecol / metil transferasa esuna enzima que degrada la dopamina o degradación -> la dopamina se puede recaptar en la celula presinaptica por un receptor de dopamina o se puede degradar a derivados de dopamina. • ¿Qué relación existe entre la disfunción mitocondrial y la enfermedad de Parkinson? Explica detalladamente / Según el caso clínico: ¿Qué procesos moleculares están ocurriendo en el paciente? o Figura 1. sugerido procesos fisiológicos relacionados con la patogénesis de la enfermedad de Parkinson (PD). o Diferentes vías y sus disfunciones como resultado de modificaciones genéticas en los genes relacionados con la EP-y conducir a un aumento del estrés oxidativo. o Las mutaciones o alteraciones en la expresión de estas proteínas resultan en deficiencia mitocondrial, el estrés oxidativo, y mal plegamiento de proteínas. o Además, el metabolismo de la dopamina puede estar oxidado a reactivo quinonas de dopamina que contribuyen al aumento de los niveles de especies reactivas de oxígeno. alfa-sinucleína se convierte modificado y acelerar su agregación. o El aumento del estrés oxidativo provoca deterioro de la función de la UPS que degrada las proteínas dañadas o mal plegada y por este medio que afecta aún más la supervivencia celular. o Las toxinas ambientales alteran la función mitocondrial, aumentar la generación de radicales libres, y conducir a la agregación de proteínas, incluyendo α-sinucleína. La disfunción mitocondrial mediante la inhibición del complejo I afecta mediante la adición de un aumento del estrés oxidativo y una disminución en la producción de ATP, que conduce a daños en los componentes intracelulares y la muerte celular. o Además, los mecanismos neuroinflamatorios podrían contribuir a la cascada de consecuencias que conducen a la muerte celular. o En resumen, todos estos varios mecanismos celulares atribuidas al estrés oxidativo están implicados en la degeneración selectiva de las neuronas dopaminérgicas. • • Las estrategias potenciales para la intervención incluyen la modulación de bobinas nativas de α expresión sinucleína o (1), la regulación positiva de moléculas chaperonas para promover la liquidación de α -sinucleína o (2), la regulación positiva de enzimas tales como la proteína fosfatasa 2A que mejoran la desfosforilación de α sinucleína en Ser129 o (3), la facilitación del sistema ubiquitinaproteasoma para borrar no deseado α sinucleína o (4), mejora de la función liposomal y α sinucleína metabolismo mediante el aumento de la actividad de GCasa o (5), la mejora directa de tóxico α despeje sinucleína por activa y / o la inmunización pasiva o (6) o mediante el bloqueo de su agregación, la prevención de la propagación de α -sinucleína de afectado a las células no afectadas o (7), la inhibición de Ca V 1.3 para reducir la afluencia de calcio o (8), la inhibición de los receptores NMDA para limitar la activación de las rutas excitatorias o (9), la inhibición de las vías inflamatorias o (10), la regulación positiva de SIRT1 a mejoran la biogénesis mitocondrial y reducir la activación de las vías proinflamatorias o (11), la inhibición de la O vías xidative de estrés o (12), la reducción de la acumulación de hierro o (13), y la inhibición de las vías de apoptosis o (14). Los recuadros grises cuentan con medicamentos pensados para actuar en estas vías. o Abreviaturas: ▪ GCSF, granulocitos factor estimulante de colonias; ▪ NMDA, N -metil- D -aspartato; ▪ PGC-1 α , peroxisomas receptor activado por el proliferador γ coactivador 1- α ; ▪ SIRT1, dependiente de NAD proteína desacetilasa sirtuin-1. El descubrimiento de los genes heredados de b Mendel ha mejorado nuestra comprensión de las vías de señalización que median la neurodegeneración en la enfermedad de Parkinson. o Una vía principal de toxicidad celular surge a través de alfa-sinucleína, mal plegamiento de proteínas y agregación. o Estas proteínas se ubiquitinated e inicialmente degradados por el sistema de ubiquitinaproteasoma (UPS), en el que parkin tiene un papel crucial. o Sin embargo, hay una acumulación y el fracaso de despeje de la UPS con el tiempo, lo que conduce a la formación de agregados fibrilares y cuerpos de Lewy. o Protofibrillas alfa-sinucleína también pueden ser directamente tóxicos, lo que lleva a la formación de estrés oxidativo que puede poner en peligro aún más los UPS mediante la reducción de los niveles de ATP, la inhibición de la proteasoma, y mediante la modificación oxidativa parkin. o Esto conduce a la acumulación acelerada de los agregados. La fosforilación de los agregados que contienen alfa-sinucleína o que contiene tau-podría tener un papel en su patogenicidad y la formación, pero no se sabe si rica en leucina repetición quinasa 2 (LRRK2) media esto. o Otra vía principal es la vía mitocondrial. o Hay evidencia de acumulación para alteración de la fosforilación oxidativa y la disminución de la actividad del complejo I en la enfermedad de Parkinson, lo que conduce a especies de oxígeno reactivas (ROS) de formación y el estrés oxidativo. o En paralelo, hay una pérdida del potencial de membrana mitocondrial. o Esto conduce a la apertura del poro de transición de permeabilidad mitocondrial (MPTP), la liberación de citocromo c desde el espacio intermembrana al citosol, y la activación de la apoptosis mitocondrial dependiente resulta en la activación de la caspasa y la muerte celular. o Hay pruebas de que los genes recesivos heredado, tales como fosfatasa y tensina homólogo (PTEN) quinasa inducida por 1 (PINK1), enfermedad de Parkinson (autosómica recesiva, inicio temprano) 7 (DJ1) y HtrA serina peptidasa 2 (HtrA2, también conocido como OMI), podría tener todos los efectos neuroprotectores contra el desarrollo de la disfunción mitocondrial, aunque el sitio exacto de su acción sigue siendo desconocido. o Parkin también se ha demostrado que inhiben la liberación de citocromo c tras el estrés inducida por ceramida, y está a su vez modificada por la proteína de interacción athanogene BCL2-asociado 5 (BAG5). o La disfunción de las dos vías conduce a estrés oxidativo, lo que hace aún más la disfunción de estas vías mediante mecanismos de retroalimentación y alimentación hacia adelante, en última instancia conduce a daño celular irreversible y muerte. o I-IV, complejos de la cadena de transporte de electrones mitochondial I-IV; alfa-syn (PO 4 ) n , fosfo alfasinucleína; A30P, alanina a la sustitución de prolina en el residuo de aminoácido sinucleína 30; A53T, alanina a posibilidad de sustitución de treonina en residuo sinucleína 53; E 1 , activadora de ubiquitina enzima; E 2 , la ubiquitina conjugación de la enzima; E46K, ácido glutámico a la sustitución de lisina en residuo sinucleína 46; NO, óxido nítrico; 3n / 4n, 3 ó 4 copias de sinucleína; Tau (PO i ) n , Tau (PO i ) n , fosfo-Tau; UCHL1, ubiquitina carboxilo-terminal esterasa L1. • ¿Qué relación existe entre la neuroinflamación y la enfermedad de Parkinson? Explica detalladamente. ▪ la neurotoxicicidad es activada por el sistema reninaagnigotensina (RAS) y los receptores de dopamina. ▪ En el RAS, la angiotensinogeno se converte en Angiotensina I por renina y la A1 se convierte en angiotensin II por la enzima convertidora de angiotensina. ▪ angiotensina II media sus acciones por el receptor AT1 y AT2Rs de angiotensina. ▪ AT1Rs activa la NADPH en donde se produce la mayor cantidad de ROS que puede ocasionar una disfunción mitocondrias y una respuesta inflamatoria. ▪ La interacción de AT1Rs con D1 y D3Rs incrementa la respuesta de dopamina mientras que D5Rs regunla al AT1Rs por mecanismos de proteosomas. ▪ los receptores de dopamina están relacionados con la respuesta inmune de las células T. o microglia -> célula inmune que controla la neuroinflamación o las toxinas ambientales ▪ en este caso las toxinas de parkinson ▪ microglia pueden cambiar a un estado sobre-activado y la liberación de ROS que puede causar neurotoxicidad. o se libera citoquinas pro inflamatorias y el aumento de la producción de ROS -> causa neurotoxicidad y eso causa la activiación de enzimas del sistema NADPH oxidada o neuromelanina -> pigmento oscuro que se reduce a partir de la oxidación de dopamina ▪ neuromelanina interactuarla con el Fe+2 que produce un aumento de ros y hace que haya un o compuesto muy occidente y produce una mayor producción de ROS o metabolismo de catecolaminas -> mayor producción de neuromelanina ->induce la neuroinflamación crónica en la enfermedad de parkinson o parkinson -> disminución de neuronas dopaminergicas ->liberación de neuromelanina -> activación de microglia o parkin -> proteina neuroprotectora que es una ubiquitina ligasa que activa sustancias que degradan la dopamina SEMANA 13 • Supervivencia celular • Apoptosis o la destrucción o muerte celular programada o provocada por el mismo organismo. o Finalidad Autocontrolar su desarrollo y crecimiento, o está desencadenada por señales celulares controladas genéticamente. Hace posible la destrucción de las células dañadas, evitando la aparición del cáncer, consecuencia de una replicación indiscriminada de una célula dañada. o La p53 es supresora tumoral es un factor de transcripción que controla el estado del DNA, e inhibe la progresión del ciclo celular si existe alguna lesión en esta molécula. o La mutación de p53 se asocia al cáncer y a numerosas enfermedades malignas. o necrosis produce inflamación porque se libera el contenido celular, dañando a las otras células, mientras que apoptosis no causa inflamación o dos grupos: ▪ proapoptóticos BAX, BCL-XS, BAK, BAD, BID, BIM, NOXA, PUMA ▪ antiapoptoticos BCL-2, BCL-XL, MCL-1 • Familia de proteínas Bcl-2 o Deriva del la proteína fundadora protooncogen bcl-2 (b-celula linfoma 2) o regulan procesos de permeabilización mitocondrial y constituyen un punto clave en la vía intrínseca de apoptosis celular. o subfamilia Bcl-2 (anti-apoptótica) Bcl-2, Bcl-XL, Bcl-W, MCL-1, BCL2A1, BCL-B. o Subfamilia Bax (pro-apoptótica) Bax, Bak, Bok. o Subfamilia BH3 (pro-apoptótica) Bad, Bid, Bik, Blk, BimL, PUMA, NOXA, BMF, HRK. • Via extrínseca de la apoptosisis o Caspasa 8 corta a BID que es un pro apoptotico y forma tBID (bid truncado) y eso favorece la formación del poro mitocondria a través de BAX/ BAK y la liberación del citocromo c. o Ligando Fas (FasL o Apo-1) proteína de membrana tipo II, miembro de la familia del TNF que se expresa en los linfocitos activados. El Fas se unen a los receptores Fas (receptor de muerte) e inmediatamente se une a la proteína FADD que convierte a la procaspasa-8 en caspasa-8 (caspasa iniciadora). o La caspasa-8 una vez activada, desencadena la activación de otras caspasas, entre las que se incluye la caspasa-3 (caspasa ejecutora). o La caspasa-8 activa la vía apoptótica mitocondrial al activar la proteína Bid, la cual puede promover la salida del citocromo c de la mitocondria y activar la caspasa-9 (caspasa-9 iniciadora) que activa a las caspasas ejecutoras. o FADD (dominio de muerte asociado a Fas). Receptores de muerte (Fas, TNFR1). • Vías apoptoticas o Adaptador intracelular denominado TRADD. La permeabilización de la membrana lisosomal (LMP) induce una proteólisis generalizada. o BH3 (pro-apoptótica) BAD, BID, PUMA, NOXA, NIX. o Bax (pro-apoptótica BAX, BAK, BOK. Factor inductor de la apoptosis (AIF). o Bcl-2 (anti-apoptótica) Bcl-2, Bcl-XL, Bcl-W, MCL-1,BCL2A1, BCL-B. o El citocromo c se une a la Apaf-1 (factor activador de la proteasa apoptótica) para inducir la activación de la caspasa-9 y con ello la cascada de las caspasas, mientras que SMAC/diablo se une y antagoniza al inhibidor de las proteínas apoptóticas (IAP). MOMP (permeabilización de la membrana mitocondrial externa). o caspasa: cisteino porteasas, degradan proteina y en el nucleo degradan ADN o ligando se une a su receptor (y dentro de el se activan dominios de muerte celular (FADD/TRADD) y activan al DISC y activa al procaspasa 8 y lo convierte en caspasa 8 y activa a la caspasa efectoras y desencadenan la muerte celular. o jian quinasa activa al lisosoma y favorece proteolisis generalizada y promueve la muerte celular por o o o o o o o o o o o casposas necrosis es cuando se libera todo el contenido lisosomal las proteinas apototicas alteran el ptencial de membrana mitocondrial formándose un poro formado por BAX/BAK para que se libere citocromo c de la mitocondira y se forma el apoptosomoa (molecula formada por citocromo c, APAF1 (factor apoptotico 1) y procaspasa 9) y activa a caspasa 9 y activa a casapasa 3,6,7 y degradan proteínas y ADN que conlleva a la muerte celular. Ligando de muerte celular: TNF y FAS Caspasa 9: caspasa iniciadora daño celular activa la p53 y activa la caspasa 2 y forma l os poros y con lleva a la translocacion nuclear que aumenta ROS y daño de ADN Intrinsico ▪ Un daño en la mitocondria produce una expresión de MOMP (alteración del potencial de membrana mitocondrial) y se va a liberar proteínas pro-apoptoticas de la mitocondria como citocromo c, SMAC, EndoG, AIF que estimulan la apoptosis ▪ Este se caracteriza por un evento central - mitocondrial permeabilización de la membrana exterior (MOMP) - lo que resulta en la liberación de citocromo c desde el espacio intermembrana mitocondrial Citosólica de citocromo c a continuación, activa el ensamblaje de un complejo caspasa-activación de la caspasa entre 9 y apoptótica factor de la proteasa activadora 1 (APAF1; apoptosoma). MOMP puede ser desencadenada por la activación de las proteínas BH3-sólo después de su movilización de otros compartimentos subcelulares y su modificación post-traduccional (tales como fosforilación o proteólisis) o la regulación positiva de la transcripción (por ejemplo, en respuesta a la activación p53). BH3-only proteínas generalmente estimular MOMP mediante la inducción de la oligomerización de asociada a BCL-2 proteína X (BAX) y / o Bcl-2 antagonista o killer (BAK) en la membrana mitocondrial externa, formando de este modo canales supramoleculares que median la liberación de soluble proteínas de la intermembrana mitocondrial espacio. Daño del ADN puede estimular la transactivación de genes que codifican las proteínas pro-apoptóticas (tales como los BH3-sólo las proteínas p53 modulador upregulated de apoptosis (PUMA) y NOXA) por p53, o activar la caspasa 2 de una manera dependiente de p53. La caspasa 2 puede entonces inducir MOMP y / o activar otras caspasas, como la caspasa 3, directamente. Entre las proteínas mitocondriales que se liberan como resultado de MOMP, factor inductor de apoptosis (AIF) y endonucleasa G (EndoG) puede promover la muerte celular independiente de caspasas, que también pueden resultar de los estímulos que causan la permeabilización de la membrana lisosomal (LMP) para liberar proteasas catepsina en el citosol. Catepsinas también pueden desencadenar MOMP, estimulando así la vía apoptótica intrínseca Extrinsico ▪ ligando se une a su receptor (y dentro de el se activan dominios de muerte celular (FADD/TRADD) y activan al DISC y activa al procaspasa 8 y lo convierte en caspasa 8 y promueve la apoptosis ▪ Esto ocurre en respuesta a la ligadura de los denominados receptores de muerte, que son CD95 (también conocido como FAS), factor de necrosis tumoral receptor 1 (TNFR1; ver la figura, parte una ) o receptor de ligando inductor de apoptosis relacionado con TNF (TRAILR ). Esto da como resultado el reclutamiento de varias proteínas, incluyendo dominio de muerte asociado a Fas (FADD), dominio de muerte de TNFR1-asociado (TRADD) y la caspasa 8. Activado caspasa 8 entonces activa proteolíticamente caspasas efectoras aguas abajo o trunca la BH3 (BCL-2 homología 3 ) -sólo BID proteína (BH3-interactuando agonista de la muerte de dominio), que co-activa la vía intrínseca de la apoptosis por translocación a la mitocondria. Anoikis ▪ Muerte celular por aislamiento de la celula ▪ La celula se ailsa, y produce una falla en la señalización de FAK Autofagosomas ▪ Da el autofagosoma actua como un activador de caspasa 8. Estimula la conversión de caspasa 8 inactiva a casapasa 8 activa para promover la apotosis ▪ Db necrosis regulado ▪ Esto se refiere a menudo como 'necroptosis' y es un proceso independiente de caspasas que implica una serie de otras moléculas efectoras, incluyendo la proteína interacciona con el receptor 1 (RIP1) y quinasas RIP3 catástrofe mitótica Esto constituye un mecanismo de onco-supresor que se inicia por la interrupción del aparato mitótico durante la fase M del ciclo celular, que es precedido por un cierto grado de detención de la mitosis y eventualmente causa la muerte celular o senescencia o la muerte celular por autofagia ▪ Otra modalidad de la muerte celular que, por definición, no implica moléculas efectoras apoptóticas o necróticas, o se produce durante la mitosis ▪ BAD, BCL-2 antagonista de la muerte celular; DISCO, induce a la muerte complejo de señalización; JNK, quinasa Jun N-terminal; NIX, NIP3 proteína similar a X; ROS, especies reactivas de oxígeno. o Funciones letales de proteínas ATG o Caspasa dependiente o Caspasa independiente • Integración de multeples vías de señalización que regulan la permeabilidad de la membrana mitocondrial externa y apoptosis o cuando se libera un factor de crecimiento se une a su receptor el cual es una tirosina quinasa se activa una vía de señalización. PI3K y PKB inhiben a un pro apoptotico (BAD) fosforilandolo 2 veces utilizando 2 ATPs. y en la mitocondria BAD inhibe a los antiapoptoticos (BCL2 y BCLxL) el cual inhibe BAK y BAK porque no dejan que se forme el poro mitocondria. o si no hay factor, no hay una vía de señalización que inhibe a BAD y ese induce la apoptosis. o Bim esta anclado en el citoesqueleto, pero en una célula que morirá, el cito esqueleto libera al bim y el bim se va a la mitocondria para activar a BAK y BAX y activan el poro mitocondria y conlleva a la muerte celular. o puma detecta un daño en el ADN y se libera del núcleo y se va a la mitocondria y activa BAK y BAX y activan el poro mitochondrial y conlleva a la muerte celular. o Daño del ADN genera BH3 (pro-apoptótica) PUMA,NOXA que expresa Bax (pro-apoptótica) BAX, BAK. o 3. Factor trófico se une al receptor que genera PKB que fosforila al BAD inhibiendo su actividad. o El BAD inhibe a la Bcl-2 (anti-apoptótica): Bcl-2, Bcl-XL, Bcl-W, MCL-1,BCL2A1, BCL-B. • Proteínas que participan en el control del crecimiento celular y proliferación o Activadores de receptores de señals codificiado por virus o Moléculas de señalizacioon o Receptor de la señal o Transductor intracelular o Receptor intraceluar o Factores de transcripocion o Protienas de reparación de ADN o Protienas de control del ciclo celular o Proteínas apoptotitcas • Genes, mutaciones y cáncer Función Ejemplos de productos Efecto de la Propiedad Origen de la normal de los génicos mutación genética del mutación genes gen mutante protooncogen Promueven la Proteínas antiapoptóticas Mutaciones de mutaciones Surgen por supervivencia componentes de vías de ganancia de son mutación celular de las señalización y de función permiten genéticamente puntal, células o la transducción de señales la proliferación y dominantes translocación proliferación que resultan en la supervivencia cromosómica, proliferación, factores de celular no amplificación transcripción reguladas Gen supresor Inhiben la Proteínas que promueven Mutaciones de Mutaciones Surgen por de tumores supervivencia la apoptosis, inhibidores perdida de son deleción, celular de la de la progresión del ciclo función permiten genéticamente mutación célula o la celular, proteína de la proliferación y recesivas puntual, proliferación control de los puntos de supervivencia metilación control que evalúan el celular no daño del ADN o reguladas cromosómico, componente de vías de señalización que limitan la proliferación celular ▪ Genes cuidadores • • • • • • Reparan o previenen el daño en el ADN Enzimas de reparación del ADN Mutaciones de perdida de función permiten que las mutaciones se acumulen Mutaciones son genéticamente recesivas Surgen por deleción, mutación puntual, metilación Detección de g1 en respuesta a daño en el ADN o El ADN dañado libera al ATM que activa a la molécula p53 y ChK2. o ChK2 fosforila a la Cdc25A, proteína que defosforila tirosinas. o Cdc25A promueve la degradación por el proteosoma, lo que impide la activación del complejo ciclina ECdk2, provocando una parada en la iniciación y progresión de la replicación del ADN. o Cdc25A en células no irradiadas, defosforila Cdk2 para promover la transición de G1 a S. o La fosforilación de p53 perturba su interacción con la ligasa E3 de ubiquitina-Mdm2, lo que impide la ubiquitinación y degradación de p53. o La comprensión de cuál es la señal que emana de las lesiones en el ADN y cómo afecta a las numerosas rutas celulares implicadas se ha obtenido estudiando la respuesta a las roturas de doble hebra (DSBs, por Double Strand Breaks), que está conservada desde levaduras hasta humanos. Proteínas kinasas asociadas: o ATM (Ataxia-telangiectasia Mutated, el gen mutado en esta enfermedad humana) ATR (ATM- and Rad3Related). Producción de energía en células cancerosas por glucolisis aerobica o La glucosa vía glucolisis anaeróbica genera ácido láctico + ATP a una mayor velocidad. o Mientras que la glucolisis aerobia esta disminuida. o Mediante la angiogénesis (proceso de formación de vasos sanguíneos normal y en el cáncer) provee nutrientes al tumor, pero no oxigeno, ya que hay disminución de eritrocitos. o El ácido láctico y el sodio sale de la célula tumoral a través del transportador MCT1. o célula tumoral: exceso de glucosa medio acido poco o2, mucho Na o en una célula tumoral, la glucolisis anaeróbico es 200 veces más rápido que una célula normal o tejido diferenciado ▪ con o2 piruato mitocondria fosforilacion oxidativa (-36 moles de ATP/mol de glucosa) ▪ sin o2 piruvato lactato glucolisis anaerobica (2 moles de ATP/mol de glucosa) o tejido proliferante + tumor (con/sin o2) ▪ glucosa piruvatato lactato (glucolisis anaeróbica (efecto warburg)) (-4 moles de ATP/mol de glucosa) Cáncer y alteraciones de las vías reguladoras del crecimenteo o Receptor del factor de crecimiento epidérmico (EGFR, ErbB-1o HER1) miembros de la familia del factor de crecimiento epidérmico. o Las mutaciones que afectan a la expresión o actividad del EGFR pueden provocar cáncer. ErbB (glioblastomas, cervical y mama). o protooncogenes genes cuyos productos promueven el crecimiento y la división de la célula. Codifican factores de transcripción que estimulan la expresión de otros genes, moléculas de transducción de señales que estimulan la división celular y reguladores del ciclo celular, que hacen que la célula progrese a través de este ciclo. Efecto de la perdida de la selalizacion por el TGF-beta o el factor de crecimiento transformante beta 1 (TGF- β1ó TGFB1) es una proteína perteneciente a la superfamilia de factores de crecimiento transformante beta de las citocinas. o Controla el crecimiento celular, la proliferación celular, los procesos de diferenciación y apoptosis. Cáncer: o proliferación de células de manera descontrolada sin regulación en el ciclo celular y conlleva a la muerte celular. un grupo de mas de 100 enfermedades desconocidas Desarrollo y metastasisi del cáncer colorectal o Se forma un pópilo (crecimiento pequeño) en la pared del colon o Crece un tomor benigno precanceroso o Crece un adenona clase II (benigno) o Crece un adenona clase III (benigno) o Se desarolla un carinoma maligno o El cáncer hace metástasis (se disemina a otros tejidos) Celula de colon normal perdida del gen supresor de tumores APC (cromosoma 5) activación del oncogen K-ras (cromosoma 12) perdida del gen supresor de tumores p53 (cromosoma 17 otros cambios o Células tumorales invaden los vasos sanguneos lo que permite que se produzca una metástasis Metástasis o invasión del carcinoma hacia los otros tejidos por invasión del vaso sanguíneo. Diabetes mellitus o diabetes mellitus tipo 2: alteración de genes, pero no se desarrolla, sino puede ser a través de efectos ambientales como la malnutrición o Consumo exceso de carbohidratos hiperinsulinismo resistencia a la insulina resistencia a las insulinas en las células beta estrés pancreático disfunción de las células beta niveles aumentados de glucosa y acidos grasos libres diabetes mellitus tipo 2 El papel de los lípidos hepáticos en la resistencia hepática a la insulina y la diabetes tipo 2 o El aumento de la DAG del hígado causa la activación de PKC y su translocación a la membrana celular, lo que resulta en la inhibición de la señalización de la insulina. La fosforilación reducida del sustrato receptor de insulina 2 (IRS2) y PI(3)K reduce la actividad Akt2 por la reducción en la actividad de PDK1, la supresión por fosforilación de la glucógeno sintasa cinasa 3 (GSK3) y la reducción de la síntesis de glucógeno hepático estimulado mediante la reducción de la actividad de la glucógeno sintasa (GS). o La actividad Akt2 dañada produce el aumento de gluconeogénesis hepática mediante la promoción de FOXO1 al núcleo debido a la fosforilación e incremento de expresión de las proteínas gluconeogénicos piruvato carboxilasa (PC), fosfoenolpiruvato carboxiquinasa (PEPCK), glucosa- 6-fosfatasa (G6Pasa), PIP3. Diabetes mellitus o Estrés del RE ▪ Es un desbalance entre la capacidad de plegamiento proteico del RE y la demanda de síntesis proteica, resultando en la acumulación de proteínas mal plegadas. o Niveles excesivos de glucosa conducen a la producción elevada de insulina en las células β. o El exceso de insulina genera estrés del RE, liberando y acumulando proteínas mal plegadas o no plegadas (UP), debido a cambios en la disponibilidad del Ca+2, ATP, o2 y agentes patógenos. o Luego se activa un programa celular de respuesta a UP (UPR) para mejorar el error, el cual incluye: Transcripción de chaperonas (proteínas que atrapan a las UP), reducción de la síntesis de nuevas proteínas y activación de la degradación de las UP en los proteosomas. o RE en estrés prolongado conduce a la apoptosis y la liberación de citocinas como la IL-1 y TNF-α que activa NF-kB que promueve agentes pro-apoptóticos (Subfamilia BH3 PUMA) y disminuyen agentes antiapoptóticos (Subfamilia Bcl-2 (Bcl-2, MCL-1). Estos cambios en la expresión génica favorecen a los agentes pro-apoptóticos (Subfamilia Bax: Bax, Bak, Bok) que generan permeabilización de la membrana mitocondrial externa ( MOMP ), liberando Cyt c que induce a la apoptosis de la célula pancreática β. Además el NF-kB activa a la óxido nítrico sintasa (iNOS) que provoca estrés del RE y apoptosis. o Lipotoxicidad promovido por ácidos grasos no esterificados (NEFAS) también conduce a estrés células β. Diabetes melitus y biomarcadores o A1C ≥6,5%. El análisis se debe realizar en un laboratorio con un método cerHficado por el NGSP y uniformado con el análisis del DCCT.* o Glucosa en ayunas (GA) ≥126 mg/dl (7,0 mmol/l).* o Glucosa plasmática (GP) a las 2 h ≥200 mg/dl (11,1 mmol/l) durante una prueba de tolerancia a la glucosa oral (PTGO). El análisis debe efectuarse como lo describe la Organización Mundial de la Salud, con una carga de glucosa que contiene el equivalente a 75 g de glucosa anhidra disueltos en agua.* o En un paciente con síntomas clásicos de hiperglucemia o una crisis hiperglucémica, una GP al azar ≥200 mg/dl (11,1 mmol/l). o *Si no hay hiperglucemia inequívoca, los resultados se deben confirmar repitiendo el análisis otro día. Biomarcadores de síndrome metabólico o • • • • • • PORTAFOLIO Y DPG – RESISTENCIA A LA INSULINA: • ¿Qué procesos bioquímicos y moleculares ocurren cuando la insulina se acopla a sus receptores en el músculo y tejido adiposo? ¿cuál es la finalidad de éste proceso? o En el tejido muscular: ▪ Estimula la entrada de glucosa (por translocación de los GLUT 4 hacia la membrana). ▪ Aumenta la glucólisis por es mulación de la fosfofructocinasa I y dela piruvatocinasa. ▪ Estimula la síntesis de glucógeno al es mular la actividad de la GS. ▪ Favorece la entrada de aminoácidos a la célula y su incorporación alas proteínas, estimula la síntesis e inhibe el catabolismo de proteínas. ▪ Estimula la captación y utilización de los cuerpos cetónicos. ▪ La insulina es mula la bomba Na+/K+, lo que favorece la entrada de K+ a las células. o En el tejido adiposo: ▪ Estimula la captación (GLUT 4) y utilización de glucosa por el adipocito. ▪ Aumenta la vía de las pentosas que aporta NADPH al es mular a laglucosa-6-fosfato deshidrogenasa. ▪ Favorece la captación de ácidos grasos al estimular a la enzima li-poproteínalipasa 1, que degrada los triglicéridos contenidos en laslipoproteínas. ▪ Estimula la síntesis de triglicéridos (al promover la glucólisis y la vía de las pentosas) e inhibe los procesos de lipólisis, por lo que se favo-rece la acumulación de éstos en los adipocitos. • Diferencia cada uno de ellos, explica y esquematiza . o insulina ▪ La insulina es una hormona anabólica importante que se sintetiza en los islotes de Langerhans en las celulas beta del pancreas y desempeña un papel esencial en la homeostasis de la glucosa mediante la regulación del equilibrio entre la producción de glucosa hepática y la absorción de glucosa por el músculo y el tejido adiposo, los dos sitios principales de la captación de glucosa en el hombre. o receptor de insulina ▪ el receptor de insulina (IR) es una glicoproteína que pertenece a la familia de tirosina quinasas las cuales se autofosforilan. El IR contiene 4 subunidades, 2 alfas, y 2 betas. las subunidades alfas se encuentran en el exterior de la membrana plasmática y contiene el sitio de unión con la insulina. las subunidades beta tienen una parte extracelular y una parte intracelular que contiene actividad tirosina cinasa que se autofosforila. o mecanismo molecular de la insulina en el músculo y en el tejido adiposo: ▪ Cuando la insulina se une a su receptor, éste desencadena múltiples vías de señalización, incluyendo la translocación de transportadores GLUT hacia la membrana, para el ingreso de glucosa a la célula. ▪ La unión de la insulina al receptor de insulina causa activación de una proteincinasa, la tirosina quinasa con la consecuente autofosforilación de los residuos de tirosina específica del receptor. Una vez que el receptor está activado se favorece la fosforilación de los residuos de tirosina de los sustratos de proteína. Las 2 vías de señalización intracelular son la fosfatidilinositol 3 quinasa (P1-3K) y la vía de proteína mitogénica activada quinasa (MAP-Quinasa). ▪ La vía de la P13K se inicia por la fosforilación de la tirosina del sustrato de receptor de insulinas 1-4, (ISR-l-4) los cuales una vez fosforilados se asocian con la P85, una subunidad regulatoria de la P13K. ▪ La P13K activada compuesta con las subunidades P85 y P110 producen fosfatidilinositol 3, 4, 5, fosfato (PIP3) por fosforilación de fosfatidilinositol-4,5-bisfosfato (PIP2). . Los niveles elevados de PIP3 resultan en la activación de AKT (efector molecular) que media los efectos de la insulina y que incluyen: • 1) la translocación de Glut-4 a la superficie de la célula para la utilización de la glucosa, • 2) la activación de la enzima sintasa constitutiva del óxido nítrico (eNos) que conduce a la síntesis del óxido nítrico por el endotelio y el cual favorece la vasodilatación de los vasos • 3) la regulación de la síntesis proteica, de glucógeno y la acción antilipolítica a nivel del tejido adiposo. ▪ a) Vía de señalización de las MAP cinasas. • Los efectos de la insulina en la regulación de la síntesis de proteínas son mediados principalmente a través de la activación de la vía deseñalización de las MAP cinasas (Fig.2). • La fosforilación en residuos de Tyr del dominio citoplasmático del IR, promueve la asociación de la proteína Shc, la cual une al complejo Grb2/SOS; SOS es un factor recambiadorde nucleótidos de guanina (GEF),capaz de activar a Ras. • La activación de Ras (GTP-Ras) inicia el encendido de la cascada de las MAP cinasas. • GTP-Ras se une y activa a Raf-1 que subsecuentemente lleva a la fosforilación y activación de la vía,que involucra el reclutamiento y activación de MEK (también llamada cinasa de MAP cinasa) y de las ERK1 (cinasa regulada extracelularmente 1)y ERK2. • Alternativamente a esta víade señalización que lleva a la activación de las ERK1 y ERK2 (conocidas genéricamente como MAPcinasas), la insulina es capaz de activara estas proteínas por una víaindependiente de Shc, pero quedepende de la activación del IRS (sustrato del receptor de insulina). • Una vez activo IRS, une al complejo Grb2/SOS y a partir de este punto lasecuencia de activación de proteínases la misma que se describió para Shc(Fig. 2). • Las MAP cinasas tienen una amplia gama de sustratos potenciales, incluyendo factores de transcripción y otras cinasas, que participan principalmente en la regulación de la expresión genética en tejidos sensiblesa la insulina pero no en la regulación del transporte de glucosa o Figura 2. Activación de la vía de las MAPK por acción de la insulina. o La insulina activa la víade las MAPK a través de dos mecanismos: en el primero, la activación del IR promueve laasociación de la proteína Shc, la cual une al complejo Grb2/SOS; SOS activa a Ras, la cualinicia el encendido de la cascada de las MAPK. o GTP-Ras une y activa a Raf-1 que subsecuentemente lleva a la fosforilación y activación de MEK y de las ERK1/2. o Alternativamente existe una vía independiente de Shc pero dependiente de la activación del IRS por la que lainsulina es capaz de activar a las MAPKs. o En esta, una vez activo IRS, une al complejo Grb2/SOS y apartir de este punto la secuencia de activación de proteínas es la misma que se describió para Shc. • ¿Qué procesos bioquímicos y molecular esocurren cuando la insulina se acopla a sus receptores en el hígado? o La insulina, a su llegada al hepatocito, se une y activa el receptor tirosinacinasa de la insulina (RTKI), el cual promueve la fosforilación del sustrato del receptor de la insulina (SRI), siendo el SRI2 el másimportante a nivel hepático. o La fosforilación de SRI2 genera sitios de unión para la quinasa fosfatidilinositol 3 -PI(3)K-. o La uniónde PI(3)K a SRI2 convierte el lípido de membrana fosfatidilinositol 4,5-bifosfato (PIP2) en fosfatidilinositol 3,4,5-trifosfato (PIP3)que, a su vez, recluta Akt2. o Bajo condiciones de estímulo de insulina, la proteína cinasa D (PDK1) es fosforilada y activa Akt2, queparece suprimir la producción hepática de glucosa mediante 2 mecanismos principales: ▪ primero, la disminución de la expresiónde las enzimas gluconeogénicas mediante la fosforilación y la exclusión nuclear de la proteína FOXO1, que inhibe la activación de la expresión de proteínas gluconeogénicas como la glucosa-6 fosfatasa (G6Pasa) y la fosfoenolpiruvato carboxiquinasa (PEPCK),dando lugar a la supresión de la gluconeogénesis hepática; ▪ segundo, el aumento de la actividad de la glucógeno sintasa (GS) mediante la fosforilación e inactivación de la quinasa glucógeno sintasa 3 (GSK3). En su forma inactiva (fosforilada), GSK3 nocataliza la fosforilación e inactivación de la GS, permitiendo así la síntesis de glucógeno hepática. • ¿cuál es la finalidad de éste proceso? o En el hígado: ▪ Incrementa la actividad y es mula la síntesis de la glucocinasa, favoreciendo la utilización de la glucosa. ▪ Aumenta la vía de las pentosas que aporta NADPH al estimular a la Glucosa-6-fosfato deshidrogenasa. ▪ Aumenta la glucólisis por estimulación de la glucocinasa, fosfofructocinasa I y de la piruvatocinasa. ▪ Favorece la síntesis de glucógeno, es mulando la actividad de la glu-cógeno sintetasa (GS). ▪ Reduce la gluconeogénesis, al disminuir principalmente la síntesis de la fosfo-enol-piruvato-carboxicinasa (PEPCK). ▪ Estimula la síntesis de proteínas. ▪ Aumenta la síntesis de lípidos, al es mular la actividad de la ATPcitrato liasa, acetil-CoA-carboxilasa, “enzima málica” y de la hidroxi-metil-glutaril-CoA reductasa. ▪ Inhibe la formación de cuerpos cetónicos. • Qué procesos bioquímicos y moleculares están ocurriendo en el paciente? Esplique y esquematice detalladamente. o imc -> 32,6 kg/ dl -> elevado o presión arterial -> 154/96 mmHg -> elevado o glicemia -> 178 mg/dL -> hiperglicemia o colesterol -> 162 mg/dL o HDL -> 53 mg/dL -> elevado o LDL -> 84 mg/dL -> o triglicéridos -> 177 mg/dL -> elevado o el paciente presenta sindrome metabolico con resistencia a la insulina: o La insulina se libera en la vasculatura por las células β en respuesta a niveles elevados de glucosa en la sangre, después de la ingestión de alimentos. o La insulina provoca sus efectos anabólicos mediante la asociación con el IR transmembranal, presente en los tejidos diana. o Estos receptores clave ligados a la membrana están presentes en las células que almacenan el exceso de carbohidratos en forma de glucógeno (hígado y músculo) o como triacilglicerol (tejido adiposo). o El IR se compone de cuatro subunidades peptídicas (dos subunidades de la cadena α y dos subunidades de la cadena β) y es un receptor de tirosina quinasa heterotetramérica. ▪ La interacción con la insulina induce la autofosforilación del receptor en los residuos de tirosina (Tyr1158, Tyr1162 y Tyr1163) y esto inicia el reclutamiento y la fosforilación de las proteínas adaptadoras intracelulares (IRS). Se han descrito trece isoformas IRS diferentes, pero las isoformas 1 y 2 se han estudiado extensamente, ya que están ampliamente distribuidas entre diferentes tipos de células y se activan principalmente en el músculo esquelético, que es responsable de aproximadamente el 75% de la glucosa en sangre estimulada por la captación de insulina en el cuerpo. o El IRS1 fosforilados, en menor medida IRS2, induce la activación de la quinasa lipídica PI3K por unión con la subunidad reguladora p85 de PI3K. La PI3K activada convierte el 3,4-bisfosfato de fosfatidilinositol (PIP2) en fosfatidilinositol 3,4,5 trifosfato (PIP3), a través de la subunidad catalítica p110. o Esta conversión activa la proteína quinasa 1 dependiente de 3-fosfoinositidos (PDK1) que posteriormente recluta y fosforila la proteína quinasa B (pAkt) en la membrana plasmática. o PDK1 también puede activar atípica proteína quinasa C (aPKC), que también regula el metabolismo de la glucosa. Aguas abajo de estas interacciones, pAkt tiene más de 100 sustratos que regulan muchos procesos celulares, incluyendo la proliferación celular, la diferenciación, la endocitosis, la supervivencia, y la homeostasis de la glucosa. o Existen tres isoformas de Akt, y Akt2 es reconocido como el más abundante en los tejidos sensibles a la insulina. Curiosamente, cuando Akt2 fue eliminado en knockout ratones, el aumento de la resistencia a la insulina se observó que ilustra el importante papel fisiológico desempeñado por Akt2 en la mediación de la glucosa homeostasis. o Mecanicamente, Akt es un importante regulador de la translocación de las vesículas GLUT4 a la membrana plasmática, que es crítico para la captación intracelular de glucosa libre en los tejidos sensibles a la insulina. o La señalización apropiada de insulina puede ser interrumpida debido a alteraciones genéticas o cambios físicos a cualquiera de los nodos de señalización antes mencionados, y esto puede manifestarse como resistencia a la insulina. Mutaciones y serina hiperfosforilación de las proteínas del IRS se asocian especialmente con el desarrollo de resistencia a la insulina, ya que se cree que disminuyen la interacción del IRS con PI3K. o Anteriormente, la interrupción homozigótica de la transcripción IRS1 llevó a la resistencia a la insulina leve , mientras que IRS2-knockout ratones mostró severa resistencia a la insulina. o Además, en pacientes con DM2 se cree que muchas sustituciones precisas de aminoácidos en las proteínas IRS1 alteran la función de la proteína, pero algunas de estas sustituciones han sido controvertidas. o Por ejemplo, los investigadores han informado de que Gly972Arg es un polimorfismo común en pacientes con DM2, pero otros no han podido observar resultados similares en otras poblaciones de DM2. o Además, se sugirió que la hiperfosforilación de serina en los residuos Ser302, Ser307, Ser612 y Ser632 en IRS1 era responsable del aumento de la resistencia a la insulina en modelos animales. o De hecho, la síntesis y secreción de citoquinas proinflamatorias no controladas y la activación de la activación de proteínas de señalización proinflamatorias, tales como el factor de necrosis tumoral alfa (TNFα) y la isoforma 1 de la proteína quinasa N-terminal c-Jun (JNK1) en respuesta al tejido adiposo Expansión, puede inducir serina hyperphosphorylation en IRS1, especialmente en el residuo Ser636 (Figura 1]. o Sin embargo, no se conoce completamente qué residuos de serina específicos o combinación de los mismos requieren hiperfosforilación para provocar el fenotipo resistente a la insulina, ya que se ha demostrado una fosforilación excesiva en Ser337 y Ser636 en muestras de músculo de pacientes con síndrome metabólico, pero no en Ser307, Ser789, O Ser1101 según lo informado por otros. o Además, la hiperfosforilación de la serina en el residuo Ser312 marca IRS1 / 2 para la degradación, que amortigua el relé de señalización mediado por IR. o En conjunto, estos datos demuestran la complejidad del papel desempeñado por las proteínas IRS, pero también su importancia en la modulación de la resistencia a la insulina. • Diabetes mellitus y inflamación de células beta o La función principal de la célula β pancreática es acoplar la detección de nutrientes y el metabolismo posterior a la liberación de insulina. o Por lo tanto, la exposición aguda de las células β a nutrientes, como glucosa, lípidos y algunos aminoácidos, promueve la secreción de insulina. o Sin embargo, la exposición incesante a la glucosa elevada y los lípidos se sabe que tienen efectos perjudiciales sobre la secreción de insulina de las células β pancreáticas y se correlaciona con el inicio de la resistencia a la insulina en la periferia . o Estos niveles elevados de nutrientes pueden dar lugar inicialmente a un aumento del metabolismo de las células β y la subsiguiente hiperinsulinemia, pero la exposición crónica induce un estrés oxidativo que puede causar disfunción de las células β e incluso la muerte de las células β. o En consecuencia, la disminución de la producción de insulina de este proceso debido a la muerte de las células β-glucolipotoxicity muerte e inicia el círculo vicioso deletéreo observado en T2DM (Figura 2]. o Figura 2: disfunción de las células β en la diabetes. ▪ Los niveles excesivos de glucosa conducen a una alta producción de insulina en las células β. ▪ El aumento de la síntesis de insulina promueve la sobrecarga del retículo endoplasmático (ER), la respuesta de la proteína no desarrollada (UPR) y el estrés de la ER. ▪ El estrés prolongado de ER conduce a la apoptosis ya la liberación de IL-1β mediante la activación del inflamasoma. ▪ Las citoquinas proinflamatorias locales inducen la activación de NFκB que promueve los cambios proapoptóticos en la expresión génica. ▪ Estos cambios en la expresión génica favorecen la oligomerización Bax / Bak y la permeabilización de la membrana externa mitocondrial (MOMP), llevando consecuentemente a la apoptosis. ▪ Además, la activación de iNOS dependiente de NFκB desencadena el estrés de ER y la apoptosis también. ▪ La lipotoxicidad promovida por NEFA también conduce al estrés de las células β-ER a través de diferentes mecanismos, incluyendo especies reactivas de oxígeno y nitrógeno (ROS / RNS), depleción de calcio (Ca2 +) y ER a Golgi. SEMANA 14 • acetilcolina o Se sintetiza en el citosol a partir de acetil coenzima A (intermediario en la degradación de glucosa y ácidos grasos) y colina. o Acetil coA + colina acetilcolina ▪ Acetilcolinisterasa ▪ Libera CoA-SH • formación de la unión neuromuscular o El axón libera agrina (proteoglicano) que inicia una reacción en cadena que finalmente conduce a la asociación de la AChR. La agrina se une a un receptor quinasa muscular específico (receptor esquelético muscular tirosina quinasa) en la membrana post-sináptica, y esto a su vez conduce a la activación de la proteína citoplasmática rapsina. o La agrina (proteoglicano) se une a un receptor esquelético muscular tirosina quinasa en la membrana postsináptica, activando a la proteína MuSK las que activa a la Dok -7 y RapSyn, para inducir la agrupación " de los receptores de acetilcolina ( RACh). o La rapsina contiene los dominios que permiten la asociación y multimerización del AChR. El nervio termina en la placa de extremo , formando la unión neuromuscular - una estructura requerida para transmitir los impulsos nerviosos en el músculo, y iniciando así la contracción muscular. • acetilcolina y oxido nítrico • unión neuronmuscular por acetilcolina o neurona tiene neurotransmisora acetilcolina y se une a su receptor colinérgico muscarimico, abre el canal na/k y favorece el ingreso de sodio a la célula muscular mientras que sale potasio. luego por tener mucho sodio en la célula muscular se abre otro canal de sodio e ingresa más sodio. por el ingreso de más sodio se abre el canal de ca+2 regulado por voltaje y además se libera el canal de calcio del retículo sarcoplasmático para ser liberado de la célula muscular para la contracción muscular. • noradrenalina • anticuerpos monoclonales • síntesis y secreción de t3 y t4 o hipotálamo libera homona liberadora de tirotropina (TRH) que estimula a la glándula pituitaria el cual estimula la TSH (hormona estimuladora de tirotropina) y estimula a la tiroides para la sintesis de la T3 y T4 1. TSH activa cAMP 2. entra la glucosa 3. glucosa vía pentosa fosfato genera NADPH genera H2O2 o • • • • • • • 4. peroxidasa transforma h2o2 a o2 5. ingresa yodo 6. tiroglobulina se sintetiza en el RE rugoso y se libera por exocitosis 7. tiroglobulina se une con el yodo por union de cargas 8. TG y yodo forman DIT y MIT 9. DIT y MIT se unen y forman T3 10. DIT y DIT se unen y forman T4 11. t3 y t4 ingresan a la celula con la tiroglobulina por fagocitosis 12. se une un lisosoma y degrada a la tiroglobulina y libera t3 y t4 13. t3 y t4 se van al torrente sanguíneo para su uso mecanismo molecular de t3 y t4 o t3 es el receptor de T3 o t3 implicado en la apoptosis por FAS en mínima cantidad o en el tejido adiposo se favorece la actividad de t3 y activa la termogenina (encargada de dar calor en tejido adiposo) o t3 estimula lipolisis y disminuye grasa corporal en el adiosito o en el hígado se estimula el LDL y el HOMGCR en sintesis de colesterol y estimula sintesis de sal bilear o a nivel muscular favorece el repartimiento de tejido o a nivel del pancreas estimula la liberación de insulina y la maduración de las células beta y el crecimiento y funcionamiento del páncreas o t3 y t4 activa vía de map quinasas sa o t3 activa p30 para estimular la oxido nitrico sintasa o la t3 y t3 estimula bomba sodio potasio ATPa hipertiroidismo o exceso de hormona tiroidea (hipertiroidismo) o constipación o incremento de presion arterial o ojo bien abierto o debilidad de huesos o mal desarrollo cognitivo hipotiroidismo o bradicardia o constipación o debilidad de los huesos o mal desarrollo cognitivo mecanismo no genómico de t3 y t4 mecanismo genómico de t3 y t4 o libera corepresores y ayuda a que se unan los coactivadores para que se una la ARN polimerassa vih mecanismo molecular o 2 factores fundamentales: ▪ carga viral (cantidad de virus suficiente para invadir) ▪ disminución del sistema inmunologico o invade a linfocitos t cd4 positivos. el virus tiene ARN con proteína gp120 el cual se une a cd4 (proteína de membrana) y luego se une ccr5 y cxcr4 para unirse al linfocito y cuando libera su contenido (ARN) y el material genético del huésped es ADN- el virus tiene transcriptas a reversa y transforma ARN a ADN y por una integrada se une al núcleo y se sintetiza proteínas virales y luego se dirige al la membrana y se exocitosis y utiliza las proteasas para liberar el virus maduro. o el virus se libera por el semen y atraviesan las células epiteliales de la vagina y se van a la submucosa epitelial y las células de Langerhans detienen el ingreso del VIH, pero si ingresa el virus atravesando la pared de células epiteliales y activa a la célula dendrítica (primera barrera) y avisa a la célula t el cual manda la orden a la tcd4. y si hay mucho virus la célula t se infecta con el virus y la celular detrítica trata de degradarlo y lo infecta y luego las células b ( que forman anticuerpos) engloban los virus y las cd4 infectadas para formar un centro germinal vih tratamiento o targa: terapia retroantiviral de gran actividad PORTAFOLIO HORMONAS TIROIDEAS 1.-¿Qué procesos bioquímicos y moleculares permiten la síntesis de hormonas tiroideas? Explica y esquematiza. • La tiroides es una glándula que pertenece al sistema endocrino cuya función consiste en producir la cantidad necesaria de hormonas tiroideas para satisfacer la demanda de los tejidos periféricos. • Las hormonas tiroideas desempeñan un papel fundamental en el crecimiento somatico y regulan numerosos procesos metabólicos. • La síntesis de hormonas tiroideas requiere de una glándula tiroidea desarrollada normlmente, un aporte nuticional de yodo adecuado y una serie de reacciones biouimicas secuenciales, complejas, procesos controlados por el sistema regulador hipotalamo-hiofisario y por la propia autorregulación tiroides. • Las numerosas funciones ejecidas por las hormonas tiroideas en practica con diferentes receptores, proteinas correguladoras y otras proteinas asociadas a receptores nucleares. • Los componentes esenciales del sistema regulador de la función tiroidea lo constituye la hormona hipotalámica liberadora de tirotropina (TRH) la tirotropina y hormona hipofisaria estimulante de tiroides (TSH) y la triyodo tironina (T3). La TRH y la TSH ejerce un efecto estimulador, mientras que la T3 ejerce un efecto inhibidor. La tiroxina (T4) procedente de la glándula tiroides pasa al plasma y debe desarrollarse a T3, la que interactúa con el receptor nucler de la célula tirotropa hipofisaria. • -La captación de yoduro es un prmer paso crucial para la sintesis de hormonas tiroideas. La fuente de yodo del organismo depende exclusivamente de la ingesta. El yodo es absorbido en el intestino delgado proximal tanto en forma organicacomo inorganica. La lberacion del yoduro tras hidrolisis enzimatica se completa posteriormente en el higado y riñon. Notese que la tiroxina contiene cuatro moleculas de yodo en su estructura. • SINTESIS Y SECRECIÓN DE HORMONA TIROIDEA: • Para la sintesis y secrecion de HT, las celulas foliculares realizan una serie de funciones especializadas. • Captación de yoduro activaente mediante la proteina NIS, que concentra el yoduro de manera dependiente del sodio. • 2.El yoduro es transportado desde la membrana basal a la membrana apical del tirocito. • 3.Se produce la oxidacion del yoduro (donde participa el peroxido de hidrogeno) mediante una enzima especifica denomiada tiroxidasa (triox), en esta oxidaion el yoduro se convierte en yodonio. • 4.El yodonio se incorpora (yodación) a la tg mediante la tiroperoxidasa (TPO), para producir yodo tirosinas hormonalmente inactivas. Se forman las monoyodotirosinas (MIT) y diyodotirosinas (DIT). • 5.La TPO nuevamente participa, en el acoplamiento de las yodo tirosinas para formar las yodotironinas (T3 y T4) hormonalmente activas. • 6.Captación de gotitas de coloide por endocitosis. • 7.Ruptura proteica de los enlaces tg-HT con la liberacion de T4 y T3 a la sangre. Degradación de la tiroglobulina, catalizando por catersina D y por la tiolproteasa, la cual es activada por el pH acido del lisosoma. Mediante esta accon se liberan monoyodotirosinas con la tiroglobulina. Las hormonas tiroideas dentro del lisosoma pasa luego al citosol y posteriormente al plasma. Dicho mecanismo aun permanece incierto pero posiblemente este involucrado el transportador MCT8 en la salida de estas hormonas desde los fagolisosomas al citosoly del tirocito hacia la circulacion general. • el hipotálamo libera homona liberadora detirotropina (TRH) que estimula a la glándula pituitaria el cual estimula la TSH (hormona estimuladora de tirotropina) yestimula a la tiroides para la sintesis de la T3 y T4 • Las hormonas tiroideas (HT) son sintetizadas en los folículos tiroideos, siendo una glucoproteína larga llamada tiroglobulina (Tg), en dicho proceso tienen importancia dos moléculas: tirosina y yodo. • La primera forma parte de la Tg, la cual es formada dentro de la célula foliculary se secreta hacia la luz del folículo; la segunda es convertida en yoduro en el tracto intestinal yluego es transportado hacia la tiroides, en donde las células foliculares lo atrapan por medio de transporte activo. • La captación de yoduro se efectúa en la membrana basal y pasa al coloide folicular a través de la membrana apical de las células foliculares, mientras que las células parafoliculares liberan calcitonina. • El yodo esoxidado por una enzima llamada tiroperoxidasa (TPO) en presencia de peróxido de hidrógenoe incorporado a los residuos de tirosina de la glucoproteína en un proceso conocidocomo organificación o PBI (protein binding iodide), dando como resultado la formación de monoyodotirosina (MIT) y diyodotirosina (DIT). • El acoplamiento de las yodotirosinas para formar yodotironinas tiene dos posibles vías: la combinación de dos moléculas de DIT para formar 3,4,3’,5’-tetrayodotironina (T4 otiroxina) o la combinación de una DIT con unaMIT para formar 3,5,3’-triyodotironina (T3) o 3,3,5’-triyodotironina (rT3), o este proceso está regulado por un sistema de retroalimentación negativa que involucra el hipotálamo, la hipófisis y la glándula tiroides, o depende de la hormona estimulante de tiroides (TSH) bajo el control del eje hipotalámico-hipofisiario; o en el hipotálamo se sintetiza un tripéptido llamado TRH (hormona liberadorade tirotropina) el cual controla la • • • • • • • • • • • • • • • • • • síntesis y liberación de la TSH, además de participar en la liberación de la hormona del crecimiento (GH) y la prolactina (PRL) provenientes de la adenohipófisis del cerdo Por otro lado, la somatostatina y dopamina enel hipotálamo pueden regular negativamente la secreción de TSH. La síntesis de las HT o inicia por endocitosis del coloide cerca dela superficie interna de la célula tiroidea, por lo tanto, la Tg interiorizada se incorporaen fagolisosomas y se somete a digestión proteolítica siendo endocitada y degradada en pre lisosomas y lisosomas liberando dos aminoácidos yodados (T3 y T4) a la circulación; o las dos yodo tirosinas sedesyodan dentro de la glándula por una enzimadenominada desyodasa, realizando un ciclointratiroideo que hace aprovechable el yodode la tirosina; o de las dos tironinas yodadas, la tiroxina predomina en todos los animales: aproximadamente el 33% del total del yodo en la glándula está en forma de T4 y por lo general menos del 10% está en forma de T3 a pesar deser esta última biológicamente más activa Aunque la T4 es la molécula producida en mayor cantidad por la glándula tiroides, su actividad biológica es pequeña e inclusive se le menciona como una prohormona, la desyodación extratiroidea o periférica convierte T4 a T3, lacual se une al receptor tiroideo en las células diana con mayor afinidad comparada con laT4 y es la forma preponderante de la molécula metabólicamente activa; la mayoría de la T3circulante se genera por el metabolismo deun pre-receptor resultante de la actividad delas enzimas desyodasa yodotironina tipo 1(D1) y tipo 2 (D2) que convierten T4 a T3 por5’-monodesyodacion (15). o La D1 se encuentraen tejidos periféricos como hígado y riñones yes responsable de la conversión de la mayoríade T4 a T3 en la circulación. o La D2 está presenteen cerebro, pituitaria y tejido adiposo marrón ograsa parda y este, a diferencia de D1, convierteT4 a T3 para uso intracelular En enfermedades crónicas, ayuno, administración de glucocorticoides o propiltiouracilo, inanición de carbohidratos y en el plasma fetal aumentala proporción T4/T3, debido a la inhibiciónde la enzima 5’-desyodasa, lo que generapoca concentración de T3 circulante, y por lotanto, un aumento en la desyodación de laT4 pero el producto nal es la rT3 que es una yodotironina biológicamente inactiva Posteriormente, luego de ser liberadas a la sangre, las HT circulan en forma fija, es decir, unidas a proteínas transportadoras o fijadoras específicas, principalmente a la globulina fijadora de hormona tiroidea (TBG) que tiene una alta afinidad por la T4; además, se ligan enforma secundaria a la albúmina, que presenta poca a nidad para T4 y T3 pero se encuentraen mayor concentración, y a la prealbúmina jadora de tiroxina (TBPA), la cual muestra unaespeci cidad y una capacidad intermedia entrela TBG y la albúmina. Desde la captación de T3, de forma indirectase logra calcular la cantidad de TBG en unamuestra, la cual está ligada a la mayoríade T4 circulante; por lo tanto, cambios en laa nidad podrían tener un largo efecto en lasconcentraciones hormonales de T4 libre, perono se re eja en las mediciones totales de las HT circulantes o T3 libre. Las conversiones metabólicas intracelulares de T4 y T3 incluyen: o 1)Desyodación por 5’-desyodasa y 5 desyodasa, o 2) Desaminación, independiente o junto conoxidación o descarboxilación y o 3) Conjugación con glucorónico o sulfato, este último seconsidera un mecanismo de destoxificación. TSH activa AMPc ingresa glucosa a la célula glucosa -> via de pentoses fosfatos -> genera NADPH genera H2O2 ingresa yodo tiroglobulinoa se sintetiza en el RE rugoso y se libera por exositosis al lumen folicular tiroglobulina se unen con el yodo por union de cargas DIT + MIT -> t3 DIT + DIT -> t4 t3 y t4 se unen a a tiroglobulina y ingresa por fagocitosis a la celula se une un lisosoma y degrada el tiroglobulina para liberar t3 y t4 • el t3 y el t4 se van al torrente sanguíneo para funcionar ¿Cuáles son los efectos que tienen las hormonas tiroideas en nuestro metabolismo? Explica y esquematiza • Las hormonas tiroideas, tiroxina (T4) y triyodotironina (T3), tienen un amplio efecto sobre el desarrollo y el metabolismo. • Algunos de los más destacados efectos del dé cit de la hormona tiroidea ocurren durante el desarrollo fetal y en los primeros meses que siguen al nacimiento. • En el niño, las alteraciones más destacadas son el déficit del desarrollo intelectual y el retraso en el crecimiento. • El déficit intelectual que es proporcional al tiempo que persista la falta de hormonas, es irreversible; el retraso en el crecimiento parece ser de origen pura-mente metabólico, ya que el crecimiento se adapta rápidamente a suritmo normal después de la instauración del tratamiento. • En el adulto, el efecto primario de las hormonas tiroideas se manifiesta por alteraciones del metabolismo. • Este efecto incluye cambios en el consumo de oxígeno y en el metabolismo de las proteínas, hidratos de carbono, grasas y vitaminas • Considerando sólo las más importantes podemos citar las siguientes acciones: o Son necesarias para un correcto crecimiento y desarrollo. o Tienen acción calorígena y termorreguladora. o Aumentan el consumo de oxígeno. o Estimulan la síntesis y degradación de las proteínas. o Regulan las mucoproteínas y el agua extracelular. o Actúan en la síntesis y degradación de las grasas. o Intervienen en la síntesis del glucógeno y en la utilización de la glucosa. o Son necesarias para la formación de la vitamina A, a partir de los carotenos. o Estimulan el crecimiento y la diferenciación. o Son imprescindibles para el desarrollo del sistema nervioso central y periférico. o Intervienen en los procesos de la contracción muscular y motilidad intestinal. o Participan en el desarrollo y erupción dental. • Resumen de los sitios de regulación de la hormona tiroidea del metabolismo. • Eje hipotalámico-hipofisario-tiroideo: o la hormona liberadora de tirotropina (TRH) y la hormona estimulante del tiroides (TSH) responden principalmente al T4 en suero circulante, convertido en hipotálamo y pituitaria a T3 por la 5'-desiodinasa tipo 2 (D2). o El transportador de monocarboxilato 8 (MCT8) es necesario para el transporte de T3 en la hipófisis y el hipotálamo. • A, neuronas parvalbuminérgicas (PBN): o PBN son una población de neuronas recién descubiertas en el hipotálamo anterior que están directamente relacionadas con la regulación de la función cardiovascular, incluyendo la frecuencia cardíaca, la presión arterial y la temperatura corporal. o La señalización del receptor de la hormona tiroidea es necesaria para el desarrollo normal de las neuronas PBN que unen la hormona tiroidea con la regulación cardiaca y la temperatura. • B, núcleo paraventricular del hipotlamo (VPN): o la leptina, producida en tejido graso periférico, proporciona retroalimentación en la VPN, estimula el transductor de señal y el activador de la transcripción (STAT) 3 fosforilación (STAT3-P *), que estimula directamente la expresión de TRH. o La leptina también estimula TRH indirectamente en el núcleo arqueado inhibiendo el neuropéptido Y y la proteína relacionada con agouti, estimulando la proopiomelanocortina (POMC), y el producto POMC estimula la CREB en la neurona TRH • C, núcleo ventromedial del hipotálamo (VMH): o hipertiroidismo o tratamiento T3 estimula la síntesis de novo de ácidos grasos en el VMH, que inhibe la fosforilación de AMPK y aumenta la actividad de la sintasa de ácidos grasos (FAS). o El aumento de la síntesis de lípidos hipotalámicos se asocia con la activación del sistema nervioso simpático (SNS) que estimula el tejido adiposo marrón (MTD). • D, BAT: o la señalización adrenérgica a través del receptor β3-adrenérgico (AR) estimula la expresión del gen UCP1, estimula la actividad D2 mediante la desubiquitinación y promueve la termogénesis y la pérdida de peso. o La señal metabólica de ácido biliar a través del receptor de ácido biliar de la membrana acoplada a proteína G (TGR5) se ha demostrado en un modelo para estimular la actividad de D2 y la producción local de T3, lo que estimula la lipólisis de BAT, la expresión de UCP1 y la termogénesis. • E, tejido adiposo blanco (WAT): o señales de SNS vía β1- y β2-AR estimulan la lipólisis de WAT. T3 estimula la producción local de norepinefrina (NE), aumentando la lipólisis y reduciendo la grasa corporal. • F, hígado: o T3 está implicado tanto en el metabolismo del colesterol como en el ácido graso o HOMGCR, 3 - hidroxi - 3 - metil - glutaril - CoA reductasa; o ACC1, acetil-CoA carboxilasa 1; CYP7a1, citocromo P - 450 7A1; o CPT - 1 \ alpha, carnitina palmitoiltransferasa 1 \ alpha; o LDL-R, receptor de lipoproteínas de baja densidad. • G, músculo: o La caja Oorkorn (OXO3) induce la expresión de D2, aumenta la T3 local en el músculo esquelético y promueve la expresión génica del objetivo T3; MioD, cadena pesada de miosina (MHC) y retículo sarcoplásmico Ca2 + ATPasa (SERCA). o Local T3 también determina el nivel relativo de expresión de las isoformas de MHC y SERCA. o El nivel de expresión de estas isoformas determina los tipos de fibras musculares y el inicio de la reparación. SERCA2a se expresa principalmente en fibras de contracción lenta y SERCA1 en fibras de contracción rápida. T3 estimula a SERCA, que hidroliza ATP y aumenta el gasto energético. • H, páncreas: o T3 y TR son necesarios para el desarrollo y la función pancreática normales. o En las células β pancreáticas de rata, la expresión de TR y D2 se activan durante el desarrollo normal. o T3 mejora la expresión génica del factor de transcripción de Mafa (v-maf musculoaponeurótico fibrosarcoma oncogén homólogo A) y aumenta el contenido de proteína de MAFA, el factor clave para la maduración de las células β para secretar insulina en respuesta a la glucosa. o T3 estimula la expresión de genes de ciclina D1 (CD1) y el nivel de proteína y promueve la proliferación. o El aumento de la ciclina D1 activa la ciclina D1 / ciclina dependiente de la quinasa / retinoblastoma proteína / E2F vía. DPG – HORMONAS TIROIDEAS SEMANA 15 • Principales vías del metabolismo energético / Interrelaciones metabólicas entre el cerebro, tejido adiposo, musculo, hígado y riñón • • efectos hormonales sobre el metabolismo energético Tejido Insulina Glucosa Epinerina Musculo Tejido adiposo Hígado • estado de nutrición adecuada • estado de ayuno y estrés o glucagón se une a un receptor acoplado a proteína g o receptor de adrenalina alfa 1 y 2 y beta 1 y 2 es afín a todas, la noradrenalina es afín a todas menos la beta2 • ayuno temprano o desde el momento que se va uno a dormir hasta que se levanta. o lo primero que se degrada es glucógeno del hígado y el músculo y se va al cerebro o se forma acido láctico en el músculo y se dirige al hígado por el ciclo de cori o el glucógeno es inducido por glucagón. o la alanina se va al hígado para formar glucosa por el proceso de gluconeogénesis o la degradación de lactato a glucosa es por gluconeogénesis o proteína no se degrada • ayuno tardío o se libera el glucagón o lo primero que se degrada son los lípidos o hay degradación de proteínas pero a un o ritmo lento y se libera alanina y se forma glucosa y la glutamina se va al intestino para formar glucosa y ambos se dirigen al hígado o el cerebro usa glucosa y cuerpos cetónicos (acetona, acido acético y beta- hidroxibutirato) o beta hidróxibutirato se encuentra en sangre y orina o cuando se agoto el glucógeno y se degrada el tejido adiposo • estado de inanición o degradación de proteínas a un ritmo acelerado o se degradan proteínas musculares y luego se degradan proteínas del hígado, en el riñón y se libera la albúmina (se encarga del equilibro osmótico (evita que se altere el pH) en el plasma es un buffer) y se pierde electrolitos (por una falla renal) y se le hincha la cara o y al final se degrada del corazón para alimentar al cerebro. o al final la persona puede sufrir una anemia cardiaca y muere • o no hay tejido adiposo y no se degradan lípidos • realimentación • bioquímica de la preclampsia o preclamsia -> aumento en presión arterial, proteinuria (proteína albumina en orina) y aumento de LDL y se le hinchan los pies y las manos (a causa de proteinuria). o placenta aumenta el ROS y citoquinas proinflamatorias cuando el LDLox se une a su receptor forma radicales libres y producen y inhiben a la oxido nítrico sintasa endotelial (eNOS) y cuando no funciona el NOS. y se activa la arginasa que degrada arginine a ADMA (dimetil arginina assimétrica) y el AMDA inhibe al NO y es atacado por radicales libres produciendo peroxinitrito o citoquinas proinflamatoria s promueven liberación de acido araquidónico (AA) y prostaglandinas (PGH5) y causa un aumento de troxanoA2 y causa una constricción y se activa sistema renina angiotensina testosterona y causa vaso constricción o vasoconstricción (aumento de presión arterial) -> disminución de oxido nítrico y aumento de endotelina o se le debe dar vasodilatadores para calmar la plecampsia bioquímica de el embarazo o bebe es un parasito porque consume todo los nutrientes de la madre o cuando la madre esta embarazada hay un desequilibrio fisiológico y bioquímico y la madre se queda sin nutrientes (se siente cansada, pálida, mareo, nauseas, vómitos) o exceso de nauseas y vomitos (hiperemesis gravidica) o eclamsia (preclampsia + convusiones (afección del SNC por liberación de glutamato) y le da MgSO4 para calmar las convulsiones bioquímica del parto o ZEB1 inhibe a CAP(proteina activador de contracción) la caspasa 3 es una proteina que ayuda a que se regenere el utero y no hay una inflamación . o el dia del parto la oxcitocina incrementa y luego decae. y ayuda a la contracción mientras que inhibe a ZEB1 y la CAP se activa y comienzan las contracciones y la oxcitocina inhibe a casapasa 3 y no hay regeneración del utero y causa una inflamación. luego el NFkB inhibe a ZEB. o apego por el bebe por liberación de amorfilial. y en una cesárea no hay liberación de oxitocina bioquímica de la lactancia o se debe dar de lactar por un año la lactogeno planetario se forma en la placenta y se estimula la formación de leche materna. o importante para la lactancia ▪ beber agua ▪ consumir alimentos pro lactogenicos (avena, maca, quinoa) ▪ succión estimula liberación de leche alcoholsimo o elmetanol causa ceguera o el metanol se degrada a formaldehído y luego a acido fornico y es muy dañino al cuerpo o el etanol se degrada a acetaldehido (responsable de resaca) y luego se degrada a acido acido acético **cuando tomas la primera enzima es la alcohol deshidrogenasa o si no se forma el acido acético en la mitocondriaria no sucede la beta oxidación y no hay una degracadion de ácidos grados, y se acumulan ácidos grasos y triglicéridos generando hígado graso o si se produce excesivamente el acetaldehido hay exceso de urea y causa exceso de NH4 y glutamato en el cerebro y causa encefalopatia hepatica o el NADPH es retirado por el sistema antioxidante (glutation, superoxido disbutasa) o se libera radicales libres y no se pueden degradar o disulfiran inhibe al aldehido deshidrogenasa o MEOS: ▪ sistema oxidante microsomal hepatic ◦ conjunto de enzimas del citocromo p450 ▪ el que degrada etanol es el CYP2E1 en el microsoma ▪ el acido acético se pierde rápido por la orina o si hay mucho NADH se inhibe el ciclo de crebs y se inhibe la fosforilacion oxidativa y no hay ruta aeróbica y se fomenta la ruta aeróbica y la glucosa se degrada a acido lactico y el exceso de ac lactico causa disminución de pH causa crisis aguda de gota o genómica o Análisis comparativo de toda la secuencia genómica de diferentes organismos y determinación de los patrones globales de expresión genética; se usa para evaluar relaciones evolutivas entre especies y para predecir el número y los tipos generales de ARN producidos por un organismo. o la genómica es el estudio de los genes comparándolo por especies o un gen es una secuencia de ADN que codifica algo nutrigenomica o • • • • • • • • farmacogenetica y farmacogenomica terapia personalizada