Desarrollo de la Tabla Periódica: Historia y Científicos Clave
Anuncio

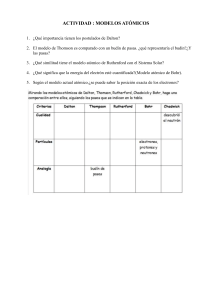
DESARROLLO DE LA TABLA PERIODICA Historia HISTORIA Al principio se pensaba que los elementos de toda materia se resumían al agua, tierra, fuego y aire. La primera definición científica de elemento químico fue establecida por Robert Boyle en 1661: sustancia simple. Los químicos del siglo XIX encontraron entonces la necesidad de ordenar los nuevos elementos descubiertos. La primera manera, la más natural, fue la de clasificarlos por masas atómicas, pero esta clasificación no reflejaba las diferencias y similitudes entre los elementos. LAVOISIER Identificó más de 20 elementos químicos y los agrupó en gases, los metales, no metales y las tierras. En 1789 publicó una lista de 33 elementos químicos. Estableció firmemente el concepto de elemento químico (el que no se puede descomponer en partes más pequeñas) a diferencia de la sustancia compuesta. Caracterizó como elemento químico el oxígeno, el nitrógeno, el hidrógeno, el fósforo, el mercurio, el zinc y el azufre JOHN DALTON “TEORÍA ATÓMICA” publicada en 1808. Creó el primer modelo atómico y publicó una tabla de pesos atómicos. Fue el primero en utilizar en 1803 símbolos para representar los elementos de la química moderna. Su propuesta, que incluía 36 elementos, consistía en círculos que contenían símbolos (como una cruz para el sulfuro) o letras (la ‘c’ para el cobre). JOSEPH LOUIS PROUST Químico francés Nació el 26 de septiembre de 1754 en Angers, Francia. Entre 1794 y 1804 Proust enunció la Ley de las proporciones definidas o constantes, también conocida como la “Ley de Proust” (dos compuestos diferírían entre sí en función de las proporciones de elementos básicos, sin apreciarse composiciones intermedias o mixtas, por ejemplo el Cu2CO3, carbonato de cobre (I) y el CuCO3, carbonato de cobre (II)). JONS JACOB VON BERZELIUS: Nació en Suecia en el año de 1779. (1814) Introdujo el uso de letras como símbolos de los elementos. Fue pionero en el uso del oxígeno como referencia para la determinación de las masas atómicas, y consiguió informar las masas de alrededor de 43 elementos. Descubrió el Cerio, el Selenio, el Torio, aisló el Silicio, el Zirconio y el Titanio. Nacido el 15 de enero de 1785 en Londres. (1815) Estableció la hipótesis que “en todos los elementos se hallan compuestos de hidrógeno como materia original”, en tal sentido propuso el ordenamiento de los elementos en base al hidrógeno, según la cual las masas atómicas eran números enteros y múltiplos WILLIAM PROUT DOBEREI NER Notó que existían grupos de tres elementos que tenían propiedades químicas semejantes y que sus propiedades físicas variaban de manera ordenada de acuerdo con sus masas atómicas A estas series las llamó triadas. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 pudimos contar con unas 20 tríadas para llegar a una primera clasificación coherente. ALEXANDREEMILE BEGUYER DE CHANCOURTOIS En 1862 Chancourtois, geólogo francés, pone en evidencia una cierta periodicidad entre los elementos de la tabla. Coloco los elementos ordenados por masa atómica creciente, de forma que en las mismas columnas se mostraban los elementos con similares características químicas “CARACOL TELURICO”. JOHN ALEXANDER REINA NEWLANDS (1837-1898) En 1864 Chancourtois y Newlands, químico inglés, anuncian la “Ley de las octavas: las propiedades se repiten cada ocho elementos.” Ordena los elementos conocidos en orden creciente de peso atómico y observa que si se empieza a contar a partir de alguno de ellos, el octavo elemento tiene propiedades similares al inicial. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. Esta clasificación es por lo tanto insuficiente, pero la tabla periódica comienza a ser diseñada. CANIZZA RO Químico italiano, determino los pesos atómicos de los elementos conocidos con gran precisión. Estableció la diferencia entre pesos atómicos y pesos moleculares. Suponía que si los átomos eran indivisibles, entonces en una molécula deberían existir necesariamente un número entero de cada tipo de átomos presentes en la molécula. Podía determinar la masa atómica de cualquier átomo utilizando la masa del átomo de hidrógeno como referencia. LOTHAR MEYER 1870. Actualizó su tabla a una de nueve columnas verticales que demostraban las propiedades físicas de los elementos. Químico alemán, pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante. Su clasificación estaba basada en la valencia de los elementos aunque no era el único factor que determinaba el orden, eran también los pesos atómicos y sus relaciones entre los de elementos homólogos. Se basaba en la serialización de las propiedades físicas de los elementos como el volumen atómico, punto de fusión, de ebullición, etc. MENDELEIEV (1869) Elaboró la clasificación definitiva de los elementos conocidos, partiendo de sus propiedades químicas. Considero además los pesos atómicos y semejanzas entre los elementos. Esta tabla fue diseñada de manera que hiciera aparecer la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente. Las agrupaciones horizontales se suceden representando los elementos de la misma “familia”. Mendeleiev compara elementos con propiedades similares y encuentra que las propiedades de los elementos dependen de manera regular del cambio de peso atómico; pero a diferencia de Meyer, presenta sus resultados en forma de tabla agrupando a los elementos con propiedades semejantes. Primera tabla de Mendeleiev (marzo de 1869) H=1 Li = 7 Ti = 50 Zr = 90 ? = 180 V = 51 Nb = 94 Ta = 182 Cr = 52 Mo = 96 W = 186 Mn = 55 Rh = 104.4 Pt = 197.4 Fe = 56 Ru = 104.4 Ir = 198 Ni = Co = 59 Pd = 106.6 Os = 199 Cu = 63.4 Ag = 108 Hg = 200 Be = 9.4 Mg = 24 Zn = 65.2 Cd = 112 B = 11 Al = 27.4 ? = 68 U = 116 C = 12 Si = 28 ? = 70 Sn = 118 N = 14 P = 31 As = 75 Sb = 122 0 = 16 S = 32 Se = 79.4 Te = 128 ? F = 19 Cl = 35.5 Br = 80 I = 127 Na = 23 K = 39 Rb = 85.4 Cs = 133 Tl = 204 Ca = 40 Sr = 87.6 Ba = 137 Pb = 207 ? = 45 Ce = 92 ? Er = 56 La = 94 ? Yb = 60 Dy = 95 ? In = 75.6 Th = 118 ? Au = 197 ? Bi = 210 ? Aparecen los 63 elementos conocidos en esa época en orden creciente de peso atómico. Algunos de estos pesos figuran en la tabla con interrogaciones pues Mendeleiev consideraba que los experimentos con que se habían obtenido no eran del todo confiables. Además en la tabla aparecen algunos huecos, esto es así porque Mendeleiev considera que no puede haber distancias tan grandes en peso entre dos elementos adyacentes y que por lo tanto deben existir elementos con pesos atómicos intermedios que no han sido descubiertos. Hace notar que la secuencia de los elementos en la tabla está en concordancia con la valencia. La valencia es una característica de los elementos que se relaciona con su capacidad de combinación. Existe una secuencia regular para la valencia (1,1,2,3,4,3,2,1,1,2...etc.) que está relacionada con la posición relativa que guardan los elementos Elemento Símbolo Valencia Lugar en la Tabla de Mendeleiev en la tabla de Mendeleiev. Hidrógeno H 1 Primero Litio Berilio Boro Carbono Nitrógeno Oxígeno Flúor Sodio Magnesio Aluminio Silicio Fósforo Azufre Cloro Potasio Calcio Li Be B C N O F Na Mg Al Si P S Cl K Ca 1 2 3 4 3 2 1 1 2 3 4 3 2 1 1 2 Segundo Tercero Cuarto Quinto Sexto Séptimo Octavo Noveno Décimo Décimo primero Décimo segundo Décimo tercero Décimo cuarto Décimo quinto Décimo sexto Décimo séptimo K=39 H=1 Ca=40 Sr= 87 '' Ba=137 Rb= 85 Cs=133 '' '' '' '' ?Yb= 88? ?Dy=138? Er=178? '' Ti=48? Zr= 90 Ce=140? La=180? Th=231 V=51 Nb= 94 " Fa=182 " Cr=52 Mo= 96 " W=184 U=240 Mn=55 " " " " Fe=56 Ru=104 " Os=195? " Co=59 Rh=104 " Ir=197 " Ni=59 Pd=106 " Pt=198? " Li= 7 Na=23 Cu=63 Ag=108 " Au=199? " Be= 9.4 Mg=24 Zn=65 Cd=112 " Hg=200 " B=11 Al=27.3 " In=113 " Tl=204 " C=12 Si=28 " Sn=118 " Pb=207 " N=14 P=31 As=75 Sb=122 " Bi=208 " O=16 S=32 Se=78 Te=125? " " " F=19 Cl=35.5 Br=80 I=127 " " " Establece también lo que se conoce como Ley Periódica: ”Las propiedades de los elementos son una función periódica de sus pesos atómicos.” Esta ley periódica tiene excepciones, es decir, existen elementos para los que si se sigue el orden estricto de peso atómico, no caen en un grupo de elementos con propiedades similares. En estos casos, Mendeleiev optó por conservarlos en el grupo idóneo aún sin respetar el orden creciente de peso atómico. Tabla de Mendeleiev de 1879 Grupo 1 grupo 2 H " Li Be Na K Mg (Cu) (Ag) Cs ?Yb Ba Zr ?Dy " ?Ce ?Er (Au) Hg " " ?La Tl " Pb Th " Ru Rh Pd Ag Os Ir Pt Au " W " " " U Cu I " Bi Ni " " Ta Co Br Te " Fe Mn Mo " Cl Se Sb " F Cr Nb grupo 8 " S As Sn " O V Grupo 7 " P " In " N Ti Grupo 6 " Si " Cd " " Al Zn Grupo 5 " C " Sr Grupo 4 " B Ca Rb Grupo 3 " " " En la época en que Mendeleiev presentó sus tablas no se conocían los llamados Gases Nobles (1902, elementos que fueron descubiertos gracias al invento del espectroscopio realizado por los maestros de Mendeleiev: Bunsen y Kirchhoff) porque al parecer no podían combinarse con otros átomos para formar compuestos es decir, eran inertes desde el punto de vista químico. Si se incorporan estos elementos (de acuerdo con su peso atómico) al sistema periódico, se obtiene un nuevo grupo y la secuencia de las valencias sería ahora 1,0,1,2,3,4,3,2,1,0,1,2...etc., lo que respeta la periodicidad y aún más, mejora la secuencia de las valencias. Si añadimos a la tabla de Mendeleiev los gases nobles, obtenemos lo que durante muchos años fue la forma más común de presentar el sistema periódico, hoy prácticamente en desuso y que conocemos como Tabla Periódica Corta. http://cea.quimicae.unam.mx/estru/tabla/06_Me MOSELEY Se hizo evidente que los átomos de diferentes elementos tenían diferente número de protones. Entonces, esta era una característica fundamental que hacía diferente a un átomo de otro. A esta cantidad se le llamó número atómico y es el parámetro fundamental que distingue a un elemento de otro. Los elementos son diferentes porque tienen diferente número atómico. En general el número atómico se representa con la letra Z. Moseley demostró que los registros de la emisión de rayos X de los átomos pueden ordenarse en forma sucesiva, y dedujo que existe un orden numérico en el que pueden ser colocados los elementos con base en ello, en lugar de seguir el de los pesos atómicos utilizado por Mendeleiev. Moseley dotó a cada elemento de un número atómico; este número correspondía a la posición de aquél en la sucesión y coincide con el número de protones que tienen los átomos correspondientes mencionado anteriormente. (1913) Con los trabajos de Moseley se pudo replantear la ley periódica, ahora en función del número atómico: ”Las propiedades de los elementos son una función periódica de sus números atómicos.” La ley periódica postulada en estos términos no presenta excepciones; por lo tanto, el número atómico es un parámetro más fundamental que el peso atómico para la clasificación de los elementos. http://cea.quimicae.unam.mx/estru/tabla/08_Numero.htm SEABORG: Fue el primero en proponer la serie actínida, que contribuyó a la clasificación actual de la tabla periódica. añadió entre 1940 y 1955 nueve elementos nuevos a la tabla periódica, de los cuales el plutonio, de número atómico 94, es el más conocido porque se utiliza como agente explosivo de cierto armamento nuclear. Los demás elementos descubiertos fueron el americio (95), el curio (96), el berkelio (97), el californio (98), el einstenio (99), el fermio (100), el mendelevio (101) y el nobelio (102).