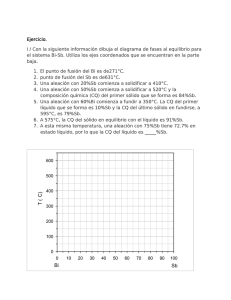
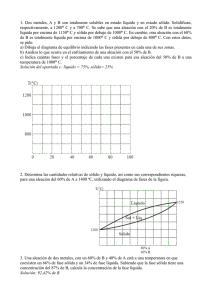
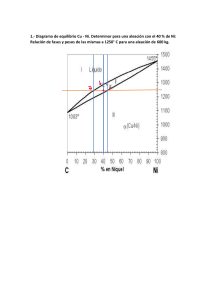
TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 9: ALEACIONES. DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus propiedades (mayor dureza, resistencia mecánica, resistencia a la corrosión, etc.) Se denomina aleación metálica a la mezcla de dos o más elementos químicos, uno de los cuales tiene carácter metálico, que en estado sólido tiene propiedades metálicas. Los elementos de una aleación deben ser totalmente miscibles en estado líquido, de forma que al solidificarse resulte un producto homogéneo. Cuando se mezclan metales que cristalizan en la misma red tridimensional, se denomina disolvente al que interviene en mayor proporción y soluto al que lo hace en proporción menos. Cuando se mezclan metales que cristalizan en distinta red, se llama disolvente al metal cuya estructura cristalina es la misma que la de la aleación, aunque intervenga en menor proporción. Estructura: soluciones sólidas Las aleaciones metálicas son soluciones sólidas entre 2 ó más elementos. Dependiendo de la disposición de los átomos del disolvente y del soluto, nos podemos encontrar con dos tipos de soluciones: Solución solida de sustitución: son aquellas aleaciones en las que los átomos del elemento disuelto (soluto) sustituyen y ocupan los nudos de los átomos del elemento disolvente en su red cristalina, sin modificarla, siendo ambos casi del mismo tamaño Para que dos átomos A y B sean totalmente solubles en estado sólido, se deben cumplir varias condiciones: - Ambos metales han de cristalizar en el mismo sistema. - Ambos metales deben tener la misma valencia. - Ambos metales han de poseer una electronegatividad semejante - Los diámetros atómicos no deben diferir en más de un 15%. Ejemplo: cobre con níquel (Cu-Ni); oro con plata (Au-Ag) La mayor parte de los metales forman únicamente soluciones sólidas de solubilidad parcial. Solución sólida de inserción son aquellas aleaciones en las que los átomos del elemento soluto se sitúan en los intersticios, entre los átomos del elemento disolvente, siendo el tamaño de los átomos del elemento disuelto mucho menores. El elemento que suele actuar de soluto es un no metal de pequeño tamaño (C, N, O ó H). Los metales que actúan de disolvente suelen ser metales de transición (Fe, Cr, Mn, Co, Ni,…) Las aleaciones hierro-carbono (acero) se presentan siempre como soluciones sólidas intersticiales, (Ferrita que es hierro α con carbono intersticial y la Austerita, que es hierro γ con carbono intersticial). El radio atómico del hierro es de 0,129 nm y el del carbono es de 0,075 nm. 1 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz 2.- Solidificación de las aleaciones La solidificación de materiales y aleaciones metálicas es un proceso industrial que parte del estado líquido y enfría el material en forma de lingote o en un molde con la forma definitiva. Las propiedades del material formado dependen en gran medida de la manera en que se lleva a cabo esta solidificación. El proceso de solidificación de un metal o de una aleación metálica puede representarse mediante la curva de enfriamiento, en función de la temperatura y el tiempo. Curva de enfriamiento de un metal y de una aleación METAL PURO Temperatura Temperatura Líquido T solidificación ALEACIÓN EUTÉCTICA ALEACIÓN Temperatura Líquido Líquido 2 1 T inicio solidificación 1 T fin solidificación 2 Intervalo solidificación T solidificación 2 1 Sólido Sólido tiempo tiempo 1 = Inicio del proceso de solidificación Sólido tiempo 2 = Fin del proceso de solidificación Los metales puros tienen una sóla temperatura de solidificación, mientras que las aleaciones tienen un intervalo de solidificación (excepto la aleación eutéctica, que es la aleación de menor punto de fusión y que veremos más adelante).. 3.- Diagrama de equilibrio en aleaciones Se llaman diagramas de equilibrio o diagrama de fases. Representan la relación entre la estructura, la composición, el número de fases y las transformaciones desde el estado líquido al estado sólido. Fase: es cada una de las partes o masa homogénea de que se compone un sistema y se diferencia físicamente del resto (ej: fase sólida, líquida y gaseosa). Dentro de un sólido pueden existir varias fases Componente: son cada una de las sustancias o elementos químicos que forman un material. (ej: el Fe (hierro) y el Fe3C (cementita)son constituyentes del acero) Los diagramas de equilibrio nos permiten saber qué fases se encuentran presentes para cada composición de una aleación y a qué temperatura. También permiten saber las temperaturas de inicio y fin del proceso de solidificación; las temperaturas en que se produce un cambio de fases y la solubilidad que tienen los componentes en estado sólido y líquido. En todos los diagramas vamos a analizar tres datos: Numero de fases Composición de cada fase (mediante la regla de la horizontal), Cantidad o proporción de cada fase (mediante la regla de la palanca o de los segmentos inversos), Representación de diagramas de equilibrio de una aleación A-B: Para dibujar un diagrama hay que seguir los siguientes pasos: - - Se parte de las curvas de enfriamiento de los metales puros A y B, de las curvas de enfriamiento de alecciones con diferentes composiciones de A y B. Y se obtienen las temperaturas de inicio y fin del proceso de solidificación. Con los datos anteriores se dibuja la gráfica temperatura-concentración. Para ello se unen todos los puntos de inicio del proceso de solidificación, obteniendo una línea por encima de 2 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz la cual todo es líquido (línea de liquido). Y se unen todos los puntos del fin del proceso de solidificación, obteniendo una línea por debajo de la cual todo es sólido (línea de solido). La zona comprendida entre ambas líneas está formada por dos fases, una fase en estado líquido y otra en estado sólido. Las gráficas que se obtienen pueden ser de tres tipos dependiendo del tipo de solubilidad que presentan los elementos A y B Tª Línea de liquido 1600 LÏQUIDO L 1500 1400 Diagrama de equilibrio en aleaciones totalmente solubles estado sólido L+ SAB 1300 1200 Línea de solido SÓLIDO SAB 1100 0 25 50 %B 75 100 Línea de liquido Tª 1500 LÏQUIDO L 1400 Diagrama de equilibrio en aleaciones insolubles en estado sólido 1300 L + SB 1100 Aleación eutéctica Sólido(A+B) 1000 0 Tª Línea de solido L + SA 1200 %B 20 40 60 100 80 A B Línea de liquido 1800 LÏQUIDO L 1600 1400 Diagrama de equilibrio en aleaciones parcialmente solubles en estado sólido L+α L+β 1200 1000 α Aleación eutéctica β Línea de solido Solido (α+β) 800 %B 0 20 40 60 80 100 DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO Y ESTADO SÓLIDO Se toman los metales puros A y B y diferentes aleaciones A-B, se funden y se dejan enfriar lentamente. Se dibujan sus gráficas de enfriamiento y se toman sus puntos de inicio y fin del proceso de solidificación para dibujar el diagrama de equilibrio (gráfica Temperaturaconcentración) T1 = temperatura de inicio de solidificación (comienza la formación de cristales) T2 = temperatura de fin de solidificación (formación del último cristal 3 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena 1600 1500 En estas aleaciones existe una solubilidad total en estado sólido, por lo que los átomos se mezclan en el interior del grano cristalino, es decir, dentro de los granos hay metal A y B. Todos los granos son similares. Línea de liquidus Tª LÏQUIDO L T1 =T2 T1 El diagrama se divide en tres zonas: T1 T1 1400 L+ T2 1300 s T2 1200 Línea de solidus T2 T1=T2 SÓLIDO s 1100 0%B 100%A 25%B 75%A 50%B 50%A Mª Jesús Saiz %B 100%B 0%A 75%B 25%A ▪ En la zona L hay una sola fase, líquida y homogénea. ▪ En la zona L+S hay dos fases, una de líquido AB y otra de cristales de aleación sólida S (AB mezclados). ▪ En la zona S hay una fase sólida formada por la mezcla AB. Vamos a analizar el diagrama fijándonos en los siguientes puntos: Tª Ejemplo: Aleación 75% A y 25% B: - En el punto “a” 1600 • Numero de fases = 1 (liquido) • Composición de cada fase: Líquido =75% A - 25 %B 1400 Cantidad o proporción de cada fase: 1300 • s l b L+S 1200 En el punto “b” c SÓLIDO S • Numero de fases = 2 (líquido y sólido S) • Composición de cada fase: se aplica la regla 0 10 50 25 75 100 de la horizontal para hallar la composición química del sólido y del líquido (se traza una línea horizontal que pase por el punto “b” y corte a las líneas de fase; el punto de corte con la línea de líquido nos da la composición de la fase líquida y el punto de corte con la línea de sólido nos da la composición de la fase sólida) Líquido L= 75% B y 25% A Sólido S = 10% B y 90% A • Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos para hallar la cantidad en tanto por ciento de la fase sólida y de la fase líquida (se traza una línea horizontal que pase por el punto “b” y corte a las líneas de fase; esa línea s-l es el denominador y en el numerador se coloca el segmento inverso desde nuestro punto “b” a la línea de fase) Wlíquido = 𝑏−𝑠 𝑙−𝑠 𝑙−𝑏 25−10 100 (%) = 1100 100 = 23% 75−10 75−25 Wsólido = 100 (%) = 100 = 77% 𝑙−𝑠 75−10 - LÏQUIDO L 1500 Wlíquido = 100 % - a En el punto “c” • Numero de fases = 1 (sólido S) • Composición de cada fase: Solido =75% A - 25 %B • Cantidad o proporción de cada fase: Wsólido = 100 % 4 %B TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO E INSOLUBLES EN ESTADO SÓLIDO Se toman los metales puros A y B y diferentes aleaciones A-B, se funden y se dejan enfriar lentamente. Se dibujan sus curvas de enfriamiento y se toman sus puntos de inicio y fin del proceso de solidificación para dibujar el diagrama de equilibrio (gráfica Temperaturaconcentración) T1 = temperatura de inicio de solidificación (comienza la formación de cristales) T2 = temperatura de fin de solidificación (formación del último cristal Observamos que todas las aleaciones A-B acaban de solidificar a la misma temperatura. Los metales puros A y B y la aleación eutéctica tienen una sola temperatura de solidificación. El resto de aleaciones tiene un intervalo de solidificación Se representa el diagrama de fases Línea de liquidus Tª 1500 1400 T1 =T2 LÏQUIDO L T1 =T2 T1 T1 T1 1300 L+B L+A 1200 T2 T2 T2 1100 Línea de solidus SÓLIDO A+B 1000 0 %B 20 40 Aleación hipoeutéctica 60 80 100 Aleación hipereutéctica El diagrama se divide en cuatro zonas. ▪ En la zona L hay una sola fase, líquida y homogénea. ▪ En la zona L+A hay dos fases, una de líquido A-B y otra de cristales de solido A. ▪ En la zona L+B hay dos fases, una de líquido A-B y otra de cristales de solido B. ▪ En la zona sólida hay un sólido formado por dos fases A y B, que no se mezclan. En estas aleaciones existe una insolubilidad entre sus elementos en estado sólido, lo que hace que, al formarse los granos cristalinos, los metales no se mezclan dentro del grano por lo que cada grano es de un metal puro; Es decir, tenemos granos formados por el metal A y granos del metal B (dos fases) mezclados al azar. A la aleación de punto de fusión más bajo se le llama aleación eutéctica. Aleación eutéctica A las aleaciones a la izquierda de la aleación eutéctica se las llama aleaciones hipoeutécticas. A las aleaciones a la derecha de la aleación eutéctica se las llama aleaciones hipereutécticas. Reacción eutéctica: transformación de un líquido a cierta temperatura en dos fases sólidas. Es la aleación de menor temperatura de fusión Vamos a analizar el diagrama fijándonos en las siguientes zonas: ▪ En las aleaciones hipoeutécticas, por debajo de la línea de líquido comienza la solidificación y los cristales que solidifican en la zona L+A son de sólido puro A, mientras que el líquido AB que queda se va progresivamente empobreciendo en A. Al llegar a la temperatura T2 desaparece todo el líquido y el sólido que se forma en ese instante contiene cristales de A puro y B puro que no se mezclan dentro del grano (sólido con dos constituyentes A+B). Este sólido tiene la misma cantidad o concentración de A y B que la aleación eutéctica. A temperaturas menores toda la aleación está en estado sólido, pero podemos considerar que tenemos un sólido con dos fases: una fase de sólido A que se formó en la zona L+A (A proeutéctico, se formó antes de la temperatura eutéctica), y una fase compuesta de sólido A+B (composición eutéctica). Es la zona Ap+(A+B)eu ▪ En la aleación eutéctica sólo hay un punto de solidificación y toda la aleación pasa de estado líquido a sólido a la temperatura T2. Se forman dos fases A y B, que no se mezclan. 5 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena ▪ Mª Jesús Saiz En las aleaciones hipereutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+B son de sólido puro B, mientras que el líquido que queda se va empobreciendo en B. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación sólida formada en ese instante contiene cristales de A puro y B puro que no se mezclan (sólido con dos fases A+B de composición eutéctica) A temperaturas menores toda la aleación está en estado sólido, pero podemos considerar que tenemos un sólido con dos fases: una fase de sólido B que se formó en la zona L+B (B proeutéctico, se formó antes de la temperatura eutéctica), y una fase compuesta de sólido A+B (composición eutéctica). Es la zona Bp+(A+B)eu Para calcular la composición de cada una de las fases se emplea la regla de la horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca. Línea de liquidus Tª LÏQUIDO L a 1400 b 1300 L + Bp L + Ap 1200 1100 c A+B Línea de solidus Aleación eutéctica 1000 Ap+(A+B)eu 0 Bp+(A+B)eu %B 20 40 60 Aleación hipoeutéctica 80 100 Aleación hipereutéctica Ejemplo: Aleación 80% A y 20% B: - Bp = B proeutéctico (A+B)eu = aleación eutéctica 1500 - Ap = A proeutéctico En el punto “a” • Numero de fases = 1 (liquido AB) • Composición de cada fase: Líquido =80% A - 20 %B • Cantidad o proporción de cada fase: Wlíquido = 100 % En el punto “b” • Numero de fases = 2 (liquido AB y sólido A) • Composición de cada fase: se aplica la regla de la horizontal Líquido = 40% B y 60% A Sólido A = 0% B y 100% A 6 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena • Mª Jesús Saiz Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Wlíquido = 𝑏−𝑠 100 = 50% 40−0 40−20 Wsólido = 100 (%) = 100 = 50% 𝑙−𝑠 40−0 - 𝑙−𝑠 𝑙−𝑏 20−0 100 (%) = En el punto “c” • Numero de fases = 2 (solido A y sólido A+B) • Composición de cada fase: Sólido A =100% A - 0 %B Sólido A+B =80% A - 20 %B (eutéctica) • Cantidad o proporción de cada fase: Primero se calculan las cantidades totales de A y B WA = 80% y WB = 20% Para conocer las cantidades de cada fase A y fase A+B, se compara la fase A+B con la composición del punto eutéctico. WAeutectico = 40% WBeutectico = 60% Comparamos los cristales de B que son todos eutécticos, mediante regla de tres: Eutéctico Punto c Aeutéctico Beutéctico 40 60 x 20 Resolviendo: x = 13,3%, de modo que el A primario o proeutéctico será 80-13,3 = 66,7. Y la cantidad de cada fase es: WA proeutéctico = 66,7% y W(A+B) eutéctico = 13,3 + 20 = 33,3% DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO Y PARCIALMENTE SOLUBLES EN ESTADO SÓLIDO La mayor parte de los metales de uso industrial presentan alguna solubilidad entre sí al alearse. Por ejemplo: en la aleación Cu-Zn, el cobre no Tª A B es capaz de solubilizar más de un 30% de Zn Línea de 1800 LÏQUIDO L liquidus Se representa el diagrama de fases 1600 En estos sistemas los metales son solubles, pero en pequeña cantidad (parcialmente solubles, Al solidificar aparecen soluciones sólidas α y β Línea de solidus 1400 L+ 1200 1000 α = solución sólida de B disuelto en A (mucha cantidad de A y poca de B) α α L+ β β α+β Aleación eutéctica Aleación eutéctica SÓLIDO α+β 800 β = solución sólida de A disuelto en B (mucha cantidad de B y poca de A) 0 %B 20 40 Aleación hipoeutéctica 7 60 80 100 Aleación hipereutéctica TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz A la temperatura eutéctica las fases sólidas que se forman son soluciones α y β. Se observa en el diagrama que ocurren transformaciones en estado sólido. El diagrama se divide en seis zonas: - ▪ ▪ En la zona L hay una sola fase, líquida AB y homogénea. En la zona L+α hay dos fases, una de líquido AB y otra de cristales de aleación sólida α (sólido α con solubilidad parcial) En la zona L+β también hay dos fases, una de líquido AB y otra de cristales de aleación sólida β (sólido β con solubilidad parcial) En la zona α, hay una fase sólida formada por cristales de aleación sólida α. En la zona β, hay una fase sólida formada por cristales de aleación sólida β. En la zona α+β hay un sólida formado por dos fases α y β, que son soluciones sólidas con solubilidad parcial. En las aleaciones hipoeutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+α son de sólido α, mientras que el líquido que queda se va empobreciendo en A. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de α (proeutécticos), más una estructura compuesta de α+β (composición eutéctica). Es la zona α+(α+β). En aleaciones hipoeutécticass con pequeñas cantidades de B, todo el sólido está en forma de α y este sólido no sufre transformaciones, todo es solución sólida α Tª A B 1800 LÏQUIDO L 1600 a 1400 L+ αP L+ b βP 1200 1000 α c Aleación eutéctica αP+(α+β)eu 800 357 0 β α+β βP+(α+β)eu 90 92 50 20 40 Aleación hipoeutéctica 60 80 100 Aleación hipereutéctica ▪ En la aleación eutéctica sólo hay un punto de solidificación y toda la aleación pasa de estado líquido a sólido α+β a la temperatura T2. ▪ En las aleaciones hipereutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+β son de sólido β, mientras que el líquido que queda se va empobreciendo en B. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de β (proeutécticos), más una estructura compuesta de α+β (composición eutéctica). Es la zona β+(α+β) ▪ En aleaciones hipereutécticas,con pequeñas cantidades de A, todo el sólido está en forma de β y este sólido no sufre transformaciones, todo es solución sólida β Para calcular la composición de cada una de las fases se emplea la regla de la horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca. Ejemplo: Aleación 60% A y 40% B: - En el punto “a” • Numero de fases = 1 (liquido AB) • Composición de cada fase: Líquido =60% A - 40 %B 8 %B TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena ▪ Mª Jesús Saiz Cantidad o proporción de cada fase: Wlíquido = 100 % - En el punto “b” • Numero de fases = 2 (liquido y sólido α) • Composición de cada fase: se aplica la regla de la horizontal Líquido = 50% B y 50% A Sólido α = 3% B y 97% A • Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Wlíquido = 𝑏−𝑠 100 = 78,7% 50−3 50−40 Wsólido = 100 (%) = 100 = 21,3% 𝑙−𝑠 50−3 - 𝑙−𝑠 𝑙−𝑏 40−3 100 (%) = En el punto “c” • Numero de fases = 2 (solido α y sólido α+β) • Composición de cada fase: se aplica la regla de la horizontal Sólido α = 5% B y 95% A Sólido β = 92% B y 8% A • Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Primero se calculan las cantidades totales de α y β Wα = Wβ = 92−40 92−5 40−5 92−5 100 = 59,8% 100 = 40,2% Para conocer las cantidades de cada fase α y fase α+β, se compara la fase α+β con la composición del punto eutéctico. Wαeutectico = Wβeutectico= 90−60 90−7 60−7 90−7 100 = 36,1% 100 = 63,9% Comparamos los cristales de β que son todos eutécticos, mediante regla de tres: αeutéctico βeutéctico Eutéctico 36,1 63,9 Punto c x 40,2 Resolviendo: x = 22,7%, de modo que el α primario será 59,8 - 22,7 = 37,1%. Y la cantidad de cada fase es: Wα proeutéctico = 37,1% y W(α+β) eutéctico = 22,7 + 40,2= 62,9 % 9 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz ALEACIONES Fe-C. PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver el carbono. Hierro α: cristaliza hasta una temperatura de 768 ºC en la red CCB. No disuelve prácticamente al carbono. Es magnético. Hierro β: cristaliza entre 768 ºC- 910 ºC en la red CCB. No es magnético. Tiene mayor volumen (mayor distancia entre átomos). Hierro γ: cristaliza entre 910 ºC- 1400 ºC en la red CCF. Disuelve más carbono (hasta un 2, 11 %). Es no magnético Hierro δ: cristaliza entre 1400 ºC- 1539 ºC en la red CCB. Es magnético. Muy parecido al hierro α. Poca aplicación 2.- Formas de encontrar el carbono en las aleaciones férreas Disuelto o combinado: Formando soluciones sólidas de inserción con el hierro α (ferrita = Fe α - C). La ferrita disuelve muy poca cantidad de carbono. La estructura cristalina será CCB Formando soluciones sólidas de inserción con el hierro γ (austenita = Fe γ - C). La estructura cristalina será CCF En forma de carburo de hierro (Fe3C = cementita). La cementita tiene un 6,67% en peso de carbono (la mayor proporción de carbono que puede solubilizarse con el hierro), y es un compuesto de inserción. La estructura cristalina que se forma es del tipo ortorrómbica con 12 átomos de hierro y 4 átomos de carbono por celda. Libre: formando nódulos o láminas de grafito, cuando el porcentaje de carbono es superior al 6,67%. El grafito es una de las formas alotrópicas en las que se puede presentar el carbono (como el diamante y el grafeno). Los átomos se colocan en capas superpuestas formando hexágonos regulares. Es de color negro con brillo metálico, se exfolia con facilidad, es conductor y muy blando. 3.- Diagrama Fe-C Los aceros son aleaciones Fe-C, donde el carbono está en proporciones del 0,03 – 2,11 %. Son forjables. Las fundiciones son aleaciones Fe-C, donde el carbono está en proporciones del 2,11 – 6,67%. Son no forjables. El 6,67% C es la máxima proporción de carbono que se puede disolver. Al compuesto con este porcentaje 6,67% C, se le llama cementita. (Fe3C) 10 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Constituyentes de las aleaciones Fe-C Ferrita (α): prácticamente Fe α, tiene muy poca solubilidad ya que apenas disuelve carbono (máxima solubilidad es 0,02 % C). Cristaliza en la red CCB. Es el más blando y dúctil constituyente de los aceros. Es magnético. Se emplea en la fabricación de imanes permanentes, en núcleos de inductancias y transformadores. . Bobinado de ferrita para uso como transformador de corriente eléctrica C Cementita: Fe3C, tiene un 6;67% de carbono. La estructura cristalina es muy compleja, es del tipo ortorrómbica con 12 átomos de hierro y 4 átomos de carbono por celda. Es el más duro y frágil constituyente de los aceros. Tiene muy poca resiliencia y no es posible utilizarla para operaciones de laminado o forja Es magnético hasta los 210ºC. La cementita se llama primaria cuando se forma desde la fase líquida y secundaria si procede de austenita durante el enfriamiento lento. Y terciaria si se desprende de la ferrita al enfriarse por debajo de 910 ºC. Perlita: α + Fe3C, es la mezcla eutectoide de ferrita y cementita (86,5% de ferrita y 13,5% de cementita). Tiene propiedades intermedias. A 723ºC la solución sólida austenita origina en el enfriamiento dos nuevas fases sólidas (a esto se le llama reacción eutectoide) Austenita γ Ferrita α + cementita Fe3C 86,5% 13,5% perlita Austenita (γ): solución sólida de inserción de carbono en Fe γ, con un máximo porcentaje de carbono de 2,11%. Cristaliza en la red CCF Se forma con temperaturas superiores a 723ºC. Es blando, ductil, resistente, tenaz, no magnético y muy denso. La austenita no es estable a temperatura ambiente. Es blanda y dúctil y, en general, la mayoría de las operaciones de forja y laminado de aceros se efectúa a aproximadamente los 1100 ºC, cuando la fase austenítica es estable. Ledeburita: γ + Fe3C, es la mezcla eutectica de austenita y cementita (52% de austenita y 48% de cementita). Se da con un porcentaje de carbono del 4,3 %. Es un constituyente de las fundiciones. A 1130 ºC la aleación líquida, solidifica formando un sólido con dos fases (reacción eutéctica) Austenita γ + cementita Fe3C Líquido 48 % 52% ledeburita Es estable hasta los 723ºC, descomponiéndose a partir de esta temperatura en ferrita y cementita Martensita: Se obtiene por enfriamiento rápido de la austenita. A velocidades de enfriamiento bajas o moderadas, los átomos de C pueden difundirse hacia afuera de la estructura austenítica. 11 C TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz b c De este modo, los átomos de Fe se mueven ligeramente y se da una transformación de Fe γ en Fe α. Es una solución sólida sobresaturada de carbono en Fe α. Es el constituyente principal de los aceros templados. Tras la cementita, es el constituyente más duro de los aceros. La martensita se presenta en forma de agujas y cristaliza en la red tetragonal a Diagrama Fe-C Los cambios de estado del hierro y el acero se verifican cuando los cambios de temperatura son lentos, según se representa en el diagrama hierro-carbono. Tª (ºC) Línea de liquidus 1539 L = líquido γ = austenita L 1500 γ 1300 L+ γ 1130 910 α 723 700 500 γ + Fe3C γ+α Línea de solidus 723 α + Fe3C Perlita α + Fe3C 300 0,89 2,1 1 Hipoeutectoides 4,3 2 Hipereutectoides 3 Hipoeutéctico 4 6,67 5 6 7 %C Hipereutéctico Fundiciones Aceros - 1130 γ + Fe3C Ledeburita 1100 900 Fe3C = cementita L+ Fe3C En la zona L hay una sola fase, líquida y homogénea. En la zona L+γ hay dos fases, una de líquido y otra sólida austenita. En la zona γ, hay una fase sólida formada por austenita. En la zona α, hay una fase sólida formada por ferrita. En la zona L+Fe3C hay dos fases, una de líquido y otra de sólido cementita. En la zona γ+ Fe3C hay un sólido formado por dos fases austenita y cementita. En la zona α+ Fe3C hay un sólido formado por dos fases ferrita y cementita. Dependiendo de la zona la austenita y la cementita pueden ser primarias (proeutécticas) o secundarias (eutécticas) 12 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena - - - - - - Mª Jesús Saiz En los aceros hipoeutéctoides (<0,89%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • 2 fases: Líquido y sólido austenita • Fase sólida austenita • 2 Fases sólidas donde el hierro γ se transforma progresivamente en hierro α • A 723ºC toda la austenita se transforma en perlita y cementita • 2 Fases sólidas de ferrita primaria y perlita En los aceros eutéctoides (0,89%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • 2 fases: Líquido y sólido austenita • Fase sólida austenita • A 723ºC toda la austenita se transforma en perlita En los aceros hipereutéctoides (0,89% - 2,11%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • 2 fases: Líquido y sólido austenita • Fase sólida austenita • 2 Fases sólidas austenita y cementita • A 723ºC toda la austenita se transforma en perlita • 2 Fases sólidas de perlita y cementita En las fundiciones hipoeutécticas (2,11% - 4,3%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • 2 fases: Líquido y sólido austenita • 2 Fases sólidas austenita primaria y ledeburita • A 723ºC toda la austenita se transforma en perlita • 2 Fases sólidas de perlita y cementita En las fundiciones eutécticas (4,3%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • A 1130ºC se produce la transformación de la fase líquida en ledeburita. • A 723ºC toda la austenita eutéctica se transforma en perlita En las fundiciones hipereutécticas (>4,3%C) existen varias zonas según vamos bajando la temperatura • Fase líquida • 2 fases: Líquido y sólido cementita • 2 Fases sólidas ledeburita y cementita primaria • A 723ºC toda la austenita eutéctica se transforma en perlita • 2 Fases sólidas de perlita y cementita Para calcular la composición de cada una de las fases se emplea la regla de la horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca. 4.- Propiedades de los aceros Al disminuir el %C: dúctiles, maleables, tenaces, soldables Al aumentar el %C: resistentes, duros, frágiles. Son oxidables y corroibles. Densidad = 7,6 – 7,8 g/cm3 5.- Clasificación de los aceros En función del porcentaje de C: Aceros hipoeutectoides: del 0,03 – 0,89 %.C Aceros eutectoides: 0,89 %.C 13 TECNOLOGÍA INDUSTRIAL I1. Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Aceros hipereutectoides: del 0,89 – 2,1 %.C En función de su composición: Aceros al C: aleación de Fe – C y bajo porcentaje de otros elementos (según las normas). Aceros aleados: aleación de Fe – C e impurezas. Además, llevan de forma voluntaria otros elementos que modifican sus propiedades. • Aceros inoxidables: Cr, Ni. Acero galvanizado: Zn • Aceros de corte (muy duros): Wf • Aceros de alta dureza: Mo, Cr, Co • Aceros resistentes a la fatiga: Vanadio 6.- Propiedades de las fundiciones Son aleaciones férricas con un porcentaje de C mayor del 2,11%. No son forjables. Funden a temperatura inferior a los aceros por lo que se moldean con facilidad. No son dúctiles, no maleables, sueldan con dificultad. Menor densidad = 7,2 – 7,68 g/cm3 Tienen tendencia a la formación de grafito (carbono libre formando láminas o nódulos). 7.- Clasificación de las fundiciones En función del porcentaje de C: Fundiciones hipoeutéctica: del 2,11 – 4,3 %.C Fundiciones oeutécticas : 4,3 %.C Fundiciones hipereutéctica del 4,3 – 6,67 %.C 14