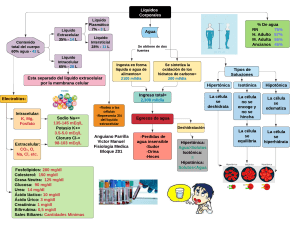
INFORME DE LABORATORIO DE BIOLOGÍA CELULAR Y MOLECULAR # TEMA: OSMOSIS EN ERITROCITOS. INTEGRANTES: BURGOS BETSY, LÓPEZ MATHIAS, PANTOJA SULLYN, ZAVALA GENESIS FECHA: 19 – 10 – 2022 GRUPO: 1 DOCENTE: BIÓL. IVONNE MORA M.SC. INTRODUCCIÓN y/o MARCO TEÓRICO La ósmosis es un fenómeno en el que un solvente pasa o se difunde a través de una membrana semipermeable que permite que el solvente, pero no el soluto, pase de una solución más diluida a una más concentrada. La capacidad del agua para atravesar la membrana plasmática como membrana semipermeable depende de la diferencia de concentración entre el líquido extracelular e intracelular. OBJETIVOS ● ● Comprender el fenómeno de la ósmosis en los glóbulos rojos. Distinguir entre soluciones hipotónicas, isotónicas e hipertónicas y su efecto en los eritrocitos. MATERIALES Y METODOLOGÍA EQUIPOS MATERIALES Microscopio Portaobjetos Cubreobjetos Lancetas desechables. Vaso precipitado Pipeta SUSTANCIA Agua destilada y Sal: Solución Hipertónica Solución Isotónica Solución Hipotónica MUESTRA Sangre diluida en distintas soluciones. Junto con agua destilada y distintas cantidades de sal en cada vaso precipitado, se prepararon las soluciones: Hipotónica, Isotónica e Hipertónica. Haciendo uso de lancetas desechables, se pudo conseguir tres muestras de sangre sobre portaobjetos distintos. Utilizando una pipeta y mondadientes se puso cierta cantidad de las soluciones en cada muestra y se mezcló. Llevamos la preparación a la platina y observamos las diferentes reacciones de la sangre con cada solución, haciendo uso de los distintos aumentos del microscopio, desde el menor aumento 4x al mayor 40x. Soluciones en vaso precipitado Punzada sobre la piel del dedo Muestra de sangre con las soluciones Observación de la muestra en el microscopio. Hipotónica Isotónica Hipertónica RESULTADOS Se observó las diferentes reacciones de los eritrocitos en cada una de las muestras, siendo que en la muestra con la solución Hipotónica, la mayoría de las células sanguíneas realizaron el fenómeno llamado Turgencia, el aumento de su volúmen. En la muestra Isotónica, no se observó reacción alguna, los eritrocitos se encontraban en un estado normal. Por último, en la solución Hipertónica se pudo observar la plasmólisis de los eritrocitos, fenómeno que provoca la disminución del volúmen de la célula. CONCLUSIONES Al finalizar la práctica, se logró observar las células sanguíneas frente a diferentes concentraciones de líquidos, llegando a comprender su comportamiento mediante la ósmosis. ACTIVIDADES DE BIOLOGÍA CELULAR Y MOLECULAR TEMA: LÍQUIDOS ISOTÓNICOS. INTEGRANTES: BURGOS BETSY, LÓPEZ MATHIAS, PANTOJA SULLYN, ZAVALA GENESIS FECHA: 19 – 10 – 2022 GRUPO: 1 DOCENTE: BIÓL. IVONNE MORA M.SC. LÍQUIDOS ISOTÓNICOS Una solución es isotónica cuando la concentración de las partículas disueltas en la misma es similar a la del plasma. Presentan una osmolaridad de 375 mosm/l, la presión osmótica es constante en el interior y el exterior de las células y estas no muestran aumento ni disminución de volumen. Dado que las soluciones isotónicas tienen la misma concentración de solutos que el plasma. Entre los distintos tipos de soluciones isotónicas están: • • Cloruro sódico al 0,9%. Solución Lactato de Ringer. • • Solución Dextrosa en agua al 5%. Solución de Ringer. SOLUCIÓN DE CLORURO SODICO AL 0,9% (ClNa al 0,9%) Constituido principal mente por agua salada y contiene únicamente agua, sodio (154 meq/l) y cloruro (154 meq/l). Se denomina ´Solución salina normal´ debido a que el porcentaje de cloruro sódico disuelto en la solución es similar a la concentración habitual de sodio y cloruro en el espacio intravascular. Se administra como tratamiento de las situaciones de disminución del líquido extracelular, tal como el déficit de volumen liquido secundario, una hemorragia, vómitos o diarrea. Entre los problemas clínicos tratados habitualmente con la perfusión de soluciones de cloruro sódico al 0,9% están: El Shock, La Hipotermia leve, La Acidosis Metabólica y la Hipercalcemia. Se debe utilizar con prudencia en ciertos pacientes tales como los que padecen de enfermedades renales o cardiacas por que puede haber la posibilidad de que se produzca una sobrecarga de volumen líquido. SOLUCIÓN DE LACTATO DE RINGER (LR) También conocida como Hartman, es la más adaptable desde el punto de vista fisiológico debido a que su contenido en electrolitos es parecido a la composición del suero y el plasma sanguíneo. Está compuesta de 130meq/l de sodio, 4 meq/l de potasio, 3 meq/l de calcio y 109 meq/l de cloruro. No contiene calorías ni magnesio y solo contiene una cantidad limitada de potasio. Se usa para la reposición de pérdidas de líquidos, también en pacientes con quemaduras y traumatismos. Se administra a los pacientes que presentan una hemorragia o una hipovolemia aguda. Tanto la solución de cloruro sódico al 0,9% y la solución lr son utilizadas para pacientes con necesidad de reposición de electrolitos. La LR se suda en pacientes con acidosis metabólica debido a que al ser metabolizada por el hígado lo convierte en lactato de bicarbonato la cual es una solución alcanizante. No debe ser usado en pacientes que no pueden metabolizar el lactato como los que son aquejados de una hepatopatía o los que presentan acidosis láctica. Se debe usar con prudencia en los pacientes con insuficiencia renal. LA SOLUCIÓN DE RINGER Muy similar a LR sin embargo no contiene lactato. Se utiliza en situaciones similares a la solución LR pero carece de contradicciones en lo que se refiere al lactato. No obstante, dado a que no es un compuesto alcanizante, puede no estar indicada para pacientes con acidosis metabólica. LA SOLUCIÓN DE DEXTROSA AL 5% EN AGUA Puede ser clasificada como isotónica e hipotónica. La dextrosa hace que esta solución sea muy similar a el líquido intravascular, lo que la convierte en una solución isotónica. Sin embargo, la dextrosa es metabolizada rápidamente por el organismo de manera que en el plasma no quedan partículas osmóticamente activas. La solución D en agua proporciona agua libre la cual no está fijada y es de un tamaño suficiente mente pequeño para atravesar los poros de las membranas hasta alcanzar los espacios intracelulares y extracelulares. La solución de Dextrosa proporciona agua libre a los riñones facilitando la excreción renal de los solutos. Dado a que esta proporciona agua libre al metabolismo también es considerada una solución hipotónica. La solución d en agua es básicamente una solución de azúcar en agua que aporta 170 calorías/l , pero no permite la reposición de los electrolitos. Esta es adecuada para el tratamiento de la hipertermia, ya que diluye el sodio existente en el compartimiento extracelular. La solución D en agua no se debe utilizar como método único de tratamientos de déficit de volumen de líquidos debido a que diluye las concentraciones plasmáticas de los electrólitos. No se debe de usar en: • • • Reanimación (Debido a que esta no se mantiene en el espacio intravascular) El periodo postoperatorio inicial (Dado a que el organismo puede aumentar la secreción de la hormona antidiurética) Pacientes con crecimiento de presión intracraneal o con sospechas (debido a sus propiedades Hipotónicas) LA SOLUCION D EN AGUA NO REPRESENTA UNA FORMA DE NUTRICIÓN A LARGO PLAZO. BIBLIOGRAFIA 1. Wayne M. Becker Lewis J. Kleinsmith Jeff Hardin. El mundo de la Célula, Becker Wayne. Ribera del Loira, 28 28042 Madrid (España): PEARSON EDUCACIÓN, S. A; 2007.