Examen QG Medicina - Enlaces, Nomenclatura, Configuración Electrónica
Anuncio

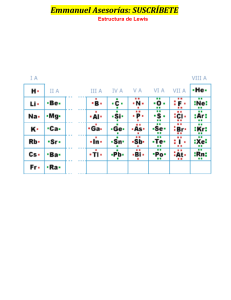
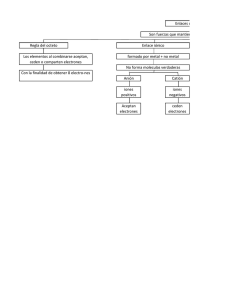
UNIVERSIDAD NACIONAL DE PIURA EXAMEN PARCIAL - 2 QG/Medicina NOMBRE Y APELLIDOS: ___________________________________________________ ESCUELA PROFESIONAL: __________________________________________________ AULA/GRUPO: ______________ FECHA: 31/08/2022 I. MARCAR CON UN ASPA O UNA CRUZ LA ALTERNATIVA CORRECTA (1 pto cada una). 1. Señale el compuesto que solo posee enlace covalente: a) KCl b) CaCO3 c) H2SO4 d) KNO3 e) BaO 2. Indicar Verdadero o Falso en los enunciados siguientes: I. El estado de oxidación del Peróxido de Hidrogeno es -1. II. La afinidad electrónica y la electronegatividad son fuerza de atracción. III. El Hidrogeno cumple con la regla del octeto. IV. Existen tres tipos de nomenclatura: Sistemático, stock y IUPAC. a) VFFF b) VVFF c) VFFV d) FFFV e) FFFF 3. Indicar la respuesta correcta: a) Fe3O4 : Tetróxido de trihierro. b) Pb3O4 : Óxido doble de Plomo. c) Pb(OH)2 : Hidróxido de Plomo. d) HCl : Cloruro de Hidrógeno. a) VVFF b) VFVF c) FFVV d) VVFV e) N.A. 4. Indicar Verdadero o Falso en los enunciados siguientes: I. El estado de Oxidación es una energía positiva, negativa o cero. II. El ion sulfato tiene 30 electrones de valencia. III. En el enlace dativo o covalente coordinado el par de electrones compartidos es proporcionado por un solo átomo. IV. En el enlace iónico hay trasferencia completa de electrones de un átomo a otro. a) VFFF DOCENTE: Ing. FERNANDO ALFARO JIMENEZ b) VVFF c) FFVV d) FFFV e) FFFF EP2/QG1/Med/UNP UNIVERSIDAD NACIONAL DE PIURA EXAMEN PARCIAL - 2 QG/Medicina 5. Al determinar la estructura molecular del Cloruro de Amonio (NH4Cl), podemos afirmar que no presenta: a) Enlace iónico. b) Enlace coordinado. c) Enlace covalente simple. d) Enlace covalente doble. e) Enlace covalente polar. II. DESARROLLAR LOS PROBLEMAS PROPUESTOS (3 ptos cada uno): 6. Un elemento “X” está constituido por átomos en cuya envoltura electrónica existe 10 electrones a los que corresponde n=5 y l=3. Desarrollar su configuración electrónica e indicar número atómico, Periodo y familia. 7. Un elemento químico posee 2 isótopos cuyos números de masa suman 68 y presentan en total 38 neutrones. Señale número atómico, configuración electrónica y la ubicación del elemento en la tabla periódica. 8. Escriba los nombres sistémicos de los compuestos siguientes: a) CuFeS2 : b) As2S3 : c) Na3AlF6 : d) NaBH4 : e) N2O : f) P2H4 : 9. Desarrollar la configuración electrónica y números cuánticos del último electrón de un elemento que se encuentra en el cuarto periodo y grupo VA. 10. Determine el estado de oxidación del carbono, nitrógeno y azufre en los compuestos siguientes: a) Glucosa: C6H12O6 : b) Ácido de Hidrógeno: HN3 : c) Peroxidisulfato de Potasio: K2S2O8 : DOCENTE: Ing. FERNANDO ALFARO JIMENEZ EP2/QG1/Med/UNP