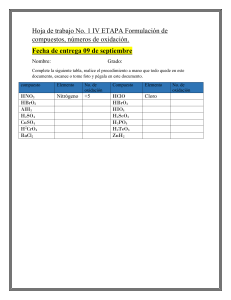
Unidad 7 Volumetría de Óxido Reducción Mg Helen Arias B. Óxido Reducción Introducción Mg Helen Arias B. Electroquímica • El concepto de estado de oxidación es una guía muy útil respecto a los cambios que se producen durante las reacciones químicas. • Entre las reacciones químicas más comunes e importantes están aquellas que implican cambios en el estado de oxidación de los átomos. • Por ej: Zn(s) + 2H+(ac) → Zn2+(ac) + H2(g) • Estado de oxidación del cinc: ↑ de 0 en Zn(s) a +2 en el Zn2+(ac) • Estado de oxidación del hidrógeno: ↓ de +1 en el H+(ac) a 0 en el H2(g) • Las reacciones químicas en las cuales el estado de oxidación de una o más sustancias cambia se llaman reacciones de oxidación- reducción o reacciones redox. Mg Helen Arias B. • La oxidación se refiere a la pérdida de electrones. • La reducción se refiere a la ganancia de electrones. • Las reacciones de oxidación-reducción implican la transferencia de electrones del átomo que se oxida al átomo que se reduce. (*) • La transferencia de electrones que ocurre durante las reacciones de oxidación-reducción se puede usar para producir energía eléctrica. La electroquímica es la rama de la química que se ocupa de las relaciones entre la electricidad y las reacciones químicas. Mg Helen Arias B. Reacciones de oxidación-reducción • ¿Cómo determinar si una reacción química dada es una reacción de oxidaciónreducción? • ... llevando la cuenta del número de oxidación de todos los elementos que participan en la reacción. Zn(s) + 2H+(ac) → Zn2+(ac) + H2(g) 0 +1 +2 0 • En otras reacciones, los estados de oxidación cambian, pero no podemos decir que alguna sustancia gana o pierde literalmente electrones. • Por ej: 2H2(g) + 0 O2(g) → 2H2O(g) 0 +1 -2 • ... la ecuación es una reacción de oxidación-reducción, sin embargo como el agua no es una sustancia iónica, no hay una transferencia completa de electrones del hidrógeno al oxígeno cuando se forma agua. Mg Helen Arias B. Si una sustancia se oxida, entonces otra se debe de reducir La sustancia que hace posible que otra sustancia se oxide se llama agente oxidante(oxidante). El agente oxidante quita electrones a otra sustancia adquiriéndolos el mismo; por lo tanto, el agente oxidante se reduce. Un agente reductor (reductor), es una sustancia que cede electrones, con lo cual hace que otra sustancia se reduzca. El agente reductor se oxida durante el proceso. Mg Helen Arias B. Oxidante + e Acepta electrones ↔ Reductor Cede electrones Se reduce Se oxida Disminuye su estado de oxidación Aumenta su estado de oxidación Mg Helen Arias B. Balanceo de ecuaciones de oxidación-reducción • Cuando balanceamos ecuaciones de oxidación- reducción existe un requisito adicional: además de obedecer la ley de la conservación de la masa (la cantidad de cada elemento debe ser la misma en ambos lados de la ecuación), la ganancia y pérdida de electrones debe estar balanceada (si una sustancia pierde un cierto número de electrones durante una reacción, entonces otra debe ganar ese mismo número de electrones). Mg Helen Arias B. Medias reacciones (semireacciones) − La oxidación y la reducción se llevan a cabo simultáneamente... Por ej: Sn2+(ac) + 2Fe3+(ac) → Sn4+(ac) + 2Fe2+(ac) …considerar dos procesos: (1) la oxidación del Sn2+ (2) la reducción del Fe3+ • Oxidación: Sn2+(ac) → Sn4+(ac) + 2e− (Productos) • Reducción: 2Fe3+(ac) + 2e− → 2Fe2+(ac) (Reactivos) Mg Helen Arias B. • Las ecuaciones que muestran solamente la oxidación o la reducción se llaman medias reacciones. • En la reacción redox global, el # de e− que se pierden en la media reacción de oxidación debe ser igual al # de e− que se ganan en la media reacción de reducción. • ⇒ Los electrones de cada lado se cancelan cuando las dos medias reacciones se suman para dar la ecuación global redox balanceada. Mg Helen Arias B. Balances redox ¿Como se balancea una reacción en la que se oxida el Fe2+ a Fe3+ mediante Cr2O72- en una solución ácida? 1. Escribir la ecuación sin balancear en forma iónica. Fe2+ + Cr2O72- Fe3+ + Cr3+ 2. Separar la ecuación en dos semireacciones. +2 Oxidación: +3 Fe2+ Fe3+ Reducción: Cr2O72- Cr3+ +6 +3 3. Balancear por inspección todos los elementos que no sean ni oxígeno ni hidrógeno en las dos semireacciones. Cr2O72- 2Cr3+ Mg Helen Arias B. 4. Para reacciones en medio ácido, agregar H2O para balancear los átomos de O y H+ para balancear los átomos de H. Cr2O7214H+ + Cr2O72- 2Cr3+ + 7H2O 2Cr3+ + 7H2O 5. Agregar electrones en el lado apropiado de cada una de las semireacciones para balancear las cargas. Fe2+ Fe3+ + 1e6e- + 14H+ + Cr2O722Cr3+ + 7H2O 6. Si es necesario, igualar el número de electrones en las dos semireacciones multiplicando cada una de las reacciones por un coeficiente apropiado. 6Fe2+ 6e- + 14H+ + Cr2O72- 6Fe3+ + 6e2Cr3+ + 7H2O Mg Helen Arias B. 7. Unir el lado izquierdo de una semireacción con el lado izquierdo de la otra y el derecho con el derecho y eliminar lo que sea posible. El número de electrones en ambas partes debe cancelarse. Oxidación: 6Fe2+ Reducción: 6e- + 14H+ + Cr2O7214H+ + Cr2O72- + 6Fe2+ 6Fe3+ + 6e2Cr3+ + 7H2O 6Fe3+ + 2Cr3+ + 7H2O 8. Verificar que el número de átomos y las cargas estén balanceadas. 14x1 – 2 + 6x2 = 24 = 6x3 + 2x3 Mg Helen Arias B.