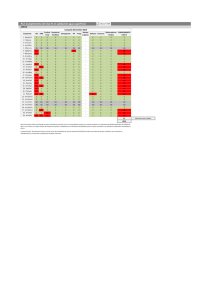
8/7/22, 16:01 D'Armas Regnault Revista Cubana de Plantas Medicinales, Vol. 22, No. 2 (2017) ARTÍCULO ORIGINAL Composición química de los aceites esenciales de las hojas de ocho plantas medicinales cultivadas en Ecuador Chemical composition of essential oils from leaves of eight medicinal plants grown in Ecuador Haydelba D'Armas,I,II Karen Montesinos,II Carmita Jaramillo JaramilloII y Ricardo LeónII I Facultad de Ciencias de la Ingeniería, Universidad Estatal de Milagro. Guayas, Ecuador. II Planta Piloto de Farmacia, Facultad de Ciencias Químicas y Salud, Universidad Técnica de Machala. Machala, Ecuador. RESUMEN Introducción: La composición química del aceite esencial depende de la especie vegetal, por ejemplo, su procedencia, condiciones geobotánicas y agrícolas del cultivo, y de los métodos de extracción. En muchos países se estudian las composiciones de estos aceites que tienen gran utilidad en las industrias farmacéutica, biocida, tabacalera, alimentaria y petroquímica. Objetivos: Extraer y caracterizar los aceites esenciales de ocho especies de uso medicinal en el Ecuador. Métodos: Se extrajeron por hidrodestilación y se caracterizaron mediante cromatografía de gases acoplada a espectrografía de masas los aceites esenciales de las hojas frescas de las plantas Cymbopogon citratus (DC.) Stapf (Poaceae), Lippia citriodora K (Verbenaceae), Melissa officinalis L (Lamiaceae), Artemisia absinthium L (Asteraceae), Ageratum conyzoides L (Asteraceae), Ambrosia artemisiifolia L (Asteraceae), Piper carpunya Ruiz & Pav (Piperaceae) y Eucalyptus globulus L (Myrtaceae) . www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 1/15 8/7/22, 16:01 D'Armas Regnault Resultados: Las familias de los compuestos químicos encontrados en mayor proporción fueron: monoterpenos oxigenados en C. citratus (87,88 %), L. citriodora (80,13 %), M. officinalis (64,17 %), A. absinthium (70,83 %), A. conyzoides (46,15 %), P. carpunya (60,44 %) y E. globulus (74,05 %); sesquiterpenos (77,55 %) en A. artemisiifolia y derivados oxigenados de sesquiterpenos en A. conyzoides (16,31 %). Los metabolitos secundarios más abundantes en sus respectivos aceites esenciales fueron: geranial en C. citratus (31,23 %), L. citriodora (42,09 %) y M. officinalis (24,29 %); acetato de mirtenilo (33,82 %) y tujona (34,70 %) en A. absinthium; cetona de artemisilo (16,38 %) y verbenona (12,76 %) en A. conyzoides; himachaleno (42,66 %) en A. artemisiifolia; piperitona (50,96 %) en P. carpunya y eucaliptol (69,92 %) en E. globulus. Conclusiones: El estudio realizado brinda información novedosa sobre la composición química de los aceites esenciales de ocho especies usadas tradicionalmente en la medicina popular de Ecuador. Esta información será útil desde el punto de vista taxonómico e importante para interpretar la actividad biológica de estas espcies. Palabras clave: aceites esenciales; composición química; Cymbopogon citratus (DC.); Lippia citriodora K; Melissa officinalis L; Artemisia absinthium L; Ageratum conizoides L; Ambrosia artemisiifolia L; Piper carpunya Ruiz & Pav; Eucalyptus globulus L. ABSTRACT Introduction: Chemical composition of an essential oil depends on the plant species involved, i.e. its place of origin, geobotanical and agricultural cultivation conditions, and extraction procedures. Studies are conducted in many countries about the composition of these oils, due to their great usefulness in the pharmaceutical, biocide, tobacco, food and petrochemical industries. Objectives: Extract and characterize essential oils from eight species of medicinal use in Ecuador. Methods: Essential oils from fresh leaves of the plants Cymbopogon citratus S (Opaceae), (DC.) Stapf (Poaceae), Lippia citriodora K (Verbenaceae), Melissa officinalis L (Lamiaceae), Artemisia absinthium L (Asteraceae), Ageratum conyzoides L (Asteraceae), Ambrosia artemisiifolia L (Asteraceae), Piper carpunya Ruiz & Pav (Piperaceae) and Eucalyptus globulus L (Myrtaceae) were extracted by hydrodistillation and characterized by gas chromatography/mass spectrometry. Results: The chemical compounds found in the largest proportion were: oxygenated monoterpenes in C. citratus (87.88 %), L. citriodora (80.13 %), M. officinalis (64.17 %), A. absinthium (70.83 %), A. conyzoides (46.15 %), P. carpunya (60.44 %) and E. globulus (74.05 %); sesquiterpenes (77.55 %) in A. artemisiifolia; and oxygenated sesquiterpene derivatives in A. conyzoides (16.31 %). The secondary metabolites most abundantly found in the corresponding essential oils were geranial in C. citratus (31.23 %), L. citriodora (42.09 %) and M. officinalis www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 2/15 8/7/22, 16:01 D'Armas Regnault (24.29 %); myrtenyl acetate (33.82 %) and thyjone (34.70 %) in A. absinthium L; artemisyl ketone (16.38 %) and verbenone (12.76 %) in A. conyzoides; himachalene (42.66 %) in A. artemisiifolia; piperitone (50.96 %) in P. carpunya; and eucaliptol (69.92 %) in E. globulus. Conclusions: The study conducted has contributed updated information about the chemical composition of essential oils from eight species traditionally used in folk medicine in Ecuador. This information will be useful for taxonomic purposes and important to interpret the biological activity of the study species. Key words: essential oils, chemical composition, Cymbopogon citratus S (DC.), Lippia citriodora K, Melissa officinalis L, Artemisia absinthium L, Ageratum conizoides L, Ambrosia artemisiifolia L, Piper carpunya Ruiz & Pav, Eucalyptus globulus L. INTRODUCCIÓN Los aceites esenciales son las fracciones líquidas volátiles que se obtienen generalmente de las hojas. Son mezclas complejas de metabolitos secundarios caracterizados por un fuerte olor, por lo general con densidades menores que la del agua, destilables, que contienen las sustancias responsables del aroma de las plantas; se biosintetizan y acumulan en las plantas aromáticas y tienen una amplia gama de aplicaciones en las industrias farmacéutica, cosmética, alimentaria y agrícola.1,2 La composición química del aceite esencial depende, por una parte, de la especie vegetal: su procedencia, condiciones geobotánicas y agrícolas del cultivo; y por otra, de los procedimientos de extracción: duración y temperatura del método de obtención utilizado.3 Actualmente, en Europa, Asia y en algunos países de América Latina se estudia la composición de estos aceites por su gran utilidad en las industrias farmacéutica, biocida, tabacalera, alimentaria y petroquímica.4 La mayoría de las especies del género Lippia (Verbenaceae) se usan tradicionalmente como remedios para tratar trastornos gastrointestinales y respiratorios. Los compuestos de los aceites esenciales y los compuestos fenólicos son los responsables de las actividades antipalúdicas, antivirales y citostáticas de algunas de estas especies.5 Por su parte, las plantas del género Melissa (Lamiaceae) son muy utilizadas en diversas preparaciones aromáticas por sus propiedades carminativas y sedantes, como estimulante digestivo, y se indican en el tratamiento de espasmos gastrointestinales, y sus hojas tienen actividad antibacteriana y antiviral.6 www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 3/15 8/7/22, 16:01 D'Armas Regnault Las especies del género Piper (Piperaceae) se usan en la medicina tradicional en Latinoamérica y en la región de las Indias occidentales. Algunas poseen propiedades biológicas y farmacológicas7 y se han caracterizado los aceites esenciales de estas plantas y se han evaluado sus propiedades bioactivas: antimutagénica, antibacteriana, antioxidante y larvicida, entre otras.8 Las especies del género Cymbopogon (Poaceae) se usan ampliamente en la medicina tradicional para el tratamiento de enfermedades nerviosas y gastrointestinales; también se utilizan como antiespasmódica, analgésica, antiinflamatoria, antipirética, diurética y sedativa.9,10 Las especies del género Ambrosia (Asteraceae) crecen en sitios con temperaturas bajas, como serranías y cordilleras, y pocas se localizan en regiones costeras y en llanuras. Se han realizado estudios que demostraron la propiedad antioxidante del extracto de las hojas de A. artemisiifolia11 y su relación con el contenido de los flavonoides y polifenoles; así como la actividad antibacteriana del aceite esencial de A. peruviana.12 Los aceites esenciales de las especies del género Artemisia (Asteraceae) siempre han tenido interés para químicos y taxonomistas por la importancia medicinal e industrial y por la composición química heterogénea de algunas variedades de estas especies y sus quimiotipos.13 La actividad antibacteriana y fungicida del aceite esencial de A. absinthium ha sido descrita por Kordali y otros.14 El género Ageratum (Asteraceae) abarca plantas herbáceas con usos medicinales tradicionales en muchos países del mundo.15 Un estudio reciente del aceite esencial de Ageratum conyzoides demostró su actividad antiaflatoxigénica y antioxidante, y los compuestos más representativos de dicho aceite son los monoterpenoides y sesquiterpenoides.16 El género Eucalyptus (Myrtaceae) agrupa un número de especies usadas en su mayoría en la medicina tradicional de Latinoamérica para el tratamiento del resfriado y de las infecciones bronquiales. Los aceites esenciales de algunas especies de este género (Eucalyptus citriodora, Eucalyptus tereticornis y Eucalyptus globulus) tienen efecto antiinflamatorio y analgésico.17 El objetivo de la investigación fue extraer los aceites esenciales de las hojas de 8 especies de plantas de uso medicinal en Ecuador: Cymbopogon citratus (DC.) Stapf, Lippia citriodora K, Melissa officinalis L, Artemisia absinthium L, Ageratum conyzoides L, Ambrosia artemisiifolia L, Piper carpunya Ruiz & Pav y Eucalyptus globulus L y caracterizarlos mediante cromatografía de gases acoplada a espetrometría de masas. Los resultados constituirán un aporte al conocimiento de la composición química de estas especies diseminadas en las latitudes ecuatorianas. www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 4/15 8/7/22, 16:01 D'Armas Regnault MÉTODOS Recolección del material vegetal Las muestras de material vegetal de Cymbopogon citratus S (DC.) (Poaceae), Lippia citriodora K (Verbenaceae), Melissa officinalis L (Lamiaceae), Artemisia absinthium L (Asteraceae), Ageratum conyzoides L (Asteraceae), Ambrosia artemisiifolia L (Asteraceae), Piper carpunya Ruiz & Pav (Piperaceae) y Eucalyptus globulus L (Myrtaceae) se recolectaron al azar en ecosistemas naturales de las localidades de Machala y Santa Rosa (provincia de El Oro: 6585 % de humedad relativa y temperatura promedio de 26 °C) y de Cuenca (provincia de Azuay: 82 % de humedad relativa y temperatura promedio de 21 °C), Ecuador, en abril y mayo de 2014 (periodo de lluvia). Se procesaron en el laboratorio, sin almacenamiento previo, para obtener sus aceites. Los ejemplares fueron identificados por el botánico Jesús Inca y archivados en la planta piloto de la farmacia de la Universidad Técnica de Machala con los registros PPFC014, PPFLC015, PPFMO016, PPFAA017, PPFAC018, PPFAA019, PPFPC020 y PPFEG021, respectivamente. Obtención de los aceites esenciales Dos horas después de trasladadas las muestras al laboratorio, las hojas frescas se cortaron en pequeños trozos hasta completar 200 g, se lavaron con agua destilada y se sometieron a hidrodestilación con adición de 2 L de agua destilada en un balón con capacidad para 4 L. Al cabo de 2 h aproximadamente, el aceite obtenido se separó de la capa acuosa mediante disolución y extracción tres veces con 3 mL de cloroformo al 100 % usando un embudo de separación. La fase orgánica extraída se secó con sulfato de sodio anhidro, el solvente se evaporó en un rotaevaporador marca Hidolph a presión reducida (11 mbar) y a 40 °C para obtener los aceites esenciales libres en el solvente, lo cual se evidenció en los análisis cromatográficos realizados posteriormente. Determinación de la composición química de los aceites esenciales Se identificaron los componentes de cada uno de los aceites esenciales mediante cromatografía de gases acoplada a espectrometría de masas (CG/EM). Para separar los componentes se preparó una solución con 50 µL del aceite disueltos en 1 mL de cloroformo puro grado HPLC, posteriormente se inyectó 1 µL de la solución en un cromatógrafo de gases marca Agilent Technologies modelo 7890 con fuente de ionización por impacto electrónico de 70 eV equipado con una columna de metil-silicona de 30 m x 250 μm x 0,25 μm y acoplado a un detector de masas cuadrupolo simple marca Agilent modelo 5975C. La temperatura inicial del www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 5/15 8/7/22, 16:01 D'Armas Regnault horno fue 30 °C, luego se incrementó hasta 290 °C a un ritmo de 25 °C/min. Los experimentos se realizaron por triplicado. La cantidad de aceite esencial de cada una de las plantas se determinó sobre la base de las áreas relativas de cada pico, según el criterio cromatográfico. La identificación de los componentes de los aceites esenciales se realizó por comparación computarizada de los espectros de masas obtenidos con la base de datos de la librería espectral de masas NIST 08. RESULTADOS Rendimiento de los aceites esenciales Los aceites esenciales de las hojas de las especies C. citratus, L. citriodora, M. officinalis, A. absinthium, A. conyzoides, A. artemisiifolia, P. carpunya y E. globulus se obtuvieron con rendimientos de extracción de 0,2459 (491,8 mg); 0,0091 (18,2 mg); 0,0063 (12,6 mg); 0,0327 (65,4 mg); 0,0424 (84,8 mg); 0,0071 (14,2 mg); 0,0096 (19,2 mg) y 0,0222 % (44,4 mg), respectivamente (tabla 1). Tabla 1. Composición química de los aceites esenciales de las hojas de las plantas en estudio Constituyentes A. abs. C. cit. E. glo. L. cit. P. M. off. A. art. car. Monoterpenos 4-tujeno 1,08 β-mirceno 1,07 3,28 a-pineno 3,54 D-limoneno 1,52 4,32 α-terpinoleno 4,67 β-pineno tujona acetato de mirtenilo 10 34,7 0,41 33,82 (1S,4S,5R)-(+)-3-tujanona 1,31 3-tujol 0,94 citronelal 3,07 2,97 citronelol 1,68 2,28 neral o citral B 18,77 23,4 12,11 trans-geraniol 31,55 7,71 21,11 geranial o citral A 31,23 42,04 24,29 www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 6/15 8/7/22, 16:01 D'Armas Regnault cis-geraniol o nerol eucaliptol 1,98 4,82 69,92 α-terpineol 1,52 α-acetato de terpenilo 1,61 acetato de geranilo 0,61 2,16 7,15 cis-4-tujanol 2,03 linalol 5,65 trans-2-caren-4-ol 1,01 piperitona 50,96 β-acetato de terpinilo 0,79 (-)-cis-verbenol 2,07 acetato de verbenilo 1,1 acetato de bornilo 2,01 cetona de artemisilo verbenona Sesquiterpenos isoledeno 2,37 aromadendreno 0,65 alloaromadendreno 0,76 nerolidol 3,71 0,82 β-cariofileno 6,45 (Z,E)-α-farneseno 0,9 cubebeno 14,9 (-)-γ-elemeno 17,87 carotol 0,64 veridiflorol 1,41 zingibereno 1,22 (Z)-cariofileno τ-cadinol cis-nerolidol óxido de cariofileno himachaleno 42,66 Aromáticos α-curcumeno www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 1,42 7/15 8/7/22, 16:01 D'Armas Regnault p-cimeno 3,77 safrol 2,46 o-metilisoeugenol 3,77 eugenol Otros metabolitos secundarios 1,3-bis-(2-ciclopropil-2-metilciclo propil)-but-2-en-1-ona 1,9 3,3-dimetil-6-metilenciclohexeno 0,62 1-octen-3-ol ciclooctanocarboxialdehido duroquinona 3-undecino Total Rendimiento 3,51 71,85 89,35 81,89 87,98 79,43 93,15 86,42 0,0327 0,246 0,0222 0,009 0,01 0,0063 0,0071 a: expresados en porcentaje; A. abs: Artemisia absinthium L; C. cit: Cymbopogon citratus; E. glo: Eucalyptus globulus; L. cit: Lippia citriodora; P. car: Piper carpunya; M. off: Melissa officinalis; A. art: Ambrosia artemisiifolia; A. con: Ageratum conyzoides. Composición química de los aceites esenciales Los porcentajes totales (m/m) de los componentes de los aceites esenciales de las hojas de A. absinthium, C. citratus,E. globulus, L. citriodora, P. carpunya, M. officinalis, A. artemisiifolia y A. conyzoides, fueron 71,85; 89,35; 81,89; 87,98; 79,43; 93,15; 86,42 y 77,03 %, respectivamente (Ver tabla 1). Las cantidades de los diferentes compuestos químicos presentes en los aceites esenciales que se obtuvieron de las hojas de las ocho plantas en estudio se muestran en la tabla 2. La familia química predominante en todas las esencias evaluados correspondió a los derivados oxigenados de monoterpenos, con excepción del aceite de A. artemisifolia que mostró más abundancia de compuestos volátiles de estructura sesquiterpenoide (77,55 %) y menos cantidad de monoterpenos oxigenados (6,20 %). Los aceites esenciales de A. absinthium, C. citratus, E. globulus, P. carpunya y M. officinalis están integrados casi en su totalidad por derivados oxigenados de monoterpenos (70,83; 87,88; 74,05; 60,00 y 64,17%) y por poca cantidad de monoterpenos (1,08; 1,07; 5,06; 8,99 y 13,28 %) (tabla 2). Sin embargo, el aceite de P. carpunya tiene un 10 % de derivados aromáticos, mientras que el de M. officinalis tiene un 6,45 % de sesquiterpenos. www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 8/15 8/7/22, 16:01 D'Armas Regnault Por su parte, el aceite de L. citriodora está constituido por derivados oxigenados de monoterpenos (80,13 %) y sesquiterpenos en menor proporción (4,53 %), mientras que el aceite de A. conyzoides contiene derivados oxigenados de monoterpenos (46,15 %) y sesquiterpenos (16,31 %), pero también metabolitos secundarios volátiles con estructura no terpenoidal (12,33 %). El análisis del aceite esencial de las hojas de A. absithium arrojó como compuestos mayoritarios 4-tujeno (1,08 %), tujona (34,70 %), tujanona (1,31 %), acetato de mirtenilo (33,82 %) y tujol (0,94 %); y el de C. citratus, β -mirceno (1,07 %), citronelal (3,07 %), citronelol (1,68 %), neral o citral B (18,77 %), transgeraniol (31,15 %), geranial o citral A (31,23 %) y cis geraniol o nerol (1,98 %). Los componentes mayoritarios del aceite esencial de las hojas de E. globulus son los compuestos α-pineno (3,54 %), D-limoneno (1,52 %), 1,8-cineol o eucaliptol (69,92 %), α-terpineol (1,52 %), α-acetato de terpenilo (1,61 %), isoledeno (2,37 %), aromadendreno (0,65 %) y alloaromadendreno (0,76 %); mientras que los correspondientes a L. citriodora son nerol (4,82 %), neral (23,40 %), trans -geraniol (7,71 %), geranial (42,04 %), acetato de geranilo (2,16 %), α-curcumeno (1,42 %), nerolidol (0,82 %), alloaromadendreno (3,71 %) y 1,3-bis-(2ciclopropil-2-metilciclopropil)-but-2-en-1-ona (1,90 %). Por su parte, el aceite esencial de las hojas de P. carpunya está compuesto principalmente por α-terpinoleno (4,67 %), p-cimeno (3,77 %), D-limoneno (4,32 %), linalol (5,65 %), cis-4-tujanol (2,03 %), trans-2-caren-4-ol (1,01 %), piperitona (50,96 %), safrol (2,46 %), acetato de terpinilo (0,79 %) y o-metilisoeugenol (3,77 %). En la esencia de M. officinalis, los componentes en mayor proporción fueron β-mirceno (3,28 %), β-pineno (10,00 www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 9/15 8/7/22, 16:01 D'Armas Regnault %), citronelal (2,97 %), 3-undecino (3,51 %), citronelol (2,28 %), neral (12,11 %), trans-geraniol (21,11 %), geranial (24,29 %), acetato de geranilo (7,15 %) y β-cariofileno (6,45 %). Los aceites esenciales de las hojas de A. artemisiifolia y A. conyzoides mostraron en mayor cantidad trece compuestos químicos: A. artemisiifolia consta de eucaliptol (0,61 %), tujona (0,41 %), 3,3-dimetil-6-metilenciclohexeno (0,62 %), cis-verbenol (2,07 %), acetato de bornilo (2,01 %), acetato de verbenilo (1,10 %), α-farneseno (0,90 %), cubebeno (14,90 %), γ-elemeno (17,87 %), carotol (0,64 %), veridiflorol (1,41 %), zingibereno (1,22 %) e himachaleno (42,66 %), mientras que los componentes mayoritarios del aceite esencial de A. conyzoides fueron: 1-octen-3-ol (6,34 %), linalol (6,90 %), cetona de artemisilo (16,38 %), α-terpineol (2,03 %), verbenona (12,76 %), piperitona (8,08 %), duroquinona (2,71 %), eugenol (1,22 %), (Z)-cariofileno (1,02 %), ciclooctanocarboxaldehido (3,28 %), τcadinol (1,72 %), nerolidol 1 (2,67 %) y óxido de cariofileno (11,92 %). DISCUSIÓN De acuerdo con los rendimientos obtenidos, C. citratus, A. absinthium, A. conyzoides y E. globulus biosintetizan mayor cantidad de aceites esenciales en comparación con las restantes especies de acuerdo con los rendimientos obtenidos. La habilidad para sintetizar metabolitos secundarios está en función de las necesidades de cada planta ya que estos se acumulan en sus órganos y desempeñan una importante función como mecanismo de defensa contra patógenos y herbívoros.1 Las plantas aromáticas estudiadas pertenecen a distintos géneros y familias taxonómicas (Poaceae, Asteraceae, Myrtaceae, Verbenaceae, Piperaceae y Lamiaceae), por lo cual responden de forma distinta al medio ambiente, y biosintetizan familias químicas en cantidades diferentes para su interacción ecológica.18 Los derivados oxigenados de los monoterpenos predominan en la mayoría de los aceites esenciales de las especies estudiadas (tabla 2) con excepción del aceite de A. artemisiifolia, el cual mostró abubdancia de sesquiterpenos. Sin embargo, estudios anteriores mencionan a los monoterpenos limoneno, alfa-pineno y mirceno como componentes principales del aceite de A. artemisiifolia, el cual presenta actividad bactericida y fungicida significativa contra varios microrganismos estudiados.19 Ciertas especies del género Artemisia producen compuestos antipalúdicos, y el compuesto aislado artemisinina extermina selectivamente las células del cáncer de mama en humanos.20 El aceite esencial analizado de A. absinthium mostró los monoterpenos tujona y el acetato de mirtenilo como componentes mayoritarios, en comparación con el alcanfor y el artemiseole www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 10/15 8/7/22, 16:01 D'Armas Regnault reportados como los componentes principales en otras especies del mismo género.14 La abundancia de monoterpenos, y en especial la abundancia de los derivados oxigenados de monoterpenos (tabla 2), así como la de algunos de los compuestos identificados en el aceite esencial de C. citratus (tabla 1), en especial neral, geraniol y geranial, se han descrito previamente en el aceite esencial de las hojas de esta especie recolectada en Cuba 21, y presentaron actividad biológica variada: antibacteriana contra la cepa Propioni bacterium acnes y repelente de insectos contra Tribolium castaneum. Por su parte, los aceites esenciales de L. citriodora y M. officinalis se comportan de forma similara similar entre ellos, en cuanto a la elevada cantidad de derivados oxigenados de monoterpenos (tablas 1 y 2), por lo que podrían mostrar actividades biológicas semejantes, tales como antimicrobiana (contra cepas grampositivas y gramnegativas, y hongos), antioxidante y citotóxica, reportadas en la literatura para L. citriodora,22 y citotóxica y fuerte actividad antibacteriana (contra cepas grampositivas) y actividad frente al hongo Candida albicans, mostrada por M. officinalis.23 Los resultados obtenidos en esta investigación (tablas 1 y 2) indican que los aceites de L. citriodora (cedrón) y M. officinalis (toronjil) en estudio son del mismo quimiotipo geranial. el uso de sus aceites esenciales como relajantes y tranquilizantes podrían atribuirse a su composición química similar. Los monoterpenoides más abundantes y comunes en las esencias de C. citratus, L. citriodora y M. officinalis son geranial, neral y geraniol. Estas especies podrían necesitar metabolitos secundarios similares para sus interacciones ecológicas, además de que los aceites esenciales constituyen una reserva energética para situaciones de emergencia, como en el caso de situaciones climatológicas adversas.24 Por otra parte, los aceites esenciales de E. globulus, P. carpunya y A. conyzoides, presentan cierta similitud entre ellos, ya que las familias de los metabolitos biosintetizados predominantes corresponden a los derivados oxigenados de monoterpenos (tabla 2). Sin embargo, los compuestos mayoritarios son diferentes (tabla 1): 1,8-cineol o eucaliptol en el aceite de E. globulus, piperitona en el correspondiente a P. carpunya, y la cetona de artemisilo y de verbenona en el de A. conyzoides. Las diferencias encontradas en la composición de los aceites esenciales de estas especies podrían deberse a las diferentes respuestas de estas plantas a las adversidades del medio ambiente, así como a la quimio-taxonomía de las especies en particular, ya que pertenecen a distintas familias biológicas.24 En la literatura se reporta el uso potencial de la planta A. conyzoides en las industrias farmacéutico y agrícola;25 y se www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 11/15 8/7/22, 16:01 D'Armas Regnault clasifica a los metabolitos: precoceno 1 (fenipropanoide) y al óxido de cariofileno como componentes principales de la esencia de esta especie recolectada en Asia.15 Este sesquiterpeno se indentificó en esta especie analizada durante esta investigación. Los aceites esenciales de tres especies de Eucalyptus (E. citriodora, E. tereticornis, y E. globulus) tuvieron efectos antiinflamatorios y analgésicos en los ensayos con ratones, lo cual indujo a desarrollar nuevas drogas. En una investigación reciente se demostraron las propiedades sinérgicas de los terpenos aromadendreno y 1,8-cineol presentes en el aceite esencial de E. globulus contra cepas patógenas de las bacterias susceptibles y resistentes a antibióticos.26,27 Los estudios químicos de especies del género Piper permitieron aislar varios productos naturales bioactivos, así como caracterizar sus aceites esenciales con una composición similar a la comprobada en esta investigación y evaluar sus actividades biológicas como antimicrobianos, antimutagénicos, antioxidantes y larvicidas, entre otras.8 En este trabajo de investigación se encontró que los metabolitos volátiles de la mayoría de los aceites esenciales de las hojas de las especies estudiadas son básicamente monoterpenos, con excepción de los de A. conyzoides que además son ricos en sesquiterpenos y de los de A. artemisiifolia que son del tipo sesquiterpenoide. Los resultados son similares a los reportados por otros autores para estas especies; sin embargo, las esencias de A. artemisiifolia y A. absinthium presentan diferencias en su composición química. El estudio realizado aporta información novedosa sobre la composición química de los aceites esenciales de ocho especies usadas tradicionalmente en la medicina popular del Ecuador y será útil desde el punto de vista taxonómico e importante para interpretar su actividad biológica. AGRADECIMIENTOS Los autores expresan su agradecimiento al Proyecto Prometeo de la Secretaría Nacional de Educación Superior, Ciencia y Tecnología de la República de Ecuador (SENESCYT) por el financiamiento de esta investigación. A John Vederas y Jing Zheng, especialistas del laboratorio de Espectrometría de Masas de la Universidad de Alberta, por su colaboración en la realización de los análisis de CG/EM. Conflicto de intereses Los autores declaran que no tienen conflicto de intereses. www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 12/15 8/7/22, 16:01 D'Armas Regnault REFERENCIAS BIBLIOGRÁFICAS 1. Bakkali F, Averbeck S, Averbeck D, Idomar M. Biological effects of essential oils: A review. Food Chem Toxicol. 2008;46(2):44675. 2. Stefanazzi N, Stadler T, Ferrero A. Composition and toxic, repellent and feeding deterrent activity of essential oils against the stored-grain pestsTribolium castaneum (Coleoptera: Tenebrionidae) and Sitophilus oryzae (Coleoptera: Curculionidae). Pest Manag Sci. 2011;67(6):639-46. 3. Rojas J, Palacios O, Ronceros S. Efecto del aceite esencial de Aloysia triphylla Britton (cedrón) sobre Tripanosoma cruzi en ratones. Rev Peru Med Exp Salud Pública. 2012;29(1):61-8. 4. Saldarriaga L, Sánchez G, Correa C, Sánchez M, Torres H. Evaluación agroindustrial de los aceites esenciales de Artemisia dracunculos L, Franseria artemisioides Willd,Salvia officinalis L, Lippia dulcis Frev y Occimun americanum L en condiciones del Valle del Cauca. Acta Agron. 2010;59(3):293-302. 5. Pascual ME, Slowing K, Carretero E, Sánchez-Mata D, Villar A. Lippia: traditional uses, chemistry and pharmacology: a review. J Ethnopharmacol. 2001;76(3):201-14. 6. Sánchez E, León M, Chávez D, Hechevarría I, Pino J. Caracterización farmacognóstica de Melissa oficinalis (toronjil). Rev Cubana Plant Med. 2010;15(4):198-208. 7. Mesa A, Toro J, Cardona F, Blair F. Actividad antiplasmodial y citotóxica de extractos etanólicos de especies de género Piper. B Latinoam Caribe Pl. 2012;11(2):154-62. 8. Morais S, Facundo V, Medeiros L, Barreira E, Anjos J, Ferreira S, et al. Chemical composition and larvicidal activity of essential oils from Piper species. Biochem Systemat Ecol. 2007;35:670-5. 9. Santin M, Dos Santos A, Nakamura C, Dias B, Ferreira I, UedaNakamura T. In vitro activity of the essential oil of Cymbopogon citratus and its major component (citral) on Leishmania amazonensis. Parasitol Res. 2009;105(6):1489-96. 10. Kpoviessi B, Accrombessia G, Frédériche M, Moudachirouc M, Quetin-Leclercq J. Chemical composition, cytotoxicity and in vitro antitrypanosomal and antiplasmodial activity of the essential oils of four Cymbopogon species from Benin. J Ethnopharmacol. 2014;151(1):652-9. 11. Maksimovic Z. In vitro antioxidant activity of ragweed (Ambrosia artemisiifolia L., Asteraceae) herb. Industrial Crops and Products. 2008;8(3):356-60. 12. Yañez C, Ríos N, Mora F, Rojas L, Díaz T, Velasco J, et al. Composición química y actividad antibacteriana del aceite esencial de Ambrosia peruviana Willd. de los llanos venezolanos. Rev Perú Biol. 2011;18(2):149-51. www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 13/15 8/7/22, 16:01 D'Armas Regnault 13. Blagojevic P, Radulovic N, Radosav P, Stojanovic G. Chemical Composition of the Essential Oil of Serbian Wild-Growing Artemisia absinthium and Artemisia vulgaris. J Agric Food Chem. 2006;54(13):4780-9. 14. Kordali S, Kotan R, Mavi A, Fakir A, Ala A, Yildrim A. Determination of the Chemical Composition and Antioxidant Activity of the Essential Oil of Artemisia dracunculus and of the Antifungal and Antibacterial Activities of Turkish Artemisia absinthium, A. dracunculus, Artemisia santonicum and Artemisia spicigera Essential Oils. J Agric Food Chem. 2005;53(24):9452-8. 15. Kamboj A, Kumar-Saluja A. Ageratum conyzoides L.: A review on its phytochemical and pharmacological profile. Int J Green Pharm. 2008;2(2):59-68. 16. Patil R, Nimbalkar M, Jadhav U, Dawkar V, Govindwar S. Antiaflatoxigenic and antioxidant activity of an essential oil from Ageratum conyzoides. J Sci Food Agric. 2010;90(4):608-14. 17. Silva J, Abebe W, Souza S, Duarte V, Machado M, Matos M. Analgesic and anti-inflammatory effects of essential oils of Eucalyptus. J. Etnopharmacol. 2003;89(2-3):277-83. 18. Ordaz G, D'Armas H, Yáñez D, Moreno S. Composición química de los aceites esenciales de las hojas de Helicteres guazumifolia (Sterculiaceae), Piper tuberculatum (Piperaceae), Scoparia dulcis (Arecaceae) y Solanum subinerme (Solanaceae), recolectadas en Sucre, Venezuela. Rev. Biol. Trop. 2011;59(2):585-95. 19. Chalchat J, Maksimovic Z, Petrovic S, Gorunovic M, Dordevic S, Mraovic M. Chemical Composition and Antimicrobial Activity of Ambrosia artemisiifolia L. Essential Oil. J Essent Oil Res. 2004;16(3):270-3. 20. Dhingra V, Rao V, Narasu L. Current state of artemisin and its derivatives as antimalarial drugs. Life Science. 1999;66(4):279300. 21. Pino J, Rosado A. Chemical Composition of the Essential Oil of Cymbopogon citratus (DC.) Stapf. from Cuba. J Essent Oil Res. 2000;12(3):301-2. 22. Oliva M, Beltramino E, Gallucci M, Casero C, Zygadlo J, Demo M. Antimicrobial activity of essential oils of Aloysia triphylla (L`Her.) Britton from different regions of Argentina. B Latinoam Caribe Pl. 2010;9(1):29-37. 23. Hancianu M, Aprotosoaie A, Gille E, Poiata A, Tuchilus C, Spac A, et al. Chemical composition and in vitro antimicrobial activity of essential oil of Melissa officinalis L. from Romania. Rev Med Chir Soc Med Nat. 2008;112(3):843-7. 24. Leicach S. Alelopatía. Interacciones químicas en la comunicación y defensa de las plantas. Buenos Aires: Eudeba; 2006. www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 14/15 8/7/22, 16:01 D'Armas Regnault 25. Okunade A. Review: Ageratum conyzoides L. (Asteraceae). Fitoterapia. 2002;73(1):1-16. 26. Mulyaningsih S, Sporer F, Zimmermann S, Reichling J, Wink M. Synergistic properties of the terpenoids aromadendrene and 1,8cineole from the essential oil of Eucalyptus globulus against antibiotic-susceptible and antibiotic-resistant pathogens. Phytomedicine. 2010;17(13):1061-6. 27. Mulyaningsih S, Sporer F, Reichling J, Wink M. Antibacterial activity of essential oils from Eucalyptus and of selected components against multidrug-resistant bacterial pathogens Pharmaceutical Biology. 2011;49(9):893-9. Recibido: 12 de diciembre de 2015. Aprobado: 22 de febrero de 2017. Haydelba D'Armas Facultad de Ciencias de la Ingeniería, Universidad Estatal de Milagro, Guayas, Ecuador. Correo electrónico: [email protected] www.revplantasmedicinales.sld.cu/index.php/pla/rt/printerFriendly/428/282 15/15