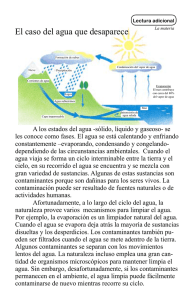
Machine Translated by Google 17 Deterioro microbiano, riesgo de infección y control de la contaminación Rosamund M. Baird Universidad de Bath, Bath, Reino Unido 1 Introducción 273 2 Deterioro: deterioro químico y fisicoquímico de productos farmacéuticos 274 2.1 Ingredientes farmacéuticos susceptibles al ataque microbiano 274 4.2.3 Equipos fuentes 283 5 El alcance de la contaminación microbiana 283 5.1 En fabricación 283 5.2 En uso 284 6 Factores que determinan el resultado de una infección transmitida por 2.2 Efectos observables del ataque microbiano en productos farmacéuticos productos 276 2.3 Factores que afectan el deterioro microbiano de los productos farmacéuticos 276 2.3.1 Tipos y tamaño del inóculo contaminante 276 2.3.2 Factores nutricionales 277 medicamentos 284 6.1 Tipo y grado de contaminación microbiana 284 6.2 Vía de administración 285 6.3 Resistencia del paciente 285 7 Conservación de medicamentos utilizando agentes antimicrobianos: principios básicos 285 7.1 Introducción 285 2.3.3 Contenido de humedad: actividad de agua ( Aw) 277 2.3.4 Potencial redox 278 2.3.5 Temperatura de 7.2 Efecto de la concentración del conservante, la temperatura y el tamaño del inóculo 286 almacenamiento 278 2.3.6 pH 278 2.3.7 Diseño de empaque 278 2.3.8 Protección de microorganismos dentro de 7.3 Factores que afectan la 'disponibilidad' de conservantes 286 7.3.1 productos farmacéuticos Efecto del pH del producto 286 7.3.2 Eficiencia en sistemas multifásicos 286 7.3.3 Efecto del envase o empaque 287 8 Garantía productos 278 de calidad y control del riesgo microbiano en medicamentos 3 Peligro para la salud 279 3.1 Toxinas microbianas 280 4 Fuentes y control de la contaminación 281 4.1 En fabricación 281 287 8.1 Introducción 287 8.2 Garantía de calidad en el diseño y desarrollo de formulaciones 287 4.1.1 Fabricación hospitalaria 281 4.1.1.1 Agua 281 8.3 Buenas prácticas de fabricación farmacéutica (GPMP) 288 8.4 4.1.1.2 Medio ambiente 281 Procedimientos de control de calidad 289 8.5 Vigilancia posterior a la 4.1.1.3 Embalaje 281 4.2 En uso 282 comercialización 290 9 Resumen 291 4.2.1 Fuentes humanas 282 10 Reconocimiento 291 4.2.2 Fuentes ambientales 282 11 Referencias y lecturas adicionales 291 estados Dichos productos no solo deben cumplir con los requisitos 1. Introducción actuales de buenas prácticas de fabricación farmacéutica (GPMP) en cuanto a calidad, seguridad y eficacia, sino que también deben ser Los productos farmacéuticos utilizados en la prevención, el tratamiento estables y suficientemente atractivos para ser aceptables para los y el diagnóstico de enfermedades contienen una amplia variedad de pacientes. Los productos fabricados en la industria farmacéutica hoy en ingredientes, a menudo en condiciones fisicoquímicas bastante complejas. día deben cumplir con altas especificaciones microbiológicas; es decir Microbiología farmacéutica de Hugo y Russell, octava edición. Editado por Stephen P. Denyer, Norman Hodges, Sean P. Gorman, Brendan F. Gilmore. © 2011 Blackwell Publishing Ltd. Publicado en 2011 por Blackwell Publishing Ltd. 273 Machine Translated by Google 274 Capítulo 17 si no son estériles, se espera que no tengan más que una población icos (xenobióticos). Sin embargo, las tasas de degradación de los microbiana mínima en el momento de la liberación del producto. materiales liberados al medio ambiente pueden variar mucho, ' desde vidas medias de horas (fenol) a meses (detergentes) odifícil años' Sin embargo, de vez en cuando, algunos productos no autorizados con un nivel y un tipo de contaminación inaceptables (pesticidas halogenados). La tasa general de deterioro de una sustancia química depende escaparán ocasionalmente de la red de control de calidad. Las de su estructura molecular; las propiedades fisicoquímicas de un consecuencias de dicha contaminación pueden ser graves y de ambiente particular; el tipo y la cantidad de microbios presentes; y largo alcance por varios motivos, especialmente si los contaminantes si los metabolitos producidos pueden servir como fuentes de han tenido la oportunidad de multiplicarse a niveles elevados. energía utilizable y precursores para la biosíntesis de componentes En primer lugar, el producto puede estropearse, haciéndolo no celulares y, por lo tanto, la creación de más microorganismos. apto para su uso debido al deterioro químico y fisicoquímico de la formulación. El deterioro y el desperdicio subsiguiente de lotes Las formulaciones farmacéuticas pueden considerarse como individuales por lo general resultan en grandes problemas microambientes especializados y su susceptibilidad al ataque financieros para el fabricante debido a la pérdida directa del microbiano puede evaluarse utilizando criterios ecológicos producto defectuoso. En segundo lugar, la amenaza de litigio y la convencionales. Algunos ingredientes naturales son particularmente publicidad perjudicial y no deseada de los retiros del mercado sensibles al ataque, y varios componentes sintéticos, como los pueden tener graves consecuencias económicas para el fabricante. tensioactivos modernos, se han construido deliberadamente para En tercer lugar, el uso involuntario de productos contaminados que se degraden fácilmente después de su eliminación en el medio puede presentar un peligro potencial para la salud de los pacientes, lo que quizás provoque brotes de infecciones relacionadas con ambiente. Los extractos de fármacos vegetales y animales crudos medicamentos e, irónicamente, por lo tanto, contribuya a la además de los agentes terapéuticos. Esto, combinado con propagación de enfermedades. Más comúnmente, la fuerte características fisicoquímicas frecuentemente propicias e inestables, a menudo contienen una amplia variedad de nutrientes microbianos contaminación del producto con patógenos oportunistas, como deja muchas formulaciones con un alto potencial de ataque Pseudomonas spp., ha resultado en la propagación de infecciones microbiano a menos que se tomen medidas para minimizarlo. nosocomiales (adquiridas en el hospital) en pacientes comprometidos; con menos frecuencia, bajos niveles de contaminación conatraído organismos patógenos, como Salmonella , han una atención considerable, al igual que 2.1 Ingredientes farmacéuticos susceptibles los productos contaminados con metabolitos microbianos tóxicos, de ataque microbiano • Agentes terapéuticos. como las micotoxinas en las medicinas a base de hierbas. Las A través del deterioro, los constituyentes activos del fármaco consecuencias de la contaminación microbiana en los productos pueden metabolizarse a formas menos potentes o químicamente farmacéuticos se analizan con más detalle a continuación. inactivas. En condiciones de laboratorio, se ha demostrado que una variedad de microorganismos pueden metabolizar una amplia variedad de fármacos, lo que provoca una pérdida de actividad. 2 Deterioro: deterioro químico y fisicoquímico de los productos farmacéuticos Los microorganismos forman una parte importante de los procesos Materiales tan diversos como alcaloides (morfina, estricnina, atropina), analgésicos (aspirina, paracetamol), talidomida (todavía se usa en el tratamiento de algunas formas de cáncer), barbitúricos, ésteres de esteroides y ácido mandélico pueden metabolizarse y servir como sustratos para el crecimiento. . De hecho, el uso de Como tales, poseen una amplia variedad de capacidades de microorganismos para llevar a cabo transformaciones sutiles en las moléculas de esteroides forma la base de la producción comercial degradación, que pueden ejercer en condiciones fisicoquímicas de potentes agentes esteroideos terapéuticos (ver Capítulo 26). En relativamente suaves. Las comunidades naturales mixtas suelen la práctica, los informes de destrucción de drogas en medicamentos naturales de reciclaje de materia biológica en el medio ambiente. ser biodeteriógenos cooperativos mucho más efectivos que las son menos frecuentes. especies individuales solas, y se producen secuencias de ataque Sin embargo, ha habido algunas excepciones notables: el de sustratos complejos donde el ataque inicial de un grupo de metabolismo de la atropina en gotas para los ojos por hongos microorganismos los hace susceptibles a un mayor deterioro por contaminantes; inactivación de inyecciones de penicilina por ÿ - lactamasa - parte de microorganismos secundarios y subsiguientes. Bajo producir bacterias (véanse los capítulos 11 y 13); metabolismo de presiones de selección ambientales adecuadas, pueden surgir esteroides en tabletas húmedas y cremas por hongos; hidrólisis nuevas vías de degradación con la capacidad de atacar productos microbiana de aspirina en suspensión por esterasa - químicos sintéticos recién introducidos. bacterias productoras; y desactivación de cloranfenicol Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 275 en un medicamento oral por una cloranfenicol acetilasa - cadena, pero los congéneres más grandes son bastante más contaminante productor. • recalcitrantes. Los polímeros de embalaje sintéticos como el Superficie - agentes activos. Los tensioactivos aniónicos , como nailon, el poliestireno y el poliéster son extremadamente los jabones de metales alcalinos y aminas de ácidos grasos, son resistentes al ataque, aunque el celofán (celulosa modificada) es generalmente estables debido al pH ligeramente alcalino de las susceptible en algunas condiciones de humedad. • Humectantes. formulaciones, aunque se degradan fácilmente una vez que se Los materiales de bajo peso molecular como el glicerol y el diluyen en las aguas residuales. Los sulfonatos de alquilo y sorbitol se incluyen en algunos productos para reducir la pérdida alquilbenceno y los ésteres de sulfato se metabolizan por ÿ - de agua y pueden metabolizarse fácilmente a menos que estén oxidación de sus grupos metilo terminales seguida de ÿ - secuencial. presentes en altas concentraciones (consulte la sección 2.3.3). • oxidación de las cadenas alquílicas y fi sión de los anillos Grasas y aceites. Estos materiales hidrófobos suelen ser aromáticos. La presencia de ramificación de la cadena implica atacados extensamente cuando se dispersan en formulaciones procesos oxidativos ÿ adicionales. En general, la facilidad de acuosas tales como emulsiones de aceite en agua, ayudados degradación disminuye con el aumento de la longitud de la cadena por la alta solubilidad del oxígeno en muchos aceites. Se han y la complejidad de la ramificación de la cadena alquílica. • Los informado ataques de hongos en películas de humedad tensioactivos no iónicos , comoalquilpolioxietileno, los emulsionantes son de alcohol fácilmente de condensada en la superficie de aceites a granel, o donde las metabolizados por una amplia variedad de microorganismos. El gotas de agua han contaminado la fase de aceite a granel. La aumento de la longitud de la cadena y la ramificación nuevamente ruptura lipolítica de los triglicéridos libera glicerol y ácidos grasos, disminuyen la facilidad de ataque. Los alcoholes de polioxietileno estos últimos a menudo experimentan una oxidación ÿ de las de alquilfenol son atacados de manera similar, pero son cadenas alquílicas y la producción de cetonas olorosas. Aunque significativamente más resistentes. La escisión lipolítica de los rara vez se informa sobre el metabolismo microbiano de los ácidos grasos de los ésteres de sorbitán, polisorbatos y ésteres de aceites de hidrocarburos farmacéuticos, este es un problema en sacarosa suele ir seguida de la degradación de los núcleos cíclicos, ingeniería y tecnología de combustibles cuando las gotas de produciendo numerosas moléculas pequeñas fácilmente utilizables agua se acumulan en los tanques de almacenamiento de aceite para el crecimiento microbiano. Tensioactivos anfolíticos, a base y la subsiguiente colonización de hongos ha catalizado una de fosfátidos, betaínas y alquilamino - corrosión grave. • Edulcorantes, aromatizantes y colorantes. Los aminoácidos sustituidos son un grupo cada vez más Muchos de los azúcares y otros agentes edulcorantes utilizados importante de tensioactivos y, en general, se informa que son en farmacia son sustratos listos para el crecimiento microbiano. razonablemente biodegradables. Los tensioactivos catiónicos Sin embargo, algunos se usan en concentraciones muy altas utilizados como antisépticos y conservantes en aplicaciones para reducir la actividad del agua en productos acuosos e inhibir farmacéuticas normalmente solo se degradan lentamente a una el ataque microbiano (consulte la sección 2.3.3). En un momento, alta dilución en las aguas residuales. Se ha encontrado que las una variedad de agentes colorantes (como la tartrazina y el pseudomonas crecen fácilmente en soluciones antisépticas de amaranto) y agentes saborizantes (como el agua de menta) se amonio cuaternario, en gran medida a expensas de otros mantuvieron como soluciones madre para fines de dispensación ingredientes, como materiales amortiguadores, aunque también se ha observado cierto metabolismo del tensioactivo. • Polímeros extemporánea, pero con frecuencia favorecieron el crecimiento de Pseudomonas . orgánicos. Muchos de los agentes espesantes y de suspensión utilizados en las formulaciones farmacéuticas están sujetos a la deben conservarse o prepararse según sea necesario mediante la dilución de soluciones alcohólicas que son mucho menos despolimerización microbiana por clases específicas de enzimas susceptibles al ataque microbiano. spp., incluyendo Ps. aeruginosa . Estas soluciones madre ahora extracelulares, lo que produce fragmentos nutritivos y monómeros. • Conservantes y desinfectantes. Muchos conservantes y Ejemplos de tales enzimas, con sus sustratos entre paréntesis, desinfectantes pueden ser metabolizados por una amplia variedad son: amilasas (almidones), pectinasas (pectinas), celulasas de bacterias Gram negativas, aunque lo más común es que se ' encuentren en concentraciones por debajo de sus niveles uso efectivos. El (carboximetilcelulosas, pero no alquilcelulosas), uronidasas (poliurónidos como en tragacanto y acacia), dextranasas crecimiento de pseudomonas en soluciones madre de antisépticos (dextranos) y proteasas (proteínas). El agar (un polisacárido de amonio cuaternario y clorhexidina ha resultado en la infección complejo) es un ejemplo de polímero relativamente inerte y, de los pacientes. Pseudomonas spp. han metabolizado los como tal, se utiliza como soporte para la solidificación de medios conservantes de éster de 4 - hidroxibenzoato (parabenos) de cultivo microbiológicos. Los polietilenglicoles de bajo peso contenidos en las gotas para los ojos y han causado infecciones molecular se degradan fácilmente por oxidación secuencial del oculares graves, y también han metabolizado los conservantes hidrocarburo. de las suspensiones y soluciones orales. En la selección de conservantes adecuados para la formulación, un conocimiento detallado de Machine Translated by Google 276 Capítulo 17 las propiedades de tales agentes, su susceptibilidad a la contaminación y las limitaciones claramente brindan información invaluable. 2.2 E fectos observables del ataque microbiano a los formulaciones tardías para crear condiciones tan desfavorable posible para el crecimiento y deterioro, dentro de las limitaciones de aceptabilidad del paciente y eficacia terapéutica. Además, las características generales de una formulación particular indicarán su susceptibilidad al ataque de varias clases de microorganismos. productos farmacéuticos Los contaminantes microbianos generalmente necesitan atacar los ingredientes de la formulación y crear los sustratos necesarios para la 2.3.1 Tipos y tamaño del inóculo contaminante biosíntesis y la producción de energía antes de que puedan La formulación exitosa de productos contra el ataque replicarse a niveles donde el deterioro evidente se hace evidente. microbiano involucra un elemento de predicción. Una 6 Así, por ejemplo, 10 microbios tendrán comprensión de dónde y cómo se utilizará el producto y 6 un efecto degradante veces más rápido queyuno los desafíos que debe enfrentar durante su vida permitirá general alrededor de 10 células. Sin embargo, el crecimiento el al formulador incorporar la mayor protección posible contra ataque bien pueden localizarse en las películas de humedad de la el ataque microbiano. Cuando inevitablemente ocurren superficie o distribuirse de manera muy desigual dentro de la mayor parte de las formulaciones viscosas como fallas de vez en cuando, el conocimiento de la ecología microbiana y la identificación cuidadosa de los cremas Los primeros indicios de deterioro suelen ser contaminantes pueden ser muy útiles para rastrear los organolépticos, con la liberación de metabolitos de olor y ' agrio aminas, ' sabor desagradables, como pasos defectuosos en el proceso de diseño o producción. ' ácidos grasos, pescado ' ' ' , amargo, ' malos huevos o sabores terroso y olores ' enfermizo. Es posible que los niveles bajos de contaminantes no causen Los productos pueden decolorarse de manera poco atractiva un deterioro apreciable, especialmente si no pueden replicarse en un debido a los pigmentos microbianos de varios tonos. Los agentes espesantes y de suspensión como el tragacanto, la acacia o la carboximetilcelulosa pueden despolimerizarse, lo que da como resultado la pérdida de viscosidad y la sedimentación de los ingredientes suspendidos. Alternativamente, la polimerización microbiana de azúcares y moléculas de surfactante puede producir masas viscosas y viscosas en ' ' jarabes, champús y cremas, y el crecimiento arenoso texturas de hongos Cambios en cremas ha producido en el producto. El pH puede ocurrir dependiendo de si se liberan metabolitos ácidos o básicos, y -D puede modificarse tanto como para permitir el ataque secundario de microbios previamente inhibidos por el pH inicial del producto. Los metabolitos gaseosos pueden verse como burbujas atrapadas dentro de formulaciones viscosas. -C Cuando se ataca una formulación compleja como una emulsión de aceite en agua, se puede observar una secuencia de deterioro grave y progresiva. El metabolismo de los tensioactivos reducirá la ' estabilidad y acelerará la formación de crema aceite. de losLaglóbulos liberación lipolítica dede ácidos grasos de los aceites reducirá el pH y fomentará la -B coalescencia de los glóbulos de aceite y el agrietamiento de la ' emulsión. Los ácidos grasos y sus productos de oxidación cetónica - UN proporcionarán un sabor agrio y un olor desagradable, mientras que las burbujas de metabolitos gaseosos pueden ser visibles, atrapadas en el producto, y los pigmentos pueden decolorarlo (consulte la Figura 17.1). Figura 17.1 Sección ( × 1,5) a través de una emulsión de aceite en agua, aceite de oliva conservada inadecuadamente en un estado avanzado de 2.3 F actores que afectan el deterioro microbiano de los productos farmacéuticos Al comprender la infl uencia de los parámetros ambientales en los microorganismos, puede ser posible manipular deterioro microbiano que muestra: A, fase acuosa descolorida, empobrecida en aceite; B, glóbulo de aceite - rica capa cremosa; C, capa de aceite ' fusionada desde laemulsión superficie. agrietada; También D, están crecimiento presentesdel un micelio mal sabor fúngico y mal en olor. Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 277 producto; sin embargo, un aumento inesperado en la carga biológica algunos productos secos donde las condiciones son adecuadamente contaminante puede presentar un desafío inaceptable para la protectoras. formulación diseñada. Esto podría surgir si, por ejemplo, las materias UNw ) primas estuvieran inusualmente contaminadas; hubo una falla en la 2.3.3 Contenido de humedad: actividad del agua planta - protocolo de limpieza; una película de biopelícula se desprendió ( Los microorganismos requieren agua fácilmente accesible en del interior de las tuberías de suministro; o el producto había sido mal cantidades apreciables para que se produzca el crecimiento. Al medir utilizado durante la administración. la actividadestimación del agua de Aw es posible obtener una deun la producto, proporción está de,disponible agua no complejada en la formulación que El tamaño del inóculo por sí solo no siempre es un indicador confiable para apoyar el crecimiento microbiano, utilizando la fórmula Aw = del potencial de deterioro probable. Los niveles bajos de pseudomonas presión de vapor de la formulación/ agresivas en una solución débilmente conservada pueden presentar un mayor riesgo que las tabletas que contienen cantidades bastante altas de esporas de hongos y bacterias. Cuando un microorganismo agresivo contamina un medicamento, presión de vapor del agua en condiciones similares. Cuanto mayor es la concentración de soluto, menor es la actividad del agua. Con la excepción de las bacterias halófilas, la mayoría de los puede haber un período de retraso apreciable antes de que comience microorganismos crecen mejor en soluciones diluidas (alta Aw ) y, a un deterioro significativo, cuya duración disminuye de manera medida que aumenta la concentración de soluto (reducción de Aw ), desproporcionada con el aumento de la carga de contaminantes. las tasas de crecimiento disminuyen hasta que se alcanza una Aw Como suele haber un retraso considerable entre la fabricación y la inhibidora mínima del crecimiento valores limitantes Aw son del orden de 0,95 para bacilos. Los Gram - negativos; 0,9 de para administración de la fábrica, estafilococos, micrococos y lactobacilos; y 0,88 para la mayoría de las medicamentos fabricados, el crecimiento y el ataque podrían ocurrir levaduras. Jarabe - durante este período a menos que se tomen medidas adicionales para prevenirlo.las levaduras osmotolerantes en fermentación han estropeado los Por otro lado, para las formulaciones dispensadas extemporáneamente productos con niveles de Aw tan bajos como 0,73, mientras que algunos se puede proporcionar cierto control especificando vidas útiles cortas, hongos filamentosos como Aspergillus glaucus pueden crecer a 0,61. por ejemplo, 2 semanas. El aislamiento de un microorganismo en particular de un producto La Aw de las formulaciones acuosas se puede reducir para aumentar la resistencia al ataque microbiano mediante la adición de notablemente deteriorado no significa necesariamente que haya sido altas concentraciones de azúcares o polietilenglicoles. el iniciador del ataque. Podría tratarse de un contaminante oportunista Sin embargo, incluso Syrup BP (67 % de sacarosa; Aw = 0,86) ha secundario que había crecido sobre el organismo de deterioro primario fallado ocasionalmente en inhibir las levaduras osmotolerantes y puede una vez que las propiedades fisicoquímicas habían sido modificadas ser necesaria una conservación adicional. Con una tendencia continua favorablemente por el agente de deterioro primario. hacia la eliminación de la sacarosa de los medicamentos, se han investigado solutos alternativos que no se cree que fomenten la caries dental, como el sorbitol y la fructosa. La aw también se puede reducir 2.3.2 Factores nutricionales mediante el secado, aunque los medicamentos secos, a menudo Los requisitos nutricionales simples y la adaptabilidad metabólica de muchos microorganismos de descomposición comunes les permiten higroscópicos (tabletas, cápsulas, polvos, envases vítreos para evitar ' la reabsorción de agua y el consiguiente microbiano gafas'crecimiento ) requerirá adecuado utilizar muchos componentes de la formulación como sustratos para la (Figura 17.2). biosíntesis y el crecimiento. El uso de productos vegetales o animales crudos en una formulación proporciona un entorno nutritivo adicional. Ahora se encuentran disponibles recubrimientos de película para tabletas Incluso el agua desmineralizada preparada con buenos métodos de que reducen en gran medida la absorción de vapor de agua durante el intercambio iónico normalmente contendrá suficientes nutrientes para almacenamiento al mismo tiempo que permiten una fácil disolución en agua permitir un crecimiento significativo de muchas bacterias Gram a granel. Estos pueden contribuir a una mayor estabilidad microbiana durante negativas transmitidas por el agua, como Pseudomonas spp. Cuando el almacenamiento en climas particularmente húmedos, aunque un empaque tales contaminantes no sobreviven, es poco probable que sea el adecuado en tiras de aluminio puede ser más efectivo, aunque más costoso. resultado de una limitación de nutrientes en el producto, sino debido a otras propiedades fisicoquímicas o tóxicas que no son de apoyo. Las películas de agua condensada pueden acumularse en la superficie de lo contrario ' productos secos como tabletas o aceites a granel después del almacenamiento en atmósferas húmedas con temperaturas Los patógenos agudos requieren factores de crecimiento fluctuantes, lo que da como resultado una Aw localizada lo suficientemente específicos normalmente asociados con los tejidos que infectan, pero alta como para iniciar el crecimiento de hongos. La condensación formada que a menudo están ausentes en las formulaciones farmacéuticas. de manera similar en la superficie de productos viscosos como jarabes y Por lo tanto, es poco probable que se multipliquen en ellos, aunque cremas, o exudada por sinéresis de hidrogeles, bien puede permitir el pueden permanecer viables e infecciosos durante un tiempo apreciable en deterioro de la superficie por levaduras y hongos. Machine Translated by Google 278 Capítulo 17 posible rebrote de bacterias Gram - negativas y liberación de endotoxinas. 2.3.6 pH Los extremos de pH previenen el ataque microbiano. Alrededor de la neutralidad, el deterioro bacteriano es más probable, con informes de pseudomonas y bacterias gramnegativas relacionadas que crecen en mezclas de antiácidos, enjuagues bucales saborizados y agua destilada o desmineralizada. Por encima de pH 8 (p. ej., con emulsiones a base de jabón), el deterioro es raro. En productos con niveles de pH bajos (p. ej., frutas, zumos, jarabes aromatizados con un pH de 3 a 4), es más probable que se produzca un ataque de hongos o levaduras. Las levaduras pueden metabolizar ácidos orgánicos y elevar el pH a niveles en los que puede ocurrir un crecimiento bacteriano secundario. Aunque el uso del ajuste de pH bajo para conservar alimentos está bien establecido (p. ej., encurtidos, ensalada de col, yogur), no es factible hacer un uso deliberado de este para medicamentos. Figura 17.2 Crecimiento fúngico en una tableta que se humedeció 2.3.7 Diseño del empaque (aumento de Aw ) durante el almacenamiento en condiciones húmedas. El empaque puede tener una gran infl uencia en la estabilidad Tenga en cuenta la escasez de micelio y conidióforos. Se cree que microbiana de algunas formulaciones al controlar la entrada el contaminante es un Penicillium sp. de contaminantes durante el almacenamiento y el uso. Se ha pensado mucho en el diseño de recipientes para evitar la entrada de contaminantes en medicamentos para administración parenteral, debido a los altos riesgos de infección por esta vía. 2.3.4 Potencial redox La Se deben usar tacos de goma autosellantes para evitar la capacidad de los microbios para crecer en un entorno está entrada de microbios en los envases de inyección multidosis influenciada por su equilibrio de oxidación-reducción (potencial (Capítulo 22) después de las extracciones con una aguja redox), ya que requerirán aceptores de electrones terminales hipodérmica. Los frascos de crema de boca ancha ahora han compatibles para permitir que sus vías respiratorias funcionen. sido reemplazados por boquillas estrechas y tubos fl exibles El potencial redox, incluso en emulsiones bastante viscosas, con tapa de rosca, eliminando así la posibilidad de que el operador: puede ser bastante alto debido a la apreciable solubilidad del contaminación introducida durante el uso del producto. oxígeno en la mayoría de las grasas y aceites. Del mismo modo, las cremas de manos, que antes se suministraban en tarros de cristal, ahora se envasan en dosificadores cerrados y 2.3.5 Temperatura de desechables. Cuando los medicamentos dependan de su baja Aw para almacenamiento El deterioro de los productos farmacéuticos podría evitar el deterioro, los envases, como las tiras de láminas, deben ser ocurrir potencialmente en el rango aunque dees alrededor los mucho extremos. menos de -20 La probable °C temperatura a 60 °C, en de materiales a prueba de vapor de agua con sellos totalmente particular de almacenamiento puede determinar selectivamente los eficientes. El embalaje exterior de cartón y las propias etiquetas pueden tipos de microorganismos involucrados en el deterioro. Se utiliza un convertirse en sustratos para el ataque microbiano en condiciones de congelador a -20 °C o menos para el almacenamiento a largode plazo humedad y, a menudo, se incluyen conservantes para reducir el riesgo de daños. algunas materias primas farmacéuticas y el almacenamiento a corto plazo de alimentos de nutrición parenteral total (TPN) dispensados 2.3.8 Protección de microorganismos dentro de preparados en hospitales. Los jarabes reconstituidos y los paquetes productos farmacéuticos La supervivencia de de colirios multidosis a veces se dispensan con la instrucción de microorganismos en ambientes particulares a veces se ve almacenarlos en un lugar fresco, como un refrigerador doméstico (2 ' a 8 °C), en parte para reducir el riesgo de crecimiento de influenciada por la presencia de materiales relativamente inertes. Así, los microbios pueden ser más resistentes al calor contaminantes introducidos inadvertidamente durante el uso. Por el oa la desecación en presencia de polímeros como el almidón, contrario, el agua para inyección (EP) debe mantenerse a 80 °C o la acacia o la gelatina. La adsorción en material particulado más después de la destilación y antes del envasado para evitar y esterilización natural puede ayudar al establecimiento y la supervivencia en algunos entornos. Hay un Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 279 creencia, pero evidencia sólida limitada, de que la presencia de comprometida como resultado de la quimioterapia antineoplásica. partículas suspendidas como caolín, trisilicato de magnesio o gel El crecimiento de bacterias Gram - negativas en las soluciones de lavado de hidróxido de aluminio puede infl uir en la longevidad de los de la vejiga se ha considerado responsable de las infecciones dolorosas. contaminantes en aquellos productos que las contienen, y que la En tiempos más recientes, la contaminación de fluidos NPT por presencia de algunos tensioactivos, agentes de suspensión y Pseudomonas durante su preparación aséptica en la farmacia del proteínas pueden aumentar la resistencia de los microorganismos hospital causó la muerte de varios niños en el mismo hospital. a los conservantes, además de su efecto inactivador directo sobre el propio conservante. Las infecciones virales fatales resultantes del uso de tejidos o fluidos humanos contaminados como componentes de medicamentos están bien registradas. Ejemplos de esto incluyen 3 Peligro para la salud la infección por VIH de hemofílicos por productos de factor VIII contaminados y tratados inadecuadamente elaborados a partir de Hoy en día, es bien sabido que el uso involuntario de un producto sangre humana mezclada, y la enfermedad de Creutzfeldt-Jakob farmacéutico contaminado también puede presentar un peligro (ECJ) por inyecciones de hormona de crecimiento humana derivada potencial para la salud del paciente. Aunque se han informado brotes aislados de infecciones relacionadas con medicamentos de glándulas pituitarias humanas, algunas de las cuales estaban infectadas. desde la primera parte del siglo XX, fue solo en las décadas de diferentes son susceptibles a la contaminación con una variedad Se sabe que los productos farmacéuticos de formas muy 1960 y 1970 cuando se entendió mejor la importancia de esta de microorganismos, que van desde patógenos verdaderos hasta contaminación para el paciente. una colección heterogénea de patógenos oportunistas (consulte la Tabla 17.1). Se sabe que están en riesgo los desinfectantes, Inevitablemente, el aislamiento poco frecuente de verdaderos antisépticos, polvos, tabletas y otros productos que brindan un patógenos, como Salmonella spp. y la notificación de infecciones entorno inhóspito para los contaminantes invasores, así como asociadas tras el uso de productos contaminados con estos productos con componentes más nutritivos, como cremas y lociones organismos (comprimidos con pancreatina y extracto de tiroides), con carbohidratos, aminoácidos, vitaminas y, a menudo, cantidades llamaron mucho la atención. Más a menudo, el aislamiento de apreciables. de agua. contaminantes oportunistas saprofitos y no fastidiosos comunes con patogenicidad limitada para individuos sanos ha presentado un desafío significativo para pacientes comprometidos. El resultado de usar un producto contaminado puede variar de un paciente a otro, según el tipo y grado de contaminación y cómo se va a usar el producto. Sin duda, los efectos más graves se han visto con productos inyectados contaminados donde se generalizó Los contaminantes gramnegativos, particularmente Pseudomo el shock bacteriémico y en algunos casos la muerte de nas spp., que tienen requerimientos nutricionales simples y pueden multiplicarse a niveles significativos en productos acuosos, han se han reportado pacientes. Lo más probable es que una herida o sido considerados responsables de numerosos brotes de infección. llaga en la piel lesionada se infecte o colonice localmente por el Por ejemplo, mientras que la córnea intacta es bastante resistente contaminante; esto, a su vez, puede resultar en una mayor a la infección, ofrece poca resistencia a las pseudomonas y bacterias relacionadas cuando se raspa o se daña con productos ocupación de camas de hospital, con las consiguientes consecuencias económicas. Debe subrayarse, sin embargo, que la químicos irritantes; la pérdida de la vista ha ocurrido con frecuencia mayoría de los casos de infecciones relacionadas con medicamentos después del uso de soluciones oftálmicas mal diseñadas que se probablemente no se reconozcan o notifiquen como tales. El habían contaminado con Ps. aeruginosa e incluso apoyó su reconocimiento de estas infecciones presenta sus propios crecimiento activo. problemas. Es un médico hospitalario afortunado quien puede, en Las pseudomonas que contaminan ' Las soluciones antisépticas tienen infectaron la piel de pacientes gravemente quemados, lo que una etapa temprana, reconocer la contaminación que se muestra como un grupo de infecciones de aparición rápida, como la que provocó el fracaso de los injertos de piel y la posterior muerte por Gram -sigue al uso de un líquido intravenoso contaminado en una sala de septicemia negativa. Las infecciones de la piel eccematosa y las hospital. Las posibilidades de que un médico general reconozca infecciones respiratorias en los recién nacidos se han atribuido a una infección relacionada con un medicamento de aparición ungüentos y cremas contaminados con bacterias Gram negativas. insidiosa, tal vez extendida durante varios meses, en un grupo Las mezclas orales y las suspensiones de antiácidos pueden diverso de pacientes en la comunidad, son mucho más remotas. favorecer el crecimiento de bacterias Gram negativas y se han Una vez reconocido, por supuesto, existe la obligación moral de producido graves consecuencias tras su administración inadvertida retirar el producto infractor; por lo tanto, las investigaciones a pacientes inmunodeprimidos. posteriores del incidente se vuelven retrospectivas. Machine Translated by Google 280 Capítulo 17 Tabla 17.1 Contaminantes encontrados en productos farmacéuticos Año Producto contaminante 1907 vacuna contra la peste Clostridium tetani 1943 Colirio de fluoresceína Pseudomonas aeruginosa 1946 Polvos de talco Clostridium tetani 1948 vacuna de suero estafilococo aureus 1955 desinfectante de cloroxilenol Pseudomonas aeruginosa 1966 tabletas de tiroides Salmonella muenchen 1966 Ungüento oftálmico antibiótico Pseudomonas aeruginosa 1966 Solución salina Serratia marcescens 1967 polvo de carmín Salmonella cubana 1967 Crema de manos Klebsiella pneumoniae 1969 agua de menta Pseudomonas aeruginosa 1970 Solución antiséptica de clorhexidina - cetrimida Pseudomonas cepacia 1972 Líquidos intravenosos Pseudomonas, Erwinia y Enterobacter spp. 1972 Polvo de pancreatina Salmonella agona 1977 solución para lentes de contacto Serratia y Enterobacter spp. 1981 Apósitos quirúrgicos Clostridium spp. solución de yodóforo Pseudomonas aeruginosa 1983 Jabón acuoso Pseudomonas stutzeri 1984 enjuague bucal de timol Pseudomonas aeruginosa 1986 Enjuague bucal antiséptico coliformes 1994 Solución de nutrición parenteral total Enterobacter cloacae 1997 Productos varios a base de hierbas mil novecientos ochenta y dos Enterobacter spp., Enterococcus faecalis, Clostridium perfringens, Klebsiella pneumonia, Escherichia, Pseudomonas 2004 Vacuna contra la influenza Bacterias Gram negativas, incluida Serratia 3.1 Toxinas microbianas Las de soluciones de hemodiálisis contaminadas. Dichos efectos bacterias Gram negativas contienen lipopolisacáridos (endotoxinas) pueden incluir fiebre, activación del sistema de citocinas, daño de en sus membranas celulares externas (Capítulo 22); estos pueden las células endoteliales, todo lo cual conduce a un shock febril séptico y, a menudo, mortal. permanecer en una condición activa en los productos incluso después de la muerte celular y algunos pueden sobrevivir a la esterilización por calor húmedo. Aunque son inactivas por vía oral, las endotoxinas Las toxinas bacterianas agudas asociadas con los episodios de intoxicación alimentaria no se informan comúnmente en los pueden inducir una serie de efectos fisiológicos si ingresan al torrente productos farmacéuticos, aunque se han detectado aspergilli sanguíneo a través de líquidos de infusión contaminados, incluso en productores de aflatoxinas en algunos ingredientes vegetales y herbales. Sin embargo, muchos de los metabolitos de microbios cantidades de nanogramos, o a través de la difusión a través de las membranas. Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 281 deterioro tienen sabores y olores bastante desagradables, incluso en Los patógenos tunecinos pueden sobrevivir en rastros de materia niveles bajos, y disuadirían a la mayoría de los pacientes de usar dicho medicamento. orgánica presente en el agua tratada y se multiplicarán rápidamente a grandes cantidades a temperatura ambiente. Por lo tanto, el agua debe almacenarse a una temperatura superior ael80 sistema °C y circular de en distribución a un caudal de 1 a 2 m/s para evitar la acumulación de 4 Fuentes y control de la contaminación biopelículas bacterianas en las tuberías. 4.1 En la fabricación Independientemente de que la fabricación se realice en la industria o a menor escala en la farmacia hospitalaria, la calidad microbiológica del producto terminado estará determinada por los componentes de la formulación utilizados, el entorno en el que se fabrican y el proceso de fabricación. proceso mismo. Como se discutió en el Capítulo 23, la calidad debe integrarse en el producto en todas las etapas del proceso y no simplemente inspeccionarse al final de la fabricación: 4.1.1.2 Medio ambiente La flora microbiana del entorno de la farmacia hospitalaria es un reflejo del entorno general del hospital y de las actividades que allí se desarrollan. Patógenos oportunistas de vida libre, como Ps. aeruginosa , normalmente se puede encontrar en como sitios desagües, húmedos, fregaderos y grifos. Los equipos de limpieza, como trapeadores, baldes, paños y fregadoras, pueden ser los encargados de distribuir estos organismos por la farmacia; si se almacenan húmedos, proporcionan un nicho conveniente para el crecimiento microbiano, • Las materias primas, en particular el agua y las de origen natural, deben tener un alto estándar microbiológico. • Todos los equipos de procesamiento deben estar sujetos a un mantenimiento preventivo planificado y deben limpiarse adecuadamente después de su uso para evitar la contaminación cruzada entre lotes. • El equipo de limpieza debe ser apropiado para la tarea en cuestión y debe limpiarse a fondo y mantenerse adecuadamente. lo que da como resultado una gran contaminación del equipo. Sin embargo, los niveles de contaminación en el entorno de producción pueden minimizarse mediante la observación de buenas prácticas de fabricación (GMP), mediante la instalación de trampas de calor en las curvas en U de los fregaderos, destruyendo así uno de los principales reservorios de contaminantes, y mediante el mantenimiento y almacenamiento adecuados de los equipos. incluyendo equipo de limpieza. Además, la limpieza de las unidades de producción por • La fabricación debe realizarse en locales adecuados, provistos de aire fi ltrado, para los cuales los requisitos ambientales varían según parte de los contratistas debe llevarse a cabo de acuerdo con las especificaciones farmacéuticas. el tipo de producto que se elabore. 4.1.1.3 Envasado • El personal involucrado en la fabricación no solo debe tener buena Las bolsas, los cartones, las fundas para tarjetas, los corchos y el salud sino también un conocimiento profundo de la importancia de la papel no son adecuados para envasar productos farmacéuticos, ya higiene personal y de producción. • El producto final requiere un que están muy contaminados, por ejemplo, con esporas bacterianas embalaje adecuado que lo proteja de la contaminación durante su o fúngicas. Estos ahora han sido reemplazados por no - vida útil y esté libre de contaminación. materiales plásticos biodegradables. En el pasado, los envases de los hospitales se reutilizaban con frecuencia por motivos económicos. Es posible que se devuelvan grandes cantidades de envases a la 4.1.1 Fabricación hospitalaria La farmacia, trayendo consigo contaminantes microbianos introducidos fabricación en locales hospitalarios plantea ciertos problemas durante el uso en las salas. Se han encontrado problemas particulares con las soluciones desinfectantes en las que se han eliminado ' residuos de existencias antiguas. rellenó ' con suministros adicionales con respecto al control de la contaminación. 4.1.1.1 Agua El agua de red en los hospitales se almacena con frecuencia en frescos, lo que resulta en el problema de las soluciones contaminadas a las salas. Por lo tanto, los recipientes reutilizables deben lavarse y grandes tanques de techo, algunos de los cuales pueden ser secarse a fondo, y nunca rellenarse directamente. relativamente inaccesibles y mal mantenidos. El agua para la fabricación farmacéutica requiere algún tratamiento adicional, Otra práctica habitual en los hospitales es el reenvasado de productos comprados a granel en envases más pequeños. La mayor generalmente por destilación, ósmosis inversa o desionización o una manipulación del producto aumenta inevitablemente el riesgo de combinación de estos, según el uso previsto del agua. Dichos contaminación, como lo demuestra una encuesta en la que se procesos requieren un control cuidadoso, al igual que la calidad descubrió que los artículos reenvasados en hospitales estaban microbiológica del agua después del tratamiento. El almacenamiento contaminados con el doble de frecuencia que los del envase original (Informe del Servicio de Laboratorio de Salud Pública, 1971). de agua requiere un cuidado especial, ya que algunos organismos Gram - negativos Machine Translated by Google 282 Capítulo 17 4.2 En uso Los fabricantes de productos farmacéuticos pueden argumentar con razón que su responsabilidad termina con el suministro de un producto bien conservado de alto nivel microbiológico en un envase adecuado y que el uso posterior, o incluso el abuso, del producto les preocupa poco. Aunque se sabe mucho menos acerca de cómo se contaminan los productos durante el uso, su uso continuado en un estado contaminado es claramente indeseable, particularmente en hospitales donde podría resultar en la propagación de ción de úlceras de decúbito en pacientes geriátricos y de estancia prolongada se contaminaron durante el uso con Ps. aeruginosa y Staphylococcus aureus . Si no se conservan, estos productos permiten la multiplicación de contaminantes, especialmente si el agua está presente como parte de la formulación, por ejemplo, en emulsiones de aceite/agua (o/w), o como una película en emulsiones w/o que se han sometido a agrietamiento, o como una película condensada del agua atmosférica. Una cantidad apreciable de contaminantes puede luego transferirse a otros pacientes cuando se reutiliza el infecciones cruzadas. Todos los productos multidosis son producto. Claramente, la economía y la conveniencia de usar vulnerables a la contaminación durante su uso. ollas deben equilibrarse con el riesgo de propagación de Independientemente de que los productos se utilicen en el infecciones cruzadas entre pacientes y el inevitable aumento ' ámbito hospitalario o comunitario, las fuentes de contaminación de la estadía de lossoperas pacientes hospital. ha El uso de ollas en en los el hospitales disminuido son las mismas, pero las oportunidades de observarla son notablemente durante las últimas dos décadas más o menos. mayores en el primero. Aunque el riesgo de contaminación durante el uso del producto se ha reducido mucho en los Otra fuente potencial de contaminación en los hospitales es últimos años, principalmente a través de mejoras en el el personal de enfermería responsable de la administración de ' empaque y cambios en las prácticas de enfermería, es saludable reflexionar sobre los casos anteriores informados. medicamentos. Durante el curso de su trabajo, las manos de las enfermeras se contaminan con patógenos oportunistas que no 4.2.1 Fuentes humanas forman parte de la flora normal de la piel pero que se eliminan Durante el uso normal, los pacientes pueden contaminar su fácilmente mediante un lavado y secado minuciosos de las medicamento con su propia flora microbiana; el uso posterior manos. En salas muy concurridas, se puede pasar por alto el de tales productos puede o no resultar en una autoinfección lavado de manos entre atender a los pacientes y los contaminantes (Figura 17.3). pueden transferirse posteriormente a los medicamentos durante la administración. Los productos tópicos se consideran de mayor riesgo, ya Las lociones y cremas para manos utilizadas para evitar que las que el producto probablemente se aplicará a mano, lo que enfermeras manos introducirá contaminantes de la flora cutánea residente de similar, especialmente cuando se envasan en recipientes estafilococos, Micrococcus spp. y difteroides, pero también multidosis y se dejan al lado del lavabo, frecuentemente sin quizás contaminantes transitorios, como Pseudomonas tapas. Las lociones y cremas para manos deben estar bien o coliformes , que normalmente se eliminarían con un lavado conservadas e, idealmente, envasadas en dosificadores de manos eficaz. Las oportunidades de contaminación pueden reducirse usando aplicadores desechables para productos desechables. Otros métodos de control efectivos incluyen el ' suministro s packs de productos y el usoendelatécnicas administración no táctiles de medicamentos para tópicos o administrando productos orales con una cuchara de pacientes individuales. La importancia del minucioso lavado desechable. se agrieten pueden contaminarse de manera de manos en el control de la cruz hospitalaria. En los hospitales, los productos multidosis, una vez contaminados, pueden servir como vehículo de contaminación cruzada o de contaminación cruzada. la infección no se puede exagerar. En los últimos años, los hospitales han aumentado con éxito el nivel de conciencia infección entre pacientes. Productos a base de zinc envasados sobre este tema entre el personal y el público en general a en calderos grandes y utilizados en el tratamiento y prevención través de publicidad generalizada y la provisión de estaciones de desinfección de manos de fácil acceso en las salas. 1. Autoinfección Paciente 4.2.2 Fuentes ambientales Una pequeña Medicamento cantidad de contaminantes transportados por el aire pueden asentarse en productos que se dejan abiertos a la atmósfera. Algunos de estos morirán 2. Infección cruzada Paciente X Medicamento Paciente Y, Z manos de enfermeras durante el almacenamiento, y2el resto 3 probablemente permanecerá en un nivel estático de aproximadamente unidades formadoras colonias – 10 10(UFC) por gramo o por de mililitro. Una gran cantidad de contaminantes transportados por el agua pueden introducirse accidentalmente en el mecanismo de salpicadura tópica si se Figura 17.3 Mecanismos de contaminación durante el uso de medicamentos. ' productos con las manos mojadas o con un dejan al costado de un recipiente. Tales contaminantes generalmente Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 283 tienen requerimientos nutricionales simples y, luego de la multiplicación, utilizado con frecuencia. Dicha información se considera invaluable no los niveles de contaminación a menudo pueden exceder las UFC/g. En el 10 6 pasado, este problema se ha encontrado particularmente cuando el solo porque puede indicar la efectividad de las prácticas y estándares producto se almacenaba en salas cálidas de hospitales o en armarios de calidad del paciente puede equilibrarse con el costo inevitable de tales baño calientes y llenos de vapor en el hogar. Los productos que se procesos. existentes, sino también porque el valor de las mejoras potenciales en la utilizan en los hospitales como sucedáneos del jabón para bañar a los pacientes corren especial riesgo y pronto no solo se contaminan con 5.1 En la fabricación Las patógenos oportunistas como Pseudomonas spp., sino que también investigaciones realizadas por la Junta Nacional de Salud de Suecia en proporcionan condiciones propicias para su multiplicación. El problema 1965 revelaron algunos hallazgos sorprendentes sobre la calidad se ve agravado por las existencias almacenadas en frascos multidosis microbiológica general de los productos no estériles inmediatamente para uso de varios pacientes en la misma sala durante un período después de la fabricación. Se encontró rutinariamente una amplia gama prolongado de tiempo. de productos contaminados con Bacillus subtilis , Staph. albus , levaduras y mohos,una y además se de encontraron grandes cantidades de infección coliformes variedad tabletas. Además, dos brotes de a en nivel nacional en Suecia se relacionaron La población microbiana autóctona es bastante diferente en el hogar y en los hospitales. Los organismos patógenos se encuentran con mucha posteriormente con el uso involuntario de productos contaminados. más frecuencia en estos últimos y, en consecuencia, se aíslan con más Doscientos pacientes se vieron involucrados en un brote de salmonelosis, frecuencia de los medicamentos utilizados en el hospital. Por lo general, causado por tabletas de tiroides contaminadas con Salmonella bareilly hay menos oportunidades de contaminación en el hogar, ya que los pacientes generalmente reciben suministros individuales en pequeñas cantidades. y Sal. muenchen (ahora conocida como Salmonella enterica 4.2.3 Fuentes de equipos Los subesp. enterica serovariedad Bareilly y Sal. enterica serovar Muenchen pacientes y el personal de enfermería pueden utilizar una variedad de respectivamente); y ocho pacientes sufrieron infecciones oculares graves aplicadores (almohadillas, esponjas, cepillos y espátulas) durante la tras el uso de un ungüento oftálmico de hidrocortisona contaminado con administración de medicamentos, en particular para productos tópicos. Ps. aeruginosa . Los resultados de esta investigación tuvieron un profundo Si se reutilizan, se contaminan fácilmente y pueden ser responsables de efecto en la fabricación de todos los medicamentos; no solo se usaron perpetuar la contaminación entre las existencias frescas de producto, como criterio para comparar la calidad microbiológica de los no como se ha demostrado en estudios de productos cosméticos. Por lo tanto, siempre se deben usar aplicadores o hisopos desechables. productos estériles fabricados en otros países, sino también como punto de partida sobre el que podrían basarse las normas internacionales. Hoy en día, en los hospitales se utiliza una amplia variedad de equipos complejos en el curso del tratamiento de los pacientes. Según la Ley de Medicamentos del Reino Unido de 1968, se esperaba Los humidificadores, incubadoras, ventiladores, resucitadores y otros que los productos farmacéuticos fabricados en la industria cumplieran aparatos requieren un mantenimiento y descontaminación adecuados después de su uso. Los desinfectantes químicos usados para este con las especificaciones de calidad química y microbiológica. Desde propósito en el pasado, debido al mal uso, se han contaminado con a un alto estándar, aunque los controles puntuales han revelado entonces, se ha demostrado que la mayoría de los productos se ajustan patógenos oportunistas, como Ps. aeru ginosa e, irónicamente, han ocasionalmente medicamentos de calidad inaceptable y, por lo tanto, han contribuido, enen pacientes lugar de hospitalizados. reducir, la propagación de infecciones cruzadas requerido la retirada del producto. Por el contrario, los productos farmacéuticos fabricados en hospitales estaban mucho menos controlados, Los desinfectantes solo deben usarse para el fin previsto y las como lo demuestran varias encuestas en la década de 1970 en las que instrucciones de uso deben seguirse en todo momento. se encontró que un número significativo de preparaciones estaban contaminadas con Ps. aeruginosa . En 1974, sin embargo, la fabricación hospitalaria también pasó a estar bajo los términos de la Ley de Medicamentos y, como consecuencia, posteriormente se 5 El alcance de la contaminación microbiana observaron mejoras considerables no solo en las condiciones y el estándar de fabricación, sino también en la calidad química y microbiológica La mayoría de los informes de contaminación transmitida por de los productos terminados. . Posteriormente se racionalizaron las medicamentos en la literatura tienden a ser de naturaleza anecdótica, refiriéndose a un producto específico y un incidente aislado. Hay poca operaciones de fabricación de hospitales. Las limitaciones económicas provocaron una evaluación crítica del verdadero costo de estas información disponible sobre el riesgo general de que los productos se actividades. La compra competitiva de la industria en muchos casos produjo contaminen y causen infecciones en los pacientes cuando se utilizan de forma subsiguiente. Machine Translated by Google 284 Capítulo 17 alternativas más baratas y la fabricación a pequeña escala se por lo tanto, pueden verse en el hogar otros problemas además desaconsejaba en gran medida. Cuando había productos con de los de contaminación microbiana. licencia disponibles, la política del NHS dictaba que debían comprarse de una fuente comercial y no fabricarse localmente. 6 F actores que determinan el resultado de una infección La eliminación de la inmunidad de la Corona del NHS en transmitida por un medicamento 1991 significó que las operaciones de fabricación en los hospitales estaban sujetas a las disposiciones de licencia completas de la Ley de Medicamentos de 1968, es decir, las Aunque imposible de cuantificar, el uso de medicamentos farmacias de los hospitales que pretendían fabricar debían contaminados sin duda ha contribuido a la propagación de obtener una licencia de fabricación y cumplir plenamente con infecciones cruzadas en los hospitales; innegablemente, tales , infecciones nosocomiales (adquiridas en el hospital) también la Guía de la CE. a las Buenas Prácticas de Fabricación Farmacéutica (Anon, 1992 revisado en 1997, 2002 y 2007). han extendido la duración de la estancia en el hospital con ' Entre otros requisitos, esto incluía la provisión de condiciones costos concomitantes. medicamento contaminado el s respuesta alUndesafío microbiano de unapor estafa ambientales de fabricación apropiadas y el monitoreo paciente puede ser diverso e impredecible, quizás con consecuencias graves. Las reacciones clínicas pueden no ser ambiental asociado. Posteriormente, la Agencia de Control de Medicamentos (MCA) emitió una guía en 1992 sobre evidentes en un paciente, pero en otro pueden ser indiscutibles, ciertas exenciones de fabricación, en virtud del tamaño del lo que ilustra un problema en el reconocimiento de infecciones lote del producto o la frecuencia de fabricación. La necesidad transmitidas por medicamentos. Las reacciones clínicas pueden ' único de dispensación extemporánea de fórmulas especial continuó en las variar desde infecciones locales inconvenientes de heridas o farmacias hospitalarias, aunque este trabajo se transfirió en piel lesionada, causadas posiblemente por el contacto con una gran medida desde la mesa de dispensación a instalaciones crema contaminada, hasta infecciones gastrointestinales por la dedicadas a la preparación con el control ambiental ingestión de productos orales contaminados, hasta infecciones graves generalizadas, como bacteriemia o septicemia, que adecuado. Hoy en día, la fabricación hospitalaria se concentra en el suministro de productos a medida desde un centro posiblemente provoquen muerte, como la causada por la regional o en la fabricación especializada a pequeña escala administración de líquidos de infusión contaminados. Sin duda, brotes de infección más graves se han visto en el pasado de aquellos artículos que actualmente no se pueden obtener de la los industria. Sin embargo, el reenvasado de productos comerciales en tamaños de cuando se inyectaron productos contaminados directamente en envase más convenientes sigue siendo una práctica común. el torrente sanguíneo de pacientes cuya inmunidad ya estaba comprometida por su enfermedad o terapia subyacente. 5.2 En uso Invariablemente, se observan índices más altos de contaminación en los productos después de abrirlos y usarlos y, entre estos, los medicamentos que se usan en los hospitales tienen más probabilidades de estar contaminados que los que se usan en la El resultado de cualquier episodio está determinado por una combinación de varios factores, entre los que se encuentran el tipo y grado de contaminación microbiana, la ' vía de administración y la importancia s resistencia del paciente. son de particular comunidad en general. El Informe del Servicio de Laboratorio de Salud Pública de 1971 expresó su preocupación por la incidencia general de contaminación en productos no estériles utilizados en las salas de hospital (327 de 1220 muestras) y la proporción de 6.1 Tipo y grado de contaminación microbiana Los microorganismos que contaminan los o CFU/ml). y causan enfermedades en los pacientes muy contaminada (18 % > 10 En 4 muestras que resultaron ser CFU/g medicamentos particular, la presencia de Ps. aeruginosa en el 2,7 % de las pueden clasificarse como patógenos verdaderos o patógenos muestras (principalmente mezclas alcalinas orales) se oportunistas. Organismos patógenos como Clostridium tetani consideró muy indeseable. y Salmonella spp. Raramente ocurren en los productos, pero cuando están presentes causan serios problemas. Por el contrario, los medicamentos utilizados en el hogar no solo están menos contaminados, sino que también contienen Se han producido infecciones de heridas y varios casos niveles más bajos de contaminantes y menos organismos de muerte neonatal por el uso de polvos de talco que contienen Cl. tetano _ Brotes de salmonelosis han patógenos. Generalmente, hay menos oportunidades de contaminación aquí porque los pacientes individuales usan cantidades más pequeñas. seguido a la ingestión inadvertida de polvos tiroideos y pancreáticos contaminados. Por otro lado, patógenos oportunistas como Ps. aeruginosa otros organismos , ,Klebsiella se aíslan deSerratia con vidamás libre y almacenamiento pueden ser inadecuadas y las fechas de caducidad pueden ignorarse; frecuencia de Sin embargo, los medicamentos en el hogar pueden acumularse y usarse durante largos períodos de tiempo. Además, las condiciones de Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 285 medicamentos y, como su nombre indica, pueden ser en el tiempo de vaciado gástrico. Los contaminantes en los patógenos si se les da la oportunidad. La principal productos tópicos pueden causar poco daño cuando se depositan preocupación con estos organismos es que sus requisitos sobre la piel intacta. La piel en sí misma no solo proporciona una nutricionales simples les permiten sobrevivir en una amplia excelente barrera mecánica, sino que pocos contaminantes normalmente gama de productos farmacéuticos y, por lo tanto, tienden a estar presentes en sobreviven en competencia con su flora microbiana residente. 6 7 números elevados, quizás superiores a 10 CFU/ – 10 UFC/g o Sin embargo, la piel dañada durante una cirugía o un traumatismo ml. Sin embargo, es posible que el producto en sí no muestre o en pacientes con quemaduras o úlceras por presión puede signos visibles de contaminación. Los patógenos oportunistas colonizarse rápidamente y posteriormente infectarse con pueden sobrevivir en desinfectantes y soluciones antisépticas patógenos oportunistas. Los pacientes tratados con esteroides que normalmente se utilizan en el control de infecciones cruzadas tópicos también son propensos a infecciones locales, en particular en hospitales, pero que, cuando se contaminan, pueden incluso si se usan inadvertidamente esteroides contaminados. perpetuar la propagación de la infección. Se considera que los pacientes hospitalizados comprometidos, es decir, pacientes ancianos, quemados, traumatizados o inmunodeprimidos, corren un riesgo particular de infección por estos organismos, mientras 6.3 Resistencia del paciente Un paciente ' La resistencia de s es crucial para determinar el resultado de una infección transmitida por medicamentos. Los pacientes que los pacientes sanos en la comunidad general han dado pocos motivos para hospitalizados están más expuestos y son más inquietud. susceptibles a la infección que los tratados en la comunidad La dosis crítica de microorganismos que iniciarán una infección se desconoce en gran medida y varía no solo entre especies sino también dentro de una misma especie. Estudios pacientes traumatizados por cirugía o accidente pueden tener en animales y voluntarios humanos han indicado que la dosis infectante puede reducirse significativamente en presencia de traumatismos o cuerpos extraños o si se acompaña de un fármaco con acción vasoconstrictora local. 6.2 Vía de administración Como se indicó anteriormente, los productos contaminados inyectados general. Los recién nacidos, los ancianos, los diabéticos y los mecanismos de defensa deteriorados. Las personas que padecen leucemia y aquellas tratadas con inmunosupresores son las más vulnerables a la infección; hay un caso innegable para proporcionar todos los medicamentos en forma estéril para estos pacientes. 7 P roservación de m edicinas u lizando agentes antimicrobianos: p rincipios b ásicos directamente en el torrente sanguíneo o instilados en el ojo causan los problemas más graves. Las inyecciones intratecales y epidurales son procedimientos potencialmente peligrosos. En 7.1 Introducción Un ' ' antimicrobiano preservativo puede incluirse en una la práctica, las inyecciones epidurales se administran con formulación para minimizar el riesgo de deterioro y, preferiblemente, frecuencia a través de un filtro bacteriano. Las soluciones para eliminar los niveles bajos de contaminantes introducidos inyectables y oftálmicas suelen ser soluciones sencillas y proporcionan a los patógenos oportunistas gramnegativos durante el almacenamiento o el uso repetido de un envase multidosis. Sin embargo, cuando existe un bajo riesgo de suficientes nutrientes para multiplicarse durante el 106 almacenamiento; si está contaminado, se debe esperar una inclusión de un conservante puede ser innecesaria. Nunca se carga biológica de UFC, así como la producción de endotoxinas. deben agregar conservantes para enmascarar procesos de fabricación deficientes. Los fluidos losTPN, pacientes formulados individuales, para los también requisitos pueden nutricionales proporcionar de Las propiedades de un conservante ideal están bien reconocidas: un amplio espectro de actividad y una rápida tasa de destrucción; selectividad al reaccionar con los contaminantes y no con los ingredientes de la formulación; no irritante y no tóxico para el paciente; y estable y eficaz durante toda la vida del producto. un soporte nutricional más que adecuado para los contaminantes invasores. PD. aeruginosa para , el los notorio ojos,contaminante ha causado infecciones de las gotas oftálmicas graves, incluida la pérdida de la vista en algunos casos. El problema se agrava cuando el ojo se daña por el uso inadecuado de lentes de contacto o se raspa con las uñas o los aplicadores de cosméticos. contaminación, como con tabletas, cápsulas y polvos secos, la Desafortunadamente, los agentes antimicrobianos más activos son a menudo de acción no selectiva, interactuando El destino de los contaminantes ingeridos por vía oral en los significativamente con los ingredientes de la formulación, así medicamentos puede estar determinado por varios factores, como con los pacientes y los microorganismos. Habiendo como ocurre con los alimentos contaminados. La acidez del excluido los agentes más tóxicos, irritantes y reactivos, los estómago puede proporcionar una barrera eficaz, dependiendo restantes generalmente tienen una eficacia antimicrobiana modesta, y ningún conservante se considera ahora lo suficientemente atóxico para su de si el medicamento se toma con el estómago vacío o lleno y también Machine Translated by Google 286 Capítulo 17 áreas altamente sensibles, por ejemplo, para inyección en 7.3 Factores que afectan la 'disponibilidad' de los tejidos del sistema nervioso central o para uso dentro del ojo. Varios conservantes microbiológicamente efectivos utilizados conservantes p La mayoría de los conservantes interactúan en solución hasta cierto punto con muchos de los en cosméticos han causado un número significativo de casos ingredientes de formulación comúnmente utilizados a través de dermatitis de contacto y, por lo tanto, no se pueden usar en de una serie de atracciones de enlaces débiles, así como con cremas farmacéuticas. Aunque puede ser preferible una tasa cualquier contaminante presente. Pueden formarse equilibrios rápida de muerte, esto puede ser posible solo para soluciones acuosas relativamente simples, como gotas para los ojos o inestables en los que sólo una pequeña proporción del total ' disponible para conservante inactivar relativo el presente es una masa microbiana relativamente pequeña; la inyecciones. Para sistemas fisicoquímicamente complejos tasa de destrucción resultante puede ser mucho más baja de tales como emulsiones y cremas, la inhibición del crecimiento lo que podría anticiparse a partir del rendimiento de las y una tasa lenta de muerte pueden ser todo lo que se puede lograr de manera realista. soluciones acuosas simples. Sin embargo, el conservante aún ' no disponible ' puede contribuir a la irritación general del Para maximizar la eficacia de los conservantes, es esencial conocer los parámetros que influyen en la actividad de soluto son muy altas y la Aw se reduce considerablemente, antimicrobiana. producto. Comúnmente se cree que cuando las concentraciones la eficiencia de los conservantes a menudo se reduce significativamente y pueden ser virtualmente inactivos con una 7.2 Efecto de la concentración de conservantes, la Aw muy baja . La práctica de incluir conservantes en productos temperatura y el tamaño del inóculo Los cambios en la eficacia de los conservantes varían exponencialmente con con Aw muy bajo , como tabletas y cápsulas, es desaconsejable, los cambios en la concentración. El efecto de los cambios en la concentración (exponente de concentración, ÿ , Capítulo secas; si se humedecen, se echarían a perder por otros, no ya que solo ofrece una protección mínima para las tabletas 18) varía con el tipo de agente. Por ejemplo, reducir a la microbianos, razones. 6 ) mitad la concentración de fenol ( ÿ = 6) produce una reducción de 64 veces (2) en la actividad letal, mientras que una dilución 7.3.1 Efecto del pH del producto similar para la clorhexidina ( ÿ = 2) reduce la actividad solo 2 cuatro veces (2 se observan cambios en la actividad conservante ). También principalmente en las moléculas unionizadas y solo tienen una En los conservantes débilmente ácidos, la actividad reside con cambios en la temperatura del producto, de acuerdo con el efi cacia significativa a valores de pH donde la ionización es baja. coeficiente de temperatura, Q 10 . Por lo tanto, una reducción de la Así, los ácidos benzoico y sórbico (p Ka = 4,2 y 4,75, temperatura de 30 °Csignificativamente a 20 °C podría resultar quintuplicado en un factor en el caso respectivamente) tienen una utilidad conservante limitada por tasa reducida de muerte para Escherichia, encima de pH 5, mientras que los ésteres de 4( p )- coli de fenol (Q 10el=caso 5) y 45 del -etanol veces(Q en10 = 45). Si tanto la temperatura como la concentración al mismo situación es más compleja; sin varían embargo, se ha tiempo, sugeridola hidroxibenzoato (parabenos) con su grupo éster no ionizable y que si una solución de clorocresol al 0,1 % ( ÿ = 6, Q 10 = 5) efecto protector moderado incluso a niveles de pH neutro. La elimina por completo una suspensión de E. coli actividad de los conservantes de amonio cuaternario y la el sustituyente hidroxilo poco ionizable (p Ka c.8,5 ) tienen un clorhexidina reside probablemente en sus cationes; son a los 30 ° C en 10 minutos, se necesitarían alrededor de 90 minutos para lograr un efecto similar si se almacena ay20 ° C efectivos en productos de pH neutro. El pH de la formulación si un ligero sobrecalentamiento durante la producción hubiera resultado en microorganismos a los conservantes (consulte el Capítulo 18). también puede influir directamente en la sensibilidad de los una pérdida del 10% en la concentración de clorocresol (los demás factores permanecieron constantes). 7.3.2 Eficiencia en sistemas multifásicos En una formulación multifásica, como una emulsión de aceite en agua, las moléculas conservantes se distribuirán en un equilibrio inestable entre la fase acuosa a granel y (1) la fase Las moléculas conservantes se agotan porque inactivan los microorganismos y porque interactúan de forma no ' suciedad ' específica con cantidades significativas de contaminantes introducidos durante el uso. Esto dará como resultado una disminución progresiva y exponencial de la eficacia del ' ' conservante restante. Conservante es undescribir términoelusado nivel para capacidad acumulativo de contaminación que un oleosa por partición, (2) las micelas del tensioactivo por solubilización, (3) los agentes de suspensión poliméricos y otros solutos por desplazamiento competitivo del agua de solvatación, (4) partículas y superficies del recipiente por la formulación conservada puede tolerar antes de agotarse tanto como para volverse ineficaz. Esto variará con el tipo de conservante y la complejidad de la formulación. adsorción y (5) cualquier microorganismo presente. En general, la eficiencia general del conservante se puede relacionar con la pequeña proporción de pre Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 287 las moléculas de servicio permanecen sin unir en la fase acuosa a El aseguramiento de la calidad abarca, a su vez, un esquema granel, aunque a medida que se agota se puede anticipar un de gestión que abarca todos los procedimientos necesarios para reequilibrio lento entre los componentes. La pérdida de moléculas proporcionar una alta probabilidad de que un medicamento se neutras en las fases oleosa y micelar puede verse favorecida sobre ajuste consistentemente a una descripción de calidad específica. las especies ionizadas, aunque se encuentra una variación Incluye diseño y desarrollo de formulaciones (I+D), GPMP, así considerable en la distribución entre diferentes sistemas. como control de calidad y vigilancia posterior a la comercialización. Dado que muchos microorganismos pueden ser peligrosos para En vista de estas importantes reducciones potenciales en la los pacientes o causar el deterioro de las formulaciones en eficacia conservante, se ha realizado un esfuerzo considerable condiciones adecuadas, es necesario realizar una evaluación del para idear ecuaciones en las que uno podría sustituir parámetros riesgo de contaminación para cada producto. En cada etapa de su vida prevista, desde las materias primas hasta la administración, del sistema derivados de diversas formas (como coeficientes de partición, constantes de unión de polímeros y surfactantes y se debe realizar una evaluación de riesgos y se deben desarrollar proporciones de aceite:agua) para obtener estimaciones de los y calcular estrategias para reducir los riesgos generales a niveles niveles de conservantes residuales en las fases acuosas. Aunque aceptablemente bajos. Dichas evaluaciones de riesgos se se han obtenido algunas predicciones modestamente exitosas para complican por las incertidumbres acerca de los peligros exactos de sistemas de laboratorio muy simples, han demostrado tener un infección y deterioro probables para muchos contaminantes, y por valor práctico limitado, ya que los datos de muchos de los las dificultades para medir su desempeño preciso en sistemas parámetros requeridos no están disponibles para los ingredientes complejos. Como las consecuencias del fracaso del producto y el de grado técnico o para los sistemas comerciales más complejos. daño al paciente serán inevitablemente graves, es habitual que las empresas de fabricación hagan suposiciones en el peor de los 7.3.3 Efecto del envase o empaque La casos y diseñen estrategias para cubrirlos por completo; también disponibilidad de conservantes puede reducirse considerablemente se abordan problemas menores. Dado que debe suponerse que por la interacción con los materiales de empaque. Los fenólicos, por ejemplo, impregnarán las almohadillas de goma y las tetinas todos los microorganismos pueden ser potencialmente peligrosos por aquellas vías de administración en las que la probabilidad de de las inyecciones multidosis o los envases de gotas para los ojos infección por contaminantes es alta, los medicamentos que se y también interactuarán con los tubos flexibles de nailon para administren por estas vías deben suministrarse en forma estéril, cremas. Los niveles de conservantes de amonio cuaternario en las como es el caso de productos inyectables. También se debe formulaciones se han reducido significativamente mediante la suponer que quienes administran medicamentos no necesariamente adsorción en las superficies de los recipientes de plástico y vidrio. están altamente capacitados o motivados en las técnicas de control Los conservantes volátiles como el cloroformo se pierden tan de la contaminación; en estas situaciones pueden incluirse fácilmente al abrir y cerrar rutinariamente los envases que su salvaguardas adicionales para controlar los riesgos. Esto puede utilidad se restringe un poco a la conservación de medicamentos incluir información detallada sobre administración y capacitación, en envases sellados e impermeables durante el almacenamiento, además de proporcionar una formulación de alta calidad. con una vida útil corta una vez abiertos. 8.2 Garantía de calidad en el diseño y desarrollo de formulaciones El riesgo de infección microbiana y 8 Garantía de calidad y control del riesgo microbiano en medicamentos deterioro que surge de la contaminación microbiana durante la fabricación, el almacenamiento y el uso podría eliminarse presentando todos los medicamentos en unidades de dosis única 8.1 Introducción Los estériles e impermeables. Sin embargo, el alto costo de esta fabricantes de medicamentos deben cumplir con los requisitos de estrategia restringe su uso a situaciones donde existe un alto riesgo su autorización de comercialización (licencia de producto) y de infección consecuente de cualquier contaminante. Cuando el asegurarse de que sus productos sean aptos para el uso previsto riesgo se evalúa como mucho menor, se adoptan estrategias en términos de seguridad, calidad y eficacia. menos eficientes pero menos costosas. El alto riesgo de infección cacy Por lo tanto, debe existir un sistema de gestión de calidad por contaminantes en los medicamentos parenterales, combinado (QMS) para que la alta dirección pueda garantizar que se cumplan con la preocupación por la toxicidad sistémica de los conservantes, los objetivos de calidad requeridos a través de un sistema de exige casi siempre unidades de dosis única estériles. Con colirios garantía de calidad (QA) diseñado de manera integral e de uso doméstico los riesgos se perciben menores, y productos implementado correctamente, que abarque tanto el GPMP como el multidosis estériles con conservantes para combatir control de calidad (QC). . Machine Translated by Google 288 Capítulo 17 se aceptan las contaminaciones previstas durante el uso; Las encontrado en uso, se sabe que el cultivo repetido en medios unidades estériles de dosis única son más comunes en hospitales microbiológicos convencionales (agar nutritivo, etc.) frecuentemente donde existe un mayor riesgo de infección. En general, se percibe da como resultado una reducción de la virulencia de las cepas. Los que las vías de administración oral y tópica presentan riesgos intentos de mantener la actividad de deterioro mediante la inclusión relativamente bajos de infección y se hace más hincapié en el de ingredientes de formulación en medios de cultivo dan resultados control del contenido microbiano durante la fabricación y la variados. Algunos fabricantes han podido mantener activas las subsiguiente protección de la formulación contra el deterioro químico cepas de deterioro mediante el cultivo en alícuotas diluidas o sin conservantes de formulaciones. y fisicoquímico. Como parte del proceso de diseño, es necesario incluir La British Pharmacopoeia y la European Pharmacopoeia características en la formulación y el sistema de administración que describen una prueba conservante de desafío único que utiliza brinden la mayor protección posible contra la contaminación rutinariamente cuatro organismos de prueba (dos bacterias, una microbiana y el deterioro. Debido a los posibles problemas de levadura y un moho), ninguno de los cuales tiene un historial toxicidad e irritación, los conservantes antimicrobianos solo deben significativo de potencial de deterioro y que se cultivan en medios considerarse cuando exista una clara evidencia de beneficio positivo. convencionales. . Sin embargo, se recomienda la extensión de la La manipulación de parámetros fisicoquímicos, como Aw , la prueba básica en algunas situaciones, como la inclusión de una eliminación de ingredientes especialmente sensibles (por ejemplo, ingredientes naturales como levadura osmotolerante si se piensa que tal deterioro durante el uso el polvo de tragacanto, utilizado como agente espesante), la podría ser un problema. A pesar de sus limitaciones aceptadas y las selección de un conservante o la elección del envase pueden indicaciones cautelosas dadas sobre lo que las pruebas podrían contribuir individual y colectivamente de forma significativa formas sugerir acerca de una formulación, la prueba proporciona algunos de dosificación secas donde indicadores básicos pero útiles de la probable estabilidad en uso. ' medicamento. Debido a que su muy baja Aw brinda protección Las solicitudes de licencia de producto del Reino Unido para medicamentos conservados deben demostrar que la formulación contra el ataque microbiano, las propiedades de vapor húmedo de cumple al menos con los criterios de eficacia conservante de la Farmacopea Británica los materiales de empaque requieren un examen cuidadoso. o una prueba similar. a la estabilidad general del Los conservantes están destinados a ofrecer una mayor El concepto del valor D tal como se utiliza en la tecnología de protección contra los contaminantes microbianos ambientales. Sin esterilización (Capítulo 21) se ha aplicado a la interpretación de las embargo, dado que son relativamente inespecíficos en su reactividad pruebas de provocación. La expresión de la tasa de inactivación (ver sección 7), es difícil calcular con certeza qué proporción de conservante agregado a todos, excepto al medicamento más simple, microbiana en un sistema preservado en términos de un valor D permite estimar el tiempo nominal para estará disponible para inactivar dicha contaminación. Se han ideado lograr un nivel proporcional prescrito de muerte. Sin embargo, pruebas de laboratorio para desafiar el producto con una carga surgen problemas cuando se trata de predecir el comportamiento de biológica artificial. Tales pruebas deben formar parte de los ensayos niveles muy bajos de supervivientes, y el método tiene tanto críticos como defensores. de desarrollo y estabilidad de la formulación para garantizar que es probable que se mantenga la actividad adecuada durante toda la vida útil del producto. Normalmente no se utilizan en el control de 8.3 Buenas prácticas de fabricación de productos farmacéuticos (GPMP) calidad de fabricación de rutina. Pruebas de desafío con conservantes ' Algunos ' (eficacia conservante - GPMP se ocupa de la fabricación de medicamentos e incluye el pruebas de inactivación) agregan inóculos relativamente grandes control de ingredientes, construcción de plantas, validación de de varios cultivos de laboratorio a alícuotas del producto y determinan procesos, producción y limpieza (consulte también el Capítulo 23). su tasa de inactivación mediante métodos de conteo viables (pruebas de desafío único), mientras que otros reinoculan Los requisitos actuales de GPMP (cGPMP) se encuentran en la sección Medicamentos y productos para el cuidado de la salud. repetidamente a intervalos establecidos, monitoreando la eficiencia Normas y directrices de la Agencia Reguladora (MHRA) para de la inactivación hasta el sistema falla (prueba de desafío múltiple). fabricantes y distribuidores de productos farmacéuticos, conocida Esta última técnica puede dar una mejor estimación de la capacidad como la Guía naranja (Anon 2007), y sus 20 anexos. de conservación del sistema que el enfoque de desafío único, pero El control de calidad es la parte del GPMP que se ocupa de la especificación, consume mucho tiempo y es costoso. la documentación y la evaluación de la conformidad con la especificación. Los problemas surgen cuando se decide si el rendimiento observado en dichas pruebas proporciona predicciones fiables de la eficacia Con el control de calidad tradicional, se ha puesto una gran confianza en probar muestras de productos terminados para real en uso. Aunque los organismos de prueba deben tener alguna determinar la calidad general de un lote. Sin embargo, esta práctica similitud en el tipo y el potencial de deterioro de los puede resultar en pérdidas financieras considerables si el incumplimiento es Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 289 detectado solo en esta etapa tardía, dejando las costosas opciones de descartar o volver a trabajar el lote. Además, algunos métodos de análisis microbiológicos tienen poca precisión y/o exactitud. La validación puede ser compleja o imposible, y la interpretación de los resultados puede resultar difícil. Por ejemplo, aunque un nivel de garantía de esterilidad a 6enviados a una esterilización terminal un fracaso en 10 inferior artículos ' proceso de esterilización se considera aceptable, no se puede pruebas cultivo de tejidos humanos o animales, se hacen esfuerzos considerables para excluir las líneas celulares contaminadas con virus huésped latentes. Las directrices oficiales para limitar el riesgo de contaminación por priones en los medicamentos exigen que los ingredientes derivados de bovinos se obtengan de fuentes donde la encefalopatía espongiforme bovina (EEB) no sea endémica. Al considerar la planta de fabricación y sus alrededores desde un punto de vista ecológico y fisiológico de los microorganismos, es confiar en el convencional para la esterilidad de los productos posible no solo identificar áreas donde los contaminantes pueden terminados (como el de la Farmacopea Europea ) para encontrar un acumularse e incluso prosperar para crear peligros para los lotes de microbio dañado pero viable dentro de los 10 elementos, 6 independientemente de permitir cultivo con del cualquier precisión (Capítulo 21). Además,sulas pruebas producto final no condiciones operativas en para desalentar tal colonización. La evitarán y es posible que ni siquiera detecten la falla de procesamiento facilidad para limpiar y secar el equipo a fondo es un impedimento no autorizada aislada. muy útil para el crecimiento. Las consideraciones de diseño deben Ahora se acepta generalmente que una alta garantía de la calidad producción posteriores, sino también manipular el diseño y las incluir la eliminación de rincones y grietas oscuros (donde las biopelículas pueden establecerse fácilmente) y la capacidad de limpiar general del producto solo puede provenir de una especificación, a fondo en todas las áreas. Algunos equipos más grandes ahora control y seguimiento detallados de todas las etapas que contribuyen tienen sistemas de limpieza en el lugar (CIP) y esterilización en el al proceso de fabricación. lugar (SIP) instalados para mejorar las capacidades de Entonces se pueden tomar decisiones más realistas sobre la descontaminación. conformidad con la especificación usando información de todos parámetros relevantes (método de liberación paramétrica), no solo Puede ser necesario incluir pasos intermedios dentro del de los resultados de pruebas selectivas de productos terminados. Por procesamiento para reducir la carga biológica y mejorar la eficiencia lo tanto, se lograría una estimación más realista de la calidad de los ciclos de esterilización letal, o para evitar que el conservante microbiana de un lote de tabletas a partir del conocimiento de se inunde en un medicamento no estéril después de la fabricación. parámetros específicos (como la carga biológica microbiana de los Algunos de los productos derivados de la biotecnología más nuevos materiales de partida, los registros de temperatura de los hornos de y frágiles pueden incluir etapas de procesamiento cromatográfico y/o secado de gránulos, el nivel de humedad de los gránulos secos , de ultrafiltración para garantizar reducciones adecuadas de los niveles datos de compactación, registros de validación para la máquina de de contaminación viral en lugar de los ciclos de esterilización sellado de tiras de aluminio y niveles microbianos en las tabletas convencionales. terminadas), que solo del contenido de contaminantes de las tabletas terminadas. De manera similar, la liberación paramétrica ahora se En un ejercicio de validación, debe demostrarse que cada etapa del sistema es capaz de proporcionar el grado de eficiencia previsto acepta como una alternativa operativa a las pruebas de esterilidad de dentro de los límites de variación para los que fue diseñado. Los rutina para la liberación de lotes de algunos productos estériles aspectos de deterioro microbiano de la validación del proceso pueden terminados. A través de la liberación paramétrica el fabricante puede incluir el examen del sistema de limpieza para determinar su brindar seguridad de que el producto es de la calidad estipulada, con capacidad para eliminar la contaminación introducida deliberadamente. base en la evidencia de la validación exitosa del proceso de La eliminación cromatográfica de contaminantes víricos se validaría fabricación y la revisión de la documentación sobre el seguimiento determinando la reducción logarítmica alcanzable frente a un título del proceso realizado durante la fabricación. Los evaluadores conocido de partículas víricas añadidas. farmacéuticos, junto con los inspectores de GMP, otorgan, rechazan o retiran la autorización para la liberación paramétrica; los requisitos se detallan en el Anexo 17 de la Guía Naranja 2007. 8.4 P rocedimientos de control de calidad Si bien existe un acuerdo general sobre la necesidad de controlar los niveles microbianos totales en los medicamentos Puede ser necesario excluir ciertos contaminantes indeseables no estériles y de excluir ciertas especies que anteriormente de los materiales de partida, como los anuncios de seudomonas del resultaron problemáticas, la precisión y exactitud de los métodos gel de hidróxido de aluminio a granel, o incluir alguna forma de actuales para contar (o incluso detectar) algunos los microbios pretratamiento para reducir sus biocargas por irradiación, como la en productos complejos son pobres. Los patógenos, presentes cáscara de ispágula, materiales a base de hierbas y especias. Para en cantidades bajas ya menudo dañados por el procesamiento, medicamentos derivados de la biotecnología producidos en pueden ser muy difíciles de aislar. Productos que muestran deterioro activo Machine Translated by Google 290 Capítulo 17 puede producir recuentos viables sorprendentemente bajos en las pruebas. Aunque en la actualidad su uso no es generalizado, los métodos Aunque esté presente en grandes cantidades, un organismo en prometedores incluyen la impedancia eléctrica, el uso de tintes ' vital ' fluorescentes y epif uorescencia, y el uso de colorantes. particular puede no ser ni patógeno ni el principal agente de deterioro, pero puede ser relativamente inerte, por ejemplo, esporas Avances considerables en la sensibilidad de los métodos para no germinadas o un contaminante secundario que ha superado al estimar el ATP microbiano usando luciferasa ahora permiten la agente de deterioro iniciador. El crecimiento desigualmente estimación de biocargas extremadamente bajas. El desarrollo distribuido en formulaciones viscosas presentará serios problemas reciente de dispositivos de escaneo láser altamente sensibles para de muestreo. El tipo de medio de cultivo (incluso diferentes lotes del detectar bacterias marcadas de diversas formas con sondas mismo medio) y las condiciones de recuperación e incubación fluorescentes selectivas permite la detección aparente incluso de pueden influir significativamente en los recuentos viables obtenidos células individuales. de los productos. Los niveles de endotoxinas (pirógenos) en productos parenterales Un problema no resuelto se refiere al momento del muestreo. y similares deben ser extremadamente bajos para evitar un shock endotóxico grave durante la administración (Capítulo 22). Los niveles bajos de pseudomonas poco después de la fabricación pueden no constituir un riesgo de deterioro si se controla su Anteriormente, esto se verificaba inyectando conejos y observando crecimiento. Sin embargo, si no se controlan, los niveles altos bien cualquier respuesta febril. La mayoría de las determinaciones ahora pueden iniciar el deterioro. se realizan utilizando la prueba de Limulus en la que un lisado de La Farmacopea Europea ha introducido estándares microbianos amebocitos del cangrejo herradura ( Limulus polyphemus ) reacciona tanto cuantitativos como cualitativos para no específicamente con lipopolisacáridos microbianos para dar un gel medicamentos estériles, que pueden ser exigibles en algunos y opacidad incluso a diluciones muy altas. Una variante de la prueba estados miembros. Prescribe niveles microbianos totales máximos que usa un sustrato cromogénico da un punto final coloreado que variables y la exclusión de especies particulares de acuerdo con las puede detectarse espectroscópicamente. Se están desarrollando vías de administración. La Farmacopea Británica ahora ha incluido pruebas de cultivo de tejidos en las que se mide directamente la estas pruebas, pero sugiere que deben usarse para ayudar a validar capacidad de las endotoxinas para inducir la liberación de citoquinas. los procedimientos de procesamiento de GPMP y no como En la industria alimentaria se han desarrollado métodos estándares de conformidad para las pruebas de rutina del producto sofisticados y muy sensibles para detectar muchas otras toxinas final. Así, para que un medicamento se administre por vía oral, el microbianas. Por ejemplo, la detección de aflatoxinas en materiales recuento viable total (TVC) no debe ser mas de 10 herbales, semillas y sus aceites se realiza mediante extracción con 3 bacterias aeróbicas o 10 2 solvente, adsorción en columnas que contienen anticuerpos hongos por gramo o mililitro de producto, y debe haber ausencia de selectivos para la toxina y detección por exposición a luz ultravioleta. Escherichia coli . Se pueden permitir niveles más altos si el producto contiene materias primas de origen natural, como en el caso de los productos a base de hierbas en los que el TVC 5 no debe exceder de 10 bacterias aeróbicas, 104 hongos y 10 Aunque sería inusual probar signos de deterioro fisicoquímico o químico activo de los productos como parte de los procedimientos 3 de control de calidad de rutina del producto, esto puede ser Enterobacterias y Gram - negativas, con ausencia de E.coli / gramo necesario ocasionalmente para examinar un incidente de falla o mililitro y Salmonella / 10 gramo o mililitro. anticipada del producto, o durante el desarrollo de la formulación. Muchos de los metabolitos volátiles y de sabor desagradable La mayoría de los fabricantes realizan pruebas periódicas en generados durante el deterioro activo son fácilmente evidentes. Su sus productos para los recuentos microbianos totales y la presencia caracterización por cromatografía líquida de alta resolución o de microorganismos problemáticos conocidos; por lo general, se cromatografía de gases se puede utilizar para distinguir el deterioro utilizan para la confirmación interna de la eficacia continua. microbiano de otros, no eficiencia de sus sistemas cGPMP, en lugar de como pruebas deterioro biológico. El deterioro a menudo da como resultado cambios convencionales de conformidad del producto final. La fluctuación en fisicoquímicos que pueden controlarse mediante métodos convencionales. los valores, o la aparición de especies específicas e inusuales, Por lo tanto, el deterioro de la emulsión se puede seguir mediante el control pueden advertir sobre defectos en los procedimientos y problemas de los cambios en las tasas de formación de crema, los cambios de pH, la inminentes. sedimentación de partículas y la viscosidad. Para reducir los costos de las pruebas y acortar los períodos de 8.5 Vigilancia posterior a la cuarentena, existe un interés considerable en las alternativas automatizadas a los métodos de prueba convencionales para la comercialización A pesar de un amplio desarrollo y un detección y determinación de microorganismos. riguroso cumplimiento de los procedimientos, es imposible garantizar que un medi Machine Translated by Google Deterioro microbiano, riesgo de infección y control de contaminación 291 el cine nunca fallará bajo los duros abusos de la vida real condiciones. Un sistema de garantía de calidad adecuado debe 11 Referencias y lecturas adicionales incluir procedimientos para monitorear el desempeño en uso y para responder a las quejas de los clientes. Estos deben ser seguidos Alejandro , RG , wilson , fiscal de distrito y davidson , AG (1997) Investigación meticulosamente en gran detalle para decidir si los esquemas de la Agencia de Control de Medicamentos sobre la calidad microbiana cuidadosamente construidos e implementados para la seguridad del 259, Pharm 259 – 261 . de los productos a base de hierbas. J , Anon ( 1992 ), ( 1997 ), producto requieren modificación para evitar que el incidente se repita. ( 2002 ) Normas que rigen los productos medicinales en la Comunidad Europea , Vol IV . Oficina de Publicaciones Oficiales de la CE , Bruselas. 9 Resumen Anónimo (1994). Dos niños mueren después de recibir soluciones de NPT . de productos , 596(2007) infectadas. Pharm J , 252 fabricantes Anon Normas y farmacéuticos orientación para Londres. y Distribuidores . Prensa farmacéutica Indudablemente, la prevención es mejor que la cura para minimizar el riesgo de infecciones transmitidas por medicamentos. En la fabricación, deben observarse los principios de GMP y deben incorporarse medidas de control en todas las etapas. Por lo tanto, las pruebas iniciales de estabilidad deben mostrar que la formulación propuesta puede soportar un desafío microbiano apropiado; las materias primas de un proveedor autorizado deben cumplir con las especificaciones microbianas internas; las condiciones ambientales apropiadas para el proceso de producción deben estar sujetas a un control microbiológico periódico; y finalmente, el análisis del producto final debe indicar que el producto es microbiológicamente adecuado para su uso previsto y cumple con los estándares internos e internacionales aceptados. , , AT (1983) Sistemas Surfactantes, Su , Química, Farmacia y Biología . Chapman & Hall Londres. Baines ,A. (2000) Pruebas de endotoxinas. En: Manual de Control Attwood , D. y Florencia Microbiológico: Productos Farmacéuticos y Dispositivos Médicos (eds. RM Baird , NA Hodges y SP Denyer), págs. 144 a 167. Taylor y Francis , Londres Baird, RM (1981) Medicamentos y cosméticos. En: Biodeterioro Microbiano (ed. AH Rose), págs. 387 – 426. Prensa Académica, Londres Baird , RM (1985) Contaminación microbiana de productos farmacéuticos productos elaborados en una farmacia hospitalaria. 234, 54 – 55 . Pharm, Jde , Baird RM (1985) Contaminación microbiana productos farmacéuticos no estériles elaborados en hospitales de la Autoridad de Salud Regional del Noreste. J Clin , 10 , 95 – 100 . Hosp Pharm Baird RM (2004) Aseguramiento de la esterilidad: conceptos, métodos yconservación problemas. En: Principios y (eds práctica de , desinfección, y esterilización A. Fraise P. Lambert & J - Y. Con base en el conocimiento actual, los contaminantes, en virtud de su tipo o número, no deberían representar un peligro potencial para la salud de los pacientes cuando se usan. La contaminación durante el uso es menos fácil de controlar. Las medidas exitosas en la farmacia hospitalaria han incluido el envasado de productos en unidades individuales, desalentando así el uso de envases multidosis. El envasado unitario (una dosis por paciente) tiene claras ventajas, pero las limitaciones económicas , Maillard), 4ª ed., págs. 526 – 539. Blackwell Scientific Baird RM & Shooter RA ( 1976 ) , Pseudomonas aeruginosa , oxford infecciones asociadas con el uso de medicamentos contaminados mentos Br Med J , ii , 349 – 350 . Baird , RM , Marrón, WRL y tirador , RA (1976) Pseudomonas aeruginosa en farmacias hospitalarias. Br Med J , i , 511 – 512 . RM masii Baird, ,Elhag, KM & en Shaw, EJhospital. (1976)de Pseudomonas el desuministro un 493 Jagua Med – 495 destilada Microbiol . tho , 9, han impedido que se lleve a cabo este procedimiento deseable. En última instancia, el enfoque más fructífero es a través de la formación y educación de los pacientes y el personal del hospital, de modo que los medicamentos se utilicen únicamente para el fin previsto. La tarea de implementar este enfoque recae inevitablemente en los farmacéuticos clínicos y comunitarios del futuro. 10 Reconocimiento Agradecemos a Edgar Beveridge quien contribuyó con un capítulo sobre deterioro y conservación en ediciones anteriores de este libro. Baird , RM , parques , A. y Awad , ZA (1977) Control de Pseudomonas aeruginosa en ambientes de farmacia y – 165Crowden . , 164 medicamentos. Pharm J , 119 Baird CA , RM , , , O Farrell , SM y Tirador RA (1979) Contaminación microbiana de productos farmacéuticos 83 , 277 – 283 . en el hogar. J Hyg , Baird RM y Bloomfield SFL (1996) Garantía de calidad microbiana de cosméticos, artículos de tocador y farmacéuticos no estériles . Taylor y Francis , productos , Baird , Londres , RM , Hodges, NA y Denyer, SP (2000). Manual de Control Microbiológico: Productos Farmacéuticos y Dispositivos Médicos . Taylor y Francis , Londres Bassett, DCJ Causas y prevención de la sepsis por bacterias (1971) Gram negativas: fuentes comunes de brotes. Proceso 980 – R Soc Med, 64, 986.