Radioinmunoensayo bueno
Anuncio

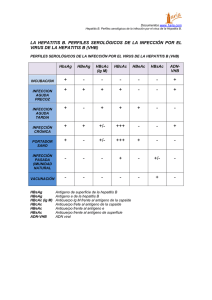
UNIVERSIDAD NACIONAL DE TRUJILLO RADIOINMUNOENSAYO (RIA) Nombres y Apellidos: Kevin Javier Del Aguila Rios Docente: Dr. Manuela Natividad Luján Velásquez EL PRINCIPIO DEL RIA Incluye la unión competitiva de un antígeno radiomarcado y antígeno no marcado a un anticuerpo de alta afinidad. El antígeno marcado se mezcla con una anticuerpo a una concentración que satura los sitios de unión de antígeno del anticuerpo. En seguida se añaden en cantidades crecientes las muestras de antígeno no marcado de concentración desconocida El anticuerpo no distingue el antígeno marcado del no marcado, por lo que los dos tipos de antígeno compiten por los sitios de unión disponibles en el anticuerpo. Conforme a la concentración de antígeno no marcado aumenta, más antígeno marcado se desplaza de los sitios de unión. RADIOINMUNOANÁLISIS (RIA) Una de las técnicas más sensibles para detectar antígeno o anticuerpo es el radioinmunoensayo. La técnica la desarrollaron en 1960 dos endocrinólogos, para determinar las concentraciones de complejos de insulina y antiinsulina en diabéticos. Aunque la técnica se recibió con escepticismo, pronto se demostró su valor para medir hormonas, proteínas séricas, fármacos y vitaminas a concentraciones de 0.001 microgramos por mililitro o menos. La disminución de la cantidad de antígeno radiomarcado que se une al anticuerpo específico en presencia de la muestra en estudio se mide para determinar la cantidad de antígeno que esta última contiene. Por lo general el antígeno se marca con un isótopo de emisión gamma como I125, pero también suelen emplearse como marcas isótopos de emisión beta como tritio. El antígeno radiomarcado es parte de la mezcla de valoración; la muestra de estudio puede ser alguna compleja; como suero u otros líquidos corporales, que contiene el antígeno no marcado. ETAPAS DEL RIA La primera etapa para llevar a cabo un RIA es determinar la cantidad de anticuerpo necesario para unir 50 a 70% de la cantidad fija de antígeno radioactivo Ag* en la mezcla por valorar. Esta relación de anticuerpo con Ag* se eligió para asegurar que la cantidad de epítopos que el antígeno marcado presenta siempre exceda el número total de sitios de unión de anticuerpo. En consecuencia el antígeno no marcado adicionado a la mezcla de estudio compite con el antígeno radiomarcado por el abastecimiento limitado de anticuerpo. Inclusive una cantidad pequeña de antígeno no marcado añadido a la mezcla de valoración de antígeno marcado y anticuerpo origina un descenso en la cantidad de antígeno radiactivo unido y esta disminución es proporcional a la cuantía del antígeno no marcado añadido. Con el objeto de determinar la cantidad de antígeno marcado unida, al complejo Ag-Ac se precipita para separarlo del antígeno libre (antígeno no unido a Ac) y se mide la radioactividad en el precipitado. Puede generarse una curva estándar utilizando muestras de antígeno no marcado de concentración conocida (en lugar de la muestra de estudio) y a partir de esta gráfica es posible determinar con precisión la cantidad de antígeno en la mezcla de estudio. SEPARACIÓN DE LAS FASES LIGADA Y NO LIGADA Tras la reacción antígeno-anticuerpo, en el tubo de reacción encontraremos: las fracciones libres, constituidas por antígeno frío y antígeno marcado las fracciones ligadas formadas por complejos antígeno-anticuerpo y antígeno marcado-anticuerpo. Sin embargo, la radiactividad total en el tubo permanece constante antes y después de la reacción, por lo que hay que separar la fase ligada de la no ligada y contar la radiactividad en una de ellas, sin interferencia de la otra. Hay diferentes métodos de separación están basados en las distintas propiedades del antígeno libre y del complejo antígenoanticuerpo: Adsorción Precipitación química Precipitación inmunológica Fase sólida Adsorción: Con carbón activo, dextrano o resinas. Adsorben (se unen) específicamente la fase libre (antígenos frío y caliente) pero no se unen a los complejos antígeno-anticuerpo que quedarían en solución. Tras centrifugación, el carbón sedimenta en el fondo del tubo con la fase no ligada mientras que la fase ligada queda en el sobrenadante, que se aspira o decanta. Este método se utiliza cada vez menos. Precipitación química: Hay substancias como el etanol, el propilenglicol o el sulfato amónico que alteran la solubilidad de las proteínas provocando su precipitación. Precipitan los complejos ligados. Tras centrifugación, quedan los complejos ligados en el sedimento y la fracción libre en el sobrenadante, que se elimina por aspiración o decantación. Precipitación inmunológica: Se utiliza un segundo anticuerpo contra el anticuerpo del sistema. La unión del segundo anticuerpo al complejo antígeno-anticuerpo da lugar a un complejo de gran tamaño, en general insoluble y fácilmente precipitable. Tras incubación y centrifugación, la fase libre queda en el sobrenadante y se separa por aspiración o decantación. Este método es muy utilizado en RIA. Por ejemplo, si el complejo Ag-Ab contiene anticuerpo IgG de conejo, entonces la IgG anticonejo de cabra se une a la IgG de conejo y precipita el complejo. En otro método se utiliza el hecho de que la proteína A de Staphylococcus aureus tiene alta afinidad por la inmunoglobulina G (IgG). Si el complejo Ag-Ab contiene un anticuerpo IgG, el complejo puede precipitarse mezclándolo con S. aureus muerto con formalina. Tras eliminar el complejo por cualesquiera de estos métodos es posible medir la cantidad de antígeno marcado libre que queda en el sobrenadante con un contador de radiación; la sustracción de este valor de la cantidad total de antígeno marcado añadido proporciona la cantidad de antígeno marcado unido. Fase sólida: Consiste en inmovilizar al anticuerpo a un soporte sólido, que puede ser la propia pared del tubo, bolitas de vidrio, partículas de Sephadex(polímero). La separación se consigue simplemente aspirando el medio de incubación. Este método tiende cada vez más a utilizarse por ser sencillo, práctico, más corto y requiere menos manipulación, e incluso permite suautomatización. ENSAYOS INMUNORADIOMÉTRICOS Un diseño más es el ensayo inmunoradiométrico (IRMA) en el cual no ocurre el proceso de desplazamiento del trazador sino que se utiliza únicamente la unión del anticuerpo a dos sitios de unión distintos que posee el ligando. Entonces la marca está en el anticuerpo, una población de anticuerpos está inmovilizado y la otra está marcada y soluble. Cuando se une el anticuerpo inmovilizado con el ligando, se fija el complejo al soporte y posteriormente se une el anticuerpo marcado a otro sitio libre, quedando el ligando unido al complejo, en una estructura llamada sandwich. APLICACIONES Cualquier sustancia del organismo puede ser considerada un antígeno. Los anticuerpos que se transforman sirven para medir la cantidad de hormonas que hay en el organismo. Así se miden: Hormonas peptídicas: T3, T4, TSH, GH...Casi todas las hormonas hipofisarias. Hormonas no peptídicas: Estrógenos, testosterona...Hormonas sexuales. Sustancias no hormonales que pueden considerarse como antígenos: Marcadores tumorales digoxina, medicamentos. DESVENTAJAS La vida del isotopo es muy corta Costosa y peligrosa Requiere un equipo especial que es el contador gama para medir la radiación Siempre requiere de la elaboración de una curva estándar para la lectura. GRACIAS………..