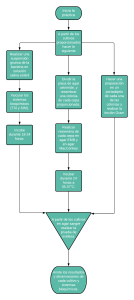
Agar Baird Parker: Detección de Staphylococcus aureus
Anuncio

Medios de Cultivo El agar Baird Parker es un medio de cultivo sólido, selectivo y diferencial. Fue creado en 1962 para la detección y recuento de estafilococos coagulasa positivos (Staphylococcus aureus). Está compuesto por hidrolizado pancreático de caseína, extracto de carne, extracto de levadura, cloruro de litio, glicina, piruvato sódico, telurito potásico, agar y emulsión de yema de huevo. El agar Baird Parker se basa en la capacidad que tiene el S. aureus de reducir el telurito y producir lecitinasa. Ambas propiedades generan una colonia con características específicas para esta especie. Por tanto, brinda una gran efectividad en la detección de este microorganismo. Las colonias típicas de S. aureus son negras o grises oscuras, con borde incoloro y un halo claro que las rodea, diferenciándose del resto de microorganismos. Este patógeno se puede encontrar en muestras clínicas, aguas, cosméticos y alimentos crudos o cocidos. Su diagnóstico o detección es de suma importancia, debido a la variedad de patologías que produce, como intoxicación alimentaria, síndrome de la piel escaldada, síndrome del shock tóxico, abscesos, meningitis, septicemias, endocarditis, entre otras. Índice del artículo Fundamento Poder nutritivo El hidrolizado pancreático de caseína, el extracto de carne y el extracto de levadura son las fuentes de nutrientes, vitaminas y minerales necesarios para el desarrollo general microbiano, mientras que el piruvato y la glicina son compuestos que favorecen el crecimiento específico de Staphylococcus aureus. Selectivo El agar Baird Parker es selectivo porque contiene sustancias que inhiben el crecimiento de la flora acompañante, mientras que favorece el desarrollo de S. aureus. Los compuestos inhibidores son el cloruro de litio y el telurito de potasio. Diferencial Este medio permite diferenciar el S. aureus del resto de los Estafilococos coagulasa negativos. S. aureus tiene la capacidad de reducir el telurito a teluro libre metálico negro, formando colonias negras o grises oscuras. Así mismo, la yema de huevo proporciona los sustratos para evidenciar la presencia de la enzima lecitinasa y lipasa. S. aureus es lecitinasa positiva y por tanto se observará un halo claro alrededor de la colonia, indicando que la lecitina fue hidrolizada. En este sentido, la aparición en este agar de colonias negras o grises oscuras brillantes con halo claro alrededor indican presencia de S. aureus. Si se forma una zona de precipitación es indicativo de que hay actividad de la lipasa. Algunas cepas de S. aureus son lipasa positivas y otras negativas. En el caso de que el S. aureus sea lipasa positiva se observará una zona opaca alrededor de la colonia negra o gris oscura, y luego el halo claro por la acción de la lecitinasa. Las colonias de bacterias distintas a S. aureus capaces de crecer en este medio desarrollarán colonias incoloras o de color marrón, sin halo alrededor. También se pueden observar colonias atípicas color negro con o sin borde incoloro, pero sin halo claro. Estas colonias no deben tomarse en cuenta, no corresponden a S. aureus. Preparación Emulsión de yema de huevo Se toma un huevo fresco de gallina, se lava bien y se coloca 2 a 3 horas en alcohol al 70%. Luego, el huevo se abre asépticamente y se separa cuidadosamente la clara de la yema. Posteriormente se toman 50 ml de la yema y se mezclan con 50 ml de solución fisiológica estéril. Telurito de potasio al 1% p/v Algunas casas comerciales venden el telurito de potasio al 1% listo para usar. Se agrega al medio antes de que el medio solidifique. Para preparar esta solución en el laboratorio se pesa 1.0 gr de telurito de potasio y se disuelve en una parte de agua. Posteriormente se completa la cantidad de agua hasta llegar a 100 ml. La solución debe esterilizarse por el método de filtración. Preparación del medio de cultivo Pese 60 gr del medio deshidratado y disuelva en 940 ml de agua destilada. Deje la mezcla en reposo durante 5 a 10 minutos aproximadamente. Aplique calor removiendo el medio frecuentemente para mejorar el proceso de disolución. Deje hervir por un minuto. Esterilice en el autoclave a 121°C por 15 minutos. Deje reposar hasta que alcance una temperatura de 45°C y agregue 50 ml de la emulsión de yema de huevo y 10 ml de telurito al 1%. Mezcle bien y sirva entre 15 a 20 ml sobre placas de Petri estériles. Dejar solidificar, ordenar de forma invertida en plaqueros y guardar en nevera hasta su uso. El pH final del medio preparado debe quedar en 6,8 ± 0,2. Antes de sembrar una muestra, se debe esperar a que la placa tome la temperatura del ambiente. Siembre las placas por estriamiento o por sembrado en superficie con espátula de Drigalski. El color del medio deshidratado es tostado claro y el color del medio preparado es ámbar claro. Uso Muestras clínicas Las muestras clínicas se siembran de forma directa descargando parte del material en un extremo de la placa, y a partir de allí se estría por agotamiento. Incubar por 24 a 48 horas a 35-37°C. Muestras de alimento Pesar 10 gr de la muestra de alimento y homogeneizar en 90 ml de agua peptonada al 0,1%, a partir de allí se preparan diluciones si es necesario. Inocular las placas por triplicado con 0,3 ml de las soluciones preparadas, y sembrar por superficie con espátula de Drigalski. Se incuba por 24 a 48 horas a 35-37°C. Esta metodología permite realizar recuento de las colonias típicas obtenidas y es ideal cuando se sospecha la presencia de S. aureus por encima de 10 UFC por gr/ml de muestra. Si se sospecha que la cantidad de S. aureus es pequeña o existe mucha flora acompañante, se sugiere enriquecer la muestra en caldo soya tripticasa con 10% de NaCl y 1% de piruvato de sodio. Esto favorecerá el crecimiento de S. aureus e inhibirá el desarrollo de la flora acompañante. Los tubos que resulten turbios se sembraran en agar Baird Parker. Muestras de agua En un sistema de filtración al vacío y esterilizado se filtran 100 ml de agua en estudio, y posteriormente la membrana microporosa de 0,4 micras se retira con una pinza estéril y se coloca sobre una placa de Baird Parker. Se incuba por 24 a 48 horas a 35-37°C. Esta técnica permite realizar el recuento de colonias típicas de S. aureus. Control de calidad Para evaluar la calidad del agar Baird Parker se pueden utilizar cepas conocidas, como Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 o Proteus mirabilis ATCC 43071. En el caso de las cepas de S. aureus ATCC se sabe que reduce el telurito, y son lipasa y lecitinasa positivas. Por tanto debe haber un desarrollo satisfactorio y crecer colonias convexas con centro negro y borde incoloro, con un halo opaco y otro halo más externo claro. Por su parte, de S. epidermidis se espera un pobre desarrollo en este medio, con colonias gris amarronado a negras, sin halo claro. Para E. coli y P. mirabilis se espera que sea inhibido total o parcialmente. En caso de crecer se desarrollarán colonias marrones sin zona opaca, ni halo claro. Recomendaciones -No se debe calentar el medio después de agregar el telurito y la yema de huevo. -La preparación de la emulsión de yema de huevo y su agregado en el medio es un paso muy vulnerable de contaminación. Se deben extremar los cuidados. -Si hay presencia de colonias típicas de S. aureus se debe corroborar montando una prueba de coagulasa a dicha cepa. -Si existen resultados dudosos con la coagulasa, se deben montar otras pruebas confirmatorias. -Tener cuidado de no confundir la presencia de colonias típicas de S. aureus con las colonias atípicas de color negro. El agar BHI o agar Brain Heart Infusión es un medio de cultivo sólido nutritivo. En español nos referimos a él como agar infusión cerebro corazón. Es un medio de cultivo no selectivo, lo que quiere decir que pueden desarrollarse todo tipo de bacterias Gram positivas y Gram negativas, así como algunos hongos levaduriformes y filamentosos. Está compuesto por infusión de cerebro y corazón de ternera, hidrolizado péptico de tejidos animales, hidrolizado pancreático de caseína, cloruro sódico, glucosa, fosfato disódico y agar. Cabe destacar que el agar BHI es uno de los medios de cultivo de uso más frecuentes en los laboratorios de bacteriología. Puede utilizarse sin suplementos como cultivo primario, subcultivo de colonias obtenidas en otros medios selectivos o para el mantenimiento de cepas en el laboratorio. Por otra parte, es un medio ideal para ser utilizado como base en la preparación de medios enriquecidos, como el agar sangre y el agar chocolate. Ambos ideales para aislar microorganismos exigentes desde el punto de vista nutricional. Sin embargo, debe tenerse en cuenta que como contiene glucosa no es adecuado para observar los patrones de hemólisis. Así mismo, el agar BHI puede ser utilizado para la preparación de medios especiales para el aislamiento de microorganismos patógenos de difícil crecimiento en los medios comunes, entre ellos: Haemophilus sp, Francisella tularensis, Corynebacterium diphtheriae e Histoplasma capsulatum. Con el aditivo de antibióticos el agar BHI se convierte en un medio selectivo para el aislamiento de hongos. Fundamento Es un medio de cultivo nutritivo para aislar microorganismos moderadamente exigentes, pudiéndose aumentar su enriquecimiento con la adición de sangre y otros suplementos nutritivos. Es un medio de cultivo no selectivo, por tanto permite el crecimiento de la mayoría de las bacterias Gram positivas y Gram negativas, así como también de algunos hongos. Sin embargo, se puede convertir en selectivo con la adición de antibióticos. El medio contiene infusión de cerebro y corazón de ternera, hidrolizado péptico de tejidos animales e hidrolizado pancreático de caseína; todos estos compuestos actúan como fuentes de vitaminas, aminoácidos, nitrógeno y carbono. La glucosa es un carbohidrato que proporciona energía a los microorganismos una vez que estos lo han fermentado. En tanto que, el cloruro sódico y el fosfato disódico mantienen el equilibrio osmótico y proporcionan un pH cercano a la neutralidad. Finalmente, el agar da la consistencia sólida al medio. Preparación Pesar 52 gramos del medio deshidratado y disolver en un litro de agua destilada. Llevar la mezcla a una fuente de calor hasta hervir, agitando frecuentemente durante el proceso de disolución. Se pueden preparar cuñas o placas de agar BHI sin aditivos. Cuñas Para la preparación de cuñas servir la preparación hasta rellenar la mitad de cada tubo, tapar y esterilizar en autoclave a 121°C por 15 minutos, al salir acostar sobre una base hasta que solidifiquen. Posteriormente guardar en nevera hasta su uso. Cuñas de BHI para bacterioteca. Fuente: Foto tomada por la autora MSc. Marielsa Gil. Placas La mezcla disuelta se autoclava a 121°C por 15 minutos, al salir se deja enfriar hasta 50°C y se sirven 20 ml del medio en placas de Petri estériles. Se dejan solidificar, se invierten y se guardan en nevera hasta su uso. Dejar que las placas tomen temperatura ambiente antes de sembrar. El pH del medio debe quedar en 7,4 ± 0,2. El medio sin preparar es de color beige y preparado es de color ámbar claro. Preparación de agar sangre Después de esterilizar el medio, enfriar hasta una temperatura aproximada de 45 a 50 °C, en ese momento agregar la sangre (50 ml), mezclar suavemente para homogenizar y servir asépticamente 20 ml en cada placa de Petri. Si se forman burbujas sobre la placa se debe pasar rápidamente la llama del mechero sobre las burbujas para eliminarlas. Así mismo, se pueden preparar los medios especiales agregando los aditivos correspondientes cuando la mezcla alcance la temperatura de 45 a 50°C. El medio queda de color rojo cereza. Usos Uso sin suplementos El agar BHI sin aditivos es útil como cultivo primario y para sembrar cepas puras de microorganismos poco o medianamente exigentes para su posterior identificación. Como es un medio de color claro, es ideal para la observación de pigmentos y además al no contener sustancias interferentes se pueden realizar sobre él algunas pruebas bioquímicas, como la oxidasa y la catalasa, o montar otras pruebas bioquímicas a partir de colonias provenientes de este agar. Así mismo, las cuñas de agar BHI son muy utilizadas para el mantenimiento de cepas por un tiempo determinado en el laboratorio (bacterioteca). Las placas o cuñas sembradas por superficie con cepas bacterianas se incuban a 37°C por 24 a 48 horas. En tanto que, en hongos la temperatura y el tiempo de incubación dependerá del tipo de hongo que se busca. Como agar base para la preparación de otros medios Con esta base se pueden preparar medios enriquecidos y selectivos. Enriquecidos Su principal función es servir como base en la preparación del agar sangre de uso de rutina en los laboratorios de microbiología. Especialmente, la base de BHI es propicia para el aislamiento de cepas de Streptococcus sp. Sin embargo, tiene el inconveniente de no ser adecuado para la observación de los patrones de hemólisis por contener glucosa. También se usa en la preparación del agar sangre de conejo o de caballo para el aislamiento de Haemophilus sp. Para mejores resultados se puede adicionar un suplemento de enriquecimiento (IsoVitaleX). Si las muestras provienen del tracto respiratorio al agar se le puede adicionar bacitracina para inhibir la flora acompañante y aumentar la probabilidad de recuperación de las cepas de Haemophilus sp. Por otra parte, se puede preparar agar sangre (cordero o humana) con cistina telurito para aislar Corynebacterium diphtheriae. Así mismo, es útil para preparar agar sangre de conejo, con el agregado de cistina y glucosa para el aislamiento de Francisella tularensis. El sembrado de las placas de agar sangre se realiza por agotamiento y se incuban a 35-37°C por 24-48 horas en microaerofilia (5-10% de CO2). Selectivo Este medio con el agregado de antibióticos puede sustituir al agar Sabouraud para el aislamiento de hongos. El combinado de agar BHI con cloranfenicol – gentamicina o penicilina -, estreptomicina y sangre de caballo es ideal para el aislamiento de Histoplasma capsulatum. Dependiendo del microorganismo que se busca aislar se recomienda la incubación a 35-37°C o a temperatura ambiente en aerobiosis. En ocasiones es necesario la incubación en ambos rangos de temperatura, utilizando 2 placas para ello. Algunos hongos como Trichophyton mentagrophytes se deben incubar a temperatura ambiente hasta por 7 días. Control de calidad De cada lote preparado se recomienda incubar 1 placa o cuña a 37°C por 24 horas y verificar que no haya crecimiento; especialmente es importante cuando se prepara agar sangre, debido a que es un medio fácilmente contaminable. Por otra parte, se puede evaluar la calidad del medio inoculando cepas patrones conocidas o certificadas y observar su desarrollo. En este sentido, para evaluar el agar BHI sin aditivos se pueden usar cepas de Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923 o Candida albicans ATCC 10231. Se incuban a 37°C en aerobiosis por 24 a 48 horas. En todos los casos se espera un crecimiento satisfactorio. Para evaluar las placas de agar sangre se pueden sembrar cepas de Streptococcus pyogenes ATCC 19615, Streptococcus pneumoniae ATCC 6305 o Trichophyton mentagrophytes ATCC 9533. Las cepas bacterianas se incuban a 37°C en microaerofilia por 24 horas, mientras que el hongo se incuba a temperatura ambiente en cámara húmeda hasta por 7 días. En todos los casos se espera crecimiento satisfactorio. bacterias. Es por ello que su utilidad aumenta especialmente en el sembrado de muestras que normalmente son estériles, como LCR y líquido articular. Aunque también se incluye dentro de los medios escogidos para siembras de muestras polimicrobianas, pero en estos casos es necesario la adición de antibióticos que inhiban la flora concomitante. El agar chocolate es un medio de cultivo sólido, enriquecido, no selectivo y no diferencial. Es utilizado principalmente para el aislamiento de microorganismos exigentes desde el punto de vista nutricional, aunque en él pueden crecer cualquier tipo de bacterias. Es por ello que su utilidad aumenta especialmente en el sembrado de muestras que normalmente son estériles, como LCR y líquido articular. Aunque también se incluye dentro de los medios escogidos para siembras de muestras polimicrobianas, pero en estos casos es necesario la adición de antibióticos que inhiban la flora concomitante. Agar Chocolate con crecimiento bacteriano Este medio posee un color marrón característico muy parecido al chocolate, de allí su nombre. La preparación es muy similar a la del agar sangre, solo que en este caso la sangre debe ser calentada con la finalidad de que los glóbulos rojos se rompan. Su preparación, al igual que el agar sangre, es muy delicada, pues es fácilmente contaminable. Por ello muchos laboratorios prefieren adquirir este medio ya preparado por casas comerciales que garantizan su calidad. Fundamento Este medio está compuesto por una base de agar rico en nutrientes y sangre calentada. La hemólisis de los glóbulos rojos proporcionan al medio factor X (hemina) y factor V (NAD), necesarios para el crecimiento de algunos microorganismos, como el género Haemophilus. También es muy útil para el aislamiento de Neisserias sp. Al igual que el agar sangre, se puede usar como agar base diferentes medios dependiendo de la necesidad. Entre los medios utilizados se encuentran infusión cerebro corazón y agar soja tripticasa, aunque los más recomendados son agar Columbia, Müeller Hinton, agar GC y agar Thayer Martin. Algunas variantes de agar chocolate incluyen un suplemento enriquecido disponible comercialmente llamado Isovitalex o Polivitex. Estos suplementos contienen vitamina B12, L-glutamina, adenina, clorhidrato de guanina, ácido p-aminobenzoico, nicotinamida adenina dinucleótido (NAD), pirofosfato de tiamina, nitrato férrico, clorhidrato de tiamina, hidrocloruro de cisteína, L-cistina y glucosa. Es importante resaltar que el agar chocolate es más enriquecido que el agar sangre, pero no permite la observación de los patrones de hemólisis. Usos Agar chocolate preparado con agar Columbia Este medio contiene digerido pancreático de caseína y de corazón, digerido péptico de carne, cloruro de sodio, agar, extracto de levadura y almidón de maíz. Además es rico en vitaminas, minerales y amino ácidos esenciales. Esta base con sangre calentada es ideal para el aislamiento de bacterias del género Neisseria. Por otra parte, si al medio adicionalmente se le añade un suplemento para Brucella se puede aislar al mencionado microorganismo. Se mejoran los resultados usando sangre de caballo. Agar chocolate preparado con agar base GC (para gonococos) Este medio contiene peptonas, almidón de maíz, buffers monobásicos y dibásicos, cloruro de sodio y agar. La mayoría de las presentaciones de agar chocolate preparados comercialmente vienen con esta base y no contienen sangre calentada, sino una mezcla sintética de hemina y un suplemento químico de factores de crecimiento, vitaminas, minerales, aminoácidos, factor V y glucosa. Agar chocolate preparado con agar Müeller Hinton Se usa para realizar la prueba de susceptibilidad antimicrobiana de microorganismos exigentes, como Streptococcus pneumoniae usando 5% de sangre de carnero calentada. También sirve para el aislamiento primario de Neisserias y Haemophilus, pero en el caso particular del aislamiento de Haemophilus se prefiere el uso de sangre de caballo, por ser una fuente rica en factor X y V. Por otra parte, si la muestra a sembrar proviene de un área no estéril es recomendable la adición de antibióticos para inhibir la flora normal del área. Ejemplo para muestras respiratorias donde se sospeche la presencia de bacterias del género Haemophilus se usa bacitracina para inhibir el crecimiento de Staphylococcus, Micrococcus, Streptococcus y Neisserias saprófitas. En el caso de muestras de chancros genitales, donde se sospecha de Haemophilus ducreyi, se ha usado con éxito un agar chocolate preparado de la siguiente manera: agar Müeller – Hinton con 5% de sangre chocolatizada de caballo, 1% de enriquecimiento Isovitalex y 3 µg/ml de vancomicina. Agar chocolate preparado con agar Thayer Martin Este medio es especial para el aislamiento de Neisseria gonorrhoeae. El mismo debe contener antibióticos para inhibir la flora acompañante. Se usa sangre de cordero. Preparación Se deben ver las indicaciones de preparación del agar base que se va a utilizar. Las mismas se encuentran al reverso del envase del medio deshidratado. Generalmente describen cuánto se debe pesar para preparar un litro de medio de cultivo. En el laboratorio se puede preparar la cantidad exacta necesaria, puede ser más o menos de un litro. Cálculos Se realiza una regla de tres para calcular cuánto se debe pesar para preparar el volumen que se desea. Ejemplo: Si para 1 litro se necesita pesar 40 gr y el laboratorio requiere 800 ml, se dice: 1000 ml ———————————40 gr 800 ml ———————————– X La fórmula quedará de la siguiente manera: X= 32 gr (cantidad a pesar para 800 ml). Pesar y disolver Se procede a pesar la cantidad necesaria y se coloca en una fiola con el agua. Se calienta a fuego moderado y se va mezclando suavemente con movimientos rotatorios hasta disolver completamente el medio deshidratado, dejando hervir por 1 minuto. Esterilizar Se introduce la fiola en el autoclave para esterilizar el medio a 121°C por 20 minutos. Agregado de la sangre Al salir del autoclave se deja reposar hasta que la temperatura del medio esté aproximadamente entre 56 a 70°C para colocar la sangre y mezclar hasta que el medio se torne color marrón. Si se va a agregar suplementos, este es el momento de hacerlo. Posteriormente mezclar y servir 20 ml a cada placa de Petri estéril. Todo el procedimiento se debe realizar en una campana de flujo laminar o alrededor del mechero de Bunsen. Dejar reposar hasta que se solidifiquen y guardar de forma invertida en nevera. Otra forma de preparar agar chocolate sin usar sangre Se prepara el medio base como se describió anteriormente, se disuelve la hemoglobina deshidratada obtenida comercialmente y se esteriliza en el autoclave. Ambas soluciones se dejan enfriar a 50 °C, se unen y se agrega el suplemento. Mezclar en condiciones asépticas y luego servir en placas de Petri estériles. Control de calidad Es importante que la sangre se coloque a la temperatura indicada, pues es la ideal para lisar los glóbulos rojos y a la vez mantener el factor V que es termosensible. No deben quedar burbujas sobre la superficie del agar. De cada lote de 100 placas se debe incubar una o dos placas en la estufa a 37°C durante 24 horas para comprobar su esterilidad. Para mejores resultados, el agar chocolate debe ser usado al poco tiempo de su preparación. Se deben tener en el laboratorio cepas bacterianas controles para evaluar la eficacia del medio recién preparado para el crecimiento de los principales microorganismos exigentes de importancia clínica. El agar EMB es un medio de cultivo sólido selectivo y diferencial utilizado para el aislamiento de bacilos Gram negativos, principalmente de la familia Enterobacteriaceae, y otros bacilos Gram negativos no exigentes. También se le conoce con las siglas EAM, que significa eosina-azul de metileno. Este medio fue creado por Holt-Harris y Teague en 1916. Contiene peptona, lactosa, sacarosa, fosfato dipotásico, agar, eosina, azul de metileno y agua. Es muy similar al agar MacConkey, sobre todo si se usa el agar EMB modificado por Levine, que no contiene sacarosa. Brillo metálico de Escherichia coli en agar EMB Fuente: Carmen Moreno González [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)], from Wikimedia Commons De hecho, cada laboratorio decide si trabaja con uno o con otro, ya que cumplen la misma función, aunque bioquímicamente sean diferentes. Incluso presenta el mismo inconveniente que el agar MacConkey clásico en cuanto a la producción de swarming por el género Proteus. Por tanto, para evitar este fenómeno se puede aumentar la concentración del agar hasta en un 5%. Fundamento Selectivo El agar EMB es sutilmente selectivo porque contiene los colorantes anilínicos (eosina y azul de metileno), los cuales actúan como inhibidores, impidiendo el crecimiento de la mayoría de las bacterias Gram positivas y de algunos bacilos Gram negativos exigentes. Sin embargo, este agar tiene el inconveniente de que algunas bacterias Gram positivas pueden resistir la presencia de las sustancias inhibidoras y crecer como pequeñas colonias puntiformes incoloras, tal como el Enterococcus faecalis y algunos Staphylococcus. También pueden crecer ciertas levaduras, como el complejo Candida albicans, que dará colonias rosadas muy pequeñas. Inclusive se pueden desarrollar clamidosporas a partir de esta levadura si la muestra es sembrada por profundidad. Diferencial Por otra parte, el agar EMB también es un medio diferencial, ya que estos colorantes juntos (eosina y azul de metileno) tienen la propiedad de formar un precipitado en pH ácido, por tanto sirven como indicadores de la producción del mismo. Por ello, las bacterias débilmente fermentadoras de lactosa o sacarosa producen colonias de color púrpura en 24 a 48 horas. Por ejemplo los géneros Klebsiella, Enterobacter y Serratia. Aquellas bacterias que fermentan fuertemente la lactosa, como Escherichia coli, o la sacarosa, como Yersinia enterocolítica o Proteus penneri, forman un precipitado negro verdoso, dando un aspecto de brillo metálico característico en estas especies. Cabe destacar que si se usa el medio EMB levine (sin enterocolítica y Proteus penneri producirán colonias transparentes. sacarosa), Yersinia Las bacterias que no fermentan la lactosa ni la sacarosa se nutren por la presencia de peptonas, que proporcionan los aminoácidos y el nitrógeno necesario para el desarrollo bacteriano, y producen colonias transparentes. Por ejemplo, los géneros Salmonella y Shigella, entre otros. Así mismo, es importante destacar que el género Acinetobacter puede presentar colonias de color azul lavanda, aun cuando no es fermentador de lactosa, ni sacarosa, pero tienen la propiedad de fijar el azul de metileno en su pared celular. Esto también puede suceder con otras bacterias oxidativas. Preparación El medio original deshidratado es de color beige claro. Para preparar este medio de cultivo se deben pesar 36 gramos del medio deshidratado y suspenderlo en una fiola que contenga un litro de agua destilada. Después de dejar la mezcla 5 minutos en reposo, llevar la fiola a una fuente de calor, mezclando de forma vigorosa y constante hasta que hierva y se logre disolver totalmente. Posteriormente, se debe esterilizar el medio de cultivo ya disuelto utilizando el autoclave a 121 °C durante 15 minutos. Terminado el tiempo, se saca del autoclave y se deja reposar brevemente. Luego se sirve aun caliente (45 – 50°C) entre 15 a 20 ml de agar en cada placa de Petri estéril. El medio debe ser azul tornasol. Después de servidas las placas se dejan ligeramente destapadas hasta que el agar enfríe un poco. Luego se tapan y se deja que solidifiquen completamente. Posteriormente se ordenan en porta plaqueros en forma invertida y se guardan en nevera (8°C) hasta su uso. Este procedimiento se realiza preferiblemente en una campana de flujo laminar o frente al mechero de Bunsen para evitar que se contaminen. Es importante tener presente que cada casa comercial indicará la cantidad a pesar para preparar el medio de cultivo. El pH final del medio debe ser de 7.2 ± 0.2 Usos Este medio se utiliza para sembrar orina y heces o cualquier tipo de muestras clínicas, especialmente si se sospecha de la presencia de bacilos Gram negativos no exigentes, como los bacilos pertenecientes a la familia Enterobacteriaceae, que crece muy bien en este medio. Las bacterias enteropatógenas de los géneros Shigella y Salmonella se distinguen por sus colonias incoloras o ligeramente ámbar. También crecen otros bacilos no fermentadores de lactosa como Aeromonas, Pseudomonas, Acinetobacter, entre otros. Así mismo, este medio es muy útil en el análisis microbiológico de alimentos y aguas, pues es ideal para la fase completa confirmatoria de la determinación de coliformes, es decir, para corroborar la presencia de E. coli a partir de caldos EC turbios, provenientes de la técnica del número más probable (NMP). Control de calidad Para verificar que el medio de cultivo recién preparado funciona bien, se pueden sembrar cepas controles para observar las características de las colonias y constatar que den conforme a lo esperado. Para ello, se pueden usar cepas ATCC o cepas bien identificadas de E. coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa y algunas bacterias Gram positivas, como S. aureus. Se espera que E. coli genere colonias bien desarrolladas color negro azulado con brillo metálico verde. En tanto que, Enterobacter aerogenes y Klebsiella sp deben dar colonias mucosas bien desarrolladas color negro azulado. Por su parte, Salmonella typhimurium y Shigella flexneri, deben desarrollar colonias grandes, incoloras o con un ligero color ámbar. Finalmente el género Pseudomonas aeruginosa crece como colonias incoloras de tamaño irregular, mientras que las bacterias Gram positivas deberían ser inhibidas totalmente o crecer de forma escasa con colonias muy pequeñas. Consideraciones finales Algunas veces la esterilización hace que el azul de metileno se reduzca, observándose un medio color naranja. Para que el azul de metileno se oxide y se recupere el color púrpura se debe mezclar suavemente hasta recuperar el color. También, después del esterilizado puede precipitar el colorante, por lo que se debe mezclar bien antes de servir a las placas de Petri. El agar MacConkey es un medio de cultivo sólido que permite el aislamiento exclusivo de bacilos Gram negativos. Por esta razón es un medio selectivo y además permite distinguir entre bacilos fermentadores y no fermentadores de la lactosa, lo que lo hace un medio diferencial. Es uno de los medios de cultivo más utilizado en un laboratorio de microbiología. Este medio se usa principalmente para el aislamiento de bacilos Gram negativos pertenecientes a la familia Enterobacteriaceae, incluyendo las especies oportunistas y las enteropatógenas. Agar MacConkey sembrado con dos tipos de bacterias. Lado izquierdo colonias fermentadoras de lactosa, lado derecho colonias no fermentadoras de lactosa. También se puede usar para aislar a otros bacilos entéricos que habitan en el tracto gastrointestinal, pero que no pertenecen a Enterobacteriaceae, como Aeromonas sp, Plesiomonas sp, entre otros. Finalmente, puede aislar otros bacilos Gram negativos no fermentadores de glucosa que se encuentran en ambiente, agua o suelos, pero que en ocasiones pueden ser patógenos oportunistas como Pseudomonas sp, Acinetobacter sp, Alcalígenes sp, Chromobacterium violaceum, Stenotrophomonas maltophilia, entre otros. Fundamento Agar MacConkey El fundamento de este medio se puede explicar a través de la descripción de sus componentes, pues cada uno posee una finalidad que determina una propiedad del mismo. Sales biliares y cristal violeta En este sentido, el agar MacConkey tiene una composición compleja. En primer lugar contiene sales biliares y cristal violeta. Estos elementos se encargan de inhibir el crecimiento de bacterias Gram positivas y algunos bacilos Gram negativos exigentes. A su vez favorece el desarrollo de los bacilos Gram negativos que no son afectados por estas sustancias. Por ello es un medio selectivo. Se dice que es ligeramente selectivo en comparación a otros medios que igualmente inhiben el crecimiento de bacterias Gram positivas y también de la mayoría de las bacterias Gram negativas. Peptonas, polipectonas y lactosa Contiene sustancias que aportan los nutrientes necesarios a los microorganismos que se desarrollan en este medio, como las peptonas, polipectonas y la lactosa. La lactosa es el punto clave para que el medio sea un medio diferencial, pues los microorganismos que poseen la capacidad para fermentar la lactosa desarrollaran colonias rosadas fuertes. Algunas bacterias pueden fermentar la lactosa lentamente o débilmente, desarrollando colonias color rosado pálido y siguen siendo lactosa positiva. Las que no fermentan la lactosa utilizan las peptonas como fuente de energía, produciendo amoníaco, alcalinizando el medio. Por ello las colonias que se originan son incoloras o transparentes. Indicador de pH El cambio de color se logra a través de otro compuesto esencial que posee el agar MacConkey. Este compuesto es el indicador de pH, que en este caso es el rojo neutro. La fermentación de la lactosa genera la producción de ácidos mixtos. Los mismos acidifican el medio a un pH por debajo de 6,8. Esto hace que el indicador de pH vire hacia a una tonalidad rosada intenso. La intensidad del color puede variar dependiendo el pH final. Agua destilada, cloruro de sodio y agar Por otra parte, contiene agua destilada y cloruro de sodio que le dan la hidratación y equilibrio osmótico al medio. Finalmente, el medio contiene agar, que es la base que proporciona la consistencia de medio sólido. El medio agar MacConkey preparado debe tener un pH final ajustado a 7,1 ± 0,2. Preparación Para un litro de agar MacConkey se debe pesar 50 gr del medio deshidratado, luego se coloca en una fiola y se disuelve en un litro de agua destilada. Después de 10 minutos de reposo se calienta mezclando constantemente hasta dejar hervir por 1 minuto. Luego se coloca la fiola en el autoclave y se esteriliza a 121°C por 20 minutos. Culminado el tiempo, se saca del autoclave y se deja enfriar hasta alcanzar una temperatura de 45°C, para posteriormente servir en placas de Petri estériles dentro de una campana de flujo laminar o frente al mechero de Bunsen. Dejar solidificar y guardar en un portaplaquero de forma invertida y refrigerar en nevera a 28°C hasta su uso. Para obtener un agar MacConkey que inhiba el efecto swarning que produce el género Proteus se usa un agar MacConkey bajo en sal. Usos del agar MacConkey convencional El agar MacConkey se incluye en todos los set de medios de cultivos dispuestos para la siembra de las muestras clínicas recibidas en el laboratorio. También es útil en microbiología de alimentos y microbiología ambiental. La variedad de bacilos Gram negativos que crecen en este medio expresan características fenotípicas que ayudan a un diagnóstico presuntivo de la especie en cuestión. Por ejemplo el tamaño, color, consistencia y olor de las colonias, son algunas de las características que pueden orientar. En este medio las especies de Escherichia coli, Klebsiella sp y Enterobacter sp producen colonias rosadas fuertes, rodeadas de una zona de bilis precipitada. En tanto que, las bacterias como Citrobacter sp, Providencia sp, Serratia sp y Hafnia sp pueden aparecer sin color después de 24 horas o rosa pálido en 24 -48 horas. Así mismo, los géneros Proteus, Edwadsiella, Salmonella y Shigella producen colonias incoloras o transparentes. Otras variantes de agar MacConkey Existen otras variantes de agar MacConkey que tienen finalidades específicas. A continuación se mencionan: Agar MacConkey con sorbitol Este medio fue diseñado para distinguir la cepa enteropatógena (Escherichia coli enterohemorrágica O157:H7) del resto de las cepas de Escherichia coli. Este medio cambia el carbohidrato lactosa por sorbitol. Las cepas de E. coli enterohemorrágicas O157:H7 se diferencian del resto porque no fermentan el sorbitol y por tanto se obtienen colonias transparentes, en cambio el resto de las cepas E. coli si fermentan el sorbitol y las colonias son rosadas fuertes. Agar MacConkey sin cristal violeta, ni sal Este agar difiere mucho del agar MacConkey clásico, pues al no tener cristal violeta pueden crecer bacterias Gram positivas. Por otra parte, la ausencia de sal inhibe la aparición de swarming sobre el agar producido por algunos bacilos entéricos, como los del género Proteus, y así facilitar el aislamiento de todas las bacterias presentes, incluyendo bacterias Gram positivas. Agar MacConkey con cefoperazone Esta variante de agar MacConkey fue diseñada para aislar inicialmente Laribacter hongkongensis y posteriormente se dieron cuenta que era útil para el aislamiento de Arcobacter butzleri. Ambos son bacilos Gram negativos ligeramente curvados resistentes a cefoperazone. Estas bacterias han sido recientemente vinculadas como causantes de gastroenteritis y diarreas adquiridas en individuos asiáticos y europeos, perfilándose como dos potentes patógenos emergentes. El antibiótico permite inhibir la flora acompañante del tracto gastrointestinal, lo que favorece el desarrollo de estas bacterias, evitando que pasen desapercibidas, ya que las mismas requieren 72 horas para crecer. Agar MacConkey preparada con agua de mar al 10% v/v Esta variante es útil para la evaluación de indicadores sanitarios bacterianos de contaminación fecal, entre ellas coliformes totales y coliformes fecales en aguas saladas recreacionales (playas y Bahías). Cortez y col en el 2013 demostraron que el medio preparado de esta manera aumenta significativamente la recuperación de estos microorganismos en el ambiente salino, en comparación con el uso de agar MacConkey preparado con agua destilada. Esto se debe a que en el medio modificado se estimula el crecimiento de bacterias que están de forma fisiológica en un estado de latencia “viables pero no cultivables”, por tanto no son recuperables en medios convencionales. El agar sangre es un medio de cultivo sólido enriquecido, diferencial pero no selectivo. Es utilizado para la recuperación y crecimiento de una gran variedad de microorganismos provenientes de muestras clínicas o para subcultivos. El agar sangre clásico debe ser incluido para el sembrado de la mayoría de las muestras clínicas recibidas en el laboratorio; a excepción de las muestras de heces en el que no es útil, a menos que se prepare con ciertas modificaciones. Placa de agar sangre Este medio de cultivo se compone básicamente de un agar base enriquecido y 5% de sangre. La base de agar puede variar de acuerdo a las necesidades, pero principalmente estará compuesto por peptonas, aminoácidos, vitaminas, extracto de carne, cloruro de sodio, agar, entre otros. En cuanto a la sangre, normalmente se requiere tener contacto con un bioterio para la obtención de sangre de animales, tales como carnero, conejo o caballo. Sin embargo, esto no siempre es posible y en ocasiones se usa sangre humana. El medio agar sangre puede ser preparado en el laboratorio o puede comprarse ya listo a empresas que se dedican a ello. La preparación de este medio es uno de los más delicados, cualquier descuido en su elaboración dará como resultado un lote contaminado. Es por ello que deben tomarse todas las precauciones posibles y al final debe realizarse un control de calidad incubando a 37 °C 1 placa por cada 100 que se preparen. Fundamento se ha mencionado que el agar sangre tiene como característica ser un medio enriquecido, diferencial y no selectivo. A continuación se explica el basamento de cada una de estas propiedades. El agar sangre es un medio enriquecido porque lleva como aditivo principal 5 -10% de sangre sobre una base de agar. Ambos compuestos contienen muchos nutrientes y esta propiedad permite que en él puedan crecer la mayoría de las bacterias cultivables. Ese crecimiento ocurre sin restricción; por este motivo es no selectivo. Sin embargo, si a este medio se le adicionan compuestos que impidan el crecimiento de algunos microorganismos y favorezca el de otros, se vuelve selectivo. Es el caso si se adicionan ciertos tipos de antibióticos o antifúngicos. Así mismo, el agar sangre es un medio diferencial, ya que permite distinguir 3 tipos de bacterias: los beta-hemolíticos, alfa –hemolíticos y gamma-hemolíticos. Los beta-hemolíticos son aquellos que tienen la capacidad de lisar o romper completamente los glóbulos rojos, formando un halo claro alrededor de las colonias, por tanto producen hemólisis ß ó ß –hemólisis y los microorganismos son llamados ß-hemolíticos. Ejemplos de bacterias ß-hemolíticos son Streptococcus pyogenes y Streptococcus agalactiae. Los alfa-hemolíticos son los que realizan una hemólisis parcial, donde la hemoglobina es oxidada a metahemoglobina, generándose una coloración verdosa alrededor de las colonias. A este fenómeno se le conoce como hemólisis α ó α –hemólisis y a las bacterias se les clasifica como α – hemolíticos. Ejemplo de bacterias α – hemolíticos son Streptococcus pneumoniae y Streptococcus del grupo viridans. Por último, están las bacterias denominadas gamma-hemolíticas o no hemolíticas. Estas crecen sobre el agar sin generar cambios sobre el mismo, efecto conocido como γ –hemólisis, y los microorganismo son γ –hemolíticos. Ejemplo de bacterias γ –hemolíticos: algunas cepas de Streptococcus del grupo D (Streptococcus bovis y Enterococcus faecalis). Usos El medio de cultivo agar sangre es uno de los más comúnmente utilizados en el laboratorio de microbiología. Entre los microorganismos capaces de crecer en el medio agar sangre se tienen: bacterias aerobias estrictas, facultativas, microaerófilas, anaerobias, Gram positivas o Gram negativas, bacterias de crecimiento rápido o crecimiento lento. También crecen algunas bacterias exigentes o fastidiosas desde el punto de vista nutricional, así como hongos y levaduras. Así mismo, es útil para realizar subcultivos o reactivar cepas que metabólicamente estén muy débiles. Sin embargo, la elección del tipo de sangre y del agar base variará dependiendo del microorganismo probable que se sospecha recuperar y al uso que se le va a dar a la placa (cultivo o antibiograma). Elección del tipo de sangre La sangre puede ser de cordero, conejo, caballo o humana. La más recomendada es la sangre de cordero, salvo algunas excepciones. Por ejemplo, para aislar especies de Haemophilus, donde la sangre recomendada es la de caballo o conejo, ya que la sangre de cordero posee enzimas que inhiben el factor V. La menos recomendada es la humana, sin embargo es la más usada, quizás por ser la más fácil de obtener. La sangre debe ser desfibrinada, obtenida sin ningún tipo de aditivo y proveniente de animales sanos. Para el uso de la sangre humana hay que tener presente varios factores: Si la sangre proviene de individuos que han padecido infecciones bacterianas, estas poseerán anticuerpos específicos. En estas condiciones es probable que se inhiba el crecimiento de algunas bacterias. Si la misma se obtiene del banco de sangre, esta contiene citrato y es posible que ciertas bacterias no se desarrollen en su presencia. Por otra parte, si la sangre proviene de pacientes que están tomando antibióticos, puede inhibirse el crecimiento de bacterias susceptibles. Y si la sangre es de una persona diabética, el exceso de glucosa interfiere en que se desarrollen adecuadamente los patrones de hemólisis. Elección del tipo de agar base El agar base utilizado para la preparación del agar sangre puede ser muy amplio. Entre ellos se tienen: agar nutriente, agar infusión cerebro corazón, agar soya tripticasa, agar Müeller Hinton, agar Thayer Martin, agar Columbia, agar Brucella, agar Campylobacter, etc. Usos del agar sangre de acuerdo al medio base utilizado para su preparación Agar nutriente Esta base es la menos utilizada, pues sobre él crecerán principalmente bacterias no exigentes, como bacilos entéricos, Pseudomonas sp, S. aureus, Bacillus sp, entre otros. No es recomendable para aislar Streptococcus. Agar infusión cerebro corazón (BHI) Es uno de los más utilizados como base del agar sangre, porque posee los nutrientes necesarios para el crecimiento de la mayoría de las bacterias, incluyendo Streptococcus sp y otras bacterias exigentes. Aunque no es apropiado para observar patrones de hemólisis. Con esta base generalmente se usa sangre de cordero. También se puede preparar variantes de agar sangre, donde se adicionan otros compuestos para aislar determinados microorganismos. Por ejemplo, el agar infusión cerebro corazón suplementado con sangre de conejo, cistina y glucosa, sirve para aislar Francisella tularensis. En tanto que, con cistina telurito es útil para el aislamiento de Corynebacterium diphteriae. Se puede usar sangre humana o de cordero. Con la primera la beta-hemólisis se verá como un halo estrecho, mientras que con la segunda el halo será mucho más amplio. Así mismo, esta base junto con bacitracina, almidón de maíz, sangre de caballo y otros suplementos de enriquecimiento (IsoVitaleX), se usa para el aislamiento del género Haemophilus sp a partir de muestras respiratorias. También, si se le adiciona la combinación de antibióticos cloranfenicol – gentamicina o penicilina – estreptomicina con sangre de caballo, es ideal para el aislamiento de hongos patógenos exigentes, incluso con un rendimiento superior al agar Sabouraud glucosa. Especialmente es útil en el aislamiento de Histoplasma capsulatum. Agar soya tripticasa Esta base es la más recomendada para una mejor observación del patrón de hemólisis y realización de pruebas diagnósticas tales como taxos de optoquina y bacitracina. Es el agar sangre clásico que se usa de rutina. Con esta base también se puede preparar el agar sangre especial para Corynebacterium diphteriae, con cistina telurito y sangre de cordero. Así mismo, la combinación de este agar con sangre de cordero, más kanamicina-vancomicina es ideal para el crecimiento de anaerobios, especialmente Bacteroides sp. Agar Müeller Hinton Esta base suplementado con sangre se usa para realizar el antibiograma de microorganismos exigentes, tal como Streptococcus sp. También es útil para el aislamiento de bacterias como Legionella pneumophila. Agar Thayer Martin Este medio es ideal como base del agar sangre cuando se sospecha del género Neisseria, especialmente Neisseria meningitidis, ya que N. gonorrhoeae no crece en agar sangre. También sirve para realizar las pruebas de susceptibilidad a Neisseria meningitidis. Agar Columbia Esta base es excelente para sembrar muestras de biopsias gástrica en busca de Helicobacter pylori. El medio se prepara adicionando 7% de sangre de cordero desfibrinada con antibióticos (vancomicina, trimetoprim, anfotericina B y cefsulodin) para restringir el crecimiento de otros tipos de bacterias que puedan estar presentes. Esta misma base suplementada con sangre humana o de cordero, ácido nalidíxico y colistina es útil para aislar Gardnerella vaginalis. También es ideal para evaluar la susceptibilidad antimicrobiana a los antibióticos del mismo microorganismo. Además, sirve para la preparación de agar sangre para el cultivo de anaerobios, adicionando aminoglucósidos y vancomicina. Esta base permite observar adecuadamente los patrones de hemólisis. Agar Brucella Este medio usado como base del agar sangre junto con la adición de vitamina K es ideal para el cultivo de bacterias anaerobias. En este caso se recomienda el uso de sangre de cordero. Agar Campylobacter Agar Campylobacter suplementado con 5% de sangre de carnero y 5 antibióticos (cefalotina, anfotericina B, trimetoprima, polimixina B y vancomicina), es el medio utilizado para aislar Campylobacter jejuni en muestras de heces. Preparación Cada casa comercial trae al reverso del envase las indicaciones para preparar un litro de medio de cultivo. Se pueden hacer los cálculos correspondientes para preparar la cantidad deseada, según el agar base seleccionado. Pesar y disolver El agar base viene deshidratado (en polvo), por tanto debe disolverse en agua destilada ajustada a pH 7,3. Se pesa la cantidad que indique el agar base escogido y se disuelve en la cantidad de agua correspondiente en una fiola, luego se calienta a fuego moderado y se mezcla con movimientos rotativos hasta disolver todo el polvo. Esterilizar Una vez disuelto, esterilizar en autoclave a 121°C por 20 minutos. Agregado de la sangre Al salir del autoclave se dejar enfriar la fiola hasta que la temperatura oscile entre 40 a 50 °C; es una temperatura que la piel humana soporta y a la vez el agar aun no se ha solidificado. Para ello, se toca la fiola con la mano y si el calor es tolerable, es la temperatura ideal para agregar la cantidad de sangre desfibrinada correspondiente (50 ml por cada litro de agar). Mezclar suavemente para homogeneizar. El paso del agregado de la sangre es crucial, pues si se realiza cuando el medio está muy caliente los glóbulos rojos se romperán y el medio no servirá para observar hemólisis. Si se agrega demasiado frío, se formarán grumos y la superficie del medio no quedará lisa para poder hacer el estriado adecuadamente. Verter en las placas de Petri Servir en placas de Petri estériles inmediatamente después de homogeneizar la sangre. En cada placa de Petri se vierte aproximadamente 20 ml. Este procedimiento se realiza en una campana de flujo laminar o cerca del mechero. Al momento de servir el agar sangre en las placas de Petri no deben quedar burbujas de aire en la superficie de la placa. Si esto sucede se pasa la llama del mechero de Bunsen rápidamente sobre la placa para eliminarlas. Las placas se dejan solidificar y se guardan en nevera (2-8°C) de forma invertida hasta su uso. Antes de usar las placas de agar sangre se deben atemperar (dejar que tomen temperatura ambiente) para poder ser sembradas. Las placas preparadas tienen una duración aproximada de 1 semana. El agar Salmonella-Shigella también conocido como agar SS, es un medio moderadamente selectivo y diferencial, especialmente diseñado para el aislamiento de bacterias enteropatógenas de los géneros Salmonella y Shigella, tanto de muestras ambientales como clínicas. El agar SS tiene una composición compleja; está constituido por extracto de carne, peptona, lactosa, sales biliares, citrato de sodio, tiosulfato de sodio, citrato férrico, agar, rojo neutro, verde brillante y agua destilada. Dada su gran selectividad se pueden sembrar muestras con abundante flora mixta. Agar SS con colonias de Salmonella sp. Fuente: Manurx27 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)], from Wikimedia Commons En los laboratorios de microbiología el medio Salmonella-Shigella es muy utilizado para investigar la presencia de Salmonella y Shigella en muestras de heces diarreicas, aguas residuales, agua potable y alimentos. En ocasiones es necesario utilizar caldos de pre-enriquecimiento (caldo lactosado) y enriquecimiento (caldo selenito cistina) para recuperar cepas de Salmonella. Estos pasos son requeridos cuando se sospecha la existencia de Salmonella en muy baja cantidad, o donde la cepa pueda estar maltratada por procesos propios de la producción industrial, principalmente de alimentos procesados. También es aconsejable enriquecer muestras de heces provenientes de pacientes que han sido tratados con antibióticos. Posteriormente, el caldo enriquecido se puede sembrar en agar Salmonella-Shigella y en otros medios similares, como el agar xilosa, lisina desoxicolato (XLD) y agar Hektoen entérico (HE). Fundamento Cada componente del medio de cultivo Salmonella-Shigella posee una función específica, y el conjunto de la mezcla le brinda las propiedades que lo caracterizan. Poder nutritivo El extracto de carne y la peptona (digerido de caseína y de tejido animal) proporcionan los nutrientes requeridos (nitrógenos, carbono y vitaminas) para el desarrollo de los microorganismos capaces de tolerar el resto de los componentes. Consistencia El agar-agar es el encargado de brindar la consistencia sólida al medio. Selectivo Este medio es altamente selectivo debido a que contiene sales biliares, citrato de sodio y verde brillante. Por ello, inhibe el crecimiento de todas las bacterias Gram positivas y de la mayoría de los bacilos Gram negativos, incluyendo algunos coliformes. Mientras que las bacterias del género Salmonella y algunas cepas de Shigella si soportan estos compuestos. Principalmente, el género Salmonella es muy resistente a las sales biliares, tanto que son capaces de vivir en la vesícula biliar de algunos pacientes portadores que expulsan la bacteria constantemente por las heces. Diferencial La lactosa es el carbohidrato fermentable que ayuda a diferenciar las cepas fermentadoras de lactosa de las no fermentadoras. Esta propiedad es evidenciada por la presencia del indicador de pH, que en este medio es el rojo de fenol. Las cepas fermentadoras de lactosa dan colonias rojas, mientras que las no fermentadoras son incoloras. Esta característica es importante, ya que Salmonella y Shigella no fermentan la lactosa. Por otra parte, este medio contiene tiosulfato sódico como fuente de sulfuro y citrato férrico como fuente de hierro. Ambos compuestos logran diferenciar a las bacterias capaces de producir sulfuro de hidrógeno. Estas reaccionan para formar un precipitado negro de sulfuro férrico insoluble y visible. Esta propiedad la tienen algunas cepas del género Salmonella. Normalmente sus colonias son planas incoloras con un punto negro en el centro de la misma. El resto de las Salmonellas no producen H2S y se desarrollan como colonias incoloras. Por otra parte, las colonias del género Shigella son planas incoloras sin ennegrecimiento. Preparación Este medio es muy sencillo de preparar. Pesar 63 gr del medio comercial deshidratado y disolver en un litro de agua destilada. Calentar la disolución y agitar. La mezcla puede llegar hasta la ebullición hasta durante minutos. Este medio no debe autoclavarse. Después de su disolución se sirve directamente sobre placas estériles sencillas o dobles. Al solidificar se ordenan de forma invertida en plaqueros y se guardan en nevera (2-8°C) hasta su uso. El medio después de preparado debe quedar a pH 7,2 ± 0.2 y con color rojo naranja. Es importante dejar atemperar las placas antes de sembrar las muestras. Se puede sembrar directamente la muestra original, descargando material en una parte del agar y luego a partir de allí estriar por agotamiento. En caso de usar caldos enriquecidos, pasar una porción del caldo selenito y sembrar con espátula de drigalski. Se incuba a 37°C durante 24 horas en aerobiosis. Hay que tener en cuenta que la cantidad de gramos a pesar y el pH final del medio pueden variar de una casa comercial a otra. El embase del medio siempre trae las indicaciones para su preparación. Uso Se usa frecuentemente en el análisis de coprocultivos y en el estudio microbiológico de muestras de agua residuales, aguas de consumo y alimentos. Frecuentemente se preparan placas dobles, en un lado se coloca agar Salmonella-Shigella y en el otro agar XLD. Limitaciones -Algunas cepas de Shigella no crecen en este medio. Por tanto, no se recomienda para aislamiento primario de este género. -No toda colonia transparente con centro negro es indicativo de Salmonella; deben realizarse pruebas bioquímicas para hacer una correcta identificación, ya que las colonias de algunas cepas de Proteus son indistinguibles de las de Salmonella. -El medio deshidratado debe cuidarse de la exposición al ambiente, ya que es muy higroscópico. Por tanto, debe mantenerse en ambiente seco y bien cerrado. Abrir por períodos muy cortos. -Con el tiempo las sales biliares del medio pueden precipitar, formando una imagen similar a un enmarañado dentro del agar, pero esto no afecta los resultados. -Algunas cepas de Shigella pueden fermentar de forma lenta la lactosa. Control de calidad Para probar que el medio está funcionando correctamente, es recomendable sembrar cepas controles conocidas o certificadas y observar si el crecimiento cumple con las características esperadas. Para ello se pueden utilizar cepas de E. coli, Enterobacter sp, Klebsiella pneumoniae, Shigella flexneri, Salmonella typhimurium o Enterococcus faecalis. Los resultados esperados son: Escherichia coli —————————-colonias convexas rosadas. Enterobacter y Klebsiella—————— colonias grandes y mucoides rojas o rosadas. Shigella flexneri —————————-colonias planas trasparentes o incoloras. Salmonella typhimurium —————— colonias incoloras con centro negro. Enterococcus faecalis———————- inhibición total. El agar TCBS es un medio de cultivo sólido altamente selectivo y diferencial, utilizado para el aislamiento y cultivo de bacterias del género Vibrio, especialmente Vibrio cholerae, V. vulnificus y V. parahaemolyticus como principales patógenos de este género. Las siglas TCBS significan tiosulfato citrato bilis sacarosa. A este agar también se le conoce con el nombre de medio selectivo para Vibrios. La fórmula original fue creada por Nakanishi y posteriormente modificada por Kobayashi. Medio TCBS comercial y placa de agar TCBS sembrada con Vibrio cholerae. Está compuesto por extracto de levaduras, peptona de carne, tripteína, citrato de sodio, tiosulfato de sodio, bilis de buey, sacarosa, cloruro de sodio, citrato férrico, azul de bromotimol, azul de timol y agar. Esta composición permite un adecuado desarrollo de las especies de Vibrio a partir de muestras de aguas, alimentos y heces; a excepción de Vibrio hollisae, que no crece en este medio. Además, el medio TCBS es capaz de inhibir el crecimiento de otras bacterias acompañantes, en especial coliformes. Debido a los graves problemas gastrointestinales y extra-intestinales que producen algunas especies del género Vibrio, su diagnóstico es muy importante. El humano se infecta principalmente por el consumo de alimentos crudos o poco cocidos del mar o aguas contaminadas, pero también a través de la infección de heridas. Debido a ello, los laboratorios clínicos deben incluir el agar TCBS en el estudio de coprocultivos de muestras de heces líquidas, especialmente con aspecto de agua de arroz. Especialmente si el paciente refiere haber estado en contacto con agua de mar o haber consumido mariscos o pescados. Fundamento El extracto de levaduras, las peptonas de carne, y la tripteína, son la fuente nutritiva de este medio. Sin embargo, el agar TCBS es un medio inhóspito para la mayoría de las bacterias. Su alta selectividad viene dada por el agregado de citrato de sodio y bilis de buey; ambos son agentes inhibidores que además proporcionan un pH alcalino al medio, restringiendo el crecimiento de la flora acompañante y favoreciendo el crecimiento de V. cholerae, entre otras especies. Cabe destacar que Vibrio cholerae es muy sensible a la acidez. Por su parte, el cloruro de sodio equilibra osmóticamente al medio. Además como su concentración es alta, también actúa como un agente inhibidor, favoreciendo el crecimiento de bacterias halófilas. La sacarosa es el azúcar fermentable que junto a los indicadores de pH azul de bromotimol y azul de timol le dan el carácter diferencial al medio. Por tal motivo, con este medio es posible diferenciar las cepas fermentadoras de sacarosa de las no fermentadoras. Las colonias de las cepas fermentadoras de sacarosa se desarrollan de color amarillo y harán virar el medio de verde a amarillo por la producción de ácidos. Las no fermentadoras crecen traslúcidas y el medio queda del color original (verde). Así mismo, este medio contiene tiosulfato de sodio como fuente de azufre y citrato férrico como agente revelador. Ambos evidencian a las bacterias capaces de producir sulfuro de hidrógeno (gas incoloro). El H2S se forma a partir del tiosulfato y posteriormente al reaccionar con el citrato férrico se forma un precipitado negro visible. Finalmente, el agar es el que proporciona la consistencia sólida al medio. Preparación Pese 89 gr del medio deshidratado y disuelva en un litro de agua destilada. Ayude la disolución por calentamiento y agitación frecuente. La mezcla puede dejarse hervir hasta por 2 minutos. Este medio no se autoclava. Después de su disolución se sirve directamente sobre placas estériles. Al solidificar se ordenan de forma invertida en plaqueros y se guardan en nevera (28°C) hasta su uso. El medio después de preparado debe quedar a pH 8,6 ± 0,2. El color del medio deshidratado es de color beige claro o beige-verdoso, y el color del medio es verde bosque o verde azulado. Es importante dejar atemperar las placas antes de sembrar las muestras. Uso La muestra más común para el aislamiento de Vibrios son las heces diarreicas. Las muestras de heces si no pueden ser sembradas inmediatamente en el medio selectivo, deben trasportarse en el medio de Cary Blair. Para aumentar la sensibilidad del cultivo, las heces pueden ser pasadas por agua peptonada a pH 8,4 como medio de enriquecimiento durante 8 horas máximo, de allí se subcultiva al medio TCBS. También hay que tener en cuenta que algunas cepas de Vibrios pueden causar septicemias en pacientes inmunosuprimidos, por tanto pueden aislarse de hemocultivos. Así mismo, pueden analizarse muestras de aguas y alimentos provenientes del mar, cuando existen brotes epidémicos de la enfermedad de cólera. Sembrado El inóculo de la muestra en estudio debe ser prominente, el sembrado se realiza por el método de estriamiento por agotamiento. Las placas se incuban a 37°C por 24 horas en aerobiosis. Las colonias presuntivas de Vibrio cholerae son de tamaño mediano, lisas, opacas, de bordes delgados y de color amarillas debido a que fermentan la sacarosa. De forma similar crecen las especies de V. alginolyticus, V. fluvialis, V. hareyi, V. cincinnatiensis, V. furnissii, V. metschnikovii y algunos V. vulnificus. Otras especies de Vibrios clínicamente importantes como V. parahaemolyticus no fermentan la sacarosa, desarrollándose como colonias verde oliva. Placa agar TCBS sembrada con Vibrio parahaemolyticus. Fuente: isis325 Flickr Por otra parte, hay que tener presente que algunas cepas de Aeromonas y Plesiomonas que son oxidasa (+) pueden crecer en este medio, desarrollando colonias amarillas que pueden confundir al clínico. Mientras que algunas cepas de Pseudomonas también oxidasa (+) crecen como colonias verdes al igual que V. parahaemolyticus. Limitación La prueba de la oxidasa que es positiva para el género Vibrio jamás deberá realizarse a partir de colonias obtenidas del agar TCBS, pues el resultado obtenido será un falso negativo. Los compuestos del medio interfieren fuertemente en esta prueba. Por tanto, debe realizarse a partir de subcultivos en agar sangre. Control de calidad Para probar que el medio está en buenas condiciones es recomendable sembrar cepas controles conocidas o certificadas, y observar si el crecimiento cumple con las características esperadas. Para ello se pueden utilizar cepas de: -Vibrio cholerae —– crecimiento satisfactorio (colonias amarillas, borde traslúcido). -Vibrio parahaemolyticus ——– crecimiento satisfactorio (colonia con centro verde y borde traslúcida). -Vibrio alginolyticus ATCC 17749 —— crecimiento satisfactorio (colonias amarillas con halos del mismo color alrededor de la colonia). -Enterococcus faecalis ATCC 29212 —— inhibición total o parcial (colonias pequeñas amarillas o traslúcidas). -Pseudomonas aeruginosa ATCC 27853—– inhibición parcial o total (colonias azules). -Escherichia coli ATCC 25922 —— Inhibido completamente. -Proteus mirabilis ATCC 43071 —– Inhibición total o parcial. (Pequeñas colonias centro verde borde traslúcido). La incubación de un medio sin inocular no debe tener cambio. El agar verde brillante es un medio de cultivo sólido, con alto grado de selectividad. Se utiliza exclusivamente para el aislamiento de cepas del género Salmonella, sin embargo existen algunas excepciones, como la especie typhi y paratyphi que no crecen en este medio. La búsqueda del género Salmonella es frecuente en muestras de heces, agua o alimentos. En este sentido, este medio puede ser de gran utilidad. Este agar fue creado en 1925 por Kristensen, Lester y Jurgens, más tarde fue modificado por Kauffmann. Agar verde brillante. Colonias fermentadoras y no fermentadoras respectivamente. Está compuesto por pluripeptonas provenientes de digerido péptico de tejido animal y digerido pancreático de caseína, además contiene extracto de levaduras, cloruro de sodio, lactosa, sacarosa, rojo fenol, verde brillante y agar-agar. Se caracteriza por ser un medio bastante inhóspito para la mayoría de las bacterias, favoreciendo el crecimiento de Salmonella, sin embargo algunos coliformes son capaces de subsistir en el mismo, desarrollándose débilmente. Es importante destacar que en este medio no crece el género Shigella y tampoco Salmonella typhimurium, ni Salmonella paratyphi. Por tanto, si se desea aislar a estos microorganismos se deben usar otros medios, como el agar XLD, entre otros. Fundamento Agar verde brillante Cada uno de los componentes que conforman el medio cumple una función específica que determinan las características y propiedades del agar. Las pluripeptonas y el extracto de levadura son la fuente de nutrientes de donde los microorganismos toman el nitrógeno y los minerales necesarios para su desarrollo. La lactosa y la sacarosa son fuentes de energía para los microorganismos que son capaces de fermentarlas. El verde brillante es la sustancia inhibidora que impide el desarrollo de las bacterias Gram positivas y un gran número de microorganismos Gram negativos. El cloruro de sodio brinda estabilidad osmótica al medio. Mientras que el rojo de fenol es el indicador de pH, el mismo vira de color al detectar la producción de ácidos proveniente de la fermentación de los carbohidratos. Las colonias no fermentadoras de lactosa y sacarosa crecen en este medio de un color blanco rosadas o trasparentes, sobre un fondo rojo. Por ejemplo, bacterias del género Salmonella. En tanto que las bacterias fermentadoras de lactosa o sacarosa capaces de crecer en este medio, desarrollan colonias de color amarillo verdosas o verde amarillentas, sobre un fondo amarillo verdoso. Por ejemplo, Escherichia coli y Klebsiella pneumoniae. Variantes del agar verde brillante (BGA) Existen otras variantes del agar verde brillante; el agar novobiocina verde brillante glucosa (NBG) y el agar novobiocina verde brillante glicerol lactosa (NBGL). El agar novobiocina verde brillante glucosa (NBG) Contiene agar tripticasa de soja, citrato férrico de amonio, tiosulfato de sodio pentahidratado, rojo fenol, glucosa, verde brillante, novobiocina y agua destilada. Sirve para el aislamiento de colonias de Salmonella a partir de muestras de heces. En este caso el verde brillante y la novobiocina son las sustancias inhibidoras que impiden el crecimiento de las bacterias Gram positivas y algunos microorganismos Gram negativos. El tiosulfato de sodio es la fuente de sulfuro y el citrato férrico es la fuente de hierro, ambas necesarias para revelar la producción de sulfuro de hidrógeno a través de la formación de un precipitado negro de sulfuro férrico. La glucosa es el carbohidrato fermentable y el rojo de fenol es el indicador de pH. En este medio las colonias de Salmonella se desarrollan grandes con centro negro rodeada de un halo rojizo y seguida por una zona visible clara. Algunas cepas de Citrobacter freundii producen colonias idénticas a la de Salmonella. El agar novobiocina verde brillante glicerol lactosa (NBGL) Este medio contiene agar tripticasa de soja, citrato férrico de amonio, tiosulfato de sodio, lactosa, glicerol, verde brillante, novobiocina y agua destilada. La diferencia de este medio con el anterior es que se sustituye la glucosa por lactosa y glicerol y no se usa rojo de fenol. El medio igualmente se usa para aislar especies de Salmonella, las colonias se desarrollan de color negro, por la producción de sulfuro de hidrógeno. Solo las colonias que no producen ácido a partir del glicerol o la lactosa logran una producción de H2S suficiente, porque el pH bajo interfiere con la formación de H2S. Esto da como resultado colonias sin color para la mayoría de las especies de Proteus y Citrobacter. Preparación -Pese 58 gramos del medio deshidratado obtenido comercialmente. Agréguelo en un litro de agua bidestilada. Mezcle, deje reposar unos minutos y someta la preparación a una fuente de calor hasta que se disuelva completamente. -Autoclave a 121°C por 15 minutos, no sobrepase el tiempo de esterilización. -Dejar reposar y servir aun caliente en placas de Petri estériles. El pH final debe quedar en 6,9 ± 0,2. -Dejar solidificar y guardar en nevera hasta su uso. Antes de sembrar las placas deben tomar temperatura ambiente. -El medio en polvo es de color verde y preparado toma un color anaranjado-marrón o rojizo verdoso, dependiendo del pH y de la casa comercial. Un color muy pardo es indicativo que el agar fue sobrecalentado. -Una vez solidificado el agar no se recomienda refundir, pues el medio se deteriora. Usos/aplicaciones Este medio es usado para la búsqueda de cepas del género Salmonella de muestras de heces y alimentos lácteos, entre otros. Por ser un medio bastante inhóspito, es recomendable sembrar un inóculo abundante si se utiliza la muestra directa. En caso contrario se debe hacer un pre-enriquecimiento y enriquecimiento de los especímenes antes de sembrar en este medio. Como algunas cepas de Salmonella son inhibidas o crecen con dificultad, se aconseja acompañar este medio con otros agares selectivos para Salmonella. Toda colonia con característica típica de Salmonella debe ser sometida a pruebas bioquímicas para su identificación definitiva. Control de calidad Para probar el buen funcionamiento del medio agar verde brillante se pueden usar cepas ATCC para observar el desarrollo de las mismas sobre él. Las cepas más frecuentes utilizadas para control de calidad son: Salmonella enteritidis ATCC 13076, Salmonella typhimurium ATCC 14028, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 700603, Escherichia 12022, Staphylococcus aureus ATCC 6538. coli ATCC 25922, Shigella flexneri ATCC Las 3 primeras deben dar colonias blancas rosáceas o trasparentes sobre fondo rojo. Salmonella con buen desarrollo y Proteus con crecimiento escaso o regular. Para Klebsiella y Escherichia se esperan colonias amarillas verdosas con fondo amarillo y en el caso de Shigella y Staphylococcus deben ser inhibidas. El medio deshidratado debe guardarse a temperatura ambiente, en lugar seco, debido a que el medio es muy higroscópico. El agar XLD o agar Xilosa Lisina Desoxicolato es un medio de cultivo sólido selectivo y diferencial para el aislamiento de enteropatógenos. Taylor diseñó la fórmula del agar XL (Xilosa, Lisina) con el fin de mejorar el aislamiento del género Shigella. Observó que este género era inhibido en la mayoría de los medios destinados para el aislamiento de enteropatógenos. Posteriormente, se le adicionó desoxicolato sódico, tiosulfato de sodio y citrato amónico férrico para aumentar su selectividad. Esta fórmula ha resultado ser útil tanto para el aislamiento de Shigella, como de Salmonella. Diferencias de las colonias de Shigella, Salmonella y coliformes en agar XLD. A. Shigella sp, B. Salmonella sp, C. Coliformes. El agar XLD está compuesto por extracto de levadura, desoxicolato de sodio, xilosa, lisina, lactosa, sacarosa, tiosulfato sódico, citrato férrico de amonio, cloruro sódico, rojo fenol y agar. En la mayoría de los laboratorios de bacteriología se usa el dúo agar XLD y agar SS para el estudio de muestras fecales en busca de Shigella y Salmonella. Otros laboratorios prefieren la combinación de CHROMagar Salmonella y agar XLD, entre otras opciones disponibles. Estos dúos se pueden preparar en placas de Petri dobles. En un lado colocan agar XLD y en el lado opuesto el otro medio elegido. Índice del artículo [Mostrar] Fundamento -Poder nutritivo El agar XLD cuenta con el extracto de levadura, que sirve como fuente de nutrientes a los microorganismos que se desarrollan en este agar. Además, la presencia de carbohidratos (xilosa, sacarosa y lactosa) proporcionan energía a las bacterias que pueden fermentarlas. -Selectividad del medio Como sustancia inhibidora presenta desoxicolato sódico; este impide el crecimiento de las bacterias Gram positivas, dándole el carácter selectivo al medio. -Poder diferencial Colonias típicas de Shigella Como ya se ha mencionado, el agar XLD contiene xilosa; este carbohidrato es fermentado por todas las bacterias que crecen en este medio a excepción del género Shigella. Esta es una de las características que le brinda su carácter diferencial, ya que las colonias de Shigella se distinguen del resto por desarrollar colonias rojas, mientras que las demás bacterias producen colonias de color amarillo. Colonias típicas de Salmonella El género Salmonella también fermenta la xilosa, generando inicialmente colonias amarillas. Sin embargo, tras agotar al carbohidrato xilosa, ataca a la lisina por su enzima lisina descarboxilasa. La descarboxilación de la lisina genera álcalis que hacen virar el color de la colonia y al medio circundante a rojo original. Este comportamiento solo es realizado por Salmonella, ya que los coliformes que descarboxilan la lisina no logran alcalinizar el medio. Esto es debido a que los coliformes también fermentan la lactosa y la sacarosa presente; por tanto, la producción de ácidos es muy alta, quedando la colonia amarilla en estas bacterias. Cabe destacar que el género Salmonella no fermenta la sacarosa, ni la lactosa. Producción de H2S El agar XLD también permite detectar a las especies de Salmonella productoras de H2S; para ello cuenta con la fuente de sulfuro representado por el tiosulfato de sodio y un revelador de la reacción que es el citrato férrico de amonio. Este último reacciona con el H2S (gas incoloro) y forma un precipitado negro visible insoluble de sulfato de hierro. En este sentido, las características de las colonias de salmonella serán rojas con un centro negro. Cabe destacar que para que se dé la reacción de formación de H2S, se necesita un pH alcalino. Es por ello que otras enterobacterias que forman H2S no pueden hacerlo o lo hacen pobremente en este medio, pues la alta acidez que producen al fermentar los carbohidratos presentes inhiben o dificultan la reacción. -Cloruro de sodio, agar y rojo de fenol Finalmente, el cloruro de sodio mantiene el equilibrio osmótico; el agar es el agente solidificante y el rojo de fenol detecta los cambios de pH, haciendo virar el color de las colonias y del medio. Preparación Pesar 55 gr de medio XLD deshidratado y disolver en 1 litro de agua. Calentar y agitar la mezcla hasta que llegue al punto de ebullición. No sobrecalentar, ya que el calor daña el medio y crea un precipitado que altera la morfología de las colonias típicas. Este medio no debe autoclavarse. Al disolver se debe pasar a un baño de María a 50°C. Al enfriar se debe servir directamente sobre placas de Petri estériles. Pueden vertirse en placas sencillas o en placas dobles. Se dejan solidificar y se guardan en nevera hasta su uso. Atemperar antes de usar. Como es un medio no esterilizado se recomienda prepararlo cercano a la fecha de su uso. El pH final del medio debe quedar en 7,4 ± 0,2. El color del medio preparado es rojo naranja, traslúcido, sin precipitado. Si se cuenta con el agar base Xilosa Lisina (XL) se le puede agregar desoxicolato de sodio, tiosulfato de sodio y citrato amónico de hierro. De esta manera se obtiene la fórmula del agar XLD. Usos El agar XLD se usa para la recuperación de enteropatógenos, principalmente del género Shigella y secundariamente del género Salmonella. Es útil para evaluar muestras de heces, agua y alimentos. Tipos de muestras Heces Las muestras de heces se pueden sembrar de forma directa en el agar XLD, realizando una buena distribución del material para obtener colonias aisladas. Para mejorar la recuperación de Salmonella se puede sembrar el agar XLD a partir de medios de enriquecimiento para Salmonella. Alimento En el caso de alimentos se pueden usar caldos de enriquecimiento para Salmonella y para Shigella. Para Salmonella se puede utilizar caldo selenito cistina, caldo tetrationato verde brillante, entre otros. En el caso de Shigella se puede enriquecer con el caldo Shigella con 0,5 µ/ml de novobiocina, incubado a 42°±1°C por 16-20 horas. Agua En los análisis de agua se recomienda la técnica de filtración con membrana y el uso de agar XLD, entre otros. Condiciones de sembrado e identificación El medio sembrado se incuba en aerobiosis a 35°C por 24 a 48 horas. Se observan las colonias típicas de cada género, a las colonias sospechosas se le deben realizar pruebas bioquímicas para su identificación. Control de calidad Para evaluar el control de calidad del medio se pueden usar las siguientes cepas bacterianas: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495. El género Salmonella se caracteriza por presentar en este medio colonias rojas con centro negro o colonias completamente negras. En tanto que, en el género Shigella las colonias deben ser rojas, es decir del color del medio. En el caso de Escherichia coli se espera que sea inhibida total o parcialmente; si crece las colonias son amarillas. Para Proteus mirabilis se espera un crecimiento escaso con colonias rosadas con o sin centro negro. Finalmente, el género Klebsiella crecerá como colonias amarillas. Consideraciones finales El agar XLD es muy empleado en los laboratorios de bacteriología por su alta eficiencia para la recuperación de Shigella y además posee una buena recuperación del género Salmonella. Rall y colaboradores (2005) en su trabajo titulado “Evaluación de tres caldos de enriquecimiento y cinco medios sólidos para la detección de Salmonella en aves de corral” demostraron que de los 3 medios clásicos probados (agar verde brillante, agar SS y agar XLD), el agar XLD obtuvo la mejor tasa de recuperación. Los porcentajes de recuperación fueron los siguientes: 13.8% para agar verde brillante, 27.6% para SS, y 34.5% para XLD. Solo fue superado por los medios cromogénicos agar Rambach con 48% de recuperación y el CHROMagar con 79.3%. El caldo EC o caldo Escherichia coli es un medio de cultivo líquido selectivo. Este medio es recomendado por la Standard Methods para el recuento de coliformes totales y fecales, por la técnica del número más probable (NMP) en muestras de agua y alimentos, donde el principal agente involucrado es la Escherichia coli. El caldo EC está compuesto por tripteína, lactosa, sales biliares, fosfato dipotásico, fosfato monopotásico, cloruro de sodio y agua. Su fórmula está estratégicamente diseñada para favorecer el crecimiento de coliformes totales y fecales e impedir el desarrollo de otros microorganismos acompañantes. Representación figurativa de la preparación del caldo EC. La bacteria Escherichia coli es el principal coliforme fecal presente como contaminante en fuentes de agua y alimentos, siendo causante de importantes afectaciones gastrointestinales. Cabe destacar que existen muchos serotipos de Escherchia coli; entre ellas se pueden mencionar la enterohemorrágica (EHEC), enteroinvasiva (EIEC), enteopatógena (EPEC), enterotoxigénica (ETEC) y enteroagregativa (EAEC). Este medio tiene la capacidad de permitir el desarrollo de todas ellas, pero sin poder diferenciarlas entre si. Para ello se deben realizar pruebas adicionales. El estudio microbiológico de agua y alimentos por el número más probable (NMP) para la búsqueda de coliformes totales y fecales es un protocolo que está conformado por varias fases; fase presuntiva, fase confirmatoria y fase de completación. El caldo EC se usa en la fase confirmatoria. Fundamento Caldo EC El medio EC se fundamenta en proporcionar los elementos nutricionales necesarios para el desarrollo óptimo de coliformes totales y fecales, donde está incluida la bacteria Escherichia coli. Estos elementos nutricionales son proporcionados por la tripteína, siendo una excelente fuente de péptidos y aminoácidos. Además, también contiene lactosa, un carbohidrato fermentable que brinda energía y permite evidenciar si la bacteria produce gas. Por otra parte, el medio contiene sales biliares que brindan el carácter selectivo, ya que inhibe el crecimiento de microorganismos Gram positivos que puedan estar presentes en la muestra. Así mismo, el fosfato dipotásico y el fosfato monopotásico actúan como un sistema equilibrador del pH. Este sistema es necesario, debido a que la lactosa contenida en el caldo tiende a acidificar el medio cuando es fermentada por los microorganismos, pero esto es compensado por las sales fosfatos. Por tanto, estos elementos son esenciales, debido a que la acidez sin control puede afectar el buen desarrollo de los microorganismos buscados. Por su parte, el cloruro de sodio estabiliza el medio osmóticamente, en tanto que el agua es el disolvente de los solutos presentes y brinda la consistencia líquida al medio. Caldo EC modificado con novobiocina Okrend y Rose crearon una variedad del caldo EC, denominado caldo EC modificado con novobiocina. La modificación consistió en la disminución de la concentración de las sales biliares y el agregado de 20 mg/dl de novobiocina. Esta modificación favorece la recuperación de cepas de Escherichia coli enterohemorrágica (O157:H7). Este serotipo bacteriano causa colitis hemorrágicas severas que pueden ocasionar el síndrome urémico hemolítico (SUH); que a su vez puede generar insuficiencia renal aguda, con una tasa de mortalidad alta que puede llegar hasta un 50% en ancianos. Debido a la morbi-mortalidad que ocasiona anualmente esta bacteria por el consumo de alimentos contaminados, el Departamento de Agricultura de los Estados Unidos (USDA) recomienda ampliamente el uso de este medio. Preparación Caldo EC Pesar 37,4 gr del medio deshidratado y disolver en 1 litro de agua destilada. La mezcla se debe dejar reposar por 5 minutos. Posteriormente, en una fuente de calor, se termina de disolver agitando con frecuencia. Una vez disuelto, se distribuye en tubos de ensayo previamente acondicionados con un tubo Durham dentro. Esterilizar en autoclave a 121°C durante 15 minutos. El pH del medio debe quedar en 6,9 ± 0,2. El color del medio deshidratado es beige y preparado es ámbar claro. Los caldos se guardan en nevera hasta su uso. Al momento de su uso los caldos deben estar a temperatura ambiente. Por otra parte, el caldo EC también puede ser preparado a doble concentración. Caldo EC modificado con novobiocina Pesar 36,7 gr del medio deshidratado y disolver en 1 litro de agua. El resto de la preparación es igual a la descrita anteriormente. Uso Análisis de coliformes totales y fecales El caldo EC es ideal para la fase confirmatoria del estudio de coliformes por el método del NMP, tanto en muestras de aguas, como en productos farmacéuticos y alimentos. Los caldos lactosados turbios y con producción de gas que se obtengan en la fase presuntiva deben resembrarse en caldos verde brillante bilis al 2% y en caldo EC. Para coliformes totales los caldos EC se incuban en aerobiosis por 24 a 48 horas a 37°C, y para coliformes fecales se incuban en aerobiosis por 24 a 48 horas a 44°C. En ambos casos se interpreta de la siguiente manera: los tubos turbios con producción de gas se consideran positivos. Si en 24 horas no hay producción de gas se continúa la incubación hasta por 48 horas. Los caldos EC positivos pasan a la fase completa confirmatoria, la cual consiste en resembrar en medios selectivos como agar Mac Conkey, agar EMB o agar Endo. Si el caldo utilizado es EC modificado con novobiocina, los tubos positivos se recomiendan resembrar en agar Mac Conkey con sorbitol. Control de calidad De cada lote de medio preparado se debe hacer un control de calidad. En primer lugar se debe evaluar la esterilidad del medio. En este sentido, se incuba uno o dos caldos sin inocular en aerobiosis por 24 horas a 37°C. El resultado esperado es un caldo transparente, sin turbidez ni cambio de color. En segundo lugar, se debe evaluar el crecimiento de cepas conocidas, para ello se pueden usar las siguientes bacterias: Escherichia coli, ATCC 8739, Escherichia coli ATCC 25922, Salmonella typhimurium ATCC 14028. En todos los casos se espera un desarrollo microbiano satisfactorio, observando un caldo turbio con producción de gas para E. coli y sin gas para Salmonella. Otras cepas que pueden ser incluidas en el control son: Staphylococcus aureus ATCC 25923, Enterococcus faecalis ATCC 29212. Estas cepas deben ser inhibidas totalmente. Recomendaciones -La colocación de los tubos Durham es indispensable para el estudio de coliformes. -Distribuir el medio en los tubos de ensayo antes de esterilizar, nunca después. -No usar si el medio tiene más de 3 meses de preparado. -No usar si se observa algún cambio de las características habituales del medio. El caldo selenito es un medio de cultivo líquido selectivo. Fue diseñado por Leifson para el enriquecimiento de muestras en donde se sospecha la presencia de bacterias enteropatógenas del género Salmonella. Este medio cumple con las exigencias de la Asociación Americana de Salud Pública (APHA), y por ello es aceptado para la investigación de presencia de Salmonella en muestras de heces, orina, alimentos líquidos o sólidos, agua, entre otros. Caldo selenito. Fuente: Foto tomada por la autora MSc. Marielsa Gil La composición química que posee favorece la recuperación de estos microorganismos y a su vez inhibe el crecimiento de otros. Es principalmente tóxico para la mayoría de las bacterias pertenecientes a la Familia Enterobacteriaceae. Sin embargo, también permite la recuperación de cepas de Shigella y no inhibe el crecimiento de Pseudomonas y Proteus. Está compuesto por selenito hidrógeno de sodio anhidro, fosfato de sodio anhidro, peptonas y lactosa. También existe una variante al que se adiciona cistina, de allí su nombre caldo selenito-cistina. En la actualidad se prefiere el uso de caldo selenito-cistina, ya que se obtiene mayor porcentaje de recuperación de Salmonella equivalente al observado con otros medios selectivos con el mismo fin, tal como el caldo tetrationato de sodio. Fundamento Las peptonas contenidas en el caldo sirven como nutrientes para el buen desarrollo de los microorganismos. Las cepas de Salmonella utilizan las peptonas como fuente de nitrógeno, vitaminas y aminoácidos. La lactosa es el carbohidrato fermentable, en tanto que el selenito de sodio es la sustancia inhibidora que frena el crecimiento de bacterias Gram positivas y de la mayoría de bacterias presentes en la flora intestinal, especialmente de la Familia Enterobacteriaceae. El fosfato de sodio es el amortiguador que estabiliza el pH del medio. En el caso de la variante de caldo selenito que contiene L-cistina, este compuesto adicional es un agente reductor que minimiza la toxicidad del selenito, aumentando la recuperación de Salmonella. Preparación -Caldo selenito Si se cuenta con los componentes de la mezcla se puede pesar: 4 gr de selenito hidrógeno de sodio anhidro. 10 gr de fosfato de sodio anhidro. 5 gr de peptonas. 4 gr de lactosa. Disolver los compuestos en 1 litro de agua destilada estéril. Se puede calentar ligeramente para disolver en su totalidad. Algunos laboratorios exponen el medio por 10 minutos en vapor fluente para esterilizarlo, ya que no debe usarse autoclave. Si se esteriliza el medio puede guardarse en nevera hasta su uso. También se puede preparar sin esterilizar y servir directo 10 a 15 ml a los tubos de ensayo estériles. En este caso se debe dejar reposar y usar inmediatamente. Como el medio no está estéril no puede guardarse en nevera para su uso posterior. –Preparación del medio comercial Si se dispone del medio comercial se pesan 23 gr del medio deshidratado y se disuelve en un litro de agua destilada estéril. Calentar brevemente para terminar de disolver. No esterilizar en autoclave. Servir asépticamente 10 o 15 ml en tubos de ensayo estériles. El pH final del medio debe ser de 7,0 ± 0,2. Cabe destacar que el color del medio deshidratado es beige y el preparado es ámbar claro y traslúcido. Variante caldo selenito–cistina Contiene los mismos compuestos del caldo selenito, pero se le adicionan 10 mg de cistina. El resto del procedimiento es exactamente igual al descrito anteriormente. Usos Este medio es especial para ser utilizado en estudios epidemiológicos, en casos donde la enfermedad no está en su etapa aguda, pacientes asintomáticos o portadores sanos. El aislamiento del género Salmonella es por lo general difícil, pues normalmente se encuentran contaminando las muestras en forma escasa. Al estar en pocas cantidades es fácilmente solapado por el crecimiento de otros géneros bacterianos que se encuentran en mayor cantidad. Por otra parte, la materia prima con la que se elaboran alimentos procesados a menudo son expuestos al calor, a procesos de deshidratación, al uso de desinfectantes, radiación y conservantes, entre otros. Por tanto, las Salmonellas presentes en la materia prima son maltratadas por el sometimiento del producto a los procesos industriales antes mencionados. Así mismo, en el caso de muestras clínicas como las heces, las cepas pueden estar débiles si provienen de pacientes que han sido tratados con antibióticos. Por ello, toda muestra en la que se sospeche la presencia de Salmonella debe ser preenriquecida en caldo lactosado, y posteriormente enriquecida en caldo selenito para optimizar su recuperación en los medios selectivos, tales como agar SS, agar xilosa, lisina desoxicolato (XLD), agar Hektoen entérico (HE) y agar verde –brillante, entre otros. Sembrado Para muestras de heces tomar 1 gr de muestra y suspender en un tubo con 10 a 15 ml de caldo selenito. Si las heces son líquidas tomar 1 ml y suspender en el caldo. Para hisopados rectales, descargar el material del hisopo en el caldo. En muestras de alimentos sólidos tomar 1 gr y suspender en el caldo selenito. En alimentos líquidos mezclar a partes iguales con el caldo selenito a doble concentración. Para muestras de orina se debe centrifugar, descartar el sobrenadante, tomar todo el sedimento y suspenderlo en el caldo selenito. Se incuban los caldos a 37°C por 24 horas de incubación. El crecimiento bacteriano se evidencia por turbidez. También se puede incluir un tubo adicional por muestra para incubar a 42°C. Posteriormente, sembrar medios sólidos selectivos a partir del caldo selenito. Control de calidad Para control de esterilidad se incuba a 37 °C por 24 horas un caldo selenito de cada lote sin inocular. Se espera que no haya turbidez, ni cambio de color del medio. Para el controlar el buen funcionamiento del medio se pueden usar cepas conocidas, tales como: Salmonella enteritidis ATCC 13076, Salmonella typhimurium ATCC 14028, Salmonella choleraesuis ATCC 12011, Escherichia coli ATCC 25922 y Proteus mirabilis ATCC 43071. Los resultados esperados son: Para las tres primeras cepas bacterianas el crecimiento debe ser satisfactorio. Para Escherichia coli inhibición parcial. Para Proteus crecimiento moderado. Limitaciones El medio caldo selenito es tóxico para la piel humana, por tanto debe evitarse el contacto directo El c aldo tetrationato o caldo TT es un medio de cultivo líquido selectivo para el enriquecimiento y recuperación de cepas del género Salmonella. Fue creado por Müeller y más tarde modificado por Kauffmann, por ello hay quienes le llaman caldo MüellerKauffmann. El medio original contenía proteosa peptonas, carbonato de calcio y tiosulfato de sodio. Kauffmann le adicionó sales biliares y creó aparte otra modalidad con verde brillante. Estas sustancias inhiben el crecimiento de coliformes, dejando el medio libre para el desarrollo de las bacterias patógenas, en este caso Salmonella. Agregado de la solución de iodo iodurada al caldo tetrationato. Fuente: Manuel Almagro Rivas [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] La modificación fue muy acertada porque aumentó significativamente la sensibilidad del medio. Por ello actualmente es útil para la búsqueda de Salmonellas en cualquier tipo de muestra, pero en especial para heces sólidas o líquidas y alimentos. Su preparación consta de dos fases; el medio comercial es una base para preparar el caldo tetrationato, y posteriormente para que el tetrationato se pueda formar se agrega una solución de iodo iodurada que completa el medio. La American Public Health Association (APHA) recomienda el uso del caldo tetrationato suplementado con verde brillante para el enriquecimiento de muestras en busca de Salmonella, ya que es más selectivo que el caldo tetrationato y el caldo selenito. En general, el caldo tetrationato es ideal cuando se sospecha la presencia de bacterias del género Salmonella en pequeñas cantidades o que se encuentren maltratadas por la exposición a sustancias inhibidoras o por procesos industriales que minimicen su viabilidad. Fundamento Las peptonas presentes corresponden a digeridos pancreático de caseína y digerido péptico de tejido animal. Estas proporcionan la fuente de carbono, nitrógeno y nutrientes en general para el crecimiento bacteriano. Por su parte, el tiosulfato de sodio reacciona con la solución iodurada para formar tetrationato. Este inhibe el crecimiento de coliformes y favorece el desarrollo de bacterias que contienen la enzima tetrationato reductasa, entre ellas se encuentra el género Salmonella, pero también Proteus. Las sales biliares también actúan como sustancia inhibidora de la mayoría de las bacterias Gram positivas y algunas Gram negativas (coliformes). El carbonato de calcio absorbe las sustancias tóxicas generadas por la descomposición del tetrationato, lo cual forma ácido sulfúrico. En este sentido, el carbonato de calcio neutraliza la acidez manteniendo el pH del medio estable. En el caso de la modalidad con verde brillante, esta sustancia aumenta el poder selectivo del caldo tetrationato al inhibir otros microorganismos distintos al género Salmonella. Preparación -Caldo tetrationato Solución iodo iodurada Pesar: 6 gr de iodo. 5 gr de ioduro de potasio. El ioduro de potasio se disuelve en aproximadamente 5 ml de agua destilada estéril, luego se le agrega el yodo poco a poco mientras se calienta la mezcla. Después que esté completamente disuelto se enrasa con agua destilada estéril hasta llegar a un volumen final de 20 ml. Medio base para caldo tetrationato Pesar 46 gramos del medio deshidratado y suspender en 1 litro de agua destilada estéril. Mezclar y calentar hasta su disolución total, puede llevar a ebullición solo por pocos minutos. No esterilizar en autoclave. La base del medio se deja enfriar hasta 45°C aproximadamente y en ese momento se le agrega 20 ml de la solución iodurada. Después de agregar la solución iodurada al medio debe utilizarse inmediatamente. Si no se desea usar toda la mezcla, se debe proceder de la siguiente manera: Se distribuye 10 ml del medio base en tubos, y solo a los que van a ser inoculados con muestras se le agrega 0,2 ml de la solución iodurada. Los que no se van a utilizar todavía se pueden guardar en nevera, sin embargo como el medio no está esterilizado, lo ideal es preparar la cantidad exacta que se necesita. El color del medio antes de agregar la solución de iodo iodurada es blanco lechoso con precipitado blanco y después de agregado es color marrón con un precipitado denso. El precipitado observado es normal y corresponde al carbonato de calcio que no se disuelve. El pH final del medio es de 8,4 ± 0,2. -Variante caldo tetrationato con verde brillante Para preparar el caldo tetrationato con verde brillante se realizan todos los pasos descritos anteriormente, pero adicionalmente se va agregar a la mezcla 10 ml de la solución verde brillante preparada al 0,1%. Verde brillante Esta solución se prepara de la siguiente manera: Pesar 0,1 gr de verde brillante y suspender en 100 ml de agua destilada. Calentar hasta ebullición para lograr su disolución total. Guardar en frasco ámbar. Uso Para muestras de heces (coprocultivo) el protocolo es el siguiente: Inocular 1 gr de heces sólidas o 1 ml de heces líquidas en un tubo con 10 ml de caldo tetrationato listo para usar. Agitar fuertemente e incubar en aerobiosis a 43°C por 6-24 horas. Subsiguientemente, tomar una alícuota de 10 a 20 µl del caldo y subcultivar en un medio selectivo para Salmonella, tales como agar SS, agar XLD, agar verde brillante, agar entérico Hektoen, entre otros. Paralelamente se deben inocular medios selectivos para Salmonella con la muestra directa (heces) sin enriquecimiento. Para muestras de hisopados rectales, descargar el material recolectado en el tubo y proceder de la forma descrita anteriormente. Para muestras de alimentos pesar 10 gr del alimento sólido o 10 ml del alimento líquido e inocular un frasco con 100 ml de caldo tetrationato listo para usar. Proceder de igual manera que la descrita anteriormente pero incubar a 37°C. Como puede observarse la relación entre la muestra y el caldo siempre será de 1:10. Control de calidad Para probar el medio de cultivo se pueden usar cepas controles conocidas. Las más utilizadas son las cepas certificadas ATCC. Las cepas a usar son Salmonella typhimurium ATCC 14028, Salmonella abony DSM 4224, Salmonella enteritidis ATCC 13076, Escherichia coli ATCC 25922, Enterococcus faecalis ATCC 19433 y Staphylococcus aureus ATCC 25923. Para las cepas de Salmonella se espera un desarrollo excelente, en tanto que Escherichia coli puede tener un desarrollo débil o regular, y las cepas Gram positivas (Enterococcus y Staphylococcus) se inhiben parcial o totalmente. Recomendaciones -Como este medio no inhibe el crecimiento de Proteus, algunos laboratorios acostumbran colocar 40 mg/L de novobiocina para evitar el desarrollo de esta cepa microbiana. El antibiótico se debe agregar antes de la solución de iodo iodurada. -Después de preparado el medio incluyendo la solución de iodo iodurada, no debe pasar más de 2 horas en ser inoculado. -Al momento de distribuir el medio en los tubos se debe homogenizar la mezcla continuamente para resuspender el precipitado formado. -En muestras menos contaminadas se incuba el caldo tetrationato a 35-37 °C, y en muestras muy contaminadas se recomienda la incubación a 43°C. El agar sal y manitol o manitol salado es un medio de cultivo sólido, selectivo y diferencial. Fue creado por Chapman para el aislamiento de cocos Gram positivos patógenos, especialmente Staphylococcus aureus. Sin embargo, también es útil para aislar Staphylococus epidermidis, que en ocasiones puede estar presente como patógeno oportunista, y Staphylococcus saprophyticus, reconocido patógeno urinario, entre otras especies. A. Fiola con medio agar manitol salado preparado. B. Placas de agar manitol salado sembrados con cepas bacterianas fermentadoras y no fermentadoras de manitol. Fuente: A y B: Fotos tomadas por la autora MSc. Marielsa Gil. Algunos Enterococcus son capaces de crecer en este medio, así como también ciertos bacilos Gram positivos formadores de esporas. Este medio es de gran utilidad en el análisis de muestras clínicas, pero también se usa en el estudio microbiológico de alimentos y en el control de calidad de productos industriales, como cosméticos, medicinas, entre otros. El agar manitol salado está compuesto por extractos y peptonas de carne bovina, tripteína, manitol, cloruro de sodio, rojo de fenol y agar. Fundamento El agar manitol es selectivo gracias a la alta concentración de sal que posee. La salinidad actúa como sustancia inhibitoria y evita el crecimiento de bacterias Gram negativas. También es diferencial debido a la presencia del carbohidrato manitol y al indicador de pH rojo de fenol. A partir de este, las bacterias capaces de fermentar el manitol producen ácidos, acidificando el medio, tornándose las colonias y el medio de color amarillo. Por otra parte, las colonias que no fermentan el manitol crecen en el medio tomando los nutrientes que les proporciona los extractos y peptonas de carne y la tripteína. De allí las bacterias extraen el carbono, el nitrógeno, las vitaminas y los minerales necesarios para su crecimiento. Las colonias en este caso pueden ser rosadas débil o fuertes, y el medio se queda del mismo color o cambia a fucsia. El agar es la sustancia que proporciona la consistencia al medio. Preparación Para preparar un litro de agar manitol salado se pesan 111 gr del medio deshidratado de la casa comercial de preferencia y se disuelven en 1000 ml de agua destilada, utilizando una fiola. Se aplica calor removiendo frecuentemente el medio para mejorar el proceso de disolución. Se deja hervir durante un minuto. Se coloca la fiola en el autoclave a 121°C por 15 minutos. Terminado el tiempo, se saca la fiola del autoclave, se deja reposar y se sirve entre 15 a 20 ml sobre placas de Petri estériles cuando la temperatura sea aproximadamente de 50 a 55°C. Se deja solidificar, ordenando de forma invertida en plaqueros y guardando en nevera hasta su uso. Antes de sembrar una muestra, se debe esperar a que la placa tome la temperatura del ambiente. Se siembran las placas por estriamiento o por sembrado en superficie con espátula de drigalski. El pH final del medio preparado debe quedar en 7,4 ± 0,2 El color del medio deshidratado es beige claro y el color del medio preparado es rojo naranja. Usos Por su alta selectividad, este medio es ideal para sembrar muestras con flora mixta en la que se quiere buscar la presencia de Staphylococus aureus, como principal patógeno de este género. En este sentido, uno de sus usos más frecuentes es en el análisis microbiológico de muestras de exudados faríngeos y secreción nasal, especialmente para detectar portadores asintomáticos de S. aureus. Algunos países han implementado este análisis como requisito obligatorio para personas que desean trabajar como expendedores de alimentos. Este control previene que se contraten personas portadoras de S. aureus, evitándose así que haya intoxicaciones alimentarias masivas, debido al consumo de alimentos contaminados con la enterotoxina estafilocócica. También puede incluirse en la siembra de infecciones de heridas, hemocultivos, LCR, lavado bronco alveolar, entre otras. El agar manitol salado es útil para reaislar colonias de urocultivos provenientes de agar CLED o agar sangre cuyo Gram haya revelado cocos Gram positivos en racimos. También es válido en el análisis microbiológico de alimentos, agua potable, suelos, entre otras aplicaciones. Control de calidad Una vez preparado un lote de placas con agar manitol salado es aconsejable realizar un control de calidad. Se siembran cepas controles para evidenciar si hay o no crecimiento de los mismos. Como control positivo se pueden usar cepas conocidas de Staphylococcus aureus. El mismo debe crecer satisfactoriamente desarrollando colonias amarillas, y el medio también se torna del mismo color. Así mismo, es conveniente incluir una cepa conocida de Staphylococcus epidermidis. Debe crecer satisfactoriamente desarrollando colonias de color rosadas, y el medio se queda del mismo color o se oscurece en un rosado más fuerte. Como control negativo, se utilizan cepas que no deberían crecer en este medio. Por ejemplo, se puede sembrar una cepa conocida de Escherichia coli o Klebsiella pneumoniae. El resultado esperado es inhibición completa, es decir, no crecimiento. Adicionalmente se debe incubar una placa sin inocular. En el mismo no debe haber crecimiento, ni cambio de color. Es importante que no se use la placa si se tienen indicios de deterioro, como contaminación, deshidratación, decoloración, entre otros. Consideraciones finales Al usar el medio agar manitol salado hay que tener en consideración algunos aspectos importantes: -Obtener un crecimiento de colonias amarillas no indica que sea Staphylococcus aureus. Hay que recordar que algunas cepas de Enterococcus son capaces de crecer en este medio y fermentar el manitol, así como ciertos bacilos Gram positivos formadores de esporas. Por tanto, es importante realizar un Gram a la colonia y una prueba de catalasa. -Por otra parte, hay que considerar que otras especies de Staphylococcus diferentes al aureus también son capaces de fermentar el manitol. Por tanto, es importante sub-cultivar la colonia a un caldo nutriente para tomar de allí y realizar la prueba de la coagulasa. Entre las especies de Staphylococcus de importancia clínica para el hombre que fermentan el manitol están: S. aureus, S. simulans, S. capitis ssp capitis, S. capitis ssp urealyticus, S. xylosus, S. cohnii ssp urealyticum, entre otros. Otras pueden dar reacción variable, es decir, algunas veces positivas y otras negativas. Algunas son S. saprophyticus, S. haemolyticus, S. warneri, S. intermedius, entre otras. -No se recomienda tomar colonias de forma directa del agar manitol para realizar la prueba de la coagulasa, ya que la alta concentración de sal del medio puede interferir en el resultado. -Finalmente se recomienda incubar las placas sembradas de manitol salado hasta durante 48 horas, debido a que algunas cepas de S. aureus pueden fermentar lentamente el manitol, aunque esto no es muy frecuente. El agar Sabouraud, también conocido como agar dextrosa Sabouraud, es un medio de cultivo sólido, especialmente enriquecido para el aislamiento y desarrollo de hongos, como levaduras, mohos y dermatofitos. Por tanto, este medio no puede faltar en un laboratorio de microbiología para investigar la presencia de hongos patógenos u oportunistas, bien sea de muestras clínicas o no clínicas. Igualmente, también es ideal para el crecimiento de bacterias filamentosas como Streptomices y Nocardias. Su uso es muy amplio, pues puede ser empleado en la micología humana, animal, vegetal e industrial. A. Agar Sabouraud sin sembrar. B. Agar Sabouraud sembrada con una levadura. Este medio fue creado en 1896 por el destacado médico dermatólogo Raimond Sabouraud, quien llegó a ser un especialista reconocido mundialmente en desórdenes del cuero cabelludo, principalmente causados por dermatofitos. Su creación fue tan importante que ha sido usado desde entonces y se mantiene en la actualidad, aunque con algunas modificaciones. Aunque es especial para hongos, en este medio pueden crecer bacterias, por tanto para muestras con flora mixta se requiere la inclusión de antibióticos en su preparación y así inhibir el crecimiento de la flora bacteriana que pueda estar presente. La elección del antibiótico debe realizarse con cuidado y tomando en cuenta el tipo de hongo que se quiere recuperar, ya que algunos se inhiben en presencia de ciertas sustancias. Fundamento El agar dextrosa Sabouraud es un medio que en su formulación original es débilmente selectivo, debido a su pH ácido de 5.6 ± 0.2, sin embargo aun así las bacterias pueden desarrollarse, principalmente en incubaciones prolongadas. El medio contiene peptona de caseína y digerido pancreático de tejido animal, que proporcionan la fuente de carbono y nitrógeno para el desarrollo de los microorganismos. También contiene alta concentración de glucosa, que actúa como fuente de energía favoreciendo el crecimiento de los hongos por encima de las bacterias. Todo ello mezclado con agar-agar, componente que le brinda la consistencia adecuada. Por otra parte, el agar dextrosa Sabouraud puede ser selectivo si se le agrega antibióticos. Con antibióticos es especialmente útil en muestras de heridas, úlceras abiertas o cualquier muestra en la que se sospeche gran contaminación bacteriana. Combinaciones más utilizadas de agar dextrosa Sabouraud con antibióticos -Agar Sabouraud con cloranfenicol: ideal para recuperar levaduras y hongos filamentosos. -Agar Sabouraud con gentamicina y cloranfenicol: en este medio crecen casi todos los hongos filamentosos y levaduras, e inhibe una gran cantidad de bacterias, entre ellas Enterobacterias, Pseudomonas y Staphylococcus. -Agar Sabouraud con cycloheximide: es especialmente útil para muestras procedentes de piel o del tracto respiratorio, siempre y cuando la sospecha sea de hongos dimórficos. El cycloheximide debe usarse con precaución; si bien se usa para inhibir el crecimiento de hongos y levaduras no patógenas o ambientales que puedan estar presentes como contaminantes en una muestra, también inhibe el crecimiento de algunos hongos como Cryptococcus neoformans, Aspergillus fumigatus, Allescheria boydii, Penicillium sp y otros hongos oportunistas. -Agar Sabouraud con cloranfenicol más cycloheximide: se usa principalmente para aislar dermatofitos y hongos dimórficos. Tiene el inconveniente que inhibe algunas especies de hongos oportunistas como Candida no albicans, Aspergillus, Zigomicetos o C. neoformans. -Agar Sabouraud con cloranfenicol, estreptomicina, penicilina G y cycloheximide: es ideal para muestras extremadamente contaminadas con bacterias y hongos saprófitos, pero tiene el inconveniente de que inhibe el crecimiento de Actinomyces y Nocardias, además de los hongos oportunistas mencionados anteriormente. Preparación Si se cuentan con los ingredientes por separado se puede preparar de la siguiente manera: Agar dextrosa Sabouraud Pesar: – 40 gr de dextrosa – 10 gr de peptona – 15 gr de agar-agar – Medir 1000 ml de agua destilada Se mezclan todos los ingredientes, se ajusta el pH a 5,6. Se procede a disolver los solutos mediante ebullición, se distribuye 20 ml del medio en tubos de 25 x 150 mm, sin reborde y con tapa de algodón preferiblemente. Tubos con tapa de algodón. Fuente: Foto tomada por la autora MSc. Marielsa Gil También se pueden usar otras medidas de tubos, según la disponibilidad. Se llevan al autoclave durante 10 minutos a una atmósfera de presión (121°C). No se debe exceder en el tiempo de autoclavado. Al salir del autoclave se inclinan los tubos con ayuda de un soporte hasta que solidifiquen en pico de flauta. Otra forma es disolver los ingredientes por calentamiento hasta que hierva. En la misma fiola autoclavar durante 10 minutos y posteriormente distribuir 20 ml en placas de Petri. Si se dispone de un medio agar dextrosa Sabouraud que ya contiene todos los ingredientes, se procede a pesar la cantidad que especifique la casa comercial para un litro de agua. El resto de los pasos es igual a los descritos anteriormente. Agar dextrosa Sabouraud (modificación de Emmons) Pesar: – 20 gr de dextrosa – 10 gr de peptona – 17 gr de agar-agar – Medir 1000 ml de agua destilada Se mezclan todos los ingredientes, se ajusta el pH a 6,9. Proceder de la misma manera del caso anterior. Hay casas comerciales que ofrecen el medio con todos los ingredientes. En este caso, pesar y preparar del modo como lo describe el inserto. Agar dextrosa Sabouraud (modificación de Emmons) con cloranfenicol Solución madre de cloranfenicol – Pesar 500 mg de cloranfenicol base – Medir 100 ml de etanol al 95% – Mezclar El medio agar dextrosa Sabouraud (Emmons) se prepara como ya fue descrito y adicionalmente por cada litro de medio añadir 10 ml de solución madre de cloranfenicol antes de autoclavar. Agar dextrosa Sabouraud Emmons con cycloheximide Solución madre de cycloheximide – Pesar 5 gr de cycloheximide – Medir 100 ml de acetona – Mezclar El medio agar dextrosa Sabouraud (Emmons) se prepara como ya fue descrito y adicionalmente por cada litro de medio añadir 10 ml de solución madre de cycloheximide antes de autoclavar. Agar dextrosa Sabouraud (Emmons) con cloranfenicol y cycloheximide El medio agar dextrosa Sabouraud (Emmons) se prepara como ya fue descrito y adicionalmente por cada litro de medio añadir 10 ml de solución madre de cloranfenicol y 10 ml de solución madre de cycloheximide antes de autoclavar. Otros antibióticos que pueden ser añadidos 20.000 a 60.000 unidades de penicilina por litro de medio. 30 mg de estreptomicina por litro de medio. Ambos deben ser incorporados después de autoclavado el medio, ligeramente enfriado (5055°C). 0,04 g de neomicina por litro de medio. 0.04 g de gentamicina por litro de medio. Consideraciones especiales Por seguridad se prefiere sembrar agar dextrosa Sabouraud en tubos en forma de cuña (inclinado en pico de flauta) antes que en placas de Petri, para evitar la dispersión e inhalación de las esporas. Es importante que los tubos con agar Sabouraud se tapen con algodón y no con tapa de rosca, ya que se ha demostrado que las condiciones semianaeróbicas inhiben la formación de esporos en algunas cepas, por ejemplo de Coccidioides immitis. Además, la mayoría de los hongos son aerobios. En caso de usar tapa de rosca, no cerrar herméticamente. Control de calidad A los medios preparados se les debe hacer control de calidad para verificar su buen funcionamiento. Para ello se siembran ciertas cepas controles. Para agar dextrosa Sabouraud con cloranfenicol se pueden usar cepas ATCC de Candida albicans, el cual debe tener un excelente crecimiento. Otra placa se inocula con cepas de Escherichia coli, debiendo ser inhibido completamente. También se incuba una placa sin inocular en la que no debe crecer ningún microorganismo. Para agar dextrosa Sabouraud con cloranfenicol y cycloheximide se pueden usar cepas de Trichophyton mentagrophytes, debiendo desarrollarse bien. Otra placa se inocula con una cepa de Aspergillus flavus, en el que debe haber crecimiento escaso o no crecimiento. Adicionalmente se incuba una placa sin inocular para demostrar su esterilidad. Para agar dextrosa Sabouraud con cycloheximide se usan cepas de Cándida albicans, Trichophyton rubrum o Microsporum canis, los cuales deben demostrar buen crecimiento. Así mismo, se incluye una cepa de Aspergillus flavus, demostrando crecimiento escaso o no crecimiento. Finalmente incubar una placa sin inocular para control de esterilidad. Usos Cultivo primario El agar dextrosa Sabouraud clásico contiene 4 gr de dextrosa y es excelente como medio primario de aislamiento, pues muestra la morfología característica de cada hongo. Además es excelente para demostrar la producción de pigmentos. Sin embargo, no es el medio más adecuado para observar la esporulación. Tampoco está recomendado para cultivar a Blastomyces dermatitidis, el cual es inhibido por la alta concentración de glucosa presente. Por otra parte, para el cultivo se deben tener presente ciertas consideraciones. Algunos hongos se desarrollan mejor a temperatura ambiente, como los mohos, otros se desarrollan exitosamente a 37°C, como algunas levaduras, y otros pueden desarrollarse a ambas temperaturas (hongos dimórficos). Por ello, a veces es necesario utilizar varias placas de agar Sabouraud para una misma muestra, pues con frecuencia se realizan sembrados por duplicado para incubar una placa a temperatura ambiente y otra a 37°C. Por ejemplo, Sporothrix schenckii se siembra en dos placas; una se incuba a temperatura ambiente para obtener la fase de moho y la otra se incuba a 37 °C para obtener la fase levaduriforme, pero en esta última es necesario adicionar 5% de sangre al medio. En otros casos, como en muestras de micetomas, se siembran dos placas de agar Sabouraud, una con cloranfenicol y otra con cycloheximide. La primera permitirá el crecimiento de agentes causales de micetoma de origen micótico (Eumicetoma) y la segunda agentes causales de micetomas de origen bacteriano, como los actinomicetomas. Esporulación El agar dextrosa Sabouraud modificado por Emmons contiene 2 gr de dextrosa y no solo sirve para el aislamiento, sino también para la esporulación y conservación de los hongos. En este medio si se pueden recuperar cepas de Blastomyces dermatitidis. Conservación Para conservar los cultivos de hongos se pueden guardar en nevera (2-8°C). El tiempo de conservación puede variar entre 2 a 8 semanas. Después de este tiempo deben subcultivarse para repetir el proceso. Algunos hongos se mantienen mejor a temperatura ambiente, como Epidermophyton foccosum, Trichophyton schoenleinnii, T. violaceum y Microsporum audounii. Se puede alargar el mantenimiento de la cepa para evitar el pleomorfismo si se elimina por completo la dextrosa del agar y si se disminuye la cantidad de agar al medio para evitar la resequedad. Microcultivos Para la identificación de algunos hongos filamentosos es necesario realizar microcultivos utilizando agar Sabouraud u otros medios especiales para observar las estructuras de reproducción sexual y asexual. En micología humana Es usado principalmente para el diagnóstico de enfermedades micóticas, especialmente aquellas que afectan la piel y sus anexos (pelo y uñas). Las muestras pueden ser secreciones, exudados, piel, pelos, uñas, esputo, LCR u orina. Los patógenos comúnmente aislados son dermatofitos, hongos causantes de micosis subcutáneas y sistémicas. El agar sulfito de bismuto es un medio de cultivo sólido, selectivo y diferencial, especialmente formulado para el aislamiento de Salmonella enterica subgrupo enterica serotipo Typhi, entre otras especies de Salmonella. Al medio se le conoce como agar BSA por sus siglas en inglés Bismuth Sulfite Agar. La fórmula original del agar sulfito de bismuto fue creada en 1927 por Wilson y Blair (Glucose Bismuth Sulphite Iron Medium); este contenía sulfito de sodio, glucosa, solución de bismuto, citrato de amonio, sulfato ferroso y agar-agar. Crecimiento de 48 horas de incubación de Salmonella sp en agar sulfito de bismuto. Fuente: Pixnio.com Autor: Dr. W. R. Erving, USCDCP Hoy en día se cuenta con una modificación del medio original, compuesto por extracto de carne, peptonas de carne y de caseína, indicador sulfito de bismuto, glucosa, fosfato disódico, sulfato ferroso, verde brillante y agar-agar. Existen muchos medios para el aislamiento de especies de Salmonella, pero cuando se trata de recuperar el serotipo Typhi, el agar sulfito de bismuto presenta una notable ventaja frente a ellos, ya que en la mayoría se obtiene una muy baja o nula recuperación de este microorganismo. Sin embargo, es necesario usar más de un tipo de medio cuando se trata de aislar enteropatógenos, debido a que el agar sulfito de bismuto resulta menos eficaz para otras especies de Salmonella y para el género Shigella, los cuales son inhibidos o se desarrollan muy pobremente en este agar. Cabe destacar, que de todas las especies de Salmonella, el serotipo Typhi es uno de los enteropatógenos más importantes en el humano, siendo este su único reservorio. Esta serovariedad produce fiebre tifoidea, gastroenteritis, bacteriemia y septicemia. Por este motivo es relevante incluir este agar cuando se analicen muestras de agua, heces o alimentos en donde se sospeche su presencia. Fundamento Como la mayoría de los medios de cultivo, el agar sulfito de bismuto contiene sustancias nutritivas para promover el desarrollo bacteriano, tales como las peptonas y el extracto de carne. Así mismo, la glucosa funciona como una fuente de energía y carbono. Ahora bien, no todas las bacterias crecerán en este medio, ya que el agar sulfito de bismuto es un medio selectivo. Este contiene compuestos que inhiben el crecimiento de los microorganismos Gram positivos y de ciertas bacterias Gram negativas. Estos compuestos son: el indicador sulfito de bismuto y el verde brillante. Por su parte, el fosfato disódico mantiene la osmolaridad y el pH del medio. Adicionalmente, el agar sulfito de bismuto es un medio diferencial gracias a la presencia del sulfato ferroso, que evidencia la formación de H2S. El H2S formado por las bacterias reacciona con el sulfato ferroso y forma un precipitado negro insoluble claramente visible. Finalmente, el agar-agar proporciona la consistencia sólida al medio. Preparación Pesar 52,3 gr del medio deshidratado y disolver en un litro de agua. Calentar hasta hervir la mezcla durante 1 minuto con agitación frecuente, hasta su disolución total. No sobrecalentar demasiado. Este medio no se esteriliza en autoclave, debido a que el calor extremo daña el medio de cultivo. Dejar enfriar a 45°C y agitar antes de servir en las placas de Petri estériles. Se recomienda realizar placas con buen grosor. Para ello se debe verter 25 ml en cada placa. Dejar solidificar. Como es un medio que no se esteriliza es normal que se sugiera su uso inmediato. Sin embargo, un estudio realizado por D’aoust en 1977, demostró que existe una mejor recuperación de Salmonella typhimurium y Salmonella enteritidis a medida que el medio agar sulfito de bismuto se envejece, no afectándose el rendimiento para las serovariedades Typhi y Paratyphi B. D’aoust recomienda usar las placas al día 4 de refrigeración, aunque advierte que a medida que envejece el medio disminuye la selectividad, desarrollándose con mayor facilidad cepas de Proteus vulgaris. Es por ello que, para muestras muy contaminadas, como las heces, es preferible usar el medio recién preparado. En caso contrario usar al día 4 de su preparación. Otros autores recomiendan usar las placas al día siguiente de su preparación, almacenadas en refrigeración. Las placas refrigeradas se deben atemperar antes de usar. El pH del medio debe quedar en 7,5 ± 0,2. El color del medio sin preparar es beige y preparado es opalescente gris verdoso. Usos Entre las muestras que pueden sembrarse en este medio están muestras de heces, aguas de consumo o residuales y alimentos. Para mejorar los aislamientos se recomienda realizar un tratamiento de pre-enriquecimiento con caldo lactosado y luego de enriquecimiento con caldo tetrationato o caldo selenito cistina, antes de sembrar en el agar sulfito de bismuto. Las placas se incuban a 35°C ± 0,2 por 24 a 48 horas, en aerobiosis. Características de las colonias en el agar sulfito de bismuto Las colonias de Salmonella Typhi suelen verse en este agar en 24 horas con un centro negro y rodeadas de un halo verde brillante. Mientras que, en 48 horas se tornan negras completamente debido a la formación de sulfuro de hidrógeno. Salmonella Paratyphi A presenta colonias con características variables. Después de 18 horas de incubación pueden observarse colonias negras, verdes o transparentes, con aspecto mucoide. En tanto que, a 48 horas se observan completamente negras y algunas veces con un brillo metálico pronunciado. S. Paratyphi A tiende a ennegrecer el medio alrededor de la colonia. Salmonella sp muestrancolonias negras o gris verdosas, con o sin brillo metálico, pudiendo ennegrecer el medio circundante o no. Las cepas de coliformes, por lo general, son inhibidas totalmente, pero si logran crecer se desarrollan como colonias de color verde o marrón opacas y sin brillo metálico. No tiñen el medio alrededor de la colonia. Limitación -Los inóculos muy débiles pueden originar colonias de Salmonella Typhi de color verde claro, pasando desapercibida y reportándose el cultivo como negativo. – El agar sulfito de bismuto puede inhibir la recuperación de algunas especies de Salmonella como S. sendai, S. berta, S. gallinarum, S. abortus-equi. -Este medio inhibe a la mayoría de las especies del género Shigella. – S. Typhi y S. arizonae pueden dar colonias muy similares. -Los coliformes que producen H2S tales como Proteus y Citrobacter producen colonias similares a las de Salmonella, por lo que es necesario realizar pruebas bioquímicas de identificación. -Debe realizarse un buen estriamiento para obtener colonias aisladas; es la única manera de poder observar las características típicas de las colonias del género Salmonella. Control de calidad Para el control de esterilidad se incuba una placa sin inocular a 37 °C, se espera que no haya crecimiento, ni cambio de color. Para el control de calidad se pueden sembrar cepas conocidas tales como: Escherichia coli ATCC 25922, Salmonella enteritidis ATCC 13076, Salmonella Typhi ATCC 19430, Shigella flexneri ATCC 12022, Enterococcus faecalis ATCC 29212. Se espera que Escherichia coli y Shigella flexneri sean inhibidas parcialmente desarrollando colonias de color marrón verdosa y marrón respectivamente. En tanto que, ambas salmonellas deben tener un excelente desarrollo con colonias negras con brillo metálico, y finalmente Enterococcus faecalis debe ser inhibido totalmente. El agar Vogel-Johnson es un medio de cultivo sólido, selectivo y diferencial, especialmente formulado para el aislamiento de Staphylococcus aureus. Este medio fue creado por Vogel y Johnson en 1960 a partir de la modificación del agar telurito glicina formulado en 1955 por Zebovitz, Evans y Niven. La modificación consistió en aumentar la concentración de manitol presente en el medio y en la incorporación de un indicador de pH. La fórmula actual está compuesta por tripteína, extracto de levadura, manitol, fosfato dipotásico, cloruro de litio, glicina, rojo de fenol, agar, solución de telurito de potasio al 1% y agua. Fuente: Pixinio.com/Laboratorio de la Clínica ProcreaTec. Flickr. Cabe destacar que existen otros medios que al igual que el agar Vogel-Johnson son selectivos para el aislamiento de S. aureus, tales como el agar manitol salado y el agar Baird Parker. En este sentido, se podría decir que el fundamento del agar Vogel – Johnson es una mezcla entre el agar manitol salado y el agar Baird Parker. En el primero las colonias de S. aureus se distinguen por fermentar el manitol y hacer virar el indicador de pH a amarillo. Por otra parte, en el segundo el S. aureus se caracteriza por reducir el telurito a teluro y formar colonias grises a negras. Ambas propiedades son observadas en el agar Vogel-Johnson. Este medio, al igual que sus homólogos, es útil para la detección de Staphylococcus aureus en muestras de alimento, controles sanitarios de productos industriales y en muestras clínicas. Fundamento Aporte de nutrientes El medio Vogel – Johnson contiene tripteína y extracto de levadura; ambas sustancias proporcionan aminoácidos de cadena larga que sirven como fuentes de carbono y de nitrógeno necesarios para el crecimiento bacteriano. Las bacterias capaces de crecer en este medio tomaran los nutrientes de estas sustancias. Poder selectivo El agar Vogel – Johnson es capaz de inhibir el crecimiento de bacterias Gram negativas e incluso algunas Gram positivas, favoreciendo el desarrollo de los estafilococos coagulasa positivos. Las sustancias inhibidoras son el telurito de potasio, el cloruro de litio y la glicina. Poder diferencial Las sustancias que hacen a este medio diferencial son el manitol y el telurito de potasio. El manitol es un carbohidrato, y cuando es fermentado se producen ácidos que hacen virar el medio de rojo a amarillo, lo cual sucede gracias a la presencia del indicador de pH rojo de fenol. En tanto que, el telurito incoloro cuando es reducido a teluro libre metálico, toma un color gris oscuro a negro. El Staphylococcus aureus fermenta el manitol y reduce el telurito a teluro. Por eso las colonias típicas de S. aureus en este medio son grises o negras rodeadas de un medio color amarillo. Las bacterias que crecen en este medio y no reducen el telurito ni fermentan el manitol, formarán colonias transparentes rodeadas de un medio color rojo, incluso más intenso que el color original, debido a la alcalinización del medio por la utilización de las peptonas. Por otra parte, las bacterias que reduzcan el telurito pero no fermenten el manitol crecerán como colonias grises o negras rodeadas de un medio color rojo intenso. Si el medio se preparara sin la adición del telurito de potasio, las colonias de S. aureus se desarrollarían como colonias amarillas, rodeadas de un medio amarillo, tal como sucede en el agar manitol salado. Balance osmótico y agente solidificante El fosfato dipotásico mantiene el balance osmótico del medio y ajusta el pH a la neutralidad 7,2. Mientras que el agar le brinda la consistencia sólida al medio de cultivo. Preparación Solución de telurito de potasio al 1% p/v Esta solución no viene incluida en el medio deshidratado, debido a que no puede ser esterilizada en autoclave. Por esta razón se prepara aparte y se agrega al medio ya esterilizado. Algunas casas comerciales venden la solución de telurito de potasio al 1% lista para usar. Si se desea preparar en el laboratorio se procede de la siguiente manera: Pesar 1.0 gr de telurito de potasio y medir 100 ml de agua destilada. Disuelver el telurito de potasio en una parte de agua y posteriormente completar la cantidad de agua hasta llegar a 100 ml. Esterilizar la solución por el método de filtración. Medio base de agar Vogel-Johnson Pesar 60 gr del medio deshidratado, y disolver en 1 litro de agua destilada. Se calienta la mezcla hasta ebullición para ayudar a la disolución completa. Durante el proceso de disolución se agita el medio frecuentemente. Esterilizar en autoclave a 15 libras de presión y 121°C por 15 minutos. Sacar del autoclave y dejar reposar hasta que el medio alcance una temperatura aproximada de 45 a 50°C. Adicionar 20 ml de la solución de telurito de potasio previamente preparada al 1%. Mezcle y vierta en placas de Petri estériles. Deje solidificar y ordene de forma invertida en plaqueros para guardar posteriormente en nevera hasta su uso. El pH final del medio preparado debe quedar en 7,2 ± 0,2. Antes de sembrar una muestra se debe esperar a que la placa tome la temperatura del ambiente. El color del medio preparado es rojo. Uso Aunque puede ser utilizado para el aislamiento de S. aureus en cualquier tipo de muestras, es mayormente usado para el análisis microbiológico de productos farmacéuticos, cosméticos y alimentos. Se recomienda que el inóculo sea denso. El sembrado puede realizarse por estriamiento con asa de platino o por superficie con espátula de Drigalski. Las placas se incuban a 35-37°C durante 24 a 48 horas en aerobiosis. Control de calidad Para realizar el control de calidad al medio Vogel- Johnson se pueden usar las siguientes cepas controles: Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 o Proteus mirabilis ATCC 43071. El resultado esperado es el siguiente: para las cepas de S. aureus crecimiento satisfactorio con colonias negras rodeadas de medio amarillo. Para S. epidermidis crecimiento regular con colonias traslúcidas o negras rodeadas de medio color rojo. Así mismo, para E. coli se espera que haya inhibición total, y para Proteus mirabilis inhibición parcial o total; si crece lo hará escasamente y las colonias serán negras rodeadas de medio color rojo.