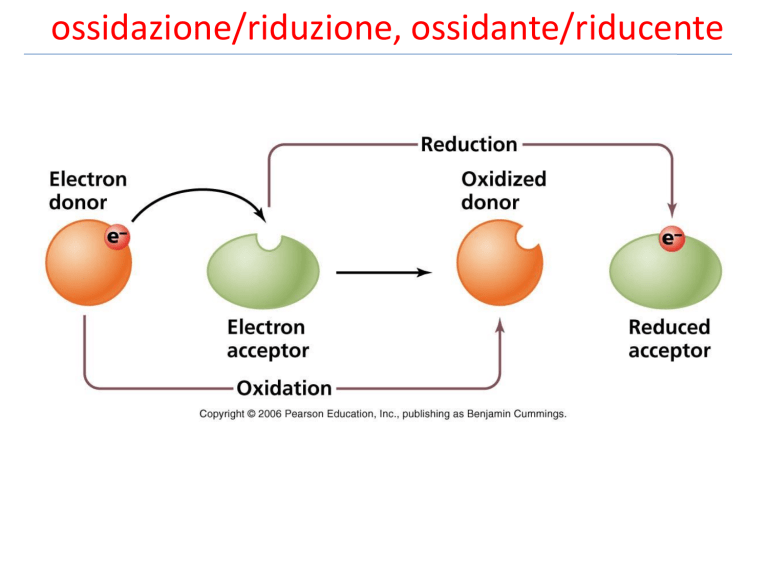
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +5 0 Cu(s) + HNO3(aq) +4 +2 Cu(NO3)2 + NO2(g) + H2O(l) Cu(s) + 2HNO3(aq) Cu(NO3)2 + 2NO2(g) + H2O(l) Bilanciamento degli elettroni in base ai numeri di ossidazione Cu(s) + 4HNO3(aq) Cu(NO3)2 + 2NO2(g) + 2H2O(l) Bilanciamento delle altre specie e verifica finale Cu(s) + 4H+ +2NO3-(aq) Cu2+ + 2NO2(g) + 2H2O(l) Determinazione dei numeri di ossidazione Identificazione degli ioni spettatori e reazione ionica netta Esercizio tipo: bilanciamento redox +6 -1 K2Cr2O7(aq) + HI(aq) K2Cr2O7(aq) + 6HI(aq) K2Cr2O7(aq) + 6HI(aq) K2Cr2O7(aq) + 14HI(aq) Cr2O7(aq)= + 14H+(aq) + 6I- -1 +3 -1 0 KI(aq) + CrI3(aq) + I2(s) + H2O(l) KI(aq) + 2CrI3(aq) + 3I2(s) + H2O(l) 2KI(aq) + 2CrI3(aq) + 3I2(s) + 7H2O(l) 2KI(aq) + 2CrI3(aq) + 3I2(s) + 7H2O(l) 2Cr3+(aq) + 3I2(s) + 7H2O(l) Esercizio tipo: titolazione redox Per misurare la concentrazione di Ca+2 nel sangue, 1,00 ml di sangue sono trattati con una soluzione di ossalato di sodio (Na2C2O4). Il precipitato formato di ossalato di calcio (CaC2O4 ) è disciolto in una soluzione acquosa acida per acido solforico diluita. La soluzione ottenuta è stata titolata con una soluzione acquosa 4.88 10-4 M di KMnO4. Si raggiunge il punto di equivalenza per aggiunta di 2.05 ml di soluzione di KMnO4. La equazione chimica (da bilanciare ) è: KMnO4(aq) + CaC2O4 (s) + H2SO4(aq) MnSO4(aq) + K2SO4(aq) + CaSO4(s) + CO2(g) + H2O(l) (a) calcolare le moli di Ca2+ (b) concentrazione ione Ca2+ espressa in mg Ca+2 per 100 ml di sangue. Soluzione-parte 1 +7 +3 KMnO4(aq) + CaC2O4 (s) + H2SO4(aq) +2 +4 MnSO4(aq) + K2SO4(aq) + CaSO4(s) + CO2(g) + H2O(l) KMnO4(aq) + 5/2CaC2O4 (s) + H2SO4(aq) 2KMnO4(aq) + 5CaC2O4 (s) + H2SO4(aq) 2KMnO4(aq) + 5CaC2O4 (s) + 8H2SO4(aq) MnSO4(aq) + K2SO4(aq) + CaSO4(s) + 5CO2(g) + H20(l) 2MnSO4(aq) + K2SO4(aq) + CaSO4(s) + 10CO2(g) + H20(l) 2MnSO4(aq) + K2SO4(aq) + 5CaSO4(s) + 10CO2(g) + 8H20(l) 2K+(aq) + 2MnO4-(aq) + 5Ca2+ (aq) + 5C2O4= (aq) + 16H+(aq) + 8SO4=(aq) 2Mn2+ (aq) + 8SO4= (aq) + 2K+ (aq) + 5Ca2+ + 10CO2(g) + 8H20(l) 2MnO4-(aq) + 5C2O4 =(aq) + 16H+(aq) 2Mn2+ (aq)+ 10CO2(g) + 8H20(l) Titolazione redox Soluzione-parte 2 le moli di agente ossidante (i.e. MnO4-) (punto equivalenza) n=1.0 10-6 moli • calcolare • ricavare moli di ione ossalato (C2O4=) (equivalenza stechiometrica) n=2.5 10-6 moli • ricavare moli Ca2+ n=2.5 10-6 moli • ricavare massa (mg) di Ca2+ (40.08 g/mole) in 1.00 ml di sangue 100.2 10-3 mg • ricavare massa (mg) di Ca2+ in 100 ml di sangue 10.0 mg Esercizio tipo: titolazione redox Un campione di 2.50 ml di latte a basso tenore di grassi è stato trattato con ossalato di sodio ed il precipitato di ossalato di calcio filtrato e disciolto in H2SO4. Il punto di equivalenza ha richiesto 6.53 ml di soluzione 4.56 10-3M di KMnO4. (a) Calcolare la molarità di Ca2+ nel latte. (b) concentrazione di Ca2+ in g/l. Il valore ottenuto è compatibile con il valore tipico pari a 1.2 g Ca2+ per litro ? 2MnO4-(aq) + 5C2O4 = + 16H+(aq) 2Mn2+ + 10CO2(g) + 8H20(l) Soluzione-parte 2 le moli di agente ossidante (i.e. MnO4-) (punto equivalenza) n=30 10-6 moli • calcolare • ricavare moli di ione ossalato (C2O4=) (equivalenza stechiometrica) n=7.44 10-5 moli • ricavare moli Ca2+ n=7.44 10-5 moli • ricavare molarità di Ca2+ 2.98 10-2 M • ricavare concentrazione di Ca2+ (40.0g g/mol) in g/litro 1.19 g/l Reazioni di ossido-riduzione di sostanze elementari • Reazioni di combinazione Due o più reagenti formano un solo prodotto: X+Y→Z • Reazioni di decomposizione Un solo reagente forma due o più prodotti: Z→X+Y • Reazioni di scambio (o spostamento) Doppio scambio: AB + CD → AC + BD Scambio semplice: X + YZ → XZ + Y • Combustione reazione di combinazione con O2 Reazioni di combinazione di elementi Reazioni di combinazione di elementi metallo + non metallo composto ionico • Esempio: ossidazione di metalli per formare ossidi 4Al(s) + 3O2 (g) non metallo + non metallo 2Al2O3(s) composto covalente • Esempio: ammoniaca da idrogeno e azoto (scala industriale) N2(g) + 3H2(g) 2NH3(g) • Esempio: tricloruro di fosforo da fosforo e cloro (reagente produzione di pesticidi) P4(s) + 6Cl2(g) 4PCl3(l) • Esempio: monossido di azoto da azoto ed ossigeno N2(g) + O2(g) 2NO(g) Reazioni di decomposizione di composti Reazioni di decomposizione di composti Esempio: produzione di metalli attivi da alogenuri fusi (elettrolisi) MgCl2(l) Mg(s) + Cl2 Esempio: decomposizione termica del clorato di potassio +5 -2 -1 0 2KClO3 (s) 2KCl (s) + 3O2 (g) Esempio: decomposizione termica del carbonato di calcio ?????? +4 -2 CaCO3(s) -2 +4 -2 CaO(s) + CO2 Reazione di spostamento (metallo in acqua) Reazione di spostamento (metallo in acido) Agente riducente 0 Agente ossidante +1 +2 0 Me (s) + 2H+ (aq) → Me2+ (aq) + H2 (g) Reattività dei metalli in soluzione acquosa acida Ferro (Fe) Zinco (Zn) Me(s) + 2HCl(aq) Magnesio (Mg) H2 (g) + MeCl2(aq) Reattività dei metalli: “capacità di spostare H2 Reazioni di spostamento tra metalli Reazione di spostamento: rame e nitrato di argento Reazione di combustione La combustione è il processo di combinazione con l’ossigeno, spesso avviene con rilascio di calore e luce. Tutte le reazione di combustione sono reazioni redox, in cui ossigeno elementare è l’agente ossidante. La combustione dei combustibili (benzina, gas naturale, carbone…) in genere porta alla formazione di diossido di carbonio e acqua. Esempio:combustione del butano 2C4H10(g) + 13O2(g) 10H2O(g) + 8CO2(g) Esercizi di riepilogo 4.1 Quante moli totali di ioni vengono rilasciate quando ciascuno dei seguenti campioni si discioglie completamente in acqua? (a) 0,83 mol di K3PO4 (R: 3.3 moli) (b) 8,11 · 10-3 g di NiBr2·3H2O (R: 8.93 10-5 moli) (c) 1,23 · 1021 unità formula di FeCl3 (R: 8.17 10-3 moli) 4.2 Quante moli e quanti ioni di ciascuna specie sono presenti nelle seguenti soluzioni acquose? (a) 100 mL di cloruro di alluminio 2,45 M (R:Al+3 0.245 moli, Cl- 0.735 moli) (b) 1,80 L di una soluzione contenente 2,59 g di solfato di litio al litro (R:Li+ 0.0848 moli, SO4-2 0.0424moli) 4.3 Quante moli di ioni H+ sono presenti nelle seguenti soluzioni acquose? (a) 1,40 L di acido perclorico 0,25 M (R: 0.35 mol) (b) 1,8 mL di acido nitrico 0,72 M (R: 1.3 10-3 mol) (c) 7,6 L di acido cloridrico 0,056 M (R: 0.43 mol) 4.5 Se 25,98 mL di una soluzione standard di KOH 0,1180 M reagisce con 52,50 mL di soluzione di CH3COOH, qual è la molarità della soluzione di acido? (R: 0.0583 M) 4.6 Identificate l’agente ossidante e l’agente riducente nelle seguenti reazioni: R: (a) Ione permangato (MnO4-) agente ossidante, acido ossalico (H2C2O4) agente riducente (b) Rame metallico (Cu) agente riducente, ione nitrato (NO3-) agente ossidante 4.7 Il bicromato di potassio (K2Cr2O7) ossida l'acido solfidrico (H2S) a zolfo elementare (S) in ambiente acido secondo la seguente reazione: K2Cr2O7 + H2S + HCl CrCl3 + KCl + S + H2O Dopo aver bilanciato, calcolare (a) quanti grammi di bicromato sono necessari ad ossidare 15 g di acido solfidrico e (b) quanto cloruro cromico (CrCl3) si forma. (R: (a) 43.2 g, (b) 46.5 g) ) Soluzione esercizio 4.7 +6 -2 K2Cr2O7 + H2S + HCl 0 +3 CrCl3 + KCl + S + H2O K2Cr2O7 + 3H2S + HCl 2CrCl3 + KCl + 3S + H2O K2Cr2O7 + 3H2S + 8HCl Cr2O7= + 3H2S + 8H+ 2CrCl3 + 2KCl + 3S + 7H2O 2Cr3+ + 3S + 7H2O nH2S = 15/34.08 = 0.44 moli nK2Cr2O7 = 0.44/3 = 0.15 moli, nCrCl3 = 0.44 x 2/3 = 0.29 moli, gK2Cr2O7 = 0.15 x 294.18 = 43.2 g gCrCl3 = 0.29 X 158.35 = 46.5 g 4.13 Usate il metodo dei numeri di ossidazione per bilanciare le seguenti equazioni introducendo i coefficienti negli spazi bianchi. Identificate l’agente riducente e l’agente ossidante in ciascuna reazione: 4.12 L’acido nitrico, un acido importante nell’industria e in laboratorio, viene prodotto industrialmente mediante il processo Ostwald in più stadi, che comincia con l’ossidazione dell’ammoniaca: (a) Quali sono l’agente ossidante e l’agente riducente in ciascuna tappa? (R: 1° O2 agente ossidante, NH3 agente riducente; 2° O2 agente ossidante, NO agente riducente; 3° NO2 agente riducente ed agente ossidante, “disproporzione”) (b) Se si suppone che ciascuna tappa abbia una resa del 100%, quanto vale la massa (in kilogrammi) di ammoniaca che si deve impiegare per produrre 3,0 · 104 kg di HNO3? (R:1.2 10-4 kg) nHNO3 = 3.0 104/63.01 = 476.11 kmoli nNO2 = 3/2 nHNO3, nNO = nNO2, nNH3 = nNO gNH3 = 714.16 x 17.03 = 1.2 104 kg nNH3 = 3/2 nHNO3 = 3/2 476.11 = 714.16 kmoli 4.15 Si determina la quantità di acido ascorbico (vitamina C; C6H8O6) nelle compresse mediante la reazione con bromo, seguita dalla titolazione dell’acido bromidrico con base standard: Una compressa è stata disciolta in acqua ed è stata fatta reagire con Br2. Poi la soluzione è stata titolata con 43,20 mL di NaOH 0,1350 M. Quanta vitamina C contiene la compressa ? (R: 513.6 mg) *40,5 g di alluminio vengono introdotti in una soluzione che contiene 146 g di HCl. Calcolare quante moli di idrogeno si formano. Calcolare inoltre quale dei due reagenti è presente in eccesso e quante moli rimangono senza aver reagito alla fine della reazione. (R: Al 0.17 moli, H2 2 moli)