Informe de Laboratorio de Equilibrio Líquido-Vapor: Análisis de Presión de Vapor
Anuncio

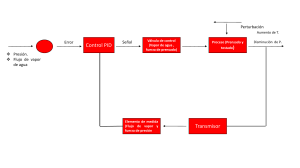
Instituto Politécnico Nacional Escuela Superior de Ingeniería Química e Industrias Extractivas Departamento de Ingeniería Química Petrolera Laboratorio de Termodinámica del Equilibrio de Fases. Practica No. 2 “Equilibrio líquido-vapor de una sustancia pura (presión de vapor)” Grupo: 2PM32 Equipo: Sección: II Integrantes: Silverio Guzmán Juan Eduardo. Sánchez Andrade Manuel Emiliano. Sánchez Mendoza Amparo Karina. Sosa Flores Luis Alberto Profesor Dr. Octavio Elizalde Solís Profesora María Mateos Hernández Fecha De Experimentación: 13/11/2020 Fecha De Entrega: 26/11/2020 ÍNDICE Objetivos …………………………………………………………………………………..3 Introducción ……………………………………………………………………………….4 Sección experimental …………………………………………………………………….9 Procedimiento experimental ……………………………………………………………9 Diagrama de bloques del proceso experimental …………………………………...10 Tabla de resultados experimentales ……………………………………………….11 Tabla de resultados bibliográficos ………………………………………………….11 Tabla de resultados 1 ………………………………………………………………..16 Gráfica presión de vapor (referencia) ……………………………………………16 Gráfica presión de vapor (experimental) ……………………………………...…17 Tabla de errores ……………………………………………………………………...18 Tabla de resultados 2 ………………………………………………………………..19 Gráfica de %error-T ………………………………………………………………..19 Grafica (ln Pvap)-(1/T) …………………………………………………………….20 Diagrama de fase del heptano ……………………………………………………….21 Cuestionario ……………………………………………………………………………..22 Observaciones y recomendaciones ……………………………..……………………23 Conclusiones …………………………………………………………………………….24 Referencias ……………………………………………………………………………………………..28 Objetivos Obtener experimentalmente la presión de vapor de un líquido a diferentes temperaturas. Analizar el equilibrio liquido-vapor para una sustancia pura. Determinar el calor de vaporización de la sustancia utilizada a partir de la ecuación de Clapeyron. Comparar las presiones de vapor y el calor latente de vaporización experimentales con respecto a valores teóricos. Introducción Para la realización de esta práctica es necesario tener conocimiento de conceptos que destacan en el procedimiento. Presión de Vapor: También llamada presión de saturación se define como la presión correspondiente a cada temperatura en donde ambas fases, líquida y sólida, están en equilibrio y no depende de la cantidad de líquido y vapor que hay en el sistema. [1] Figura 2.1 Presión de vapor Equilibrio térmico: Se considera equilibrio termodinámico cuando hay un equilibrio mecánico en el sistema, también si todos los componentes del sistema se encuentran a la misma temperatura y no se está produciendo ninguna reacción química. [2] Cuando se calienta una sustancia, crece su energía cinética media de sus moléculas, y las que tienen la energía mayor y que se encuentran en la superficie de la sustancia, escaparán y formarán la fase de vapor. Cuando contenemos esta sustancia en un sistema cerrado, algunas moléculas de vapor van a chocar con la superficie de la sustancia y se agregarán a la fase líquida. Cuando las moléculas que salen son igual en cantidad a las moléculas que permanecen, se observa un equilibrio dinámico. La presión de vapor no depende del volumen, solo de la temperatura la cual es una temperatura fija y también es importante decir que la presión se considera independiente de la cantidad de líquido y de vapor que están presentes en el sistema. [3] Los siguientes conceptos investigados son para una sustancia pura: Equilibrio térmico: se presenta cuando todos los componentes de la sustancia alcanzan la misma temperatura. [4] Figura 2.2 Equilibrio térmico Equilibrio mecánico: se presenta cuando la suma de las fuerzas del sistema estudiado es nula, es decir, cero. Equilibrio químico: es un proceso el cuál se considera reversible donde no se presentan cambios con respecto al tiempo a pesar de que los componentes de una sustancia están reaccionando entre sí. [5] Equilibrio homogéneo: se presenta cuando todos los componentes de la sustancia se encuentran en la misma fase. Equilibrio heterogéneo: se presenta cuando no todos los componentes de la sustancia se encuentran en la misma fase. Equilibrio termodinámico: se presenta el equilibrio termodinámico en un sistema cuando el sistema presenta equilibrio mecánico, térmico y químico. [6] ¿Cómo es la relación presión con respecto a la temperatura? Gracias a la ley de Gay-Lussac sabemos que cuando se presenta un volumen constante, es decir, cuando nuestra sustancia se encuentra en un sistema cerrado, en la relación entre la temperatura y la presión de un gas se pueden realizar las siguientes interpretaciones: La temperatura aumenta si aumenta la presión y la temperatura disminuye si disminuimos la presión. Esto ocurre debido que el aumento de la temperatura hace que las moléculas del gas se muevan mas rápidamente, es decir, aumenta su energía cinética causando más choques contra las paredes por lo que la presión aumenta. 𝑃 𝑇 =𝑘 Ec. 2.1 (la división de la presión entre la temperatura es una constante). [7] Diagramas de fase de una sustancia pura (agua) En el siguiente diagrama las regiones de las dos fases aparecen como áreas. Figura 2.3 Diagrama de fase del agua Grados de libertad para una sustancia pura en diferentes fases Los grados de libertad se definen como el numero de variables intensivas independientes que son necesarias para hacer la especificación de un estado intensivo, es decir, la especificación del estado termodinámico. [8] Regla de las fases La siguiente ecuación se utiliza cuando el sistema no lleva a cabo ninguna reacción: F = C-P + 2 Donde: F = los grados de libertad C = el número de especies químicas P = el número de fases 2 variables intensivas Figura 2.4 Punto de ebullición Conceptos generales Punto de ebullición: Cuando una sustancia alcanza una cierta temperatura en la cual la presión de vapor es suficientemente grande para que se logren formar burbujas en el cuerpo del líquido. Cuando la sustancia comienza a hervir la temperatura se mantiene constante hasta que toda la sustancia haya pasado a la fase gaseosa. Figura 2.5 Punto de fusión Punto de fusión: el punto crítico es la temperatura a la que la sustancia debe llegar para poder cambiar de fase sólida a fase líquida, a una presión constante de 1 atm, es importante destacar que para las sustancias puras el proceso de fusión se manifiesta cuando ésta está a una temperatura constante. Figura 2.5 Punto triple Punto triple: Es más común que dos fases estén en equilibrio a que se encuentren tres fases en equilibrio, pero en algunas condiciones estas fases de cierta sustancia pura coexisten en equilibrio. Se pueden observar los diagramas P-v o P-T, a la línea que forma este punto se le conoce como línea triple. La línea triple que se forma por el equilibrio de los tres estados se representa como un punto sobre los diagramas P-T y por eso es por lo que se le conoce con el nombre de punto triple. Punto crítico: se conoce como el límite en donde el volumen de un líquido es igual a la masa contenida en el sistema y también igual al vapor que contiene el sistema. Otra manera de interpretarlo es por medio de densidades, ya que en este punto las densidades del líquido y vapor contenidos en el sistema son iguales. [9] Ec. 2.2 Ecuación de Clausius-Clapeyron Esta ecuación se utiliza para determinar las variaciones de la presión de vapor de un sistema con respecto a la temperatura. Por otro lado, también se puede utilizar para la región sólido-vapor si la utilizamos de tal manera que sustituyamos la entalpía de sublimación de la sustancia que estemos estudiando en el sistema. La curva que va a dividir estos estados en coexistencia se le conoce como curva de coexistencia. [10] Donde: Ec. 2.3 es la pendiente de dicha curva ΔH es el calor latente o entalpía del cambio de fase ΔV es el volumen. Sección Experimental Materiales y reactivos Vaso de precipitados Embudo Matraz de bola de 250 a 500 mL Tubo refrigerante Parrilla eléctrica Termómetro de mercurio Manómetro digital Agua Etanol Propanol Barómetro Bomba de Vacío Mangueras Pinzas Tapón de hule horadado Trampa de vapor Conectores “T” y “L” de vidrio Hexano Heptano Procedimiento experimental 1. Agregar aproximadamente 100mL del reactivo a utilizar en un vaso de precipitados. 2. Verter el reactivo en el matraz de bola con la ayuda de un embudo 3. Preparar el equipo de equilibrio líquido-vapor (matraz, tubo refrigerante, conectores, manguera, trampa de vacío). 4. Conectar el termómetro de mercurio y el manómetro digital en el matraz de bola. 5. Conectar al equipo la bomba de vacío. 6. Iniciar el calentamiento de la sustancia. 7. Se enciende la bomba de vacío y se genera el máximo vacío. 8. Una vez alcanzado el punto de ebullición, registrar la temperatura, presión manométrica y presión barométrica. 9. Disminuir el vacío con la ayuda de una válvula, en este momento la ebullición desaparece debido al cambio de presión. 10. Repetir los pasos 8 y 9 para otras 9 lecturas hasta alcanzar la presión atmosférica. 11. Apagar la bomba de vacío. 12. Desmontar el equipo y lavar el material. Diagrama de bloques del proceso experimental Agregar aproximadamente 100mL del reactivo a utilizar en un vaso de precipitados. 1.Verter el reactivo en el matraz de bola con la ayuda de un embudo 1.Preparar el equipo de equilibrio líquido-vapor (matraz, tubo refrigerante, conectores, manguera, trampa de vacío). 1.Iniciar el calentamiento de la sustancia. 1.Conectar al equipo la bomba de vacío. 1.Conectar el termómetro de mercurio y el manómetro digital en el matraz de bola. 1.Se enciende la bomba de vacío y se genera el máximo vacío. 1.Una vez alcanzado el punto de ebullición, registrar la temperatura, presión manométrica y presión barométrica. 1.Disminuir el vacío con la ayuda de una válvula, en este momento la ebullición desaparece debido al cambio de presión. 1.Desmontar el equipo y lavar el material. 1.Apagar la bomba de vacío. 1.Repetir los pasos 8 y 9 para otras 9 lecturas hasta alcanzar la presión atmosférica. Tabla de datos experimentales Evento C K Manométrica Presión absoluta 1 62 335.15 -428 157 2 72 345.15 -344 241 3 74 347.15 -322 263 4 78 351.15 -275 310 5 80 353.15 -240 345 6 82 355.15 -215 370 7 84 357.15 -179 406 8 89 362.15 -107 478 9 90 363.15 -82 503 10 92 365.15 -40 545 11 94 367.15 -2 583 Tabla de datos bibliográficos Obtener la presión de vapor reportado en tablas, ecuaciones o correlaciones a partir de la temperatura experimental. Reportar la entalpia de vaporización bibliográfica de la sustancia utilizada, así como las condiciones (temperatura y presión) del punto triple y punto crítico. Evento 1 2 3 4 5 6 7 8 9 10 11 𝑻[℃] 62 72 74 78 80 82 84 89 90 92 94 𝑷𝒗𝒂𝒑 [𝒎𝒎𝑯𝒈] 226.78112 325.838854 349.2881765 400.2373609 427.8453972 456.9496544 487.6069148 571.4265799 589.4802967 626.938314 666.2488229 Tabla de resultados 1 Evento 1 Con los datos proporcionados obtenemos la presión absoluta el cual es la suma de la presión manométrica con la presión del barómetro teniendo así la ecuación: 𝑃𝑎𝑏𝑠 = 𝑃𝑚𝑎𝑛 + 𝑃𝑏𝑎𝑟𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑎 Obteniendo la presión absoluta. Los valores de presión de vapor se obtuvieron mediante la ecuación de Warner 𝑎𝜏 + 𝑏𝜏 1.5 + 𝑐𝜏 2.5 + 𝑑𝜏 5 𝐿𝑛(𝑃𝑣𝑎𝑝 ) = 𝑇𝑟 Teniendo así a, b, c, d como constantes que se encontraron de manera bibliográfica. Pbar [mmHg] 585 a b c d Tc [K] Pc [bar] -7.77404 1.85614 -2.8298 -3.507 540.15 27.35 𝑇 Para sacar 𝑇𝑟 se utiliza la ecuación 𝑇𝑟 = 𝑇 , en donde Tc es 540.15 K y la T es cada 𝑐 temperatura en de cada evento proporcionado. Y para sacar τ tenemos la expresión:𝜏 = 1 − 𝑇𝑟 donde 𝑇𝑟 es el valor calculado de cada evento y así sustituyendo valores tenemos que para el evento 1 es igual: 𝐿𝑛(𝑃𝑣𝑎𝑝 ) −7.77404(0.37952421) + 1.85614(0.37952421)1.5 + −2.8298(0.37952421)2.5 + (−3.507)(0.37952421)5 = 0.62047579 𝐿𝑛(𝑃𝑣𝑎𝑝 ) = −4.5048894 𝑏𝑎𝑟 Pero para solo obtener la 𝑃𝑣𝑎𝑝 ese resultado se eleva a la Euler para que se cancele el Euler con el logaritmo natural y obtener el valor de la 𝑃𝑣𝑎𝑝 : 𝑃𝑣𝑎𝑝 = 0.01105481 𝑏𝑎𝑟 Y para tener la presión teórica se multiplica la 𝑃𝑣𝑎𝑝 calculada por la presión critica 𝑃𝑐 = 27.35 𝑏𝑎𝑟 𝑃𝑣𝑎𝑝 = 𝑎𝜏+𝑏𝜏1.5 +𝑐𝜏2.5 +𝑑𝜏5 ×𝑃𝑐 𝑇𝑡𝑟 𝑒 Teniendo así: 𝑃𝑣𝑎𝑝 = 0.01105481 ∗ 27.35 = 0.302349123 𝑏𝑎𝑟 Pero como se desea tener la presión en mm Hg se la presión de vapor teórico se multiplica por 750.063 para así obtener las unidades deseadas. 𝑃𝑣𝑎𝑝 = 0.302349123 ∗ 750.0637 = 226.7811 𝑚𝑚 𝐻𝑔 Donde Ln(Pvap) va a ser el logaritmo natural de la presión de Vapor y 1/T es la inversa de las temperaturas obtenidas de manera experimental. 1 𝑇 1 335.15 = 0.00298374 Evento 2 (Temperatura) 𝑇 = ℃ + 273.15 𝑇 = 72℃ + 273.15 = 345.15 𝐾 (Presión de vapor) 𝑣𝑎𝑝 𝑣𝑎𝑝 𝑃𝑎𝑏𝑠 = 𝑃𝑚𝑎𝑛 + 𝑃𝑏𝑎𝑟𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑎 ; 𝑑𝑜𝑛𝑑𝑒 𝑛𝑢𝑒𝑠𝑡𝑟𝑎 𝑃𝑏𝑎𝑟𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑎 = 585 𝑚𝑚𝐻𝑔 𝑣𝑎𝑝 𝑃𝑎𝑏𝑠 = − − 344 𝑚𝑚𝐻𝑔 + 585 𝑚𝑚𝐻𝑔 = 241.00 𝑚𝑚𝐻𝑔 𝑇 𝑇𝑟 = 𝑇 𝑐 𝑇𝑟 = 345.15𝐾 540.15𝐾 = 0.6389892 𝐾 𝜏 = 1 − 𝑇𝑟 𝜏 = 1 − 0.6389892 = 0.36101 ln(𝑃𝑣𝑎𝑝 ) 𝐿𝑛(𝑃𝑣𝑎𝑝 ) = 𝑎𝜏 + 𝑏𝜏 1.5 + 𝑐𝜏 2.5 + 𝑑𝜏 5 𝑇𝑟 𝐿𝑛(𝑃𝑣𝑎𝑝 ) −7.77404(0.36101 𝐾) + 1.85614(0.36101𝐾)1.5 + −2.8298(0.36101𝐾)2.5 + (−3.507)(0.36101𝐾)5 = 0.6204758 𝐾 ln(𝑃𝑣𝑎𝑝 ) = −4.14247 𝑏𝑎𝑟 𝑃𝑣𝑎𝑝 −7.77404(0.36101 𝐾)+1.85614(0.36101K)1.5 ±2.8298(0.36101𝐾)2.5 +(−3.507)(0.36101𝐾)5 ×27.35 0.6204758 𝐾 𝑃𝑣𝑎𝑝 = 𝑒 𝑃𝑣𝑎𝑝 = 0.434414 ∗ 750.0637 = 325.8388 𝑚𝑚𝐻𝑔 1 𝑇 Evento 3 1 345.15 = 0.00289729 = 0.434414𝑏𝑎𝑟 (Temperatura) 𝑇 = ℃ + 273.15 𝑇 = 74℃ + 273.15 = 347.15 𝐾 (Presión de vapor) 𝑣𝑎𝑝 𝑣𝑎𝑝 𝑃𝑎𝑏𝑠 = 𝑃𝑚𝑎𝑛 + 𝑃𝑏𝑎𝑟𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑎 ; 𝑑𝑜𝑛𝑑𝑒 𝑛𝑢𝑒𝑠𝑡𝑟𝑎 𝑃𝑏𝑎𝑟𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑎 = 585 𝑚𝑚𝐻𝑔 𝑣𝑎𝑝 𝑃𝑎𝑏𝑠 = −322 𝑚𝑚𝐻𝑔 + 585 𝑚𝑚𝐻𝑔 = 263.00 𝑚𝑚𝐻𝑔 𝑇 𝑇𝑟 = 𝑇 𝑐 𝑇𝑟 = 347.15𝐾 540.15𝐾 = 0.6426918 𝐾 𝜏 = 1 − 𝑇𝑟 𝜏 = 1 − 0.6389892 = 0.3573082𝐾 ln(𝑃𝑣𝑎𝑝 ) 𝐿𝑛(𝑃𝑣𝑎𝑝 ) = 𝑎𝜏 + 𝑏𝜏 1.5 + 𝑐𝜏 2.5 + 𝑑𝜏 5 𝑇𝑟 𝐿𝑛(𝑃𝑣𝑎𝑝 ) −7.77404(0.357308𝐾) + 1.85614(0.357308𝐾)1.5 + −2.8298(0.357308𝐾)2.5 + (−3.507)(0.357308𝐾)5 = 0.6204758 𝐾 ln(𝑃𝑣𝑎𝑝 ) = −4.072977 𝑏𝑎𝑟 𝑃𝑣𝑎𝑝 𝑃𝑣𝑎𝑝 = 𝑒 −7.77404(0.3573082K)+1.85614(0.3573082K)1.5 ±2.8298(0.3573082K)2.5 +(−3.507)(0.3573082K)5 ×27.35 0.6204758 𝐾 𝑃𝑣𝑎𝑝 = 0.4656779 ∗ 750.0637 = 349.288176 𝑚𝑚𝐻𝑔 1 𝑇 1 347.15 = 0.0028806 Punto critico 𝑇𝑐 = 540.15 𝐾 𝑃𝑐 = 27.35 𝑏𝑎𝑟 𝑃𝑐 [𝑏𝑎𝑟] = ( 750.0637554192 1𝑚𝑚𝐻𝑔 ) = 20551.747 𝑚𝑚𝐻𝑔 1 𝑏𝑎𝑟 Punto de fusión = 0.4656779𝑏𝑎𝑟 𝑇𝑓𝑢𝑠𝑖𝑜𝑛 = 182.6 𝐾 𝑃𝑓𝑢𝑠𝑖𝑜𝑛 = 1.01325 𝑏𝑎𝑟 750.0637554192 1𝑚𝑚𝐻𝑔 𝑃𝑓𝑢𝑠𝑖𝑜𝑛 [𝑏𝑎𝑟] = ( ) = 760.0021002 𝑚𝑚𝐻𝑔 1 𝑏𝑎𝑟 Ecuación de entalpia de vaporización 𝐴 = 53.66 𝛽 = 0.2831 𝑇𝑟𝑝𝑟𝑜𝑚 = 0.656661029 ∆𝑣𝑎𝑝 𝐻 = 𝐴 exp(−𝛽𝑇𝑟 ) (1 − 𝑇𝑟 )𝛽 ∆𝑣𝑎𝑝 𝐻 = 56.66 exp(−0.2831 × 0.656661029) (1 − 0.656661029)0.2831 = 32.92139383 [ ∆𝑣𝑎𝑝 𝐻𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 = 42.69621448 [ 𝑘𝐽 𝑚𝑜𝑙 𝑘𝐽 𝑚𝑜𝑙 ] Punto triple 𝑘𝐽 Entalpia de vaporización estándar del heptano: 36 [𝑚𝑜𝑙] Condiciones del punto triple 𝑇𝑡𝑟𝑖𝑝𝑙𝑒 = 182.56 𝐾 𝑅 = 8.314 [ 𝐽 ] 𝑚𝑜𝑙𝐾 𝑇1 = 335.15𝐾 𝑇2 = 367.15𝐾 Utilizando la “Ecuación de Clausius-Clapeyron” 𝑑𝑃 Δ𝐻 = 𝑑𝑇 TΔ𝑉 𝑃2 Δ𝐻 1 1 𝐿𝑛 ( ) = − ( − ) 𝑃1 R 𝑇2 𝑇1 𝑃𝑡𝑟𝑖𝑝𝑙𝑒 [𝑏𝑎𝑟] = ( 𝐽 𝑚𝑜𝑙 ) ( 1 − 1 ) = 1.33550824 𝑏𝑎𝑟 𝐽 367.15 335.15 8.314 𝑚𝑜𝑙𝐾 42696.21448 Cambiar de unidades a [𝑚𝑚𝐻𝑔] ] 750.0637554192 1𝑚𝑚𝐻𝑔 𝑃𝑡𝑟𝑖𝑝𝑙𝑒 [𝑏𝑎𝑟] = ( ) = 1001.71633 𝑚𝑚𝐻𝑔 1 𝑏𝑎𝑟 Y así para cada evento que se tenga. Teniendo la siguiente tabla. TABLA DE RESULTADOS 1 -HEPTANOTemperatura Pvap Evento Ln (Pvap) man [°C] [K] [mmHg] abs [mmHg] 1 157.00 5.42398532 62 335.15 -428 2 241.00 5.78640295 72 345.15 -344 3 347.15 263.00 5.8558973 74 -322 4 310.00 5.99205777 78 351.15 -275 5 345.00 6.05876191 80 353.15 -240 6 370.00 6.12457322 82 355.15 -215 7 406.00 6.18950958 84 357.15 -179 8 478.00 6.34813601 89 362.15 -107 9 503.00 6.3792413 90 363.15 -82 10 545.00 6.44084815 92 365.15 -40 11 583.00 6.50166321 94 367.15 -2 1 𝑇 0.00298374 0.00289729 0.0028806 0.00284779 0.00283166 0.00281571 0.00279994 0.00276129 0.00275368 0.0027386 0.00272368 Presión de Vapor (Referencia) Presión de Vapor [mmHg] 700 600 500 400 300 200 100 0 330 335 340 345 350 355 Temperatura [K] 360 365 370 Presión de Vapor (Experimental) 700,00 Presión de Vapor [mmHg] 600,00 500,00 400,00 300,00 200,00 100,00 0,00 330 335 340 345 350 355 360 365 370 Temperatura [K] Calcular los porcentajes de error para la presión de vapor entre los valores experimentales y teóricos. Evento 1 %𝐸 = 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 − 𝑉𝑎𝑙𝑜𝑟 𝐸𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 ∗ 100 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 %𝐸 = 226.78112 − 157 ∗ 100 226.78112 %𝐸 = 30.770251 Evento 2 %𝐸 = 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 − 𝑉𝑎𝑙𝑜𝑟 𝐸𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 ∗ 100 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 %𝐸 = 325.83885 − 241 ∗ 100 325.83885 %𝐸 = 26.037059 Evento 3 %𝐸 = 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 − 𝑉𝑎𝑙𝑜𝑟 𝐸𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 ∗ 100 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 %𝐸 = 349.28818 − 263 ∗ 100 349.28818 %𝐸 = 26.037059 Siguiendo el mismo procedimiento para los eventos restantes, se obtuvieron los siguientes resultados del porcentaje de error. T(K) %E 335.15 30.7702507 345.15 26.0370588 347.15 24.7040073 351.15 22.5459614 353.15 19.3633957 355.15 19.0282788 357.15 16.7362095 362.15 16.3497085 363.15 14.6706 365.15 13.0695975 367.15 12.495155 Tabla de Resultados 2 Pvap(exp, mmHg) Pvap(teórica, mmHg) T(K) %error P 335.15 157.00 226.7811186 30.7702507 345.15 241.00 325.838854 26.0370588 347.15 263.00 349.2881765 24.7040073 351.15 310.00 400.2373609 22.5459614 353.15 345.00 427.8453972 19.3633957 355.15 370.00 456.9496544 19.0282788 357.15 406.00 487.6069148 16.7362095 362.15 478.00 571.4265799 16.3497085 363.15 503.00 589.4802967 14.6706 365.15 545.00 626.938314 13.0695975 367.15 583.00 666.2488229 12.495155 Graficar porcentajes de error para la presión de vapor (y) – temperatura(x). %Error - Temperatura 35 30 %error [%] 25 20 15 10 5 0 330 335 340 345 350 Temperatura [K] 355 360 365 370 Graficar (ln Pvap)-(1/T). Ln (Pvap) - (1/T) 0,003 0,00295 (1/T) 0,0029 0,00285 0,0028 0,00275 0,0027 5,3 5,5 5,7 5,9 Ln (Pvap) 6,1 6,3 [mmHg]) Mediante un método analítico, obtener la entalpia de vaporización. Para este punto, se utilizará la Ecuación de entalpia de vaporización ∆𝑣𝑎𝑝 𝐻 = 𝐴𝑒𝑥𝑝(−𝛽𝑇𝑟 )(1 − 𝑇𝑟 )𝛽 donde: A=53.66 β=0.2831 Trprom=0.656661029 Sustituyendo nos queda: ∆𝑣𝑎𝑝 𝐻 = (53.66)(℮(−0.2831)(0.656661029) )(1 − 0.656661029)0.2831 ∆𝑣𝑎𝑝 𝐻 = 32.92139383 𝑘𝐽 𝑚𝑜𝑙 𝑘𝐽 1000 𝐽 ∆𝑣𝑎𝑝 𝐻 = 32.92139383 𝑚𝑜𝑙 *| 1𝑘𝐽 Entalpia de vaporización de referencia. ΔvapHref= 36 kJ/mol= 36000 J/mol 𝐽 | = 32921.39383 𝑚𝑜𝑙 6,5 6,7 Calcular el %error entre la entalpia de vaporización experimental y teórica. ΔvapHref [kJ/mol] ΔvapHexp [kJ/mol] 36 32.92139383 ΔvapHref [J/mol] ΔvapHexp [J/mol] 36000 32921.39383 %𝐸 = 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 − 𝑉𝑎𝑙𝑜𝑟 𝐸𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 ∗ 100 𝑉𝑎𝑙𝑜𝑟 𝑇𝑒ó𝑟𝑖𝑐𝑜 %𝐸 = 36000 − 32921.39383 ∗ 100 36000 %𝐸 = 8.551683806 Realizar una gráfica de temperatura(x)-presión(y) Marcando las siguientes cinco series de datos: (1) curva de vaporización experimental, (2) curva de vaporización bibliográfica, (3) punto triple, (4) punto crítico y (5) punto de fusión Temperatura - Presión 700,00 20000 600,00 500,00 15000 Curva Experimental 400,00 Curva Referencia 10000 300,00 Punto Triple Punto de Fusión Punto Critico 200,00 5000 100,00 0,00 0 100 150 200 250 300 350 400 450 500 550 600 Cuestionario ¿Cómo es el comportamiento de la presión de vapor con respecto a la temperatura de ebullición? Su comportamiento es exponencial respecto a la temperatura con la presión de vapor, por lo tanto, si aumentamos la temperatura también incrementa la presión a la largo de nuestra curva, al igual si aumentamos la presión incrementa la temperatura. ¿Por qué es importante conocer el calor latente de vaporización de una sustancia pura? El calor latente de vaporización es una propiedad termodinámica ya que está presente un gran número de procesos y con él la determinación de datos energéticos de los procesos, y es importante en nuestra practica conocerla porque podemos saber cuánta energía suministrar o extraer del heptano sin cambiar la temperatura. ¿Qué significado físico tiene el valor obtenido de entalpia de evaporización? La energía necesaria para que el heptano este en equilibrio con su propio vapor y se observe el cambio de estado de líquido a vapor ¿Qué significado físico tiene la entropía en la transición liquido-vapor a una temperatura especifica? La entropía va a sufrir un cambio discontinuo al transformar una parte del líquido en vapor ya que se presenta a una temperatura específica y la entropía representa un proceso reversible e irreversible, dicha energía no puede usarse para producir un trabajo. Observaciones y Recomendaciones. Tener medidas de seguridad generales en la experimentación, tanto en personales y en las instalaciones Tener un área de trabajo limpia y ordenada para la experimentación. Verificar el material empleado, que este en buenas condiciones y que este calibrado. Tener en cuenta en el material que sea de alta precisión, si es que se quiere tener porcentajes de error bajos Verificar el sistema ya que presenta anomalías, que al colocar la instrumentación sea de la manera adecuada para su experimentación. Estar informados sobre la experimentación, antes de hacer la práctica, esto con el fin de no cometer errores en la práctica. Al aumentar la temperatura, la presión aumenta, esto quiere decir que se comporta de manera proporcional. En la gráfica 1 y 2 se puede observar que existe un comportamiento exponencial directamente proporcional, aunque no en todos sus datos. En la gráfica 3, se comprueba lo dicho anteriormente, ya que esta muestra los errores cometidos durante la experimentación Grafica 4, Se coloco en el eje (x) los valores de la inversa de la temperatura (1/T) vs el logaritmo de presión de vapor en nuestro eje (y), nuestra presión de vapor va en proporción a nuestra temperatura, tengamos en cuenta que son valores experimentales y como se ha mencionado el porcentaje de error es muy grande y al graficar, nos aparece recta inclinada donde está en descenso nuestra inversa de temperatura. Grafica 5, Es una gráfica donde graficamos la curva de vaporización experimental, curva de vaporización (bibliográfica), punto triple, punto crítico y punto de fusión, y si lo apreciamos de manera cartesiana, en nuestro eje (y) es la presión y en el eje (x) nuestra temperatura y podemos apreciar las diferencias que están presentes con respecto a nuestros valores teóricos y experimentales, al igual a las condiciones que están presentes en nuestro sistema con la sustancia del heptano. Conclusión Se trabajó con heptano en fase liquida y se determinaron las presiones de vapor que ejercen fuerzas cuando cambia de fase, esto debido a que en nuestro sistema estamos aumentando la temperatura que va en una relación exponencial (Temperatura-Presión vapor) y así se identifica el punto triple donde hay un equilibrio de fases y se observa en la experimentación donde obtuvo a una presión de 1001,76 mmHg, y hacer la comparación del calor latente de presiones de vapor experimental y teórico obtenido en las referencias está presente una considerable diferencia y de igual manera al hacer los gráficos y al obtener los porcentajes de error, se determina que hubo fallas en las mediciones, y esto debido al barómetro empleado en la experimentación ya que no es tan preciso al obtener la presión atmosférica, también en las tomas de las temperaturas por nuestro termómetro o bien alguna falla en nuestro sistema con el material empleado, ya que sus porcentajes de error son muy altos, y también estos porcentajes se reducen al aumentar nuestra temperatura en cada evento. Sanchez Andrade Manuel Emiliano Conclusión En esta experimentación se obtuvo la presión de vapor (o de saturación) del heptano el cual analizamos a diferentes temperaturas, así como el calor de vaporización del heptano con la ayuda de la ecuación de Clapeyron, por lo que podemos afirmar que nuestros objetivos establecidos se cumplieron de manera exitosa. Al trabajar con el heptano, Se observó que, al aumentar la temperatura, la presión aumenta de manera proporcionalmente, debido a la energía cinética que aumenta en las moléculas del heptano. Es importante mencionar que el heptano es una sustancia pura, por lo que cuando realizamos el análisis del sistema líquido-vapor muchos de los conceptos fueron más específicos para este tipo de sustancia. En los cálculos se utilizaron mmHg y K debido a que se requerían escalas absolutas. En los resultados de la presión de vapor se puede observar que, si aumenta la temperatura, la presión de vapor también aumenta de manera exponencial, dando como resultado una curva, esta curva es la llamada curva de saturación. Al trabajar con el heptano y debido a su gran disposición de información en plataformas como NIST, se logró obtener información confiable realizada a base de estudios de la sustancia. Comparando las presiones de vapor y el calor latente de vaporización experimentales con respecto a valores teóricos tenemos un error considerable, y mientras aumenta la temperatura el error disminuye. Esto se puede deber a que el barómetro empleado no tiene una precisión elevada y también a las condiciones de presión y temperatura que se emplearon en el laboratorio. Sin embargo, el error de la entalpía fue considerablemente más pequeño. Al haber obtenido todos los datos realizamos un diagrama de fase en donde se observa que la curva teórica llega a una presión más elevada acercándose más al punto crítico, mientras que la experimental fue menor, pero comenzó desde una presión más pequeña y cercana al punto de fusión. Sanchez Mendoza Amparo Karina Conclusión A partir de la realización de la práctica, se pudo obtener experimentalmente la presión del heptano en las diferentes temperaturas dadas. Además de que pudimos obtenerla a su vez, de operaciones indirectas que al ser comparadas con las que ya estaban prestablecidas bibliográficamente, resultaron ser muy similares. Una de las dificultades que se presentaron al elaborar la práctica fue que algunos datos recabados bibliográficamente no estaban en las unidades que nosotros requeríamos(mmHg) por lo cual se tuvieron que hacer una serie de conversiones para poder trabajar todos los datos en una misma unidad de medida. Se comprobó que partir de la ecuación de Clausius-Clapeyron, nuestra presión cambia de manera que proporcional al cambio de nuestra temperatura. Además de que se comprobó el estado líquido-vapor de la sustancia pura con la que se trabajó. REFERENCIAS [1]https://www.ecured.cu/Presi%C3%B3n_de_vapor#Factores_de_que_dep ende_la_Presi.C3.B3n_de_vapor [2] https://www.ecured.cu/Equilibrio_termodin%C3%A1mico [3] https://www.ecured.cu/Equilibrio_qu%C3%ADmico [4] https://www.ecured.cu/Equilibrio_t%C3%A9rmico [5]http://recursostic.educacion.es/newton/web/materiales_didacticos/equ ilibrio_quimico/equil_homogeneo.html?3&0#:~:text=Equilibrio%20homog%C 3%A9neo&text=donde%20%E2%88%86n%20es%20la,coeficientes%20estequi om%C3%A9tricos%20de%20los%20reactivos. [6] https://www.ier.unam.mx/~ojs/pub/Liquid3/node8.html [7]https://www.educaplus.org/gases/ley_gaylussac.html#:~:text=La%20pres i%C3%B3n%20del%20gas%20es,la%20temperatura%2C%20disminuir%C3%A1 %20la%20presi%C3%B3n. [8]https://laurasancheznivia.wordpress.com/fisica-2013-2/primerperiodo/termodinamica/calor-y-temperatura/cambios-de-estado/puntocritico/ [9] http://depa.fquim.unam.mx/amyd/archivero/CLASES03y04_21046.pdf [10]http://www.quimicafisica.com/ecuacion-declapeyron.html#:~:text=La%20ecuaci%C3%B3n%20de%20Clapeyron%20nos, cualquier%20valor%20de%20P%2CT.&text=%5CDelta%20S%20y%20%5CDelta %20V,%5Cbeta%20a%20la%20%5Calpha.&text=Esta%20%C3%BAltima%20ex presi%C3%B3n%20se%20conoce%20como%20ecuaci%C3%B3n%20de%20Cl apeyron.


![Propiedades de los materiales peligrosos [pg. 2]](http://s2.studylib.es/store/data/007393325_1-7f6d1d3fa00a812be4e2e67483113660-300x300.png)