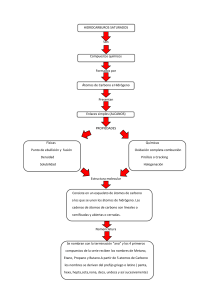
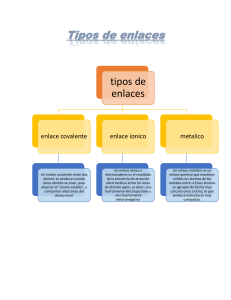
Materiales amorfos y cristalinos Introducción a la Ingeniería en Materiales I Término 2020-2021 Objetivos de la sesión • Representar las estructuras de los materiales mediante sus características básicas. • Analizar el efecto de la estructura en las propiedades de un material. Introducción a la Ingeniería en Materiales Ingeniería en materiales Introducción a la Ingeniería en Materiales ¿Por qué es importante la estructura de los materiales? Introducción a la Ingeniería en Materiales Recordando Química General • Un átomo estable tiene igual número de protones que de electrones, lo cual quiere decir que: • su carga es neutra. • El átomo es capaz de emitir o absorber cantidades discretas de energía al abajar o subir de nivel respectivamente. Discretas se refiere a: • que no puede tomar cualquier valor, sino solo uno correspondiente al conjunto de energías posibles. • Los enlaces se producen dado que en la distancia de enlace la fuerza neta es cero y la energía es mínima. • Verdadero. Introducción a la Ingeniería en Materiales Tabla periódica y propiedades • Reactividad; propiedades químicas. • Grupos • 0, gas inertes o nobles, químicamente inactivo (Ar). • IA y IIA incluyen los álcalis y metales alcalinos, tienen un electrón en la ultima capa, tienden a ceder electrones, son químicamente activos. • VIIA, tienen a ganar un electrón en la ultima capa, químicamente activos. • IV son materiales en transición, como el Si importante en la fabricación de chips (semiconductores). • IIIB y IIB son metales de transición, los cuales tiene el subnivel d parcialmente ocupado, aquí encontramos los materiales magnético. Introducción a la Ingeniería en Materiales Incremento de Electronegatividad Electronegatividad y tabla periódica Incremento de Electronegatividad Introducción a la Ingeniería en Materiales Enlaces Tipo Energía del enlace Características Iónico Elevada (enlace fuertes) No direcciones, estables, punto de fusión elevado, conductividad baja, coeficiente de expansión bajo. Ej.: cerámicos Covalente Variable, elevada como el diamante, bajo como los polímeros Punto de fusión elevado y variable, aislante, frágil o flexible. Ej: algunos cerámicos, semiconductores, y cadenas poliméricas Metálicos Variable, elevada como el Tungsteno y pequeña como el mercurio Punto de fusión variable, buenos conductores del calor y electricidad, opacos a la luz. Ej ; metales Secundarios Pequeños Direcciones , inter moléculas como los polímeros o intramolecular Introducción a la Ingeniería en Materiales Temperatura de fusión vs enlaces Tipo Iónico Covalente Metálico Van der Waals Hidrogeno Sustancia Energía (eV/átomo) Temperatura de fusión (oC) NaCl 3.3 801 MgO 5.2 2800 Si 4.7 1410 C 7.4 Ø3550 Hg 0.7 -39 Al 3.4 660 Fe 4.2 1538 W 8.8 3410 Ar 0.08 -189 Cl2 0.32 -101 NH3 0.36 -78 H2 0 0.52 0 Introducción a la Ingeniería en Materiales Clasificación por ordenamiento espacial • Cristalinos • Amorfos • Semicristalinos Introducción a la Ingeniería en Materiales Sistemas cristalinos • Son descripciones de celdas (formas estructurales) con relación a su geometría • 6 parámetros de red de una estructura cristalina: • 3 longitudes y • 3 ángulos inter-axiales. Introducción a la Ingeniería en Materiales Estructuras cristalinas de materiales metálicos Se relacionan con la geometría de la estructura y con el ordenamiento atómico. • Cúbica centrada en el cuerpo (BCC) • Cúbica centrada en la cara (FCC) • Hexagonal Compacta (HCP) Introducción a la Ingeniería en Materiales Estructuras Cúbicas Centradas en el Cuerpo (BCC en inglés) Estructura: Cúbica de cuerpo centrado Red de Bravais: BCC Introducción a la Ingeniería en Materiales BCC – Átomos por celda Si imaginamos los lados de la celda cúbica como límites reales, podemos ver que la intersección de estos lados corta los átomos (de forma esférica). Los átomos que están “dentro” de límites de la celda son: • 1 átomo central • 1/8 átomos/esquina • 8 esquinas • Total = 2 Introducción a la Ingeniería en Materiales BCC – Factor de empaquetamiento (APF en inglés) Factor de empaquetamiento es la fracción del volumen de la esfera sólida en una celda unitaria, asumiendo el modelo de esfera dura atómica. APF = Volumen de átomos en una celda unitaria / Volumen total de la celda unitaria ! !"# = 4 √3, (2) P * 3 4 ,! 8 √3 ! = P( ) = 0.68 3 4 Introducción a la Ingeniería en Materiales BCC – Número de coordinación (1) Para los metales, cada átomo tiene el mismo número de átomos vecinos o que se tocan. Si vemos el átomo central se puede observar como: (2) (1) tiene 8 átomos vecinos; y, (2) al estar en el centro, solo 8 átomos lo tocan. Introducción a la Ingeniería en Materiales Estructuras BCC Átomos / celda unitaria =2 Parámetro de la red = 4R √ 3 Factor de empaquetamiento = 68% Número de coordinación =8 Ejemplos Metales: Cr, Fe, W Introducción a la Ingeniería en Materiales Estructuras Cúbicas Centras en las Caras (FCC en inglés) Átomos de red : 4 Parámetro de la red a= 2 R √ 2 Numero de coordinación : 12 Metales típicos : Fe, Cu, Al, Au, AG Introducción a la Ingeniería en Materiales Estructuras Hexagonales Compactas (HCP en inglés) Átomos de red : 6 Parámetro de la red a=4 r/2, c=1.633a Factor de empaquetamiento : 74% Numero de coordinación : 12 Metales típicos : Ti, Mg, Zn, Be, Co Celda unitaria Introducción a la Ingeniería en Materiales Estructuras de materiales cerámicos Tipos de Estructuras • A-X • Am Xp • Am Bn Xp Introducción a la Ingeniería en Materiales Estructuras tipo A-X • Roca de sal (NaCl) Coordination number is 6, cation–anion radius ratio is between approximately 0.414 and 0.732. Unit cell is generated from an FCC arrangement of anions with one cation situated at the cube center and one at the center of each of the 12 cube edges. • Cloruro de cesio (CsCl) Coordination number is 8. Anions are located at each of the corners of a cube, whereas the cube center is a single cation. • Blenda de Zinc (ZnS) Coordination number is 4; that is, all ions are tetrahedrally coordinated. For a unit cell: all corner and face positions of the cubic cell are occupied by S atoms, while the Zn atoms fill interior tetrahedral positions. Introducción a la Ingeniería en Materiales Estructuras tipo AmXp • Cargas de cationes y aniones no son las mismas. • m y/o p, no son iguales a 1. • Ejemplos CaF2, UO2 , PuO2 , and ThO2. Introducción a la Ingeniería en Materiales Estructuras tipo AmBnXp • Compuestos para más de un tipo de catión (A y B). • Titanato de bario (BaTiO3) • Estructura de cristal de pervoskita. • Encima de 120 C (248 F), la estructura es cúbica. • Celda unitaria: iones Ba en las 8 esquinas, el de Ti en centro del cubo, iones de O en centro de cada una de las 6 caras. Introducción a la Ingeniería en Materiales Materiales amorfos y cristalinos Introducción a la Ingeniería en Materiales I Término 2020-2021 Introducción a la Ingeniería en Materiales Carbono Diamante Grafito Fulerenos • Carbono metastable a temperatura ambiente y presión atmosférica. • Más estable que diamante a T y P ambiente. • Grupo esférico hueco de 60 átomos C. • Estructura es variación de blenda de zinc, pero C ocupa todas las posiciones. • Estructura de capas de átomos dispuestos hexagonalmente. • Cada molécula tiene grupos de átomos que se unen para forman hexágonos (20) y pentágonos (12). • Cada C se une a otros 4 C – enlaces covalentes. • Cada C se une a 3 átomos vecinos coplanares. • El cuarto electrón participa en una unión van derWaals entre las capas. • Configurado para que ningún pentágono comparta un lado común. Introducción a la Ingeniería en Materiales Puntos, direcciones y planos cristalográficos La cristalinidad de un material se puede representar por un sistema de coordenadas como el de la figura. • Los puntos son las posiciones de los átomos en la celda unitaria. • La distancia se mide en términos del número de parámetros de red que debemos mover en cada una de las para llegar desde el origen al punto en cuestión. • Las coordenadas se escriben como las tres distancias, con comas que separan los números. Introducción a la Ingeniería en Materiales Puntos, direcciones y planos cristalográficos • Las direcciones son vectores (dimensión y sentido) que tienen características en una estructura: • Una dirección y su negativo no son idénticas – van en sentidos contrarios. • Una dirección y su múltiplo son idénticas – van en el mismo sentido. • Si redefinimos el sistema de coordenadas, podemos generar direcciones (que no siendo iguales en número) son equivalentes. Se denominan familia de direcciones. • Las direcciones cristalográficas indican una orientación particular de un solo cristal o de un material policristalino orientado. • Los metales se deforman más fácilmente en direcciones a lo largo de las cuales los átomos están en contacto más cercano. • Es mucho más fácil magnetizar el hierro en la dirección [100] en comparación con las direcciones [111] o [110]. Introducción a la Ingeniería en Materiales Puntos, direcciones y planos cristalográficos • Los planos son también tienen un significado particular. • Metales se deforman a lo largo de planos de átomos que están más apretados. • Energía superficial de las caras de un cristal depende de los planos – importante para el crecimiento de cristales. • En crecimiento de película delgada de ciertos materiales electrónicos debemos asegurarnos de que el sustrato esté orientado de tal manera que la película pueda crecer en un plano particular. • Aspectos importantes: • Los planos y sus negativos son idénticos (opuesto a las direcciones). • Los planos y sus múltiples no son idénticos (opuesto las direcciones). • En cada celda unitaria, los planos de una familia representan grupos de planos equivalentes que tienen sus índices particulares debido a la orientación de las coordenadas. • En sistemas cúbicos, una dirección que tiene los mismos índices que un plano es perpendicular a ese plano. Introducción a la Ingeniería en Materiales Densidades Densidad volumétrica: densidad asociada al tipo de estructura cristalina nA rV = VC N A n = numero de átomos asociado a cada celda unitaria A = peso atómico VC= volumen de la celda unitaria NA= numero de Avogadro (6.023 x 1023 átomos/mol • Densidad lineal : son los números de átomos que intersecan una o varias direcciones de las estructuras cristalinas # atomos int . rL = longitud de linea seleccionada • Densidad planar: densidad en varios planos, el centro del átomo debe ser intersecado por un plano # atomos int . rP = Area selecciona da Introducción a la Ingeniería en Materiales Anisotropía • Se denomina así cuando las propiedades físicas de los cristales individuales dependen de la dirección cristalográfica en la que se toman las medidas. • Esta direccionalidad está asociada con la variación de la separación atómica o iónica con la dirección cristalográfica. • La extensión y magnitud de los efectos anisotrópicos en los materiales cristalinos son funciones de la simetría de la estructura cristalina. Introducción a la Ingeniería en Materiales Alotropía • Es la propiedad que poseen ciertos elementos químicos para presentarse bajo estructuras moleculares diferentes. • Oxígeno – puede presentarse como oxígeno atmosférico (O2) y como ozono (O3) • Fósforo – fósforo rojo y fósforo blanco • Carbono – grafito, diamante y fulereno. • Para que a un elemento se le pueda denominar como alótropo, sus diferentes estructuras moleculares deben presentarse en el mismo estado físico. Introducción a la Ingeniería en Materiales Sobre la cristalinidad Cristales únicos • Para un sólido cristalino, cuando la disposición periódica y repetida de los átomos es perfecta o se extiende por toda la muestra sin interrupción, el resultado es un solo cristal. Todas las celdas de la unidad se entrelazan de la misma manera y tienen la misma orientación. Materiales policristalinos • La mayoría de los sólidos cristalinos se componen de una colección de muchos cristales pequeños o granos; dichos materiales se denominan policristalinos. Introducción a la Ingeniería en Materiales Espaciamiento d Introducción a la Ingeniería en Materiales Difracción de rayos X Los rayos X son fotones con alta energía que al impactar en planos atómicos son afectados. Introducción a la Ingeniería en Materiales Ley de Bragg Entonces, la condición geometría de la difracción de rayos X es igual a: nλ = BC + CD nλ = dhkl sin θ + dhkl sin θ nλ = 2d sin θ Introducción a la Ingeniería en Materiales Difractograma Introducción a la Ingeniería en Materiales Algunas acotaciones • Planos con mayor espaciamiento interplanar tiene el menor Angulo de Bragg • Solamente planos con dhkl >λ/2 dan origen a un rayo difractado • El numero de picos de difracción depende de la longitud de onda • Análisis de picos de difracción (1) De la posición angular, se determina el tamaño y forma de la celda unitaria (2) De la intensidad de los picos se puede deducir la posición de los átomos de la celda unitaria Introducción a la Ingeniería en Materiales Materiales poliméricos ¿Qué es un polímero? Poli mero varias unidad de repetición Unidad de repetición Unidad de repetición H H H H H H C C C C C C H H H H H H H H H H H H C C C C C C H Cl H Cl H Cl Polietileno (PE) Cloruro de polivinilo (PVC) Unidad de repetición H C H H H C C CH3 H H H C C CH3 H H C CH3 Polipropileno (PP) Adapted from Fig. 14.2, Callister & Rethwisch 9e. Introducción a la Ingeniería en Materiales Polímeros antiguos • Originalmente se utilizaban polímeros naturales • Madera • Algodón • Cuero - Caucho - Lana - Seda • Usos conocidos más antiguos • Bolas de goma utilizadas por los incas • Noé usó brea (un polímero natural) para el arca Introducción a la Ingeniería en Materiales Composición de polímeros La mayoría de polímeros son hidrocarburos – i.e., hecho de H y C • Hidrocarburos Saturados • Cada carbono unido individualmente a otros cuatro átomos • Ejemplo: • Etanol, C2H6 H H C H H C H H Introducción a la Ingeniería en Materiales Hidrocarburos insaturados • Enlaces dobles y triples algo inestables – pueden formar nuevos enlaces • Doble enlace encontrado en etileno o eteno - C2H4 H H C C H H • Triple enlace encontrado en acetileno o etino - C2H2 H C C H Introducción a la Ingeniería en Materiales Isomerismo • 2 compuestos con la misma fórmula química pueden tener estructuras bastante diferentes por ejemplo: C8H18 • normal-octano H H H H H H H H H C C C C C C C C H = H3C CH2 CH2 CH2 CH2 CH2 CH2 CH3 H H H H H H H H ß H3C ( CH2 ) CH3 6 • 2,4-dimethylhexane CH3 H3C CH CH2 CH CH3 CH2 CH3 Introducción a la Ingeniería en Materiales Peso molecular • Peso molecular, M: Masa de una mol de cadenas. Bajo M Alto M No todas las cadenas de un polímero tienen la misma longitud. - es decir, hay una distribución de pesos moleculares Introducción a la Ingeniería en Materiales Grado de polimerización (DP) DP = número promedio de unidades repetidas por cadena H H H H H H H H H H H H H C C (C C ) C C C C C C C C H DP = 6 H H H H H H H H H H H H Mn DP = m where m = average molecular weight of repeat unit for copolymers this is calculated as follows: m = Σfi mi Fracción de cadena mol. peso de la unidad de repetición i Introducción a la Ingeniería en Materiales Estructuras moleculares para polímeros secondary Linear bonding B ranched Cross-Linked Network Adapted from Fig. 14.7, Callister & Rethwisch 9e. Introducción a la Ingeniería en Materiales Copolímeros Fig. 14.9, Callister & Rethwisch 9e. dos o más monómeros polimerizados juntos • aleatorios - A y B posicionados aleatoriamente a lo largo de la cadena • alternando - A y B se alternan en la cadena de polímero • bloque: grandes bloques de unidades A se alternan con grandes bloques de unidades B • injerto: cadenas de unidades B injertadas en una columna vertebral A A– B– random alternating block graft Introducción a la Ingeniería en Materiales Cristalinidad en polímeros • Arreglos atómicos ordenados que involucran cadenas moleculares. • Estructuras de cristal en términos de células unitarias. • Ejemplo mostrado Fig. 14.10, Callister & Rethwisch 9e. • celda unitaria de polietileno Introducción a la Ingeniería en Materiales Polímero cristalino • Regiones cristalinas • plaquetas delgadas con pliegues de cadena en las caras • Estructura de cadena plegada Fig. 14.12, Callister & Rethwisch 9e. ≈ 10 nm Introducción a la Ingeniería en Materiales Polímero cristalino Polímeros raramente 100% cristalinos • Difícil para que todas las regiones de todas las cadenas se alineen crystalline region • Grado de cristalinidad expresado como% de cristalinidad. – Algunas propiedades físicas dependen del % de cristalinidad. – El tratamiento térmico hace que crezcan las regiones cristalinas y que aumente el porcentaje de cristalinidad. amorphous region Fig. 14.11, Callister 6e. (From H.W. Hayden, W.G. Moffatt, and J. Wulff, The Structure and Properties of Materials, Vol. III, Mechanical Behavior, John Wiley and Sons, Inc., 1965.) Introducción a la Ingeniería en Materiales Hasta aquí esta sección. Recuerda que si tienes alguna consulta puedes realizarla en el foro que se generará para esta sección. Introducción a la Ingeniería en Materiales