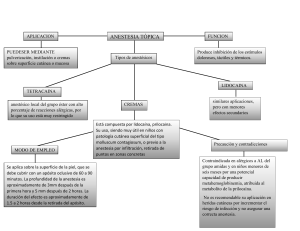
(Anestesia y analgesia) Manual de anestesia y analgesia en pequeñas especies
Anuncio

Manual de anestesia y analgesia en pequeñas especies ZZZPHGLOLEURVFRP EL LIBRO MUERE CUANDO LO FOTOCOPIA AMIGO LECTOR: La obra que usted tiene en sus manos posee un gran valor. En ella, su autor ha vertido conocimientos, experiencia y mucho trabajo. El editor ha procurado una presentación digna de su contenido y está poniendo todo su empeño y recursos para que sea ampliamente difundida, a través de su red de comercialización. Al fotocopiar este libro, el autor y el editor dejan de percibir lo que corresponde a la inversión que ha realizado y se desalienta la creación de nuevas obras. Rechace cualquier ejemplar “pirata” o fotocopia ilegal de este libro, pues de lo contrario estará contribuyendo al lucro de quienes se aprovechan ilegítimamente del esfuerzo del autor y del editor. La reproducción no autorizada de obras protegidas por el derecho de autor no sólo es un delito, sino que atenta contra la creatividad y la difusión de la cultura. Para mayor información comuníquese con nosotros: PRIMERA EDICIÓN EN ESPAÑOL TRADUCIDA DE LA SEGUNDA EDICIÓN DEL INGLÉS Manual de anestesia y analgesia en pequeñas especies Kurt A. Grimm William J. Tranquilli Leigh A. Lamont Traducido por: Biol. Juan Roberto Palacios Martínez Universidad Autónoma de Baja California Editor responsable: Dr. Carlos Mendoza Murillo Editorial El Manual Moderno Nos interesa su opinión, comuníquese con nosotros: Editorial El Manual Moderno, S.A. de C.V., Av. Sonora núm. 206, Col. Hipódromo, Deleg. Cuauhtémoc, 06100 México, D.F. (52-55)52-65-11-00 @ [email protected] [email protected] IMPORTANTE Los autores y editores de esta obra se han basado en fuentes confiables, en un esfuerzo por proporcionar información completa y en concordancia con los estándares aceptados a la fecha de la publicación. Sin embargo, en vista de la posibilidad de errores humanos o cambios en las ciencias médicas, no garantizan que el contenido sea exacto o completo en todos los aspectos y no se hacen responsables de errores, omisiones o resultados obtenidos por el uso de la información proporcionada en esta publicación. Se invita a los lectores a corroborar con otras fuentes de divulgación científica la información aquí presentada. Ésta es una traducción de: Essentials of Small Animal Anesthesia and Analgesia, 2nd edition Original English edition published by First edition © 1999 by Lippincott, Williams, and Wilkins Copyright © 2011 by John Wiley & Sons, Inc. ISBN: 13:978-0-8138-1236-6 Para mayor información en: • Catálogo del producto • Novedades • Distribuciones y más www.manualmoderno.com Manual de anestesia y analgesia en pequeñas especies D.R. © 2013 por Editorial El Manual Moderno, S.A. de C.V. ISBN: 978-607-448-359-8 ISBN: 978-607-448-360-4 versión electrónica Miembro de la Cámara Nacional de la Industria Editorial Mexicana, Reg. núm. 39 “All rights reserved. Authorised translation from the English language edition published by Blackwell Publishing Limited. Responsibility for the accuracy of the translation rests solely with Editorial El Manual Moderno, S.A. de C.V. and is not the responsibility of Blackwell Publishing Limited. No part of this book may be reproduced in any form without the written permission of the original copyright holder, Blackwell Publishing Limited.” “Todos los derechos reservados. Traducción autorizada de la edición en inglés publicada por Blackwell Publishing Limited. La responsabilidad de la traducción únicamente es de la Editorial El Manual Moderno, S.A. de C.V. y no de Blackwell Publishing Limited. Ninguna parte de este libro podrá ser reproducida sin la autorización por escrito del titular del copyright original, Blackwell Publishing Limited.” Manual de anestesia y analgesia en pequeñas especies / [coordinadores] Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont ; traducido por Juan Roberto Palacios Martínez. –- Primera edición. -- México : Editorial El Manual Moderno, 2013. xiii, 572 páginas : ilustraciones ; 23 cm. Traducción de: Essentials of small animal anesthesia and analgesia. -- 2nd ed. Incluye índice ISBN 978-607-448-359-8 ISBN 978-607-448-360-4 (versión electrónica) 1. Anestesia veterinaria – Manuales, etc. 2. Analgesia – Manuales, etc. 3. Mascotas – Cirugía – Manuales, etc. I. Grimm, Kurt A. II. Tranquilli, William J. III. Lamont, Leigh A. IV. Palacios Martínez, Juan Roberto, traductor. 636.0897-scdd21 Biblioteca Nacional de México Director editorial y de producción: Dr. José Luis Morales Saavedra Editora asociada: Lic. Vanessa Berenice Torres Rodríguez Revisión técnica: MVZ. María Luisa Botello Montiel Universidad Autónoma Metropolitana, Xochimilco. Diseño de portada: DP. Cinthya Karina Oropeza Heredia Contenido Colaboradores..........................................................................................................................VII Colaboradores de Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition........................................................................................ VIII Prefacio.....................................................................................................................................XII 1 Valoración del paciente y manejo de riesgos.....................................................................3 William W. Muir, Steve C. Haskins y Mark G. Papich 2 Fisiología y farmacología anestésicas............................................................................... 15 William W. Muir, Wayne N. McDonell, Carolyn L. Kerr, Kurt A. Grimm, Kip A. Lemke, Keith R. Branson, Hui-Chu Lin, Eugene P. Steffey, Khursheed R. Mama, Elizabeth A. Martinez y Robert D. Keegan 3 Fisiología, farmacología y tratamiento del dolor............................................................82 Peter W. Hellyer, Sheilah A. Robertson, Anna D. Fails, Leigh A. Lamont, Karol A. Mathews, Roman T. Skarda, Maria Glowaski, Dianne Dunning y Duncan X. Lascelles 4 Tratamiento del dolor crónico........................................................................................ 147 Duncan X. Lascelles y James S. Gaynor 5 Equipo de anestesia..........................................................................................................158 Craig Mosley 6 Vigilancia del paciente.....................................................................................................197 Steve C. Haskins 7 Equilibrio ácido–base y fluidoterapia............................................................................240 William W. Muir , Helio S.A. de Morais y David C. Seeler 8 Manejo anestésico de perros y gatos..............................................................................274 Richard M. Bednarski 9 Anestesia e inmovilización de mamíferos pequeños..................................................... 300 Paul A. Flecknell, Claire A. Richardson, Aleksandar Popovic, Rachael E. Carpenter y David B. Brunson V VI Manual de anestesia y analgesia en. . 10 Anestésicos locales y técnicas analgésicas regionales...................................................326 Roman T. Skarda y William J. Tranquilli 11 Anestesia para pacientes con enfermedad cardiovascular........................................... 378 Tamara L. Grubb and Stephen A. Greene 12 Anestesia para pacientes con afección respiratoria o de vías respiratorias................................................................................ 387 Tamara L. Grubb y Stephen A. Greene 13 Anestesia para pacientes con enfermedad neurológica................................................ 400 Stephen A. Greene y Tamara L. Grubb 14 Anestesia para animales pequeños con enfermedad renal...........................................412 Stuart Clark-Price 15 Anestesia para pacientes con enfermedad hepática..................................................... 422 Fernando Garcia 16 Anestesia para pacientes con enfermedad gastrointestinal.........................................434 Jennifer G. Adams 17 Anestesia para pacientes con trastornos endocrinos....................................................455 Stephen A. Greene y Tamara L. Grubb 18 Consideraciones anestésicas para intervenciones especiales........................................................................................461 Marjorie E. Gross, Elizabeth A. Giuliano, Marc R. Raffe, Rachael E. Carpenter, Gwendolyn L. Carroll, David D. Martin, Sandra Manfra Marretta, Glenn R. Pettifer, Tamara L. Grubb, Elizabeth M. Hardie, Victoria M. Lukasik, Janyce L. Cornick-Seahorn, Jennifer B. Grimm y Steven L. Marks 19 Urgencias y accidentes en anestesia............................................................................... 509 A. Thomas Evans y Deborah V. Wilson Índice......................................................................................................................................... 529 Este libro cuenta con un sitio web con preguntas de repaso disponibles en línea en: www.manualmoderno.com/grimm Colaboradores Los siguientes autores aportaron materiales nuevos para este libro: Jennifer G. Adams, DVM, ACVIM(LA), ACVA 1341 Buford Carey Road Hull, Georgia 30646 Stuart Clark-Price, DVM, MS, DACVIMLA, DACVA University of Illinois Veterinary Teaching Hospital Urbana, IL 61802 Fernando Garcia, DVM, MS, DACVA Department of Small Animal Clinical Sciences College of Veterinary Medicine Michigan State University East Lansing, MI 48824-1314 Stephen A. Greene, DVM, MS, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Washington State University Pullman, WA 99164-6610 Tamara L. Grubb, DVM, MS, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Washington State University Pullman, WA 99164 Craig Mosley, DVM, MSc, DACVA Canada West Veterinary Specialists and Critical Care Hospital Vancouver, Canada V5M 4Y3 VII Colaboradores Este libro fue refinado y revisado a partir de material proporcionado a Lumb and Jones’ Veterinary Anesthesia and Analgesia, cuarta edición por los siguientes autores:* Richard M. Bednarski, DVM, MS, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Ohio State University Columbus, OH 43210 Keith R. Branson, DVM, MS, DACVA Department of Medicine and Surgery College of Veterinary Medicine University of Missouri Columbia, MO 65211 David B. Brunson, DVM, MS, DACVA Department of Surgical Sciences School of Veterinary Medicine University of Wisconsin Madison, WI 53711 Rachael E. Carpenter, DVM Department of Veterinary Clinical Medicine College of Veterinary Medicine University of Illinois Urbana, IL 61802 Gwendolyn L. Carroll, DVM, MS, DACVA Department of Small Animal Clinical Sciences College of Veterinary Medicine and Biomedical Sciences Texas A & M University College Station, TX 77843-4474 * Janyce L. Cornick-Seahorn, DVM, MS, DACVA, DACVIM Equine Veterinary Specialists Georgetown, KY 40324 Helio S. A. de Morais, DVM, PhD, DACVIM Department of Medical Sciences School of Veterinary Medicine University of Wisconsin Madison, WI 53706 Dianne Dunning, DVM, MS, DACVS College of Veterinary Medicine North Carolina State University Raleigh, NC 27606 A. Thomas Evans, DVM, MS, DACVA Veterinary Clinical Center Michigan State University East Lansing, MI 48824 Anna D. Fails, DVM, PhD, DACVIM Department of Biomedical Sciences College of Veterinary Medicine and Biomedical Sciences Colorado State University Fort Collins, CO 80523 Nota: Las afiliaciones de muchos autores han cambiado desde que se publicó la cuarta edición de Lumb & Jones’ Veterinary Anesthesia and Analgesia. VIII Colaboradores Paul A. Flecknell, VetMB, PhD, DECLAM, DECVA Comparative Biology Centre Newcastle University Newcastle upon Tyne, UK NE2 4HH James S. Gaynor, DVM, MS, DACVA Animal Anesthesia and Pain Management Center Colorado Springs, CO 80918 Elizabeth A. Giuliano, DVM, MS, DACVO Department of Medicine and Surgery College of Veterinary Medicine University of Missouri–Columbia Columbia, MO 65211 Maria Glowaski, DVM, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Ohio State University Columbus, OH 43210-1089 Stephen A. Greene, DVM, MS, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Washington State University Pullman, WA 99164-6610 Jennifer B. Grimm, DVM, MS, DACVR Veterinary Specialist Services, PC Conifer, CO 80433-0504 IX Tamara L. Grubb, DVM, MS, DACVA Pfizer Animal Health Uniontown, WA 99179 Elizabeth M. Hardie, DVM, PhD, DACVS Department of Clinical Sciences College of Veterinary Medicine North Carolina State University Raleigh, NC 27606 Steve C. Haskins, DVM, MS, DACVA, DACVECC Department of Surgical and Radiological Sciences School of Veterinary Medicine University of California Davis, CA 95616 Peter W. Hellyer, DVM, MS, DACVA College of Veterinary Medicine and Biomedical Sciences Colorado State University Fort Collins, CO 80523 Robert D. Keegan, DVM, DACVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Washington State University Pullman, WA 99164 Kurt A. Grimm, DVM, PhD, DACVA, DACVP Veterinary Specialist Services, PC Conifer, CO 80433-0504 Carolyn L. Kerr, DVM, DVSc, PhD, DACVA Department of Clinical Studies Ontario Veterinary College University of Guelph Guelph, Canada N1G 2W1 Marjorie E. Gross, DVM, MS, DACVA Department of Clinical Medicine College of Veterinary Medicine Oklahoma State University Stillwater, OK 74078-2005 Leigh A. Lamont, DVM, MS, DACVA Department of Companion Animals Atlantic Veterinary College University of Prince Edward Island Charlottetown, Canada C1A 4P3 X Manual de anestesia y analgesia en. . Duncan X. Lascelles, BVSc, PhD, DECVS, DACVS Department of Clinical Sciences College of Veterinary Medicine North Carolina State University Raleigh, NC 27606 Kip A. Lemke, DVM, MS, DACVA Department of Companion Animals Atlantic Veterinary College University of Prince Edward Island Charlottetown, Canada C1A 4P3 Hui-Chu Lin, DVM, MS, DACVA Department of Clinical Sciences College of Veterinary Medicine Auburn University Auburn, AL 36849 Victoria M. Lukasik, DVM, DACVA Southwest Veterinary Anesthesiology Southern Arizona Veterinary Specialty Center Tucson, AZ 85705 Khursheed R. Mama, DVM, DACVA Department of Clinical Sciences College of Veterinary Medicine and Biological Sciences Colorado State University Fort Collins, CO 80523-1620 Sandra Manfra Marretta, DVM, DAVDC Department of Veterinary Clinical Medicine College of Veterinary Medicine University of Illinois Urbana, IL 61802 Steven L. Marks, BVSc, MS, DACVIM Department of Clinical Sciences College of Veterinary Medicine North Carolina State University Raleigh, NC 27606 David D. Martin, DVM, DACVA Veterinary Operations Companion Animal Division Pfizer Animal Health New York, NY Elizabeth A. Martinez, DVM, DACVA Department of Small Animal Clinical Sciences College of Veterinary Medicine and Biomedical Sciences Texas A & M University College Station, TX 77843-4474 Karol A. Mathews, DVM, DVSc, DACVECC Department of Clinical Studies Ontario Veterinary College University of Guelph Guelph, Canada N1G 2W1 Wayne N. McDonell, DVM, PhD, DACVA Department of Clinical Studies Ontario Veterinary College University of Guelph Guelph, Canada N1G 2W1 William W. Muir, DVM, PhD, DACVA, DACVECC Department of Veterinary Clinical Sciences College of Veterinary Medicine Ohio State University Columbus, Ohio 43210 Mark G. Papich, DVM, MS, DACVCD Department of Molecular Biomedical Sciences College of Veterinary Medicine North Carolina State University Raleigh, NC 27606 Glenn R. Pettifer, DVM, DVSc, DACVA Veterinary Emergency Clinic and Referral Centre Toronto, Canada M4W 3C7 Colaboradores Aleksandar Popovic, DVM, Cert LAS Merck Frosst Centre for Therapeutic Research Kirkland, Canada H9H 3l1 Marc R. Raffe, DVM, MS, DACVA, DACVECC Department of Veterinary Clinical Medicine College of Veterinary Medicine University of Illinois Urbana, IL 61802 Claire A. Richardson, BVM&S Comparative Biology Centre Newcastle University Medical School Newcastle upon Tyne, UK NE2 4HH Sheilah A. Robertson, BVM & S, PhD, DACVA Department of Small Animal Clinical Sciences College of Veterinary Medicine University of Florida Gainesville, FL 32610 David C. Seeler, DVM, MSc, DACVA Department of Companion Animals Atlantic Veterinary College University of Prince Edward Island Charlottetown, Canada, C1A 4P3 XI Roman T. Skarda (finado), DMV, PhD, DACVA, DECVA Department of Veterinary Clinical Sciences College of Veterinary Medicine Ohio State University Columbus, OH 43210-1089 Eugene P. Steffey, VMD, PhD, DACVA, DECVA Department of Surgical and Radiological Sciences School of Veterinary Medicine University of California Davis, CA 95616 William J. Tranquilli, DVM, MS, DACVA Department of Veterinary Clinical Medicine College of Veterinary Medicine University of Illinois Urbana, IL 61802 Deborah V. Wilson, BVSc, MS, DACVA Department of Large Animal Clinical Sciences College of Veterinary Medicine Michigan State University East Lansing, MI 48824 Prefacio Esta edición del Manual de Anestesia y analgesia en pequeñas especies, es el acompañante de Lumb and Jones’ Veterinary Anesthesia and Analgesia, cuarta edición, recientemente aparecido. Su principal objetivo es presentar a los veterinarios y estudiantes las bases de farmacología, fisiología y manejo de casos clínicos aplicables a anestesia y analgesia de pequeñas especies. Los editores han incluido lo más relevante de los capítulos que abordan farmacología, valoración del paciente y vigilancia en Lumb and Jones’ Veterinary Anesthesia and Analgesia, cuarta edición. Los lectores tal vez deseen recurrir a esos capítulos para profundizar en el tema o en busca de referencias no incluidas en el Manual de Anestesia y analgesia en pequeñas especies. Además, varios autores aportaron nuevos capítulos sobre equipo y atención de pacientes con trastornos específicos en Lumb and Jones’ Veterinary Anesthesia and Analgesia, cuarta edición. Tales capítulos tienen referencias detalladas y aportan diferentes perspectivas sobre manejo de casos clínicos. Los editores desean expresar su gratitud a todos los autores que aportaron materiales para los capítulos originales de Lumb and Jones Veterinary Anesthesia and Analgesia, cuarta edición, así como a los nuevos autores que hacen contribuciones al presente libro. El Dr. Steven Greene merece un especial agradecimiento por ayudar con la coordinación y edición de los capítulos sobre tratamiento de pacientes con condiciones específicas. Los editores también desean agradecer a los profesionales de Wiley-Blackwell, y de manera específica a Erica Judisch, Nancy Turner y Susan Engelken por su ayuda con este proyecto. Por último, nunca será suficiente el reconocimiento de los autores a sus familias por su paciencia, comprensión y amor cuando el trabajo los aleja de ellas. Kurt A. Grimm Leigh A. Lamont William J. Tranquilli XII © Editorial El manual moderno Fotocopiar sin autorización es un delito. Manual de anestesia y analgesia en pequeñas especies Segunda edición 1 Capítulo 1 Valoración del paciente y manejo de riesgos William W. Muir, Steve C. Haskins y Mark G. Papich Introducción El objetivo de la anestesia es inducir inconciencia reversible, amnesia, analgesia e inmovilidad con objeto de realizar intervenciones intracorporales. Sin embargo, la administración de fármacos anestésicos, la inconciencia, el decúbito y la inmovilidad ponen en riesgo la homeostasia del paciente. Las crisis anestésicas son impredecibles y tienden a ser de inicio rápido y naturaleza devastadora. El objetivo de la vigilancia es alcanzar las metas terapéuticas al mismo tiempo que se maximiza la seguridad de la intervención anestésica. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración preanestésica Es necesario examinar todos los aparatos y sistemas e identificar anomalías. La exploración física e historia clínica determinan en qué medida se requieren pruebas de laboratorio e intervenciones especiales. En todos los casos, salvo en las urgencias extremas, debe determinarse de manera sistemática el hematócrito y la concentración plasmática de proteína. Según sean la historia clínica y la exploración física, otras valoraciones pueden ser: biometría hemática completa; análisis de orina; química sanguínea para determinar el funcionamiento renal y hepático, gases en sangre y pH; electrocardiografía; tiempo de coagulación y recuento de plaquetas; coprocultivo o búsqueda de filarias; y determinaciones de electrólitos sanguíneos. Tal vez estén indicados también estudios radiológicos o ecográficos. Después de la exploración, el estado físico del paciente (estado general de salud) se somete a la clasificación de la American Society of Anesthesiologists (ASA) (cuadro 1-1). Este ejercicio mental obliga al anestesiólogo a valorar la condición del paciente y resulta valioso para la selección apropiada de los anestésicos. La clasificación de la salud general es parte esencial de cualquier sistema de registro anestésico. La exploración física preliminar debe efectuarse en presencia del propietario, cuando es posible, de modo que el pronóstico pueda comunicársele de manera personal. Esto permite al cliente hacer preguntas y al veterinario comunicar los riesgos de la anestesia y disipar los temores del paciente acerca del tratamiento. Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A.Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 3 Manual de anestesia y analgesia en. . 4 Cuadro 1-1. Categoría Clasificación del estado físicoa Estado físico Posibles ejemplos de esta categoría I Pacientes sanos normales Enfermedad no discernible; animales programados para ovariohisterectomía, recorte de orejas, caudectomía o castración II Pacientes con enfermedad sisté- Tumor cutáneo, fractura sin choque, hernia no mica leve complicada, criptorquidectomía, infección localizada o cardiopatía compensada III Pacientes con enfermedad sisté- Fiebre, deshidratación, anemia, caquexia o himica grave povolemia moderada IV Pacientes con enfermedad sisté- Uremia, toxemia, deshidratación e hipovolemia mica grave que amenaza de for- graves, anemia, descompensación cardiaca, ma constante la vida emaciación, o fiebre alta V Pacientes moribundos que es im- Choque y deshidratación extremos, cáncer o inprobable que sobrevivan un día, fección terminales, traumatismo grave con o sin operación a Esta clasificación es la adoptada por la ASA. Fuentes: Muir W.W. 2007. Considerations for general anesthesia. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 17. El diagnóstico y tratamiento del dolor requiere la identificación de sus consecuencias, una comprensión fundamental de los mecanismos causantes de su producción, y reconocimiento práctico de los fármacos analgésicos disponibles. Se han desarrollado métodos semiobjetivos y objetivos conductuales, numéricos y categórico para la caracterización del dolor, entre ellos la escala analógica visual (EAV) que ha ganado gran aceptación. En condiciones ideales, el tratamiento del dolor debe dirigirse a los mecanismos que lo producen (tratamiento multimodal) y considerar, cuando sea posible, el comienzo de las medidas terapéuticas antes del inicio del dolor (analgesia preventiva). La American Animal Hospital Association (AAHA) ha desarrollado lineamientos para la valoración, diagnóstico y tratamiento del dolor, los cuales deben adoptar todos los veterinarios (cuadro 1-2). Valoración preanestésica del estrés Tanto el dolor agudo como el crónico pueden producir estrés. El dolor no tratado puede iniciar una serie amplia y potencialmente destructiva de episodios caracterizados por desregulación neuroendocrina, fatiga, disforia, mialgia, comportamiento anómalo y alteración del desempeño físico. Incluso sin un estímulo doloroso, algunos factores ambientales (ruido intenso, restricción o presencia de un depredador) pueden causar un estado de ansiedad o temor que sensibiliza al sujeto y amplifica la respuesta al estrés. El malestar, una forma exagerada de estrés, se presenta cuando el costo biológico del estrés afecta las funciones biológicas críticas para la supervivencia. Por lo tanto, el dolor debe considerarse en términos de respuesta al estrés y potencial para el desarrollo de malestar. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración preanestésica del dolor Valoración del paciente y. . . Cuadro 1-2. 5 Normas de la AAHA para controlar el dolor 1. 2. 3. 4. 5. 6. 7. 8. Valoración del dolor en todos los pacientes sin importar la molestia de presentación Valoración del dolor mediante escala/puntaje estandarizados, y anotados en el registro médico El manejo del dolor se individualiza La práctica recurre al control preventivo del dolor Se proporciona control apropiado para el grado esperado de dolor Se aplica control del dolor por la duración esperada de éste Se tranquiliza al paciente con dolor durante toda la intervención potencialmente dolorosa Los pacientes con enfermedad persistente o recurrente se evalúan para determinar sus necesidades de manejo del dolor 9. El tratamiento analgésico se utiliza como un recurso para confirmar la existencia de un trastorno doloroso cuando se sospecha el dolor pero no puede confirmarse por métodos objetivos. 10. Se emplea un protocolo escrito de control del dolor 11. Cuando el control del dolor es parte del plan terapéutico, se educa de manera eficaz al cliente Fuentes: Muir W.W. 2007. Considerations for general anesthesia. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 19, y AAHA, Lakewood, CO. El aumento de la eferencia simpática central eleva el gasto cardiaco y la presión arterial, además de causar piloerección y dilatación pupilar. La secreción de catecolaminas desde la médula suprarrenal y de noradrenalina a partir de terminales nerviosas simpáticas posganglionares incrementa estos efectos centrales. En última instancia, la observación de los cambios en el comportamiento de un animal puede ser el método menos traumático y más prometedor para vigilar la gravedad del dolor que éste sufre y el estrés asociado. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Preparación del paciente Ayuno preanestésico Con demasiada frecuencia, las operaciones se practican sin que el paciente se haya sometido a una preparación adecuada. En la mayor parte de los tipos de anestesia general es mejor suspender el alimento 12 h antes. Algunas especies toleran mal el ayuno. Las aves, recién nacidos y mamíferos pequeños pueden sufrir hipoglucemia tras el ayuno de unas cuantas horas y la movilización de las reservas de glucógeno pueden alterar el metabolismo y depuración de los fármacos. De ser posible, debe evitarse la inducción de anestesia en animales con el estómago lleno, debido a los peligros de la aspiración. Fluidoterapia preanestésica En la mayor parte de las especies se permite que el paciente beba hasta el momento de la administración de preanestésicos. Debe recordarse que muchos animales viejos tienen afectación renal clínica o subclínica. Si bien en condiciones ideales estos animales permanecen compensados, el estrés de la hospitalización, privación de agua y anestesia, incluso si no se trata de una operación, pueden causar descompensación aguda. Es mejor establecer un estado de diuresis leve con líquido intravenoso en pacientes nefróticos antes de la administración de anestésicos. 6 Manual de anestesia y analgesia en. . Los animales deshidratados se tratan con líquidos y alimentación apropiada antes de la operación; la fluidoterapia debe continuarse según se requiera. Debe intentarse correlacionar el equilibrio electrolítico del paciente con el tipo de líquido administrado. La anemia e hipovolemia, determinadas por medios clínicos y hematológicos, se corrigen administrado sangre entera o productos hemáticos y soluciones electrolíticas equilibradas. Los pacientes en choque sin pérdida de sangre o en estado de deficiencia nutricional se benefician de la administración de plasma o expansores plasmáticos. En cualquier caso, es una práctica anestésica correcta suministrar líquido intravenoso durante la anestesia para ayudar a mantener volemia y diuresis adecuadas, a fin de contar con una vía para administrar fármacos. Administración de antibióticos profilácticos La administración sistémica de antibióticos es una medida profiláctica útil antes de una operación mayor o cuando se anticipa la contaminación del sitio operatorio. Lo ideal es administrar antibióticos alrededor de 1 h antes de la inducción de la anestesia. Oxigenación y ventilación Cardiopatía La cardiopatía descompensada es una contraindicación relativa para la anestesia general. Si es necesario anestesiar, debe intentarse la estabilización del paciente con la administración de inotrópicos, antiarrítmicos y diuréticos apropiados antes de la anestesia. Si hay ascitis, es posible aspirar el líquido para reducir la presión excesiva contra el diafragma. Enfermedad hepatorrenal En casos de insuficiencia hepática o renal grave, debe considerarse el modo de eliminación del anestésico, y a menudo son preferibles los anestésicos inhalados. Es deseable alentar la defecación, la micción o ambas inmediatamente antes de la inducción, para lo cual se traslada a los animales a un patio de carrera o ejercicio. Colocación del paciente Durante la anestesia, siempre que sea posible, se sujeta al paciente en posición fisiológica normal. La compresión del tórax, angulación aguda del cuello, extensión excesiva o compresión © Editorial El manual moderno Fotocopiar sin autorización es un delito. Varias alteraciones pueden restringir gravemente la oxigenación y ventilación eficaces. Entre ellas se incluyen: obstrucción de vías respiratorias superiores por masas o abscesos, neumotórax, hemotórax, piotórax, quilotórax, hernia diafragmática y distensión gástrica. Los animales afectados se encuentran a menudo en un estado marginal de oxigenación. Está indicada la administración de oxígeno por cánula nasal o mascarilla si el paciente lo acepta. Es necesario extraer por toracocentesis el aire o el líquido intrapleurales antes de la inducción, ya que el volumen pulmonar efectivo puede estar muy reducido y es posible que ocurra dificultad respiratoria grave al momento de la inducción. Los anestesiólogos deben estar preparados para realizar todas las fases de inducción, intubación y ventilación controlada en una operación continua. Valoración del paciente y. . . 7 de las extremidades y compresión de la vena cava posterior por vísceras grandes pueden causar complicaciones graves, como hipoventilación, daño de nervios o músculos, y deterioro del retorno venoso. La inclinación de los pacientes anestesiados altera la cantidad de gases respiratorios que el tórax puede contener (capacidad residual funcional [CRF]) hasta en 26%. En perros que sufren hemorragia, inclinarlos con la cabeza arriba (posición de Trendelenburg inversa) ha resultado perjudicial, dado que causa hipotensión, hiperpnea y depresión de la fuerza contráctil cardiaca. Cuando se ha inclinado a los perros con la cabeza abajo (posición de Trendelenburg) no se observa mejoría de la circulación. En la mayor parte de las especies, la cabeza debe extenderse para despejar las vías respiratorias e impedir la obstrucción de la sonda endotraqueal. Selección de anestésicos y analgésicos La selección de un anestésico se basa en la determinación de varios factores, como los siguientes: © Editorial El manual moderno Fotocopiar sin autorización es un delito. 1) Especie, raza y edad del paciente 2) Estado físico del paciente 3) Tiempo necesario para la intervención quirúrgica (o de otra naturaleza), su tipo y gravedad, y habilidad del cirujano 4) Familiaridad con la técnica anestésica propuesta 5) Equipo y personal disponibles En general, los veterinarios tendrán mayor éxito con los fármacos que usan con más frecuencia y con los que están más familiarizados. Las habilidades de administración y vigilancia sólo se desarrollan con la experiencia; por tanto, el cambio de un fármaco familiar a otro nuevo suele acompañarse de un incremento temporal del riesgo anestésico. El tiempo necesario para una intervención quirúrgica y la cantidad de ayuda disponible durante este periodo determinan a menudo la anestesia a usar. En general, las intervenciones más cortas se realizan con fármacos de acción breve, como propofol, alfaxalona CD y etomidato, o con combinaciones en que intervienen fármacos disociativos, tranquilizantes u opioides. Cuando se requiere anestesia más prolongada, se prefieren técnicas anestésicas por inhalación o equilibradas. Interacciones medicamentosas Cuando administran anestesia y analgesia a animales, los veterinarios usan con frecuencia combinaciones de fármacos sin reconocer del todo las interacciones potenciales. Son posibles muchas interacciones medicamentosas, tanto benéficas (con el resultado de una disminución del riesgo anestésico) como adversas (que incrementan el riesgo anestésico). Aunque la mayoría de los veterinarios considera indeseables las interacciones medicamentosas, la práctica moderna de anestesia y analgesia hace hincapié en su uso en beneficio del paciente (anestesia o analgesia multimodales). Debe distinguirse entre las interacciones medicamentosas que ocurren in vitro (p. ej., en una jeringa o ampolleta) y las que suceden in vivo (en los pacientes). Los veterinarios mezclan con frecuencia fármacos en jeringas, ampolletas o bolsas de suero antes de administrarlos a sus 8 Manual de anestesia y analgesia en. . pacientes. Las reacciones in vitro, también llamadas interacciones farmacéuticas, pueden formar un precipitado o producto tóxico, o desactivar uno de los fármacos en la mezcla. También son posibles interacciones in vivo, que afectan la farmacocinética (absorción, distribución o biotransformación) o la farmacodinamia (mecanismo de acción) de los fármacos y pueden potenciar o reducir las acciones farmacológicas o aumentar la incidencia de efectos adversos. Algunos términos de uso común para describir las interacciones medicamentosas son adición, antagonismo, sinergia y potenciación. Desde el punto farmacológico, y tras considerar sólo las implicaciones teóricas, la adición se refiere a la simple aditividad de dosis fraccionarias de dos o más fármacos, en la cual la fracción se expresa respecto de la dosis de cada fármaco necesaria para producir la misma magnitud de respuesta; es decir, respuesta a X cantidad del fármaco A = respuesta a Y cantidad del fármaco B = respuesta a ½XA + ½YB, ¼XA + ¾YB. La aditividad es un fuerte apoyo a la presuposición de que los fármacos A y B actúan por el mismo mecanismo (p. ej., en los mismos receptores). Los ensayos de unión a receptor in vitro aportan datos confirmatorios. Las fracciones de concentración alveolar mínima (CAM) para anestésicos inhalables son aditivas. Todos los fármacos inhalables tienen mecanismos de acción similares, pero al parecer no actúan en receptores específicos. La sinergia se refiere a la situación en que la respuesta a dosis fraccionarias descrita antes es mayor que la respuesta a la suma de las dosis fraccionarias (p. ej., ½XA + ½YB produce una respuesta mayor que XA o YB). La potenciación es el aumento del efecto de un fármaco por un segundo fármaco que no tiene acción detectable por sí solo. El antagonismo se refiere a la acción opuesta de un fármaco contra otro. El antagonismo puede ser competitivo o no competitivo. En el primero, agonista y antagonista compiten por el mismo sitio receptor. Hay antagonismo no competitivo cuando agonista y antagonista actúan a través de diferentes receptores. El modo en que suelen administrarse los anestésicos plantea consideraciones especiales con respecto a las interacciones medicamentosas. Por ejemplo, 1) suelen usar fármacos que actúan con rapidez; 2) las respuestas a los fármacos administrados se miden, con frecuencia de manera muy precisa; 3) a menudo se recurre al antagonismo medicamentoso; y 4) las dosis o concentraciones de fármacos se ajustan por lo general con base en su efecto. Aumentos o decrementos menores de las respuestas tienen pocas consecuencias y se observan con regularidad. Interacciones farmacológicas de anestésicos de uso común Con frecuencia se usan dos o más tipos diferentes de agentes neuroactivos inyectables con el objetivo de inducir una mejor calidad de anestesia con efectos secundarios mínimos. Los fármacos tienen a menudo efectos complementarios en el encéfalo, pero es posible que uno de ellos también antagonice un efecto indeseable de otro. Ejemplos de estas combinaciones son tiletamina y zolazepam o ketamina y midazolam. Tiletamina y ketamina producen sedación, inmovilidad, amnesia y analgesia diferencial, pero también pueden causar rigidez muscular y convulsiones tonicoclónicas. Zolazepam y midazolam provocan sedación, reducen la ansiedad y minimizan la probabilidad de rigidez muscular y convulsiones. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Nomenclatura Valoración del paciente y. . . 9 Para tratar mejor el dolor relacionado con la cirugía, cada vez es más común combinar los analgésicos de administración regional con la anestesia general ligera (anestesia crepuscular). Un ejemplo de este método es la administración de un anestésico local solo o combinado con opioide o un agonista a2-adrenérgico en el espacio epidural antes o durante la anestesia general. Los beneficios de esta técnica son la reducción de la cantidad de anestesia general necesaria y la inducción de analgesia preventiva. Al reducir los requerimientos de anestesia general disminuye el potencial de efectos secundarios sistémicos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Interacciones entre opioides En años recientes ha confusión acerca de la posibilidad de que la administración de agonistas de opioides con agonistas/antagonistas produzca una interacción que atenúe el efecto analgésico de la combinación. En teoría, fármacos como butorfanol y nalbufina tienen propiedades antagonistas en el receptor m, de modo que deben revertir en parte algunos efectos sobre los agonistas del receptor m (p. ej., morfina) cuando se administran juntos. Sin embargo, las implicaciones clínicas de este antagonismo se han objetado. Por ejemplo, en perros, si bien el butorfanol revierte en parte la depresión respiratoria y la sedación producidas por los agonistas puros, la eficacia analgésica se preserva casi siempre. De modo similar, en perros que reciben butorfanol para el dolor posoperatorio por cirugía ortopédica, no decrece la eficacia con la administración posterior de oximorfona. No obstante, en otro estudio, los perros que no habían reaccionado al butorfanol después de artrotomía de hombro reaccionaron a la administración posterior de oximorfona, pero la dosis de ésta, es necesaria para producir un efecto mayor del que se habría requerido si la oximorfona se hubiera usado sola, lo cual sugiere que pudo intervenir algún antagonismo de la analgesia. Cuando butorfanol y oximorfona se han administrado juntos a gatos, se ha informado una mayor eficacia respecto de cuando cada fármaco se emplea solo. Estas observaciones clínicas, tomadas en conjunto, indican que puede ocurrir un antagonismo en algunos pacientes clínicos, pero en otros la coadministración en realidad tiene como resultado un efecto analgésico sinérgico. Estos resultados divergentes de un individuo a otro pueden deberse a diversos factores, como: 1) diferencias en el síndrome de dolor que se trata, 2) variación entre especies en la respuesta a opioides, 3) dosificación de los opioides específicos administrados, y 4) variación genéricas en la eficacia de los opioides. Por ejemplo, cuando se observa el primero de estos factores en seres humanos, antagonismo o sinergia con la coadministración de butorfanol y un agonista de opioide puro dependen al parecer de la naturaleza del dolor (somático o visceral). Estos tipos de estudios no se han realizado hasta la fecha en especies comunes de animales de compañía. Riesgo El riesgo se refiere a la incertidumbre y el potencial de un desenlace adverso a consecuencia de anestesia y operación. Debe hacerse hincapié que estado físico, riesgo anestésico y riesgo operatorio son distintos. Cirugías mayores e intervenciones complejas se vinculan con mayor morbilidad y mortalidad en comparación con las operaciones menores. La implicación de órganos vitales aumenta el riesgo: las operaciones en sistema nervioso central (SNC), corazón y pulmones poseen el máximo riesgo, seguidas de las realizadas en tubo digestivo, hígado, riñones, órganos reproductivos, 10 Manual de anestesia y analgesia en. . músculos, hueso y piel. Las intervenciones de urgencia son más peligrosas debido a inestabilidad o afección grave de la homeostasia y menor oportunidad para preparar o estabilizar al paciente y para que el equipo quirúrgico y anestésico se prepare. Las condiciones de operación se refieren a las instalaciones, el equipo físico y el personal de apoyo disponibles. Asimismo, son importantes, la determinación del equipo quirúrgico, experiencia y frecuencia con la que se practica. Por último, también deben considerarse la duración del procedimiento y la fatiga, ya que los pacientes no pueden operarse por tiempo indefinido. Morbilidad y mortalidad aumentan con la duración de la anestesia y la operación. En consecuencia, la eficiencia del equipo quirúrgico es importante para reducir el riesgo. Entre los factores anestésicos que pueden modificar el riesgo se incluyen la elección del anestésico, la técnica anestésica y la duración de la anestesia. La elección del anestésico puede afectar el resultado, pero más a menudo los fármacos no son el problema sino el modo de administrarlos. La experiencia del anestesiólogo con el procedimiento es importante para la administración segura. Vale la pena señalar que el error humano es todavía la causa principal de los problemas relacionados con anestesia y es un factor importante que contribuye al riesgo anestésico. En varios estudios retrospectivos se ha informado una mortalidad perioperatoria de 20 a 189 por 10 000 pacientes que reciben anestésicos. Se ha notificado que la anestesia contribuye con 2.5 a 9.2 muertes por 10 000 pacientes (cuadro 1-3). La mortalidad fue mayor en los pacientes con peor estado físico preoperatorio y mayor edad, justo cuando las reservas biológicas son limitadas, y entre pacientes sometidos a intervenciones de urgencia, en cuyo caso planeación y preparación preoperatorias son limitadas, pero aun así tuvo notable frecuencia en pacientes Complicaciones de la anestesia en especies pequeñas Especies Perro Gato Conejo Cobayo Hurón Criceto Chinchilla Rata Otros mamíferos pequeños Periquito australiano Melopsittacus undulatus Loro Otras aves Reptiles Otros a Número Número de muer- Riesgo de mueren tes relacionadas tes relacionadas riesgo con anestésicos con anestésicos y sedantes y sedantes (%) IC al 95% (%) 98 036 79 178 8 209 1 288 601 246 334 398 232 49 163 189 114 49 2 9 11 8 4 8 0.17 0.24 1.39 3.80 0.33 3.66 3.29 2.01 1.72 16.33 0.14-0.19 0.20-0.27 1.14-1.64 2.76-4.85 0.04-1.20a 1.69-6.83a 1.38-5.21 0.87-3.92a 0.47-4.36a 7.32-29.66a 127 284 134 50 5 5 2 0 3.94 1.76 1.49 0 1.29-8.95a 0.57-4.06a 0.18-5.29a 0-7.11a Intervalo de confianza (IC) exacto al 95%. Fuente: Broadbelt D.C., Blissitt K.J., Hammond R.A., Neath P.J., Young L.E., Pfeiffer D.U., Wood J.L. 2008. The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg 35(5):365-373. Epub May 5, 2008. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 1-3. Valoración del paciente y. . . 11 jóvenes sanos sometidos a procedimientos programados (cuadro 1-4). De las muertes, 1% ocurrió en la premedicación, 6 a 8% en la inducción, 30 a 46% en el periodo intraoperatorio, y 47 a 61% en el posoperatorio (cuadro 1-5). Entre las causas intraoperatorias de muerte se encuentran proceso patológico primario; aspiración; hipovolemia e hipotensión; hipoxia por problemas con vías respiratorias o sonda endotraqueal, o neumotórax; dosificación incorrecta de fármacos; e hipotermia. Entre las causas posoperatorias de muerte figuran el proceso patológico primario, paro Cuadro 1-4. Riesgo de muerte relacionada con anestesia y sedación en perros, gatos y conejos sanos y enfermos Especies Estado de Número de Número Riesgo de IC al 95% (%) saluda muertes rela- calculado de muertes relacionadas con anestesias cionadas con anestesia anestesia y sedación (%) Perro Sano 49 90 618 0.05 0.04-0.07 Enfermo 99 7 418 1.33 1.07-1.60 163 98 036 0.17 0.14-0.19 Globalb Gato Sano 81 72 473 0.11 0.09-0.14 Enfermo 94 6 705 1.40 1.12-1.68 189 79 178 0.24 0.20-0.27 Globalb Conejo Sano 56 7 652 0.73 0.54-0.93 Enfermo 41 557 7.37 5.20-9.54 114 8 209 1.39 1.14-1.64 Globalb a © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sano (ASA I y II): enfermedad perioperatoria ausente o leve; enfermo (ASA III a V): enfermedad preoperatoria grave. b Los riesgos globales incluyen muertes adicionales para las cuales se disponía de información insuficiente (incluido el estado de salud) para excluirlas de la clasificación como relacionadas con la anestesia. Fuente: Broadbelt D.C., Blissitt K.J., Hammond R.A., Neath P.J., Young L.E., Pfeiffer D.U., Wood J.L. 2008. The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg 35(5):365-373. Epub May 5, 2008. Cuadro 1-5. conejos Momento de las muertes relacionadas con anestesia y sedación en perros, gatos y Momento de la muerte Después de la premedicación Inducción de la anestesia Mantenimiento de la anestesia Muerte posoperatoriaa 0 a 3 h después de la operación 3 a 6 h después de la operación 6 a 12 h después de la operación 12 a 24 h después de la operación 24 a 48 h después de la operación Tiempo desconocido Total a Perros (%) 1 (1) 9 (6) 68 (46) 70 (47) 31 11 12 13 3 0 148 (100) Gatos (%) 2 (1) 14 (8) 53 (30) 106 (61) 66 9 7 12 10 2 175 (100) Conejos (%) 0 6 (6) 29 (30) 62 (64) 26 7 13 9 3 4 97 (100) Las muertes posoperatorias se clasificaron además por tiempo después de la anestesia. Los valores porcentuales se proporcionan entre paréntesis. Fuente: Broadbelt D.C., Blissitt K.J., Hammond R.A., Neath P.J., Young L.E., Pfeiffer D.U., Wood J.L. 2008. The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg 35(5):365-373. Epub May 5, 2008. 12 Manual de anestesia y analgesia en. . durante la aspiración por la sonda endotraqueal, aspiración, neumonía e insuficiencia cardiaca (cuadro 1-6). Las demandas presentadas al Professional Liability Insurance Trust de la American Veterinary Medical Association por incidentes anestésicos, quirúrgicos y médicos reflejan el cambio en las tendencias en la práctica veterinaria y la preocupación de los propietarios por una atención óptima de los pacientes (cuadro 1-7). Debe hacerse notar que el porcentaje de demandas por Cuadro 1-6. Causas principales de muerte en perros, gatos y conejos Causa de la muerte Cardiovascular Respiratoria Cardiovascular o respiratoria Neurológica Renal Desconocida Total Perros (%) 34 20 55 7 1 31 148 Gatos (%) (23) (13) (37) (5) (1) (21) (100) 11 16 99 8 6 35 175 (6) (9) (57) (5) (3) (20) (100) Conejos (%) 3 13 22 2 0 57 97 (3) (13) (23) (2) (59) (100) Las muertes se expresan como número de animales (porcentaje del total). Sólo se incluyen casos para los cuales se recibió un cuestionario de casos y testigos. Fuente: Broadbelt D.C., Blissitt K.J., Hammond R.A., Neath P.J., Young L.E., Pfeiffer D.U., Wood J.L. 2008. The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg 35(5):365-373. Epub May 5, 2008. Especies 1976 a 1982 Perros Gatos Caballos Bovinos 1999 a 2003 Perros Gatos Caballos Bovinos 2005 a 30 nov 2010 Perros Gatos Caballos Bovinos Fuente: Datos cortesía de AVMA-PLIT. Total Anestesia (%) Causas médicas (%) Causas quirúrgicas (%) 1 225 216 542 436 13.1 6.5 13.8 3.9 44.4 47.7 44.5 51.8 42.5 45.8 41.7 44.2 6 892 2 135 1 521 727 5.1 7.0 4.5 2.1 41.8 42.2 42.3 29.3 40.7 40.7 37.2 52.4 9 586 2 571 994 385 4.3 6.0 4.9 0.8 35.5 38.3 37.3 24.4 60.3 55.7 57.8 74.8 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 1-7. Tendencias en las demandas relacionadas con anestesia, cirugía y medicina presentadas ante el Professional Liability Insurance Trust de la American Veterinary Medical Association (AVMA-PLIT) Valoración del paciente y. . . 13 anestesia decreció en más de 50% en el caso de perros y caballos de 1982 a 2003, lo cual refleja la complejidad y seguridad crecientes de la anestesia veterinaria durante este periodo. El lector interesado en datos más recientes sobre demandas relacionadas con anestesia puede remitirse a la American Veterinary Medical Association Liability Insurance Trust. Mientras se administren anestésicos, el peligro de muerte nunca podrá eliminarse por completo; sin embargo, puede minimizarse, en especial si se desea investigar y aprender de los errores. Una vez que ha ocurrido una muerte relacionada con un anestésico, debe revisarse la secuencia de los sucesos perioperatorios que precedieron a la muerte y valorar sus implicaciones; se recomienda realizar una necropsia para dilucidar patogenia y las causas. Con base en esta información, el veterinario puede entonces tomar medidas para evitar que el problema recurra. Registros © Editorial El manual moderno Fotocopiar sin autorización es un delito. El American College of Veterinary Anesthesiologists (ACVA) actualizó en fecha reciente sus recomendaciones para la vigilancia anestésica, con la intención de mejorar los cuidados de los pacientes veterinarios. El ACVA reconoce que algunos de los métodos pueden ser imprácticos en determinadas situaciones clínicas y que los pacientes anestesiados pueden vigilarse y tratarse sin equipo especializado. Los aspectos del manejo anestésico abordados por los lineamientos del ACVA que merecen atención cuidadosa son circulación, oxigenación, ventilación, registro y personal. Para obtener datos significativos acerca de la anestesia, debe colectarse determinada información. Se lleva un registro individual para cada animal anestesiado. Entre los puntos que deben anotarse en el registro anestésico del paciente están: 1) 2) 3) 4) 5) 6) 7) 8) Identificación del paciente, especie, raza, edad, sexo, peso y estado físico. Procedimiento quirúrgico u otra causa de la anestesia. Preanestésicos administrados (dosis, vía, hora). Compuestos anestésicos suministrados (dosis, vía, hora). Persona que administra la anestesia (veterinario, técnico, estudiante o lego). Duración de la anestesia. Medidas de mantenimiento. Dificultades encontradas y métodos de corrección. Es necesario que cada paso de la administración de anestésico se anote en un registro anestésico (figura 1-1). Como mínimo, deben vigilarse frecuencia del pulso y respiratoria a intervalos de 5 min y anotarse a intervalos de 10 min. Las tendencias en estos parámetros se tornan evidentes antes de que el estado del paciente se deteriore gravemente, cuando pueden tomarse medidas correctivas. Revisado a partir de “Considerations for General Anesthesia” de William W. Muir; “Monitoring Anesthetized Patients” de Steve C. Haskins; y “Drug Interactions” de Mark G. Papich en Veterinary Anesthesia and Analgesia de Lumb y Jones, cuarta edición. 14 Manual de anestesia y analgesia en. . REGISTRO ANESTÉSICO Fecha: Jaula núm. Cirujano: Intervención(es): Anestesiólogo: INFORMACIÓN DEL PACIENTE FC Fármacos preanestésicos Fármaco Dosis Vía Hora FR Valores preanestésicos MM Temp VCP color Fármacos de inducción Fármaco Dosis Vía PT Estado del animal Peso Hidratación (kg / lb) Estado físico Hora 1 2 4 30 5 E 45 Lect. vaporizador Valoración del DOLOR: ausencia--------------------------------------------------------------------------------El peor posible Hora 00 15 30 45 00 15 30 45 00 15 Anestesia 5.0 4.0 _ Isoflurano 3.0 2.5 _ Sevoflurano 2.0 1.5 _ Otro 1.0 0 Flujo O2 (L/min) 3 CÓDIGOS A Anestesia 200 O Operación 180 C Campos 160 R Recuperación 140 Pulso 120 100 o Respiración 80 ∨ Sistólica 60 ∧ Diastólica 40 - 30 Media ∗ SpO2 20 Δ PCO2 10 τ Temperatura 0 Líquidos tipo _________ mL Total líquidos ________ Hora de extubación ________ Tiempo esternal ________ Temperatura _______ > 36.7 ºC Comentarios: Valoración del DOLOR posoperatoria: ausencia------------------------------------------------------------------------El peor posible Figura 1-1. Ejemplo de registro anestésico. Fuente: Muir W.W. 2007. Considerations for general anesthesia. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 26. © Editorial El manual moderno Fotocopiar sin autorización es un delito. SÍMBOLOS Capítulo 2 Fisiología y farmacología anestésicas William W. Muir, Wayne N. McDonell, Carolyn L. Kerr, Kurt A. Grimm, Kip A. Lemke, Keith R. Branson, Hui-Chu Lin, Eugene P. Steffey, Khursheed R. Mama, Elizabeth A. Martinez y Robert D. Keegan Anatomía y fisiología cardiovasculares © Editorial El manual moderno Fotocopiar sin autorización es un delito. La captación, distribución y eliminación de fármacos anestésicos dependen del flujo sanguíneo. El sistema cardiovascular, constituido por corazón, vasos sanguíneos, vasos linfáticos y sangre, está diseñado para aportar un flujo continuo de sangre a todos los tejidos del organismo. Corazón El corazón está formado por cuatro cámaras: dos aurículas de pared delgada, separadas por un tabique (septo) interauricular, y dos ventrículos de pared gruesa, separados por un tabique interventricular. Las aurículas reciben sangre que retorna de la circulación sistémica (aurícula derecha, AD) y la circulación pulmonar (aurícula izquierda, AI), y en grado limitado actúan como cámaras de almacenamiento. Los ventrículos, principales cavidades de bombeo del corazón, están separadas de las aurículas por la válvula tricúspide en el lado derecho y la válvula mitral en el lado izquierdo. Los ventrículos reciben sangre desde sus respectivas aurículas y la impulsan a través de las válvulas semilunares (válvula pulmonar, entre el ventrículo derecho [VD] y arteria pulmonar, y válvula aórtica, entre el ventrículo izquierdo [VI] y aorta) hacia la circulación pulmonar y la circulación sistémica, respectivamente. Una vez iniciado el proceso de contracción cardiaca, a la contracción casi simultánea de las aurículas le sigue la contracción casi sincrónica de ventrículos, lo cual produce diferencias de presión entre aurículas, ventrículos y circulaciones pulmonar y sistémica. La contracción cardiaca induce cambios de presión diferenciales que dan lugar a la abertura y cierre de las válvulas auriculoventriculares (AV), semilunares y emisión de ruidos cardiacos. Las cuerdas tendinosas, que proceden de músculos papilares situados en la pared interna de las cámaras ventriculares, están unidas a bordes libres de las valvas de las válvulas AV y Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A.Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 15 16 Manual de anestesia y analgesia en. . Vasos sanguíneos Los vasos grandes y pequeños de las circulaciones pulmonar y sistémica facilitan el suministro de sangre a los sitios de intercambio en los lechos capilares pulmonares y sistémicos y el retorno de sangre al corazón. La aorta y otras grandes arterias constituyen la parte de presión elevada de la circulación sistémica y son relativamente rígidas en comparación con las venas, puesto que poseen una gran proporción de tejido elástico respecto de los tejidos de músculo liso y fibrosos. El flujo de sangre a tejidos periféricos durante el ciclo cardiaco (contracción-relajación-reposo) recibe el nombre de efecto de windkessel (de un término alemán que significa “cámara de aire”). Se piensa que el efecto de windkessel representa hasta 50% del flujo de sangre periférica en la mayoría de las especies durante la frecuencia cardiaca (FC) normal. Las taquiarritmias y enfermedades vasculares (vasos rígidos, no elásticos) modifican el efecto de windkessel y producen cambios distintivos en la onda de presión arterial. Las arterias grandes más distales contienen mayores porcentajes de músculo liso en comparación con el tejido elástico y actúan como conductos para la transferencia de sangre a gran presión hacia los tejidos. Las arterias pequeñas, arteriolas terminales y anastomosis arteriovenosas más distales contienen músculo liso de forma predominante, están muy inervadas y funcionan como resistores que regulan la distribución del flujo sanguíneo, ayudan a regular la presión arterial (PA) sistémica y modulan la presión de perfusión tisular. Los capilares son sitios de intercambio funcional para oxígeno, nutrimentos, electrólitos, productos de desecho celulares y otras sustancias. Son de tres tipos distintos: continuos (pulmones y músculo), fenestrados (riñones e intestinos) y discontinuos (hígado, bazo y médula ósea). Las vénulas poscapilares se integran con un recubrimiento endotelial y tejido fibroso, y su función es colectar sangre desde los capilares. Algunas vénulas actúan como esfínteres poscapilares y todas las vénulas se fusionan en venas pequeñas. Las venas pequeñas y mayores contienen cantidades crecientes de tejido fibroso, además de músculo liso y tejido elástico, aunque sus paredes son mucho más delgadas que las de las arterias de tamaño comparable. Muchas venas contienen válvulas que actúan junto con la compresión externa (contracción muscular y diferencias de presión en las cavidades abdominal y torácica) para facilitar el retorno venoso de sangre a la AD. El sistema venoso también actúa como un gran depósito de sangre. En realidad, 60 a 70% del volumen sanguíneo puede almacenarse en la vasculatura venosa sistémica en condiciones de reposo (figura 2-1). Otros dos componentes estructurales que son importantes durante la circulación normal son las anastomosis arteriovenosas y sistema linfático. Las anastomosis arteriovenosas eluden los lechos capilares. Tienen células de músculo liso en toda su longitud y se localizan en la mayoría parte de los lechos tisulares, si no es que en todos. Se piensa que la mayoría de las anastomosis arteriovenosas son importantes para regular el flujo sanguíneo a tejido muy vascularizado (piel, patas, cascos). Sin embargo, su participación en el mantenimiento de la homeostasis normal, aparte de la termorregulación, es teórica. © Editorial El manual moderno Fotocopiar sin autorización es un delito. contribuyen a mantener la competencia valvular y prevenir la regurgitación de sangre hacia la aurícula durante la contracción ventricular. La alteración de la geometría de las cavidades cardiacas (p. ej., estiramiento o hipertrofia) a causa de cambios en el volumen sanguíneo, deformación (taponamiento pericárdico) o enfermedad puede tener profundos efectos en el funcionamiento miocárdico, al igual que los cambios producidos por alteraciones neurohumorales, metabólicas y farmacológicas. Fisiología y farmacología anestésicas 17 Traquea Bronquio Arteriolas Circulación pulmonar Pulmones Alveolo Vénulas Capilares Arteria pulmonar Vena pulmonar Válvulas cardiacas AD Válvulas cardiacas VI VD Venas sistémicas Aorta Capilares © Editorial El manual moderno Fotocopiar sin autorización es un delito. Tejidos Vénulas Válvulas venosas Circulación sistémica AI Arteriolas Arterias Figura 2-1. El aparato circulatorio está constituido por corazón, sangre y dos circulaciones paralelas (pulmonar y sistémica). Circulación pulmonar: la arteria pulmonar lleva sangre desde el ventrículo derecho (VD) hasta los pulmones, donde se elimina dióxido de carbono y se capta oxígeno. La sangre oxigenada vuelve a la aurícula izquierda (AI) a través de las venas pulmonares. Circulación sistémica: la sangre es bombeada por el ventrículo izquierdo (VI) hacia la aorta, que la distribuye en los tejidos periféricos. En los lechos capilares se reciben oxígeno y nutrimentos a cambio de dióxido de carbono y otros subproductos del metabolismo tisular, después de lo cual la sangre vuelve a la aurícula derecha (AD) a través de las vénulas y las grandes venas sistémicas. Fuentes: Modificado a partir de Shepherd J.T., Vanhoutte P.M. 1979. The Human Cardiovascular System; Facts and Concepts, 1st ed. New York: Raven; y Muir W.W. 2007. Cardiovascular system. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 62. 18 Manual de anestesia y analgesia en. . Desde el punto de vista anatómico, el sistema linfático periférico no es parte del aparato circulatorio. No obstante, tiene una función integral en el mantenimiento de la dinámica circulatoria normal, en particular del volumen de líquido intersticial (alrededor de 10% del filtrado capilar). Los capilares linfáticos colectan líquido intersticial (linfa), que al final regresa a la vena cava craneal y la AD después de pasar por una serie de vasos linfáticos, ganglios linfáticos y el conducto torácico. Los vasos linfáticos tienen músculo liso dentro de sus paredes y contienen válvulas similares a las propias de las venas. La contracción de los músculos esqueléticos (bomba linfática) y el músculo liso de los vasos linfáticos, junto con las válvulas linfáticas, se encarga del flujo de linfa. Sangre La sangre es una suspensión de eritrocitos (glóbulos rojos), leucocitos (glóbulos blancos) y plaquetas (trombocitos) en plasma. La función esencial de la sangre es suministrar oxígeno a los tejidos. El oxígeno es relativamente insoluble en plasma (0.003 mL de oxígeno por cada 100 mL de sangre por cada 1 mm Hg de presión parcial de oxígeno, [PO2]; alrededor de 0.3 mL de oxígeno por 100 mL de sangre a una PO2 de 100 mm Hg). Los eritrocitos transportan cantidades mucho mayores de oxígeno de las que pueden movilizarse en solución; en términos funcionales, la cantidad que puede transportarse depende de la cantidad de hemoglobina (Hb) en los eritrocitos. La afinidad de la Hb por oxígeno depende de la presión parcial de dióxido de carbono (PCO2), pH, temperatura corporal, concentración intraeritrocítica de 2,3-difosfoglicerato y estructura química de la Hb (figura 2-2). Una vez que la cantidad de Hb desoxigenada (Hb desaturada) excede los Vol % 100 20 80 ↓ pH 60 ↑ CO2 50 10 ↑ Temp. 40 ↑ 2,3-DPG 5 20 0 40 60 80 PO2 (mm Hg) 100 0 Figura 2-2. La curva de disociación de la oxihemoglobina ilustra la relación entre la presión parcial del oxígeno (PO2) en la sangre y la saturación de la hemoglobina (Hb) con oxígeno (O2). Nótese que esta curva se desplaza a la derecha (Hb tiene menos afinidad por O2) por acidosis, aumento de la temperatura corporal y la enzima 2,3-difosfoglicerato (2,3-DPG). Este efecto ayuda a descargar el O2 de la Hb en los tejidos y eleva la afinidad de la Hb por el O2 en los pulmones. El contenido total de oxígeno en sangre arterial (CaO2) se determina por la concentración total de Hb en la sangre, su saturación porcentual (SaO2%) y la PaO2. Fuente: Muir W.W. 2007. Cardiovascular system. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 64. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 15 Contenido de O2 (CaO2) en 15 g Hb/dL Saturación de la Hb (%) 90 Fisiología y farmacología anestésicas 19 5 g/100 mL de sangre, ésta cambia de un color rojo intenso a uno azul lívido (cianosis). Parte del dióxido de carbono producido por el metabolismo en los tejidos se une a la Hb desoxigenada y lo eliminan los pulmones durante el proceso de oxigenación de la Hb antes de que la sangre vuelva a la circulación sistémica y el ciclo se repita. El mantenimiento de una oxigenación tisular adecuada depende de la captación de oxígeno por los pulmones, el suministro de oxígeno (DO2) hacia los tejidos y su extracción a partir de éstos (OE), y el uso de oxígeno por los mecanismos metabólicos de las células. Los factores que determinan el suministro de oxígeno a los tejidos son concentración de Hb, afinidad de la Hb por el oxígeno (P50), saturación de Hb con oxígeno (SaO2), presión parcial de oxígeno en sangre arterial (PaO2), gasto cardiaco (GC) y consumo de oxígeno por los tejidos (VO2). La ecuación de Fick (VO2 = GC [CaO2 – CvO2]) incorpora todos los componentes esenciales de esta relación. El contenido de oxígeno en sangre arterial (CaO2) se calcula como sigue: CaO2 = Hb × 1.35 × SaO2 + (PaO2 × 0.003). Por ejemplo, la sangre arterial (Hb = alrededor de 15 g/dL a un hematócrito [Hct] = 45%) contiene unos 20 a 21 mL de oxígeno/dL de sangre cuando la SaO2 = 100% y la PaO2 = 100 mm Hg (aire ambiental). El contenido de oxígeno en sangre venosa (CvO2) es casi siempre de 14 a 15 mL/dL, lo que arroja una OE de 0.2 a 0.3 (20 a 30%). Un incremento de la concentración de lactato en sangre arterial es el signo cardinal de aporte inadecuado de oxígeno a los tejidos que realizan metabolismo y sugiere que el consumo de oxígeno se ha tornado dependiente del suministro o que se ha desarrollado un defecto en la OE o el uso por los tejidos. Presión, resistencia y flujo En los circuitos eléctricos, el flujo de corriente (I) se determina por la fuerza electromotriz o voltaje (E) y la resistencia al flujo de corriente (R); conforme a la ley de Ohm, © Editorial El manual moderno Fotocopiar sin autorización es un delito. I = E/R El flujo de líquido (gasto, Q) por tubos no distensibles depende de la presión (P) y la resistencia al flujo (R). Por lo tanto, Q = P/R. La resistencia al flujo sanguíneo se determina por la viscosidad de la sangre (h) y los factores geométricos de los vasos sanguíneos (radio y longitud). El flujo laminar estable, no pulsátil, de los fluidos newtonianos (fluidos homogéneos en los cuales la viscosidad no cambia con el gasto o la geometría vascular), como agua, solución salina y, en condiciones fisiológicas, plasma, puede describirse con la ley de Poiseuille-Hagen, la cual establece que: Q = (P1 – P2)r4p/8Lh; R = 8Lh/r4p, donde P1 – P2 es la diferencia de presión, r4 es el radio a la cuarta potencia, L es la longitud del tubo, h es la viscosidad del fluido, y p/8 es una constante de proporcionalidad. El mantenimiento del flujo laminar es una presuposición fundamental de la resistencia que se opone al flujo de estado estable del fluido en la ecuación de Poiseuille-Hagen. La relación entre presión que distiende el vaso (o la cámara cuando se describe el corazón), diámetro del vaso, espesor de la pared del vaso y tensión de la pared del vaso se describe por la ley de Laplace: P = 2Th/r o T = Pr/2h, 20 Manual de anestesia y analgesia en. . donde T es la tensión de la pared, P es la presión generada, r es el radio inicial y h es el espesor de la pared. Esta fórmula es importante porque relaciona presión y dimensiones del vaso con cambios en la presión generada, la cual se sabe es un determinante importante de acoplamiento ventriculovascular (poscarga), trabajo miocárdico y consumo miocárdico de oxígeno. Presión arterial La presión arterial (PA), ya sea que se mida de manera directa o indirecta, se evalúa con frecuencia durante la anestesia. La cuantificación de la PA es una de las maneras más rápidas e informativas de evaluar el funcionamiento cardiovascular y constituye una indicación exacta de efectos de fármacos, procedimientos quirúrgicos y tendencias hemodinámicas. Los factores que determinan la PA son FC, volumen sistólico (VS), resistencia vascular, distensibilidad arterial y volumen sanguíneo. La PA media es un componente clave para establecer la presión de perfusión tisular y la propiedad del flujo sanguíneo tisular. En general, se piensa que para perfundir los tejidos son adecuadas presiones de perfusión mayores de 60 mm Hg. Las estructuras como corazón (circulación coronaria), pulmones (circulación pulmonar), riñones (circulación renal) y feto (circulación fetal) contienen circulaciones especiales, en las cuales los cambios en la presión de perfusión pueden tener efectos inmediatos en el funcionamiento de los órganos. En clínica, la PA suele medirse como presión arterial media. Cuando esta última no puede valorarse de manera directa, se cuantifica mediante la fórmula: donde Pm, Ps y Pd son las PA media (m), sistólica (s) y diastólica, en ese orden (figura 2-3). Tanto Ps como Pd pueden medirse de manera indirecta (calcularse) por técnicas Doppler u oscilométricas. La mayor parte de los fármacos usados para producir anestesia reduce el GC y la resistencia vascular periférica. Sin embargo, los fármacos vasoconstrictores (p. ej., agonistas adrenérgicos a2) pueden incrementar la resistencia vascular periférica y mantener la PA dentro de intervalos fisiológicos, al tiempo que reducen en grado notable el GC y el flujo sanguíneo a determinados tejidos (p. ej., piel y músculo esquelético) (figura 2-4). La presión del pulso arterial (Ps – Pd) y el análisis de la onda de presión del pulso proporcionan valiosa información acerca de cambios en distensibilidad y tono vasculares. En general, los fármacos (fenotiazinas) o las enfermedades (choque endotóxico) que causan dilatación arterial considerable incrementan la distensibilidad vascular e inducen aumento rápido, duración breve y descenso acelerado de la onda arterial al tiempo que elevan la presión del pulso arterial. Las situaciones que provocan vasoconstricción reducen la distensibilidad vascular y generan una onda del pulso de mayor duración y descenso más lento de la PA sistólica hasta valores diastólicos. La presión del pulso puede contener formas de onda secundarias y algunas veces terciarias, en particular si el sitio en que se mide se halla en una arteria periférica a alguna distancia del corazón. Control nervioso, humoral y local La regulación del sistema cardiovascular se integra a través de los efectos combinados de los sistemas nerviosos central y periférico, la influencia de sustancias vasoactivas circulantes (humorales), y mediadores tisulares locales que modulan el tono vascular. Estos procesos regulatorios © Editorial El manual moderno Fotocopiar sin autorización es un delito. Pm = Pd + 1/3 (Ps – Pd), Fisiología y farmacología anestésicas Presión del pulso Pm = Pd + 1/3 (Ps - Pd) 120 80 Frecuencia cardiaca Presión sistólica Volumen sistólico Factores fisiológicos Presión media Presión diastólica © Editorial El manual moderno Fotocopiar sin autorización es un delito. Presión (mm Hg) Factores físicos 0 21 t1 Tiempo t2 Gasto cardiaco Resistencia periférica Rigidez arterial Distensibilidad arterial Presión arterial Figura 2-3. La PA se determina por factores fisiológicos y físicos. La presión arterial media (Pm) representa el área bajo la curva de presión arterial dividida entre la duración del ciclo cardiaco y puede calcularse sumando un tercio de la diferencia entre la presión arterial sistólica (Ps) y la diastólica (Pd) a Pd. Ps menos Pd es la presión del pulso. Fuentes: Modificado a partir de Berne R.M., Levey M.N. 1990. Principles of Physiology, 1st ed. St. Louis, MO: Mosby; y Muir W.W. 2007. Cardiovascular system. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 92. mantienen el flujo sanguíneo a un nivel apropiado al tiempo que distribuyen el flujo de sangre para satisfacer las necesidades de los lechos tisulares con la mayor demanda. Electrofisiología cardiaca La actividad eléctrica cardiaca normal es decisiva para el funcionamiento contráctil normal del corazón (acoplamiento de excitación y contracción). La membrana celular cardiaca (sarcolema) es una bicapa lipídica muy especializada que contiene conductos relacionados con proteína, bombas, enzimas e intercambiadores en un medio estructuralmente complejo y, pese a ello, fluido (reorganizable y movible). La mayoría de los fármacos y muchos agentes anestésicos producen 22 Manual de anestesia y analgesia en. . ↑ Gasto cardiaco Vo l co tóli sis en m u Nódulo SA GC = FC × VS = PA ÷ RVP ↑ Frecuencia cardiaca Factores cardiacos Contrac↑ Vasos de tilidad resistencia RVP arteriolares ↑Precarga Factores de acoplamiento ↓ Poscarga Retorno venoso notables efectos directos e indirectos en la membrana celular y los organelos intracelulares, lo que en última instancia modifica el acoplamiento de excitación y contracción cardiacas (figura 2-5). En condiciones normales, el marcapasos cardiaco (nódulo sinoauricular, SA) suprime la automaticidad de marcapasos más lentos o subsidiarios (supresión por superioridad), de tal manera que impide que más de un marcapasos controle la FC. Al inicio de un impulso eléctrico en el nódulo SA le sigue la transmisión electroquímica rápida del impulso a través de las aurículas, lo cual da origen a la onda P. La repolarización de las aurículas genera la onda Ta, que es más evidente en animales grandes (caballos y bovinos), en los cuales la masa total del tejido auricular basta para generar suficiente fuerza electromotriz reconocible en el ECG. La repolarización de las aurículas en especies menores (perros y gatos) y la despolarización de los nódulos SA y AV no generan un potencial eléctrico suficientemente grande para registrarse en la superficie corporal, salvo en algunos casos de taquicardia sinusal. Una vez que la onda de despolarización llega al nódulo AV, la conducción se torna más lenta debido al bajo potencial de membrana de reposo de éste. Un mayor tono parasimpático puede causar notable desaceleración de la conducción en el nódulo AV, lo que ocasiona bloqueo cardiaco de primero y segundo grado y, raras veces, tercer grado. Muchos fármacos empleados en anestesia, incluidos opioides, agonistas adrenérgicos a2, y en ocasiones acepromazina, elevan el tono simpático y predisponen a los pacientes al bloqueo cardiaco y las bradiarritmias. El uso de muscarínicos como atropina y glucopirrolato es casi siempre un tratamiento eficaz en estas situaciones, a menos que el bloqueo se deba a una enfermedad estructural (p. ej., inflamación, fibrosis o calcificación). En condiciones normales, la conducción del impulso eléctrico por el nódulo AV produce el intervalo PR o PQ del electrocardiograma (ECG) y da tiempo para que las aurículas se contraigan antes de la activación y contracción de los ventrículos. Esta demora reviste importancia funcional, © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 2-4. El GC es igual a la frecuencia cardiaca (FC) por el volumen sistólico (VS), o a la presión arterial (PA) dividida entre la resistencia vascular periférica (RVP). El GC se eleva con incrementos de FC, contractilidad cardiaca y precarga, y decremento de la poscarga. Precarga y poscarga se consideran factores de acoplamiento porque dependen de la resistencia vascular, capacitancia y distensibilidad. Fuente: Muir W.W. 2007. Cardiovascular system. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 81. Presión arterial (mm Hg) 120 100 23 Sí st o C le a on u r Ex tr. i icul pu sov ar ls ol ió . n Ex rá pu pi da ls ió n R re el du . Ll iso ci e v da ve nad ol. nt o r ic Ll ular en r r e ad ápi d du o ci ve o do nt - d r ic ia ul st ar as is Fisiología y farmacología anestésicas Válvula aórtica se cierra Presión aórtica Válvula aórtica se abre 80 60 40 Presión en el VI Válvula mitral se cierra Válvula mitral se abre 20 0 Pulso Ruidos Volumen Electrocardiograma venoso cardiacos ventricular (mL) © Editorial El manual moderno Fotocopiar sin autorización es un delito. Flujo sanguíneo aórtico (L/min) Presión en la AI 1 2 3 4 c a v R T P Q 0 P S Sístole ventricular 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 Tiempo (s) Figura 2-5. El ciclo cardiaco ilustra de manera esquemática la relación entre sucesos mecánicos, acústicos y eléctricos en función del tiempo. Contr. isovol., contracción isovolumétrica; rel. isovol., relajación isovolumétrica. Fuentes: Modificado a partir de Berne R.M., Levey M.N. 1990. Principles of Physiology, 1st ed. St. Louis, MO: Mosby; y Muir W.W. 2007. Cardiovascular system. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 78. 24 Manual de anestesia y analgesia en. . en particular a mayores FC, porque hace posible que la contracción auricular contribuya al llenado ventricular. Una vez que el impulso eléctrico ha atravesado el nódulo AV se transmite con rapidez al músculo ventricular por células musculares especializadas que se conocen como fibras de Purkinje. Haces de células de Purkinje (las ramas derecha e izquierda del haz de His) transmiten los impulsos eléctricos al septo ventricular y las paredes ventriculares libres derecha e izquierda, respectivamente. Su distribución explica las diferencias en el patrón del ECG (despolarización ventricular) entre especies. Las fibras de Purkinje tienen potenciales de acción y periodos refractarios mucho más largos que las células musculares ventriculares, lo cual impide con regularidad la reentrada del impulso eléctrico y la reactivación de los ventrículos. La configuración y magnitud de la onda T varían en grado notable entre especies y se modifican por cambios en FC, temperatura y concentración extracelular de potasio. Por ejemplo, la hiperpotasemia causa un incremento de la conductancia de la membrana para el potasio. Esto acorta la repolarización y produce ondas T de gran magnitud, por lo general en forma de espiga o acuminadas, y de corta duración (intervalo QT corto). El intervalo que comienza inmediatamente después de la onda S del complejo QRS (punto J) y que precede a la onda T se denomina segmento ST y tiene importancia clínica. La elevación o depresión del segmento ST (± 0.2 mV o más) respecto de la línea isoeléctrica es casi siempre una indicación de hipoxia o isquemia del miocardio, GC bajo, anemia, pericarditis o contusión cardiaca, y sugiere la posibilidad de desarrollar arritmias. GC = FC × VS El VS es la cantidad de sangre expulsada del ventrículo durante la contracción,y por tanto representa la diferencia entre los volúmenes ventriculares telediastólico y telesistólico. Precarga Por lo regular, la precarga se explica en términos de la relación de Frank-Starling o como una autorregulación heterométrica: los incrementos de la longitud de las fibras del miocardio (volumen ventricular) elevan la fuerza de la contracción cardiaca y el GC. Es tema de controversia si las sarcómeras individuales aumentan o no de longitud (estiramiento) al incrementarse el volumen ventricular. Debido a la dificultad para determinar de manera exacta el volumen ventricular en el entorno clínico, como cálculos de la precarga, se usan diámetro ventricular, presión telediastólica ventricular, presión de enclavamiento pulmonar y, en ocasiones, presión auricular media. La sustitución de volumen por presión, si bien es común, debe efectuarse sin perder de vista que existen muchos casos (procedimientos a tórax abierto y rigidez o falta de distensibilidad del corazón) en que la presión no representa de manera exacta los cambios del volumen ventricular, y por tanto no es un indicador exacto de la precarga. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Determinantes de desempeño y gasto En clínica se emplea la ecocardiografía Doppler en modo M y flujo a color para valorar el funcionamiento ventricular. Estas técnicas proporcionan una representación temporal dinámica del funcionamiento del corazón y, cuando se acoplan a sistemas de análisis hemodinámico por computadora, una valoración gráfica y cuantitativa del desempeño cardiaco. Las necesidades de oxígeno de los tejidos se satisfacen por el ajuste continuo del GC, que es el producto de FC y VS: Fisiología y farmacología anestésicas 25 Poscarga El término poscarga se usa de manera amplia en la bibliografía cardiológica básica y clínica para describir la fuerza que se opone a la expulsión ventricular. Una razón importante del gran interés por este determinante fisiológico del funcionamiento cardiaco es su relación inversa con el VS y su correlación directa con el consumo miocárdico de oxígeno. La poscarga cambia de manera continua durante la expulsión ventricular y se describe de manera más exacta por la tensión (esfuerzo) que se desarrolla en la pared del ventrículo izquierdo durante la expulsión o por la impedancia al ingreso arterial (Zi). Por lo general, el esfuerzo o tensión de la pared ventricular se ha calculado a partir de la relación de Laplace: tensión (T) = Pr/2 h Debe hacerse notar que al utilizar esta valoración de la poscarga ventricular se presupone una geometría ventricular esférica. La medición de la resistencia vascular sistémica (RVS) se usa en clínica como una medida de poscarga y tono vascular porque es simple de obtener en términos técnicos y más fácil de comprender. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Inotropismo La contractilidad cardiaca (inotropismo) es la capacidad intrínseca del corazón de generar fuerza. Un decremento de la contractilidad cardiaca es un factor clave para la insuficiencia cardiaca en pacientes con cardiopatía o después de la administración de fármacos inotrópicos negativos potentes (p. ej., anestésicos inhalables). Los indicadores ideales de la contractilidad cardiaca deben ser independientes de los cambios de la FC, precarga, poscarga y tamaño cardiaco; en otras palabras, deben ser independientes de la carga. Lusitropismo En los textos de fisiología cardiovascular se omite a menudo una descripción de las fases de relajación después de la contracción cardiaca, pero reviste importancia fundamental para comprender el funcionamiento cardiaco. Los factores mecánicos, factores de carga, actividad inotrópica, FC y asincronicidad (patrones de relajación) son los principales determinantes del lusitropismo. Fisiología del aparato respiratorio El mantenimiento de una actividad respiratoria adecuada es un requisito para la anestesia exitosa. La oxigenación tisular gravemente inapropiada puede ocasionar la muerte de manera aguda. La elevación excesiva de las presiones parciales arteriales del dióxido de carbono (presión parcial de CO2 arterial [PaCO2]) o la hipoxemia moderada sostenida pueden causar algún grado de disfunción orgánica, lo que contribuye a una recuperación subóptima tras la anestesia. Durante la anestesia general siempre existe la tendencia a que las presiones parciales arteriales de oxígeno (PaO2) sean menores que las observadas en la misma especie cuando está consciente y respira la misma fracción de concentración de oxígeno inspirado (FiO2). También existe la tendencia a que la PaCO2 esté elevada por encima de los valores en reposo consciente si 26 Manual de anestesia y analgesia en. . el animal anestesiado respira de manera espontánea, y a que ocurran incrementos de la resistencia de las vías respiratorias, a menos de que se emplee una sonda endotraqueal. Se observan algunas diferencias, según sea el régimen anestésico utilizado, pero la profundidad de la anestesia a menudo es más importante. Definiciones La respiración es el proceso global por el que se suministra oxígeno a las células corporales y éstas lo usan, tras lo cual se elimina dióxido de carbono por medio del gradiente de presión parcial. La ventilación es el movimiento de gas hacia dentro y fuera de los alveolos. La necesidad ventilatoria para la homeostasis varía con el requerimiento metabólico de los animales, y por tanto con talla corporal, grado de actividad, temperatura corporal y profundidad de la anestesia. La ventilación inadecuada para satisfacer las necesidades metabólicas de intercambio gaseoso se denomina depresión respiratoria o hipoventilación. Se manifiesta en clínica como aumento de PaCO2 y acidosis respiratoria. Cuando se respira con FiO2 alta, la saturación de Hb no decrece, a menos que la hipoventilación sea grave. La ventilación pulmonar se realiza mediante expansión de la cavidad torácica y contracción elástica de los pulmones. Se emplean varios términos para describir los diversos tipos de patrones respiratorios que pueden observarse: Eupnea es la respiración tranquila ordinaria. Disnea es la respiración laboriosa. Taquipnea es el aumento de la frecuencia respiratoria. Hiperpnea es la respiración rápida o profunda (o ambas), lo cual indica “sobrerrespiración”. Polipnea es la respiración rápida y superficial, como el jadeo. Bradipnea es la respiración regular lenta. Hipopnea es la respiración lenta o superficial (o ambas), que tal vez indique “subrespiración”. La apnea es la cesación de la respiración transitoria (o más prolongada). Las respiraciones de Cheyne-Stokes aumentan en frecuencia y profundidad, y luego se tornan más lentas, seguidas por un breve periodo de apnea. 10. Las respiraciones de Biot son secuencias de jadeos, apnea y varios jadeos profundos. 11. Las respiraciones de Kussmaul son respiraciones profundas regulares sin pausa. 12. La respiración apneústica ocurre cuando un animal retiene una inspiración al final de la inhalación por un breve lapso antes de exhalar. Es común con la administración de anestésicos disociativos (p. ej., ketamina o tiletamina/zolazepam). Para describir los sucesos de la ventilación pulmonar, el aire contenido en los pulmones se ha clasificado en cuatro volúmenes y cuatro capacidades diferentes (figura 2-6). Sólo el volumen corriente (VC) y la capacidad residual funcional (CRF) pueden medirse en animales no cooperadores conscientes: 1. VC es el volumen de aire inspirado o espirado en una respiración. 2. El volumen de reserva inspiratoria (VRI) es el volumen de aire que puede inspirarse por encima y abajo del VC normal. 3. El volumen de reserva espiratoria (VRE) es la cantidad de aire que puede espirarse mediante espiración máxima (“forzada”) después de una espiración normal. 4. El volumen residual (VR) es el aire que queda en los pulmones después de la espiración máxima posible (“más forzada”). © Editorial El manual moderno Fotocopiar sin autorización es un delito. 1. 2. 3. 4. 5. 6. 7. 8. 9. Fisiología y farmacología anestésicas 8 Volumen (L) 6 4 27 Papel Capacidad pulmonar total Capacidad vital Volumen corriente Espirómetro Pluma 2 0 Capacidad residual Volumen funcional residual Figura 2-6. Volúmenes y capacidades pulmonares. CPT, CRF y VR no pueden medirse por espirometría. VRI, VRE y CI no se incluyen en el diagrama. Fuente: West J.B. 2001. Chronic obstructive pulmonary disease. In: Pulmonary Physiology and Pathophysiology: An Integrated, Case-Based Approach. Baltimore, MD: Lippincott Williams and Wilkins. Baltimore, p. 39. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Otro término de uso frecuente es el de volumen respiratorio en un minuto o ventilación por minuto (VE). Éste es igual a VC por frecuencia respiratoria (f). En ocasiones es deseable considerar juntos dos o más de los volúmenes mencionados. Tales combinaciones se conocen como capacidades pulmonares: 1. La capacidad inspiratoria (CI) es VC más VRI. Es la cantidad de aire que puede inhalarse tras comenzar después de una espiración normal y distender los pulmones al máximo. 2. La capacidad residual funcional (CRF) es VRE más VR. Es la cantidad de aire que queda en los pulmones después de una espiración normal. Desde el punto de vista mecánico, en la CRF el “tirón” hacia dentro de los pulmones debido a su elasticidad es igual al “tirón” hacia fuera de la pared torácica. 3. La capacidad vital (CV) es VRI más VC más VRE. Es la cantidad máxima de aire que puede expulsarse de los pulmones después de llenarlos a su máxima capacidad. 4. La capacidad pulmonar total (CPT) es VRI más VC más VRE más VR, o el volumen máximo al que los pulmones pueden expandirse con el máximo esfuerzo inspiratorio posible (o por insuflación plena a una presión del aire de 30 cm H2O cuando el paciente está anestesiado). Control de la respiración Con la ayuda de la circulación, la respiración mantiene el oxígeno, el CO2 y el pH de la célula. La actividad respiratoria se halla bajo el control de centros respiratorios centrales, quimiorreceptores centrales y periféricos, reflejos pulmonares, y señales aferentes neurales no respiratorias. El Manual de anestesia y analgesia en. . “controlador” neural central incluye grupos especializados de neuronas localizadas en cerebro, tallo encefálico y médula espinal que rigen tanto la ventilación voluntaria como la automática al regular la actividad de los músculos respiratorios. Éstos, al contraerse, expanden la cavidad torácica y producen la ventilación alveolar (VA). Los cambios en VA afectan las presiones parciales de los gases sanguíneos y la concentración de iones hidrógeno. Estos dos factores son vigilados por quimiorreceptores periféricos y centrales que envían señales al controlador central para inducir los ajustes necesarios en VA. Los mecanorreceptores en los pulmones y receptores de estiramiento en los músculos respiratorios vigilan el grado de expansión o estiramiento de los pulmones y el “esfuerzo” respiratorio, respectivamente, y envían la información al controlador central para modificar el patrón respiratorio. También se realizan ajustes para considerar actividades no respiratorias, como termorregulación y vocalización. De manera global, este complejo sistema de control produce una combinación de frecuencia y profundidad respiratorias adaptado, en condiciones ideales, para la ventilación óptima con esfuerzo mínimo para la especie particular, y que ajusta aporte de oxígeno y eliminación de CO2 de tal modo que se mantenga la homeostasis (lo cual se refleja en concentraciones estables de gases en sangre arterial) en una amplia gama de situaciones ambientales y metabólicas. Los sedantes, analgésicos, anestésicos y el equipo usado para la anestesia por inhalación pueden influir en mayor grado en la respiración y la capacidad de un animal de mantener la homeostasis celular. El factor más importante en la ventilación pulmonar es la rapidez con que el gas alveolar se intercambia por aire atmosférico. Esto no es igual al volumen de ventilación alveolar por minuto, dado que una gran porción del aire inspirado se usa para llenar los conductos respiratorios (espacio muerto anatómico, VManat), en vez de los alveolos, no ocurre un intercambio gaseoso significativo en este aire. La frecuencia respiratoria (f) y el VC determinan el VE. El volumen “efectivo”, o porción de VC que contribuye al intercambio gaseoso, es el volumen alveolar, casi siempre llamado VA por minuto. Los alveolos no perfundidos no contribuyen al intercambio gaseoso y constituyen espacio muerto alveolar (VMA). El espacio muerto fisiológico (VM) incluye VManat y VMA, y suele expresarse como un valor por minuto (VM) junto con VA, o como un cociente VM/VC (figura 2-7). El término hipoxia se refiere a cualquier estado en el cual la PO2 de pulmones, sangre o tejidos es anormalmente baja y su efecto es un metabolismo tisular anormal o daño celular. La hipoxemia es la oxigenación insuficiente de la sangre para satisfacer las necesidades metabólicas. En animales que respiran de manera espontánea, la hipoxemia se caracteriza por niveles de PaO2 menores que los normales para la especie. Los niveles de PaO2 en especies domésticas suelen variar de 80 a 100 mm Hg en animales sanos despiertos al nivel del mar. Algunos veterinarios consideran que una PaO2 menor de 70 mm Hg (~94% de saturación de la Hb) es hipoxemia en animales que se encuentran al nivel del mar o cerca de éste, aunque las implicaciones clínicas de este grado de tensión de oxígeno sanguínea varían de acuerodo con algunos factores, como salud y edad del animal, concentración de Hb y duración de la baja presión parcial de oxígeno para la tasa metabólica tisular (p. ej., los pacientes hipotérmicos están en menor riesgo). Transporte de oxígeno En condiciones normales, el oxígeno es captado por los alveolos pulmonares y el CO2 se elimina de ellos a un ritmo suficiente para mantener la composición del aire alveolar en una concentra- © Editorial El manual moderno Fotocopiar sin autorización es un delito. 28 Fisiología y farmacología anestésicas VM anatómico VM alveolar VM fisiolófico = VManat – VMalv VT PIO2 PECO2 Relación de volúmenes de espacio muerto/corriente VD = PaCO2 - PECO2 VT Pa CO2 Mezcla venosa CvO 2 Sangre venosa CvO ˉ 2 Gas alveolar “IDEAL” PACO2, PAO2 Presión de O2 alveolar PAO2 = (PB - PH2O) FiO2 - PaCO2 0.8 lar Cc’O 2 Sangre capi Diferencia de PO2 alveolocapilar A - a PO2 = PAO2 - PaO2 © Editorial El manual moderno Fotocopiar sin autorización es un delito. 29 PaCO2 CaO2 Mezcla venosa (fracción de derivación) Q = Cc’ O2 - CaC2 ˉ 2 QT Cc’ O2 - CvO Figura 2-7. Esquema de ventilación y flujo sanguíneo desiguales. El alveolo de la izquierda está ventilado pero no perfundido y por tanto se considera espacio muerto alveolar, mientras que el alveolo de la derecha está perfundido pero no ventilado, y en consecuencia contribuye a la mezcla venosa o derivación. El alveolo central está perfundido y ventilado por igual y tiene entonces un cociente V/Q de 1.0. Se muestran las ecuaciones pertinentes para el cálculo de: 1. cociente espacio muerto/VC; 2. presión parcial alveolar de oxígeno (PAO2); 3. diferencia de presión parcial de oxígeno alveoloarterial P(A – a)O2; y 4. fracción de mezcla venosa (Q/QT). Fuente: Reproducido a partir de Robinson NE. 1991. The respiratory system. In: Equine Anesthesia: Monitoring and Emergency Therapy. W.W. Muir and J.E. Hubbell, eds. St. Louis, MO: Mosby Year Book, pp 7-38. Con permiso de Elsevier. ción relativamente constante. En los pulmones, el gas se intercambia a través de las membranas alveolares y capilares. La distancia total en la que ocurre el intercambio es menor de 1 mm; por lo tanto, dicho intercambio se realiza con rapidez. Salvo a grados incrementados de actividad física, el equilibrio casi se alcanza entre la sangre en los pulmones y el aire en los alveolos, y la PO2 en la sangre venosa pulmonar casi iguala la PO2 en los alveolos. Mientras que la difusión del oxígeno a través del espacio alveolocapilar es una barrera teórica a la oxigenación, rara vez constituye un problema práctico durante la anestesia veterinaria a menos que haya edema pulmonar o neumopatía significativos. La composición alveolar promedio normal de los gases respiratorios en seres humanos se describe en seguida. A la temperatura corporal normal del ser humano, el aire alveolar está saturado de vapor de agua, que tiene presión de 48 mm Hg a 37°C. Si la presión barométrica en los alveolos es de 760 mm Hg (nivel del mar), entonces la presión debida al aire seco es 760 – 48 = 712 mm Hg. Si se conoce la composición del aire alveolar, es posible calcular la presión parcial de cada gas en los alveolos: 30 Manual de anestesia y analgesia en. . O2 = (760 – 48) × 0.14 = 100 mm Hg CO2 = (760 – 48) × 0.056 = 40 mm Hg N2 = (760 – 48) × 0.80 = 570 mm Hg Transporte de dióxido de carbono Las concentraciones de CO2 en sangre arterial dependen tanto de la eliminación de CO 2 como de su producción, y en circunstancias normales las concentraciones de PaCO2 se mantienen dentro de límites estrechos. Durante el esfuerzo extenuante, la producción de CO2 aumenta en grado considerable, mientras que durante la anestesia es probable que disminuya. La eliminación de CO2 depende de flujo sanguíneo pulmonar (GC) y VA. En condiciones normales, la producción de CO2 es paralela al consumo de oxígeno conforme al cociente respiratorio: R = VCO2/VO2. Aunque el valor varía según sea la alimentación, por lo regular R es de 0.8 en estado estable. Un gradiente de presión de CO2, opuesto al de oxígeno y mucho menor, existe entre los tejidos y el aire atmosférico: tejidos = 50 mm Hg (durante la realización de esfuerzo puede ser mayor); sangre venosa = 46 mm Hg; aire alveolar = 40 mm Hg; aire espirado = 32 mm Hg; aire atmosférico = 0.3 mm Hg; y aire arterial = 40 mm Hg (equilibrio con el aire alveolar). El dióxido de carbono se desplaza desde las mitocondrias hasta los alveolos de varias maneras. En el plasma, parte del CO2 se transporta en solución (5%), y cierta cantidad se combina con agua y forma ácido carbónico, que a su vez se disocia en iones bicarbonato e hidrógeno (5%). La mayor parte (~90%) del CO2 se difunde hacia el interior de los eritrocitos, donde se une a Hb o se transforma (de manera reversible) en iones bicarbonato e hidrógeno a través de la acción de la enzima anhidrasa carbónica. La formación de bicarbonato en el eritrocito se acompaña del desplazamiento de cloruro (lo que representa alrededor de 63% del transporte total de CO2). Del mismo modo en que la cantidad de oxígeno transportada por la sangre depende de la PO2 a la cual se expone ésta, así también el transporte de CO2; sin embargo, la curva de disociación del CO2 es más o menos lineal. Por consiguiente, en contraste con los efectos mínimos en el contenido de oxígeno, la hiperventilación y la hipoventilación pueden tener notables efectos en el contenido de CO2 de la sangre y los tejidos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. La PO2 en los pulmones al nivel del mar es por tanto cercana a 100 mm Hg a 37 o 38°C. En estas condiciones, 100 mL de plasma contienen 0.3 mL de oxígeno en solución física. Bajo las mismas condiciones, la sangre entera posee 20 mL de oxígeno, o unas 60 veces más que el plasma. De igual modo, la sangre contiene CO2. En consecuencia, es evidente que el oxígeno y el CO2 se transportan en la sangre sobre todo en combinación química, dado que ambos se desplazan por la sangre en cantidades mucho mayores de lo que ocurriría por simple absorción. A la saturación completa, cada gramo de Hb se combina con 1.36 a 1.39 mL de oxígeno. Ésta es la capacidad total de carga de la Hb, o cuatro moléculas de oxígeno combinadas con cada molécula de Hb. La capacidad de la Hb de combinarse con oxígeno depende de la PO2 en el ambiente circundante. El grado en que se satura a diversos valores de PO2 varía en sumo grado. Se ajusta de tal modo que, incluso cuando la ventilación es ineficiente o el suministro de oxígeno es escaso a grandes altitudes, el grado de saturación aún tiende al 100%. Por ejemplo, aunque es probable que la Hb no se sature por completo sino hasta que se la exponga a una PO2 de 250 mm Hg, está saturada al 94% cuando la PO2 es tan sólo de 79 mm Hg. Fisiología y farmacología anestésicas 31 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Mecanismos de control normales Tan importante es la información detallada ya mencionada para comprender las adaptaciones respiratorias a grandes altitudes, enfermedad y esfuerzo físico, para el manejo exitoso de la anestesia clínica basta una comprensión muy simplificada del control de la respiración. En animales conscientes, VE y VA se determinan sobre todo por la reactividad de los quimiorreceptores centrales a las cifras de PaCO2. Los quimiorreceptores centrales, localizados en la superficie ventral del bulbo raquídeo y bañados por líquido cefalorraquídeo (LCR), son extraordinariamente sensibles a los cambios de las cantidades de PaCO2 porque el CO2 se difunde con facilidad al LCR y la célula quimiorreceptora central. Es probable que en última instancia los cambios de PaCO2 se detecten como un cambio en el pH dentro de la célula quimiorreceptora. Un descenso del pH arterial también estimula la respiración a través de los quimiorreceptores centrales y periféricos, como se observa en la acidosis metabólica. Los quimiorreceptores periféricos, que se localizan en los cuerpos carotídeo y aórtico, tienen en general una participación significativa en el impulso respiratorio sólo cuando las concentraciones de PaO2 disminuyen por abajo de 60 mm Hg. Los centros apneústico y neumotáxico, así como los receptores pulmonares y de las vías respiratorias, se encargan en mayor medida de ajustar el equilibrio entre f y VC para alcanzar un nivel particular de VA, por lo general de un modo que minimiza el costo energético de la respiración. Aunque en general se considera que los compuestos anestésicos y preanestésicos no influyen en gran medida en el funcionamiento de estos receptores, es posible que intervengan en algunas de las diferencias entre especies observadas en la respuesta a un fármaco o grupo de compuestos en particular. Umbral apneico El umbral apneico es el grado de PaCO2 al que cesa el esfuerzo ventilatorio espontáneo. Una reducción de la PaCO2 de 5 a 9 mm Hg respecto de los valores normales a través de hiperventilación voluntaria (en una persona consciente), o por ventilación artificial en animales sedados o anestesiados, produce apnea. La distancia entre la cantidad de PaCO2 en reposo y el umbral apneico es relativamente constante (5 a 9 mm Hg), cualquiera que sea la profundidad de la anestesia. Los anestesiólogos veterinarios usan el umbral apneico para controlar la respiración (es decir, abolir los esfuerzos espontáneos) cuando conectan a un animal al ventilador, o para crear de forma temporal un campo quirúrgico tranquilo sin la necesidad de recurrir al empleo de fármacos relajantes musculares. Efecto de los fármacos en el control de la ventilación Los anestésicos y algunos preanestésicos alteran la respuesta de los quimiorreceptores centrales y periféricos al CO2 y oxígeno de una manera dependiente de la dosis. Esto tiene relevantes implicaciones clínicas en términos de mantener la homeostasis durante el periodo perioperatorio. También se atenúan los signos externos en animales anestesiados hipoxémicos o hipercárbicos. Mientras que los animales no sedados presentan con frecuencia taquipnea evidente y aumento de VC o del esfuerzo respiratorio en respuesta a hipoxemia o hipercapnia graves, estos signos externos de una crisis inminente bien pueden faltar o estar muy disminuidos en animales anestesiados. 32 Manual de anestesia y analgesia en. . Fármacos inhalables e inyectables Todos los fármacos administrados en la actualidad en anestesia general causan un decremento de la respuesta al CO2 dependiente de la dosis. En el caso de los fármacos inhalables de uso común, la respuesta al CO2 es casi plana a una concentración alveolar mínima (CAM) de 2.0. La disminución de la aferencia sensitiva y la sensibilidad central al CO2 provoca un notable decremento de VA, muchas más veces que la de un descenso dependiente de la dosis en VC, en el cual f se mantiene razonablemente normal. Se observa un aumento proporcional de VM/VC porque VManat es más o menos constante. Como resultado de esos cambios, las concentraciones de PaCO2 se incrementan al hacerlo la dosis de anestésico cuando los animales respiran de manera espontánea. En planes con anestesia ligera (p. ej., CAM múltiplo de 1.2), la PaCO2 en general permanece moderadamente elevada, pero estable, durante muchas horas de anestesia, mientras que a mayores concentraciones la PaCO2 aumenta de manera progresiva con el tiempo. El grado de hipercarbia a dosis equipotentes de anestésicos inhalables (e intravenosos, IV) varía con la especie y el grado de estimulación quirúrgica. Tranquilizantes Los sedantes fenotiazina y benzodiazepina reducen a menudo la frecuencia respiratoria, en particular si el animal está un tanto excitado antes de la administración, pero no alteran en grado notorio las presiones parciales de los gases en sangre arterial. Sedantes e hipnóticos Los agonistas de los adrenorreceptores a2 producen un efecto más complicado en la respiración. Cuando se emplean solos en dosis sedantes, los agonistas a2 muestran pocos indicios de depresión respiratoria muestran pocos indicios de depresión respiratoria en perros o gatos sanos. Puede haber un decremento de la frecuencia respiratoria y quizá un pequeño incremento de las cantidades de PaCO2, si bien las cifras de PaO2 se mantienen bien. Al parecer, la cianosis periférica observadada hasta en un tercio de los perros sedados con medetomidina es consecuencia del bajo flujo sanguíneo a través de los lechos capilares de membranas mucosas y la desaturación venosa, más que un decremento de las saturaciones de Hb arteriales. Sin embargo, es importante señalar que el grado de depresión respiratoria producido por cualquier agonista a2 aumenta cuando éste se administre junto con otros fármacos sedantes © Editorial El manual moderno Fotocopiar sin autorización es un delito. Opioides Cuando se administran solos, los opioides desplazan la curva de respuesta al CO2 hacia la derecha con escaso cambio en la pendiente, excepto a dosis muy altas. Esto significa que el grado de PaCO2 en reposo podría ser un poco mayor en un animal que recibe una dosis terapéutica de un opioide como premedicación o recuperación posoperatoria, pero que la respuesta a una mayor cantidad de CO2 (por metabolismo, obstrucción de vías respiratorias, entre otros) no se suprime. En clínica, cuando se administran opioides en dosis altas como parte de un régimen anestésico equilibrado, se observa un efecto aditivo de la depresión por opioide del centro respiratorio y el anestésico general, y es posible una hipercarbia considerable o incluso apnea. A las dosis de uso común para premedicación sistemática con opioide o analgesia posoperatoria en la práctica veterinaria, muy rara vez se desarrolla depresión respiratoria, pero la depresión leve o moderada es habitual. Fisiología y farmacología anestésicas 33 o anestésicos. En varios estudios se ha demostrado con claridad que la medetomidina produce concentraciones elevadas de PaCO2 y PaO2 en el intervalo ligeramente hipóxico (60 a 70 mm Hg) cuando se combina con opioides, propofol o ketamina en dosis clínicas en animales sanos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Relaciones de ventilación-perfusión durante la anestesia El inicio de la anestesia general o un cambio de la posición corporal provocan con frecuencia grados de PaO2 más bajos de lo esperado para la concentración suministrada de oxígeno inspirado. Este cambio puede ocurrir incluso sin hipoventilación y durante la respiración espontánea y la controlada. Se produce una menor PaO2 debido a los cocientes de ventilación/perfusión alterados en los pulmones. Gran parte del conocimiento sobre este fenómeno de intercambio gaseoso alterado proviene de estudios sobre la respuesta humana a la anestesia, algunos experimentos en perros, y muchos estudios con caballos anestesiados. Cuando se observan los resultados colectivos resulta obvio que existen notables diferencias entre las especies, aunque las causas de estas diferencias no siempre son claras. Medición de la discordancia V/Q Cuando se conocen la presión barométrica, concentración de oxígeno inspirado, PaCO2 y cociente respiratorio, la PAO2 puede calcularse mediante una forma de la ecuación para aire alveolar. La diferencia entre este valor y la PaO2 (es decir, el gradiente alveoloarterial [P(A – a)O2]) constituye una medida conveniente y práctica de la eficiencia relativa del intercambio gaseoso. El valor P(A – a)O2 medido se incrementa cuando lo hace la FiO2 para cualquier situación particular de V/Q, y es imperativo tomar en cuenta la cantidad de FiO2 cuando se realizan comparaciones. En la práctica, la mayor parte de las determinaciones de P(A – a)O2 se efectúa a concentraciones de oxígeno de 21% o cerca de 100%. La cantidad de mezcla venosa o flujo de derivación pulmonar puede determinarse si se obtiene el contenido de oxígeno en sangre venosa (de la arteria pulmonar) y arterial mixta junto con una medición de CO y el cálculo de PaO2. Los términos mezcla venosa y flujo de derivación no significan exactamente lo mismo, si bien se utilizan muchas veces de manera indistinta en la bibliografía, lo que suscita cierta confusión. La mezcla venosa se refiere al grado de combinación de sangre venosa mixta con sangre del extremo de los capilares venosos que se requeriría para producir la diferencia observada entre la PO2 arterial y del extremo de los capilares. Se presupone que la PO2 del extremo de los capilares es igual a la PO2 alveolar. La mezcla venosa es una cantidad calculada (una proporción del GC) e incluye el efecto reductor de la PaO2 que tienen las áreas con V/Q reducido, el flujo de sangre sobre zonas no ventiladas, y el verdadero flujo de derivación anatómico (flujo de sangre por las venas bronquiales y de Tebesio). Cuando las cifras de oxígeno inspirado son elevadas, la sangre que pasa por zonas de bajo cociente V/Q está oxigenada, y el gradiente P(A – a)O2 y la determinación de la mezcla venosa son una medida del flujo sanguíneo total que no contribuye al intercambio gaseoso; de ahí el término de flujo de derivación pulmonar. Nótese que este flujo incluye tanto el flujo de derivación anatómica como el flujo por alveolos no ventilados o colapsados. Si se conocen la concentración de oxígeno inspirado y la PaO2, y se presupone que la diferencia de oxígeno entre sangre arterial y venosa es normal, puede emplearse un diagrama de isolíneas de derivación para obtener una determinación conveniente y razonablemente exacta de la magnitud del flujo de derivación pulmonar. Manual de anestesia y analgesia en. . Implicaciones clínicas de la respiración alterada durante la anestesia En perros y gatos sanos, el gradiente P(A – a)O2 y el grado de mezcla venosa son menores que en el ser humano. Esto se debe quizá al menor tamaño de los pulmones en estas especies o a la diferencia en los cambios de la pared torácica durante la anestesia, o tal vez a que hay una excelente ventilación pulmonar colateral en estas especies. Un alto grado de ventilación colateral significa que si la vía respiratoria no ventila a un alveolo, bien puede realizar el intercambio gaseoso a través de pasajes (poros de Kohn) que desembocan en otros alveolos, los cuales sí se ventilan. A pesar de la situación relativamente favorable acerca de la discordancia V/Q en estas especies, aún se recomienda una cantidad mínima de oxígeno inspirado de 30 a 35%. Los animales obesos, bajo anestesia profunda y con el abdomen distendido (p. ej., por preñez u obstrucción intestinal) o con enfermedad pulmonar o lesiones ocupativas del tórax (tumor, neumotórax, hemotórax o hernia diafragmática), se encuentran en especial riesgo. En los animales bajo sedación profunda se requiere casi tanto oxígeno complementario como en los que reciben un anestésico general (IV o inhalado). Éste es el motivo por el cual son benéficas las maniobras simples, como colocar una mascarilla facial con oxígeno en un paciente de alto riesgo antes de la inducción y durante ésta o el uso de una cánula nasal de oxígeno en el periodo posoperatorio. Cuando se infunden mezclas de oxígeno al 100% con los anestésicos inhalables comunes en perros y gatos sin enfermedad cardiopulmonar grave, la concentración de PaO2 arterial es casi siempre de 450 a 525 mm Hg, ya sea que el animal respire de manera espontánea o se halle bajo ventilación, cualquiera que sea la posición del cuerpo. Con tales cifras altas de oxígeno inspirado, sólo ocurre hipoxemia por desconexión del animal de la máquina de anestesia o por colocación defectuosa de la sonda endotraqueal, paro cardiaco o apnea por más de 5 min. Pese a ello, incluso con estas elevadas concentraciones de PaO2 puede desarrollarse hipoxia tisular si las cantidades de Hb son bajas o si la circulación es inadecuada (GC bajo). La decisión de aplicar ventilación con presión positiva intermitente (VPPI) asistida o controlada se toma muchas veces para prevenir o tratar la hipercapnia, no para conseguir la oxigenación. Casi todos los perros y gatos que respiran de manera espontánea muestran algún grado de hiperventilación e hipercapnia (PaCO2 de 45 a 55 mm Hg). A continuación se presentan unos cuantos lineamientos acerca del componente respiratorio de la anestesia para perros y gatos: 1. Casi todas las anestesias en perros se realizan mejor con una sonda endotraqueal colocada; en muchas situaciones los gatos pueden intubarse. 2. Utilizar al menos oxígeno inspirado al 30 a 35% en todos los perros y gatos anestesiados, aun los que recibieron una mezcla anestésica inyectada o que están bajo sedación profunda. 3. La hipoxemia es rara en perros y gatos que respiran de manera espontánea si reciben una mezcla de oxígeno cercana al 100%. 4. Después de un periodo prolongado de anestesia en gatos y perros pequeños, y con anestésicos de efecto más corto en perros grandes con tórax profundo, es recomendable insuflar los pulmones a 30 cm H2O de presión en las vías respiratorias (hacer “suspirar” los pulmones) de manera periódica y al final de la anestesia. 5. La inmovilidad prolongada y la administración excesiva de líquido pueden elevar la mezcla venosa y reducir la PaO2, además de lo que ocasiona la anestesia misma. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 34 Fisiología y farmacología anestésicas 35 Anatomía y fisiología del sistema nervioso En general, el sistema nervioso puede clasificarse en las divisiones central y periférica, aunque ambas están integradas y funcionan de manera conjunta. La división central, formada por el encéfalo y la médula espinal, contiene todos los núcleos importantes y es esencial para integrar las actividades sensitiva y motora. La división periférica está formada por nervios (incluidos los nervios o pares craneales) y ganglios que conectan los órganos y tejidos con el sistema nervioso central (SNC). © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anatomía del encéfalo El encéfalo puede dividirse en cinco regiones con base en su desarrollo embrionario: telencéfalo, diencéfalo, mesencéfalo, metencéfalo y mielencéfalo. Grosso modo, puede considerarse que está integrado por cerebro y tallo encefálico. El cerebro consta de las porciones telencefálica y diecefálica. La porción telencefálica puede dividirse a su vez en los hemisferios cerebrales y ganglios basales (también llamados núcleos basales). Juntos, los hemisferios derecho e izquierdo conforman la corteza cerebral, que se organiza en una capa cortical de materia gris que contiene una alta densidad de somas (cuerpos de células nerviosas) y una médula interna de materia blanca que consta en mayor medida de fibras nerviosas mielinizadas. En la corteza cerebral ocurre la actividad sensitiva, motora y de asociación. La porción diencefálica del cerebro, que se localiza abajo y entre los hemisferios cerebrales, es la zona central que debe recorrer la mayor parte de la información que se transmite hacia y desde los hemisferios. Consta de tálamo, subtálamo, epitálamo e hipotálamo y se ubica entre el telencéfalo y el tallo encefálico. Este último consiste en la parte del encéfalo caudal al telencéfalo, sin incluir el cerebelo (es decir, mesencéfalo, puente de Varolio y bulbo raquídeo). El mesencéfalo contiene vías sensitivas y motoras, los núcleos de los pares craneales III y IV (oculomotor y troclear), y dos núcleos motores principales: el núcleo rojo y la sustancia negra. Pares craneales Éstos constan de un segmento periférico, un centro nuclear en el tallo encefálico (excepto los nervios olfatorios y ópticos) y conexiones comunicantes con otras partes del encéfalo. Los 12 pares craneales son, como su nombre indica, dobles. Desde el punto de vista funcional, los pares craneales pueden dividirse en motores (eferentes), sensitivos (aferentes) y mixtos. Los pares craneales sensitivos y motores se relacionan con al menos un núcleo y los pares craneales mixtos lo hacen con al menos dos núcleos (figura 2-8). Fisiología del encéfalo Los procesos consumidores de energía del encéfalo se dividen en los de neuroprocesamiento y mantenimiento de la integridad celular. Los requerimientos de oxígeno del encéfalo canino sano consciente se aproximan a 5.5 mL/100 g/ min; 60% de las necesidades corresponde al neuroprocesamiento y 40% al mantenimiento de la integridad de las células encefálicas. Si el funcionamiento cardiovascular es normal, se espera que sean normales el suministro de oxígeno y el encefalograma (EEG), con PaO2 cercana a 100 mm Hg y flujo sanguíneo cerebral (FSC) de 36 Manual de anestesia y analgesia en. . Bulbo raquídeo Fosa interpeduncular Cuerpo mamilar Cuerpo trapezoidal Cintilla óptica Cerebelo C1 XII XI X Bulbo olfatorio I IX VIII VII II VI Quiasma óptico V IV III Lóbulo piriforme Infundíbulo Fisura rinal caudal I. Olfatorio II. Óptico VIII. Auditivo Nervios eferentes III. Motor ocular común IV. Troclear (patético) VI. Motor ocular externo XI. Espinal XII. Hipogloso Nervios mixtos V. Trigémino VII. Facial IX. Glosofaríngeo X. Neumogástrico Figura 2-8. Vista ventral del encéfalo y los pares craneales caninos. Fuente: Jenkins T.J. 1978. Functional Mammalian Neuroanatomy, 2nd ed. Philadelphia, PA: Lea and Febiger. 50 mL/100 g/min. Es probable el daño irreversible del tejido cerebral cuando la PaO2 desciende por debajo de 20 a 23 mm Hg y el FSC por debajo de 100 mL/100 g/min. En seres humanos, el funcionamiento normal del encéfalo despierto requiere alrededor de 3.5 mL O2/100 g/min, o un total de casi 50 mL/min extraídos de un FSC promedio normal de 57 mL/100 g/min. En el estado despierto, la mayor parte de las reservas de energía celular del encéfalo se agota en los 2 a 4 min que siguen al momento en que se interrumpe el suministro de oxígeno. Durante el periodo anóxico, las concentraciones celulares de lactato pueden aumentar en tres a cinco veces. La anestesia, hipotermia y lesión encefálica pueden alterar los requerimientos metabólicos encefálicos de oxígeno (RMEO2) y deben considerarse al interpretar la propiedad de los parámetros cardiopulmonares que se vigilan durante la anestesia. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Nervios aferentes Fisiología y farmacología anestésicas 37 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Efectos de los anestésicos en la fisiología encefálica El manejo anestésico de los pacientes exige que el FSC se mantenga en una cifra suficiente para satisfacer las demandas metabólicas del encéfalo. La autorregulación permite el mantenimiento de un FSG constante sobre una amplia gama de valores de PA sistémica. La autorregulación no es inmediata; cuando la PA sistémica cambia, se requieren unos 2 min para que el FSC vuelva a la normalidad. Se han realizado muchos estudios sobre los efectos de los anestésicos en el FSC y la autorregulación, y en algunos casos los resultados han sido confusos. Todos los anestésicos inhalables potentes tienden a atenuar el metabolismo encefálico e incrementar la presión intracraneal (PIC), pero varían en grado. Médula espinal Después del bulbo raquídeo en sentido caudal, el SNC continúa en la médula espinal, que está contenida en el conducto raquídeo. La médula espinal es un conjunto complejo de fibras organizadas en haces ascendentes y descendentes, interneuronas, células de mantenimiento de las neuronas, vasos sanguíneos y tejido conectivo. La médula está rodeada por las meninges, que la sostienen y protegen. De la superficie al interior se denominan duramadre, aracnoides y piamadre. En perros, la médula espinal y las estructuras subaracnoideas relacionadas suelen terminar al nivel de L6-L7 y en los gatos terminan de manera variable entre L6 y el sacro. La administración subaracnoidea inadvertida de anestésicos o analgésicos es más probable en felinos cuando la aguja se inserta en el espacio lumbosacro. El espacio epidural no es una cavidad vacía, sino que contiene vasos sanguíneos, linfáticos y grasa epidural, y se comunica con los tejidos paravertebrales a través de los agujeros intervertebrales. Esta comunicación puede interrumpirse en animales viejos por tejido conectivo fibroso y malformaciones óseas vinculadas con artritis raquídea, y por grasa en pacientes obesos. Esto reviste importancia clínica porque los volúmenes de inyección epidural se reducen a menudo en animales viejos u obesos para prevenir la propagación craneal excesiva de los fármacos. El espacio subaracnoideo se localiza entre la aracnoides y la piamadre; contiene LCR y es continuo entre los segmentos craneal y vertebral. No hay comunicación directa entre los espacios epidural y subaracnoideo; sin embargo, los fármacos (en especial los lipófilos) pueden difundirse a través de la aracnoides e ingresar en el LCR después de la administración epidural. La piamadre, que tiene una capa de células de espesor, yace directamente sobre el encéfalo y la médula espinal. Es probable que no constituya una barrera significativa contra la difusión de fármacos. Las meninges cubren las raíces nerviosas dorsales y ventrales hasta su fusión, punto en el cual se combinan con el nervio espinal y no se extienden más allá en dirección periférica. Líquido cefalorraquídeo y presión intracraneal Dentro de la calvaria, el LCR se encuentra tanto en un sistema interno (ventricular) como en uno externo (subaracnoideo). El sistema interno consta de los ventrículos laterales (con simetría bilateral) dentro de los hemisferios cerebrales, el tercer ventrículo (con situación medial entre el tálamo y el hipotálamo) y el cuarto ventrículo (abajo del cerebelo y dentro del bulbo raquídeo). El LCR se produce en el plexo coroides, un pliegue de piamadre con forma de listón en el piso de ambos ventrículos laterales y en el cuarto ventrículo, y también por el recubrimiento ependimario 38 Manual de anestesia y analgesia en. . Espacio subaracnoideo Ventrículo lateral Tercer ventrículo Agujero de Monro Acueducto de Silvio Agujero de Luschka Agujero de Magendie Cuarto ventrículo Cisterna magna o posterior de los ventrículos. El LCR se genera a partir de la sangre por procesos secretorios y de filtración. El líquido contenido en los ventrículos laterales se vierte en el tercer ventrículo a través de los agujeros de Monro pares. A su vez, el tercer ventrículo drena en el cuarto a través del acueducto de Silvio. El conducto central de la médula espinal se continúa con el cuarto ventrículo. El sistema externo o subaracnoideo descansa sobre el encéfalo y la médula espinal. Los agujeros de Luschka, bilaterales, permiten que el líquido pase entre los sistemas ventricular y subaracnoideo. En la mayor parte de los primates, el agujero de Magendie, impar, posibilita una conexión adicional entre el cuarto ventrículo y el espacio subaracnoideo. El agujero de Magendie no se encuentra en la mayoría de las especies veterinarias comunes (figura 2-9). El LCR se absorbe en las vellosidades aracnoideas, que se encuentran sobre todo en los senos venosos subdurales. Las vellosidades aracnoideas son proyecciones digitiformes de la membrana aracnoidea que penetran los senos venosos. Su endotelio es poroso y altamente permeable, lo cual hace posible el paso libre de agua, electrólitos, proteínas e incluso eritrocitos. El LCR amortigua al encéfalo y la médula espinal. La presión normal del LCR se aproxima a 10 mm Hg pero puede fluctuar dentro de un estrecho margen. La composición del LCR permanece distinta de la propia del plasma debido a la barrera hematoencefálica. La barrera es un impedimento para el transporte enzimático y celular y también una separación anatómica. La concentración de sodio es igual a la del plasma, la concentración de cloruro en el LCR es 15% mayor, y la concentración de potasio y glucosa es 40 y 30% menor que en el plasma, respectivamente. La densidad relativa (peso específico) del LCR es de 1.002 a 1.009. Su pH se mantiene muy cercano a 7.32. El dióxido de carbono, pero no los iones hidrógeno, cruza con facilidad la barrera hematoencefálica. Los iones bicarbonato cruzan por transporte activo. Como resultado, el pH del LCR se modifica con rapidez por los cambios en la PaCO2 pero no por los cambios del pH arterial. El pH del LCR, no la PCO2 de manera directa, es el principal mecanismo que regula la ventilación en la mayor parte de los mamíferos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 2-9. Circulación del LCR en el ser humano y el resto de los primates. Los no primates carecen del agujero de Magendie. Fuente: Stoelting RK. 1991. Pharmacology and Physiology in Anesthetic Practice, 2nd ed. Philadelphia, PA: Lippincott. Fisiología y farmacología anestésicas 39 © Editorial El manual moderno Fotocopiar sin autorización es un delito. El cráneo forma una cámara no distensible llena de parénquima encefálico, sangre y LCR. Un incremento del volumen de un componente debe acompañarse de un decremento compensatorio de los otros, o de lo contrario la PIC aumenta (hipótesis de Monro-Kellie). La PIC normal es menor de 15 mm Hg. Al aumentar la PIC, el flujo sanguíneo hacia el encéfalo decrece, a menos que ocurra una elevación de la presión arterial media para mantener la presión de perfusión cerebral (presión de perfusión cerebral = presión arterial media – PIC). Siempre debe medirse la PA en animales en los que se sospecha hipertensión intracraneal, ya que los decrementos de la PA media inducidos por anestésico pueden ocasionar isquemia encefálica catastrófica aunque la PA se mantenga por encima de las cifras aceptables para animales sanos (p. ej., PA media de 60 mm Hg). El aumento de la presión del líquido cerebral o raquídeo genera un incremento reflejo de FC y PA (respuesta de Cushing). Se ha conjeturado que la elevación de la presión del LCR crea isquemia de las neuronas y que éste es el estímulo para precipitar una mayor actividad simpática. Pueden usarse fármacos que reducen la actividad metabólica encefálica o el FSC, diuréticos osmóticos, hipotermia y normoventilación mecánica o hiperventilación para reducir la PIC. Es imperativo que el manejo anestésico se centre en mantener la presión de perfusión cerebral adecuada más que en sólo reducir el FSC o la PIC. La administración de analgésicos, en especial opioides, debe vigilarse de cerca en animales con enfermedad intracraneal, debido a su capacidad para incrementar la PaCO2, que podría elevar el FSC y la PIC. Tal vez se requiera apoyo ventilatorio en caso de depresión respiratoria. Nervios raquídeos Éstos suministran inervación eferente y aferente a la mayor parte del organismo, con la excepción de cabeza y vísceras. También forman parte del sistema nervioso autónomo, que controla funciones homeostásicas. Los nervios raquídeos varían en número, según sea la especie. Los nervios pueden clasificarse por su tamaño y grado de mielinización, que determinan la velocidad de la transmisión de impulsos. Las fibras grandes muy mielinizadas tienen las mayores velocidades de conducción, y las fibras pequeñas no mielinizadas poseen las más bajas. Las fibras más grandes, tipo A, se subclasifican en A-a, A-b, Ag y Ad. Las fibras A-a inervan a músculos esqueléticos y también participan en la propriocepción. En condiciones normales, las fibras A-b intervienen en el tacto inocuo y presión, pero pueden intervenir en el “encordamiento” del sistema nervioso que puede provocar hiperalgesia, alodinia o ambos después de estimulación crónica de nociceptores. Las fibras A-g inervan los husos de músculo esquelético para mantener el tono muscular. Las fibras A-d intervienen en la percepción de temperatura, dolor rápido y tacto. Las fibras tipo B son fibras neurovegetativas preganglionares. Las fibras tipo C no están mielinizadas y se encargan de la inervación simpática posganglionar y transmisión de sensaciones del dolor visceral y lento, el tacto y la temperatura. La actividad nociceptiva anormal de las fibras C causa muchos síndromes de dolor crónico mejor descritos en seres humanos; dos ejemplos son la neuropatía diabética y la neuralgia posherpética. Es probable una disfunción similar de fibras C en diversas afecciones con dolor crónico en otras especies de mamíferos. Después de salir por el agujero intervertebral, cada nervio raquídeo se divide en las ramas dorsal y ventral. Las ramas dorsales suelen inervar a los músculos y la piel del dorso, mientras que las ramas ventrales inervan a los músculos y la piel de tórax, abdomen y extremidades. Pueden combinarse ramas de varios nervios raquídeos para formar plexos, como el plexo braquial, o nervios importantes, como el nervio ciático. 40 Manual de anestesia y analgesia en. . Funcionamiento neuronal Conducción axónica Los impulsos nerviosos son corrientes electroquímicas que pasan por el axón hasta la membrana presináptica. Desde el punto de vista farmacológico, existe una notable distinción entre la conducción eléctrica de un impulso nervioso a lo largo de un axón y la transmisión química de esta señal de un lado a otro de una sinapsis. La mayor parte de los anestésicos generales tiene escaso efecto sobre la velocidad de conducción nerviosa. Neurorreguladores Éstos tienen una participación clave en la comunicación entre células nerviosas y pueden subdividirse en dos grupos. Los neurotransmisores de molécula pequeña se sintetizan en el citosol de la terminal presináptica, se absorben en las vesículas de transmisor, y se liberan en la hendidura sináptica en respuesta a la llegada de un potencial de acción a la terminación nerviosa. La liberación de neurotransmisores depende de voltaje y requiere el ingreso (influjo) de calcio en la terminal presináptica. Después de su liberación, el transmisor se une al receptor postsináptico. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sistema nervioso autónomo En contraste con el sistema nervioso somático, que inerve los músculos estriados, el sistema nervioso autónomo no requiere control consciente. Está formado por los nervios eferentes y aferentes que inervan vísceras, glándulas y otros tejidos necesarios para la homeostasia y la respuesta de lucha o huida. Su principal función homeostásica es controlar circulación, respiración, excreción y mantenimiento de la temperatura corporal. Estas funciones regulatorias están sujetas a modificación por señales procedentes de centros encefálicos superiores, en especial como resultado de reacciones al ambiente. Las vías eferentes neurovegetativas (autónomas) viscerales consisten en dos neuronas en vez de una sola motoneurona, como en el sistema somático. El cuerpo celular (pericarion o soma) de la primera neurona se halla en el tallo encefálico o la médula espinal. Su axón termina en el soma de la segunda neurona, situada en un ganglio neurovegetativo. El axón de la célula ganglionar termina en la célula efectora. Las fibras aferentes viscerales neurovegetativa son sobre todo neuronas sensitivas similares a las de los tejidos somáticos, aunque tienden a presentar áreas receptivas más amplias, por lo que tienen menor capacidad de diferenciar el origen anatómico de las señales aferentes. Inducen respuestas reflejas en las vísceras y una sensación de plenitud en órganos huecos, como estómago, intestino grueso y vejiga. Impulsos aferentes contribuyen a las sensaciones de bienestar o malestar y transmiten señales desde los nociceptores. Las fibras aferentes de dolor visceral se vinculan con la división simpática. El hipotálamo es la principal región del encéfalo que controla el sistema nervioso autónomo. Éste puede subdividirse en el sistema craneosacro o parasimpático y el sistema toracolumbar o simpático. Una característica del sistema nervioso autónomo es que ambas divisiones están activas todo el tiempo, de lo que resulta un grado basal de actividad simpática y parasimpática. En consecuencia, cada división puede aumentar o disminuir su efecto en un órgano particular para regular de modo más estrecho su funcionamiento. Fisiología y farmacología anestésicas 41 La membrana posunión se excita por el aumento de la conductancia de sodio y se inhibe cuando se favorece la conductancia de potasio o cloruro. Algunos transmisores se unen a receptores que activan enzimas, lo que modifica el funcionamiento celular. Los moduladores neuropeptídicos se sintetizan en el soma neuronal y se desplazan a la terminal nerviosa por corrientes axónicas. Se liberan en respuesta a un potencial de acción, pero en cantidades mucho menores que los transmisores de molécula pequeña. Los neuropéptidos inducen efectos prolongados para amplificar o amortiguar la actividad neuronal. Ejercen sus efectos a través de diversos mecanismos, como cierre prolongado de los conductos de calcio, modificación del metabolismo celular, activación o desactivación de genes específicos, y alteración prolongada del número de receptores excitatorios o inhibitorios. Aunque por lo regular cada tipo de neurona sólo libera un neurotransmisor de molécula pequeña (ley de Dale), la misma neurona puede liberar uno o más moduladores neuropeptídicos al mismo tiempo. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Farmacología de los sedantes y los anticolinérgicos Anticolinérgicos Los anticolinérgicos se administran en el perioperatorio para tratar la bradicardia y el bloqueo AV relacionados con la manipulación quirúrgica (reflejos oculovagales y viscerovagales) o con la administración de otros fármacos coadyuvantes de anestésicos (p. ej., agonistas a2 u opioides). En ocasiones también se emplean para controlar el exceso de secreciones bucales y de vías respiratorias. Los anticolinérgicos no deben suministrarse en el perioperatorio de manera ilimitada. Más bien deben evaluarse los riesgos y beneficios de la administración de diferentes fármacos y elegirse los más seguros para cada paciente. Los anticolinérgicos se llaman a menudo parasimpaticolíticos porque bloquean los efectos del sistema nervioso parasimpático en otros aparatos y sistemas, en especial los aparatos circulatorio y digestivo. La atropina y glucopirrolato son los anticolinérgicos más empleados en medicina veterinaria. Estos dos fármacos no bloquean a receptores colinérgicos nicotínicos y es más exacto clasificarlos como antimuscarínicos. Existen tres tipos principales de receptores muscarínicos: M1, M2 y M3. Los receptores M1 se localizan en neuronas del SNC y en ganglios neurovegetativos. Los receptores M2 se ubican en los nódulos SA y AV y en el miocardio auricular. Los receptores M3 se hallan en glándulas secretorias, endotelio vascular y músculo liso. La atropina y glucopirrolato son antagonistas muscarínicos relativamente no selectivos, pero a pesar de esta falta de selectividad la eficacia del bloqueo muscarínico varía de forma notoria de un tejido a otro. Las glándulas salivales y bronquiales son las más sensibles al bloqueo muscarínico. Los tejidos cardiacos y músculo liso tienen sensibilidad intermedia y las células parietales gástricas son las menos sensibles al bloqueo muscarínico. De manera invariable, la administración de anticolinérgicos causa taquicardia sinusal, que es problemática para muchos pacientes con enfermedad cardiovascular. La taquicardia relacionada con la administración de anticolinérgicos incrementa el trabajo del miocardio y reduce su perfusión. Además, la coadministración de anticolinérgicos y ketamina se ha vinculado con infartos del miocardio y muerte en gatos jóvenes sometidos a intervenciones quirúrgicas regulares. A dosis 42 Manual de anestesia y analgesia en. . menores pueden surgir de manera transitoria decremento de la frecuencia sinusal y desaceleración de la conducción en el nódulo AV (bloqueo AV). Al parecer, esta respuesta se debe al bloqueo de los receptores muscarínicos presinápticos que por lo regular inhiben la liberación de acetilcolina (ACh). Una vez que se ha establecido el bloqueo muscarínico postsináptico, este incremento paradójico del tono vagal se resuelve casi siempre. La administración de anticolinérgicos también tiene efectos notables en el funcionamiento gastrointestinal. En dosis terapéuticas, los antagonistas muscarínicos no selectivos como la atropina y el glucopirrolato reducen el tono del esfínter esofágico inferior y tienen escaso efecto en el pH gástrico. Estos dos factores incrementan la incidencia de reflujo gastroesofágico y esofagitis en perros anestesiados. La administración perioperatoria de anticolinérgicos también atenúa la motilidad intestinal y puede ocasionar complicaciones gastrointestinales en el posoperatorio. Farmacocinética y farmacodinamia. La atropina se absorbe con rapidez después de la administración intramuscular (IM). El inicio de los efectos cardiovasculares aparece en el transcurso de los 5 min siguientes y los efectos máximos se alcanzan en 10 a 20 min. Tras la administración intravenosa de una dosis de 0.03 mg/kg, el inicio de los efectos cardiovasculares ocurre en el minuto siguiente, los efectos máximos se presentan en el transcurso de 5 min y la FC aumenta en 30 a 40% por unos 30 min. Los efectos de la atropina en otros aparatos y sistemas desaparecen en unas pocas horas, pero los efectos oculares pueden persistir por uno o dos días. La atropina se elimina con rapidez de la sangre después de la administración parenteral. Parte del fármaco se hidroliza hasta metabolitos inactivos (tropina y ácido trópico), y parte se excreta sin cambio en la orina. Los conejos y algunas otras especies (gatos y ratas) tienen una enzima plasmática (atropina esterasa) que acelera el metabolismo y la depuración del fármaco. En dosis terapéuticas, la atropina induce efectos limitados en el SNC. Puede observarse un efecto sedante leve y se reduce la incidencia de vómito mediado por el sistema vestibular. El bloqueo del músculo constrictor pupilar y el músculo ciliar provoca midriasis y cicloplejía prolongadas, respectivamente. También se reducen las secreciones lagrimales, lo que puede contribuir a la desecación corneal durante la anestesia, a menos que se apliquen al mismo tiempo lágrimas artificiales. La atropina debe usarse de manera juiciosa en animales con glaucoma agudo debido a que el efecto midriático puede impedir el drenaje desde la cámara anterior. El músculo liso de las vías respiratorias y las glándulas secretorias también reciben señales parasimpáticas desde los nervios neumogástricos. El bloqueo de los receptores M3 por dosis terapéuticas de atropina reduce las secreciones de las vías respiratorias e incrementa el diámetro de éstas y el espacio muerto anatómico. Con anterioridad se administraba atropina antes de los anestésicos inhalables peligrosos (éter) para reducir las secreciones de las vías respiratorias y el posible laringoespasmo. Los anestésicos inhalables modernos no provocan el mismo grado de © Editorial El manual moderno Fotocopiar sin autorización es un delito. Atropina Desde el punto de vista químico, la atropina consta de dos componentes (ácido trópico y una base orgánica) unidos por un enlace éster. La atropina tiene más o menos la misma afinidad por los tres tipos principales de receptores muscarínicos. Respecto de otros antagonistas muscarínicos sintéticos, la atropina es muy selectiva para los receptores muscarínicos y tiene escaso efecto sobre los receptores nicotínicos. Fisiología y farmacología anestésicas 43 irritación de las vías respiratorias y es difícil justificar la administración preoperatoria sistemática de atropina por esta razón. Usos clínicos. La atropina puede administrarse por las vías subcutánea (SC), IM o IV, pero se prefieren estas dos últimas porque la captación desde sitios subcutáneos es errática en pacientes con problemas de hidratación y circulación periférica. Las dosis para perros y gatos oscilan entre 0.02 y 0.04 mg/kg. La atropina también es eficaz cuando se administra por vía endotraqueal o endobronquial a perros para reanimación cardiopulmonar. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Glucopirrolato El glucopirrolato es un antagonista muscarínico sintético constituido por un compuesto de amonio cuaternario. Como la atropina, tiene dos componentes (ácido mandélico y una base orgánica) unidos entre sí por un enlace éster. El glucopirrolato es cuatro veces más potente que la atropina y tiene más o menos la misma afinidad por los tres tipos principales de receptores muscarínicos. La estructura polar del fármaco (amina cuaternaria) limita la difusión a través de las membranas lipídicas y hacia el SNC y la circulación fetal. Farmacocinética y farmacodinamia. La absorción, metabolismo y eliminación del glucopirrolato son similares a los propios de la atropina. La absorción es rápida por la vía IM. El inicio de los efectos cardiovasculares aparece en 5 min, los efectos máximos se presentan en los 20 min posteriores a la administración y la FC permanece elevada por alrededor de 1 h. El glucopirrolato se elimina con rapidez de la sangre después de la administración parenteral y la mayor parte del fármaco se excreta sin cambio en la orina. En dosis terapéuticas, el glucopirrolato tiene pocos efectos o ninguno en el SNC. A diferencia de lo que ocurre en el caso de la atropina, no se observa sedación, y los tiempos de recuperación no son prolongados. La administración de glucopirrolato a perros conscientes con presión intraocular normal no altera el diámetro pupilar ni la presión intraocular, y al parecer es seguro cuando se usa en el intraoperatorio en perros con glaucoma e hipertensión intraocular. El glucopirrolato tiene efectos cardiacos comparables a los de la atropina. Estudios en personas sugieren que el glucopirrolato produce menos taquicardia que la atropina, pero ambos fármacos inducen incrementos similares en la FC cuando se emplean por vía IV en perros sedados o anestesiados. La respuesta típica a la administración IV o IM de dosis terapéuticas (5 a 10 mg/ kg) de glucopirrolato es aumento del ritmo sinusal, aceleración de la conducción en el nódulo AV e incremento de la contractilidad auricular. En dosis menores es posible un decremento transitorio del ritmo sinusal y desaceleración de la conducción en el nódulo AV. El glucopirrolato también puede administrarse en el intraoperatorio para corregir la bradicardia. Como la atropina, el glucopirrolato afecta el aparato digestivo. La motilidad intestinal se reduce por un mínimo de 30 min en perros anestesiados. Usos clínicos. El glucopirrolato se usa en el perioperatorio para prevenir la bradicardia intensa causada por la manipulación quirúrgica (reflejos vagales) o por la administración de otros anestésicos. Las dosis para perros y gatos varían entre 5 y 10 mg/kg. 44 Manual de anestesia y analgesia en. . Fenotiazinas y butirofenonas Las fenotiazinas, y en menor grado las butirofenonas, producen una amplia variedad de efectos conductuales, neurovegetativos y endocrinos. Los efectos conductuales de estos fármacos tienen la mediación principal del bloqueo de receptores de dopamina en los ganglios basales y el sistema límbico. En dosis terapéuticas, las fenotiazinas y butirofenonas inhiben la conducta condicionada de evitación y reducen la actividad motora espontánea. Con dosis mayores pueden ocurrir efectos extrapiramidales (temblor, rigidez y catalepsia). Estos sedantes también tienen afinidad de unión significativa por receptores adrenérgicos y muscarínicos. Por ejemplo, las fenotiazinas se unen con gran afinidad a receptores adrenérgicos a1 y actúan como antagonistas de ellos, de lo cual resulta la hipotensión que suele relacionarse con el uso perioperatorio de estos fármacos. El bloqueo de receptores de dopamina en la zona activadora de los quimiorreceptores en el bulbo raquídeo tiene efecto antiemético y el agotamiento de catecolaminas en el centro termorregulador del hipotálamo ocasiona pérdida del control termorregulador. La acepromazina (una fenotiazina) es uno de los sedantes más utilizados en medicina veterinaria. Su nombre químico es 2-acetil-10-(3-dimetilaminopropil)-fenotiazina. Muchas veces se administra en combinación con un opioide como preanestésico para facilitar la colocación de catéteres IV y reducir la dosis de anestésicos inyectables e inhalables necesarios para inducir y mantener la anestesia. La acepromazina también puede indicarse en el posoperatorio para hacer más suave la recuperación, siempre que el paciente tenga estabilidad hemodinámica y haya recibido analgesia eficaz. Las dosis IM para gatos y perros pequeños fluctúan entre 0.01 y 0.2 mg/kg y para perros más grandes entre 0.01 y 0.05 mg/kg. En general, para la sedación leve a moderada en el periodo preanestésico o posanestésico son adecuadas las dosis menores de 0.05 mg/kg. Agonistas adrenérgicos a2 En la mayoría de las especies, los agonistas a2 producen sedación, analgesia y relajación muscular confiables dependientes de la dosis, las cuales pueden revertirse con la administración de antagonistas selectivos. La xilazina se ha usado en animales pequeños y grandes durante más de tres décadas. En especies pequeñas se ha empleado asimismo la medetomidina y en fechas más recientes su isómero purificado la dexmedetomidina. Los receptores a2 se localizan en tejidos de todo el cuerpo y la noradrenalina es su ligando endógeno. Los receptores a2 se encuentran antes y después de las sinapsis en tejidos neuronales y no neuronales y en un plano extrasináptico en el endotelio vascular y las plaquetas. Dentro del sistema nervioso, los receptores a2 tienen ubicación presináptica en neuronas noradrenérgicas (autorreceptores) y en neuronas no noradrenérgicas (heterorreceptores). Los efectos sedantes y ansiolíticos de los receptores a2 son mediados por la activación de autorreceptores supraespinales o receptores postsinápticos localizados en el puente de Varolio (locus ceruleus) y algunos © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sedantes Las respuestas conductuales a diferentes clases de sedantes varían de forma notoria entre las especies. Las fenotiazinas y los agonistas a2 son sedantes eficaces en perros y gatos. A la inversa, las benzodiazepinas son sedantes eficaces en hurones, conejos y aves, pero no son sedantes confiables en gatos y perros jóvenes. Fisiología y farmacología anestésicas 45 © Editorial El manual moderno Fotocopiar sin autorización es un delito. de los efectos analgésicos son mediados por la activación de heterorreceptores presentes en el asta dorsal de la médula espinal. Los receptores a2 supraespinales localizados en el puente de Varolio también tienen una función importante en la modulación descendente de señales aferentes nociceptivas. Se han identificado tres subtipos distintos de receptores a2 (A, B y C). La respuesta celular a la activación de estos subtipos celulares es mediada por varios mecanismos moleculares distintos. Medetomidina y dexmedetomidina. La medetomidina, o monohidrocloruro de (±)-4-(1-[2,3-dimetilfenil]-etil)-1H-imidazol, es una mezcla racémica de enantiómeros levógiros y dextrógiros. Toda o casi toda su acción farmacológica se debe al enantiómero dextrógiro, la dexmedetomidina. Poco después de que la medetomidina se aprobó para su uso en perros como analgésico sedante en Estados Unidos, la dexmedetomidina se aprobó para su administración en personas como un sedante posoperatorio en ese país. Como se esperaba, la dexmedetomidina es alrededor del doble de potente que la mezcla racémica disponible para su uso en animales. En perros y gatos, tanto la dexmedetomidina como la medetomidina tienen inicio rápido de acción y pueden administrarse por vía IV o IM. Después de la administración IM, el fármaco se absorbe con rapidez, y las concentraciones plasmáticas se alcanzan en 30 min. La eliminación tiene lugar sobre todo por biotransformación en el hígado y los metabolitos inactivos se excretan en la orina. El inicio de sedación, analgesia y relajación muscular es rápido después de la administración IM de la medetomidina en perros y gatos; la intensidad y duración de estos efectos dependen de la dosis. Cuando el fármaco se administra por vía IM a perros en dosis de 30 mg/kg, es evidente una sedación significativa en los 5 min siguientes y persiste por 1 a 2 h. De modo similar, cuando la medetomidina se suministra a gatos en dosis de 50 mg/kg, es notoria una sedación significativa en el transcurso de 15 min y persiste por 1 a 2 h. A estas dosis, la analgesia alcanza el máximo en 30 min y persiste por 1 a 2 h. La administración de medetomidina reduce en grado notable la necesidad de anestésicos inyectables e inhalables (en más de 50% en perros). El uso del fármaco por vía IM en dosis de 10, 20 y 40 mg/kg reduce la cantidad de tiopental necesaria para la intubación a 7.0, 4.5 y 2.4 mg/kg, respectivamente. De modo similar, el empleo de medetomidina IM en dosis de 20 mg/kg disminuye la cantidad de propofol necesaria para la intubación a 1.8 mg/kg. La administración de medetomidina IM también reduce la dosis de ketamina necesaria para inducir anestesia en perros y gatos. El suministro de la medetomidina IV en dosis de 30 mg/kg reduce la CAM del isoflurano en 47%. Además, la medetomidina IM en dosis de 8 mg/kg redujo de manera consistente el índice biespectral (un índice de la profundidad de la anestesia) en perros anestesiados con isoflurano (1.0, 1.5 y 2.0 CAM). Como en el caso de otros agonistas a2, la medetomidina provoca cambios en los parámetros cardiovasculares que suelen vigilarse. Los efectos cardiovasculares se describen mejor en dos fases: una fase periférica inicial caracterizada por vasoconstricción, aumento de la PA y bradicardia vagal refleja, y una fase central ulterior reconocible por disminución de tono simpático, FC impulsada por mecanismos simpáticos, y PA. En ocasiones ocurre bloqueo AV debido al incremento inicial de la PA y el incremento reflejo (mediado por barorreceptores) en el tono vagal. En perros Manual de anestesia y analgesia en. . conscientes, la presión arterial media aumenta de manera transitoria y la FC y el índice cardiaco decrecen en alrededor de 60% después de la administración IV de la medetomidina en dosis de 5 a 20 mg/kg. A estas dosis, los cambios en la PA media, presión venosa central y resistencia vascular son dependientes de la dosis, mientras que los cambios en FC e índice cardiaco no lo son. En gatos conscientes, al parecer la PA media no cambia (debido quizá a mayores grados de estrés de referencia) y la FC y el índice cardiaco descienden en alrededor de 50% después de la administración IM de medetomidina en dosis de 20 mg/kg. En gatos anestesiados con isoflurano (2%), la presión arterial media se eleva de 77 a 122 mm Hg, la FC disminuye de 150 a 125 latidos por minuto y el flujo arterial medio desciende de 578 a 325 mL/min 20 min después de la administración IM de 10 mg/kg de medetomidina. En animales conscientes, el decremento del GC se debe en mayor medida a la disminución de la FC y el incremento de la resistencia vascular, y no a una depresión directa de la contractilidad del miocardio. Aunque el GC aminora después de administrar medetomidina o dexmedetomidina, el flujo sanguíneo al corazón, encéfalo y riñones se mantiene por la redistribución del flujo desde órganos y tejidos menos vitales. En pacientes con reserva cardiopulmonar adecuada, la administración concurrente de un anticolinérgico impide las bradiarritmias, en tanto que mejora un poco el GC a expensas de un incremento más bien grande del trabajo miocárdico y el consumo de O2. En consecuencia, el uso en el preoperatorio de un anticolinérgico con agonistas a2 para prevenir bradicardia y bloqueo AV es todavía un tanto controvertido. Se ha recomendado administrar un anticolinérgico por las siguientes razones: primero, incluso a dosis preanestésicas bajas puede ocurrir bradicardia significativa si no se administra al mismo tiempo un anticolinérgico; en segundo lugar, el potencial de respuestas vagotónicas graves y bradicardia profunda, secundario a la manipulación quirúrgica y administración de otros anestésicos (opioides), es más alto durante el periodo perioperatorio; en tercer lugar, si bien la administración concurrente de anticolinérgicos con dosis altas de medetomidina puede precipitar aumentos notables de la resistencia vascular y trabajo del miocardio; estos incrementos pueden minimizarse y por lo general se toleran bien en pacientes sanos que reciben dosis bajas de medetomidina antes de la anestesia con fármacos inhalables (vasodilatadores). La administración de medetomidina tiene escaso efecto en el funcionamiento pulmonar. La frecuencia respiratoria y VE disminuyen con ese fármaco, pero al parecer tal descenso de VE es paralelo a un decremento de la producción metabólica de CO2, y los valores de gases en sangre arterial permanecen estables. La medetomidina ejerce efectos significativos en el funcionamiento gastrointestinal en animales. Hay vómito en 10% de los perros y más de 50% de los gatos que reciben el fármaco por vía IM en dosis medias de 40 y 80 mg/kg, respectivamente. El vómito incrementa en grado notable la presión intraocular, que es un problema potencial para algunos pacientes con lesión o enfermedad oculares. La medetomidina atenúa la liberación de gastrina y la motilidad intestinal y colónica en perros. Estos efectos son mediados por la activación de receptores a2 viscerales y la inhibición de la liberación de ACh. El empleo de medetomidina tiene efectos notorios en el funcionamiento renal y urogenital en animales. En perros, dicho fármaco (10 a 20 mg/kg IV) reduce la densidad de la orina y eleva la diuresis por unas 4 h. Al parecer, los agonistas a2 interfieren en la acción de la hormona antidiurética sobre los túbulos renales y los conductos colectores, lo que incrementa la producción de orina diluida. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 46 Fisiología y farmacología anestésicas 47 © Editorial El manual moderno Fotocopiar sin autorización es un delito. La administración preoperatoria de agonistas a2 atenúa la respuesta de estrés relacionada con el traumatismo quirúrgico. En perras sometidas a ovariohisterectomía, el uso preoperatorio de medetomidina reduce las concentraciones de catecolaminas y cortisol en el posoperatorio. De modo similar, la medetomidina preoperatoria (20 mg/kg IM) aminora los incrementos perioperatorios de las concentraciones de noradrenalina, adrenalina y cortisol en mayor medida que la acepromazina. La administración de xilazina o medetomidina activa a los receptores a2 en las células b pancreáticas e inhibe la liberación de insulina por unas 2 h, de lo que resulta un incremento de las concentraciones plasmáticas de glucosa. Como regla general, no debe administrarse medetomidina a animales pediátricos, geriátricos o con enfermedad neurológica, cardiovascular, respiratoria, hepática o renal significativa. Una vez que se administran fármacos preanestésicos y anestésicos, los pacientes deben vigilarse de cerca durante el periodo perioperatorio, con especial atención a la frecuencia y el ritmo cardiacos. Xilazina. Aunque su mecanismo de acción se desconocía cuando comenzó a usarse en la práctica clínica, la xilazina fue el primer agonista a2 empleado por veterinarios. Se sintetizó en la entonces Alemania Occidental en 1962 para su uso como antihipertensor en personas, pero se observó que tenía potentes efectos sedantes en animales. Su nombre químico es clorhidro-2(2,6dimetilfenilamino)-4H-5,6-dihidro-1,3-tiazina. Al principio se la usó como sedante en bovinos y otros rumiantes en Europa. A principios de la década de 1970, en la bibliografía veterinaria estadounidense y europea comenzaron a aparecer informes sobre la utilidad de la xilazina como coadyuvante de anestésicos. En esos informes se documentaba la eficacia de la xilazina para eliminar la hipertonicidad muscular en perros y gatos que recibían ketamina, y para producir sedación, analgesia y relajación muscular rápidas y predecibles en caballos y bovinos por vía IV. También resultó evidente que había una gran variación en la dosis de xilazina necesaria para generar grados equivalentes de sedación y analgesia en diferentes especies. En 1981, los efectos sedantes y analgésicos de la xilazina se vincularon de manera definitiva con la activación de receptores adrenérgicos a2 centrales. La mayoría de los estudios clínicos demuestra que los efectos sedantes y analgésicos de la xilazina son comparables en duración, y no apoyan la “sabiduría convencional” de que el efecto analgésico es significativamente más corto que el efecto sedante. La administración de xilazina reduce en grado notable la necesidad de anestésicos inyectables e inhalables en varias especies (de modo similar a como se observa para la dexmedetomidina). Antagonistas adrenérgicos a2 Los antagonistas a2 se emplean para revertir los efectos sedantes y cardiovasculares de los agonistas a2. En la actualidad se dispone de tres antagonistas (tolazolina, yohimbina y atipamezol) para su uso en animales, pero sólo el atipamezol se recomienda para revertir medetomidina y dexmedetomidina en especies pequeñas. Además de revertir los efectos sedantes y cardiovasculares de los agonistas a2, los antagonistas a2 pueden generar efectos secundarios significativos. Si se administra una sobredosis relativa de un antagonista, son posibles efectos secundarios neurológicos (excitación y temblores musculares), cardiovasculares (hipotensión y taquicardia) y gastrointestinales (salivación y diarrea). También 48 Manual de anestesia y analgesia en. . Sedantes benzodiazepínicos Las benzodiazepinas producen la mayoría de sus efectos farmacológicos al modular la neurotransmisión mediada por ácido g-aminobutírico (GABA). El GABA es el principal neurotransmisor inhibidor en el sistema nervioso de los mamíferos, y las membranas celulares de la mayor parte de las neuronas del SNC expresan receptores de GABA. Estos receptores también se encuentran fuera del SNC en ganglios neurovegetativos. Dos tipos importantes de receptores de GABA intervienen en la transmisión neuronal: el complejo receptor de GABAA es un conducto de cloruro controlado por ligando que consiste en un poro central rodeado por cinco subunidades glucoproteínicas. El sitio de unión a benzodiazepina, así como los sitios de unión para otros anestésicos inyectables (barbitúricos, propofol y etomidato), se localizan en el complejo receptor de GABAA. Las benzodiazepinas favorecen la unión entre GABA y receptor de GABAA, e incrementan la frecuencia de abertura del conducto. En contraste, los barbitúricos favorecen la actividad intrínseca e incrementan la duración de la abertura del conducto. Ambos mecanismos aumentan la conductancia del cloruro e hiperpolarizan la membrana celular, lo que reduce la excitabilidad neuronal. Las benzodiazepinas no tienen actividad agonista intrínseca y no pueden modificar la conductancia de cloruro en ausencia de GABA. Esta falta de actividad intrínseca limita la depresión del SNC y da a las benzodiazepinas un margen de seguridad mucho más amplio del que tienen los barbitúricos. Los ligandos que se unen a receptores de benzodiazepinas se clasifican en agonistas, agonistas inversos y antagonistas. Los agonistas se unen a receptores de benzodiazepinas y tienen efectos sedantes, ansiolíticos, miorrelajantes y anticonvulsivos en casi todos los animales. Los agonistas inversos se unen al mismo receptor y producen los efectos opuestos. Los antagonistas tienen alta afinidad por el receptor de benzodiazepinas y escasa o nula actividad intrínseca. Estos ligandos bloquean o revierten los efectos tanto de agonistas como de agonistas inversos. El diazepam, midazolam y zolazepam son los agonistas de benzodiazepinas que más se usan en medicina veterinaria. El diazepam y midazolam se administran sobre toto como sedantes, relajantes musculares y anticonvulsivos. El zolazepam está disponible en combinación con un anestésico disociativo (tiletamina) y está aprobado para su empleo como anestésico en perros y gatos en Estados Unidos. Diazepam. El nombre químico del diazepam es 7-cloro-1,3-dihidro-1-metil-5-fenil-2H1,4-benzodiazepin-2-ona. No es soluble en agua y las formulaciones parenterales contienen © Editorial El manual moderno Fotocopiar sin autorización es un delito. se han informado muertes después de la administración IV rápida. Es probable que el mecanismo implique la reversión rápida de la vasoconstricción sin tiempo suficiente para que el sistema nervioso simpático aumente el GC, con el resultado de hipotensión grave. La reversión completa de los efectos sedantes, analgésicos y cardiovasculares de la medetomidina se logra con la administración IM de atipamezol a perros y gatos en dosis de cuatro a seis veces y dos a cuatro veces (con base en microgramos administrados y no en volumen) la dosis de medetomidina, respectivamente. Por lo tanto, si la dosis inicial de medetomidina es de 20 mg/kg para un perro, entonces se administra atipamezol IM en una dosis de 100 mg/kg. De modo similar, si la dosis inicial de medetomidina es de 40 mg/kg para un gato, entonces se administra atipamezol IM en dosis de 120 mg/kg. En ambos ejemplos, la dosis de atipamezol puede reducirse si han transcurrido más de 30 min desde la administración de la medetomidina. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fisiología y farmacología anestésicas 49 40% de propilenglicol y 10% de etanol. El fármaco también es sensible a la luz y se adhiere al plástico, de tal modo que no debe almacenarse en jeringas de plástico por tiempo prolongado. El diazepam se utiliza en especial como relajante muscular y es un anticonvulsivo para perros y gatos. El diazepam es muy liposoluble y se distribuye con rapidez por todo el organismo. Alrededor de 90% del fármaco está unido a proteína y el diazepam se metaboliza por desmetilación e hidroxilación a N-desmetildiazepam (nordiazepam), 3-hidroxidiazepam, y oxazepam. El nordiazepam y el oxazepam producen efectos farmacológicos significativos a concentraciones clínicas. En perros, la semivida de eliminación del diazepam después de una dosis relativamente alta (2 mg/kg IV) es de 3.2 h. El nordiazepam aparece pronto en el plasma y excede con rapidez las concentraciones del diazepam, mientras que el oxacepam alcanza valores máximos en un lapso de 2 h. La semivida de eliminación de nordiazepam y oxacepam es de 3.6 y 5.7 h, en ese orden. En gatos, la semivida de eliminación del diazepam después de administrar dosis relativamente altas (5, 10 y 20 mg/kg IV) es de 5.5 h. Alrededor de 50% de la dosis del diazepam se convierte en nordiazepam y la semivida de eliminación media del metabolito es de 21 h, que es unas cuatro veces mayor que la semivida del diazepam. El diazepam no seda a los perros de manera confiable y puede causar excitación, disforia y ataxia. En perros, la administración IV de este fármaco (0.5 mg/kg) produce vigilia y excitación. El diazepam puede causar disforia y agresividad en gatos y debe emplearse en esta especie sin perder de vista dicha respuesta posible. Debido a esos efectos conductuales, el diazepam administrado solo (no combinado) tiene utilidad limitada como sedante para perros y gatos. El diazepam no es un sedante confiable, pero constituye un buen relajante muscular y anticonvulsivo en la mayoría de las especies. En perros se administra casi siempre por vía IV en dosis de 0.2 a 0.5 mg/kg inmediatamente antes de la inducción de la anestesia con ketamina. También puede administrarse antes de la inducción con tiopental, propofol, etomidato o un opioide. Al parecer, es un sedante más confiable en perros de mayor edad y puede suministrarse solo o combinado con un opioide para producir sedación en esta subpoblación. Muchas veces se infunden dosis más grandes cuando el diazepam se utiliza como anticonvulsivo. En animales pequeños, este fármaco se administra por vía IV en dosis de 0.5 a 1.0 mg/kg para controlar las convulsiones. La formulación parenteral del diazepam es muy irritante y potencialmente cardiotóxica y debe administrarse mediante inyección IV lenta. Midazolam. El midazolam es una benzodiazepina con un anillo imidazol fusionado que explica la hidrosolubilidad del fármaco a valores de pH menores de 4.0. Su nombre químico es 8-cloro-6-(2fluorofenil)-1-metil-4H-imidazol(1,5-a)(1,4)-benzodiazepina. El pH de la formulación parenteral es de 3.5 y el fármaco es fotosensible, como el diazepam. Al pH sanguíneo, el midazolam cambia su configuración química y se torna más liposoluble, lo cual facilita la difusión en los tejidos. El midazolam se absorbe casi por completo (>90%) después de inyección IM y las concentraciones plasmáticas máximas se alcanzan en un lapso de 15 min. El fármaco también sufre unión extensa a proteína (>95%) y cruza con rapidez la barrera hematoencefálica. Se hidroxila en el hígado y los conjugados glucurónidos se excretan en la orina. Por lo regular, el midazolam se administra para promover la relajación muscular y facilitar la intubación en perros y gatos, y se coadministra con ketamina, etomidato o propofol. Su 50 Manual de anestesia y analgesia en. . administración preanestésica (0.1 a 0.2 mg/kg IV) reduce la dosis de inducción de barbitúricos y propofol y la concentración de isoflurano requerida para mantener la anestesia durante la operación. El midazolam produce efectos mínimos en el funcionamiento cardiopulmonar en mamíferos y aves. Dado que este fármaco tiene efectos limitados en el funcionamiento cardiopulmonar, es un sedante ideal para muchos animales viejos o enfermos. En perros se administra solo en dosis de 0.2 a 0.4 mg/kg IM o combinado con opioides (butorfanol, hidromorfona u oximorfona) para inducir efectos sedantes. Puede usarse por vía IV en dosis de 0.1 a 0.2 mg/kg antes de la inducción de la anestesia con ketamina, tiopental, propofol o etomidato. Flumazenilo. El flumazenilo es un antagonista del receptor de benzodiazepinas competitivo muy selectivo. Su nombre químico es 3-carboxilato de etil-8-fluoro-5,6-dihidro-5-metil-6-oxo-4Himidazol-(1,5-a)-benzodiazepina. Se dispone de datos farmacocinéticos limitados para animales. Se ha informado una semivida de eliminación de 0.4 a 1.3 h en perros. En personas, el midazolam y el flumazenilo tienen perfiles farmacocinéticos similares, lo cual hace a este último un antagonista adecuado para el midazolam. El flumazenilo revierte con rapidez los efectos sedantes y miorrelajantes de los agonistas de benzodiazepinas en animales. En perros, la administración del flumazenilo revierte por completo los efectos conductuales y miorrelajantes de una sobredosis de diazepam (2 mg/kg IV) o midazolam (1 mg/kg IV) en un lapso de 5 min. Además, el flumazenilo puede revertir los efectos anticonvulsivos de los agonistas de benzodiazepinas. Aunque tiene actividad intrínseca mínima, la administración del antagonista puede facilitar el desarrollo de convulsiones en animales predispuestos. Al parecer, el flumazenilo también ejerce efectos mínimos en el funcionamiento cardiopulmonar en animales. En la actualidad es el único antagonista de las benzodiazepinas empleado en medicina veterinaria. En perros, una sobredosis de diazepam (2.0 mg/kg IV) o midazolam (1.0 mg/kg IV) puede antagonizarse de manera eficaz con flumazenilo en dosis de 0.08 mg/kg. Estas dosis corresponden a cocientes agonista/antagonista de 26:1 y 13:1 para diazepam/flumazenilo y midazolam/flumazenilo, respectivamente. Anestésicos inyectables Los anestésicos inyectables se usan para inducir un estado inconsciente o hipnótico o se administran por inyección repetida e infusión continua a fin de mantener la depresión mental necesaria para la anestesia. Continúa la búsqueda de nuevos fármacos y combinaciones con © Editorial El manual moderno Fotocopiar sin autorización es un delito. Antagonistas de benzodiazepinas Los antagonistas tienen gran afinidad por el receptor de benzodiacepinas, pero carecen de actividad intrínseca y están relativamente exentos de efectos secundarios. Además, los antagonistas de benzodiazepinas no pueden revertir los efectos de los anestésicos (barbitúricos) que se unen a otros sitios en el complejo receptor de GABAA. El flumazenilo es el único antagonista de benzodiazepinas disponible en la actualidad para uso clínico. En animales, se emplea en mayor medida para revertir los efectos sedantes y miorrelajantes del diazepam y otras benzodiazepinas. Fisiología y farmacología anestésicas 51 perfiles farmacocinéticos-farmacodinámicos apropiados para su empleo en animales domésticos y silvestres. En animales, a diferencia de lo que ocurre en el ser humano, no es posible obtener sólo con opioides un estado que tienda a la anestesia general. En consecuencia, en la anestesia veterinaria los opioides se han utilizado en mayor medida como analgésicos en el perioperatorio y como coadyuvantes de anestésicos para inducir un estado de neuroleptoanestesia, y no solos como anestésicos IV. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Barbitúricos Los barbitúricos se han clasificado en cuatro grupos por la duración de sus efectos: larga, intermedia, corta y ultracorta. Todos los usados para anestesia clínica corresponden a los grupos de acción corta y ultracorta, mientras que los suministrados para sedación o control de convulsiones son de acción larga o intermedia. El principal efecto de un barbitúrico es la depresión del SNC por interferencia con el paso de impulsos hacia la corteza cerebral. Los barbitúricos actúan de manera directa en neuronas del SNC de modo similar a como lo hace el transmisor inhibitorio GABA. A las concentraciones clínicas, los barbitúricos tienen dos mecanismos de acción en los receptores de GABAA. A concentraciones bajas ejercen un efecto GABAmimético al reducir la tasa de disociación del GABA desde el receptor de GABAA. A concentraciones crecientes activan de manera directa el conducto de cloruro relacionado con el receptor de GABAA. Se piensa que los efectos GABAmiméticos de los barbitúricos intervienen en las acciones sedantes e hipnóticas, mientras que la activación directa del conducto de cloruro causa las acciones anestésicas. Los barbitúricos se difunden por todo el cuerpo, penetran las paredes celulares y cruzan la placenta. La magnitud de ionización, liposolubilidad (coeficiente de reparto, CR) y unión a proteína son los tres factores más importantes para la distribución y eliminación de los barbitúricos. Fenobarbital sódico El fenobarbital es un barbitúrico de acción larga, un efecto prolongado que se ha aprovechado para tratar diversos trastornos convulsivos. Dicho fármaco no se usa como anestésico. Sin embargo, la coadministración de algunos anestésicos que metaboliza la misma enzima microsómica puede tener como resultado semivida y efecto más breves debido a la inducción de la enzima microsómica. Pentobarbital sódico La duración de la anestesia quirúrgica con dosis anestésicas (~30 mg/kg) de pentobarbital varía en grado notable entre los animales individuales, pero promedia unos 30 min. La recuperación completa suele ocurrir en 6 a 18 h. En ocasiones, los animales (en particular gatos) no despiertan hasta por 24 a 72 h. Debido al mayor tiempo de recuperación y a la disponibilidad de compuestos con acción corta más predecible, el pentobarbital ya no se emplea en Estados Unidos para producir anestesia en la mayoría de las especies pequeñas de compañía. Sin embargo, es el principal componente de la mayoría de las soluciones de eutanasia inyectables. Metohexital sódico Es un singular barbitúrico de acción ultracorta porque no contiene un átomo de azufre. Su efecto breve se debe más a la redistribución que al metabolismo rápido. La dosis para perros y gatos es 52 Manual de anestesia y analgesia en. . Tiopental sódico El tiopental es el análogo azufrado del pentobarbital sódico y difiere sólo en que el carbono 2 está unido a un átomo de azufre en vez de uno de oxígeno. Tiene acción ultracorta debido a su redistribución rápida (p. ej., en el tejido muscular) y se aloja en la grasa corporal. Cuando las concentraciones de tiopental en plasma, músculo y vísceras decrecen, la concentración en grasa sigue en aumento. Por otra parte, una cantidad considerable se metaboliza en el hígado y ello contribuye a la rápida reducción temprana de la concentración arterial del fármaco. Para la inducción rápida de anestesia de corta duración, la dosis es de 10 a 12 mg/kg. Si se requieren 10 a 20 min de anestesia quirúrgica, el intervalo posológico es de 20 a 30 mg/kg. Un tercio de la dosis calculada se inyecta con rapidez en 15 s y el resto se administra con lentitud hasta el efecto deseado. Pueden infundirse dosis adicionales para prolongar la anestesia cuando se requiera. Después de dosis grandes, la recuperación (hasta la incorporación) requiere 1 a 1.5 h. Las dosis grandes saturan los tejidos y causan un final de la anestesia prolongado. Cuando la inducción va precedida de sedación preanestésica, se emplea un intervalo de dosificación de 8 a 15 mg/kg (figura 2-10). En ocasiones, los animales luchan durante la inducción de la anestesia con barbitúrico y parte del fármaco puede administrarse por vía perivascular. Esto debe evitarse en todo lo posible porque puede ocurrir esfacelación. Si se sospecha que la solución de barbitúrico se ha inyectado en un sitio perivascular, la zona debe infiltrarse con 1 o 2 mL de solución de lidocaína al 2%. Los anestésicos locales son eficaces por dos razones. Primero, son vasodilatadores y previenen el vasoespasmo en la zona, y por tanto ayudan a la dilución y absorción del barbitúrico. En segundo lugar, se degradan en un medio alcalino, y esta reacción neutraliza el álcali (barbitúrico). El uso de compresas calientes o hidroterapia puede ser benéfico, al igual que la infiltración de la zona con solución salina para diluir aún más el barbitúrico. Además, los antiinflamatorios sistémicos pueden ser benéficos. Neuroesteroides Esta clase de fármacos se valoró de forma inicial como una combinación de dos esteroides: alfaxalona y acetato de alfadolona. La combinación de los dos esteroides tiene un índice terapéutico excepcionalmente alto (30.6). Su efecto acumulativo es bajo y la duración de la anestesia varía con la especie. Se ha desarrollado un nuevo producto neuroesteroideo consistente en una solución de 10 mg/mL de alfaxalona en 2-hidroxipropil-b-ciclodextrina. Al parecer, este preparado no induce la liberación de histamina, que se ha relacionado con el vehículo que se usaba en preparados neuroesteroideos anteriores. © Editorial El manual moderno Fotocopiar sin autorización es un delito. de 6 a 10 mg/kg de peso corporal. La mitad de la dosis calculada se inyecta por vía IV con rapidez, seguida de la administración hasta el efecto deseado. Con la inyección inicial se obtiene anestesia quirúrgica por 5 a 15 min. Puede mantenerse una anestesia más prolongada con administración intermitente o en goteo continuo. La recuperación es rápida y puede acompañarse de temblores musculares y excitación intensa, lo que afecta la utilidad del fármaco. Incluso con sedación preanestésica, el periodo de recuperación se caracteriza por temblores musculares y combatividad. Los perros son ambulatorios 30 min después de que cesa la administración. Fisiología y farmacología anestésicas Efecto acumulativo del tiopental 1a Inyección 53 2a 3a 4a 15 30 45 Tiempo (min) 60 75 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 2-10. Duración promedio de la anestesia después de inyecciones IV horarias sucesivas de dosis iguales de tiopental en perros. Fuentes: Adaptado a partir de datos publicados en Wyngaarden J.N., Woods L.A., Ridley R., Seevers M.H. 1949. Anesthetic properties of sodium-5-allyl-5-(1-methylbutyl)-2-thiobarbiturate (Surital) and certain other thiobarbiturates in dogs. J Pharmacol Exp Ther 95:322; y Branson K.R. 2007. Injectable and alternative anesthetic techniques. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 284. Etomidato En apariencia, el etomidato funciona de manera similar a como lo hacen el propofol y los barbitúricos, en el sentido de que favorece la acción del neurotransmisor inhibitorio GABA. Las inyecciones individuales producen hipnosis relativamente breve. En perros, las dosis son de 1.5 y 3.0 mg/kg duran 8 ± 5 min y 21 ± 9 min, respectivamente. El etomidato se hidroliza con rapidez en el hígado y se excreta en la orina. La inducción y la recuperación son rápidas, con un breve lapso de mioclono al principio del periodo de recuperación. Se introdujo en Estados Unidos como un agente de inducción para pacientes humanos de bajo riesgo porque no deprime los aparatos circulatorio y respiratorio ni libera histamina. Cuando se usa solo en perros, no produce cambios en FC, PA o desempeño miocárdico. Los recién nacidos de madres anestesiadas con etomidato tienen depresión respiratoria mínima. El etomidato inhibe la esteroidogénesis suprarrenal en perros, al suprimir el incremento habitual del cortisol plasmático que se observa durante la operación. Una sola dosis de inducción de etomidato puede deprimir la actividad suprarrenal hasta por 3 h. Sin embargo, la falta de una respuesta de estrés a la intervención no tiene efectos perjudiciales y se ha aducido que la atenuación de las respuestas metabólica y endocrina a la operación reduce en realidad la morbilidad; este efecto singular del etomidato podría ser benéfico para el resultado global. Se ha concedido atención al desarrollo de crisis addisonianas a causa del bloqueo de la producción de corticosteroides inducido por el etomidato durante la infusión prolongada para mantener la 54 Manual de anestesia y analgesia en. . Propofol El propofol (2,6-diisopropilfenol) no guarda relación con los barbitúricos, euganoles o anestésicos esteroides. Antes de 2010 sólo se comercializaba en Estados Unidos como una emulsión acuosa que contenía 10 mg de propofol, 100 mg de aceite de soya, 22.5 mg de glicerol y 12 mg de lecitina de huevo por mililitro. La emulsión de propofol puede sostener la proliferación microbiana y la producción de endotoxinas. Debido al potencial de septicemia yatrógena, el propofol no utilizado que queda en un frasco ámpula abierto debe descartarse y no conservarse toda una noche para usarse el día siguiente. Algunas formulaciones contienen inhibidores de la proliferación bacteriana para impedir la contaminación después de abrir una ampolleta, pero estos aditivos no inhiben por completo la multiplicación de microorganismos, de tal modo que aun en este caso el propofol no usado debe desecharse 6 h después de abrir la ampolleta o el frasco ámpula, a menos que se especifique por escrito una mayor vida de almacenamiento. El inicio rápido de acción se debe a la captación acelerada por el SNC. La acción corta y la cesación suave y pronta de la anestesia son resultado de la redistribución rápida del encéfalo a otros tejidos y la eliminación eficiente desde el plasma por metabolismo. El propofol tiene un gran volumen de distribución, como se esperaría por su naturaleza lipófila. Se metaboliza sobre todo por conjugación, pero la rápida desaparición del propofol desde el plasma es mayor que el flujo sanguíneo hepático, lo cual sugiere sitios extrahepáticos de metabolismo. Si la administración es precedida por un preanestésico como morfina o dexmedetomidina, la dosis de inducción de propofol puede reducirse en grado sustancial. La dosis para la inducción de anestesia en perros no premedicados varía de 6 a 8 mg/kg IV, mientras que la dosis en animales sedados puede ser apenas de 2 a 4 mg/kg IV. El ritmo de infusión continua para el mantenimiento de la anestesia es de 0.15 a 0.4 mg/kg/min. Cuando se usa una técnica de bolo intermitente, se administran dosis de 0.5 a 2 mg/kg, según se requiera. El propofol es un compuesto fenólico y por tanto puede inducir lesión oxidativa en los eritrocitos felinos cuando se administra de manera repetida durante varios días. Este efecto tóxico es quizá el resultado de la baja capacidad del gato de conjugar fenol. Se forman cuerpos de Heinz y puede haber signos clínicos como anorexia, diarrea y malestar general. © Editorial El manual moderno Fotocopiar sin autorización es un delito. sedación en pacientes bajo cuidados intensivos. En consecuencia, no se recomienda la infusión a largo plazo. El etomidato (2 mg/kg) puede provocar hemólisis aguda. Al parecer, en el mecanismo de la hemólisis interviene el etilenglicol, que genera un incremento rápido de la osmolalidad que induce rompimiento de eritrocitos. El etomidato es compatible con otros preanestésicos comunes. Es frecuente el dolor venoso con la inyección en seres humanos y puede ocurrir mioclonía si no se administra premedicación. La náusea y el vómito son problemáticos, en especial después del uso de múltiples dosis y pueden presentarse en la recuperación y la inducción. En mayor medida, estos efectos secundarios pueden prevenirse mediante sedación preanestésica adecuada. En resumen, el etomidato puede ser uno de los mejores fármacos de inducción en pacientes traumatizados o con miocardiopatía grave, inestabilidad cardiovascular, cirrosis o lesiones intracraneales, o en pacientes que requieren operación cesárea. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fisiología y farmacología anestésicas 55 Anestésicos disociativos El término anestesia disociativa se emplea para describir un estado anestésico inducido por fármacos que interrumpen la transmisión ascendente desde las partes del encéfalo encargadas de las funciones conscientes e inconscientes, no tanto por la depresión generalizada de todos los centros encefálicos, como se observa con la mayor parte de los anestésicos generales restantes. La anestesia disociativa se caracteriza por un estado cataleptoide en el cual los ojos permanecen abiertos con una mirada nistágmica lenta. A menudo ocurren grados variables de movimiento hipertónico y deliberado o reflejo de músculos esqueléticos sin relación con estimulación quirúrgica. La analgesia producida por anestésicos disociativos ocurre con dosis subanestésicas. Los elevados umbrales del dolor se correlacionan con concentraciones plasmáticas de ketamina de 0.1 mg/mL o mayores. Al parecer, el grado de analgesia es mayor para el dolor somático que para el dolor visceral. En gatos, la analgesia visceral inducida por ketamina (2, 4 y 8 mg/kg IV) es similar a la producida por butorfanol (0.1 mg/kg IV). Con dosis crecientes de ketamina, o cuando se administran de manera simultánea ketamina y butorfanol, la analgesia visceral no aumenta. A una dosis alta de ketamina (8 mg/kg), los gatos lucen anestesiados pero aún reaccionan a la estimulación de nociceptores colónicos, lo cual sugiere analgesia visceral limitada en gatos y tal vez en otras especies. Es posible que los anestésicos disociativos sean más útiles para la anestesia y la analgesia posoperatoria relacionadas con cirugía tegumentaria y musculoesquelética superficial. En apariencia, los receptores de N-metil-d-aspartato (NMDA) participan en las respuestas hiperalgésicas después de lesión e inflamación de tejidos periféricos, lo cual sugiere que la ketamina (y quizá otros anestésicos disociativos) serían eficaces para reducir la hiperalgesia después del traumatismo tisular. La infiltración local de ketamina puede producir un breve periodo de efecto anestésico local. Cuando se administra junto con bupivacaína, la ketamina duplica la duración de los efectos analgésicos y anestésicos locales de la bupivacaína. Este efecto analgésico periférico de la ketamina puede atribuirse a uno de los siguientes mecanismos o todos ellos: 1) bloqueo de las corrientes de sodio y potasio en nervios periféricos; 2) bloqueo de receptores de NMDA, ácido a-amino-hidroxi-5-metil-4-isoxazolpropriónico (AMPA) y kainato en axones no mielinizados; y 3) efectos del bloqueo del glutamato en terminaciones nerviosas sin fibras C. De modo similar a lo observado con la administración sistémica, la ketamina epidural produce al parecer analgesia somática profunda pero analgesia visceral deficiente. La administración epidural tiene acción analgésica dependiente de la dosis. Los anestésicos disociativos inducen incrementos significativos de FSC, PIC y presión del LCR como resultado de vasodilatación encefálica y PA sistémica elevada. Casi nunca están indicados en todos los pacientes en riesgo de hipertensión intracraneal, en particular cuando se administran en presencia de otro anestésico o cuando se establece ventilación controlada. Sin embargo, debe evitarse la ketamina en pacientes que respiran de manera espontánea con sospecha de hipertensión intracraneal o enfermedad hasta que se disponga de evidencia científica que demuestre lo contrario. Puede sobrevenir un comportamiento anormal que tal vez avance al delirio durante el final de la anestesia disociativa. La depresión del colículo inferior y el núcleo geniculado medial, que ocasiona interpretación errónea de estímulos auditivos y visuales, puede ser la causa de esta reacción. Las reacciones al final de la anestesia se caracterizan por ataxia, aumento de la actividad motora, hiperreflexia, sensibilidad al tacto y algunas veces recuperación violenta. Estas reacciones suelen desaparecer en varias horas sin recurrencia. 56 Manual de anestesia y analgesia en. . Uso clínico en perros En perros, los anestésicos disociativos pueden incrementar el tono muscular e inducir movimiento espontáneo y recuperación súbita, así como convulsiones. Para reducir estos efectos indeseables, dichos fármacos se adminitran a menudo en combinación con coadyuvantes. Las benzodiazepinas inducen un efecto miorrelajante central que reduce la hipertonicidad muscular relacionada con la ketamina. El zolazepam se combina con tiletamina en una proporción fija en la mezcla patentadaTelazol®. Esta combinación reduce los efectos adversos de la tiletamina cuando se administra sola, aunque el metabolismo del zolazepam puede variar entre especies y tener como resultado un efecto más prolongado o reducido que el de la tiletamina. En perros, la infusión IV continua de una dosis baja de ketamina (10 mg/kg/ min) reduce la CAM del isoflurano en 25%, mientras que la infusión continua de una combinación de morfina (3.3 mg/kg/min), lidocaína (50 mg/kg/ min) y ketamina (10 mg/kg/min) ha reducido el requerimiento de isoflurano hasta en 45%. Se ha informado que la administración concurrente de combinaciones de morfina-lidocaína o morfina-ketamina reduce la hipersensibilidad del SNC en personas con dolor inflamatorio o neuropático. Uso clínico en gatos En gatos, los fármacos disociativos se han utilizado como anestésicos primarios. El diazepam (0.3 mg/kg) se mezcla a menudo en la misma jeringa con ketamina (5.5 mg/kg) y se administra con lentitud por vía IV para la anestesia a corto plazo. Se ha demostrado que ésta es una combinación segura en gatos con disfunción cardiovascular. También se ha usado con éxito diazepam (0.22 mg/kg IV o 0.44 mg/kg IM) seguido de ketamina (1 a 5 mg/kg IM) en pacientes geriátricos. Telazol® se ha empleado solo o en combinación en gatos. Al parecer, el zolazepam se metaboliza © Editorial El manual moderno Fotocopiar sin autorización es un delito. Los efectos cardiovasculares de los anestésicos disociativos se caracterizan por estimulación cardiovascular indirecta. Algunos de los efectos en órganos blanco son acciones simpatomiméticas mediadas desde el interior del SNC, inhibición de la captación neuronal de catecolaminas por terminaciones nerviosas simpáticas, vasodilatación directa de músculo liso vascular, y un efecto inotrópico en el miocardio. Por lo regular, la FC y la PA aumentan como resultado de la elevación de la actividad eferente simpática. Se ha demostrado que la ketamina suprime la activación del factor nuclear neuronal inducido por entotoxina kB, el cual regula la producción de citocinas proinflamatorias, como factor de necrosis tumoral a en células del glioma humano in vitro y células encefálicas de ratón in vivo. Por lo tanto, en teoría, la ketamina puede tener algunos efectos neuroprotectores durante la endotoxemia. Los anestésicos disociativos incrementan a menudo la salivación y las secreciones de vías respiratorias, lo que puede controlarse en parte con la administración de un antimuscarínico (p. ej., atropina). Los reflejos laríngeo y faríngeo se conservan en parte o por completo durante la anestesia disociativa. No obstante, los reflejos de deglución pueden estar un tanto embotados, ya que la mayoría de las especies puede intubarse cuando se las anestesia con ketamina. Siempre deben manejarse con cuidado las vías respiratorias o la intubación endotraqueal (o ambas) para prevenir la aspiración. Fisiología y farmacología anestésicas 57 con más lentitud que la tiletamina en esta especie, con el resultado de miorrelajación y sedación residuales, lo cual retrasa muchas veces la recuperación completa. Se ha evaluado el uso de oximorfona, morfina, meperidina y butorfanol combinados con ketamina en gatos. Anestésicos inhalables © Editorial El manual moderno Fotocopiar sin autorización es un delito. Los anestésicos inhalables se administran de forma amplia en veterinaria. Son únicos entre los anestésicos porque se administran (y en gran medida se eliminan del organismo) por la vía pulmonar. Su aceptación se debe en parte a que sus características farmacocinéticas favorecen el ajuste predecible y rápido de la profundidad de la anestesia. Además, se utiliza casi siempre un aparato especial para suministrar los fármacos inhalables. Este aparato incluye una fuente de oxígeno (O2) y un circuito respiratorio en el paciente que, a su vez, incluye una sonda endotraqueal o mascarilla, un medio para eliminar dióxido de carbono (CO2) y un depósito de gas distensible. Estos componentes ayudan a minimizar la morbilidad o morbilidad porque facilitan la ventilación pulmonar y mejoran la oxigenación arterial. Además, en la actualidad es fácil y económico medir casi al instante la concentración de anestésicos inhalables en muestras de gas. Tal medición hace más preciso y seguro el manejo anestésico más allá de lo que suele ser posible con anestésicos inyectables. Características fisioquímicas La estructura química de los anestésicos inhalables y sus propiedades físicas determinan sus acciones y seguridad de administración. Los aspectos fisioquímicos que se presentan en los cuadros 2-1 y 2-2 determinan o influyen en consideraciones prácticas acerca de su uso clínico. Por ejemplo, determinan la forma en que el fabricante los suministra (p. ej., gas o líquido) y explican la resistencia de la molécula de anestésico a la degradación por factores físicos (p. ej., calor y luz) y sustancias con las que entra en contacto durante su uso (p. ej., componentes metálicos del aparato de suministro de anestésico y los absorbentes de CO2, como cal). El equipo necesario para suministrar el fármaco de manera segura a los pacientes (p. ej., vaporizador y circuito respiratorio) es influido por algunas de estas propiedades, al igual que captación del fármaco y distribución en el paciente y eliminación desde él (incluido el potencial de degradación metabólica). Características químicas Todos los anestésicos inhalables actuales son compuestos orgánicos excepto N2O y xenón. Los más importantes se clasifican en hidrocarburos alifáticos (de cadena recta o ramificada) y éteres (dos radicales orgánicos unidos a un átomo de oxígeno; la estructura general es ROR). En la continua búsqueda de un anestésico inhalable no inflamable menos reactivo y más potente ha predominado el interés por la halogenación (la adición de flúor, cloro o bromo; el yodo es menos útil) de estos compuestos. Características físicas Se observa un intercambio constante de gases respiratorios (O2 y CO2) entre las células y el ambiente externo a través de la sangre. La anestesia por inhalación implica consideraciones adi- 168 1.47 23.5 Peso molecular (g) Densidad (fase líquida a 20°C) (g/mL) Punto de ebullición (°C) 209.7 mL vapor/mL líquido a 20°C Sí Radiación UV Sí Sí Ninguno 197.5 207 172 57 1.52 185 Enflurano No No Sí 227 288 2.43 50 1.86 197 Halotano Sí Sí Ninguno 194.7 286 240 49 1.49 185 Isoflurano No No No disponible 206.9 28 23 105 1.42 165 Metoxifluranoa Sí Sí Ninguno – – – -89 1.42 44 N 2O ? No Sí 182.7 183 160 59 1.52 200 Sevoflurano © Editorial El manual moderno Fotocopiar sin autorización es un delito. Excepto por las referencias nuevas en donde se indica, los datos bibliográficos aparecen en la edición anterior de este texto y capítulo. a El metoxiflurano ya no se comercializa. Fuente: Steffey E.P., Mama K.R. 2007. Inhalation anesthetics. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 357. N2O, óxido nitroso. Sí Cal Estabilidad en: Ninguno 804 a 24°C Conservador 700325 a 20°C Presión de vapor (mm Hg) Desflurano Algunas propiedades físicas y químicas de los anestésicos inhalables Propiedad Cuadro 2-1. 58 Manual de anestesia y analgesia en. . Fisiología y farmacología anestésicas Cuadro 2-2. Solvente Agua Sangre Aceite de oliva Encéfalo Hígado Riñón Músculo Grasa 59 Coeficientes de reparto (solvente/gas) de los anestésicos inhalables a 37°C Desflurano Enflurano Halotano Isoflurano – Metoxiflurano N2O Sevoflurano 0.78 0.82 0.62 4.50 0.47 0.60 0.42 18.70 2.00 96.00 2.54 224.00 1.46 91.00 15.00 970.00 0.47 1.40 0.68 47.00 1.30 1.30 1.00 2.00 27.00 2.70 3.70 1.90 2.20 83.00 1.90 2.10 1.00 3.40 51.00 1.60 1.80 1.20 2.90 45.00 20.00 29.00 11.00 16.00 902.00 0.50 0.38 0.40 0.54 1.08 1.70 1.80 1.20 3.10 48.00 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Las muestras de tejido provienen de seres humanos. Los datos se tomaron de fuentes citadas en la edición anterior de este texto y capítulo. Fuente: Steffey E.P., Mama K.R. 2007. Inhalation anesthetics. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 359. N2O, óxido nitroso. cionales para que un anestésico se transfiera de manera controlada desde un recipiente hasta sus sitios de acción en el SNC. Al principio de este proceso, el fármaco se diluye a una concentración apropiada y se administra al aparato respiratorio en una mezcla gaseosa que contiene al menos el O2 suficiente para mantener la vida. La cadena de sucesos que resulta es influida por muchas características físicas y químicas que pueden describirse de manera cuantitativa. Las características físicas de la acción de los anestésicos inhalables que es importante conocer pueden dividirse de manera conveniente en dos categorías generales: las que determinan el medio por el cual se administran los fármacos y las que ayudan a determinar su cinética en el organismo. Esta información se aplica para manipular la inducción y la recuperación de la anestesia y para facilitar de manera oportuna los cambios en la depresión del SNC inducida por el anestésico. Propiedades que determinan los métodos de administración. Una variedad de propiedades físicas y químicas determinan los medios por los cuales se administran los anestésicos inhalables. Entre ellas se incluyen características como peso molecular, punto de ebullición, densidad en el estado líquido (peso específico o densidad relativa) y presión de vapor. Los anestésicos inhalables son gases o vapores. En el estudio de los anestésicos inhalables, el término gas se refiere a un fármaco, como el N2O, que existe en su forma gaseosa a la temperatura ambiente y la presión al nivel del mar. El término vapor indica el estado gaseoso de una sustancia que a la temperatura y la presión ambientales es un líquido. Con la excepción del N2O, todos los anestésicos actuales corresponden a esta categoría. Es desflurano es uno de los líquidos volátiles que se encuentran cerca del punto del transición y tienen algunas características únicas. Ya sea que los anestésicos inhalables se suministren como gases o como líquidos volátiles en condiciones ambientales, los mismos principios físicos se aplican a todos cuando se encuentran en el estado gaseoso. Las moléculas se mueven al azar a grandes velocidades y chocan entre sí Manual de anestesia y analgesia en. . o contra las paredes del recipiente. La fuerza del bombardeo puede medirse y se conoce como presión. Relaciones como las descritas por la ley de Boyle (volumen contra presión), la ley de Charles (volumen contra temperatura), la ley de Gay-Lussac (temperatura contra presión) y la ley de Dalton de las presiones parciales (la presión total de una mezcla de gases es igual a la suma de las presiones parciales de todas las sustancias gaseosas presentes), entre otras, son importantes para la comprensión global de las características de gases y vapores respiratorios y anestésicos. Las cantidades de anestésicos inhalables se caracterizan por uno de tres métodos: presión (milímetros de mercurio [mm Hg]), concentración (volumen porcentual [vol%]) o masa (miligramos [mg] o gramos [g]). La forma más familiar para los veterinarios es la concentración (p. ej., concentración de un fármaco A en relación con la mezcla total de gases). El equipo de vigilancia moderno muestrea gases inspirados y espirados y proporciona lecturas de concentración de anestésicos inhalables. Los vaporizadores de precisión usados para controlar el suministro de anestésicos inhalables se calibran en porcentajes de fármaco y las dosis efectivas casi siempre se informan como porcentajes. La presión es también una forma importante de describir los anestésicos inhalables y se describe de forma adicional como una medida de la potencia de un anestésico. Una mezcla de gases en un recipiente cerrado ejercerá presión contra las paredes del recipiente. La presión individual de cada gas en una mezcla de gases es su presión parcial. En muchos cálculos se utilizan el peso molecular y la densidad del fármaco para convertir volumen y masa de líquido en volumen y masa de vapor. De manera sinóptica, el principio de Avogadro establece que volúmenes iguales de todos los gases bajo las mismas condiciones de temperatura y presión contienen el mismo número de moléculas (6.0226 × 1023 [número de Avogadro] por peso molecular gramo). Además, en condiciones estándares, el número de moléculas de gas en un peso molecular gramo de una sustancia ocupa 22.4 L. Para comparar las propiedades de diferentes sustancias en el mismo estado es necesario hacerlo en condiciones similares; en lo que se refiere a gases y líquidos, esto significa en relación con presión y temperatura. Como condiciones estándares, los físicos y químicos han elegido de manera arbitraria 0°C (273 K de temperatura absoluta) y 760 mm Hg de presión (una atmósfera [1 atm] al nivel del mar). Si las condiciones difieren, a los datos resultantes deben aplicarse las correcciones apropiadas de temperatura, presión, o ambas. El peso de un volumen determinado de líquido, gas o vapor puede expresarse en términos de su densidad o gravedad específica. La densidad es un valor absoluto de masa (por lo general gramos) por unidad de volumen (para líquidos, volumen = 1 mL; para gases, 1 L en condiciones estándares). La densidad específica es un valor relativo, esto es, el cociente del peso de una unidad de volumen de una sustancia sobre el peso de un volumen similar de agua en el caso de líquidos o de aire en el caso de gases (o vapores) en condiciones similares. La densidad relativa del aire y del agua es de 1. Al menos para fines clínicos, el valor de densidad y densidad relativa para un anestésico inhalable es el mismo. En consecuencia, por ejemplo, es posible determinar el volumen del gas isofluorano (vapor) a 20°C a partir de 1 mL de isoflurano líquido conforme al esquema de la figura 2-11. Este tipo de cálculo tiene aplicaciones prácticas. Las moléculas de los líquidos también están en movimiento aleatorio constante. Algunas de las que se encuentran en la capa superficial adquieren suficiente velocidad para vencer las fuerzas de atracción de las moléculas contiguas y al escapar de la superficie pasan a la fase de vapor. Las moléculas de vapor ejercen una fuerza por unidad de área o presión exactamente del mismo modo que las moléculas de un gas. La presión (mm Hg) que las moléculas de vapor ejercen cuando © Editorial El manual moderno Fotocopiar sin autorización es un delito. 60 Fisiología y farmacología anestésicas 61 a. Densidad del isoflurano = 1.49 g/mL, por lo que: 1 mL de isoflurano líquido = 1 mL 3 1.49 g/mL = 1.49 g b. Dado que el peso molecular del isoflurano = 185 g (del cuadro 2-1), entonces: 1.49 g 4 185 g = 0.0081 mol de líquido c. Dado que 1 mol de gas = 22.4 L, entonces: 0.0081 mol 3 22 400 mL/mol = 181.4 mL de vapor de isoflurano a 0°C, 1 atm d. Pero el vapor está a 20°C, no a 0°C (273 K), Por lo que, 181.4 3 293/273 = 194.7 mL de vapor/mL de isoflurano líquido a 20°C y a la presión del nivel del mar Para una variación sustancial de la presión ambiental, la cifra anterior tendría que corregirse en un factor de 760/presión barométrica local © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 2-11. Ejemplo de cálculos para determinar el volumen de vapor del isoflurano a 20°C a partir de 1 mL de isoflurano líquido. Fuente: Steffey E.P., Mama K.R. 2007. Inhalation anesthetics. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 360. las fases de líquido y vapor están en equilibrio se conoce como presión de vapor. Por lo tanto, la presión de vapor de un anestésico es una medida de su capacidad de evaporarse, esto es, una medida de la tendencia de las moléculas en el estado líquido a pasar a la fase gaseosa (de vapor). Aquí radica una diferencia práctica entre las sustancias clasificadas como gases o como vapores: un gas puede administrarse en una gama de concentraciones, desde 0 hasta 100%, mientras que el vapor tiene un techo que se determina por su presión de vapor. La concentración de vapor saturado puede determinarse con facilidad al relacionar la presión de vapor con la presión ambiental. Por ejemplo, en el caso del halotano, es posible una concentración máxima de 32% en las condiciones habituales (es decir, [244/760] × 100 = 32%, donde 760 mm Hg es la presión barométrica al nivel del mar). Si se consideran constantes otras variables, a mayor presión de vapor, mayor concentración del fármaco suministrado al paciente. La presión barométrica también influye en la concentración final de un fármaco. Por ejemplo, en sitios de gran altitud, unos 1 500 m sobre el nivel del mar, donde la presión barométrica es apenas de 635 mm Hg, la concentración de vapor de halotano saturado a 20°C es (243/635) × 100 = 38.3%. El punto de ebullición de un líquido se define como la temperatura a la cual la presión de vapor del líquido es igual a la presión atmosférica. Se acostumbra usar la temperatura de ebullición a la presión atmosférica estándar de 760 mm Hg. El punto de ebullición disminuye con la altitud porque la presión de vapor no cambia, pero la presión barométrica decrece. El punto de ebullición del N2O es de –89°C a 1 atm de presión al nivel del mar. Por consiguiente, es un gas en las condiciones ambientales del quirófano. Debido a ello, para fines clínicos se distribuye en tanques de acero (“cilindros”), comprimido al estado líquido a unas 750 psi (pounds per square inch, libras por pulgada cuadrada; 750/14.9 psi [1 atm] = 50 atm). Cuando el N2O se extrae del 62 Manual de anestesia y analgesia en. . Cálculo de la concentración de anestésico suministrada por un vaporizador. La presión de vapor saturado de la mayoría de los anestésicos volátiles es de tal magnitud que la concentración máxima de anestésico que puede alcanzarse en las condiciones habituales del quirófano se halla por encima del intervalo de concentraciones necesarias para el manejo anestésico clínico seguro. Por lo tanto, es necesario algún control de la concentración adminitrada y éste se obtiene a través de un dispositivo conocido como vaporizador. El objetivo del vaporizador es diluir el vapor generado por el anestésico líquido con O2 (o una mezcla de O2 y N2O) para producir una concentración más satisfactoria de anestésico inspirado. Esta dilución del anestésico se consigue al dividir en dos chorros el gas que entra en el vaporizador: uno que pasa a la cámara de vaporización (volumen de la cámara de anestésico: Vanes) y otro que evita dicha cámara (volumen de dilución o Vdilución). Si el vaporizador es eficiente, el gas portador que pasa por la cámara de vaporización se satura por completo a una concentración (porcentaje) de anestésico reflejada por (presión de vapor del anestésico/presión atmosférica) × 100, a la temperatura de la cámara del vaporización. A continuación, la concentración anestésica resultante disminuye (dilución) corriente abajo por la adición del segundo chorro de gas a una concentración “de trabajo”. En los modernos vaporizadores de precisión específicos de fármaco no se requiere esfuerzo mental para su programación; los fabricantes han precalibrado el vaporizador para un suministro exacto de la concentración programada. Con la finalidad de calcular la concentración de anestésico que sale del vaporizador debe conocerse la presión de vapor del fármaco (y la temperatura de uso), la presión atmosférica, el gasto de gas nuevo que entra en la cámara de vaporización y el gasto de gas diluyente. En consecuencia: Porcentaje de anestésico = flujo de anestésico desde la cámara del vaporización/flujo del gas total El lector interesado en el tema puede ver más detalles en la figura 2-12. Propiedades que influyen en la cinética del fármaco. Los gases y vapores anestésicos se disuelven en líquidos y sólidos. La solubilidad de un anestésico es una característica importante y tiene ramificaciones clínicas cruciales. Por ejemplo, la solubilidad en sangre y tejidos corporales es un determinante principal de la rapidez de captación y la distribución dentro del organismo, y por tanto de la rapidez de inducción de la anestesia y la recuperación luego de ésta. La liposolubilidad guarda estrecha relación con la potencia de un anestésico y su tendencia a disolverse en © Editorial El manual moderno Fotocopiar sin autorización es un delito. tanque, pasa de la fase líquida a la de vapor, y la presión del gas encima del líquido dentro del cilindro permanece constante hasta que ya no queda líquido en el tanque. En este punto, sólo hay N2O gaseoso y la presión de gas disminuye a medida que el restante se extrae del cilindro. En consecuencia, el peso del N2O menos el peso del tanque es un indicador más exacto de la cantidad de N2O restante en éste que la presión del gas en su interior. El desflurano tiene la peculiaridad de que su punto de ebullición es cercano a la temperatura ambiente. Esta característica representa un interesante desafío para los ingenieros que desarrollan un dispositivo de administración (un vaporizador) para uso regular en el ambiente relativamente constante del quirófano y limita su posible uso a una estrecha gama de circunstancias de la práctica veterinaria. Por ejemplo, debido a su bajo punto de ebullición, incluso el enfriamiento evaporativo tiene una gran influencia en la presión de vapor y por tanto en la concentración del vapor en las mezclas de gases suministradas a los pacientes. Fisiología y farmacología anestésicas 63 Vdiluyente Entrada Vportador Derivación B Salida A Cámara de vaporización VAnes + VPortador Anestésico líquido Pasos: 1. La concentración saturada de anestésico en la cámara de vaporización y a la salida de ésta (idealmente en el punto A) puede calcularse si se conocen la presión de vapor saturado (PVP) (del cuadro 2-1) y la presión barométrica (PB). Por ejemplo: 243 (a) Halotano (%) = × 100 = 32.0% 760 2. El volumen de anestésico que sale de la cámara de vaporización es el volumen original del gas portador (O2) que entra en la cámara del vaporización (Vportador) y el volumen de anestésico (Vhalo) que se agrega. Vhalo Halotano (%) – × 100 (b) Vportador + Vhalo Halotano (%) se conoce de (a) anterior, y Vportador se conoce del control del flujómetro (p. ej., un vaporizador de flujo medido) o a través de las características de diseño de un vaporizador específico de agente comercial que de manera automática “separa” el flujo de gas nuevo desde un medidor de flujo único. En cualquier caso, se requieren controles de flujo de dos gases, uno para Vportador y otro para un mayor flujo de dilución del gas (Vdilución). En caso de modificación manual o automática del flujo de gas nuevo, en la ecuación se despeja Vhalo (expresado en mL de vapor de halotano). Por ejemplo, si Vportador = 100 mL O2, entonces: Vhalo 32% = × 100 100 + vhalo 3. Por tanto, Vhalo está contenido en un volumen total de gas en B de Vtotal de gas = Vhalo + Vdiluyente (c) donde Vdiluyente es fijado por el anestesiólogo usando un segundo control de gas (flujómetro; las unidades aquí son mL/min) o por el diseño del vaporizador y la lectura de la válvula. Así, en este ejemplo, para un Vdiluyente de 1 000 mL (en 1 min), 4. Vtotal = 47.1 + 100 + 1 000 = 1 147 mL (redondeado) De modo que la concentración final de vapor de halotano se determina por V halotano (%) = halo × 1000 Vtotal Una vez más, en este ejemplo, halotano (%) = 47.1 × 4.1% 1147 De manera alternativa, con manipulación algebraica básica de las ecuaciones anteriores, los mismos números pueden aplicarse a la fórmula resultante que sigue para llegar a la concentración de anestésico. La fórmula condensada es: 3200 + 32Vhalo = 100Vhalo 3200 = 68Vhalo © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vhalo = 47.1 mL de vapor de halotano. Figura 2-12. Vaporizador de anestésico que ilustra los principios que subyacen al cálculo de la concentración de vapor de un anestésico inhalable que sale de un vaporizador. Se usan las condiciones relacionadas con el suministro de halotano en un lugar al nivel del mar (presión barométrica = 760 mm Hg) a 20°C como un ejemplo de los principios generales. Fuente: Steffey E.P., Mama K.R. 2007. Inhalation anesthetics. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 363. los componentes de suministro (como las partes de caucho) influye en la selección del equipo y otros aspectos del manejo anestésico. Dentro del organismo, los gases anestésicos se separan entre la sangre y los tejidos corporales conforme a la ley de Henry. Quizá pueda comprenderse mejor este proceso mediante un sistema formado por tres compartimientos (p. ej. gas, agua y aceite) en un recipiente cerrado. En tal sistema, el gas se encuentra arriba del aceite, que a su vez se halla arriba del agua. Dado que existe un gradiente pasivo desde la fase de gas hasta la de aceite, las moléculas de gas entran en el compartimiento de aceite. Este movimiento a su vez desarrolla un gradiente para las moléculas de gas en aceite respecto del agua. Si continuamente se agrega gas encima del aceite, hay un Manual de anestesia y analgesia en. . movimiento neto continuo de moléculas de gas desde la fase gaseosa hasta el aceite y de este punto al agua. A una temperatura particular, cuando ya no se disuelve más gas en el solvente, se dice que éste está saturado por completo. En este punto, la presión de las moléculas de gas en los tres compartimientos es la misma, pero la cantidad (el número de moléculas o el volumen del gas) distribuida entre los dos líquidos varía de acuerdo con la naturaleza de éstos y del gas. Por último, es importante comprender que la cantidad de gas que entra en solución depende de la temperatura del solvente. Se disuelve menos gas en un solvente a medida que la temperatura aumenta y más gas es captado conforme la temperatura del solvente disminuye. El grado en que un gas se disuelve en un solvente dado se expresa en términos de su coeficiente de solubilidad. En el caso de los anestésicos inhalables, la solubilidad se mide y expresa más a menudo como un coeficiente de reparto (CR). Otras medidas de solubilidad son los coeficientes de solubilidad de Bunsen y Ostwald. El CR es el cociente de las concentraciones de un anestésico en las fases de solvente y gas (p. ej., sangre y gas) o entre dos tejidos que actúan como solventes (p. ej., encéfalo y sangre). Por lo tanto, describe la capacidad de un solvente particular de disolver el gas anestésico; esto es, cómo se distribuye el anestésico entre las fases de gas y solvente líquido después de alcanzar el equilibrio. Debe recordarse que el movimiento del gas anestésico se debe a la diferencia de presión parcial entre las fases de gas y solvente líquido, de tal modo que cuando ya no hay diferencia de presión parcial del anestésico deja de ocurrir movimiento neto de éste, y se alcanza el equilibrio. En el cuadro 2-2 se presentan los CR solvente-gas de algunos anestésicos inhalables. Los valores indicados en este cuadro corresponden a tejidos humanos porque están más ampliamente disponibles en la bibliografía sobre anestesia. Cualquiera que sea la especie, es importante poner de relieve que muchos factores pueden modificar la solubilidad del fármaco anestésico. Quizá el más notable, después de la naturaleza del solvente, es la temperatura. De todos los CR descritos o de interés, dos revisten particular importancia para la comprensión práctica de la acción de los anestésicos. Son los coeficientes de solubilidad sangre-gas y aceite-gas. Los CR sangre-gas constituyen un medio para predecir la rapidez de inducción de la anestesia, la recuperación, y el cambio de la profundidad. Considérese, por ejemplo, que el anestésico A tiene un valor de CR sangre-gas de 15. Esto significa que la concentración del anestésico en sangre es 15 veces mayor en el equilibrio que en el gas alveolar. En otras palabras, el mismo volumen de sangre, por ejemplo 1 mL, contiene 15 veces más del anestésico A que 1 mL de gas alveolar pese a que la presión parcial es la misma. De manera alternativa, considérese el anestésico B con un CR de 1.4. Este CR indica que, en el equilibrio, la cantidad de anestésico B es sólo 1.4 veces mayor en sangre que en aire alveolar. La comparación del CR del anestésico A y del CR del anestésico B indica que el primero es mucho más soluble en sangre que el segundo (unas 11 veces más soluble: 15/1.4). A partir de esto, y tras presuponer que otras condiciones no cambian, el anestésico A necesita un mayor tiempo de administración para alcanzar una presión parcial en el organismo para un punto final particular (p. ej., inducción de la anestesia) que el anestésico B. Asimismo, dado que hay más anestésico A en la sangre y otros tejidos corporales bajo condiciones similares, la eliminación (y por tanto la recuperación tras la anestesia) es prolongada si se compara con el anestésico B. Captación y eliminación de anestésicos inhalables El objetivo de administrar un anestésico inhalable a un paciente es alcanzar una presión parcial (o tensión) adecuada del anestésico (Panes) en el SNC para inducir un nivel deseado de depresión © Editorial El manual moderno Fotocopiar sin autorización es un delito. 64 Fisiología y farmacología anestésicas 65 congruente con la definición de anestesia general. La profundidad anestésica varía de manera directa con Panes en el tejido encefálico. La rapidez de cambio de la profundidad de la anestesia tiene clara importancia clínica y depende de manera directa de la rapidez de cambio de las tensiones del anestésico en los diversos medios en que éste está contenido antes de llegar al encéfalo. En consecuencia, el conocimiento de los factores que rigen estas relaciones es de importancia fundamental para el control de la anestesia general por fármacos inhalables. Los fármacos inhalables son singulares entre las clases de fármacos empleados para producir anestesia general debido a que se administran por vía pulmonar. La farmacocinética de los anestésicos inhalables describe la rapidez de su captación por sangre desde los pulmones, su distribución en el organismo y su ulterior eliminación por los pulmones y otras vías. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Captación del anestésico Los anestésicos inhalables se desplazan por una serie de gradientes de presión parcial desde regiones de mayor tensión hacia otras de menor tensión hasta que se establece el equilibrio. Por lo tanto, en la inducción, la Panes en su fuente en un vaporizador es alta, se determina por la presión de vapor y disminuye de manera progresiva conforme el anestésico se desplaza desde el vaporizador hasta el circuito respiratorio en el paciente, desde el circuito hasta los pulmones, de los pulmones a la sangre arterial, y por último de la sangre arterial a los tejidos corporales (p. ej., encéfalo) (figura 2-13). En este punto también puede ser útil recordar que si bien la presión parcial del anestésico reviste importancia fundamental, con frecuencia la dosis clínica de un anestésico inhalable se define en términos de concentración (C; es decir, %vol). Como ya se mencionó, esto se debe a que es una práctica común en clínica regular o medir los gases respiratorios y anestésicos como porcentaje en volumen. Además, en la fase gaseosa, la relación entre la Panes y la Canes es simple: Panes = concentración fraccionaria de anestésico × presión ambiental total Eliminación del anestésico La recuperación tras la anestesia por inhalación resulta de la eliminación del anestésico desde el SNC. Esto requiere un descenso de la presión parcial alveolar del anestésico (concentración), que a su vez favorece un decremento de la presión parcial arterial y luego de la presión parcial en el SNC del anestésico. Los principales factores que explican la recuperación son los mismos observados para la inducción. Por lo tanto, factores como VA, GC, y en especial la solubilidad del fármaco, influyen en grado notable en la recuperación tras la anestesia por agentes inhalables. En efecto, las curvas que representan la eliminación (lavado) del anestésico desde los alveolos contra el tiempo son en esencia las inversas de las curvas de absorción. Es decir, la eliminación de los anestésicos menos solubles es alta al principio y luego declina con rapidez hasta un nivel más bajo de salida, la cual continua pero a menor velocidad. El lavado de los comuestos más solubles también es alto al principio, pero la magnitud del decremento de la concentración del anestésico alveolar es menor, y dicha concentración disminuye de manera más gradual con el tiempo. Biotransformación Los agentes inhalables no son químicamente inertes. Sufren grados variables de metabolismo en el hígado pero también, en menor medida, en pulmones, riñones y tubo digestivo. La importancia de esto es doble. Primero, de manera muy limitada en los anestésicos más antiguos, el metabo- 66 Manual de anestesia y analgesia en. . Psuministrada Pcircuito Pinspirada Pespirada Palveolar Parterial Pvenosa Figura 2-13. Patrón de flujo en la inhalación de agentes anestésicos durante la inducción de anestesia y la recuperación. La anestesia con fármacos inhalables puede verse como el desarrollo de una serie de gradientes de presión parcial. Durante la inducción hay una elevada presión parcial de anestésico en el vaporizador, que disminuye de manera progresiva conforme el flujo de gas anestésico avanza desde su fuente hasta el encéfalo. Algunos de estos gradientes son fáciles de manipular por el anestesiólogo; otros no pueden modificarse o se manipulan con dificultad. Fuente: Steffey E.P., Mama K.R. 2007. Inhalation anesthetics. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 365. lismo puede facilitar la recuperación tras la anestesia. En segundo lugar, y más importante, son posibles efectos tóxicos agudos y crónicos causados por metabolitos intermedios y finales de los fármacos inhalables, en especial en riñones, hígado y órganos reproductivos. La magnitud del metabolismo de los anestésicos inhalables se determina por diversos factores, incluidos estructura química, actividad de enzimas hepáticas (enzimas del grupo del citocromo P-450 localizadas en el retículo endoplásmico del hepatocito), concentración sanguínea del anestésico, estados patológicos y factores genéticos (algunos individuos y especies son metabolizadores más activos de estos fármacos que otros, p. ej., el ser humano en comparación con la rata). El sevoflurano se degrada in vivo más o menos en la misma magnitud que el isoflurano, según lo indican los incrementos posanestésicos transitorios de las concentraciones sanguíneas y urinarias de fluoruro. Las concentraciones séricas máximas de fluoruro observadas en personas durante y después de la anestesia con sevoflurano son bajas y no se esperan efectos nefrotóxicos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Ptejidos Fisiología y farmacología anestésicas 67 El desflurano resiste la degradación in vivo. El aumento del fluoruro inorgánico sérico es mucho menos que en el caso del isoflurano. Dosis de anestésico: CAM En 1963, Merkel y Eger describieron lo que se ha convertido en el índice estándar de potencia para anestésicos inhalables: la CAM. Ésta se define como la concentración alveolar mínima de un anestésico a 1 atm de presión que produce inmovilidad en 50% de los sujetos expuestos a un estímulo doloroso supramáximo. Por consiguiente, la CAM corresponde a la mediana de dosis eficaz (DE50): la mitad de los sujetos son anestesiados y la mitad aún no alcanza ese “nivel”. La dosis que corresponde a la DE95 (95% de los individuos son anestesiados), al menos en personas, es 20 a 40% mayor que la CAM. La potencia de un anestésico inhalable guarda relación inversa con la CAM (es decir, potencia = 1/CAM). Con base en la información presentada antes, también se infiere que la CAM guarda relación inversa con el CR aceite-gas. En consecuencia, un anestésico muy potente como el fármaco de distribución formal metoxiflurano, que tiene un elevado CR aceite-gas, posee baja CAM, mientras que un fármaco con bajo CR aceite-gas tiene mayor CAM. Vale la pena insistir en algunas características de la CAM. Primero, la A en CAM representa concentración alveolar, no inspirada o suministrada (es decir, a la salida del vaporizador). Esto es importante porque la concentración alveolar es fácil de vigilar con la tecnología actual. Además, como se dijo antes, después de un tiempo suficiente para el equilibrio (minutos), la presión parcial alveolar es más cercana a las presiones parciales arterial y encefálica del anestésico. En segundo lugar, la CAM se define en términos de porcentaje en volumen a 1 atm y por tanto representa una presión parcial (P) de anestésico en el sitio de acción de éste; es decir, no debe olvidarse que © Editorial El manual moderno Fotocopiar sin autorización es un delito. Px = (C/100) · Pbar donde Px representa la presión parcial del anestésico en la mezcla de gas, C es la concentración de anestésico en porcentaje en volumen, y Pbar es la presión barométrica o total de la mezcla gaseosa. Por lo tanto, aunque la CAM para un fármaco particular puede variar de acuerdo con las condiciones de presión ambiental (p. ej., al nivel del mar o a gran altitud), la presión parcial de anestésico siempre permanece constante. Por ejemplo, la CAM del isoflurano en perros sanos se informa como 1.63 %vol. El estudio que arrojó este valor se realizó en condiciones cercanas al nivel del mar en Davis, California (es decir, Pbar = 760 mm Hg). Con base en la exposición anterior, una CAM de 1.63 %vol representa una presión parcial del isoflurano (Piso) alveolar de 11.6 mm Hg. En comparación, para el mismo perro en la Ciudad de México (altitud de 2 240 m sobre el nivel del mar; Pbar = 584 mm Hg), se espera que la Piso alveolar a la CAM sea la misma que se determinó en Davis (11.6 mm Hg), mientras que la CAM (la concentración alveolar) se aproximaría a 2.17 %vol. Por último, es importante observar que la CAM se determina en animales sanos en condiciones de laboratorio en ausencia de otros fármacos y circunstancias comunes del uso clínico que puedan modificar los requerimientos de anestesia. En otra parte, se presentan las técnicas generales para determinar la CAM en animales. En una misma especie, la variabilidad de la CAM (respuesta a un estímulo doloroso) es casi siempre pequeña y no la influyen en grado sustancial el sexo, la duración de la anestesia, la 68 Manual de anestesia y analgesia en. . Acciones y toxicidad de los anestésicos volátiles Todos los anestésicos inhalables actuales influyen de un modo u otro en el funcionamiento de órganos vitales. Algunas acciones son inevitables y acompañan al uso de todos los fármacos, mientras que otras son una característica especial o evidente de un fármaco o un grupo de fármacos. Además, las relaciones dosis-respuesta de los anestésicos inhalables no son paralelas en todos los casos. Las diferencias de acción (y en especial de acción indeseable) de anestésicos específicos constituyen la base para seleccionar uno de ellos sobre los demás para un paciente o una operación particulares. Las acciones indeseables también constituyen un impulso para el desarrollo de nuevos fármacos o técnicas anestésicas. SNC Los anestésicos inhalables afectan el SNC de varias maneras. La mayor parte de ellos se selecciona porque inducen un estado reversible relacionado con la dosis de arreactividad del SNC (somático y motor) a la estimulación dolorosa, es decir, un estado de anestesia general. Resulta interesante el hecho de que, si bien la anestesia clínica se introdujo hace más de 150 años, siguen sin conocerse los sitios y mecanismos por los cuales los anestésicos generales (incluidos los inhalables) causan arreactividad a la operación u otras formas de estimulación dolorosa. De manera tradicional, se ha asumido que este estado al que se hace referencia como anestesia general es resultado de sucesos que se concentran en el encéfalo. Sin embargo, pruebas crecientes han modificado idea en cierto © Editorial El manual moderno Fotocopiar sin autorización es un delito. variación de PaCO2 (de 10 a 90 mm Hg), la alcalosis o la acidosis metabólica, la variación de PaO2 (de 40 a 500 mm Hg), anemia moderada o hipotensión moderada. Aun entre especies, la variabilidad en la CAM para un fármaco dado no es grande. En seres humanos, la CAM para el N2O es de 104%, lo cual lo hace el menos potente de los anestésicos inhalables usados en la actualidad en esta especie. Su potencia en otras especies es menor de la mitad de aquella cifra (esto es, cercana a 200%). Dado que la CAM del N2O es mayor de 100%, dicho fármaco no puede usarse por sí solo a 1 atm de presión en ninguna especie, a no ser que se suministre menos O2 del adecuado. En consecuencia, y considerando que los valores de CAM para combinaciones de anestésicos inhalables son aditivos, el N2O se administra con otro fármaco inhalable más potente para reducir de este modo la concentración del segundo compuesto necesario con fines de anestesia. Sin embargo, dada la diferencia de potencia entre animales y personas, la cantidad de reducción difiere en grado considerable. Por ejemplo, la administración de N2O al 60% con halotano reduce la cantidad de éste necesaria para producir la CAM en alrededor de 55% en personas sanas, pero sólo en un 20 a 30% en perros. Las dosis equipotentes (concentraciones equivalentes de diferentes anestésicos a la CAM) son útiles para comparar los efectos de los anestésicos inhalables sobre órganos vitales. En este sentido, la dosis de anestésico se define como múltiplos de la CAM (es decir, 1.5 o 2.0 veces la CAM o tan sólo 1.5 o 2.0 CAM). Por lo tanto, con base en la exposición anterior, la DE50 es igual a la CAM o 1.0 CAM y representa un nivel ligero de anestesia (sin duda inadecuado en 50% de los animales sanos que no reciben otro fármaco). La DE50 es 1.2 a 1.4 CAM, y 2.0 CAM representa un nivel profundo de anestesia, en algunos casos incluso una sobredosis de anestésico. El concepto de múltiplos de CAM puede emplearse para comparar los efectos de fármacos y la farmacodinamia de múltiples dosis de un fármaco específico. Fisiología y farmacología anestésicas 69 grado, de tal modo que este estado que se conoce como anestesia general es tal vez un grupo de puntos finales distintos y específicos de sitio, e incluyen sucesos suprarraquídeos y raquídeos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Efectos electroencefalográficos. El electroencefalógrafo (EEG) se usa para ayudar a identificar alteraciones del encéfalo y predecir el desenlace de las lesiones en esta región. Los estudios también han demostrado que la anestesia general altera parámetros del EEG y este conocimiento se aplica para comprender mejor las circunstancias de la anestesia. En general, a medida que la profundidad de la anestesia aumenta desde los estados de vigilia, la actividad eléctrica de la corteza cerebral se desincroniza. Al incrementarse más la concentración de un anestésico, tiene lugar un decremento de la frecuencia y un aumento de la amplitud de las ondas del EEG. La amplitud de onda se incrementa a un máximo (cerca de 1 CAM) y a continuación, con un aumento ulterior de la dosis, declina de manera progresiva (a alrededor de 1.5 CAM ocurre la supresión de oleadas; es decir, oleadas de actividad lenta de alto voltaje separadas por silencio eléctrico) y al final se convierte en una línea plana (predominio del silencio eléctrico). En el caso del isoflurano, se observa un patrón isoeléctrico a aproximadamente 2.0 CAM, mientras que, en el otro extremo, éste no ocurre con el halotano sino hasta >3.5 CAM. Los dos anestésicos volátiles más recientes, sevoflurano y desflurano, causan cambios relacionados con dosis similares a los que produce el isoflurano. Metabolismo encefálico. Todos los anestésicos volátiles reducen la tasa metabólica encefálica (TME, consumo de O2 por el encéfalo). La magnitud del decremento es mínima con halotano pero similar con isoflurano, sevoflurano y desflurano. FSC. Los anestésicos volátiles no provocan cambios en el FSC e incluso lo incrementan a menudo. Es probable que el efecto neto sea la suma de una tendencia tanto a disminuir el FSC por reducciones del consumo encefálico de O2 inducidas por el anestésico como a incrementar el FSC por vasodilatación debida a una acción directa del anestésico en el músculo liso vascular. En general se considera que el orden en que los anestésicos inhalables incrementan el FSC es halotano > enflurano, isoflurano, desflurano y sevoflurano (estos cuatro lo hacen en grado similar). PIC. Los anestésicos inhalables incrementan la PIC y este cambio es paralelo al aumento del FSC que de manera similar acompaña a estos fármacos. Se considera que las elevaciones de la PIC entre especies pueden reducirse por hiperventilación y reducción de la PaCO2. En consecuencia, el uso de hiperventilación es una medida común en situaciones clínicas en las que incluso las elevaciones pequeñas de la PIC generan una especial preocupación. Analgesia. Un anestésico general deseable en clínica debe tener efectos hipnóticos y analgésicos. Sin embargo, los estudios para diferenciar la potencia hipnótica de la potencia analgésica dentro de un intervalo de concentraciones de anestésico son, cuando menos, difíciles de interpretar. Se han realizado ensayos con concentraciones subanestésicas de anestésicos inhalables, pero con resultados inconsistentes. Se ha informado que algunos anestésicos inhalables elevan el umbral de respuesta a la estimulación dolorosa en comparación con condiciones similares sin medicación (p. ej., éter dietílico), en tanto que otros (p. ej., isoflurano y sevoflurano) no cambian el umbral y otros más, como el halotano, reducen el umbral de respuesta y contribuyen a una mayor conciencia de la estimulación dolorosa (antianalgesia). 70 Manual de anestesia y analgesia en. . Aparato circulatorio Todos los anestésicos inhalables volátiles causan cambios dependientes de la dosis y específicos de fármaco en el desempeño cardiovascular. La magnitud y algunas veces la dirección del cambio son influidos por otras variables que a menudo acompañan a la anestesia general. Los mecanismos de los efectos cardiovasculares son diversos, pero con frecuencia incluyen depresión miocárdica directa y decremento de la actividad simpaticosuprarrenal. Todos los anestésicos volátiles reducen el GC. La magnitud del cambio se relaciona con la dosis y depende del agente. En general, entre los fármacos actuales administrados en animales, el halotano es el que deprime más el GC. En muchos sentidos, el desflurano es similar en su acción cardiovascular al isoflurano, mientras que el sevoflurano tiene características parecidas a las del halotano e isoflurano. Los tres anestésicos volátiles más recientes tienden a preservar el GC cuando se usan en concentraciones útiles en clínica. El decremento del GC se debe en gran medida a un descenso de VS como resultado de la depresión relacionada con la dosis de la contractilidad del miocardio. El efecto de los anestésicos inhalables en la FC es variable y depende del fármaco y la especie. Por ejemplo, en seres humanos, la FC no es alterada en grado sustancial por la anestesia con halotano, pero suele aumentar con isoflurano, desflurano y sevoflurano. En contraste con lo que sucede en perros despiertos tranquilos, la FC aumenta con el suministro de cualquiera de los cuatro anestésicos mencionados. Existen datos que sugieren que las diferencias entre fármacos en el grado de aumento de la FC en perros se explican por diferencias en la actividad vagolítica de los anestésicos. En perros, la FC permanece constante en una gama de concentraciones alveolares de utilidad clínica en ausencia de otros factores modificadores (p. ej., estimulación dolorosa). La distribución del flujo de sangre a los órganos se modifica durante la anestesia por inhalación. Los anestésicos volátiles causan un decremento dependiente de la dosis en la PA. En general, el decremento relacionado con la dosis en la PA es similar, cualquiera que sea la especie estudiada. En animales, el decremento de la PA relacionado con la dosis para los cuatro fármacos actuales se vincula en particular con un descenso del VS. En algunos casos (anestésico, especie o ambos) © Editorial El manual moderno Fotocopiar sin autorización es un delito. Aparato respiratorio Los anestésicos inhalables deprimen la actividad del aparato respiratorio. En particular, los compuestos volátiles reducen la ventilación de una manera específica de fármaco y de especie. De acuerdo con las condiciones, incluida la especie de interés, algunas de las medidas de eficacia respiratorio de uso más común (esto es, f y VC) pueden no revelar nada o incluso ser engañosas. En general, la ventilación espontánea disminuye de manera progresiva a medida que aumenta la dosis de anestésico, dado que a dosis bajas el VC disminuye más de lo que aumenta la f. Cuando se incrementa más la dosis del anestésico, la f también decrece. En animales (y personas) que no reciben más medicación que los anestésicos volátiles, sobreviene un paro respiratorio entre 1.5 y 3.0 CAM. El decremento de VE y el probable incremento variable de la ventilación de espacio muerto reducen la VA. Además, la estimulación normal de la ventilación por el aumento de la PaCO2 (o el descenso de PaO2) la deprimen los anestésicos inhalables, en apariencia debido a la acción directa de éstos en los quimiorreceptores bulbares y periféricos (cuerpos aórtico y carotídeo). Los cambios en la PaO2 perianestésicos, salvo por los que pueden relacionarse con la magnitud de VA, no son notablemente distintos entre los diversos anestésicos inhalables en una especie particular. Fisiología y farmacología anestésicas 71 © Editorial El manual moderno Fotocopiar sin autorización es un delito. una menor resistencia vascular periférica también puede tener una función importante pero de menor magnitud. Este escenario común en animales difiere de los resultados que se informan en estudios con sujetos anestesiados, al menos con isoflurano, sevoflurano y desflurano, en los cuales las presiones disminuyen sobre todo por un decremento de RVS. Los anestésicos inhalables pueden incrementar la automaticidad del miocardio y la probabilidad de propagar impulsos desde sitios ectópicos, en especial desde el interior del ventrículo. Aunque las arritmias espontáneas eran más notables con los primeros anestésicos inhalables (p. ej., halotano), al parecer ninguno de los tres fármacos derivados del éter desarrollados en fechas más recientes predispone al corazón a extrasístoles. Los fármacos administrados inmediatamente antes de los anestésicos inhalables o al mismo tiempo (medicación preanestésica, fármacos de inducción anestésica inyectables, agentes vasoactivos y cardiotónicos, etc.) pueden influir en el funcionamiento cardiovascular al modificar la necesidad de anestésico (es decir, la CAM, y de este modo elevar o reducir la concentración de anestésico) o a través de su propia acción directa en el desempeño cardiovascular. Con frecuencia se administran fármacos inyectables, como acepromazina, agonistas a2, tiobarbitúricos y disociativos (p. ej., ketamina) a los animales como parte del manejo anestésico. Estos fármacos alteran los efectos principales de los anestésicos inhalables y pueden acentuar la depresión cardiovascular. Efectos en los riñones Se considera en general que los anestésicos volátiles actuales producen leves decrementos reversibles similares relacionados con la dosis en el flujo sanguíneo renal y la tasa de filtración glomerular, y que en gran medida tales cambios reflejan una disminución inducida por anestésico en el GC. Sin embargo, algunos estudios demuestran escaso o nulo cambio en estos parámetros renales. Como consecuencia del decremento inducido por el anestésico en la filtración glomerular, los animales anestesiados sanos producen por lo regular un menor volumen de orina concentrada respecto de cuando están despiertos. Una anestesia en particular prolongada puede acompañarse de aumento del nitrógeno ureico sanguíneo, creatinina y fosfato inorgánico. La atenuación del funcionamiento renal es efecto en gran medida del estado de hidratación del animal y la hemodinamia durante la anestesia. En consecuencia, el tratamiento simultáneo con líquidos IV y la prevención de un descenso notable del flujo sanguíneo renal aminoran o contrarrestan la tendencia a la disfunción renal. En la mayor parte de los casos, los efectos de la anestesia por inhalación en el funcionamiento renal se revierten con rapidez luego de la anestesia. Entre los anestésicos inhalables, el metoxiflurano es el más nefrotóxico. Aunque ya no se lo comercializa para uso en personas o animales, sus acciones revisten interés fisiopatológico y por tanto se lo describe de manera breve aquí. En particular en seres humanos y algunas cepas de ratas, la administración del metoxiflurano produjo insuficiencia renal caracterizada no por oliguria sino por un gran volumen de orina y falta de respuesta a la vasopresina. Ello se debió a la biotransformación del metoxiflurano y la gran liberación de iones fluoruro libres que, a su vez, dañaron de forma directa a los túbulos renales. Con la posible excepción del enflurano y el sevoflurano, la degradación de otros anestésicos inhalables no conlleva el riesgo de efectos nefrotóxicos del fluoruro. La biotransformación de enflurano y sevoflurano en el ser humano después de una anestesia de duración moderada da lugar a que las concentraciones séricas de fluoruro inorgánico aumenten incluso más allá de los 50 mmol/L, lo que en condiciones normales 72 Manual de anestesia y analgesia en. . Efectos en el hígado La depresión del funcionamiento hepático y el daño hepatocelular pueden deberse a la acción de anestésicos volátiles. Los efectos pueden ser leves y transitorios o permanentes y la lesión se debe a acciones directas o indirectas. Un decremento de la depuración hepática intrínseca de fármacos, junto con el cambio de otras variables de importancia farmacocinética (p. ej., descenso del flujo sanguíneo hepático) a causa del anestésico, promueve una demora de la eliminación del fármaco o un aumento de la concentración plasmática durante la anestesia. Todos los anestésicos inhalables potentes pueden infligir lesión hepatocelular al reducir el flujo sanguíneo y el suministro de oxígeno hepáticos. Sin embargo, los datos disponibles sugieren que, de los cuatro anestésicos volátiles actuales, es probable que el isoflurano mantenga mejor el suministro tisular de O2, y por tanto es el fármaco con menor probabilidad de causar lesión hepática, aunque se administre por periodos prolongados. El efecto de los dos agentes más nuevos, sevoflurano y desflurano, son muy similares a los del isoflurano, mientras que el halotano produce los cambios más adversos. En apariencia, el halotano produce dos tipos de efectos hepatotóxicos en individuos susceptibles. Uno es una forma posanestésica leve autolimitada de destrucción hepatocelular con aumento concomitante de las concentraciones séricas de enzimas hepáticas. Los signos de efectos hepatotóxicos se presentan poco después de la exposición al anestésico. El otro es una hepatotoxicosis grave rara, con frecuencia letal, de inicio tardío y en gran medida limitada en clínica a pacientes humanos (hepatitis por halotano); es posible que sea un efecto tóxico inmunitario. © Editorial El manual moderno Fotocopiar sin autorización es un delito. se considera el umbral nefrotóxico en seres humanos. Sin embargo, sólo raras veces se han informado en pacientes humanos pruebas clínicas, histológicas o bioquímicas de lesión relacionada con aumento del fluoruro. El abrumador consenso es que el sevoflurano tiene escaso potencial de inducir efectos nefrotóxicos por desfluoración. Dos factores pueden explicar la ausencia general de lesión a pesar de la capacidad del organismo para degradar el sevoflurano. En 1977, Mazze y et al., propusieron que el área bajo la curva de concentración sérica de fluoruro contra el tiempo podría ser un determinante de nefrotoxicidad de mayor importancia que la concentración sérica máxima de fluoruro. Dado que el sevoflurano es poco soluble y se elimina con rapidez por la vía pulmonar, la duración de su disponibilidad para la biotransformación es muy limitada. En fechas más recientes, Kharasch y colaboradores propusieron otra posibilidad: el sevoflurano se metaboliza en mayor medida por el hígado, mientras que los sitios hepáticos y renales son importantes para la degradación del metoxiflurano. La ausencia relativa de desfluoración intrarrenal de anestésico podría reducir en grado notable su potencial nefrotóxico. El sevoflurano se degrada por la acción de absorbentes de CO2 como cal y Baralyme® (Chemetron Medical Division, Allied Healthcare Products, St. Louis, MO). Se genera un producto de degradación nefrotóxico, el compuesto A. Éste causa lesión renal y muerte en ratas, y la concentración renal para efectos nefrotóxicos se encuentra dentro del intervalo de concentraciones que pueden encontrarse relacionadas con el manejo del anestésico en seres humanos. No es de sorprender el hecho de que el compuesto A se forme en los circuitos de recirculación empleados en la práctica veterinaria. Aún queda por establecer la importancia definitiva de la degradación in vitro del sevoflurano para el bienestar de pacientes veterinarios, como perros y gatos, pero la impresión clínica es que el riesgo resulta relativamente bajo. Fisiología y farmacología anestésicas 73 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Efectos en el músculo esquelético: hipertermia maligna La hipertermia maligna (HM) es una miopatía farmacogenética potencialmente letal que se notifica más a menudo en seres humanos y cerdos susceptibles (p. ej., razas Landrace, Pietrain o Poland China), aunque también existen informes de su incidencia en otras especies. Los cuatro anestésicos volátiles actuales pueden iniciar HM, pero el halotano es el inductor más potente de ellos. El síndrome se caracteriza por elevación rápida de la temperatura corporal que, si no se trata con rapidez, produce la muerte. Está indicada la vigilancia de temperatura y producción de CO2 en pacientes susceptibles o con sospecha de HM. Los individuos susceptibles a la HM pueden anestesiarse sin riesgo. Evitar el uso de agentes inductores y administrar dantroleno profiláctico antes de la anestesia son medidas eficaces para prevenir el inicio de HM. Efectos tóxicos específicos del óxido nitroso El óxido nitroso se introdujo en la práctica clínica hace más de 150 años. Desde entonces, su administración ha constituido la base para más técnicas de anestesia general en pacientes humanos que cualquier otro fármaco inhalable individual. Su utilización se generalizó debido a sus múltiples propiedades deseables, como baja solubilidad en sangre, depresión cardiovascular y respiratoria limitada, y al parecer toxicidad relativamente mínima. Su empleo en el manejo anestésico de animales surgió como una extensión natural de su uso en personas. A pesar de ello, el óxido nitroso no es el anestésico ideal para seres humanos o animales. Para obtener los notables beneficios del N2O, éste suele administrarse en altas concentraciones inspiratorias. Sin embargo, a medida que la concentración de N2O aumenta, se advierte un cambio en la proporción y la presión parcial de los otros componentes de la mezcla inspirada, en particular el O2. En consecuencia, para evitar la hipoxemia, la concentración máxima que puede administrarse de manera segura al nivel del mar es de 75% de la mezcla inspirada. Para la utilización de N2O en localidades situadas por encima del nivel del mar se requiere una menor concentración de este gas a fin de asegurar una presión parcial adecuada de O2 inspiratorio (PiO2). El óxido nitroso tiene menor utilidad en el manejo anestésico de animales que en el de seres humanos porque su potencia anestésica en animales es sólo de la mitad en comparación con las personas, de tal modo que en la práctica clínica veterinaria el N2O es más útil como coadyuvante de la anestesia. La baja solubilidad sanguínea del óxido nitroso es la causa de su rápido inicio de acción. Aunque no tiene la potencia necesaria para producir anestesia, puede emplearse para acelerar la inducción de anestesia con agentes inhalables en virtud de sus efectos inherentes (aunque limitados) en el SNC y, como ya se mencionó, porque incrementa la captación de un anestésico volátil más potente coadministrado, como el halotano (efecto del segundo gas). Cuando se administra una alta concentración de N2O en una mezcla con un agente inhalable (p. ej., N2O más halotano), la concentración alveolar del anestésico coadministrado (halotano) se incrementa con más rapidez que cuando el “segundo” gas se ha administrado sin N2O. El efecto del segundo gas es el resultado de un mayor volumen inspiratorio debido al gran volumen de N2O captado (recuérdese, el N2O se utiliza a concentraciones elevadas) y a un efecto concentrador sobre el segundo gas en un volumen más pequeño (y por tanto un mayor gradiente para la transferencia a la sangre) como resultado de la captación del gran volumen de N2O. Los efectos del N2O en el funcionamiento cardiovascular y respiratorio (además de reducir la concentración del O2 inspirado) son leves en comparación con los de otros anestésicos inhalables. Deprime de manera directa la actividad del miocardio, pero sus propiedades de 74 Manual de anestesia y analgesia en. . Transferencia de óxido nitroso a espacios cerrados llenos de gas. En el organismo existen o pueden existir espacios llenos de gas en diversas condiciones y en grados variables. Por ejemplo, las más de las veces se encuentra gas en estómago e intestino. El intestino es un depósito dinámico; el gas que contiene se mueve con libertad hacia dentro y fuera de él conforme a las leyes de la difusión. El gas intestinal consiste en aire deglutido y gas producido de manera regular por bacterias y reacciones químicas y que se difunde a partir de la sangre. Existe gran variabilidad tanto en composición como en volumen del gas estomacal e intestinal (p. ej., herbívoros y carnívoros). En otras cavidades aéreas naturales, como los senos aéreos y el oído medio, y en algunas circunstancias, se introduce aire de manera deliberada o inadvertida como parte de acciones diagnósticas o terapéuticas (p. ej., neumoencefalograma, neumocistograma, endoscopia y embolia aérea vascular). Son posibles problemas relacionados con espacios aéreos cuando un animal que respira aire recibe una mezcla gaseosa que contiene N2O. El nitrógeno es el principal componente del aire (80%) y de la mayor parte de los espacios llenos de gas (en el intestino también se encuentran cantidades variables de metano, CO2 e hidrógeno). Cuando se introduce N2O en el aire inspirado, el restablecimiento del equilibrio de los gases en el espacio específico comienza con la entrada rápida de N2O y la salida lenta de N2. Esto significa que, debido a su mayor solubilidad en la sangre, el volumen de N2O que puede transportarse a un espacio cerrado lleno de gas es muchas veces el volumen de N2 que puede llevarse. Por ejemplo, el CR sangre-gas para N2O es de 0.47, mientras que el del N2 se aproxima a 0.015. Por consiguiente, el N2O es más de 30 veces más soluble en sangre que el N2 (0.47/0.015). El resultado de la transferencia neta de gas al espacio gaseoso puede manifestarse como un aumento de volumen (como ocurre en intestino, neumotórax o embolia aérea vascular), una elevación de presión (p. ej., en oído medio o para neumoencefalografía), © Editorial El manual moderno Fotocopiar sin autorización es un delito. estimulación simpática contrarrestan parte de la depresión directa (la propia y la secundaria a los anestésicos volátiles acompañantes). Como resultado de su activación del sistema nervioso simpático puede contribuir a una mayor incidencia de arritmias cardiacas. De manera global, como perspectiva conservadora acerca del uso de N2O en términos de respiración y circulación, puede señalarse que se justifica una preocupación significativa sólo en pacientes con deterioro inicial del funcionamiento. Como en el caso de cualquier fármaco, sus ventajas y desventajas deben ponderarse para cada paciente individual. El óxido nitroso tiene escaso o nulo efecto en el funcionamiento de hígado y riñones. Si bien hay pruebas de interferencia inducida por N2O en la producción de eritrocitos y leucocitos en la médula ósea, los riesgos de resultados adversos en pacientes expuestos en la mayoría de las circunstancias veterinarias clínicas son mínimos o inexistentes. No obstante, la exposición prolongada a N2O provoca hematopoyesis megaloblástica y polineuropatía. Es posible que los pacientes muy enfermos tengan mayor sensibilidad a estos efectos tóxicos. Se presentan problemas con la desactivación inducida por N2O de la enzima dependiente de vitamina B12, la denominada metionina sintasa, la cual controla las interrelaciones entre la vitamina B12 y el metabolismo del ácido fólico. Aunque algún sujeto ocasional puede desarrollar signos que sugieren deficiencia de vitamina B12 y ácido fólico después de una técnica anestésica que incluye el empleo de N2O, éste es un suceso raro en personas y animales. El óxido nitroso se elimina con rapidez, en particular en el gas exhalado. La magnitud de la biotransformación (a nitrógeno molecular, N2) es muy baja y corre a cargo de la flora intestinal. Fisiología y farmacología anestésicas 75 © Editorial El manual moderno Fotocopiar sin autorización es un delito. o ambas cosas (cuando se alcanzan los límites de distensión del espacio distensible). Por lo general se utiliza aire para insuflar el manguito de la sonda endotraqueal. Este manguito es otro espacio aéreo cerrado relativamente distensible. El óxido nitroso expande de modo similar este espacio lleno de gas y puede incrementar la presión ejercida en la pared traqueal. Exposición ocupacional: concentraciones vestigiales de anestésicos inhalables Con mucha frecuencia, el personal de quirófano se expone a bajas concentraciones de anestésicos inhalables. El aire ambiental se contamina durante el llenado del vaporizador, lo que se conoce como fugas inadvertidas en el circuito de respiración del paciente y derrame desatendido del agente líquido. En diversas condiciones hay cantidades medibles de gases y vapores anestésicos en el aire del quirófano. El personal inhala y, como lo demuestran los estudios, retiene estos fármacos por algún tiempo. La baja velocidad de eliminación de algunos vapores (en especial los más solubles en sangre, como el halotano) da lugar a que día con día se acumulen cantidades vestigiales retenidas de anestésico. Lo anterior es preocupante porque protocolos epidemiológicos en seres humanos y estudios de laboratorio en animales han sugerido que la exposición crónica a niveles vestigiales de anestésicos puede constituir un peligro sanitario. Existe especial preocupación por los informes de que los anestésicos inhalables tienen potencial mutágeno, carcinógeno o teratógeno. Según sea la fase vital en que ocurra la exposición, hay alarma porque estos mecanismos subyacentes pueden a su vez ser causantes de una mayor incidencia de muerte fetal, aborto espontáneo, defectos congénitos o cáncer en trabajadores expuestos. Con todo, hasta la fecha no se ha demostrado en seres humanos un efecto genotóxico de la exposición a largo o corto plazos a los anestésicos inhalables. Aunque los datos actuales (en especial sobre los efectos en la reproducción humana) son todavía inconsistentes, no existe una relación de causa y efecto firme entre exposición crónica a concentraciones vestigiales de anestésicos y problemas de salud en el ser humano. Si bien es mínimo al parecer el riesgo de la exposición a largo plazo a concentraciones vestigiales de anestésico entre el personal de quirófano, los datos actuales son suficientes para causar preocupación y alentar prácticas que reduzcan la contaminación del personal de quirófano por anestésicos. En realidad, el gobierno de Estados Unidos ha recomendado grados de exposición: 2.0 partes por millón (ppm) de agentes volátiles y 25 ppm de N2O. En este sentido, se dispone de métodos económicos para reducir y controlar la exposición a anestésicos del personal de quirófano, y deben usarse. Relajantes musculares y bloqueo neuromuscular Los relajantes musculares son coadyuvantes de la anestesia administrados para mejorar la relajación de los músculos esqueléticos durante intervenciones quirúrgicas o diagnósticas. El término agentes bloqueadores neuromusculares (ABNM) es un nombre complejo pero descriptivo que se refiere a esta clase de fármacos que producen su efecto al actuar en la unión neuromuscular. El término más general de relajante muscular (o miorrelajante) se refiere a cualquier fármaco con propiedades relajantes e incluye a compuestos de acción central como benzodiazepinas, agonistas de adrenorreceptores a2 y guaifenesina. Aunque se usan con frecuencia en anestesia humana y en 76 Manual de anestesia y analgesia en. . Fisiología de la unión neuromuscular Todos los ABNM ejercen su efecto en la unión neuromuscular, que forma la interfaz entre el nervio motor mielinizado grande y el músculo al que inerva. La unión neuromuscular puede dividirse en la terminación nerviosa motora preunión, la hendidura sináptica y la membrana posunión de la fibra de músculo esquelético. En las zonas preunión y posunión de la unión neuromuscular hay receptores nicotínicos, que se unen a ACh u otro ligando apropiado y responden a él. Se piensa que el receptor preunión es importante para la síntesis y movilización de reservas de ACh, pero no para su liberación. Al parecer hay dos tipos de receptores posunión: de la unión y extraunión. Los receptores de la unión se encuentran en las placas motoras terminales de los animales adultos normales y se encargan de interactuar con la ACh liberada para iniciar la contracción muscular. El antagonismo de la ACh en los receptores de la unión interviene en el efecto relajante que se observa cuando se administra un ABNM. Los receptores extraunión no se encuentran en grandes cantidades en las membranas del músculo esquelético de los mamíferos adultos, pero son importantes porque se sintetizan en músculos que reciben un grado de estimulación de motoneuronas menor al normal. En consecuencia, su número puede aumentar después de lesión de la médula espinal o tras un periodo de desuso muscular, por ejemplo cuando se coloca una férula en una extremidad. También se encuentran en recién nacidos. Al parecer, los receptores extraunión son más reactivos a los ABNM despolarizantes, como succinilcolina, y menos reactivos a ABNM no despolarizantes, como atracurio. Si el déficit neuromuscular es grave, los receptores extraunión pueden ser más numerosos y distribuirse de forma amplia en la membrana muscular. Es posible que tales pacientes tengan una respuesta más intensa a las acciones de un ABNM despolarizante y una liberación más profunda de iones potasio (K+) intracelulares, con sus efectos cardiacos adversos concomitantes. Las terminaciones nerviosas preunión sintetizan y almacenan una cantidad de ACh en vesículas sinápticas. Durante la transmisión neuromuscular normal, un potencial de acción llega a la terminación nerviosa motora preunión y produce despolarización de la terminal nerviosa. La ACh se hidroliza con rapidez a colina y acetato por acción de la acetilcolinesterasa. De este modo, la célula muscular se despolariza por el potencial de placa terminal creado por la unión de ACh al receptor, y luego se repolariza cuando la ACh se retira del receptor y se hidroliza. Fármacos despolarizantes y no despolarizantes Los fármacos bloqueadores de la unión neuromuscular despolarizantes y no despolarizantes tienen ambos afinidad por los receptores de ACh nicotínicos de la unión neuromuscular y se unen a ellos; sin embargo, su actividad intrínseca en el receptor es muy diferente. Los fármacos no despolarizantes se unen al receptor pero no lo activan. Su inicio de acción se caracteriza por debilitamiento progresivo de la contracción muscular y, en última instancia, parálisis flácida. Los fármacos despolarizantes también se unen al receptor y, como ocurre en el caso de la ACh, lo estimulan, de tal modo que provocan la despolarización de la membrana posunión. A diferencia de lo que ocurre con la ACh, succinilcolina y otros ABNM no despolarizantes, no son susceptibles a la degradación por acetilcolinesterasa, y por tanto el conducto iónico permanece abierto y no ocurre la repolarización. El estado persistente de despolarización vinculado con el uso de © Editorial El manual moderno Fotocopiar sin autorización es un delito. algunas especialidades veterinarias como la oftalmología, el empleo de los ABNM en la práctica veterinaria general es limitado. Fisiología y farmacología anestésicas 77 © Editorial El manual moderno Fotocopiar sin autorización es un delito. ABNM despolarizantes produce inexcitabilidad de la placa motora terminal y, como en el caso de los ABNM no despolarizantes, parálisis flácida. Además del mecanismo diferente de acción de los fármacos despolarizantes, otras diferencias son evidentes en clínica cuando se los compara con los ABNM no despolarizantes. La administracción de succinilcolina puede causar fasciculaciones musculares inmediatamente antes de que ocurra la parálisis flácida. Dosis grandes, administración repetida o suministro de succinilcolina como infusión hacen que el carácter del bloqueo cambie de la acción despolarizante típica mencionada (bloqueo de fase I) a un bloqueo de fase II, que se parece al producido por fármacos no despolarizantes como la d-tubocuranina. A pesar de años de investigación sobre la génesis del bloqueo de fase II, aún no se comprende con claridad su mecanismo. La exposición prolongada de los receptores colinérgicos al agonista succinilcolina probablmente causa desensibilización del receptor, bloqueo del conducto o una combinación de ello. Tanto la desensibilización del receptor como el bloqueo del conducto tienen propiedades que se asemejarían a las de los ABNM no despolarizantes, y por tanto cambiarían el mecanismo y la naturaleza del bloqueo inducido por succinilcolina. Bloqueadores neuromusculares individuales Los ABNM son compuestos de amonio cuaternario similares al átomo de nitrógeno cuaternario de la ACh. Son atraídos hacia los receptores nicotínicos en la placa motora terminal y hacia receptores nicotínicos localizados en ganglios neurovegetativos. Casi todos los ABNM son compuestos hidrosolubles con carga positiva y volumen de distribución limitado así como, en la mayoría de los casos, biotransformación hepática limitada. La baja liposolubilidad de los ABNM limita su transferencia a través de estructuras membranosas, incluidas la placenta y la barrera hematoencefálica. Metabolismo hepático y redistribución a sitios distintos de los músculos esqueléticos no son mecanismos importantes para la cesación de los efectos de los ABNM. Una excepción es el vecuronio, cuya excreción biliar es importante para su eliminación del organismo. Debido a su hidrosolubilidad, la mayor parte de los ABNM se excreta por filtración glomerular y en general no se resorben en los túbulos renales. La naturaleza hidrosoluble de estos fármacos también puede contribuir a la observación de que los neonatos pueden requerir dosis relativamente mayores de ABNM, debido a que tienen un mayor porcentaje de agua corporal que los adultos y por lo regular mayores volúmenes de distribución aparentes para fármacos hidrosolubles. En el cuadro 2-3 se presentan las dosis recomendadas de relajantes musculares en especies domésticas comunes. Cuadro 2-3. Dosis de ABNM de uso común en algunas especies domésticas Fármaco (mg/kg) Succinilcolina Pancuronio Atracurio Vecuronio Pipecuronio Perro 0.3–0.4 0.07 0.15–0.2 0.1–0.2 0.05 Gato 0.2 0.06 0.15–0.25 0.025–0.05 0.003 Caballo 0.12–0-15 0.12 0.07–0.15 0.1 Fuente: Martinez E.A., Keegan R.D. 2007. Muscle relaxants and neuromuscular blockade. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 423. 78 Manual de anestesia y analgesia en. . Succinilcolina. Ésta es en la actualidad el único ABNM despolarizante usado en medicina veterinaria. Desde el punto de vista estructural, la molécula de succinilcolina posee dos moléculas de ACh unidas extremo con extremo. Este fármaco se hidroliza con rapidez en el plasma por la seudocolinesterasa (colinesterasa plasmática), de tal manera que sólo una pequeña fracción de la dosis inyectada sobrevive a la degradación en el plasma para llegar al sitio de acción en la unión neuromuscular. Hay muy poca seudocolinesterasa en la hendidura sináptica y por tanto la parálisis inducida por succinilcolina se termina por la difusión del fármaco desde la unión neuromuscular hacia el líquido extracelular. De manera paradójica, la rápida degradación de la succinilcolina en el plasma es en algún sentido causante del inicio rápido del efecto del fármaco. Debido a la degradación rápida por seudocolinesterasa plasmática, pueden administrarse dosis comparativamente grandes de succinilcolina sin necesidad de preocuparse por una mayor duración del efecto. A mayor dosis de succinilcolina, más rápido inicio de la parálisis. Esta medida no se aplica cuando se utilizan ABNM no despolarizantes, en cuyo caso un incremento significativo de la duración del efecto sigue al uso de dosis crecientes. La seudocolinesterasa se sintetiza en el hígado y la producción decrece en caso de hepatopatía, anemia crónica, desnutrición, quemaduras, embarazo, fármacos citotóxicos, metoclopramida e inhibidores de colinesterasa. Además, pueden existir diferencias entre especies en la actividad de seudocolinesterasa. Es posible esperar que un decremento de la actividad de colinesterasa plasmática prolongue el efecto de la succinilcolina. Atracurio. Éste es un ABNM no despolarizante de acción corta que posee una estructura de bencilisoquinolina similar a la propia de la d-tubocurarina. Su inicio de acción, dependiente de la dosis, es de unos 5 min, y su efecto dura alrededor de 30 min en perros. Las dosis repetidas no tienden a ser acumulativas, de tal modo que el bloqueo neuromuscular se mantiene algunas veces por infusión IV continua. El atracurio es sigular porque casi la mitad se degrada por eliminación de Hofmann e hidrólisis estérica inespecífica. La fracción restante se degrada por vías aún no definidas, aunque existen pruebas de que su efecto no es prolongado en individuos con insuficiencia hepática o renal. No son necesarios metabolismo hepático ni excreción renal para la terminación de su efecto. En consecuencia, el atracurio puede administrarse en pacientes con insuficiencia hepática o renal sin que aumente en grado significativo la duración de su efecto. La eliminación de Hofmann es un proceso de descomposición molecular espontánea y al parecer depende de pH y temperatura. No requiere actividad enzimática. Dado que la eliminación de Hofmann puede ocurrir ex vivo, el atracurio debe mantenerse refrigerado y se suministra a un pH de 3.25 a 3.65. Cuando se inyecta por vía IV, se descompone de manera espontánea en laudanosina y monoacrilato cuaternario a pH y temperatura fisiológicos. El metabolito laudanosina es un conocido estimulante del SNC y puede inducir convulsiones. A diferencia del atracurio, la © Editorial El manual moderno Fotocopiar sin autorización es un delito. Pancuronio. El pancuronio fue el primero de una serie de ABNM no despolarizantes en tener un núcleo esteroide. Tiene inicio de acción dependiente de la dosis aproximado de 5 min y duración del efecto de 40 a 60 min en perros. Gran parte del fármaco se excreta por los riñones y el resto se metaboliza en el hígado. Además de tener afinidad por los receptores nicotínicos en la unión neuromuscular, el pancuronio también puede inhibir a receptores muscarínicos cardiacos, con lo cual incrementa en grado leve a moderado la FC en algunos pacientes. Fisiología y farmacología anestésicas 79 laudanosina depende casi por completo de la biotransformación hepática para su eliminación; por lo tanto, sus concentraciones plasmáticas pueden estar elevadas en sujetos con insuficiencia hepática que reciben atracurio para intervenciones quirúrgicas prolongadas. La hidrólisis estérica del atracurio se efectúa por varias esterasas plasmáticas no relacionadas con la colinesterasa plasmática. En contraste con lo que ocurre en el metabolismo de la succinilcolina, la duración del efecto del atracurio no se prolonga en presencia de inhibidores de colinesterasa. Muchos ABNM que tienen la estructura de bencilisoquinolina se relacionan con la liberación de histamina y un grado variable de hipotensión. Fármacos más recientes con la estructura bencilisoquinolina, como atracurio y mivacurio, requieren varias veces la dosis eficaz para el bloqueo neuromuscular antes de que se liberen cantidades considerables de histamina. Aunque no se observan casi nunca signos de liberación de histamina, como hipotensión y taquicardia, cuando se administra atracurio, siempre se prefiere la administración IV lenta. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cisatracurio. El atracurio es una mezcla racémica de 10 isómeros ópticos. El 1R-cis, isómero 1R9-cis, o cisatracurio, constituye alrededor de 15% del atracurio racémico; es unas cuatro veces más potente y tiene mucho menor potencial de liberación de histamina. Por ejemplo, la concentración plasmática de histamina en gatos no cambió cuando se administró 60 veces la dosis eficaz de cisatracurio. Éste tiene inicio de acción y duración del efecto similares a los del atracurio. La eliminación de Hofmann metaboliza más de la mitad de la dosis administrada de cisatracurio, pero a diferencia de lo que se observa con el compuesto racémico, no ocurre la hidrólisis estérica. Como en el caso del atracurio, la eliminación de Hofmann da lugar a la producción de laudanosina. Dado que el cisatracurio es unas cuatro veces más potente que el atracurio, la dosis administrada es proporcionalmente menor, al igual que la producción de laudanosina. Vecuronio. Introducido en la década de 1980, éste fue uno de los primeros ABNM sin efectos cardiovasculares. Tiene inicio de acción dependiente de la dosis de unos 5 min y duración del efecto intermedia similar a la del atracurio: 30 min. Como en el caso de éste, no tiene como característica notoria un efecto acumulativo con dosis ulteriores. El vecuronio es inestable cuando se prepara en solución y se expende como un polvo liofilizado que se reconstituye con agua estéril antes de inyectarlo. El polvo no necesita refrigeración y, una vez reconstituida, la solución es estable por 24 h. Poco más de la mitad del fármaco se metaboliza por enzimas microsómicas hepáticas y se excreta en la bilis, mientras que una fracción significativa sufre eliminación renal. Rocuronio. Éste es un derivado del vecuronio y tiene alrededor de un octavo de la potencia del compuesto progenitor. Puesto que vecuronio y rocuronio poseen pesos moleculares similares y el segundo tiene menor potencia, una mayor dosis inyectada de éste coloca un mayor número de moléculas cerca de la unión neuromuscular, lo que se traduce en un inicio más rápido del bloqueo neuromuscular. El inicio rápido del efecto del rocuronio lo convierte en una alternativa no despolarizante atractiva a la succinilcolina para la intubación endotraqueal. La duración de su efecto en perros es similar a la propia de vecuronio y atracurio. Al igual que el vecuronio, el rocuronio carece al parecer de efectos cardiovasculares y no libera histamina. La principal vía de eliminación es hepática, mientras que una pequeña fracción se elimina por vía renal. 80 Manual de anestesia y analgesia en. . Doxacurio. Éste es un ABNM de la clase de las bencilisoquinolinas con efecto prolongado. De modo similar a lo observado en otros fármacos afines como el atracurio, el doxacurio carece de propiedades vagolíticas o no causa bloqueo ganglionar. Del mismo modo que el cisatracurio, la administración de dosis clínica no produce liberación considerable de histamina. En apariencia, el doxacurio sufre metabolismo mínimo y se excreta sin cambio en bilis y orina. Precauciones Dado que se paralizan los músculos respiratorios, debe controlarse la ventilación, ya sea con un ventilador mecánico o a través de la acción de un miembro del personal que ventile manualmente al paciente hasta que recupere la fuerza muscular. Los miorrelajantes no tienen propiedades sedantes, anestésicas o analgésicas, de tal modo que es crítico que el animal sea anestesiado de manera adecuada para que esté del todo inconsciente. Evaluar el nivel de anestesia en un paciente paralizado es más difícil que en uno no paralizado, dado que se suprimen los indicadores habituales de profundidad de la anestesia (p. ej., movimiento deliberado en respuesta a un estímulo doloroso, respuesta palpebral y tono mandibular). Cuando se incluye un ABNM en un protocolo anestésico, los anestesiólogos deben tener la certeza de que pueden mantener de manera confiable un plano adecuado de anestesia quirúrgica y un nivel de ventilación. Reversión del bloqueo neuromuscular Como ya se expuso, la acetilcolinesterasa se encuentra en altas concentraciones en la unión neuromuscular. Hidroliza la ACh en colina y ácido acético, con lo que termina la acción de la ACh. Los efectos de los relajantes musculares no despolarizantes se antagonizan por acción de la administración de anticolinesterasa (un inhibidor de la acetilcolinesterasa). Esta clase de fármacos inhibe la enzima acetilcolinesterasa e incrementa la concentración de moléculas de ACh en la unión neuromuscular. Dado que los relajantes musculares no despolarizantes y la ACh compiten por los mismos sitios de unión postsinápticos, el incremento de la ACh puede inclinar el equilibrio de la competencia en favor de la ACh y se restablece la transmisión neuromuscular. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Mivacurio. Este fármaco es un ABNM de acción rápida y duración breve que se comercializa para su uso en seres humanos para facilitar la intubación endotraqueal y la inducción de la anestesia. Como en el caso del atracurio, el mivacurio puede inducir la liberación de histamina si se administra en dosis elevadas. El mivacurio se biotransforma con rapidez por la seudocolinesterasa plasmática y los metabolitos no tienen actividad de bloqueo neuromuscular notorio. Su duración de acción dependiente de la dosis difiere entre especies. El efecto de las dosis típicas empleadas en seres humanos dura unos 25 min, alrededor de la mitad a un tercio menos que el del atracurio. El mivacurio también presenta diferencias notables en potencia entre especies; es mucho más potente en perros que en personas. En perros, un tercio de la dosis humana genera un bloqueo cinco veces más prolongado. Las diferencias en duración del efecto entre especies pueden reflejar en parte la menor actividad de seudocolinesterasa en perros, ya que se ha notificado que en esta especie las concentraciones plasmáticas normales de colinesterasa son 19 a 76% de los valores para seres humanos. Además, la enzima seudocolinesterasa canina podría tener diferente afinidad para los tres isómeros principales del mivacurio. Las observaciones clínicas indican que el mivacurio posee acción mucho más breve en gatos que en perros. Fisiología y farmacología anestésicas 81 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Entre los fármacos anticolinesterásicos utilizados para antagonizar el bloqueo neuromuscular figuran edrofonio, neostigmina y piridostigmina. Difieren en el modo en que inhiben la actividad de acetilcolinesterasa. El edrofonio ejerce una inhibición reversible por unión electrostática al sitio aniónico y por unión mediante enlaces de hidrógeno al sitio estérico en la acetilcolinesterasa. La acción del edrofonio es relativamente breve porque no se forma un enlace covalente y la ACh compite con facilidad con el edrofonio por el acceso a la enzima. Neostigmina y piridostigmina inhiben la acetilcolinesterasa y forman un complejo carbamiléster en el sitio estérico de la acetilcolinesterasa. Este enlace dura más si se compara con el enlace entre la enzima y ACh, de tal forma que impide el acceso de la acetilcolinesterasa a la ACh. La acumulación de ACh después de que se administra un anticolinesterásico no es específica de la unión neuromuscular. Si bien se observan efectos nicotínicos en la unión neuromuscular y los ganglios neurovegetativos, los efectos colinérgicos muscarínicos se deben a inhibición de la acetilcolinesterasa en el nódulo sinusal, músculo liso y glándulas. Entre los efectos clínicos del aumento de las concentraciones de ACh en estos sitios deben señalarse bradicardia, paro sinusal, broncoespasmo, miosis, hiperperistaltismo intestinal y salivación. Debido a ello, se recomienda administrar un anticolinérgico, ya sea atropina o glucopirrolato, inmediatamente antes de la reversión del bloqueo neuromuscular con un anticolinesterásico. La recuperación tras el uso de succinilcolina (bloqueo de fase I) es rápida y espontánea debido a la hidrólisis de ésta por colinesterasas plasmáticas. Puede retrasarse en pacientes con decremento de los valores plasmáticos o la actividad de colinesterasa. La administración de un anticolinesterásico en realidad prolongaría el bloqueo despolarizante. Por otro lado, un bloqueo de fase II con succinilcolina puede antagonizarse de modo similar al causado por relajantes musculares no despolarizantes, lo cual pone de relieve la necesidad de determinar el tipo (fases I o II) de bloqueo presente cuando se administra succinilcolina. Revisado a partir de “Cardiovascular System” por William W. Muir; “Respiratory System” por Wayne N. McDonell y Carolyn L. Kerr; “Nervous System” por Kurt A. Grimm y Anne E. Wagner; “Anticholinergics and Sedatives” por Kip A. Lemke; “Injectable and Alternative Anesthetic Techniques” por Keith R. Branson; “Dissociative Anesthetics” por Hui-Chu Lin; “Inhalation Anesthetics” por Eugene P. Steffey y Khursheed R. Mama; y “Muscle Relaxants and Neuromuscular Blockade” por Elizabeth A. Martinez y Robert D. Keegan en Veterinary Anesthesia and Analgesia de Lumb y Jones, cuarta edición. Capítulo 3 Fisiología, farmacología y tratamiento del dolor Peter W. Hellyer, Sheilah A. Robertson, Anna D. Fails, Leigh A. Lamont, Karol A. Mathews, Roman T. Skarda, Maria Glowaski, Dianne Dunning y Duncan X. Lascelles Introducción Definición de dolor El dolor es una experiencia sensitiva y emocional (percepción) desagradable relacionada con daño tisular real o potencial, o que se describe en términos de tal daño. La incapacidad de comunicarse de ningún modo anula la posibilidad de que un individuo experimente dolor y requiera tratamiento adecuado para aliviarlo. El dolor nociceptivo surge por la activación de un conjunto definido de receptores y vías nerviosas a causa de estímulos dolorosos que pueden dañar a los tejidos. El dolor es la percepción consciente de una estimulación nociceptiva aguda o crónica que ocurre con grados variables de gravedad como resultado de lesión y enfermedad o del procesamiento nervioso anormal vinculado con malestar emocional, según lo revelan cambios biológicos, conductuales, o ambos. El dolor induce acciones motoras protectoras, tiene como resultado la evitación aprendida y puede Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 82 © Editorial El manual moderno Fotocopiar sin autorización es un delito. La prevención y el control del dolor son parte fundamental de la práctica de la medicina veterinaria. Es esencial que los veterinarios comprendan los procesos fisiológicos que conducen a la percepción del dolor y las respuestas de los pacientes a este proceso. En última instancia, el manejo anestésico del paciente es el control del dolor y el mantenimiento de la homeostasia en caso de estímulos dolorosos. El protocolo analgésico perioperatorio tiene un efecto en el bienestar del paciente que a menudo se extiende más allá del periodo anestésico inmediato. El control apropiado del dolor no sólo es parte integral de un plan anestésico, sino un componente fundamental de una práctica médica apropiada. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 83 modificar rasgos de comportamiento específicos de especie, incluido el comportamiento social. El dolor agudo es el efecto de un suceso traumático, quirúrgico o infeccioso que comienza de manera abrupta y es relativamente breve. Casi siempre desaparece con anestésicos. El dolor crónico es el que persiste más allá del tiempo habitual de una enfermedad aguda o de un tiempo razonable para que una lesión sane, o bien el que se vincula con un proceso patológico crónico o una disfunción neurológica que persisten o recurren por meses o años (p. ej., artrosis). El dolor crónico rara vez se alivia de manera permanente con analgésicos, pero puede reaccionar a una combinación de analgésicos, tranquilizantes o fármacos psicotrópicos, terapia física, manipulación ambiental y condicionamiento conductual. El dolor agudo es un síntoma de lesión o enfermedad, mientras que el dolor crónico es por sí mismo una enfermedad de neuroprocesamiento alterado. El dolor agudo tiene una función biológica en virtud de que sirve como advertencia de una disfunción y conduce a cambios conductuales protectores. El dolor crónico no tiene una función biológica e impone varias formas de estrés. Dado que el dolor es una percepción, siempre es subjetivo. En personas, la experiencia dolorosa tiene tres dimensiones (sensitiva-diferenciadora, motivacional-afectiva y cognitiva-evaluadora) de las cuales se encargan tres sistemas fisiológicamente distintos. La dimensión sensitiva-diferenciadora suministra información sobre inicio, localización, intensidad, tipo y duración del estímulo que induce el dolor. Este aspecto es función principal de haces nociceptivos ascendentes laterales, tálamo y corteza somatosensitiva. La dimensión motivacional-afectiva altera la sensación de bienestar del individuo y su resultado es la experiencia desagradable de dolor y sufrimiento, lo cual lleva al organismo a actuar. Esta dimensión se relaciona de forma estrecha con el sistema nervioso autónomo; las respuestas cardiovascular, respiratoria y gastrointestinal se vinculan con ella (aunque tales reacciones también pueden ocurrir de manera refleja). Esta dimensión se transmite por los haces nociceptivos ascendentes mediales y su aferencia en el sistema límbico. La dimensión cognitiva-evaluadora comprende los efectos de experiencias, valores sociales y culturales, ansiedad, atención y condicionamiento. Estas actividades se deben en gran medida a la actividad cortical, aunque ésta depende de la actividad reticular. La dimensión cognitiva-evaluadora de la experiencia dolorosa en mamíferos inferiores puede ser la única que difiere en grado significativo respecto del ser humano. Para analizar la fisiología del dolor y su control se requiere una revisión de las definiciones empleadas con frecuencia para describir esta percepción. Algología: ciencia y estudio de los fenómenos del dolor. Alodinia: dolor causado por un estímulo que normalmente no provoca dolor. Analgesia: ausencia de dolor en presencia de estímulos que habitualmente serían dolorosos. Analgésicos: fármacos que producen analgesia. Anestesia: ausencia de todas las modalidades sensitivas. Anestésicos: fármacos que inducen anestesia regional (es decir, en una parte del cuerpo) o anestesia general (es decir, inconciencia). Causalgia: síndrome de dolor ardoroso, alodinia e hiperpatía prolongados después de una lesión nerviosa traumática, a menudo en combinación con disfunción vasomotora y sudomotora (sudación) y cambios tróficos ulteriores. Dermatoma: segmento corporal con su propio suministro sensitivo en piel y tejido subcutáneo. Disestesia: sensación anormal desagradable, sea espontánea o inducida. Manual de anestesia y analgesia en. . Dolor canceroso: dolor consecutivo al crecimiento de un tumor primario, enfermedad metastásica o efectos tóxicos de la quimioterapia y la radiación, como las neuropatías causadas por fármacos antineoplásicos neurotóxicos. Dolor central: dolor relacionado con una lesión o alteración de la neurofisiología del sistema nervioso central (SNC). Dolor crónico: dolor que persiste por un tiempo mayor que el marco temporal esperado para la curación del dolor vinculado con enfermedad no maligna progresiva (como artrosis). Dolor de desaferenciación: dolor causado por pérdida de la aferencia sensitiva en el SNC, como sucede en la avulsión del plexo braquial u otros tipos de lesiones de nervios periféricos, o secundarias a afectación del SNC. Dolor inflamatorio: dolor espontáneo e hipersensibilidad al dolor en respuesta a daño e inflamación tisulares. Dolor neuropático: dolor espontáneo e hipersensibilidad al dolor en relación con daño o lesión del sistema nervioso. Dolor nociceptivo: dolor transitorio en respuesta a estímulos dolorosos. Estímulo doloroso: acción que causa daño real o potencial a tejidos corporales. Tiene intensidad y calidad suficientes para inducir reacciones nociceptivas en un animal y dolor en personas. Hiperalgesia: respuesta aumentada a un estímulo que normalmente es doloroso. Hiperestesia: mayor sensibilidad a la estimulación, sin incluir los sentidos especiales. Hipoalgesia: menor sensibilidad a la estimulación dolorosa. Hipoestesia: atenuación de la sensibilidad a la estimulación, sin incluir los sentidos especiales. Intervalo de tolerancia al dolor: diferencia aritmética entre el umbral de detección del dolor y el umbral de tolerancia al dolor. Malestar: expresión externa de sufrimiento a través de emoción o conducta (es decir, temor, ansiedad, hiperactividad o agresión). Neuralgia: dolor en la vía de distribución de uno o más nervios. Neuritis: inflamación de uno o más nervios. Neuropatía: trastorno funcional o cambio patológico de un nervio. Nocicepción: recepción, conducción y procesamiento nervioso central de señales nerviosas generadas por la estimulación de nociceptores. Es el proceso fisiológico que al completarse tiene como resultado la percepción consciente del dolor. Nociceptor: receptor en particular sensible a un estímulo doloroso o un estímulo que se sería doloroso si se prolongara. Parestesia: sensación anormal, sea espontánea o inducida. Las parestesias no son dolorosas (en oposición a las disestesias). Radiculalgia: dolor a lo largo de la distribución de una o más raíces nerviosas sensitivas. Radiculitis: inflamación de una o más raíces nerviosas. Radiculopatía: disfunción o cambio patológico en una o más raíces nerviosas. Reacciones: una combinación de reflejos cuya finalidad es producir movimiento generalizado tras la aplicación de un estímulo. Las reacciones son reflejos masivos que no se encuentran bajo control voluntario y por tanto en ellas no participa la corteza cerebral. Reflejos: respuestas involuntarias, ordenadas e inducidas por un estímulo. La base anatómica del arco reflejo consiste en un receptor, una fibra nerviosa aferente primaria vinculada con el © Editorial El manual moderno Fotocopiar sin autorización es un delito. 84 Valoración del paciente y. . . 85 © Editorial El manual moderno Fotocopiar sin autorización es un delito. receptor, una región de integración en la médula espinal o el tallo encefálico (sinapsis), y una motoneurona inferior que se propaga hasta un órgano efector, como músculos esqueléticos (reflejos somáticos), músculos lisos o glándulas (reflejos viscerales). Respuestas: movimiento voluntario del cuerpo o partes del cuerpo. Una respuesta no puede ocurrir sin participación de la corteza cerebral somatosensitiva. Un animal descerebrado puede tener una reacción pero no una respuesta. Los reflejos y reacciones pueden relacionarse o no con la percepción (es decir, el estímulo se percibe o no como doloroso). Dado que las respuestas requieren una corteza somatosensitiva funcional, primero debe percibirse el estímulo activador. Somático: adjetivo que suele usarse para describir la aferencia desde tejidos corporales distintos de las vísceras. Sufrimiento: estado emocional desagradable que se interna y no se expresa. Se describe como un estado mental indeseable o como emoción desagradable que las personas y los animales prefieren evitar. El sufrimiento puede referirse a una amplia gama de estados subjetivos intensos y desagradables, como los de temor o frustración. Puede ser de origen físico o psicológico. El sufrimiento puede ser provocado por dolor o estímulos externos no dolorosos que no dañan tejidos, por ejemplo negación de la satisfacción de instintos naturales o necesidades de un animal, como la privación materna, de contactos sociales, u otros. Tolerancia al dolor: máxima intensidad de dolor que un individuo tolera. La tolerancia al dolor varía en gran proporción entre individuos, sean humanos o animales. Depende en gran medida de la experiencia particular, ambiente, estrés y fármacos. Umbral (de detección) del dolor: experiencia de dolor mínima que un individuo puede reconocer. Es el punto al cual un sujeto comienza a percibir dolor cuando se aplica un estímulo doloroso en un estudio ascendente o punto en el cual el dolor desaparece en uno descendente. El umbral de detección del dolor es relativamente constante entre individuos y especies. En la mayor parte de los casos es mayor que el umbral del nociceptor. Umbral nociceptor: intensidad mínima de un estímulo que llevará a un nociceptor a generar un impulso nervioso. Neuroanatomía de las vías nociceptivas Nociceptores y estímulos La nocicepción es la recepción de señales procedentes de la activación de nociceptores que detectan estímulos que dañan tejidos (estímulos nocivos, llamados más a menudo dolorosos). El dolor implica que se han percibido estímulos dolorosos en el plano cortical. Entre los estímulos que activan nociceptores figuran los mecánicos, térmicos y químicos. Algunos nociceptores reaccionan sólo a una de estas modalidades, mientras que otros son sensibles a una diversidad de ellas (nociceptores polimodales). Los nociceptores son terminaciones nerviosas desnudas (no encapsuladas), distribuidas de forma amplia en piel y tejidos profundos. Representan las terminaciones periféricas de neuronas aferentes primarias nociceptivas que poseen axones pequeños con escasa o nula mielina. La activación de fibras A-d, de conducción rápida (5 a 30 m/s), se relaciona con dolor penetrante o pungitivo (según lo refieren las personas). Las fibras C, no mielinizadas y de conducción lenta (0.5 a 2.0 m/s), se vinculan con un tipo de dolor urente más lento. Ambos tipos de fibras nociceptivas inervan la piel (dolor superficial) y estructuras somáticas o viscera- 86 Manual de anestesia y analgesia en. . Divergencia en las vías nociceptivas Además de las conexiones de las vías nociceptivas ascendentes con la corteza somatosensitiva para la percepción consciente, las vías nociceptivas poseen grados variables de conectividad con varias regiones subcorticales del encéfalo, y a través de estas conexiones inducen varias respuestas no conscientes. Un aspecto de la nocicepción (y de otras modalidades sensitivas) que reviste importancia conductual es el grado en que afecta el estado de alerta mental. Esta relación entre sensación y conciencia está organizada en la formación reticular (FR), un agregado laxo de núcleos en el centro del tallo encefálico que se extiende desde el diencéfalo hasta el bulbo raquídeo. Entre las funciones de la FR figuran la regulación de las frecuencias cardiaca y respiratoria, atención selectiva a estímulos y mantenimiento de la conciencia y la alerta cortical. La FR es crucial para la regulación del nivel de conciencia a través de sus proyecciones rostrales con el diencéfalo, el cual excita a su vez de manera difusa la corteza cerebral. La FR recibe señales de todas las vías aferentes, aunque el grado en que estas conexiones se establecen es variable, según sea la vía. Los estímulos, en especial los dolorosos, elevan el estado de alerta y las funciones neurovegetativas, como las frecuencias cardiaca y respiratoria. La información nociceptiva se dirige de manera simultánea al hipotálamo, que es el coordinador encefálico de las respuestas neurovegetativas elaboradas y el principal integrador de las respuestas fisiológicas y emocionales. Las señales que se propagan por vías nociceptivas hasta el hipotálamo producen actividad en el sistema nervioso simpático y la glándula hipófisis, y de este modo elevan la concentración circulante de adrenalina/noradrenalina y glucocorticoides. La actividad catabólica y otras manifestaciones endocrinas de esta activación pueden tener efectos negativos en la salud. Tanto el hipotálamo como la FR tienen proyecciones en otras partes del sistema límbico, un grupo de regiones corticales y subcorticales que producen los cambios conductuales, cognitivos y fisiológicos que las personas describen como emociones. Las vías nociceptivas emiten proyecciones colaterales al mesencéfalo (cerebro medio). Un grupo de blancos nucleares en el mesencéfalo consiste en motoneuronas que coordinan movimientos orientadores de cabeza y ojos hacia el estímulo doloroso (reflejo de sujeción visual). Otras neuronas que forman la materia gris periacueductal (MGP) del mesencéfalo activan importantes sistemas moduladores del dolor descendentes. © Editorial El manual moderno Fotocopiar sin autorización es un delito. les profundas (dolor profundo). La distinción entre dolor superficial y profundo no es del todo arbitraria, basada en “afuera” y “adentro”. Cada uno se vincula con una vía de dolor anatómica y funcionalmente separada; es susceptible de distinta manera al dolor y se revisa por separado en una exploración neurológica. La investigación sobre el dolor ha revelado la presencia de un tipo funcional particular de nociceptor denominado nociceptor silencioso. El elevado umbral de esta terminación nerviosa asegura que, en circunstancias normales, sea relativamente insensible a cualquier estímulo. Sin embargo, después de la liberación de mediadores inflamatorios tisulares, el umbral se reduce en gran medida y estos nociceptores hasta entonces silenciosos pueden activarse por diversos estímulos térmicos y mecánicos. La presencia de nociceptores silenciosos es un mecanismo por el cual la inflamación produce hiperalgesia primaria. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 87 Vías raquídeas ascendentes Múltiples vías nociceptivas que se han descrito en la médula espinal de animales domésticos están presentes en todos los funículos de la médula, con un grado confuso de superposición en sus funciones. Ninguna de estas vías es exclusiva para la transmisión de nocicepción (todas tienen fibras que conducen información táctil). Para fines clínicos, sólo es necesario comprender dos: los haces espinocervicotalámico y espinorreticular. El haz espinocervicotalámico se encarga de la transmisión del dolor superficial y sensaciones táctiles, y se considera la principal vía de dolor consciente en carnívoros. Las aferentes primarias de esta vía hacen sinapsis en el asta dorsal, desde donde aferentes secundarias median reflejos locales y se proyectan en sentido craneal en un haz ipsolateral en la parte dorsal del funículo lateral. Los axones de este haz ascienden a los segmentos C1 y C2 de la médula espinal, donde hacen sinapsis en el núcleo cervical lateral. Las fibras que surgen de este núcleo se decusan y proyectan a través del tallo encefálico al tálamo. Algunas colaterales de las fibras ascendentes terminan en la FR. Desde el tálamo, se emiten fibras hacia la corteza somatosensitiva. Las sensaciones transmitidas por el haz espinocervicotalámico son de tacto y dolor superficial. Esta vía es diferenciadora en el sentido de que el animal puede determinar la localización precisa del estímulo doloroso, una cualidad relacionada con el alto grado de somatotopia que tiene esta vía. En clínica, el funcionamiento del haz espinocervicotalámico se examina mediante contacto ligero de la piel con los dedos o un hemostato mosquito. Este estímulo se aplica de manera ligera y breve, de tal modo que active de preferencia la vía espinocervicotalámica. El haz espinorreticular se enfoca en mayor medida en la transmisión del dolor profundo y sensaciones viscerales. Las aferentes primarias de esta vía ingresan en la médula espinal y de inmediato divergen para proyectar colaterales a varios segmentos de distancia en sentido rostral y caudal respecto del segmento de entrada. Esta propagación de la información a través de varios segmentos de la médula espinal permite a esas aferentes participar en reflejos intersegmentales (diversas manifestaciones de reflejos de retiro y posturales en respuesta a estímulos dolorosos). En el asta dorsal hay neuronas de segundo orden. En los funículos lateral y ventral se encuentran de manera difusa axones de neuronas de proyección de este sistema. Dichas proyecciones son bilaterales; la decusación de axones en este sistema ocurre de manera difusa por todo el eje mayor de la médula espinal. La mayor parte de las emisiones ascendentes del haz espinorreticular que llegan al tallo encefálico no se proyecta de forma directa en el tálamo, sino que termina en la FR. Por lo tanto, la mayor proporción del dolor profundo que se percibe de manera consciente llega a la corteza a través de proyecciones reticulares difusas hacia el tálamo. La activación de esta vía aumenta la excitación y activa al sistema límbico, una conexión que en el ser humano se vincula con las respuestas emocionales al dolor. El dolor visceral es en particular poco localizado. Fibras aferentes viscerales discurren en nervios simpáticos, tienen grandes campos receptores superpuestos, y reaccionan en mayor medida a estiramiento, isquemia, dilatación o espasmo (el traumatismo directo de vísceras, incluido el traumatismo quirúrgico, es un estímulo sorprendentemente ineficaz para los nociceptores). El dolor de origen visceral tiende a ser sordo, insidioso o urente. Las aferentes primarias procedentes de vísceras siguen nervios vegetativos (p. ej., neumogástrico y nervios simpáticos) hasta el SNC. La vía nociceptiva profunda se examina en la exploración neurológica al aplicar un hemostato 88 Manual de anestesia y analgesia en. . en la base de un dedo del pie (con cuidado de no incluir piel), una manipulación que estimula nociceptores en el periostio de la tercera falange. Sistema trigémino Para la cabeza, nocicepción e información táctil se transmiten por el sistema trigémino. Los somas de las fibras aferentes primarias residen dentro del ganglio trigémino (semilunar). Sus procesos centrales ingresan en el puente de Varolio con el nervio trigémino y discurren en sentido caudal a lo largo de la superficie lateral del bulbo raquídeo. Una columna nuclear yace medial al haz raquídeo en toda su longitud. En su parte rostral en el puente de Varolio, este grupo de somas constituye un núcleo sensitivo pontino. En dirección más caudal, la columna se conoce como núcleo espinal de V. Los núcleos pontino y espinal de V contienen somas de las neuronas de segundo orden de este sistema. Ocurre una separación en sentido rostral a caudal de las funciones de estos núcleos: el núcleo pontino se encarga en mayor medida de estímulos táctiles diferenciadores y proprioceptivos, mientras que la parte rostral del núcleo espinal de V emite información somatosensitiva al cerebelo. Sin embargo, la mayoría de las neuronas del núcleo espinal de V se enfoca en la nocicepción. Muchas de ellas se proyectan en núcleos motores de pares craneales para participar en arcos reflejos (p. ej., los reflejos corneal y palpebral) y muchas más se proyectan en la FR para influir en respuestas neurovegetativas e incrementar la excitación. Empero, fibras para la percepción consciente cruzan de manera difusa la línea media del bulbo raquídeo y se unen al haz quintotalámico contralateral, adyacente al lemnisco medial. El haz quintotalámico (también llamado lemnisco trigémino) se proyecta en el tálamo y, desde allí, la información nociceptiva llega a la corteza somatosensitiva a través de la cápsula interna. Existe una tendencia a concebir las vías somatosensitivas como circuitos eléctricos que reaccionan a los estímulos de modos predecibles y que de manera consistente producen una percepción sensorial que es un registro fidedigno del estímulo ocurrido en la periferia. Éste es un modelo útil pero que simplifica en extremo la situación real, dado que la actividad del SNC puede modular el procesamiento somatosensitivo. Esta capacidad de modificar la actividad del sistema sensitivo está especialmente desarrollada en las vías nociceptivas. La posibilidad de que un estímulo particular produzca una percepción de dolor es una propiedad muy lábil y puede modificarse en la periferia, la médula espinal, el tallo encefálico y centros superiores. Modulación en la periferia (nociceptores) El umbral de un nociceptor no es constante. Como se describió antes, la presencia de los llamados nociceptores silenciosos es un ejemplo del modo en que las condiciones en el ambiente celular de la terminación nerviosa desnuda pueden modificar la sensibilidad del receptor al estímulo. El alto umbral de los nociceptores silenciosos asegura que, en circunstancias normales, sean relativamente insensibles a cualquier estímulo, pero al exponerse a mediadores inflamatorios este umbral se reduzca en gran medida, y puedan activarse nociceptores hasta entonces silenciosos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Modulación del dolor Valoración del paciente y. . . 89 © Editorial El manual moderno Fotocopiar sin autorización es un delito. De modo similar, muchos mediadores inflamatorios (p. ej., prostaglandinas [PG] y leucotrienos), llamados en conjunto sintetizadores de nociceptores, reducen el umbral de otras poblaciones de nociceptores. En consecuencia, en tejido dañado o inflamado, estímulos que normalmente serían subumbrales pueden producir actividad en eferentes nociceptivas. De modo similar, determinados mediadores inflamatorios (p. ej., bradicinina y serotonina) o sustancias liberadas por células dañadas (p. ej., iones potasio y trifosfato de adenosina) estimulan de manera directa a nociceptores y pueden por tanto considerarse activadores de nociceptores. Resulta interesante que terminaciones nerviosas libres estimuladas puedan liberar sustancias directamente en los tejidos circundantes. Entre ellas es notable la sustancia P. Ésta (que también es un importante neurotransmisor en vías nociceptovas centrales) dilata vasos sanguíneos y desgranula mastocitos (edema neurógeno), los cuales contribuyen ambos a la inflamación y a una mayor sensibilización a nociceptores locales. Todos estos sucesos participan en el desarrollo de hiperalgesia primaria (que resulta del aumento de reactividad de los nociceptores a estímulos dolorosos) y de un fenómeno relacionado, la alodinia (en la cual estímulos no dolorosos, como los inducidos por una sensación de tacto, se tornan capaces de activar nociceptores). Modulación en el asta dorsal En el asta dorsal se realiza un considerable procesamiento de información nociceptiva, aunque no se conoce con exactitud qué ocurre. Uno de los conceptos fundamentales del procesamiento en el asta dorsal señala que una población de neuronas de segundo orden se encarga de la nocicepción (células nociceptivas específicas) y un grupo más pequeño recibe señales de aferentes primarias que conducen información táctil dolorosa y no dolorosa. Se sospecha que las neuronas nociceptivas específicas participan sobre todo en la nocicepción diferenciadora (esto es, localización). El segundo grupo, las llamadas neuronas de intervalo dinámico amplio (IDA), reacciona tanto a estímulos dolorosos como no dolorosos, y es probable que intervenga en vías que tienen menor somatotopia (es decir, son menos diferenciadoras). Al parecer, las neuronas IDA son relativamente insensibles a información táctil y descargan a una frecuencia en respuesta a estímulos táctiles inocuos, pero lo hacen de manera más vigorosa (a mayor frecuencia) a la estimulación dolorosa. Estas neuronas también reciben información de estructuras somáticas y viscerales, lo cual es una característica que subyace en apariencia al fenómeno de dolor referido. En éste, estímulos dolorosos que se originan en las vísceras se perciben como originados en una región somática (pared corporal o piel). Es posible que esta percepción sea resultado de que la información procedente de la región de la víscera converge en neuronas IDA y vías que también transmiten información desde estructuras somáticas. Las neuronas IDA son tal vez las células más importantes en la expresión de la facilitación raquídea del dolor, o encordamiento (figura 3-1). Éste ocurre con activación continua y rápida de aferentes nociceptivas primarias, quizá en especial fibras de diámetro pequeño no mielinizadas (fibras C). Las descargas de alta frecuencia de potenciales de acción (PA) en la terminal aferente primaria estimulan la liberación de mayores cantidades de glutamato y también se relacionan con la liberación de sustancia P y factor neurotrófico derivado del encéfalo (BDNF). La mayor exposición al glutamato en la hendidura sináptica activa a receptores de N-metil-d-aspartato (NMDA) (inactivos excepto en condiciones de despolarización persistente de la membrana) en la membrana postsináptica. Esta variedad específica de receptor de glutamato es única porque exhibe conductancia de calcio, por lo que su activación se relaciona con la entrada de iones 90 Manual de anestesia y analgesia en. . Facilitación espinal del dolor (“encordamiento”) PA Terminal aferente primaria de cia en cu re PA af alt Aferente secundaria (membrana postsináptica) Glutamato Glutamato Sustancia P BDNF Receptor de AMPA (respuesta rápida; despolarización) Receptor de NMDA (conductancia de Ca2+; cambios en la sensibilidad de la membrana) Figura 3-1. Procesos que intervienen en la facilitación espinal del dolor o “encordamiento”. AMPA, ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico; PA, potencial de acción; BDNF, factor neurotrófico derivado del encéfalo; NMDA, N-metil-D-aspartato. Fuente: Hellyer P.W., Robertson S.A., Fails A.D. 2007. Pain and its management. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia , 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 37. calcio en la neurona postsináptica, lo que precipita una serie de cascadas intracelulares que en última instancia causan la regulación a la alza de los receptores. Sustancia P y BDNF son neurotransmisores neuromoduladores que se unen a receptores acoplados a proteína G. Éstos también activan cascadas de señalización intracelular que incrementan la sensibilidad de la membrana a la estimulación ulterior. El efecto neto de estos sucesos es que los PA de alta frecuencia en la neurona aferente primaria “adiestran” a las neuronas de segundo orden para que reaccionen de manera más vigorosa a la estimulación ulterior. Este cambio puede durar horas a días (o más) después de que el suceso causal termina. Por lo tanto, los estímulos dolorosos prolongados de manera eficaz producen mayor sensibilidad a estímulos posteriores. Lo que resulta en particular significativo acerca de este fenómeno es que la anestesia general no previene el encordamiento, como tampoco la © Editorial El manual moderno Fotocopiar sin autorización es un delito. Receptores acoplados a proteína G (respuesta lenta; cambios en la sensibilidad de la membrana; cambios de largo plazo en la expresión génica) Valoración del paciente y. . . 91 generación de PA en las aferentes primarias. Esta observación se ha usado como un argumento convincente para la administración de analgésicos en el preoperatorio o el intraoperatorio en prevención del desarrollo de encordamiento durante las operaciones en las que es probable la activación de fibras C. Modulación suprasegmentaria La actividad en vías nociceptivas espinales también está influida en grado notable por sistemas antinociceptivos que se originan en el tallo encefálico. El cerebro medio (mesencéfalo) y el bulbo raquídeo poseen ambos una serie de núcleos en la línea media que modulan la transmisión de nocicepción. Señales aferentes desde centros cerebrales superiores y colaterales de vías nociceptivas ascendentes, en particular las que transmiten dolor profundo (haz espinorreticular), activan dichos núcleos. Entre los núcleos que dan origen a vías moduladoras del dolor descendentes, revisten particular interés la MGP mesencefálica y el núcleo del rafe magno de la parte rostroventral del bulbo raquídeo. La MGP recibe señales de haces nociceptivos ascendentes y centros superiores (incluidas estructuras límbicas y corteza cerebral) y proyecta axones al núcleo del rafe magno, a otros núcleos reticulares bulbares y, en mucha menor magnitud, al asta dorsal de la médula espinal. Estos axones liberan múltiples neurotransmisores, sobre todo endorfinas, que se transmiten con potentes propiedades antinociceptivas. Las señales de la MGP hacia el núcleo del rafe magno activan (por desinhibición) las vías monoaminérgicas que surgen aquí y descienden por la médula espinal para modular la nocicepción en el asta dorsal. Los principales neurotransmisores del núcleo del rafe magno y otros núcleos bulbares son serotonina y noradrenalina. La actividad en estos sistemas atrae a un grupo de interneuronas cuyos neurotransmisores (endorfina, encefalina y dinorfina) inhiben la transmisión en vías de la médula espinal en el asta dorsal. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Dolor neuropático El dolor neuropático es el dolor causado por lesión del sistema nervioso. El daño que ocasiona el dolor neuropático puede deberse a diversas lesiones, como traumatismo (p. ej., amputación y lesión por aplastamiento), lesión vascular (p. ej., enfermedad tromboembólica), endocrinopatía (p. ej., diabetes mellitus) o infección (p. ej., neuralgia posherpética). Es probable que el dolor neuropático que resulta de estas causas distintas no sea una sola entidad. Se piensa que es probable que varios mecanismos contribuyan al dolor neuropático; no siempre todos subyacen a cualquier caso particular, aunque no son excluyentes entre sí. Hiperalgesia y alodinia se vinculan a menudo con dolor neuropático. Las personas afectadas describen algunas veces disestesias, sensaciones anormales desagradables que se caracterizan con frecuencia como hormigueo o “descargas eléctricas”, aunque el dolor neuropático se describe las más de las veces como de calidad urente y lancinante. En el sistema nervioso periférico, la lesión de aferentes primarias (hasta los ganglios de la raíz dorsal, inclusive) puede causar dolor neuropático. No se comprenden con claridad los mecanismos que producen este dolor y, como todas las facetas del dolor neuropático, es probable que sean múltiples. Al menos en algunos casos, la aferente primaria dañada produce mayor frecuencia de PA espontáneos (la mayor parte de las neuronas lo hace en alguna medida, pero las aferentes nociceptivas normales suelen hacerlo con Manual de anestesia y analgesia en. . muy baja frecuencia), un fenómeno llamado descarga ectópica. Las aferentes primarias dañadas son también capaces de desarrollar ramas colaterales, quizá en respuesta a factores neurotróficos liberados por los tejidos dañados. Colaterales aberrantes de neuronas nociceptivas pueden propagarse a la piel adyacente u otros tejidos, donde su activación causa en ocasiones percepción anormal del dolor. Una línea de indagación ha revelado un fenómeno de acoplamiento eléctrico entre fibras somatosensitivas y simpáticas en la periferia (incluidos los ganglios de la raíz dorsal). Este acoplamiento, llamado dolor mantenido por vías simpáticas, activa a vías nociceptivas (y la percepción del dolor) con actividad en neuronas simpáticas. En el sistema nervioso central es probable que las alteraciones descritas al exponer el encordamiento (facilitación raquídea del dolor) participen en el desarrollo de dolor neuropático sostenido, en la medida en que la regulación ascendente de receptores en membranas postsinápticas puede persistir por largo tiempo. Dado que la activación de receptores de NMDA-glutamato es parte clave de la facilitación raquídea del dolor, el uso de antagonistas de NMDA tiene potencial como tratamiento para el dolor neuropático. Además, existen pruebas de que las fibras aferentes A-b táctiles (es decir, no nociceptivas) emiten colaterales en el asta dorsal (una vez más, probablemente en respuesta a factores neurotróficos liberados por tejido nervioso lesionado), que establecen conexiones aberrantes con neuronas de proyección normalmente encargadas de la nocicepción. Por lo tanto, la actividad en estas fibras induce actividad en vías nociceptivas y al final da lugar a la percepción de mayor dolor. También hay abundantes pruebas de que el repertorio de neurotransmisores, receptores o ambos en el asta dorsal sufre cambios en respuesta a lesiones. Algunos investigadores han demostrado un decremento del ácido g-aminobutírico (GABA, un neurotransmisor inhibidor) en modelos animales de dolor neuropático. Las técnicas experimentales que elevan los valores de GABA en la médula espinal causan atenuación de la alodinia, que es característica del dolor neuropático. Un aspecto particularmente frustrante del dolor neuropático es su grado de resistencia a opioides. Tal vez esto se debe a la pérdida de receptores de opioides, un fenómeno que se ha observado en el ganglio de la raíz dorsal y el asta dorsal. De manera simultánea, al parecer la colecistocinina y sus receptores se regulan de modo ascendente por la lesión del tejido nervioso; se ha documentado actividad de opioide antagonista de la colecistocinina. Medición del dolor en pacientes veterinarios Como ya se indicó, el dolor es una experiencia multidimensional extremadamente compleja con elementos sensitivos y afectivos. Resulta claro que existen poblaciones bien definidas, como recién nacidos humanos, adultos afásicos y animales, que no pueden expresar de manera abierta su dolor. Sin embargo, todos los mamíferos poseen los componentes neuroanatómicos y neurofarmacológicos necesarios para transducción, transmisión y percepción de estímulos dolorosos; por tanto, suele presuponerse que los animales experimentan dolor aunque no lo perciban o comuniquen exactamente del mismo modo en que lo hacen las personas. No existe en la actualidad un método de referencia para valorar el dolor en animales. Se han publicado muchos métodos de puntuación diferentes que incluyen variables fisiológicas (en un intento de identificar medidas objetivas) y variables conductuales, pero pocos se han validado de manera rigorosa. El tema de la valoración del dolor en animales es en particular complejo © Editorial El manual moderno Fotocopiar sin autorización es un delito. 92 Valoración del paciente y. . . 93 porque deben considerarse diferencias de sexo, edad, especie, raza, cepa y ambiente. Los sistemas de valoración también deben tomar en cuenta los diferentes tipos y fuentes de dolor, como dolor agudo contra crónico o dolor neuropático y visceral contra dolor somático. Por ejemplo, si se desarrollara una escala de dolor para determinar el dolor posoperatorio agudo en perros después de una operación abdominal común, como ovariohisterectomía, entonces la escala podría ser inapropiada para cuantificar el dolor después de procedimientos ortopédicos o vinculados con artrosis crónica en esa especie. No hay duda de que a medida que más estudios se enfoquen en conductas de dolor específicas de especie y en los diferentes tipos de dolor, la capacidad de la comunidad veterinaria de reconocer y tratar el dolor en animales mejorará. Con todo, la cuantificación del dolor en animales no dejará de ser una tarea subjetiva e inexacta en el futuro. Las respuestas conductuales al dolor varían en grado notorio entre especies y esas diferencias pueden relacionarse con las conductas innatas de un animal. Por ejemplo, dado que ratas y ratones son animales de presa, los signos claros de dolor o lesión llaman la atención de los depredadores, por lo cual los roedores han evolucionado de tal modo que por instinto ocultan el dolor. Los signos sutiles del dolor exhibidos por estas especies, como la compresión abdominal y el arqueo del dorso, pueden pasar inadvertidos con facilidad por un observador inexperto. Debido a las diferencias conductuales, las herramientas de valoración del dolor deben ser específicas de especie. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Dolor agudo La mayoría de los estudios en perros y gatos se ha concentrado en determinar el dolor posoperatorio agudo. No todos los sistemas usados se han validado o probado de manera rigurosa, y la pregunta clave para un veterinario abrumado de trabajo es: “¿Cuán bien funcionan en la práctica clínica estos sistemas de puntuación?” Medidas objetivas Tanto en gatos como en perros se ha estudiado la correlación entre variables fisiológicas fáciles de medir (frecuencias cardiaca y respiratoria, presión arterial, diámetro pupilar) y puntajes de dolor. En ningún estudio se ha encontrado una medida objetiva confiable de manera consistente, lo cual no causa sorpresa dado que estos parámetros pueden afectarse por muchos factores además del dolor. Por ejemplo, un opioide administrado de manera aislada causa midriasis en gatos pero miosis en perros. El tamaño pupilar también se altera por temor y luz ambiental. En un entorno de investigación estrechamente controlado, la presión arterial parecía promisoria como un indicador indirecto del dolor en gatos, pero en un ambiente clínico esta variable resultó ser un indicador poco confiable de dolor. Los cambios del cortisol plasmático y endorfinas b son componentes de la “respuesta de estrés” a la anestesia y la operación, y se ha dedicado mucho esfuerzo a los intentos de correlacionar estas hormonas con el dolor en ensayos de analgesia en el laboratorio y la clínica. El cortisol plasmático no fue un marcador de dolor útil en perros y es en extremo poco confiable en gatos. Las pruebas mecánicas del umbral nociceptivo con diversos dispositivos (palpómetros y algiómetros) han resultado útiles para evaluar hiperalgesia primaria (herida) y secundaria (área remota) en gatos y perros. Los cambios en la sensibilidad de la herida se han correlacionado con una puntuación analógica visual en gatos, lo cual sugiere que evaluar la sensibilidad de la herida es una herramienta valiosa y debe incorporarse en un protocolo de valoración general. Los análisis de la marcha en placa de fuerza se han usado ampliamente para evaluar cojera en perros de 94 Manual de anestesia y analgesia en. . manera objetiva. Esta técnica también se ha empleado para determinar la respuesta a diferentes intervenciones quirúrgicas y la eficacia de diversos analgésicos. Escalas descriptivas simples. Éstas son las escalas de dolor básicas. Por lo regular tienen cuatro o cinco descriptores entre los cuales los observadores eligen, por ejemplo ausencia de dolor, dolor leve, dolor moderado, dolor intenso o dolor muy intenso. Aunque son sencillas de usar, estas escalas son en extremo subjetivas y no detectan cambios pequeños en la conducta de dolor. Escalas de calificación numéricas. Éstas no difieren en gran medida de las escalas descriptivas simples, pero asignan números para facilitar la tabulación y el análisis; por ejemplo, a la ausencia de dolor se le asigna el número 0 y al dolor muy intenso el 5. Este sistema implica igual diferencia o peso entre cada categoría, lo cual no es el caso. Se trata de escalas discontinuas; por consiguiente, un perro que experimenta un dolor que “apenas llega” a la categoría 2 se encuentra en una condición muy distinta de otro perro que también se considera en la categoría 2 pero casi en la categoría 3. Un desarrollo más de los sistemas de calificación descriptivo simple y numérico es un parámetro de calificación numérico categorizado en el que se eligen determinadas conductas y se les asigna un valor. Por ejemplo, la vocalización puede dividirse en ninguna (puntaje = 0), gemidos con reactividad (puntaje =1) y gemidos sin reactividad (puntaje = 2); otras categorías pueden incluir movimiento, agitación y postura. Escala analógica visual. En un intento por mejorar escalas discontinuas, la escala analógica visual (EAV) se ha usado de forma amplia en medicina veterinaria (figura 3-2). Esta herramienta consiste en una línea continua (por lo regular de 100 mm de largo) que en cada extremo tiene una descripción de los límites de la escala, por ejemplo ausencia de dolor o sedación en un extremo y dolor extremo o paciente dormido en el otro. Un observador traza una marca en el punto de la línea en el que considera que se encuentra el grado de dolor del animal atendido y dicho punto se traduce después en un número al medir la distancia de cero a la marca. Sin capacitación y experiencia, la EAV posee una amplia variación interobservador. La escala analógica visual dinámica e interactiva (EAVDI) es una extensión del sistema EAV común en perros. Con el sistema EAVDI, primero se observa al animal sin alterarlo desde una distancia y luego la persona se le acerca, lo manipula y lo alienta a caminar. Por último, se palpan la incisión quirúrgica y la zona circundante y se realiza una valoración final de sedación y dolor. Este método supera algunas de las deficiencias de los sistemas observacionales; por ejemplo, un © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sistemas de puntuación subjetivos Dado que los animales no pueden informar por sí mismos, todos los sistemas de puntaje que dependen de un observador humano deben, por definición, ser subjetivos en algún grado y contar con un margen de error, que puede ser de defecto o exceso en la cuantificación del dolor del animal. Cualquier sistema usado debe ser válido, confiable y sensible. Al no contar con criterios definidos de manera estricta y con observadores bien capacitados y experimentados, muchos sistemas de puntuación son demasiado variables, lo cual es una de las principales críticas a los ensayos clínicos multicéntricos. Un sistema de puntuación puede mostrar que un agente analgésico es eficaz, mientras que otro revela que el mismo analgésico es ineficaz. Si un sistema es insensible, entonces esas diferencias son inevitables y tienen como resultado gran variabilidad entre observadores (“interobservador”). Valoración del paciente y. . . AUSENCIA DE DOLOR 95 PEOR DOLOR POSIBLE © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 3-2. Escala analógica visual usada para evaluar el dolor en animales. Fuente: Hellyer P.W., Robertson S.A., Fails A.D. 2007. Pain and its management. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia , 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 43. perro puede yacer inmóvil y silencioso por el dolor de una herida y pese a ello es posible que ésta no se reconozca a menos que el observador interactúe con el animal. El sistema EAVDI también se ha usado para determinar el dolor posoperatorio en gatos y, cuando lo realiza un individuo que desconoce los tratamientos, identifica diferencias entre analgésicos y entre gatos tratados y no tratados. Hasta la fecha, los sistemas de puntuación analizados en esta sección se consideran unidimensionales dado que sólo cuantifican la intensidad del dolor. Si se considera la complejidad del dolor, no es sorprendente que los sistemas unidimensionales, subjetivos y simples no resulten ideales. En seres humanos, los sistemas multidimensionales (como el Cuestionario de Dolor de McGill), que indican no sólo intensidad sino también cualidades sensitivas y afectivas (emocionales) del dolor, han posibilitado una cuantificación más amplia del dolor de un paciente. Los sistemas multidimensionales revisten particular importancia cuando no es posible el autoinforme, pero los informes deben incorporar componentes sensibles y específicos para el dolor (p. ej., expresiones faciales en lactantes) en la especie estudiada. La Escala de Dolor de la University of Melbourne se desarrolló para incorporar datos fisiológicos objetivos (frecuencia cardiaca, frecuencia respiratoria, tamaño pupilar y temperatura rectal) y respuestas conductuales (actividad, respuesta a la palpación, postura, estado mental, vocalización). Al asignar números a cada factor, se obtiene un puntaje de 0 a 27. Esta escala se ha probado en perras después de ovariohisterectomía y ha demostrado buena concordancia entre distintos asesores. Puede diferenciar entre perros anestesiados pero no sometidos a operación y los que sí se operaron. Con algunas depuraciones para detectar diferencias menores, el sistema es promisorio para uso clínico. Hasta la fecha, la escala mejor validada para determinar el dolor posoperatorio agudo en perros es la escala del dolor medido compuesta de Glasgow. Las 279 palabras o expresiones originales para describir el dolor en perros se redujeron a 47 bien definidas y colocadas en una categoría fisiológica y siete categorías conductuales. Estas últimas comprenden valoraciones de postura, comodidad, vocalización, atención a la herida, talante y respuesta a personas, movilidad y respuesta al tacto. Cada descriptor está bien definido para evitar interpretaciones erróneas. La valoración incluye tanto observación desde una distancia como interacción con el paciente (p. ej., palpación de la herida). Son necesarias valoraciones frecuentes porque el dolor no es un proceso estático y deben determinarse los beneficios de la intervención con analgésicos. En una práctica veterinaria saturada, el considerable tiempo necesario para las determinaciones es el mayor factor 96 Manual de anestesia y analgesia en. . en contra para el tratamiento eficaz del dolor. Por ello se ha desarrollado una forma breve de la escala de dolor compuesta de Glasgow, que sólo tarda unos minutos en realizarse. Dolor crónico El dolor crónico puede afectar la calidad de vida de un animal. Debido a la naturaleza del dolor crónico, como el relacionado con artrosis en perros y gatos, los cambios conductuales acompañantes pueden ser insidiosos y fáciles de pasar por alto. En realidad, muchos propietarios suponen que esos cambios son inevitables con el avance de la edad. Datos preliminares basados en entrevistas con propietarios revelan cambios en 32 tipos de conducta en perros con dolor crónico. Este estudio también indicó que los propietarios son quienes mejor valoran el dolor de sus mascotas. El Cuestionario de Comportamiento Canino en Materia de Salud de la Glasgow University ha identificado algunos indicadores clave del dolor crónico, entre ellos decrementos de movilidad, actividad, sociabilidad y curiosidad, así como aumentos de agresión, ansiedad, sueño diurno y vocalización. El dolor crónico es sin lugar a duda un problema clínico en gatos, pero no está bien documentado. A diferencia de lo que ocurre en el caso de los perros, se sabe muy poco de la enfermedad articular degenerativa en felinos, pero pruebas radiográficas en gatos geriátricos sugieren que la incidencia puede ser hasta de 90%. Debido al modo de vida de los gatos domésticos, la cojera no es una queja común de los propietarios; pero, cambios conductuales como disminución del acicalamiento, renuencia a saltar a los sitios favoritos y defecar fuera del arenero deben inducir a los veterinarios a buscar fuentes de dolor crónico. Es común que los propietarios no adviertan cuán debilitada está su mascota sino hasta que ven una mejoría impresionante después del tratamiento. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Frecuencia de la valoración en animales El estado de salud del animal, magnitud de operaciones/lesiones y duración anticipada del uso de analgésicos determinan la frecuencia y el intervalo de las determinaciones. En general, las valoraciones deben efectuarse cuando menos cada hora por las primeras 4 a 6 h después de la intervención, siempre que el animal se haya recuperado de la anestesia, tenga signos vitales estables y repose con comodidad. Los animales que no se recuperan de la manera prevista de anestesia o la operación y los que tienen enfermedad crítica requieren determinaciones mucho más frecuentes hasta que se estabilicen. La respuesta del paciente al tratamiento analgésico y la duración esperada del efecto de los fármacos analgésicos administrados ayudan a determinar la frecuencia de las evaluaciones. Por ejemplo, si un perro reposa de forma cómoda después de la administración posoperatoria de morfina, tal vez no sea necesario reevaluarlo en 2 a 4 h. Debe permitirse que los animales duerman después del tratamiento analgésico. A menudo es posible revisar los signos vitales sin molestar de manera innecesaria al paciente que duerme. En general, no se despierta a los animales para revisar su estado de dolor; sin embargo, esto no significa que no deban recibir los analgésicos programados. Es probable que las observaciones continuas sin alterar al paciente, aunadas a observaciones interactivas periódicas (abrir la jaula, palpar la herida, etc.), proporcionen más información que la observación ocasional del animal a través de la puerta de la jaula. Es lamentable que las observaciones continuas no sean prácticas en la mayor parte de las situaciones clínicas. En general, a mayor frecuencia de las observaciones, mayor probabilidad de reconocer signos sutiles de dolor. Valoración del paciente y. . . 97 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Tratamiento del dolor La analgesia es, en el sentido más estricto, la ausencia de dolor, pero desde el punto de vista clínico es la reducción de la intensidad percibida del dolor (hipoalgesia). El objetivo no debe ser eliminar el dolor por completo, sino hacerlo lo más tolerable posible sin deprimir indebidamente a los pacientes. En el ambiente clínico puede inducirse analgesia al atenuar o interrumpir los procesos nociceptivos en uno o más puntos entre el nociceptor periférico y la corteza cerebral. La nocicepción implica cuatro procesos fisiológicos sujetos a modulación farmacológica. La transducción es la conversión de energía física (estímulos dolorosos) en actividad eléctrica en el nociceptor periférico. La transmisión es la propagación de impulsos nerviosos por el sistema nervioso. La modulación ocurre a través de los sistemas analgésicos descendentes endógenos, que modifican la transmisión nociceptiva. Estos sistemas endógenos (opioide, serotoninérgico y noradrenérgico) modulan la nocicepción mediante inhibición de las células del asta dorsal. La percepción es el proceso final que resulta de transducción, transmisión y modulación exitosas, y la integración de las funciones talamocortical, reticular y límbica para producir la experiencia dolorosa subjetiva y emocional consciente. La transducción puede abolirse en gran medida mediante el uso de anestésicos locales infiltrados en el sitio de lesión o incisión, o mediante inyección intravenosa, intrapleural postoracotomía o intraperitoneal poslaparotomía. Los antiinflamatorios no esteroideos (AINE) atenúan la transducción al reducir la producción de sustancias algógenas endógenas como las PG en el sitio de lesión. La transmisión puede suprimirse mediante bloqueo anestésico local de nervios periféricos o plexos nerviosos, o con inyección epidural o subaracnoidea. La modulación puede amplificarse mediante inyección subaracnoidea o epidural de opioides, con agonistas adrenérgicos a2, o de ambos modos. La percepción puede embotarse con anestésicos generales o administración sistémica de opioides y agonistas adrenérgicos a2, ya sea solos o combinados con tranquilizantes-sedantes. La analgesia equilibrada o multimodal resulta de la administración de analgésicos combinados y en múltiples sitios para inducir analgesia al modificar más de una parte del proceso nociceptivo. La analgesia multimodal se basa en los efectos aditivos o sinérgicos de dos o más analgésicos que actúan por diferentes mecanismos. Cuando se usa analgesia multimodal, las dosis necesarias de los fármacos individuales suelen reducirse, lo que en teoría reduce el potencial para que un fármaco cualquiera induzca efectos adversos. La analgesia preventiva es la aplicación de técnicas de analgesia equilibrada antes de exponer a los pacientes a estímulos dolorosos (invasión quirúrgica). Al hacerlo, la médula espinal no se expone al bombardeo de impulsos nociceptivos aferentes que inducen los cambios neuroplásicos causantes de la hipersensibilidad. Por consenso, este concepto ha ganado aceptación como el medio más eficaz de controlar el dolor posoperatorio. Existen tres clases principales de analgésicos que se emplean en medicina veterinaria: opioides, AINE y anestésicos locales. Además de estas tres clases farmacológicas tradicionales, otro grupo diverso de fármacos usados para tratar el dolor se conoce de manera colectiva como coadyuvantes de analgésicos. Manual de anestesia y analgesia en. . Opioides Todos los analgésicos opioides guardan relación química con un grupo de compuestos que se han purificado a partir del jugo de una especie particular de amapola: Papaverum somniferum. El extracto no depurado de la amapola se llama opio y contiene de manera natural unos 20 compuestos con actividad farmacológica, incluidos algunos familiares como morfina y codeína. Estos agentes naturales purificados se conocen de manera específica como opiáceos. Además, para uso clínico se han desarrollado numerosos análogos semisintéticos y sintéticos de los opiáceos. La palabra “opioide” se emplea de manera amplia para abarcar todos los fármacos que son derivados químicos de los compuestos purificados del opio y es el término que se utiliza en este capítulo. Los opioides son todavía la piedra angular del tratamiento eficaz del dolor en medicina veterinaria. Son un grupo versátil de fármacos con aplicaciones extensas en el control del dolor en pacientes con traumatismo agudo, sometidos a intervenciones quirúrgicas, con afecciones médicas dolorosas o procesos patológicos, o que sufren dolor crónico que requiere tratamiento de largo plazo. Es bien conocido que los opioides administrados de manera exógena, como la morfina, ejercen sus efectos al interactuar con receptores de opioide específicos y asemejarse a moléculas naturales llamadas péptidos opioides endógenos. Existen tres tipos bien definidos de receptores de opioide, más conocidos por sus designaciones con letras griegas m (mi), d (delta) y k (kappa). Esta terminología habitual se ha modificado por varios años y durante este tiempo se han propuesto varios sistemas alternos para denominarlos, lo que suscita una considerable confusión. Además, se ha caracterizado un cuarto tipo de receptor de opioide, el receptor de nociceptina (también conocido como receptor de orfanina FQ). De acuerdo con las recomendaciones más recientes del Comité de Nomenclatura de la International Union of Pharmacology , las variaciones basadas en letras griegas son aún aceptables. En consecuencia, se considera que son abreviaturas indistintas m o MOP (péptido opioide m); d o DOP (péptido opioide d); k o KOP (péptido opioide k) y NOP (péptido opioide nociceptina). Se han clonado secuencias de DNA complementario (cDNA) distintas para los cuatro tipos de receptores de opioide y al parecer cada tipo posee una distribución singular en encéfalo, médula espinal y periferia. La diversidad de receptores de opioide se amplía de forma adicional por la existencia de varios subtipos de receptores m, d y k. Con base en estudios farmacológicos, se piensa que existen al menos tres subtipos de receptores m, m1, m2 y m3; dos subtipos de receptores d, d1 y d2, y quizá hasta cuatro subtipos de receptores k, k1a, k1b, k2 y k3. El descubrimiento de subtipos de receptores de opioide generó gran entusiasmo entre los investigadores e introdujo la posibilidad de desarrollar agentes terapéuticos específicos de subtipo con perfiles favorables de efectos secundarios. Sin embargo, en el momento actual las implicaciones funcionales de estos subtipos de receptores son todavía inciertas y aún no se identifican secuencias distintas de cDNA que correspondan a estos subtipos. En general, parece ser que el receptor m media la mayor parte de los efectos anelgésicos de relevancia clínica, así como la mayoría de los efectos adversos relacionados con la administración de opioides. Los fármacos que actúan en el receptor d tienden a ser analgésicos deficientes, pero en determinadas circunstancias pueden modificar la antinocicepción mediada por receptores m y mediar la “comunicación cruzada” entre receptores de opioide. El receptor k media la analgesia © Editorial El manual moderno Fotocopiar sin autorización es un delito. 98 Valoración del paciente y. . . 99 © Editorial El manual moderno Fotocopiar sin autorización es un delito. en varios sitios específicos del SNC y la periferia, pero ha sido difícil distinguir los efectos analgésicos mediados por receptores m y k. En contraste con los receptores de opioide comunes, el receptor de nociceptina no media la analgesia por opioides típica, sino que produce efectos antiopioides (pronociceptivos). Debido a la considerable homología estructural entre los tres receptores de opioide que se describen como típicos, es probable que ocurran interacciones significativas entre ellos en diferentes tejidos, y las funciones fisiológicas apenas esbozadas que se atribuyen a cada tipo de receptor aún requieren dilucidación. Ligandos de receptores endógenos Los receptores de opioide ya mencionados son parte de un extenso sistema que incluye un gran número de ligandos llamados péptidos opioides endógenos. Éstos son moléculas pequeñas producidas de manera natural en el SNC y en diversas glándulas de todo el cuerpo, como hipófisis y suprarrenales. Se han identificado tres familias distintas de péptidos opioides endógenos: encefalinas, dinorfinas y endorfina b. Cada una de ellas deriva de un polipéptido precursor distinto: proencefalina, prodinorfina y proopiomelanocortina, respectivamente. Estos péptidos opioides endógenos se expresan a través del SNC y también se ha confirmado su presencia en tejidos periféricos. Existen considerables semejanzas estructurales entre estos tres grupos de péptidos y cada familia posee afinidades variables con los receptores m, d y k. Ninguna de ellas se une de manera exclusiva a un solo receptor de opioide ni tampoco tiene afinidad significativa con el receptor de nociceptina. En la actualidad no se comprenden del todo las funciones fisiológicas de estos péptidos. Al parecer, actúan como neurotransmisores, neuromoduladores y, en algunos casos, neurohormonas. Median algunas formas de analgesia inducida por estrés y también participan en la analgesia inducida por estimulación eléctrica de regiones discretas del encéfalo, como la zona gris periacueductal del mesencéfalo. La nociceptina (también llamada orfanina FQ) es el ligando endógeno del receptor de nociceptina descubierto en fecha más reciente. La nociceptina deriva de la pronociceptina y su secuencia de aminoácidos guarda estrecha relación con la propia de los péptidos opioides endógenos ya señalados. A pesar de esta homología, la unión de la nociceptina es específica para el receptor de nociceptina y en apariencia el péptido no interactúa con receptores m, d o k. Además, los efectos fisiológicos de la nociceptina contrastan claramente con las acciones de los péptidos opioides endógenos habituales, ya que la nociceptina tiene un efecto pronociceptivo preciso. La importancia funcional de la nociceptina y su receptor aún debe dilucidarse, pero los descubrimientos más recientes sobre este nuevo péptido opioide tendrán implicaciones sustanciales en el desarrollo futuro de fármacos terapéuticos. Además de encefalinas, dinorfinas, endorfina b y nociceptina, en fecha reciente se descubrieron otros dos péptidos opioides endógenos llamados endomorfina 1 y endomorfina 2. Estos péptidos son supuestos productos de un precursor aún no identificado y se ha propuesto que son los ligandos endógenos altamente selectivos del receptor m. Las endomorfinas son pequeños tetrapéptidos sin relación estructural con los péptidos opioides endógenos. Su identificación anuncia una nueva era en la investigación del sistema de opioides m, la cual puede contribuir a la comprensión de la neurobiología de los opioides y crear nuevas vías para intervenciones terapéuticas. 100 Manual de anestesia y analgesia en. . Distribución e implicaciones terapéuticas Aunque los estudios a nivel celular y molecular sobre los receptores de opioide y sus ligandos son invaluables para comprender su funcionamiento, es crucial colocar los receptores de opioide en su contexto anatómico y fisiológico para reconocer con precisión el sistema opioide y su importancia para la mitigación del dolor. Desde hace mucho tiempo, un postulado básico de la analgesia con opioides establece que estos fármacos ejercen acción central, y esta comprensión ha moldeado el modo en que tales analgésicos se usan en clínica. Está bien establecido que los efectos analgésicos de los opioides se deben a su capacidad de inhibir de manera directa la transmisión ascendente de información nociceptiva desde el asta dorsal de la médula espinal, y de activar vías inhibitorias que descienden desde el mesencéfalo a través de la parte ventromedial rostral del bulbo raquídeo hasta la médula espinal. Dentro del SNC se han encontrado pruebas de la existencia de RNA mensajero para receptores de opioide m, d y k o la unión de péptidos opioides (o ambas cosas) en sitios supraespinales, como la MGP mesencefálica, la FR mesencefálica, diversos núcleos de la parte ventromedial rostral del bulbo raquídeo, y en regiones del prosencéfalo como el núcleo auditivo, así como en la médula espinal dentro del asta dorsal. Son complejas las interacciones entre grupos de receptores de opioide en diversos sitios espinales y supraespinales, así como © Editorial El manual moderno Fotocopiar sin autorización es un delito. Señalización y mecanismos de la analgesia La unión de un opioide agonista a un receptor de opioide neuronal, al margen de que el agonista sea endógeno o exógeno, ocasiona a menudo varios sucesos que inhiben la activación de la neurona. Los receptores de opioide son parte de una gran superfamilia de receptores unidos a membrana que se acoplan a proteínas G. Por ello guardan relación estructural y funcional con receptores de muchos otros neurotransmisores y neuropéptidos que modulan la actividad de células nerviosas. La unión a receptores de opioide, a través de la activación de diversos tipos de proteínas G, puede inhibir la actividad de adenililciclasa (monofosfato de adenosina cíclico), activar corrientes de iones potasio (K+) operadas por receptor, y suprimir corrientes de iones calcio (Ca2+) controladas por voltaje. En el plano presináptico, la disminución de la entrada (influjo) de Ca2+ reduce la liberación de sustancias transmisoras, como la sustancia P, desde fibras aferentes primarias en el asta dorsal de la médula espinal, con lo cual se inhibe la transmisión sináptica de señales aferentes nociceptivas. En sentido postsináptico, el aumento de la salida de K+ da lugar a la hiperpolarización de neuronas de proyección de la médula espinal e inhibe vías nociceptivas ascendentes. Un posible tercer modo de acción de los opioides implica la regulación a la alza de vías antinociceptivas descendentes supraespinales en la MGP. Ahora se sabe que este sistema está sujeto a inhibición tónica mediada por neuronas GABAérgicas, y se ha demostrado que la activación de receptores de opioide suprime esta influencia inhibitoria y amplifica la transmisión antinociceptiva descendente. La base celular propuesta para ello implica receptores m que activan a iones K+ dependientes de voltaje presentes en terminales nerviosas GABAérgicas presinápticas, las cuales inhiben la liberación de GABA en la hendidura sináptica. Es importante hacer notar que si bien la comprensión global de la señalización mediada por receptores de opioide ha aumentado en grado impresionante en los últimos años, la relación de tales sucesos subcelulares con la analgesia clínica en el organismo aún requiere mayor dilucidación. Valoración del paciente y. . . 101 © Editorial El manual moderno Fotocopiar sin autorización es un delito. las interacciones entre diferentes tipos de receptores en un sitio particular, y su comprensión es incompleta en el momento actual. La administración sistémica de analgésicos opioides mediante inyección intravenosa, intramuscular o subcutánea induce un inicio de acción relativamente rápido por interacción con estos receptores del SNC. La administración oral, transdérmica, rectal o en la mucosa bucal de opioides produce una absorción sistémica variable, de acuerdo con las características del agente específico; los efectos analgésicos son mediados en gran medida por los mismos receptores presentes en el SNC. Además, resulta eficaz la administración neuraxial, ya sea en el espacio subaracnoideo o el epidural. Las dosis pequeñas de opioides por estas vías penetran con facilidad en la médula espinal e interactúan con receptores de opioide espinales, supraespinales o ambos para producir analgesia profunda y potencialmente prolongada, cuyas características dependen del fármaco específico usado. Aunque desde hace mucho los opioides se han considerado el prototipo de los analgésicos de acción central, ha surgido un cuerpo de evidencia el cual indica con claridad que los opioides pueden inducir analgesia potente y mensurable en clínica mediante la activación de receptores de opioide en el sistema nervioso periférico. Se han identificado receptores de opioide de los tres tipos principales en los procesos de neuronas sensitivas, y estos receptores reaccionan a opioides aplicados en la periferia y a péptidos opioides endógenos liberados localmente cuando se regulan de forma ascendente durante estados de dolor inflamatorio. Además, aunque también se ha demostrado que neuronas simpáticas y células inmunitarias expresan receptores de opioide, aún es incierta su función. Si bien las características de unión de receptores de opioide periféricos y centrales son similares, al parecer la masa molecular de receptores de opioide m periféricos y centrales difiere, lo cual sugiere que podrían desarrollarse ligandos selectivos para estos receptores periféricos que produjeran analgesia opioide sin el potencial de inducir efectos adversos de mediación central. Efectos adversos Aunque los opioides se emplean en clínica sobre todo por su capacidad para aliviar el dolor, también producen múltiples efectos en varios aparatos y sistemas. Esto no es sorprendente a la luz de la amplia distribución de los péptidos opioides endógenos y sus receptores en sitios supraespinales, espinales y periféricos. Algunos de estos efectos adversos, como la sedación, pueden clasificarse como deseables o indeseables, según sean las circunstancias clínicas. El siguiente es un breve resumen de estos efectos secundarios principales de los opioides como clase farmacológica. SNC. Existen considerables diferencias entre especies en la respuesta del SNC a los analgésicos opioides, las cuales no pueden atribuirse sólo a variaciones farmacocinéticas. Es común observar depresión del SNC (es decir, sedación) en perros, monos y personas, en tanto que puede inducirse estimulación del SNC (es decir, excitación, actividad motora espontánea o ambas cosas) en gatos, caballos, caprinos, ovinos, cerdos y bovinos después de la administración sistémica de diversos opioides, de forma notable morfina. En la actualidad no son del todo claras las razones de estas diferentes respuestas, pero se presupone que se relacionan con las distintas concentraciones y distribuciones de receptores m, d y k el diversas regiones del encéfalo en estas especies. A pesar de estas diferencias fundamentales, debe recordarse que existen numerosos factores que pueden afectar la respuesta del SNC a los opioides en una especie dada, como temperamento o condición del paciente; presencia o ausencia de dolor; dosis, vía y momento de la administración; y el opioide específico administrado. El sistema termorregulador hipotalámico también se modifica con la administración de opioides. La respuesta más común tiende a ser la hipotermia, en particular cuando se usan opioides durante el periodo perioperatorio en presencia de otros fármacos depresores del SNC. Sin embargo, en algunas circunstancias clínicas, el suministro de opioides causa hipertermia en gatos. Parte de esta elevación de la temperatura corporal puede atribuirse a un aumento de la actividad muscular vinculado con excitación del SNC en esta especie; empero, también se ha referido un mecanismo hipotalámico central específico, aunque sigue sin comprenderse del todo. Es común observar jadeo después de la administración de opioides, más a menudo en perros, pero este efecto tiende a disminuir con el inicio de la hipotermia. La náusea y el vómito que acompañan a la administración de opioides se deben a la estimulación directa de la zona activadora de los quimiorreceptores para el vómito localizada en el área postrema del bulbo raquídeo. Como en el caso de los otros efectos secundarios de mediación central, la especie influye para determinar la tendencia de un individuo a vomitar después de recibir un opioide. Es posible que los gatos vomiten, pero las más de las veces lo hacen a dosis mayores de las que estimularían el vómito en perros. Éstos suelen vomitar después de la administración de opioides, en especial morfina. La emesis es rara cuando los opioides se administran en el posoperatorio inmediato o en cualquier paciente que pueda experimentar algún grado de dolor. Los opioides tienen eficacia variable para deprimir el reflejo tusígeno, debido al menos en parte a un efecto directo en el centro de la tos localizado en el bulbo raquídeo. Determinados opioides son antitusígenos más eficaces que otros y en ocasiones se prescriben fármacos como codeína, hidrocodona y butorfanol de manera específica para esta indicación. Como regla general, los opioides tienden a causar midriasis en aquellas especies que desarrollan excitación del SNC, y miosis en las que experimentan sedación después de recibir opioides. La miosis se produce por un efecto excitatorio de los opioides en la activación neuronal en el núcleo oculomotor. En gatos, y al parecer en otras especies que sufren midriasis, este aumento de la actividad en el complejo nuclear oculomotor también ocurre, pero el efecto miótico es ocultado por una mayor liberación de catecolaminas, que produce midriasis. Aparato respiratorio. Los opioides producen depresión de la ventilación dependiente de la dosis, mediada en especial por receptores m2, lo cual genera un efecto depresor directo en los centros respiratorios del tallo encefálico. Este efecto se caracteriza por decremento de la reactividad de dichos centros al dióxido de carbono y se refleja en una mayor presión parcial arterial en reposo del dióxido de carbono y desplazamiento a la derecha de la curva de respuesta al CO2. Este efecto se complica con la coadministración de agentes sedantes, anestésicos o ambos, lo cual implica que es mucho más probable que ocurran depresión respiratoria significativa e hipercapnia en pacientes anestesiados que reciben opioides que en los que están conscientes. Debe hacerse notar que, en general, el ser humano tiende a ser más sensible a los efectos depresores respiratorios de los opioides en comparación con la mayoría de las especies veterinarias, y el riesgo de hipoven- © Editorial El manual moderno Fotocopiar sin autorización es un delito. 102 Manual de anestesia y analgesia en. . Valoración del paciente y. . . 103 tilación rara vez constituiría una causa legítima para declinar el tratamiento con opioides en la práctica clínica; sin embargo, es prudente la vigilancia cuidadosa del sujeto. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Aparato cardiovascular. La mayor parte de los opioides tiene efectos mínimos en gasto y ritmo cardiacos y presión arterial cuando se administran en dosis analgésicas con acción clínica. La estimulación vagal del bulbo raquídeo inducida por opioides puede causar bradicardia, que reacciona con facilidad al tratamiento anticolinérgico. Opioides específicos (morfina y meperidina) pueden producir liberación de histamina, en especial después de la administración intravenosa rápida, con el resultado de vasodilatación e hipotensión. Debido a los efectos relativamente benignos en el funcionamiento cardiovascular, los opioides son casi siempre la base de los protocolos de anestesia para pacientes con enfermedad cardiovascular preexistente. Aparato digestivo. Los efectos gastrointestinales de los opioides tienen la mediación de receptores m y d localizados en el plexo mientérico del tubo digestivo. La administración de opioides estimula con frecuencia la defecación en perros, y menos a menudo en gatos. Después de esta respuesta inicial, el espasmo del músculo liso gastrointestinal predispone a los pacientes a íleo y estreñimiento. Estos efectos secundarios tienden a ser más significativos con la administración prolongada de opioides en perros y gatos que experimentan dolor crónico; estos pacientes pueden requerir modificaciones de la alimentación y ablandadores de heces para tratar los efectos adversos. Se ha demostrado que en el ser humano los opioides (sobre todo fentanilo y morfina) elevan la presión en las vías biliares por constricción del esfínter de Oddi. Sin embargo, la incidencia de este efecto secundario en personas es muy baja. A pesar de las diferencias anatómicas, esta observación ha suscitado inquietud acerca de la administración de opioides a perros y gatos con pancreatitis, colangitis o ambas. En un estudio en que se revisó la bibliografía sobre el ser humano se encontró que, pese a la práctica clínica generalizada, no hay pruebas que indiquen que la morfina esté contraindicada en la pancreatitis aguda. Dado que no hay estudios en que se evalúen de manera específica los efectos de los opioides en perros y gatos con pancreatitis, en el momento actual no parece apropiado privar de esta clase de fármacos a dicho subgrupo de pacientes con dolor intenso. Aparato genitourinario. Los opioides, en particular cuando se administran por vía neuraxial, pueden causar retención urinaria por supresión dependiente de la dosis de la contractilidad del detrusor y decremento de la sensación de orinar. Tal vez se requieran expresión manual de la vejiga urinaria o sonda en determinados individuos hasta que se recupere el funcionamiento urodinámico normal. El volumen urinario también puede verse afectado por los opioides y al parecer el mecanismo de este efecto es multifactorial. Los agonistas m tienden a causar oliguria en el ambiente clínico y esto se debe en parte a una mayor liberación de vasopresina (hormona antidiurética), que altera el funcionamiento de los túbulos renales. Es posible que las elevaciones del péptido natriurético auricular plasmático circulante también participen en la antidiuresis inducida por morfina. A la inversa, los agonistas k tienden a inducir un efecto diurético, tal vez al inhibir la secreción de vasopresina. Otros mecanismos periféricos que implican estimulación de receptores a2-adrenérgicos renales también pueden contribuir a este efecto agonista k. 104 Manual de anestesia y analgesia en. . Agonistas Casi todos los opioides con utilidad clínica ejercen sus efectos analgésicos al actuar como agonistas en receptores m. Aunque unos cuantos opioides actúan como agonistas k, estos fármacos también tienden a presentar efectos antagonistas o agonistas parciales en receptores m o d, o ambos, y por tanto no se clasifican como agonistas puros. Los agonistas puros o completos de opioides pueden inducir la activación máxima del receptor cuando se unen a él, y los subsecuentes procesos descendentes producen un efecto analgésico máximo (figura 3-3). En clínica, los agonistas m completos son analgésicos superiores y son los fármacos de elección para el dolor moderado a intenso en muchas especies veterinarias (véanse las dosis recomendadas en el cuadro 3-1). Morfina. La morfina es el analgésico opioide prototípico y actúa como agonista completo no sólo en los receptores m, sino también en los d y k. A pesar del desarrollo de numerosos opioides Opioide agonista (morfina) μ κ μ κ Agonista Log dosis → aumenta Figura 3-3. Se emplea una analogía de cerradura y llave para ilustrar las interacciones de un fármaco agonista completo con receptores de opioide; se muestra una curva de dosis–respuesta relativa de eficacia analgésica. Un opioide agonista completo (en este ejemplo morfina) estimula tanto los receptores μ como los κ, lo cual induce un mayor efecto analgésico al aumentar la dosis. Fuente: Modificado a partir de Nicholson A., Christie M. 2002. Opioid analgesics. In: Small Animal Clinical Pharmacology . J. Maddison, S. Page, and D.B. Church, eds. Philadelphia, PA: WB Saunders, pp. 271–292. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Analgesia → aumenta Ambos receptores activados → efectos de opioide © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 105 sintéticos, muchos de los cuales son más potentes que la morfina y tienen otras características que los hacen alternativas deseables a ésta en determinadas circunstancias, no se ha demostrado que ningún otro fármaco sea más eficaz que la morfina para aliviar el dolor. Comparada con los opioides agonistas sintéticos, la morfina es relativamente hidrófila y cruza la barrera hematoencefálica con mayor lentitud que fentanilo u oximorfona, con lo que demora un tanto el efecto máximo incluso después de la administración intravenosa. En clínica no es probable que esta demora sea significativa en la mayoría de las circunstancias, y el inicio de la analgesia ocurre en un lapso razonablemente rápido después de una sola dosis de morfina y suele durar 3 a 4 h. La baja liposolubilidad de la morfina significa que puede inducir analgesia prolongada cuando se administra en el espacio epidural o el subaracnoideo, con efectos que persisten por 12 a 24 h. El efecto de primer paso es significativo después de la administración oral y la biodisponibilidad de preparados orales de morfina sólo es del orden de 25%. Si se hacen ajustes posológicos, se obtiene alivio adecuado del dolor con el uso de morfina oral y la duración del efecto tiende a ser un tanto mayor por esta vía. En la mayoría de las especies, la principal vía metabólica para la morfina implica la conjugación con ácido glucurónico, lo que conduce a la formación de dos metabolitos principales: 6-glucurónido de morfina y 3-glucurónido de morfina. Pese a las bajas concentraciones de glucuroniltransferasa en gatos, la farmacocinética de la morfina en esta especie parece ser en general comparable a la de perros y personas, aunque las velocidades de depuración pueden ser marginalmente más bajas. Esto sugiere que la morfina debe experimentar un tipo distinto de reacción de conjugación en esta especie. El 6-glucurónido de morfina tiene actividades farmacológicas indistinguibles de las propias de la morfina en modelos animales y en personas, mientras que el 3-glucurónido de morfina tiene al parecer escasa afinidad por los receptores de opioide, pero puede contribuir a los efectos excitatorios de la morfina en algunas situaciones. Con la administración crónica de morfina es probable que el metabolito activo, 6-glucurónido de morfina, contribuya en grado significativo a la analgesia clínica. Los efectos adversos de la administración de morfina son típicos de la mayor parte de los opioides agonistas y ya se expusieron en este capítulo. En particular, la mayor incidencia de vómito después de administrar morfina, así como su potencial para precipitar la liberación de histamina después del uso intravenoso, ayudan a distinguir la morfina de otros opioides agonistas completos. En clínica, la morfina es un analgésico útil en perros y gatos. A menudo se administra a intervalos de dosificación fijos por las vías intramuscular, subcutánea o, menos a menudo, intravenosa para tratar el dolor relacionado con diversas lesiones traumáticas y procesos patológicos. La morfina también se ha usado de manera extensa en todo el periodo perioperatorio en estas especies contra el dolor quirúrgico. En perros y gatos, el efecto de la morfina de reducir la necesidad de anestésico inyectable o inhalable puede ser significativo. La morfina tiene especial eficacia en perros por vía intravenosa como infusión continua, lo cual facilita un ajuste más preciso de la dosis para lograr efectos analgésicos óptimos. En la actualidad se utilizan infusiones subcutáneas de morfina y otros opioides en personas con dolor por cáncer y, dado que están en desarrollo dispositivos de infusión subcutánea aplicables a perros y gatos, es posible que esta vía de administración esté al alcance de los veterinarios en el futuro. La administración del fármaco en el espacio epidural o, menos a menudo, el subaracnoideo, es una técnica analgésica común que se emplea tanto en © Editorial El manual moderno Fotocopiar sin autorización es un delito. Intervalos de dosificación (miligramos por kilogramo) de opioides agonistas en varias especies domésticas Perros Gatos Caballos Bovinos Porcinos 0.3 a 2.0 IM, SC 0.05 a 0.2 IM, SC 0.1 a 0.3 IM, SC ¿? 0.5 a 2.0 (¿?) IM, SC 0.1 a 0.5 IV 0.1 a 0.2 epidurala 0.1 a 0.2 epidurala 0.1 a 0.3/h IV IRC 0.1 a 0.2 epidurala 1.5 a 3 VOb Oximorfona 0.05 a 0.2 IV, IM, SC 0.05 a 0.1 IV, IM, SC 0.01 a 0.03 IV, IM, SC NR 0.05 a 0.2 (¿?) IM, SC Hidromorfona 0.05 a 0.2 IV, IM, SC 0.05 a 0.1 IV, IM, SC 0.01 a 0.03 IV, IM, SC NR 0.05 a 0.2 (¿?) IM, SC Meperidina 3 a 5 IM, SC 3 a 5 IM, SC 1 a 3 IM, SC 3 a 4 (¿?) IM, SC 1 a 2 (¿?) IM, SC 0.2 a 1.0 IV Fentanilo 0.002 a 0.01 IV 0.001 a 0.005 IV 0.001 a 0.002/h transdér- 0.001 a 0.002/h trans- NR micad dérmicad 0.002 a 0.03c/h IV IRC 0.002 a 0.03c/h IV IRC 0.001 a 0.005/h epidurala 0.001 a 0.005/h epiduraIRC la IRC 0.002 a 0.005/h transdér- 0.002 a 0.005/h transmicad dérmicad Alfentanilo ¿? ¿? NR NR ¿? Sufentanilo 0.001 a 0.005 IV dosis de ¿? NR NR ¿? carga 0.001 a 0.01c/h IV IRC Remifentanilo 0.004 a 0.01 IV dosis de ¿? NR NR ¿? carga 0.004 a 0.06c/h IV IRC Metadona 0.05 a 0.2 VO, IM, SC 0.05 a 0.2 VO, IM, SC NR NR NR Codeína 1 a 2 VO 0.1 a 1.0 VO NR NR NR Oxicodona 0.1 a 0.3 (¿?) VO ¿? NR NR NR Hidrocodona 0.5 mg/kg VO c/8 a 12 h ¿? NR NR NR a Se recomiendan formulaciones sin conservador para administración epidural. b Las dosis son de productos de liberación sostenida (MS Contin®, Purdue Pharma L. P., Stamford, CT), que deben administrarse cada 12 h. c Son apropiados ritmos de infusión IV para la mayoría de los tipos de dolor, mientras que los ritmos mayores producen analgesia profunda adecuada para cirugía. d Los parches transdérmicos de fentanilo están disponibles en dosis de 0.025, 0.05, 0.075 y 0.1 mg/h. IRC, infusión a ritmo continuo; IM, intramuscular; IV, intravenosa; NR, no se recomienda su administración en esta especie; VO, vía oral; SC, subcutánea; ¿?, no se han establecido dosis confiables para esta especie. Fuente: Lamont L.A., Mathews K.A. 2007. Opioids, nonsteroidal anti-inflammatories, and analgesic adjuvants. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia , 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 245. Cuadro 3-1. Opioide Morfina 106 Manual de anestesia y analgesia en. . Valoración del paciente y. . . 107 perros como en gatos en diversas situaciones clínicas. En fechas más recientes, el descubrimiento de receptores de opioides m periféricos ha llevado a la práctica clínica de instilar morfina local en articulaciones inflamadas e incluso de manera tópica en córneas dañadas para complementar la analgesia en pacientes caninos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Oximorfona. La oximorfona es un opioide sintético que actúa como agonista completo en receptores m y es comparable a la morfina en su eficacia analgésica y duración de efecto. Es más liposoluble que la morfina y se absorbe con facilidad después de la administración intramuscular o subcutánea. No está disponible en formulación oral. Comparada con la morfina, la oximorfona tiene menor probabilidad de inducir vómito en perros y gatos y tiende a producir más sedación cuando se administra a estas especies. Sus efectos depresores respiratorios son similares a los inducidos por la morfina, pero al parecer la oximorfona posee mayor probabilidad de causar jadeo en perros. No provoca la liberación de histamina, incluso si se administra por vía intravenosa. Otros efectos secundarios de la oximorfona son típicos de otros opioides agonistas m completos y ya se describieron. La oximorfona se ha usado de forma extensa en perros y gatos, y se administra más a menudo a intervalos de dosificación fijos, por las vías intramuscular, subcutánea o intravenosa, para controlar el dolor en diversos contextos clínicos. También es de uso común en los periodos preanestésico, intraoperatorio y posoperatorio en pacientes quirúrgicos. La oximorfona se ha administrado por vía epidural en perros, pero su liposolubilidad relativa significa que sus efectos analgésicos son más breves cuando se administra por esta vía que en el caso de la morfina. Hidromorfona. La hidromorfona es un opioide sintético que actúa como agonista completo en los receptores m y se emplea en seres humanos y animales. En clínica, hidromorfona y oximorfona tienen eficacia, potencia, duración del efecto analgésico y perfil de efectos secundarios similares, pero la hidromorfona aún es significativamente menos costosa. Como la oximorfona, la hidromorfona no se vincula con liberación de histamina, de tal modo que la administración intravenosa en bolo se considera segura, aunque puede causar excitación y vocalización breves. En perros y gatos, la hidromorfona puede usarse en cualquier situación clínica en que se emplee oximorfona. Los resultados notificados en la bibliografía para el ser humano sugieren que la hidromorfona es casi siempre adecuada para la administración por infusión continua, por las vías intravenosa, subcutánea o epidural, y estas vías de administración pueden ampliar aún más el uso de la hidromorfona en pacientes veterinarios en el futuro. Meperidina. La meperidina es un opioide sintético que ejerce sus efectos analgésicos por agonismo en receptores m. Resulta interesante el hecho de que también es al parecer capaz de unirse a otros tipos de receptores, lo cual puede contribuir a algunos de sus efectos clínicos, además de la analgesia. La meperidina puede bloquear los conductos de sodio e inhibir la actividad en neuronas del asta dorsal de manera análoga a como lo hacen los anestésicos locales. También ejerce actividad agonista en receptores a2, de manera específica del subtipo a2B, lo cual sugiere que podría poseer algunas propiedades de tipo agonista a2. La meperidina tiene acción analgésica más breve que morfina, oximorfona o hidromorfona y casi nunca se extiende más de 1 h. Las vías metabólicas varían entre diferentes especies, pero en general la mayor parte del fármaco se desmetila hasta normeperidina en el hígado y luego sufre ulterior hidrólisis y al final excreción renal. La normeperidina es un metabolito activo y tiene alrededor de la mitad de la eficacia analgésica de la meperidina. La normeperidina ha producido efectos secundarios neurotóxicos en pacientes humanos que reciben meperidina por periodos prolongados, en particular en presencia de disfunción renal. A diferencia de la mayoría de los otros opioides en uso clínico, se ha demostrado que la meperidina produce efectos inotrópicos negativos significativos cuando se administra sola a perros conscientes. Debido a sus modestos efectos atropínicos, la meperidina tiende a elevar la frecuencia cardiaca más que predisponer a los pacientes a la bradicardia, como se observa a menudo con otros opioides. Nunca se han dilucidado con claridad las implicaciones clínicas de estos efectos cardiovasculares en el periodo perianestésico. Al igual que la morfina, la meperidina también da lugar a la liberación de histamina cuando se administra por vía intravenosa. Una interacción medicamentosa rara, pero potencialmente letal, que podría tener relevancia en medicina veterinaria se ha informado en pacientes humanos que reciben meperidina. La combinación de meperidina (y quizás otros opioides) con un inhibidor de la monoaminooxidasa podría precipitar el síndrome de serotonina, que se caracteriza por una constelación de signos y síntomas, incluidos confusión, fiebre, escalofrío, diaforesis, ataxia, hiperreflexia, mioclono y diarrea. Un inhibidor de la monoaminooxidasa, la selegilina, se ha usado en pacientes caninos para tratar el hipercorticalismo dependiente de hipófisis o modificar la conducta en caso de disfunción cognitiva. Aunque hasta la fecha no se han realizado estudios científicos sobre interacciones adversas entre meperidina y selegilina en perros, los veterinarios deben tener presente la posibilidad de complicaciones si se requiere analgesia en pacientes que reciben inhibidores de la monoaminooxidasa. En un estudio reciente en el que se evaluaron los efectos de otros opioides (oximorfona y butorfanol) en perros tratados con selegilina no se identificaron interacciones medicamentosas adversas específicas en estos animales. En clínica, la meperidina se ha empleado en mayor medida en perros y gatos durante el periodo preanestésico, a menudo en combinación con sedantes o tranquilizantes. En pacientes sometidos a operación se recomienda la administración posoperatoria de otro opioide agonista m completo con efecto más prolongado. Al parecer, en esas especies la meperidina tiene pocas o ninguna ventaja sobre otros opioides, como oximorfona o hidromorfona, durante el periodo perioperatorio. Fentanilo. El fentanilo es un opioide agonista m sintético de acción breve altamente liposoluble. Una sola dosis de fentanilo administrada por vía intravenosa tiene inicio más rápido y acción mucho más breve que la morfina. Los efectos analgésicos máximos ocurren en unos 5 min y duran alrededor de 30 min. La redistribución rápida del fármaco a sitios tisulares inactivos, como grasa y músculo esquelético, ocasiona un decremento de la concentración plasmática y es causante de la cesación rápida de los efectos clínicos. En la mayoría de las especies veterinarias, la semivida de eliminación después de un bolo único o una infusión breve se encuentra en el intervalo de 2 a 3 h. La administración de dosis muy grandes o de infusiones prolongadas puede causar la saturación de tejidos inactivos, en cuyo caso la terminación de los efectos clínicos se © Editorial El manual moderno Fotocopiar sin autorización es un delito. 108 Manual de anestesia y analgesia en. . © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 109 hace dependiente del metabolismo hepático y la excreción renal. En consecuencia, la semivida sensible al contexto del fentanilo aumenta en grado significativo con la duración de la infusión, y los efectos clínicos pueden persistir por un lapso prolongado después de que termina una infusión intravenosa a largo plazo. Los efectos adversos de la administración de fentanilo son similares a los que se observan con los otros opioides agonistas m completos. En general, la estabilidad cardiovascular es excelente con fentanilo y la administración intravenosa no se vincula con liberación de histamina. La bradicardia puede ser significativa si se usan bolos, pero reacciona con facilidad a los anticolinérgicos si se requiere el tratamiento. En personas se ha identificado rigidez muscular, en especial de la pared torácica, después de la administración de fentanilo o uno de sus congéneres. Por el momento no son claras las implicaciones potenciales de este efecto adverso en animales y el riesgo se considera mínimo si se evitan las dosis grandes en bolos rápidos. En clínica, el fentanilo se usa con mayor frecuencia en perros y gatos, pero también es un analgésico potencialmente útil en otras especies. Debido a su acción más corta, se administra casi siempre en infusión continua con fines analgésicos. El fentanilo intravenoso puede infundirse en dosis relativamente bajas para complementar la analgesia intraoperatoria o posoperatoria (o ambas) en perros y gatos. También puede ser útil para el tratamiento del dolor, como el de la pancreatitis. De manera alternativa, pueden administrarse dosis mayores, muchas veces en combinación con una benzodiazepina como midazolam, para inducir anestesia general en perros con inestabilidad cardiovascular o hemodinámica. De modo similar, pueden usarse mayores ritmos de infusión de fentanilo como anestésico principal para el mantenimiento quirúrgico en pacientes que no tolerarían concentraciones significativas de anestésicos inhalables volátiles. Además de la administración intravenosa, el fentanilo puede depositarse en el espacio epidural para producir analgesia. Debido a su elevada liposolubilidad, el fentanilo epidural, a diferencia de la morfina, se absorbe con rapidez en la circulación sistémica. En consecuencia, los efectos clínicos de un bolo único de fentanilo epidural se asemejan a los de una inyección intravenosa. Sin embargo, pueden lograrse los beneficios de la administración neuraxial al administrar el fentanilo epidural como una infusión continua a través de una sonda epidural a permanencia, a menudo en combinación con otros analgésicos. Por lo general, esta técnica se emplea en perros para el tratamiento del dolor agudo intenso, pero puede tener más aplicaciones en el tratamiento del dolor crónico también. El desarrollo de vías novedosas menos traumáticas de administración de opioides en seres humanos condujo a la comercialización de parches transdérmicos de fentanilo, diseñados para liberar una cantidad constante de fentanilo por hora que se absorbe por la piel y es captada de manera sistémica. Los parches de fentanilo están diseñados para la piel y la temperatura corporal humanas, pero se ha evaluado su uso en varias especies veterinarias. Aunque el fentanilo transdérmico parece ser un medio eficaz para inducir analgesia en varias situaciones clínicas, se han documentado variaciones sustanciales en las concentraciones plasmáticas del fármaco, y es común que ocurran retrasos significativos después de la colocación del parche hasta el inicio de la analgesia. Además, se ha demostrado que los cambios en la temperatura corporal afectan en grado significativo la absorción de fentanilo en gatos anestesiados, y es probable que otros factores vinculados con la preparación de la piel y la colocación del parche modifiquen en grado sustancial las concentraciones plasmáticas del fentanilo y la eficacia analgésica. Dos estudios recientes en 110 Manual de anestesia y analgesia en. . los que se evaluó la eficacia del suministro de fentanilo por gel orgánico de lecitina plurónica (gel OLP) a través de la piel en perros y gatos concluyeron que este método de administración no produce concentraciones plasmáticas mensurables y por tanto no es un medio eficaz para la administración sistémica. Metadona. La metadona es un opioide agonista m sintético con propiedades farmacológicas cualitativamente similares a las de la morfina, pero que posee afinidad adicional por receptores de NMDA. Entre las características clínicas únicas de la metadona se encuentran excelente absorción por la vía oral, ausencia de metabolitos activos conocidos, alta potencia y larga duración de sus efectos. En seres humanos se ha usado sobre todo para tratar los síndromes de supresión de opioides, pero se emplea cada vez más para el tratamiento del dolor crónico y agudo. Aunque la metadona sufre metabolismo por CYP 450 en perros y existe el potencial de interacciones medicamentosas, hasta el momento sólo se ha demostrado que el cloranfenicol demora en grado significativo la biotransformación de la metadona en perros. Estudios ulteriores podrían identificar una función de la metadona oral en el tratamiento del síndrome de dolor agudo y crónico en pacientes veterinarios. Codeína. La codeína es el resultado de la sustitución de un grupo metilo en la morfina, lo cual limita el metabolismo hepático de primer paso y explica la mayor biodisponibilidad oral de la codeína. Ésta es bien conocida por sus excelentes propiedades antitusígenas y muchas veces se combina en una formulación oral con un analgésico no opioide, como el paracetamol, para el tratamiento del dolor leve a moderado en seres humanos. La codeína, sola o combinada con pa- © Editorial El manual moderno Fotocopiar sin autorización es un delito. Alfentanilo, sufentanilo y remifentanilo. Alfentanilo, sufentanilo y remifentanilo son análogos estructurales del fentanilo que se desarrollaron para su uso en seres humanos en un esfuerzo por crear analgésicos con inicio de acción más rápido y terminación predecible de los efectos opioides. Los tres son similares en inicio de acción, y tienen semividas sensibles al contexto más breves que la del fentanilo después de infusión prolongada. El remifentanilo es único entre los opioides en que se metaboliza por esterasas plasmáticas inespecíficas hasta metabolitos inactivos. Por consiguiente, la disfunción hepática o renal tiene escaso efecto en la depuración del fármaco y esto, en combinación con la naturaleza robusta del sistema metabólico de las esterasas, contribuye a la predectibilidad de la infusión de remifentanilo. Estos tres fármacos se usan durante la anestesia general para intervenciones que requieren analgesia intensa, atenuación de la respuesta del sistema nervioso simpático a la estimulación dolorosa, o ambas cosas. Aún son limitadas sus aplicaciones en el control del dolor posoperatorio o crónico. Como el fentanilo, pueden administrarse a ritmos de infusión relativamente bajos como coadyuvantes en protocolos de anestesia general basados en anestésicos inhalables volátiles o inyectables, o a ritmos mayores como agentes principales para la anestesia intravenosa total. Las propiedades de ahorro de concentración alveolar mínima de estos agentes se han demostrado en perros y gatos. Existen pocas pruebas que sugieran que cualquiera de los análogos del fentanilo tenga ventajas sobre la morfina cuando se administra en el espacio epidural con fines analgésicos. Valoración del paciente y. . . 111 racetamol (Tylenol 3®, Ortho-McNeil Pharmaceuticals, Titusville, NJ), se ha usado para el dolor leve en perros no hospitalizados. Las combinaciones con paracetamol no deben prescribirse a gatos debido a los posibles efectos tóxicos de éste. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Oxicodona e hidrocodona. Son opioides que suelen administrarse por vía oral para el tratamiento del dolor en seres humanos. Aunque la oxicodona se encuentra disponible en una formulación de liberación continua de fármaco único (Oxycontin®, Purdue Pharma L.P., Stamford, CT), estos medicamentos más a menudo se formulan en combinación con analgésicos no opioides, como ácido acetilsalicílico y paracetamol (p. ej., Percocet®, Endo Pharmaceuticals, Chadds Ford, PA; Percodan®, Endo Pharmaceuticals; y Vicodin®, Abbott Laboratories, Abbott Park, IL). Es poco lo que se ha publicado acerca del uso de estos opioides en pacientes veterinarios. Agonistas-antagonistas y agonistas parciales Este grupo incluye a fármacos con perfiles variables de unión a receptor de opioide, pero que comparten una característica: Todos ocupan receptores de opioide m, pero no inician una respuesta clínica máxima. Fármacos como butorfanol y nalbufina se clasifican como agonistas-antagonistas. Son antagonistas competitivos de receptores m, pero ejercen sus efectos analgésicos al actuar como agonistas en los receptores k (figura 3-4). La buprenorfina, por otra parte, se clasifica como agonista parcial y se une a receptores m, pero tiene efecto clínico limitado (figura 3-5). Estos fármacos agonistas-antagonistas mixtos se desarrollaron para el ser humano en un intento de crear analgésicos que causaran menor depresión respiratoria y tuvieran menor potencial adictivo. Debido a sus afinidades de unión a receptor de opioide, los efectos adversos de estos fármacos presentan el llamado efecto de techo, en el cual dosis mayores de un valor determinado no producen respuestas adversas adicionales. Infortunadamente, los beneficios de este efecto de techo sobre la depresión ventilatoria se obtienen a expensas de la eficacia analgésica limitada y sólo una discreta capacidad de reducir los requerimientos de anestésico. La coadministración de opioides con diferentes perfiles de unión a receptor es en la actualidad un campo de investigación activa que merece más análisis. Las interacciones en estas circunstancias son complejas y al parecer la coadministración de opioides puede producir efectos analgésicos aditivos, sinérgicos o antagónicos, según sean la especie, la dosis, los fármacos y el modelo de dolor evaluado. En la siguiente sección se describen de modo sinóptico los opioides agonistas-antagonistas y agonistas parciales que se encuentran en uso clínico en la actualidad. Butorfanol. El butorfanol es un opioide agonista-antagonista sintético y se ha empleado de manera extensa en una amplia variedad de especies veterinarias. De manera original se clasificó como un antitusígeno en perros, pero en la actualidad sólo está aprobado como analgésico en gatos y caballos. El butorfanol ejerce sus efectos clínicos relevantes al interactuar con receptores k y actúa como antagonista en los receptores m. La duración de los efectos analgésicos del butorfanol es todavía tema de alguna controversia y es probable que varíe con la especie, tipo e intensidad del dolor, dosis y vía de administración. En general, sus efectos son más efímeros que los de la morfina y se encuentran quizá en el intervalo de 1 a 3 h. Por lo regular, el butorfanol se administra por las vías intramuscular, subcutánea o intravenosa, aunque se dispone de una formulación oral que en ocasiones se prescribe para analgesia en perros no hospitalizados. 112 Manual de anestesia y analgesia en. . Agonista–antagonista (butorfanol) μ Agonista μ κ κ Analgesia → aumenta Activación del receptor κ pero ocupación sin acción en el receptor μ Agonista Agonista– antagonista (interacción κ) Agonista + agonista– antagonista (bloqueo de la acción en el receptor μ) Figura 3-4. Se emplea una analogía de cerradura y llave para ilustrar las interacciones medicamentosas agonista–antagonista en receptores de opioide, con una curva de dosis–respuesta relativa de eficacia analgésica. Un opioide agonista–antagonista (en este caso butorfanol) tiene actividad agonista en los receptores κ y actividad antagonista en los receptores μ. En presencia de un agonista μ completo, estos opioides tienden a presentar efectos antagonistas, y elevan la dosis de agonista completo necesaria para lograr el máximo efecto analgésico. Fuente: Modificado a partir de Nicholson A., Christie M. 2002. Opioid analgesics. In: Small Animal Clinical Pharmacology . J. Maddison, S. Page, and D.B. Church, eds. Philadelphia, PA: WB Saunders, pp. 271–292. El butorfanol no induce liberación de histamina cuando se administra por vía intravenosa y tiene efectos mínimos en el funcionamiento cardiopulmonar. Existen datos inconsistentes acerca de los efectos del butorfanol sobre los requerimientos de anestésicos inhalables en perros y gatos. En estudios anteriores no fue posible demostrar un efecto ahorrador significativo sobre la CAM cuando el butorfanol se coadministró con halotano en perros. En fecha más reciente se demostraron reducciones de la CAM de isoflurano después de la administración de dosis clínicas de butorfanol en perros y gatos. Las razones de estas discrepancias tal vez se relacionan con diferencias en las técnicas de estudio y, de manera específica en perros y gatos, el butorfanol puede inducir en apariencia al menos reducciones discretas de los requerimientos de anestésicos inhalables. Cuando se administra como fármaco único a perros y gatos sanos, el butorfanol sólo produce sedación mínima. Sin embargo, el fármaco se emplea casi siempre en combinación con diversos © Editorial El manual moderno Fotocopiar sin autorización es un delito. Log dosis → aumenta Valoración del paciente y. . . 113 Opioide agonista Opioide agonista parcial (buprenorfina) Analgesia → aumenta μ μ κ κ Activación parcial del receptor μ Agonista Agonista parcial Agonista + agonista parcial © Editorial El manual moderno Fotocopiar sin autorización es un delito. Log dosis → aumenta Figura 3-5. Se emplea una analogía de cerradura y llave para ilustrar las interacciones de fármacos agonistas parciales en receptores de opioide; se muestra una curva de dosis–respuesta relativa de eficacia analgésica. Un opioide agonista parcial (en este caso buprenorfina) estimula débilmente a los receptores μ, lo cual produce un efecto analgésico máximo reducido en comparación con un agonista completo. Una dosis grande de agonista parcial interfiere en las acciones de un agonista completo en el receptor, desplazando su curva de dosis–respuesta a la derecha y deprimiendo su efecto analgésico máximo. Fuente: Modificado a partir de Nicholson A., Christie M. 2002. Opioid analgesics. In: Small Animal Clinical Pharmacology. J. Maddison, S. Page, and D.B. Church, eds. Philadelphia, PA: WB Saunders, pp. 271–292. sedantes y tranquilizantes, como acepromazina, dexmedetomidina o midazolam, a fin de inducir sedación y analgesia para intervenciones con penetración corporal mínima. También se usa durante los periodos preanestésico y posoperatorio con objeto de proporcionar analgesia para operaciones que producen dolor leve a moderado. Al parecer, el butorfanol no es un monoanalgésico eficaz para el dolor moderado a intenso en estas especies, en particular cuando el dolor es de origen ortopédico. Por lo regular se pensaba que la administración simultánea o secuencial de butorfanol con un opioide agonista m puro, como morfina o hidromorfona, sería contraproducente desde el punto de vista analgésico porque la capacidad del butorfanol de antagonizar los receptores m podría inhibir o incluso revertir los efectos del fármaco agonista. Desde luego, se ha demostrado con claridad que la sedación excesiva relacionada con un agonista m puro puede revertirse en parte con la administración de dosis bajas de butorfanol, y se presupuso que de modo similar el butorfanol 114 Manual de anestesia y analgesia en. . también revertiría los efectos analgésicos mediados por m. En la actualidad parecería que las interacciones potenciales entre butorfanol y opioides agonistas m completos son más complejas de lo que se pensaba al principio. Es probable que los efectos clínicos de tal coadministración dependan de muchos factores, como especie, tipo de dolor, dosis y fármaco específico. Buprenorfina. La buprenorfina es un opioide semisintético altamente lipófilo derivado de la tebaína. A diferencia de otros opioides de esta categoría, la buprenorfina se considera un agonista parcial de receptores de opioide m. El fármaco se une con avidez a los receptores m y se disocia con lentitud de ellos, pero no puede inducir una respuesta clínica máxima. Debido a sus características de unión a receptor, la buprenorfina tiene una demora en el inicio de acción y tarda al menos 1 h en alcanzar su efecto máximo después de la administración intramuscular. También tiene efecto relativamente prolongado, que persiste por 6 a 12 h en la mayoría de las especies. Además, su elevada afinidad por el receptor m significa que puede ser difícil antagonizar sus efectos con un fármaco como la naloxona. La buprenorfina se ha administrado más a menudo por vía intravenosa o intramuscular; sin embargo, debido al largo tiempo que transcurre antes de que se alcancen efectos clínicos después de la administración intramuscular, se prefiere la vía intravenosa. En un estudio reciente se documentaron concentraciones plasmáticas y eficacia analgésica comparables con las propias de la administración transmucosa oral en gatos. Esta vía parece ser bien tolerada por felinos y es cada vez más aceptada en la práctica clínica. En la actualidad existe en el mercado un parche transdérmico de buprenorfina que se encuentra bajo valoración. En perros y gatos, la buprenorfina se utiliza con más frecuencia en el periodo posoperatorio para tratar el dolor leve a moderado. Como en el caso de otros opioides de esta categoría, la buprenorfina puede no ser adecuada para tratar el dolor intenso, como el secundario a toracotomías o intervenciones ortopédicas traumáticas. El fármaco es un analgésico regular en animales de laboratorio porque puede formularse con diversos alimentos y administrarse por vía oral a roedores. Antagonistas Estos fármacos tienen altas afinidades por los receptores de opioide y pueden desplazar opioides agonistas a partir de receptores m y k. Después de este desplazamiento, los antagonistas puros se unen a receptores de opioide y los ocupan, pero no los activan. En circunstancias ordinarias, en pacientes que no han recibido opioides agonistas exógenos, los opioides antagonistas tienen pocos efectos clínicos cuando se administran en dosis clínicas. Es importante reconocer que © Editorial El manual moderno Fotocopiar sin autorización es un delito. Nalbufina y pentazocina. Se clasifican como opioides agonistas-antagonistas y son clínicamente similares al butorfanol. Inducen analgesia leve acompañada de sedación mínima, depresión respiratoria o efectos cardiovasculares adversos. En seres humanos, la nalbufina se usa más a menudo que el butorfanol, mientras que en medicina veterinaria el butorfanol se administra con frecuencia mucho mayor. Como el butorfanol, la nalbufina se emplea en ocasiones para la reversión parcial de los efectos de un opioide agonista m puro al tiempo que se mantiene alguna analgesia residual. Valoración del paciente y. . . 115 estos fármacos revierten con rapidez todos los efectos clínicos inducidos por opioides, incluida la analgesia. Por lo tanto, el uso de opioides antagonistas puros debe reservarse para situaciones de urgencia, como sobredosis de opioide o depresión respiratoria profunda. Su uso sistemático para revertir la sedación excesiva en pacientes con recuperación prolongada tras la anestesia o que presentan bradicardia por la administración de opioide puede causar dolor agudo intenso y activación del sistema nervioso simpático. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Naloxona. El uso de este opioide antagonista puro puede revertir todos los efectos de los opioides agonistas e incrementar el estado de alerta, reactividad, coordinación y tal vez la percepción del dolor. Los efectos de la naloxona son más cortos que los de muchos de los opioides agonistas; las dosis intravenosas recomendadas duran entre 30 y 60 min. En consecuencia, los animales deben vigilarse de cerca en busca de renarcotización después de una dosis de naloxona. En ocasiones se observan excitación o ansiedad después de la reversión con naloxona de un opioide agonista. También se han documentado contracciones ventriculares prematuras después de la reversión, pero no son comunes y al parecer son más probables si hay concentraciones elevadas de catecolaminas circulantes. Este fármaco se administra algunas veces por vía sublingual a neonatos con depresión respiratoria nacidos por operación cesárea después de administrar a la madre un opioide agonista. También se ha demostrado en modelos animales y pacientes humanos que la naloxona produce una mejoría dependiente de la dosis en la contractilidad miocárdica y la presión arterial media durante el choque. Se requieren más estudios para dilucidar la función del sistema opioide endógeno en la fisiopatología de diversas formas de choque. Nalmefeno y naltrexona. Ambos son opioides antagonistas puros con efectos clínicos que duran más o menos el doble que los propios de la naloxona. Aunque son escasas las publicaciones sobre el uso de estos fármacos en pacientes veterinarios, pueden ser ventajosos para prevenir la renarcotización cuando se emplean con la finalidad de antagonizar los efectos de un opioide de efecto prolongado. Antiinflamatorios no esteroideos Los AINE alivian el dolor leve a moderado y la eficacia depende del AINE específico que se administre. Al parecer, los AINE confieren sinergia cuando se usan en combinación con opioides y pueden ejercer un efecto ahorrador de opioide si se requieren dosis menores de opioide. Su efecto prolongado, además de su eficacia analgésica y libertad de alteraciones del SNC (sedación o disforia), hacen a los AINE ideales para tratar el dolor agudo y crónico en pacientes veterinarios. Sin embargo, es crítica la selección cuidadosa de paciente y fármaco debido a los posibles efectos adversos peligrosos. Ciclooxigenasas y síntesis de PG En 1971, Vane descubrió el mecanismo por el cual el ácido acetilsalicílico (AAS) ejerce sus efectos antiinflamatorios, analgésicos y antipiréticos. Demostró que AAS y otros AINE inhibían la actividad de una enzima ciclooxigenasa (COX) que producía PG capaces de intervenir en la patogenia de inflamación, tumefacción, dolor y fiebre. Veinte años después se descubrió una segunda enzima COX y en fechas más recientes la COX-3. La COX (antes llamada PG sintasa) oxida al ácido araquidónico (antes llamado ácido eicosatetraenoico) hasta diversos eicosanoides (incluidos PG y otros compuestos relacionados) (figura 3-6). La oxidación del ácido araquidónico por 5-lipooxigenasa (5-LOX), la oxigenasa de mamífero con mayor importancia biológica, produce la serie de eicosanoides llamados leucotrienos. La liberación de ácido araquidónico desde el fosfolípido de membrana se cataliza por acción de la enzima fosfolipasa A2 y es el paso limitante de la velocidad en la síntesis de PG y leucotrieno. La PGG2 es el prostanoide inicial formado, seguido por PGH2, que sirve como sustrato para PGE sintetasa, PGD isomerasa, PGF reductasa, prostaciclina sintetasa y tromboxano sintetasa en la conversión a una variedad de otros prostanoides ubicuos en las células y los tejidos del organismo. Entre ellos se incluyen las PG llamadas PGE2, PGD2, PGF2 y PGI2 (prostaciclina), y los tromboxanos TXA2 y TXB2, todos con diversas funciones. Las PG no se almacenan, sino que se sintetizan a un ritmo constante. Tienen semividas breves de 4 a 6 min a 37°C y actúan de forma local en el sitio de producción. Las PG producidas por COX-1 y COX-2 son ubicuas en todo el organismo y facilitan muchas funciones fisiológicas en los estados de salud y patológico. En consecuencia, el uso clínico de los AINE puede alterar estas funciones, con la posibilidad de causar disfunción orgánica significativa. Por lo tanto, además de su función como analgésicos, siempre deben considerarse los efectos de los AINE en las funciones constitutivas de las PG. Hay varios puntos clave que deben tomarse en cuenta: 1) COX-1 genera PG que son causantes de la defensa de las mucosas (es decir, secreción de bicarbonato y moco, atenuación de la constricción de mucosas y vasos sanguíneos, y regeneración del epitelio mucoso), así como TXA2, necesario para el funcionamiento plaquetario; 2) COX-2 produce PG que previenen erosiones en las mucosas y promueven su reparación, además de ejercer efectos antiinflamatorios al inhibir la adhesión leucocítica y participar en la protección y maduración renales; y 3) COX-3 produce PG que ejercen una función protectora al iniciar la fiebre. En consecuencia, según sea el AINE seleccionado, se modifican las actividades de formación de un tapón primario de plaquetas, modulación del tono vascular de riñones y mucosa gástrica, funciones citoprotectoras dentro de la mucosa gástrica, contracción de músculo liso y regulación de la temperatura corporal. Sin embargo, en este sentido, no todos los AINE se crean del mismo modo. Como ya se indicó, las enzimas COX-1, COX-2 y COX-3 hacen contribuciones variables a esas funciones y los AINE individuales inhiben cada una de estas enzimas de modo distinto. Algunos AINE inhiben tanto COX-1 como COX-2 (es decir, AAS, fenilbutazona, ketoprofeno, ketorolaco y flunixina meglumina); otros AINE inhiben a COX-2 de forma preferencial, con apenas una inhibición débil de COX-1 (es decir, meloxicam, carprofeno, etodolaco, vedaprofeno y ácido tolfenámico); otros inhiben sólo a COX-2 (es decir, deracoxib, firocoxib y rofecoxib); un fármaco más, el paracetamol, sólo inhibe débilmente tanto a COX-1 como a COX-2 al tiempo que inhibe de manera preferencial la actividad de COX-3. Se han publicado varios estudios in vitro enfocados en la inhibición selectiva de AINE de las isoenzimas COX-1 y COX-2, pero sus resultados son muy difíciles de interpretar debido a inconsistencias en los métodos usados. Desde el punto de vista clínico, esta información es confusa porque no considera la farmacocinética de fármacos específicos y sus concentraciones en diversos tejidos. Se ha demostrado que la mayor parte de los AINE que inhiben a COX desvía al © Editorial El manual moderno Fotocopiar sin autorización es un delito. 116 Manual de anestesia y analgesia en. . Valoración del paciente y. . . 117 ÁCIDO ARAQUIDÓNICO 5-Lipooxigenasa Ciclooxigenasa 5-HPETE HIDROPERÓXIDO DE PROSTAGLANDINA (PGG2) Hidrolasa Tromboxano sintetasa 5-HETE LEUCOTRIENO B4 TROMBOXANO A2 PGH2 Deshidrasa Prostaglandina E sintetasa LEUCOTRIENO A4 Glutatión transpeptidasa LEUCOTRIENO C4 Glutamiltranspeptidasa Prostaciclina sintetasa PGE2 Prostaglandina D-isomerasa PROSTACICLINA Prostaglandina F-reductasa LEUCOTRIENO D4 Cisteinilglicinasa TXB2 PGD2 PGF1 © Editorial El manual moderno Fotocopiar sin autorización es un delito. LEUCOTRIENO E4 Figura 3-6. Cascada del ácido araquidónico y síntesis de eicosanoides. 5-HETE, ácido 5-hidroxi6,8,11,14-eicosatetraenoico; 5-HPETE, ácido 5-hidroperoxi-6,8,11,14-eicosatetraenoico. Fuente: Lamont L.A., Mathews K.A. 2007. Opioids, nonsteroidal anti-inflammatories, and analgesic adjuvants. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia , 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 253. araquidonato hacia la vía 5-LOX. Esta vía se encuentra sobre todo en células polimorfonucleares, mastocitos, monocitos, basófilos y linfocitos B que sufren atracción durante las reacciones inflamatoria e inmunitaria. Esta enzima cataliza el paso inicial en la biosíntesis de leucotrienos, que después produce diversos eicosanoides; el leucotrieno B4 (LTB4) es el mediador potente más notable de la inflamación. La producción excesiva de leucotrienos se ha referido en la creación de úlceras por AINE. Como siempre, no obstante, el sistema biológico no es tajante. Aunque la vía LOX es proinflamatoria, también hay una vía antiinflamatoria, la cual se analiza con más detalle más adelante. La contribución de los leucotrienos al proceso inflamatorio parecería sugerir que la inhibición tanto de la vía COX como de la 5-LOX por un agente terapéutico mejoraría el perfil de 118 Manual de anestesia y analgesia en. . Mecanismos de analgesia Las PG, en especial PGE2 y prostaciclina, son potentes mediadores de inflamación y dolor. Estas moléculas ejercen efectos hiperalgésicos y favorecen la nocicepción producida por otros mediadores, como la bradicinina. El mecanismo de acción analgésico de los AINE implica inhibición de la actividad de COX-1, COX-2 y COX-3, con prevención ulterior de la síntesis de PG. Los efectos antinociceptivos de los AINE se ejercen de forma periférica y central. Los AINE penetran en tejidos inflamados, donde tienen un efecto local; esto los hace excelentes opciones analgésicas para el tratamiento de lesiones con inflamación acompañante, así como de afecciones como sinovitis, artritis, cistitis y dermatitis. La acción central se ejerce a los niveles espinal y supraespinal, con contribuciones de COX-1 y COX-2. Este efecto central puede explicar el bienestar global y la mejoría del apatito que a menudo se observan en pacientes que reciben AINE por vía parenteral para el alivio de dolor agudo. El uso racional de AINE como analgésicos debe basarse en la comprensión de fisiología y fisiopatología. En las vías nociceptivas pueden participar el gen para COX-1 o el que codifica a COX-2, y estos genes se expresan en diferentes sitios y circunstancias. Se sabe que la isoenzima COX-2, conocida como la isoforma inducible porque es regulada de forma ascendente en estados inflamatorios, tiene una función clave en la nocicepción. Aunque se ha considerado casi siempre que el gen para la COX-1 se expresa de manera constitutiva, esta isoenzima también forma parte integral de la experiencia dolorosa. La isoenzima COX-2, o isoforma inducible, puede aumentar 20 veces el valor basal en presencia de lesión tisular e inflamación. Citocinas proinflamatorias y mitógenos, como interleucina 1b (IL-1b), interferón γ y factor de necrosis tumoral a (TNF-a), inducen la expresión de COX-2 en macrófagos, al igual que pueden hacerlo el factor activador plaquetario y la PGE2. Estos sucesos también ocurren en condrocitos, osteoblastos y células sinoviales del endotelio microvascular. El incremento de los valores de COX eleva la producción de prostanoides, que actúan como amplificadores de las señales aferentes nociceptivas y la transmisión tanto en el sistema nervioso periférico como en el central. Se ha demostrado que los AINE selectivos de COX-2 tienen utilidad clínica para el tratamiento del dolor inflamatorio en seres humanos y animales. Éste ha sido un tema de interés para la industria farmacéutica, ya que un inhibidor de COX-2 más selectivo podría ser eficaz para aliviar dolor e hiperalgesia sin modificar la actividad constitutiva de COX-1 y sin los efectos adversos potenciales relacionados con la administración de AINE. Infortunadamente, este sistema biológico no es tan simple como se pensó en un principio. Aunque la COX-2 se induce durante la inflamación, se ha demostrado que también se induce durante la resolución de la res- © Editorial El manual moderno Fotocopiar sin autorización es un delito. seguridad y podría conferir una eficacia analgésica aún mayor debido a efectos antiinflamatorios y antinociceptivos más amplios. Los datos disponibles muestran que los compuestos de acción doble son eficaces en modelos de artritis, en los que también retienen actividad antitrombótica, causan poco o nulo daño gastrointestinal, y no afectan el estado asmático. Un doble inhibidor de COX–5-LOX (tepoxalina) se sometió a ensayos clínicos y está aprobado para uso veterinario. La tepoxalina tiene probada actividad antiinflamatoria gastrointestinal en ratones, lo cual apoya la teoría de que la inhibición de 5-LOX podría tener una función vital para prevenir la inflamación gástrica inducida por AINE. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 119 puesta inflamatoria, momento en que se producen las PG antiinflamatorias (PGD2 y PGF2), pero no PGE2, proinflamatoria. La inhibición de COX-2 durante esta fase podría en realidad prolongar la inflamación. Como en el caso de COX-1, en la actualidad parece ser que la isoenzima COX-2 también tiene importantes funciones constitutivas. Los estudios indican que COX-2 podría tener una función protectora en el mantenimiento de la integridad gastrointestinal, la curación de las úlceras y la colitis experimental en ratas. Además, la isoenzima COX-2 tiene al parecer funciones constitutivas relacionadas con el funcionamiento de nervios, encéfalo, ovarios y útero y el metabolismo óseo. Por lo tanto, son preocupantes los posibles efectos adversos de los AINE en estos sistemas. Revisten gran importancia las funciones constitutivas de COX-2 en los riñones, las cuales difieren de las propias de COX-1 en estados hipotensivos e hipovolémicos. Asimismo, parece ser que COX-2 es importante para la maduración de las nefronas. El riñón canino no está por completo maduro sino hasta tres semanas después del nacimiento, y la administración de un AINE durante este lapso, o a la perra antes del parto, puede causar una nefropatía permanente. En realidad, en ratones sin COX-2 (por carecer del gen que la codifica) ocurre la muerte de manera indefectible a causa de insuficiencia renal antes de las ocho semanas de edad. La insuficiencia renal no sucede en ratones en desarrollo sin COX-1, que tampoco sufren afección gástrica. El análisis de los detalles de la producción y las especificaciones de COX-1 y COX-2 ha proporcionado importantes datos para el tratamiento del dolor con AINE. Sin embargo, el cuadro aún es incompleto porque algunos AINE no inhiben en grado significativo estas enzimas. Esta observación llevó a la búsqueda de una posible isoenzima COX-3. En estudios con corteza cerebral canina se descubrió una isoenzima COX-3 codificada por el mismo gen que COX-1. La isoenzima COX-3 también se encuentra en tejidos encefálicos y cardiacos humanos. Difiere de COX-1 y COX-2, como se demostró en estudios con AINE analgésicos-antipiréticos comunes para suprimir la producción de COX. El paracetamol inhibió la actividad de COX-3, pero no la de COX-1 y COX-2, como sí lo hizo la dipirona. Ambos fármacos se usan con frecuencia para reducir la fiebre en animales. Otros AINE analgésicos–antipiréticos que son inhibidores eficaces de COX-3 son diclofenaco (el más potente), AAS e ibuprofeno (estos últimos que inhiben de forma preferencial a COX-3 sobre COX-1 y COX-2). La conclusión general de este estudio específico fue que COX-3 posee actividad de COX que difiere en términos farmacológicos de la propia de COX-1 y COX-2, pero es más parecida a la de COX-1. Estas observaciones indican que la isoenzima COX-3 es más susceptible a la inhibición por fármacos que son analgésicos y antipiréticos pero que carecen de actividad antiinflamatoria. Inhibición de la fiebre Del mismo modo en que la relación entre el dolor y las diversas actividades del sistema COX es compleja, también lo es la vinculación entre la fiebre y las isoenzimas COX. Los mecanismos que conducen a la generación de fiebre varían de acuerdo con el factor inductor, que puede ser periférico (es decir, endotoxina) o central (es decir, pirógenos endógenos, como IL-1). La variación entre especies también es sustancial y aún debe dilucidarse la participación definitiva de las COX en la piresis. Las pruebas sugieren que COX-2 participa en la pirexia por endotoxinas; en cambio, con base en los efectos antipiréticos de paracetamol y AAS, al parecer COX-1 y COX-3 actúan en la pirexia endógena. Estos dos fármacos son eficaces para reducir la fiebre en perros. Como una alternativa en felinos, se ha demostrado que ketoprofeno y meloxicam son antipiréticos 120 Manual de anestesia y analgesia en. . Mecanismos antiinflamatorios endógenos Los mediadores químicos de molécula pequeña generados de manera endógena, o autacoides, participan en el control de la inflamación al inhibir la atracción de células polimorfonucleares y promover la actividad de monocitos de manera no flogística. Se ha descubierto que las lipoxinas derivadas del ácido araquidónico, en particular la lipoxina A4, son mediadores antiinflamatorios, lo cual indica que la vía LOX tiene una doble función proinflamatoria y antiinflamatoria. Los AINE pueden amplificar o aminorar este sistema antiinflamatorio endógeno. El AAS es más selectivo de COX-1 y puede anular muchos componentes de la defensa mucosa y favorecer la adhesión de los leucocitos dentro de la microcirculación gástrica y mesentérica. Sin embargo, con el uso crónico de AAS, una adaptación de la mucosa gástrica se relaciona con notable regulación a la alza de la expresión de COX-2 y la producción de lipoxina. Esta última se denomina específicamente lipoxina inducida por AAS (ATL, del inglés aspirin-triggered lipoxin). El AAS es único entre los tratamientos actuales porque acetila la COX-2, con lo cual hace posible la biosíntesis de ácido 15(R)-hidroxieicosatetraenoico a partir del ácido araquidónico; ese derivado se convierte después en ATL por 5-LOX. La inhibición de las enzimas COX-2 o 5-LOX causa el bloqueo de la síntesis de ATL. Lipoxina A4 y ATL (un epímero de 15 carbonos de la lipoxina) atenúa la adhesión leucocítica inducida por AAS, mientras que la administración de inhibidores selectivos de COX-2 bloquea la síntesis de ATL y se ha demostrado que amplifica el daño inducido por AAS y la adhesión leucocítica al endotelio de las vénulas mesentéricas en ratas. La acetilación de COX-2 por AAS, además de las lipoxinas, genera otros muchos autacoides endógenos derivados de los ácidos grasos W-3 de los alimentos. Algunos de estos autacoides locales son inhibidores potentes de la convocación de neutrófilos, lo cual limita la participación de estas células durante la fase de resolución inflamatoria, y por ello se conocen como resolvinas. La identificación de lipoxinas y resolvinas ha creado nuevas vías terapéuticas potenciales para el tratamiento de la inflamación, la enfermedad cardiovascular y el cáncer. Consideraciones farmacológicas Los AINE son analgésicos eficaces, según lo indica el consumo humano de 120 000 millones de tabletas de AAS al año además de los diversos AINE que existen en el mercado en la actualidad. A pesar de ello, el perfil de seguridad de estos analgésicos es todavía causa de preocupación. Aún se buscan AINE sin efectos adversos gastrointestinales. La incorporación de un componente generador de óxido nítrico en la molécula de varios AINE ha atenuado los efectos ulcerógenos de estos fármacos. Sin embargo, el óxido nítrico también se ha referido en la patogenia de la artritis y la ulterior destrucción tisular. Debido a su tendencia a unirse a proteína, los AINE pueden desplazar a otros fármacos de sus sitios de unión a proteína plasmática y elevar su concentración en el plasma. Esto rara vez es preocupante a menos que los AINE se administren a pacientes con disfunción orgánica o que reciben otros medicamentos con fuerte tendencia a unirse a proteína con índice terapéutico estrecho. © Editorial El manual moderno Fotocopiar sin autorización es un delito. eficaces. En apariencia, el ketoprofeno es un buen antipirético tanto en gatos como en perros, y esta acción puede obtenerse a menudo con una dosis relativamente baja. Valoración del paciente y. . . 121 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Puede ocurrir interferencia en el metabolismo y la excreción de determinados fármacos coadministrados; por lo tanto, siempre es obligatorio verificar la seguridad de un tratamiento combinado. La insuficiencia renal inducida por AINE suele ser temporal y reversible al suspender el fármaco y administrar líquidos intravenosos. La ingestión accidental de AINE debe tratarse con lavado gástrico (si ocurrió menos de 1 h antes) seguido de carbón activado y protectores gástricos. Si hay indicios de úlceras gástricas, es necesario el tratamiento radical con sucralfato. La fluidoterapia intravenosa debe continuar por un mínimo de un día. El tratamiento más allá de este periodo depende del estado renal y gástrico del paciente individual. Selección de los pacientes y consideraciones terapéuticas La salud general del paciente influye en gran medida en la decisión de usar AINE. Gatos y perros son más susceptibles que el ser humano a los efectos adversos de esta clase de fármacos. Por lo tanto, la seguridad informada para cualquier AINE particular en pacientes humanos no debe extrapolarse a animales. La mayoría de los AINE tiene un estrecho margen de seguridad, por lo que es necesaria la dosificación precisa. La administración de AINE para el tratamiento del dolor perioperatorio debe restringirse a animales mayores de seis semanas bien hidratados y normotensos. Los pacientes deben tener hemostasia normal, sin indicios ni posibilidad de úlceras gástricas, y funcionamiento renal y hepático normal. Aunque éstas son directrices generales, estudios futuros podrían indicar que es seguro el tratamiento a corto plazo del dolor agudo con AINE que respetan la COX-1 y, en algún grado, la COX-2 en animales con afección mínima de hígado o riñón. Los pacientes no deben recibir corticoesteroides y AINE al mismo tiempo, ni AINE diferentes al mismo tiempo. El uso preventivo de AINE es tema de controversia debido a su capacidad de dañar. Un estudio anterior en el que se evaluaron los efectos renales de la administración preoperatoria de ketorolaco, ketoprofeno o carprofeno reveló alteraciones variables en los parámetros medidos. Las conclusiones fueron que, en perros sin afección clínica sometidos a operación programada, el uso de esos AINE no estaba contraindicado, aunque no se midió el funcionamiento renal y dos perros del grupo de ketoprofeno y dos del de ketorolaco eran hiperazoémicos. Otro estudio en que se analizaron los efectos de la administración preoperatoria de ketoprofeno sobre agregación plaquetaria en sangre entera, tiempo de sangrado de la mucosa bucal e índices hematológicos en perras sometidas a ovariohisterectomía programada reveló un decremento de la agregación plaquetaria por un mínimo de un día después de la intervención. El beneficio de la administración preoperatoria de AINE es la posibilidad de un efecto preventivo y la presencia de analgesia al momento de la recuperación. Cuando se administran AINE en el posoperatorio, con frecuencia se suministran al mismo tiempo opioides, ya que se requieren 45 min para obtener un efecto terapéutico con un AINE, cualquiera que sea la vía de administración. Otro método podría consistir en administrar el AINE por vía parenteral antes de completar la operación al menos 45 min antes de la extubación. A menudo es difícil reconocer la diferencia entre los efectos analgésicos de los AINE preoperatorios e intraoperatorios. Para intervenciones prolongadas, el beneficio de un efecto posoperatorio más largo puede verse con la administración del AINE al final del procedimiento y no al principio. 122 Manual de anestesia y analgesia en. . Dolor posoperatorio Los AINE tienen enorme utilidad en intervenciones ortopédicas y de tejidos blandos selectas, en especial cuando existe inflamación extensa o traumatismo de tejidos blandos. Se prefiere la administración de opioides inmediatamente después de cualquier operación porque los efectos sedantes–analgésicos de esta clase de fármacos ayuda a asegurar una recuperación sin contratiempos. Los AINE inyectables (carprofeno, ketoprofeno, meloxicam, ácido tolfenámico) pueden coadministrarse al principio con un opioide y luego usarse solos después de intervenciones ortopédicas y de algunas operaciones seleccionadas de tejidos blandos; sin embargo, esto depende del grado de dolor que experimenta el animal. Pueden administrarse AINE orales cuando el animal puede comer. La dosis inicial de AINE depende de la intensidad esperada del dolor. Artrosis Los principales efectos adversos relacionados con el consumo a largo plazo de AINE para la artrosis en perros se observan de manera predominante en el tubo digestivo. Se ha valorado la afectación gastroduodenal vinculada con AAS amortiguado, carprofeno, etodolaco y placebo en perros sanos después de un tratamiento de cuatro semanas. En dos estudios independientes se concluyó que la administración de carprofeno, etodolaco o placebo produjo en grado significativo menos lesiones gastroduodenales en perros que el AAS amortiguado. En un estudio similar en el que se comparó el ketoprofeno con AAS y placebo, y otro en que se comparó carprofeno, meloxicam y ketoprofeno con AAS y placebo, se reconoció que estos AINE causaron lesiones gastrointestinales leves a moderadas similares a las producidas por el placebo, pero mucho menos graves que las secundarias a AAS. Dado que muchos pacientes con artrosis son geriátricos, se recomienda una reducción rápida de la dosis hasta inducir un estado confortable a fin de abatir los efectos tóxicos potenciales. Por ejemplo, alternar el tratamiento a base de meloxicam cada tercer día con la mitad de la dosis recomendada por el fabricante fue eficaz en algunos perros durante un periodo de un año. Si un paciente individual requiere dosis altas persistentes de un AINE específico para el dolor, prescribir un AINE distinto puede ser más eficaz debido a la variación individual en respuesta y efecto, como ya se expuso. Cuando existe preocupación por los efectos adversos de un AINE, reducir la dosis y agregar un analgésico de otra clase (p. ej., tramadol) puede ser igual de eficaz para el tratamiento del dolor intenso crónico. Sin embargo, para muchos animales geriátricos © Editorial El manual moderno Fotocopiar sin autorización es un delito. Estados inflamatorios Para el alivio del dolor causado por meningitis, tumores óseos (en especial después de biopsia), tumefacción de tejidos blandos (mastitis), poliartritis, cistitis, otitis o enfermedades o lesiones dermatológicas inflamatorias graves (p. ej., desprendimiento de la piel de las patas y mordeduras), los AINE suelen ser más eficaces que los opioides. No obstante, dado que muchos de estos pacientes son más susceptibles a los efectos tóxicos de los AINE, se recomienda seleccionar y tratar de manera cuidadosa. La combinación de un opioide con una dosis baja de AINE también es eficaz en estas circunstancias. Una excepción es la fascitis necrosante, en la cual los AINE en realidad pueden elevar la morbimortalidad. Valoración del paciente y. . . 123 con insuficiencia renal, los AINE pueden ser la única clase eficaz de analgésicos. Para estos animales, la calidad de vida es una consideración importante. En estas situaciones es imperativo el consentimiento informado del propietario, debido a la prescripción de un fármaco contra las indicaciones aprobadas por el fabricante. Durante el tratamiento con AINE, todos los pacientes deben vigilarse en busca de rectorragia o melena, vómito, aumento del consumo de agua y cambios inespecíficos en la conducta. Se instruye al propietario para que suspenda el medicamento y consulte a un veterinario si ocurre cualquiera de los signos anteriores. Se recomienda la vigilancia intermitente de creatinina y alanina aminotransferasa (ALT) cuando se prescribe el uso crónico de AINE. Otra consideración importante para la administración crónica de AINE es su efecto potencial en el metabolismo de articulaciones y cartílago. En estudios sobre los efectos de carprofeno y meloxicam en dosis terapéuticas no se identificaron acciones tóxicas o farmacológicas en el metabolismo del proteoglucano cartilaginoso. Además, es posible que el meloxicam controle reacciones inflamatorias celulares en sitios inflamados de las articulaciones de pacientes con artrosis. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Trastornos diversos Otras indicaciones para el uso de AINE son panosteítis, osteodistrofia hipertrófica (ODH), dolor canceroso (en especial de hueso) y dolor dental. Los AINE con inhibición selectiva de COX-1 deben emplearse con cautela después de extracciones dentales en las cuales el sangrado es o podría ser motivo de preocupación. Meloxicam, carprofeno y los “coxibs” (inhibidores selectivos de COX-2) tienen actividad antitromboxano mínima o nula y por tanto no interfieren en la adhesión plaquetaria. Para panosteítis grave y ODH se requiere la dosis de carga completa de un AINE para obtener un efecto adecuado. La ODH de los perros Weimaraner reacciona poco al tratamiento con AINE y se trata mejor con corticoesteroides a corto plazo en dosis altas, siempre que se haya descartado enfermedad infecciosa y los signos clínicos sean consistentes con ODH aislada. Contraindicaciones No deben administrarse AINE a pacientes con insuficiencia renal aguda, insuficiencia hepática, deshidratación, hipotensión o trastornos relacionados con bajo volumen circulante efectivo (p. ej., insuficiencia cardiaca congestiva o ascitis), coagulopatías (p. ej., deficiencias de factores de la coagulación, trombocitopenia o enfermedad de von Willebrand), o indicios de ulceración gástrica (es decir, vómito con o sin material en pozos de café o melena). La administración de AINE después de procedimientos gastrointestinales debe decidirse con base en la salud general del intestino y el momento de la operación. Dado que la isoenzima COX-2 es importante para la curación, los AINE que inducen inhibición potente de la enzima COX-2 estarían contraindicados si se observa afectación intestinal. No se recomienda el uso concurrente de otros AINE (p. ej., AAS) o corticoesteroides. Está contraindicado el empleo de AINE con acción preferente sobre COX-1 en pacientes con lesión espinal (incluida la hernia de discos intervertebrales) debido a que provocan hemorragia y deterioro neurológico, además de sangrado excesivo en el sitio quirúrgico si se practica la operación. Los AINE nunca deben administrarse a pacientes en choque, sujetos traumatizados en el momento de la presentación, o si hay indicios de hemorragia (p. ej., 124 Manual de anestesia y analgesia en. . epistaxis, hemangiosarcoma o traumatismo cefálico) mientras no se los estabilice y se valore el funcionamiento orgánico. El estado de los pacientes con asma grave o mal controlada, como el asma felino u otros tipos de neumopatía moderada a grave, puede deteriorarse si se administran AINE. Se ha documentado que el uso de AAS exacerba el asma en seres humanos, pero la administración de AINE específicos para COX-2 no empeoró los signos clínicos. Se desconoce si los animales pueden afectarse de esta manera. Debido a la inhibición de la actividad de PG, los AINE pueden ser perjudiciales para el funcionamiento reproductivo. La indometacina bloquea la actividad de PG en mujeres embarazadas y causa cesación del trabajo de parto, cierre prematuro del conducto arterial en el feto y trastorno de la circulación fetal. Estos efectos también ocurren en animales, por lo que no deben administrarse AINE en la gestación. Dado que la inducción de COX-2 es necesaria para la ovulación y la ulterior implantación embrionaria, debe evitarse el uso de AINE en hembras durante esta fase del ciclo reproductivo. Como ya se indicó, la isoenzima COX-2 es necesaria para la maduración del riñón embrionario, por lo que deben evitarse los AINE que actúan en COX-2 a las madres en lactación. AINE específicos Las dosis recomendadas se presentan en el cuadro 3-2. Carprofeno. Aunque se clasifica como un AINE, el carprofeno administrado a sabuesos no suprimió la síntesis de PGE2, ácido 12-hidroxieicosatetraenoico o TXB2 en un estudio experimental en que se usaron líquidos de tejido subcutáneo. Se concluyó que el principal modo de acción del carprofeno eran los mecanismos distintos de la inhibición de COX o 12-LOX. Sin embargo, estudios más recientes indican que es un AINE con acción preferencial en COX-2. El carprofeno está aprobado para el tratamiento del dolor perioperatorio y crónico en perros en Australasia, Europa y Norteamérica y para el uso perioperatorio en dosis única en gatos en Europa. La actividad antitromboxano es mínima, lo cual sugiere que la coagulopatía inducida no es un problema en pacientes con mecanismos hemostásicos intactos. Se han informado efectos hepatotóxicos y muerte después de la administración de carprofeno en perros con funcionamiento hepático previo normal (sobre todo en cobradores de Labrador). El potencial de efectos hepatotóxicos parece ser una característica general de los AINE y no específica de un producto dado cualquiera. El carprofeno induce analgesia adecuada 12 a 18 h después de diversas intervenciones ortopédicas. En gatas sometidas a ovariohisterectomía, la administración de carprofeno produjo analgesia profunda de 4 a 20 h en el posoperatorio. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Meloxicam. El meloxicam es un AINE con acción preferente en COX-2 aprobado para uso oral en perros en Australasia, Europa y Norteamérica. La formulación parenteral está aprobada para gatos en Australasia y EUA. Los estudios indican ausencia de anomalías renales o hepáticas con la administración aguda; sin embargo, existe preocupación (como en el caso de todos los AINE) de que los gatos puedan sufrir daño renal agudo con una o más dosis. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 125 Cuadro 3-2. Intervalos de dosificación (miligramos por kilogramo, a menos que se indique otra cosa) para AINE en perros y gatos AINEa Indicación Especie, dosis, vía Frecuencia Ketoprofeno Dolor quirúrgico Perros, ≤2.0 IV, SC, IM, VO Una vez Gatos, ≤2.0 SC Una vez luego perros y gatos, ≤1.0 IV, SC, IM, VO c/24 h Perros y gatos, ≤2.0 VO Dolor crónico luego ≤1.0 Una vez Meloxicam Dolor quirúrgico Perros, ≤0.2 IV, SC Una vez luego ≤0.1 IV, SC, VO c/24 h Dolor crónico Perros, ≤0.2 VO Una vez luego ≤0.1 VO c/24 h Dolor quirúrgico Gatos, ≤0.2 SC, VO Una vez luego ≤0.1 SC, VO peso magro c/24 h por 2 a 3 días Gatos, ≤0.2 SC, VO Una vez Dolor crónicob luego ≤0.1 VO peso magro c/24 h por 2 a 3 días luego 0.025 VO o (0.1 mg/GAT máx) peso 3 a 5 × semana magro Carprofeno Dolor quirúrgico Perros, ≤4.0 IV, SC, IM Una vez en la inducción luego ≤2.2 VO Repetir c/12 a 24 h Gatos, ≤1.0 SC peso magro Una vez en la inducción sólo Dolor crónico Perros, ≤2.2 VO c/12 a 24 h Robenacoxib Dolor quirúrgico Perros, ≤1 VO, SC Gatos, 1 VO hasta 3 días c/24 h y crónico Ácido tolfená- Dolor agudo, Perros y gatos, ≤4 SC, VO c/24 h por 3 días, 4 días mico crónico no, luego repetir el ciclo Firocoxib Dolor crónico Perros, 5.0 PO c/24 h Flunixina me- Dolor quirúrgico Perros, ≤1.0 IV, SC, IM Una vez glumina Gatos, 0.25 SC c/12 a 24 h SSR × 1 o 2 dosis Pirexia Perros y gatos, 0.25 SC c/12 a 24 h SSR × 1 o 2 dosis Intervenciones Perros, 0.25 a 1.0 SC, IM c/12 a 24 h SSR × 1 o 2 oftálmicas dosis Ketorolaco Dolor quirúrgico Perros, 0.3 a 0.5 IV, IM c/8 a 12 h × 1 o 2 dosis Gatos, 0.25 IM c/12 h × 1 o 2 dosis Panosteítis Perros, 10 mg dosis total en perros ≥30 kg c/24 h por 2 a 3 días VO, 5 mg dosis total en perros >20 kg <30 kg VO Deracoxib Dolor quirúrgico Perros, ≤3 a 4 VO c/24 h por 3 a 7 días Dolor crónico Perros, ≤1 a 2 VO c/24 h Tepoxalín Dolor crónico Perros, 10 VO c/24 h Piroxicam Inflamación de Perros, 0.3 VO c/24 h × 2 dosis, luego vías urinarias inc/48 h feriores 126 Manual de anestesia y analgesia en. . Ketoprofeno. El ketoprofeno está aprobado para el tratamiento del dolor posoperatorio y crónico en perros y gatos en Europa y Canadá. Dado que este fármaco es un inhibidor tanto de COX-1 como de COX-2, los efectos adversos son un problema potencial que requiere selección cuidadosa de los pacientes. Aunque varios estudios en los que se usó ketoprofeno en el preoperatorio indican su eficacia para controlar el dolor posoperatorio, un consenso general entre los veterinarios ha restringido su uso al periodo posoperatorio para reducir el peligro de hemorragia. El ketoprofeno no debe administrarse a pacientes con factores de riesgo para hemorragia. A menudo se usa en animales inmediatamente después de intervenciones ortopédicas (p. ej., reparación de fractura, reparación de ligamento cruzado, oniquectomía); sin embargo, se recomienda restringir la administración después de laparotomía o toracotomía hasta un momento en que no haya riesgo de hemorragia y cuando se hayan retirado sondas de drenaje intracavitarias. En un estudio en que se investigó la eficacia de los AINE para controlar el dolor posoperatorio, el ketoprofeno indujo un estado de analgesia muy favorable a excelente hasta por 24 h en comparación con el butorfanol. También se ha sugerido la administración de ketoprofeno para el dolor por ODH y panosteítis en perros. Deben coadministrarse gastroprotectores. Es posible el vómito ocasional con el uso crónico de ketoprofeno. Etodolaco. El etodolaco es un AINE de efecto preferencial sobre COX-2 aprobado en EUA para uso oral en perros con dolor e inflamación por artrosis. Al parecer, la mayor parte de los efectos adversos se restringen sobre todo al tubo digestivo. No obstante, se ha informado queratoconjuntivitis seca (QCS) después de administrar etodolaco a perros; su uso se ha limitado. Robenacoxib, deracoxib y firocoxib. La clase de los inhibidores específicos de COX-2, o “coxibs”, está aprobada en EUA y Canadá para el control del dolor y la inflamación posoperatorios en caso de intervenciones ortopédicas y dolor crónico por artrosis en perros. El robenacoxib está aprobado para su uso en perros en Europa, pero en la actualidad es el único AINE de esta clase aprobado para su uso en gatos. Debe usarse por un máximo de tres días por vía oral en gatos en EUA y hasta por seis días en Europa. Tiene semivida relativamente corta, lo que debe limitar © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 3-2. Intervalos de dosificación (miligramos por kilogramo, a menos que se indique otra cosa) para AINE en perros y gatos (continuación) Paracetamol Dolor agudo, Perros, 15 VO (contraindicado en gatos) c/8 h crónico AAS Dolor agudo, Perros, 10 VO c/12 h crónico a Véanse en el texto los detalles sobre contraindicaciones de su uso. b El fabricante recomienda de manera específica no repetir la dosis de meloxicam en gatos. GAT máx, dosis máximas en gatos; IM, intramuscular; IV, intravenosa; AINE, antiinflamatorio no esteroideo; VO, vía oral; SSR, según se requiera; SC, subcutáneo. Fuente: Lamont L.A., Mathews K.A. 2007. Opioids, nonsteroidal anti-inflammatories, and analgesic adjuvants. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 259. Valoración del paciente y. . . 127 la acumulación del fármaco con el uso repetido. Esta clase de AINE se publicitaba al principio como más gastroprotectora en personas respecto de los AINE que respetan menos la COX-1, como el AAS. Sin embargo, datos más recientes y uso a gran escala en pacientes humanos indican que los AINE inhibidores específicos de COX-2 no garantizan gastroprotección. En un estudio más reciente en perros en el que se comparó el perfil de seguridad gastrointestinal de la licofelona (un inhibidor doble de COX–LOX) con el propio del rofecoxib (un inhibidor de COX-2 similar a deracoxib y firocoxib), se observó que el rofecoxib induce lesiones gástricas y gastroduodenales significativas. Tepoxalina. La tepoxalina es un inhibidor de COX-1, COX-2 y LOX con grados variables de eficacia comparables a los de meloxicam o carprofeno y seguridad comparable a la del placebo. La tepoxalina se aprobó para el tratamiento del dolor de la artrosis en perros. Su perfil de seguridad no difirió del propio del placebo cuando se administró antes de un periodo de anestesia de 30 min y una operación menor en perros. Ácido tolfenámico. El ácido tolfenámico está aprobado para su uso en gatos y perros en Europa y Canadá a fin de controlar el dolor posoperatorio agudo y el crónico. La dosificación tiene un esquema de tres días sí y cuatro días no, y es necesario apegarse de forma estricta a este esquema. Los efectos adversos que se han informado son diarrea y vómito ocasional. El ácido tolfenámico tiene actividad antiinflamatoria y antitromboxano significativa, de tal modo que la hemostasia postraumática y quirúrgica puede verse afectada durante el sangrado activo después de administrar este AINE. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vedaprofeno. La forma oral está aprobada para su uso en perros en Europa y Canadá. La forma parenteral tiene aprobación para su uso en caballos en Europa y Norteamérica y tiene propiedades farmacocinéticas y farmacodinámicas muy similares a las del ketoprofeno. Ketorolaco. El ketorolaco, un inhibidor de COX-1 y COX-2, no está aprobado para su uso en veterinaria, pero se incluye aquí para el beneficio de quienes trabajan en la investigación, en la que es más probable que se disponga de ketorolaco que de otros AINE. El ketorolaco es comparable a la oximorfona en eficacia y al ketoprofeno en duración y eficacia contra el dolor poslaparotomía y ortopédico en perros. Sólo deben administrarse una o dos dosis a perros y gatos. El ketorolaco se ha empleado con éxito en el tratamiento de la panosteítis grave en perros cuando todos los demás tratamientos han fallado. Se recomienda que el ketorolaco se administre con alimento o gastroprotectores para reducir la incidencia de irritación gástrica (que es relativamente común). Piroxicam. Está aprobado para su uso en veterinaria, pero ha sido valioso por sus efectos antiinflamatorios en las vías urinarias inferiores en perros con carcinoma de células de transición o cistitis y uretritis. A menudo se recomienda administrarlo con gastroprotectores. Paracetamol. Es un inhibidor de COX-3 con efectos mínimos en COX-1 y COX-2. No está aprobado para su uso en veterinaria. No debe administrarse a gatos, debido a la glucuronidación deficiente del paracetamol en esta especie. Puede administrarse a perros como antipirético 128 Manual de anestesia y analgesia en. . y analgésico para dolor leve y combinarse con opioides para un efecto analgésico sinérgico o ahorrador de opioide. Cuando se prescribe como fármaco individual puede coadministrarse con un opioide (lo cual permite más flexibilidad al dosificar el opioide); existen presentaciones patentadas en que se combina con un opioide (p. ej., codeína más paracetamol, u oxicodona más paracetamol). Ácido acetilsalicílico. El ácido acetilsalicílico (AAS), también llamado aspirina, es en mayor medida un inhibidor de COX-1 y se usa más a menudo como analgésico para el dolor por artrosis en perros. También se lo encuentra en combinaciones patentadas con diversos opioides (AAS más codeína, o AAS más oxicodona) para lograr un efecto sinérgico en el tratamiento del dolor moderado. Se emplea asimismo como antipirético y anticoagulante en perros y gatos. Coadyuvantes de analgésicos Se definen como fármacos que tienen como indicaciones principales otras distintas del dolor, pero que ejercen acciones analgésicas en determinados trastornos dolorosos. Esta definición incluye a un grupo muy diverso de fármacos y distingue los coadyuvantes de analgésicos de los llamados analgésicos comunes, entre los que se encuentran los opioides, los AINE y los anestésicos locales. Sólo en fechas recientes los coadyuvantes de analgésicos comenzaron a usarse en medicina veterinaria y la mayor parte de las recomendaciones terapéuticas se han extrapolado a partir de la experiencia con pacientes humanos y aplicado después a las especies de compañía. Como el nombre señala, estos agentes suelen coadministrarse con los analgésicos regulares. Se han utilizado con mayor frecuencia en el tratamiento de estados de dolor crónico; sin embargo, se ha incrementado su empleo en situaciones de dolor agudo y determinados coadyuvantes se han convertido en complementos comunes de analgésicos durante el periodo perioperatorio. En situaciones de dolor crónico, los coadyuvantes de analgésicos se administran para 1) tratar el dolor incoercible con los analgésicos tradicionales, 2) reducir las dosis de analgésicos tradicionales a fin de aminorar los efectos adversos, y 3) tratar de modo concurrente un signo o síntoma distinto del dolor. En algunas situaciones clínicas, por ejemplo en síndromes de dolor neuropático crónico, los coadyuvantes de analgésicos han tenido tan buena aceptación que se administran como tratamiento de primera línea en pacientes humanos. Cuando se considera administrar un coadyuvante de analgésico, los veterinarios deben tener presente la farmacología clínica del medicamento y su uso específico en pacientes con dolor. Es necesaria la siguiente información acerca del fármaco: 1) indicaciones aprobadas, 2) indicaciones no aprobadas (p. ej., analgesia) que se aceptan de forma amplia en la práctica médica veterinaria, 3) efectos secundarios comunes e infrecuentes pero potencialmente graves, 4) características farmacocinéticas importantes, y 5) directrices de dosificación específicas para dolor. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Dipirona. La dipirona, un inhibidor de COX-3, está aprobada para su uso en gatos y perros en Europa y Canadá. Debe administrarse por la vía intravenosa para evitar la irritación que causa por vía intramuscular. La analgesia producida no suele ser adecuada para el dolor posoperatorio moderado a intenso, y la dipirona se reserva para su administración como antipirético en casos en que están contraindicados otros AINE. Los efectos nefrotóxicos o ulceración gástrica no causan mayor preocupación a corto plazo incluso en pacientes en estado crítico. La administración de dipirona induce discrasias sanguíneas en el ser humano, pero no se ha informado que eso ocurra en animales. Valoración del paciente y. . . 129 Numerosos fármacos pueden considerarse coadyuvantes de analgésicos en la medicina veterinaria actual. Algunos, como ketamina y agonistas a2, son habituales para los veterinarios, mientras que otros no se habían usado antes en la medicina veterinaria. Gran parte de la evidencia que sustenta el uso de estos fármacos proviene de investigación en animales de laboratorio, ensayos clínicos en seres humanos, o informes empíricos en pacientes humanos o animales. En la sección que sigue se revisa de modo sinóptico el estado actual del conocimiento acerca de coadyuvantes de analgésicos seleccionados usados en medicina veterinaria (véanse las dosis recomendadas en el cuadro 3-3). Ketamina Es un anestésico disociativo que se ha usado por décadas en medicina veterinaria. En fechas más recientes se han reconocido sus efectos como un antagonista de receptores de NMDA, y en dosis muy bajas puede hacer una contribución sustancial a la analgesia al minimizar la sensibilidad del SNC. Agonistas adrenérgicos a2 La xilazina y, en fecha más reciente, medetomidina, dexmedetomidina y romifidina, se han usado de manera extensa para suministrar sedación en diversas especies veterinarias. Medetomidina y dexmedetomidina tienen en particular considerable potencial analgésico, incluso en microdosis, y pueden administrarse por varias vías y técnicas novedosas para complementar la analgesia y favorecer las acciones analgésicas de otros fármacos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Gabapentina Es un fármaco antiepiléptico utilizado en seres humanos aprobado por la Food and Drug Administration desde 1993. Varios años después comenzaron a aparecer en la bibliografía informes de Cuadro 3-3. Intervalos de dosificación (miligramos por kilogramo) de coadyuvantes de analgésico para especies domésticas seleccionadas Coadyuvante de analgésico Ketamina Perros Gatos 0.5 IV dosis de carga 0.5 IV dosis de carga 0.1 a 0.5/h IV IRC 0.1 a 0.5/h IV IRC Dexmedetomidina 0.001 a 0.015 IV, IM 0.0025 a 0.02 IV, IM Gabapentina 2 a 10 VO c/8 a 12 h 2 a 10 VO c/8 a 12 h Amantadina 3 a 5 VO c/24 h 3 a 5 VO c/24 h Tramadol 2 a 10 VO c/12 a 24 h ¿? IRC, infusión a ritmo continuo; IM, intramuscular; IV, intravenosa; VO, vía oral; ¿?, no se han establecido dosis confiables para esta especie. Fuente: Lamont L.A., Matthews K.A. 2007. Opioids, nonsteroidal anti-inflammatories, and analgesic adjuvants. In: Lumb and Jones’ Veterinary Anesthesia and Analgesia , 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 263. 130 Manual de anestesia y analgesia en. . Amantadina Es un antiviral desarrollado para inhibir la multiplicación del virus de la gripe A en seres humanos. Es eficaz para el tratamiento de los efectos extrapiramidales inducidos por fármacos y en el tratamiento de la enfermedad de Parkinson. En fechas más recientes se la ha recomendado contra diversos tipos de dolor. Ejerce sus efectos analgésicos por antagonismo de receptores de NMDA de manera análoga a como lo hace la ketamina. Aunque no se han realizado ensayos clínicos controlados en seres humanos, la amantadina es al parecer más eficaz en el tratamiento de los tipos neuropáticos crónicos de dolor caracterizados por hiperalgesia y alodinia. Los pacientes con tolerancia a opioides también reaccionan casi siempre de modo favorable a la amantadina. Las recomendaciones de dosificación se basan en gran medida en informes empíricos; no obstante, en un estudio de 2008, Lascelles et al demostraron mejor actividad en perros con artrosis resistente a AINE cuando se agregó amantadina al meloxicam. Como el tratamiento del dolor crónico en animales de compañía recibe aún mucha atención, es probable que aumente el uso de amantadina y otros fármacos con mecanismo de acción similar. Tramadol Es un análogo sintético de la codeína y un agonista débil de receptores m. Además de su actividad opioide, el tramadol también suprime la recaptación neuronal de noradrenalina y 5-hidroxitriptamina (serotonina), y puede facilitar en realidad la liberación de 5-hidroxitriptamina. Se piensa que estos efectos en vías catecolaminérgicas centrales hacen una contribución significativa a la eficacia analgésica del fármaco. El tramadol se recomienda para el tratamiento del dolor agudo y crónico moderado a intenso relacionado con diversos trastornos, como artrosis, fibromialgia, neuropatía diabética, dolor neuropático e incluso dolor perioperatorio en seres humanos. En un estudio publicado en 2003 se compararon los efectos del tramadol intravenoso y la morfina administrados antes de ovariohisterectomía en perras. El tramadol fue comparable a la morfina en su eficacia analgésica para este tipo de dolor quirúrgico. Es claro que se requieren más estudios antes de emitir recomendaciones terapéuticas definitivas para el tratamiento del dolor perioperatorio en diversas especies. Abundan los informes anecdóticos de tratamiento de dolor © Editorial El manual moderno Fotocopiar sin autorización es un delito. sus efectos antihiperalgésicos en modelos roedores de dolor experimental, así como informes de casos y ensayos clínicos no controlados en pacientes humanos con dolor neuropático. Se desconoce el mecanismo de acción analgésica de la gabapentina, pero hay datos que sugieren que se trata de un bloqueador de los conductos de Ca2+ dependientes de voltaje y que puede incrementar la inhibición central o reducir la síntesis de glutamato, aunque al parecer no interactúa de manera directa con receptores de NMDA. Si bien por el momento no se dispone de datos controlados, se ha recomendado la administración de gabapentina para tratar diversos síndromes de dolor neuropático en personas, y en fechas más recientes para tratar el dolor incisional y la artritis. En ensayos clínicos en seres humanos se han reconocido efectos adversos en alrededor de 25% de los pacientes, pero suelen ser leves y autolimitados, e incluyen somnolencia, fatiga y aumento de peso con el uso crónico. Las directrices de dosificación en perros y gatos se han extrapolado a partir de las recomendaciones de dosificación para seres humanos y algunos datos de farmacocinética preliminares. Las modificaciones posológicas se basan con frecuencia en la eficacia clínica lograda en pacientes veterinarios individuales. Valoración del paciente y. . . 131 crónico en perros y gatos con tramadol cuando está contraindicado el uso de AINE. Debido a su efecto inhibitorio en la captación de 5-hidroxitriptamina, el tramadol no debe usarse en pacientes que tal vez consumieron inhibidores de la monoaminooxidasa (IMAO) como selegilina (véase también la sección sobre meperidina), que reciben un inhibidor selectivo de la recaptación de serotonina (ISRS), o con antecedente reciente de actividad convulsiva. Tapentadol Es un analgésico multimodal aprobado para su uso en seres humanos que experimentan dolor. Tiene efectos noradrenérgicos significativos así como acciones de opioide. Su uso en medicina veterinaria no se ha informado a la fecha, pero parece promisorio como una alternativa al tramadol en animales que no toleran éste. Las desventajas de su uso en el momento actual son costo considerable y su estado de sustancia controlada. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Acupuntura y medicina tradicional china La formación del veterinario lo hace a menudo escéptico a las prácticas médicas tradicionales de Oriente debido a sus evidentes oposiciones a la metodología científica occidental y la presuposición de que la práctica médica oriental se basa en cierto grado en la fe. Es importante que las personas no familiarizadas con la medicina tradicional china (MTC) comprendan que gran parte de su teoría y nomenclatura, si bien son similares a la terminología occidental, guardan escasa correlación directa. Gran parte de la práctica de la MTC se desarrolló antes del advenimiento de la ciencia médica occidental y la publicación de textos médicos, de tal modo que tuvo que diseñarse un método simplificado para la práctica de la MTC basada en medidas diagnósticas y terapéuticas observables en las superficies externas del cuerpo. En consecuencia, lo mejor es considerar que la descripción de los puntos de acupuntura y los diagnósticos de la MTC son metáforas o auxiliares didácticos más que correlaciones anatómicas o fisiopatológicas con la medicina occidental. Las medidas terapéuticas evolucionaron durante milenios de ensayo y error en muchas especies y representan un consenso entre practicantes de la MTC acerca de lo que es eficaz. La enseñanza médica occidental actual sostiene que la MTC es complementaria de la medicina occidental y no una alternativa a ella. Por lo regular, la acupuntura se ha percibido como una modalidad terapéutica entre varias usadas por los practicantes de la MTC. La mayoría de los diagramas de acupuntura occidentales muestra puntos de acupuntura de transposición y meridianos en animales, lo cual significa que los puntos se adaptan a partir de correlaciones anatómicas con el cuerpo humano. Esto crea algunas adaptaciones interesantes, dado que la anatomía animal difiere de la humana. Algunos acupunturistas prefieren utilizar los puntos descritos para animales en los primeros textos veterinarios chinos. Éstos pueden estar alineados o no con los puntos modernos. Son difíciles de aprender para muchos occidentales porque los nombres son chinos y a menudo describen la anatomía en términos de objetos naturales (ríos, ramas, etc.). Algunos acupunturistas sólo emplean puntos localizados en las extremidades distales. Con frecuencia, éstos reciben el nombre de puntos Ting y son los extremos de los meridianos, y por lo regular extremadamente dolorosos cuando reciben un estímulo con agujas (como clavar alfileres bajo las uñas), de modo que se esperaría que produjeran una respuesta pronunciada. 132 Manual de anestesia y analgesia en. . Todo paciente programado para tratamiento con acupuntura debe valorarse con los estándares de atención establecidos para la medicina veterinaria occidental. Esto incluye exploración física exhaustiva, auscultación torácica, análisis de sangre en caso necesario, y cualesquiera otras pruebas diagnósticas necesarias. No apegarse a este estándar de atención puede considerarse negligencia profesional. La acupuntura se usa a menudo junto con tratamientos occidentales, como operaciones o farmacoterapia. Se recomienda que los clientes firmen una carta de rechazo de la atención occidental cuando desean que sólo se aplique acupuntura. Tales clientes han causado gran preocupación y controversia ética entre los veterinarios. El interés por la acupuntura en occidente surgió en EUA a principios de la década de 1970, en parte porque James Reston, un reportero del New York Times que cubría el viaje del presidente Richard Nixon a China, sufrió apendicitis aguda. Después de que su dolor posoperatorio se trató con acupuntura, Reston describió la experiencia en la primera plana del diario, con lo cual se suscitó el interés por la acupuntura en la comunidad médica occidental. Con posterioridad, médicos estadounidenses y europeos que visitaron China presenciaron operaciones en las cuales el único anestésico usado era la acupuntura. Se sucedieron varios artículos en diarios y revistas sobre el uso de la acupuntura en vez de la anestesia general. La investigación básica sobre los mecanismos de la acupuntura en las sociedades occidentales comenzó en 1976 después de que se postuló la hipótesis del efecto de las endorfinas sobre el mecanismo de acción de la acupuntura. Un mayor avance de la investigación sobre la acupuntura se debió a la introducción de la resonancia magnética nuclear funcional (RMNf) y la tomografía por emisión de positrones, que revelaron la relación entre estimulación por acupuntura y activación de determinadas estructuras encefálicas. El interés en EUA llevó a los National Institutes of Health a crear el National Center for Complementary and Alternative Medicine (NCCAM), que ha patrocinado estudios básicos y clínicos sobre acupuntura. En 1997, la Organización Mundial de la Salud publicó una lista de afecciones humanas que podrían beneficiarse del tratamiento con acupuntura. Entre las aplicaciones se incluyen prevención y tratamiento de náusea y vómito del posoperatorio y por quimioterapia, tratamiento del dolor, tratamiento del alcoholismo y otras adicciones, tratamiento de asma y bronquitis, y rehabilitación de lesiones neurológicas como las causadas por el accidente cerebrovascular. La información científica sobre la eficacia de la acupuntura para trastornos veterinarios es limitada. La eficacia del tratamiento se determina por consenso entre veterinarios que realizan con frecuencia acupuntura en especies específicas. El escepticismo acerca de la eficacia de la acupuntura en seres humanos y animales persiste entre algunos profesionales de la salud occidentales. Algunos factores que contribuyen a este escepticismo son: 1) todavía no se dilucida la base científica de la acupuntura, 2) la base filosófica de la acupuntura es difícil de aceptar para una sociedad industrial moderna, 3) el lenguaje operativo es inusual, y 4) el sistema tradicional de los puntos de acupuntura no corresponde a los conceptos occidentales de anatomía o neurología. Además, la acupuntura tradicional china aún es una mezcla de filosofía y ciencia y enseña que muchos factores pueden influir profundamente en el resultado del tratamiento. Además de los signos relacionados con la enfermedad, el practicante podría considerar sexo y perfil psicológico del paciente, estación del año, hora del día, e incluso el ambiente en que se administra el tratamiento. Debido a estas diferencias, se piensa que © Editorial El manual moderno Fotocopiar sin autorización es un delito. Historia Valoración del paciente y. . . 133 la eficacia de las intervenciones puede diferir en grado sustancial entre pacientes con síntomas similares, y por tanto es difícil estandarizar procedimientos. La exploración científica de estos factores todavía es limitada. Otro problema relacionado con los estudios sobre la acupuntura consiste en definir un placebo adecuado como una intervención testigo (control). Algunos ensayos comparan la acupuntura con fármacos y otros usan acupuntura fingida (acupuntura en puntos aleatorios de la superficie corporal que se consideran inactivos). Sin embargo, existe controversia sustancial acerca del uso de la acupuntura fingida como tratamiento testigo porque la intervención misma puede tener efectos neurohormonales y clínicos, aunque por lo general de menor eficacia en comparación con los del tratamiento en puntos de acupuntura definidos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Conceptos básicos La teoría de la MTC, de la cual la acupuntura forma parte, es compleja y supero los alcances de esta revisión. A diferencia de la ciencia biomédica occidental, la MTC no hace distinción entre componentes físico, mental y emocional de la vida. Además, considera a un ser como parte integral del universo. Se cree que todo en el universo, incluidos los animales, obedece las mismas leyes. Por lo tanto, salud y enfermedad son resultado de que haya equilibrio o desequilibrio. Órganos y meridianos La mayoría de las escuelas modernas de acupuntura enseña la teoría de los meridianos. Sin embargo, los antiguos practicantes (y algunos de los modernos) no reconocen meridianos o no concuerdan en su trayectoria. Los meridianos son más útiles para recordar la ubicación de los puntos, aunque se usan al diseñar los protocolos de tratamiento. Los meridianos se identificaron a partir de observaciones en un pequeño porcentaje de personas que son en extremo sensibles a la acupuntura. Un meridiano puede describir el curso de una sensación de hormigueo o ardor a lo largo de una trayectoria que de manera aproximada corresponde al meridiano. La mayoría de los meridianos no guarda relación anatómica evidente con los trayectos de los nervios, aunque muchas de las relaciones observadas se explican al parecer por la manera en que los nervios periféricos ingresan en la médula espinal y las vías neurales convergen en el encéfalo. Por ejemplo, muchas personas que sufren un ataque cardiaco describen un dolor a través del pecho y hasta el brazo. El meridiano del corazón recorre el pecho y el brazo. El dolor (originado en el músculo cardiaco) se siente en el brazo porque algunas de las fibras aferentes entran en la médula espinal cerca del sitio de las aferentes desde la extremidad torácica. Otras observaciones indican que zonas distantes del cuerpo tienen efectos complementarios porque muchas áreas de la corteza somatosensitiva del cerebro se colocalizan. Las relaciones entre órganos internos y meridianos (y puntos superficiales) son muy comunes y tienen sentido si se comprende el concepto de dolor referido. La teoría de la acupuntura tradicional china reconoce 12 meridianos principales con órganos correspondientes en el cuerpo humano. Además, pueden distinguirse ocho llamados meridianos curiosos. La mayoría de los “órganos” de la acupuntura tiene nombres similares a los órganos de la medicina occidental, pero sólo una correlación aproximada con funciones fisiológicas y estructuras anatómicas. Los órganos, según los consideran las antiguas tradiciones chinas, son sistemas funcionales y no estructuras anatómicas, con funciones fisiológicas y representaciones 134 Manual de anestesia y analgesia en. . anatómicas más amplias y algunas veces peculiares. Por ejemplo, dos órganos de la acupuntura tradicional, el “triple calentador” y el “pericardio” (“gobernador del corazón”), no tienen una representación anatómica bien definida. Todos los meridianos y órganos están conectados y relacionados entre sí de manera directa o indirecta de acuerdo con diversas reglas y principios: Puntos En la acupuntura china, los puntos se llaman xue, que significa “cueva” o “agujero”. En la tradición y el lenguaje de la acupuntura china, los nombres de los puntos son importantes e informativos. Los practicantes de la acupuntura occidental rara vez usan nombres chinos, por falta de familiaridad con las lenguas chinas. En cambio, los puntos se identifican con una abreviatura de número y letra mayúscula del meridiano al cual pertenecen: 365 puntos clásicos se localizan a lo largo de los meridianos y existe al menos la misma cantidad de puntos extrameridianos. La localización exacta de los puntos es importante porque, en concordancia con la teoría clásica, incluso pequeñas desviaciones respecto de la localización deseada pueden anular la respuesta. La distancia de los puntos de acupuntura a las referencias anatómicas suele describirse como cun. La investigación sobre la anatomía y fisiología de los puntos de acupuntura ha llevado a formular la hipótesis de que la mayor de los puntos de acupuntura reconocidos coincide con tejidos que son capaces de inducir una intensa respuesta neurohumoral cuando se irritan. Entre éstos se incluyen nervios, complejos neurovasculares, aparatos tendinosos de Golgi y otros tejidos sensibles. La estimulación de estos tejidos podría causar irritación aguda e intensa que induce la activación de sistemas endógenos analgésicos, inmunitarios y conductuales-adaptativos, de lo que resulta la eficacia clínica de la acupuntura. Varios factores se han relacionado con la localización precisa de los puntos de acupuntura: • Los puntos se encuentran en un pequeño hueco o depresión en la superficie cutánea. • Los puntos de acupuntura suelen ser sensibles comparados con el área circundante y a menudo puede inducirse una respuesta (tal vez relacionada con malestar) mediante palpación profunda. Los pacientes humanos describen una sensación de dolor leve o entumecimiento que se irradia de manera circular por un mínimo de un centímetro cuando se presiona el punto. • Pueden reconocerse rugosidad o adhesividad subjetivas cuando un punto de acupuntura se frota levemente con el dedo. • Los pacientes humanos suelen percibir una sensación específica llamada sensación de-qi y el acupunturista percibe un cambio en la resistencia al movimiento de la aguja cuando ésta estimula un punto de acupuntura. En seres humanos, la sensación de-qi puede describirse como dolorimiento, entumecimiento, calor, pesantez o distensión alrededor de la zona en que se inserta una aguja. Algunas veces esta © Editorial El manual moderno Fotocopiar sin autorización es un delito. • Cada órgano tiene un meridiano correspondiente con puntos de acupuntura a lo largo de él. • Los meridianos discurren dentro del cuerpo y en su superficie y están conectados entre sí y con los órganos mediante una compleja red de conexiones colaterales accesorias. • La función de los meridianos es regular y modificar el órgano o grupo de órganos relacionados correspondiente. Los meridianos pueden controlar al parecer el dolor a lo largo de las zonas que recorren. Valoración del paciente y. . . 135 © Editorial El manual moderno Fotocopiar sin autorización es un delito. sensación se propaga a lo largo del trayecto del meridiano al cual pertenece el punto estimulado. Un practicante experimentado también siente tensión y alguna pesantez en los dedos cuando la aguja incide en el punto. Este cambio en la resistencia a la aguja, aunada a la reacción del animal a la colocación de la aguja, es la base de la mayoría de los acupunturistas veterinarios para deducir que se ha inducido la sensación de-qi. La mayoría de los acupunturistas que trabajan con personas o animales considera que la sensación de-qi es crucial para que la acupuntura tenga efecto. Las descripciones de diámetro y profundidad de los puntos de acupuntura varían entre las distintas especies. Por lo regular, el tamaño depende del punto individual, el estado del paciente, la hora del día y quizá la estación del año. La profundidad guarda relación con la cantidad de pelo del paciente, el grosor de la piel (p. ej., la piel delgada de los gatos en oposición a la piel gruesa de los garañones), la localización del punto y la duración de la enfermedad. En acupuntura veterinaria se presupone que la mayoría de los puntos de uso clínico en casi todas las especies se halla 3 a 15 mm debajo de la superficie de la piel. Estimulación de puntos La acupuntura china tradicional enseña que cada punto tiene funciones e indicaciones específicas para su uso. Por ejemplo, la estimulación de determinados puntos de acupuntura distantes de la fuente de dolor puede proporcionar analgesia, mientras que la estimulación de puntos mal seleccionados muy cerca de la fuente del dolor podría ser ineficaz o incluso agravar los síntomas. La estimulación de puntos de acupuntura específicos de sitio induce con frecuencia analgesia espacialmente restringida. Aunque este aspecto de la acupuntura no se ha estudiado lo suficiente, Benedetti y colaboradores demostraron que el placebo o la expectación por el tratamiento generan en personas una respuesta analgésica con presentación muy espacial, que se suprime por completo con la administración sistémica de naloxona. Estos datos indican que este tipo de respuesta analgésica es mediado por la liberación de opioides endógenos, pero que el efecto es regional más que sistémico. La acupuntura podría tener un mecanismo de acción similar. La especificidad puntual también fue objeto de análisis en un estudio de RMNf realizado por Cho y colaboradores, en el que se aplicó acupuntura de meridianos y fingida para la transmisión y percepción de dolor. La acupuntura de meridianos ejerció un control más profundo del dolor que la estimulación fingida de puntos, pero el efecto quizá no sea por completo específico del punto. La especificidad puntual, según lo señala la bibliografía sobre acupuntura tradicional y demostrada por la práctica clínica y algunos estudios experimentales, no se sustenta en grado suficiente en otros estudios y por lo tanto es todavía tema de controversia. Para cualquier especie tratada con acupuntura, sólo la investigación sistemática cuidadosa, con puntos de acupuntura específicos de sitio, órgano y función con selección cuidadosa de los puntos de acupuntura fingidos como controles, puede resolver esta cuestión. Mecanismos de acción analgésica A partir de la década de 1960, médicos chinos formados en occidente comenzaron a estudiar la analgesia por acupuntura, en particular los cambios fisiológicos en el SNC inducidos por acupuntura. Esta investigación, y la realizada después en países occidentales, dio por resultado el descubrimiento de varios mecanismos plausibles de la analgesia por acupuntura, receptores y opioides endógenos que intervienen en el proceso; a partir de estas publicaciones se formuló una hipótesis amplia de la analgesia por acupuntura. Desde entonces, estudios experimentales 136 Manual de anestesia y analgesia en. . en animales y estudios clínicos en personas han identificado numerosas respuestas clínicas y fisiológicas a la estimulación por acupuntura. Estimulación eléctrica La estimulación eléctrica de puntos de acupuntura (electroacupuntura) se desarrolló como una alternativa a la estimulación manual de puntos de acupuntura. La estimulación eléctrica tiene varias ventajas porque 1) es menos dolorosa que la estimulación manual, 2) requiere menos tiempo del practicante dedicado de modo directo al paciente, 3) proporciona mejor analgesia, y 4) facilita la estandarización. En la actualidad, la electroestimulación transcutánea y la percutánea son los tipos más comunes de analgesia por acupuntura en personas. En seres humanos, la sensación de-qi depende del tipo de estimulación por acupuntura. La estimulación manual produce sobre todo dolorimiento, plenitud y distensión, mientras que la electroacupuntura provoca por lo general hormigueo y entumecimiento. Aún no se evalúa el modo en que diversas modalidades de estimulación influyen en las redes encefálicas de las especies de compañía como perros y gatos. La electroacupuntura con estimulación de alta frecuencia (100 a 200 Hz) genera analgesia de inicio rápido no acumulativa que no puede bloquearse con naloxona. Este tipo de analgesia tal vez tenga la mediación de noradrenalina, serotonina y dinorfinas. En contraste, la estimulación de baja frecuencia (2 a 4 Hz) y frecuencia intermedia (15 a 30 Hz) produce un efecto analgésico que se revierte con naloxona (y por tanto existe un posible mediación de encefalinas y endorfinas), tiende a acumularse y dura al menos 1 h después de la cesación del tratamiento. Se ha informado que la antinocicepción inducida por estimulación de baja frecuencia es mediada por receptores © Editorial El manual moderno Fotocopiar sin autorización es un delito. Tipos de acupuntura Los métodos intracorporales (traumáticos) son la penetración de la piel con una aguja de acupuntura y ulterior estimulación manual de las agujas, aplicación de electricidad (electroacupuntura) o inserción crónica de agujas intradérmicas. Estos métodos se consideran “técnicas de aguja seca”. Es posible inyectar fármacos en los puntos de acupuntura, en la llamada acupuntura de aguja húmeda o acuapuntura. Entre los métodos no intracorporales (atraumáticos) están acupresión, estimulación eléctrica transcutánea, moxibustión y aplicación de diversos parches y comprimidos estimulantes. Dado que la teoría tradicional de la acupuntura se basa en el concepto de que las enfermedades son consecuencia de un desequilibrio del qi, el objetivo de la inserción de agujas es, en el contexto de la MTC, activar el qi excesivo o restituir el faltante. Estos dos objetivos pueden alcanzarse de varias maneras: aplicando agujas de diferentes diámetros o longitudes, usando agujas de diferentes materiales, cambiando el sentido de la inserción de las agujas, seleccionando diferentes puntos de estimulación, y otro más. Para la estimulación intensa se presupone que una aguja más grande, manipulación mayor de las agujas o dirección de la punta de la aguja contra el flujo hipotético de energía a lo largo del meridiano dispersan la energía excesiva, mientras que para la estimulación leve se recurre a una aguja más pequeña, inserción gentil y más superficial de la aguja o dirección de ésta hacia el flujo de energía a fin de reponer esta última. Es posible modificar las técnicas de estimulación manual para producir el efecto deseado mediante movimientos verticales enérgicos (arriba y abajo), rotación o vibración ligera, entre otros. Algunos practicantes consideran que seleccionar las maniobras y los puntos de acupuntura apropiados es la clave para inducir un efecto terapéutico satisfactorio. Valoración del paciente y. . . 137 de opioide m y d; la estimulación por electroacupuntura de alta frecuencia induce antinocicepción a través de receptores de opioide k; y la estimulación de frecuencia intermedia (p. ej., 30 Hz) induce antinocicepción mediada por los tres tipos de receptores de opioide. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Agujas La mayor parte de las agujas usadas en la acupuntura moderna es de acero inoxidable, aunque también se dispone de agujas de oro o plata. Casi siempre miden entre 1.3 y 12.7 cm de largo y su diámetro oscila entre los calibres 26 y 36. Tienen la punta redondeada y por tanto separan las fibras en vez de cortar tejidos. Por esta razón, incluso el sangrado capilar es raro en los sitios de acupuntura, a menos que una aguja penetre por accidente en un vaso. En el tratamiento de pacientes humanos se han diseñado agujas especiales para uso intradérmico y para acupuntura auricular y de pies y manos. Acupuntura veterinaria Es probable que la especie más tratada sea el perro, aunque en términos históricos la acupuntura de equinos se empleaba más porque los caballos eran importantes para la supervivencia diaria de las personas (algo similar ocurrió en la historia de la medicina veterinaria occidental). Los perros tienden a ser cooperadores y la mayoría se relaja durante el tratamiento. Si un animal se altera mucho es improbable que el tratamiento tenga el efecto deseado. Los problemas que más se atienden se relacionan con el aparato musculoesquelético. Es importante que los principiantes reconozcan que en muchos trastornos musculoesqueléticos (en especial afecciones degenerativas crónicas, incluida la enfermedad de disco intervertebral de grado bajo),, dolor y desuso fluctúan con frecuencia. Esto, aunado al efecto placebo, sugeriría que algunos de los pacientes tratados (ya sea con acupuntura o AINE) deben mejorar, al menos por un tiempo. Es necesario tener cuidado de no interpretar una respuesta positiva como adquisición de capacidades superiores para la MTC. Sin embargo, cierta evidencia científica respalda el uso de la acupuntura sola o con otros tratamientos occidentales, como los AINE. Otros usos comunes de la acupuntura en caninos son el tratamiento de los signos relacionados con enfermedad crónica, como cáncer, degeneración del sistema nervioso e insuficiencia orgánica, por ejemplo la insuficiencia renal crónica. A menos de que haya tejido funcional, es improbable que se revierta el avance de la enfermedad. La acupuntura no puede regenerar tejido de manera milagrosa. Deben explicarse a los propietarios los alcances de cada forma de tratamiento antes de administrarla. Se notifica a los propietarios acerca de las complicaciones y contraindicaciones del tratamiento. Las complicaciones de la acupuntura son raras, pero entre ellas se incluyen infección, traumatismo de tejidos u órganos y rotura de una aguja. Las agujas de acupuntura son en extremo flexibles y fuertes, de tal modo que su rotura es rara; es más común que se rompan agujas hipodérmicas. El comportamiento del animal puede cambiar después de los tratamientos, de tal modo que debe instruirse al propietario acerca lo que debe esperar. Algunos practicantes han sugerido que el tratamiento de acupuntura puede ser problemático en pacientes con cáncer. Es posible que éste se propague por el aumento del flujo sanguíneo y el traumatismo de las agujas. Sin embargo, muchas personas encuentran la acupuntura útil para el tratamiento sintomático de afecciones paraneoplásicas. El estrés y las respuestas fisiológicas relacionados con la acupuntura pueden causar descompensación en animales muy enfermos. Se sugiere que estos animales se traten al 138 Manual de anestesia y analgesia en. . principio de manera muy conservadora hasta que puedan tolerar un tratamiento más radical. No deben utilizarse implantes para estimulación crónica de puntos de acupuntura (p. ej., esferas de oro) cuando los animales se someten a exámenes con fines de compra (en especial caballos). Las esferas se identifican en las radiografías y muchas veces anticipan un diagnóstico de cojera preexistente. La preñez puede ser una contraindicación para la acupuntura, dado que es probable que la estimulación de puntos distales a codo y rodilla induzca el trabajo de parto. Preparación preoperatoria Los objetivos de la preparación preoperatoria con acupuntura son optimizar el estado del paciente, reducir la ansiedad preoperatoria e inducir la liberación de opioides endógenos para favorecer la analgesia. Una manera en que la acupuntura podría ayudar a la preparación preoperatoria es la inducción de relajación y sedación. Por ejemplo, Ekblom y colaboradores demostraron que si bien la acupuntura no produjo analgesia intraoperatoria y posoperatoria para cirugía dental en seres humanos, sí indujo relajación y somnolencia significativas. Ulett y colaboradores informan que la electroacupuntura de puntos típicos se relaciona con un efecto tranquilizador profundo. En personas, intensidad del dolor posoperatorio y consumo posoperatorio de analgésicos se correlacionan con la cantidad de ansiedad que los pacientes experimentan. Anestesia intraoperatoria asistida La reducción de la necesidad de anestésicos volátiles u opioides es un resultado de importancia clínica porque puede reducir el efecto toxico de los anestésicos y el tiempo hasta la recuperación. Las pruebas sugieren que el dolor tratado de manera inadecuada, incluso durante la anestesia general, activa vías nociceptivas. La liberación ulterior de mediadores locales ceba entonces el sistema nociceptivo y agrava el dolor posoperatorio. En la medida en que la acupuntura intraoperatoria inhibe la activación de vías nociceptivas y proporciona analgesia, de modo similar puede reducir el dolor posoperatorio y la necesidad de opioides posoperatorios. Es importante insistir en que la acupuntura no genera anestesia o inconsciencia verdaderas, ya que preserva todas las funciones sensitivas, motoras y proprioceptivas normales. No induce relajación muscular adecuada ni suprime reflejos neurovegetativos causados por dolor visceral intraabdominal. En cambio, la acupuntura produce analgesia y sedación siempre que los pacientes cooperen. Por estas razones, la acupuntura no puede recomendarse como una técnica anestésica aislada en animales. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Aplicación en el periodo perioperatorio La acupuntura perioperatoria y técnicas relacionadas se han recomendado para proporcionar sedación preoperatoria, reducir el uso intraoperatorio de opioides y aminorar el dolor posoperatorio. Existen pruebas concluyentes de que la acupuntura reduce la náusea y el vómito posoperatorios en pacientes humanos y se ha usado para abatir el vómito vinculado con la administración de opioides en perros. También estabiliza el funcionamiento cardiaco y atenúa algunos efectos adversos de anestesia y operación. La acupuntura perioperatoria puede dividirse en tres componentes: preparación preoperatoria, anestesia intraoperatoria asistida por acupuntura, y atención posoperatoria. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Valoración del paciente y. . . 139 Control del dolor posoperatorio La acupuntura y técnicas relacionadas pueden servir como coadyuvantes importantes para el control del dolor y aliviar los efectos adversos de los opioides en el periodo posoperatorio. Sin embargo, resultados controvertidos, diferencias de diseño entre estudios y modos diversos de estimulación de los puntos de acupuntura hacen difícil determinar la importancia clínica de la analgesia perioperatoria por acupuntura en una amplia gama de especies. Se han publicado en inglés pocos resultados de ensayos clínicos controlados aleatorizados sobre alivio del dolor posoperatorio por acupuntura. La interpretación de estos estudios disponibles es complicada porque el éxito de la acupuntura depende de numerosos factores, entre ellos la selección adecuada de los pacientes y el conocimiento y grado de capacidad del acupunturista. Como ya se dijo, en pacientes humanos la selección de puntos y el modo de estimulación son importantes para el éxito de la acupuntura en el alivio del dolor posoperatorio. En apariencia, diferentes componentes del dolor posoperatorio reaccionan a diferentes combinaciones de puntos de acupuntura. Los puntos shu de los órganos internos se localizan bilateralmente a 3 cm de la línea posterior en sentido lateral. Dichos puntos se relacionan con las vísceras y casi siempre se han usado para el tratamiento de enfermedades de órganos internos. La estimulación de estos puntos puede aliviar el dolor consecutivo a disfunción visceral. La estimulación nerviosa eléctrica transcutánea (ENET) cerca del sitio de incisión reduce en grado significativo el dolor posoperatorio. Sin embargo, este tratamiento es al parecer más eficaz para el componente cutáneo superficial del dolor posoperatorio y deja en gran medida intacto el componente visceral profundo del dolor. Parece probable que la ENET de alta frecuencia cerca del sitio de incisión estimule en mayor grado fibras nerviosas aferentes específicas en vez de inducir mecanismos de liberación de opioides endógenos. Por lo tanto, la combinación de ENET y estimulación de puntos shu relacionados con vísceras en el plan de tratamiento es promisoria para reducir respectivamente el dolor visceral superficial y el profundo posoperatorio. La electroacupuntura de alta y baja frecuencia en el punto Zusanli (ST 36) 20 min antes de la inducción de la anestesia reduce el consumo de morfina después de un procedimiento abdominal en personas. Por lo general, este punto se ha considerado eficaz para el tratamiento de trastornos abdominales. El grupo sometido a acupuntura de alta frecuencia experimentó una reducción de 61% del consumo de morfina mediante analgesia controlada por el paciente en 24 h. Los puntajes de dolor posoperatorio no difirieron en gran proporción entre los grupos, pero consumo acumulado de morfina por las primeras 24 h, número de demandas de analgesia controlada por el paciente e intervalo hasta la primera solicitud de analgésico tuvieron una mejora notoria en los grupos sometidos a electroacupuntura de alta y baja frecuencias. Los parámetros mencionados también mejoraron en el grupo que recibió acupuntura fingida respecto al grupo testigo (control), aunque no tanto como en los grupos tratados con acupuntura. Esto no es sorprendente, dado que la acupuntura fingida tiene al parecer un efecto analgésico en 40 a 50% de los pacientes contra 60 a 70% de la acupuntura real y 30 a 35% del placebo (control). La extrapolación o traducción de los resultados del ensayo clínico de seres humanos a animales es tema de controversia, aunque son plausibles respuestas y mecanismos de acción similares. El tratamiento de náusea y vómito posoperatorios es uno de los usos más comunes y más investigados de la acupuntura en pacientes humanos. Hasta la fecha, esta aplicación no se ha evaluado lo suficiente en animales durante el periodo perioperatorio. Es posible que la acupuntura 140 Manual de anestesia y analgesia en. . reduzca náusea y vómito mediante la liberación de endorfina b endógena en el líquido cefalorraquídeo o a través de un cambio en la transmisión por serotonina mediante activación de fibras serotoninérgicas y noradrenérgicas. Aún deben establecerse los mecanismos exactos. Reanimación cardiopulmonar En un estudio con 35 perros anestesiados con halotano, la acupuntura revirtió la depresión cardiovascular inducida por morfina y halotano. La acupuntura en el punto Jen Chung (GV 26) incrementó en grado significativo gasto cardiaco, volumen sistólico, frecuencia cardiaca, presión arterial media y presión del pulso, al mismo tiempo que redujo en gran medida la resistencia periférica total y presión venosa central. Los autores concluyeron que la estimulación del punto de acupuntura GV 26 podría ser útil para reanimar a pacientes cuyo aparato circulatorio está deprimido por opioides y anestésicos volátiles. GV 26 (también llamado Renzhong) se halla en la línea media del filtro nasal, a una tercera parte de la distancia desde la nariz hasta el borde del labio superior y en el centro de la línea horizontal que une el borde de las narinas. GV 26 tiene muchos usos clínicos, el mejor conocido de los cuales es su empleo en situaciones de urgencia (coma, choque, apnea, urgencias anestésicas, semiahogamiento, otras). En seres humanos se considera desde hace mucho tiempo que el punto Neiguan (P 6) es un punto principal para el tratamiento de diversas enfermedades cardiovasculares. Se ha demostrado que es eficaz como una modalidad terapéutica coadyuvante en el manejo conservador de la angina de pecho grave. La electroacupuntura en el punto Neiguan (P 6) fue eficaz para mantener la hemodinamia y la contractilidad cardiaca en perros anestesiados con el tórax abierto. Volumen sistólico y gasto cardiaco aumentaron un poco respecto del grupo testigo. Presión y elasticidad telesistólicas se elevaron en proporción notable en el grupo sometido a acupuntura en Neiguan (P 6). No hay datos análogos que apoyen beneficios cardiovasculares de la acupuntura en personas. Disfunción intestinal Un efecto secundario importante de la anestesia general y la administración de opioides para el control del dolor posoperatorio es el deterioro del funcionamiento intestinal. En la medida en que la acupuntura intraoperatoria y posoperatoria con fines de analgesia reduce el consumo perioperatorio de opioides, puede ser benéfica para acelerar la recuperación posoperatoria del funcionamiento intestinal. También se ha demostrado que el tratamiento con acupuntura promueve la recuperación de dicho funcionamiento después de operación abdominal en personas. Tratamiento de rehabilitación La rehabilitación de animales de compañía es un campo de crecimiento rápido encaminado a mejorar el cuidado de mantenimiento de pacientes veterinarios. En este entorno, la rehabilitación es en esencia similar a lo que se realiza en la profesión de la fisioterapia de personas. Al igual que la fisioterapia, la rehabilitación utiliza métodos físicos y mecánicos, como luz, calor, frío, © Editorial El manual moderno Fotocopiar sin autorización es un delito. Usos perioperatorios diversos Valoración del paciente y. . . 141 © Editorial El manual moderno Fotocopiar sin autorización es un delito. agua, electricidad, masaje y ejercicio para mejorar el funcionamiento y reducir dolor y morbilidad en diversas afecciones, como enfermedades ortopédicas y neurológicas. Otros términos de uso común para describir la rehabilitación son rehabilitación física, terapia física y fisioterapia. Dado que en ocasiones algunas técnicas causan dolor y molestias, los terapeutas deben estar preparados para administrar un analgésico apropiado. Se dispone de capacitación avanzada y certificación en rehabilitación para técnicos veterinarios, fisioterapeutas y veterinarios certificados. Los reglamentos de práctica varían de un lugar a otro, pero en la mayoría de los casos es necesario que la rehabilitación de animales sea supervisada y en algunos casos realizada por un veterinario. Hasta fecha reciente, la rehabilitación no había tenido una función importante en el tratamiento del dolor en medicina veterinaria. La atención posoperatoria estándar se ha concentrado en el cuidado de enfermería y de mantenimiento, confinamiento e intervención farmacéutica. Al incorporarse la rehabilitación en la atención de mantenimiento y el tratamiento del dolor, muchos pacientes se han recuperado en menos tiempo y de manera más completa de sucesos médicos, quirúrgicos y traumáticos. Sin embargo, hasta la fecha los beneficios de los tratamientos no medicamentosos en el control del dolor, incluidos los propios de la rehabilitación, se han documentado poco en la bibliografía veterinaria. De modo similar, los efectos analgésicos y los beneficios globales de tratamientos como acupuntura, electroacupuntura, acupresión y ENET están mal definidos. A pesar de la falta de pruebas científicas experimentales de su eficacia, la experiencia clínica en animales sugiere que el uso de tales modalidades terapéuticas junto con farmacoterapia puede ser benéfico. El resultado clínico deseado es un mejor control de las molestias y reducción de la necesidad global de fármacos para los pacientes. Modalidades terapéuticas Se aplican siete modalidades terapéuticas para reducir dolor e inflamación y estimular respuestas curativas normales en pacientes veterinarios: 1) hipotermia e hipertermia locales, 2) actividad de arcos de movimiento pasivos, 3) masaje, 4) ejercicio terapéutico, 5) hidroterapia, 6) ultrasonido, y 7) estimulación eléctrica. Hipotermia local El tratamiento de hipotermia local, o crioterapia, consiste en la aplicación de frío terapéutico a un tejido musculoesquelético. Entre las formas comunes de frío terapéutico se incluyen compresas de hielo y gel comerciales reutilizables, frazadas con agua fría en circulación continua, compresas y toallas frías caseras, masaje con hielo e hidroterapia con agua fría. La aplicación de hipotermia local está indicada en el periodo inmediatamente posterior a una lesión aguda (<72 h) para aminorar inflamación, irritación, dolor, tumefacción y edema. El principal mecanismo propuesto de acción de la crioterapia es la vasoconstricción, que reduce el flujo sanguíneo arterial y capilar, con lo que se minimiza el escape de líquido y edema. Dado que la crioterapia también reduce actividad enzimática y metabolismo en los tejidos, es eficaz contra la inflamación local en tejidos periarticulares y articulares. Se induce analgesia por modificación de la conducción nerviosa sensitiva y relajación del músculo esquelético. Los efectos enfriadores de la hipotermia local sobre tejidos más profundos son menos intensos, además de impredecibles, según sean el método de aplicación, la temperatura inicial de la zona 142 Manual de anestesia y analgesia en. . Hipertermia local En esta técnica se usa calor para promover la dilatación capilar y elevar la presión hidrostática capilar, permeabilidad y filtración. Los cambios celulares y vasculares producidos por el calor también estimulan la inflamación y promueven la reparación de heridas. Los tejidos tratados con hipertermia local aumentan su temperatura, lo cual da lugar a la liberación local de histamina al tiempo que favorece el metabolismo celular. El tratamiento con calor induce analgesia al incrementar el flujo sanguíneo y la permeabilidad capilar, reducir el edema, elevar el metabolismo local, aumentar la extensibilidad del colágeno en tejidos articulares y ligamentosos, y aminorar la tensión y el espasmo musculares, así como inducir relajación general. Entre las formas comunes de calor terapéutico empleadas en medicina veterinaria se incluyen la aplicación de compresas calientes, lámparas térmicas, toallas calientes, frazadas de agua tibia, ultrasonido terapéutico, tratamiento láser, baños de agua caliente circulante y unidades de hidroterapia. El protocolo terapéutico para el calor es similar al de la crioterapia, con duración de la aplicación de 15 a 20 min, dos a cuatro veces al día. Otros tipos de tratamiento térmico menos frecuentes son las fuentes de radiación incandescente, infrarroja, ultravioleta y de microondas, todas las cuales requieren equipo y adiestramiento especiales. Dado que el principal mecanismo de acción del tratamiento térmico es inflamatorio, la hipertermia local sólo debe usarse una vez que ha cedido la inflamación aguda, por lo regular 24 a 72 h después de la lesión o la operación. El tratamiento térmico está indicado para eliminar los mediadores inflamatorios y el edema presentes en los tejidos que rodean a la lesión. Es importante hacer notar que la hipertermia local tiene una estrecha ventana de temperatura terapéutica (40 a 45°C) y requiere vigilancia cuidadosa. Debe tenerse cautela de no aplicar calor de manera prematura después de una lesión traumática, dado que ello puede inducir fuga vascular, exacerbar la reacción inflamatoria, favorecer la formación de edema y seroma, y potenciar hemorragia y dolor. La hipertermia local tiene pocas indicaciones en el periodo posoperatorio inmediato y debe combinarse con otras formas de terapia física (masaje o ejercicio) en las últimas fases de la convalecencia (>72 h después de la intervención). El calor terapéutico también está contraindicado en pacientes con deterioro neurológico o vascular. Es posible la lesión nerviosa directa por hipertermia local y quemaduras, en especial con aplicación prolongada o uso de almohadillas calentadoras eléctricas. Actividad de arcos de movimiento pasivos El ejercicio de arcos de movimiento pasivos (ADMP) es el movimiento controlado de las extremidades y articulaciones en flexión, extensión, aducción y abducción por el terapeuta sin © Editorial El manual moderno Fotocopiar sin autorización es un delito. tratada y la duración del tratamiento. Con todo, la aplicación de hipotermia local debe limitarse a múltiples sesiones breves (5 a 15 min hasta cuatro veces al día) para prevenir vasodilatación refleja y edema. La crioterapia excesiva que causa un decremento de 10.0°C o más de la temperatura tisular puede provocar degradación de proteínas, hiperemia local, daño de epitelios y nervios, y atrofia y contractura musculares. El uso de hipotermia local debe evitarse en animales hipotérmicos. Si la temperatura central desciende aún más, pueden resultar vasoconstricción periférica e hipertensión arterial. Además, la crioterapia está contraindicada en personas (y se presupone que animales) con diabetes mellitus, lesiones isquémicas, vasculitis o heridas indolentes. Valoración del paciente y. . . 143 © Editorial El manual moderno Fotocopiar sin autorización es un delito. que el animal realice esfuerzo. Los objetivos de los ADMP son estirar y manipular las estructuras periarticulares del esqueleto apendicular a fin de mantener el arco de movimiento (ADM) normal, al tiempo que se previene la contractura de tejidos blandos y músculo. Ensayos experimentales en que se evaluaron los efectos de inmovilización prolongada y restricción del soporte de peso en cartílago canino revelan atrofia de condrocitos y deterioro de la matriz de mantenimiento, que en muchos casos es irreversible. Además de los beneficios directos para el cartílago, los ejercicios de ADMP mejoran el riego sanguíneo y la conciencia sensitiva de articulaciones y extremidades afectadas. Sin embargo, los ejercicios de ADMP no reemplazan el soporte de peso normal y los efectos superiores del movimiento activo voluntario. En comparación con el ADMP, el ejercicio activo produce cartílago de calidad superior, previene mejor la atrofia muscular, y mejora fuerza y resistencia musculares. El ejercicio de ADMP debe instituirse inmediatamente después de la operación y continuarse hasta que el paciente comience a ambular dentro de los límites normales. Si el animal tiene reducción de ADM, documentada por goniometría, los ejercicios de ADMP pueden prolongarse para mejorar el funcionamiento de la extremidad. Por lo generar, tales ejercicios se realizan con el animal en decúbito lateral relajado. Las articulaciones se flexionan o extienden hasta su punto extremo no doloroso y se mantienen así por 10 a 30 s, tras lo cual se devuelven a su posición normal o funcional de pie. Esto se repite en 10 a 15 ciclos completos de flexión y extensión. Debe tenerse cautela de no estirar en exceso los tejidos periarticulares, ya que los ejercicios de ADMP demasiado enérgicos pueden desgarrar la cápsula articular y los tejidos circundantes, y provocar dolor y formación de escara fibrosa no intencional. Entre las contraindicaciones para el uso de ejercicios de ADMP se incluyen fracturas inestables, luxaciones, hipermotilidad articular o injertos de piel. Masaje terapéutico Éste implica la manipulación manual o mecánica de tejidos blandos y músculo mediante fricción, amasado o golpeteo. Entre los beneficios del masaje sobresalen aumento de la circulación local, disminución del espasmo muscular, atenuación del edema, y desintegración de tejido cicatrizal irregular. El mecanismo de acción de esta técnica terapéutica se basa en efectos reflexivos y mecánicos. Los efectos reflexivos se deben a estimulación de receptores periféricos, que produce los efectos centrales de relajación al mismo tiempo que miorrelajación y dilatación arteriolar. Los efectos mecánicos se deben a aumento del drenaje linfático y venoso (que elimina edema y desechos metabólicos), mayor circulación arterial (que favorece la oxigenación tisular y la reparación de heridas), y manipulación de tejido conectivo restrictivo (que mejora el ADM y la movilidad). Las técnicas más comunes de masaje aplicadas en medicina veterinaria son roce, amasamiento, fibras cruzadas y palmoteo. El roce (en francés éffleurage, del latín effluere, “fluir hacia fuera”) es una forma de masaje de frotamiento superficial o ligero y se usa por lo general al principio de todas las sesiones de masaje para relajar y aclimatar al animal. El amasamiento se caracteriza por manipulación y compresión profundas de músculos y tejidos blandos circundantes. El masaje de fibras cruzadas también es profundo y se concentra a lo largo de líneas de tejido cicatrizal restrictivo y tiene el objetivo de promover el ADM normal. Este tipo de masaje posee uso limitado en medicina veterinaria porque requiere sedación del animal durante el tratamiento, y más a menudo exacerba de modo temporal la cojera debido a una respuesta inflamatoria a la manipulación del tejido. El palmoteo supone la manipulación y percusión de tejidos blandos 144 Manual de anestesia y analgesia en. . con una mano ahuecada o equipo de masaje especial, y las más de las veces se emplea para relajar la contracción muscular espástica o promover el drenaje postural en afecciones respiratorias. Entre las contraindicaciones al masaje terapéutico se incluyen fracturas o tejidos inestables o infectados y manipulación directa de cáncer. En la mayoría de los casos, el masaje es un tratamiento indispensable cuando los animales están en cuidados intensivos y tienen movilidad restringida. Rehabilitación acuática Entre las técnicas terapéuticas basadas en agua para pacientes veterinarios figuran masaje terapéutico local con agua tibia o fría, ejercicio en banda sinfín sumergida, y natación. El masaje en agua es en particular benéfico para los animales posoperados porque es un método eficaz para eliminar el linfedema de las extremidades. El tratamiento en agua también es relajante y eficaz para limpiar incisiones quirúrgicas. Puede emplearse hidroterapia en agua fría tan pronto como una incisión quirúrgica ha establecido un sello de fibrina, casi siempre en las 24 h siguientes a la operación. Esta forma de hidroterapia es un método de rehabilitación de tecnología relativamente baja y alto rendimiento que requiere poco equipo, además de una bañera y una manguera. Aumentar la profundidad del agua y la temperatura a 30 a 32°C proporciona un ambiente de baja gravedad que es ideal para realizar ejercicio asistido activo sin concusión, por ejemplo banda sinfín sumergida y natación. Las propiedades naturales del agua proporcionan flotabilidad y resistencia, que pueden manipularse para mejorar movilidad de las extremidades, ADM articular, marcha y cadencia. Debe tenerse cautela con cualquier ejercicio acuático, a fin de minimizar el riesgo de aspiración o ahogamiento. Es aconsejable aclimatar a los animales al agua antes de iniciar cualquier régimen terapéutico. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Ejercicio terapéutico La posibilidad de falla catastrófica por actividad descontrolada había limitado el lugar del ejercicio terapéutico en la recuperación de pacientes veterinarios, en particular en el posoperatorio de intervenciones ortopédicas. Sin embargo, el ejercicio terapéutico activo controlado puede realizarse de manera segura en la mayoría de los casos, incluidos los ortopédicos, cuando es asistido y vigilado por el terapeuta o el propietario. Los beneficios del ejercicio terapéutico son numerosos. Ayuda a conferir fuerza, masa muscular, agilidad, coordinación y salud cardiovascular. Además, el ejercicio terapéutico puede utilizarse como una medida preventiva para mejorar la salud general, reducir la obesidad y mejorar el desempeño en todos los pacientes veterinarios. Antes de iniciar el tratamiento, todos los animales deben evaluarse y valorarse de manera exhaustiva, dado que es imperativo ajustar la intensidad de las actividades al grado de funcionamiento y capacidad del animal. En el repertorio de ejercicios activos controlados se encuentran incorporarse con ayuda, caminar en una situación facilitada, sentarse y acostarse de manera prolongada, momentánea y repetitiva, subir y bajar escaleras, caminar en pendientes y colinas, y desplazar peso. Cuando se realizan de manera apropiada y en consulta con el médico veterinario o cirujano de atención primaria, estas actividades pueden realizarse en una fase temprana del periodo de recuperación posoperatoria, así como modificarse e intensificarse para promover la aptitud cardiovascular y musculoesquelética. Valoración del paciente y. . . 145 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Ultrasonido terapéutico El método de acción del ultrasonido terapéutico se basa en el suministro de energía a los tejidos en la forma de vibraciones acústicas. Las ondas sónicas pueden producir calor fisiológico e inflamación celular. Los efectos fisiológicos netos del ultrasonido pueden dividirse en dos categorías: térmicos y no térmicos. Los efectos térmicos del ultrasonido incrementan la extensibilidad del tejido conectivo y la vascularidad, y aportan una forma de bloqueo nervioso temporal, con lo que promueven la relajación muscular y el alivio del dolor. Los efectos no térmicos del ultrasonido incluyen aceleración y compresión de la fase inflamatoria de la curación; aumento de la circulación local; disminución del edema; elevación de endorfinas, encefalinas y serotonina; y estimulación de la síntesis de colágeno y el crecimiento óseo. El ultrasonido terapéutico está indicado en mayor medida en el tratamiento del tejido cicatrizal crónico y las úlceras por decúbito indolentes. También puede ser eficaz para paliar espasmos musculares y favorecer la curación tendinosa. Entre las contraindicaciones para el uso del ultrasonido terapéutico se incluyen infección o inflamación tisulares. Antes de su aplicación, el ultrasonido terapéutico debe investigarse de manera exhaustiva porque existe una amplia variedad de modos de suministro de onda continua o pulsátil, intensidades de onda, y regímenes terapéuticos entre los cuales elegir. Las complicaciones se relacionan con inexperiencia del operador y errores que pueden provocar calor excesivo, radicales libres y ulterior destrucción tisular. Estimulación eléctrica Ésta implica el suministro de corriente eléctrica a una zona de tratamiento seleccionada. Algunos usos comunes de la estimulación eléctrica son reeducación muscular, paliación de dolor y reducción de edema. Existe una variedad de formas de onda y dispositivos disponibles, que varían en costo y versatilidad. La nomenclatura es bastante confusa y hace poco por mejorar la comprensión de los fundamentos de la estimulación eléctrica. Sin embargo, en esencia hay dos formas: estimulación eléctrica neuromuscular (EENM) y ENET. La EENM está indicada en animales con trastornos neurológicos, debilitados, postrados o inmovilizados o que necesitan inmovilidad articular prolongada. Previene la atrofia por desuso y mejora el desempeño de la extremidad al convocar fibras contráctiles e incrementar la fuerza de contracción máxima de los músculos afectados. El dispositivo de estimulación eléctrica consiste en un generador de pulsos simple y electrodos, que se colocan sobre grupos musculares debilitados o paralizados seleccionados para crear una contracción artificial. Amplitud de pulsos, frecuencia y duración del ciclo pueden variarse para comodidad del paciente. También pueden reducirse dolor muscular y edema por mejoría del flujo sanguíneo. La combinación de estimulación neuromuscular y ejercicios de ADMP mejora el ADM articular y previene la contractura muscular, y está indicada en particular en fracturas de la parte distal del fémur de perros jóvenes. Esta técnica ha sido eficaz para promover la reeducación muscular después de desuso prolongado. La ENET se ha usado de forma amplia para identificar estimuladores neurales que modifican el dolor. En la estimulación eléctrica para modificar la sensación de dolor se aplica una corriente eléctrica a un nervio sensitivo. Se han sugerido muchos posibles mecanismos causantes de la modificación de la sensación dolorosa: teoría del control por compuerta, en el que participa la mayor actividad de las aferentes sensitivas para causar inhibición presináptica de la transmisión; liberación de un opiáceo endógeno; teoría del contrairritante; y efecto placebo. En la mayoría 146 Manual de anestesia y analgesia en. . © Editorial El manual moderno Fotocopiar sin autorización es un delito. de los pacientes, la percepción alterada del dolor por ENET se debe en parte tal vez a todos los mecanismos mencionados. La ENET debe considerarse una modalidad analgésica coadyuvante y combinarse con otras técnicas de tratamiento del dolor en vez de emplearse de manera aislada con este fin. Revisado a partir de “Pain and Its Management” por Peter W. Hellyer, Sheilah A. Robertson y Anna D. Fails; “Opioids, Nonsteroidal Anti-inflammatories, and Analgesic Adjuvants” por Leigh A. Lamont y Karol A. Mathews; “Acupuncture” por Roman T. Skarda y Maria Glowaski; y “Rehabilitation and Palliative Analgesia” por Dianne Dunning y Duncan X. Lascelles en Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 4 Tratamiento del dolor crónico Duncan X. Lascelles y James S. Gaynor Consideraciones generales Si bien en años recientes los veterinarios han reconocido la importancia del tratamiento del dolor perioperatorio agudo en perros y gatos, el tratamiento del dolor crónico se ha rezagado. Entre las barreras para controlar de modo eficaz el dolor crónico en animales figuran las siguientes: • Nulo reconocimiento de que muchos procesos patológicos crónicos y cánceres se vinculan con dolor intenso (cuadro 4-1). • Incapacidad de valorar el dolor crónico en perros y gatos. • Desconocimiento de fármacos, farmacoterapia y otras técnicas analgésicas. • Falta de comunicación con los clientes y participación de éstos en las fases de valoración y tratamiento. • Subutilización del personal de enfermería para valorar y revalorar el dolor en pacientes hospitalizados. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Existen cuatro pasos principales para superar estas barreras y garantizar la optimización del tratamiento del dolor crónico en pacientes veterinarios: 1. Asegurarse de que los veterinarios tengan la formación y el adiestramiento apropiados acerca de la importancia de la analgesia, cuantificación del dolor, fármacos disponibles, complicaciones potenciales y técnicas intervencionistas. 2. Asesorar al cliente en relación con las expectativas realistas sobre el control del dolor y la calidad de vida, y transmitir el principio de que en la mayoría de los pacientes el dolor puede tratarse. Esto implica indicarle al cliente que su participación para valorar a la mascota y dar retroalimentación sobre el tratamiento es crucial para el éxito. Tanto el veterinario como el propietario deben participar en el desarrollo de medidas eficaces para atenuar el dolor. La participación del cliente también ayuda a reducir la desesperanza. 3. Valorar de manera exhaustiva el dolor de la mascota al comienzo y durante el tratamiento, no sólo cuando se intensifica. 4. Contar con buen apoyo de la comunidad veterinaria o la institución para administrar opioides y otras sustancias controladas. Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 147 148 Manual de anestesia y analgesia en. . Cuadro 4-1. Trastornos comunes que pueden provocar dolor crónico en perros y gatos Trastorno Cáncer Ejemplos • • • • • Osteosarcoma Condrosarcoma Tumor de vaina nerviosa Tumor de médula espinal Carcinoma de células de transición Inflamación/lesión de tejidos blan- • Otitis media e interna dos • Lesión de desprendimiento traumático de la piel de las patas • Lesión inducida por radioterapia Inflamación/lesión musculoesque- • Artrosis coxofemoral, de rodilla, codo y hombro léticas • Artrosis espinal (espondilosis) • Rotura del ligamento cruzado • Luxación de rótula(s) Inflamación/lesión viscerales • Pancreatitis • Cistitis Enfermedad dental • Lesiones por resorción odontoclástica de los felinos • Estomatitis • Gingivitis Enfermedad ocular • Glaucoma Aunque el tratamiento farmacológico es una piedra angular del control del dolor crónico, las terapias no medicamentosas coadyuvantes, como la acupuntura, pueden tener una función terapéutica importante. Debe recordarse también que la operación es una modalidad de tratamiento fundamental para muchos tipos de dolor crónico y que la radioterapia es útil para el tratamiento o la paliación de la enfermedad neoplásica. Un acercamiento básico al tratamiento del dolor crónico puede resumirse como sigue: 1. Valorar el dolor. Preguntar al propietario acerca de sus percepciones del dolor de la mascota o cualquier factor que afecte su calidad de vida. 2. Confiar en el propietario. Éste ve a la mascota todos los días en su propio ambiente y sabe cuándo ocurren cambios de comportamiento. Los propietarios rara vez sugieren un diagnóstico, pero saben cuándo hay un problema. El veterinario debe familiarizarse con la terminología que el cliente emplea para explicar las conductas anormales de la mascota, a fin de establecer un grado de comunicación para continuar la evaluación en el ambiente doméstico una vez que se inicia el tratamiento. 3. Elegir el tratamiento apropiado de acuerdo con la etapa de la enfermedad. Cualquier dolor, con excepción del leve, debe tratarse con más de una clase de analgésico o con un analgésico combinado con tratamiento coadyuvante no farmacológico. Es preciso considerar también problemas concurrentes y farmacoterapia, además de tener presentes interacciones medicamentosas potenciales y efectos tóxicos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Inflamación/lesión de tejido ner- • Enfermedad de disco intervertebral cervical, torácico, lumbar vioso • Posamputación (extremidad fantasma) • Postoracotomía Tratamiento del dolor crónico 149 4. Suministrar el tratamiento de manera lógica y coordinada y explicar de forma detallada al propietario cualesquiera efectos adversos posibles. 5. Alentar a los clientes para que participen de manera activa en el tratamiento de su mascota; solicitar retroalimentación y actualizaciones sobre los efectos del tratamiento. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Importancia de aliviar el dolor El alivio del dolor es importante desde los puntos de vista fisiológico y biológico, así como en términos éticos. El dolor puede inducir en los pacientes una respuesta de estrés que se relaciona con elevaciones de corticotropina (hormona adrenocorticotrópica), cortisol, hormona antidiurética (vasopresina), catecolaminas, aldosterona, renina, angiotensina II y glucosa, así como decrementos de insulina y testosterona. Una respuesta al estrés prolongada puede reducir la rapidez de la curación. Además, la reacción al estrés puede afectar los aparatos circulatorio y respiratorio, la homeostasis de líquidos y el funcionamiento del tubo digestivo. Los veterinarios tienen la obligación ética de tratar el dolor en animales. La mayoría de los casos de tratamiento insuficiente del dolor crónico se debe tal vez a falta de conocimiento y recursos adecuados, más que a la falta de interés. Es importante manifestar interés por la mascota y la familia a fin de demostrar un enfoque basado en vínculos para el tratamiento crónico y el manejo del dolor. Es esencial que el veterinario promueva una buena comunicación en relación con el tratamiento primario y la analgesia, y que al mismo tiempo demuestre empatía al propietario. En especial en pacientes con cáncer, la prevención y el tratamiento del dolor no son los únicos aspectos que inciden en el bienestar del animal, y los veterinarios deben evaluar todos los componentes del bienestar cuando toman decisiones terapéuticas. Se han sugerido cinco consideraciones en la valoración del bienestar de un animal (cuadro 4-2). El enfoque en el tratamiento del dolor crónico en perros y gatos debe tomar en cuenta todos los aspectos del bienestar. Para cada libertad deben intensidad, incidencia y duración de la alteración. En el caso del dolor, cuando mayor sea la duración, como en los cánceres dolorosos prolongados, tanto mayor se verá afectado el bienestar. Sobresale especial interés el hecho de que el suministro de analgésicos reduce en grado significativo los efectos tumorígenos de someterse a una resección y recuperarse de ella. La operación suprime varias funciones inmunitarias, como la actividad de células citolíticas naturales (CN) en animales y personas, tal vez como resultado de sustancias liberadas, como catecolaminas y prostaglandinas. Esta supresión de la actividad de células CN puede favorecer las metástasis. Al parecer, la reducción de los efectos tumorígenos de la intervención quirúrgica mediante analgésicos se debe a la corrección de las reducciones de la actividad de células CN inducidas por el dolor, Cuadro 4-2. Las cinco consideraciones para la valoración del bienestar animal Falta de hambre y sed Ausencia de incomodidad física y térmica Sin dolor, lesión y enfermedad Capacidad de expresar conductas normales Ausencia de temor y malestar 150 Manual de anestesia y analgesia en. . pero es probable que también intervengan factores aún no identificados, además de las células inmunitarias. Por lo tanto, el control apropiado del dolor perioperatorio en la cirugía oncológica puede proteger a los pacientes clínicos contra secuelas metastásicas. El tratamiento mismo del dolor podría proteger contra metástasis y tal vez la propagación local del cáncer. Valoración del dolor crónico La valoración del dolor en animales puede ser difícil y frustrante. La tolerancia al dolor en pacientes veterinarios tal vez varía demasiado entre un individuo y otro, como ocurre en seres humanos. Si se agrega la capacidad innata de perros (y sobre todo de gatos) de ocultar en grado significativo enfermedad y dolor, la tarea se torna aún más desafiante. Con frecuencia, los veterinarios dependen de la experiencia del propietario de una mascota para determinar el grado de dolor de los animales. La base de la valoración del dolor crónico en gatos y perros es el reconocimiento de los cambios del comportamiento. En el cuadro 4-3 se delinean conductas que son indicativas de dolor. El punto principal que debe recordarse es que cualquier cambio de comportamiento Conductas que pueden relacionarse con dolor crónico en perros y gatos Conducta Comentarios Actividad • Menor actividad de lo normal • Pueden cambiar actividades muy específicas: disminución de salto, juego, salidas, disposición a salir a caminar (perros) • Marcha rígida, marcha anormal o cojera pueden relacionarse con dolor general, pero más a menudo con dolor apendicular o del aparato musculoesquelético axial • Lentitud para levantarse y moverse después del reposo Hambre • A menudo disminuida Actitud • Agresión, embotamiento, timidez, apego excesivo, aumento de la dependencia, otros. Expresión facial • Cabeza gacha, estrabismo (gatos) • Cabeza baja, expresión triste (perros) Acicalamiento • La falta de acicalamiento puede deberse a dolor generalizado Respuesta a la palpa- • La palpación o manipulación de la zona afectada exacerba temporalción mente el dolor de grado bajo e induce una respuesta de aversión (como intentos de escapar, aullidos, gemidos, siseos, mordeduras) Respiración • La frecuencia respiratoria puede elevarse con el dolor intenso Lesiones autoinfligidas • Lamedura de una zona afectada (como articulación, hueso o abdomen) • Rascadura de una lesión cutánea o mordedura del flanco en caso de dolor prostático o colónico • También puede observarse en caso de dolor neuropático o referido Excreción urinaria y • No usar el arenero (gatos) • Micción y defecación dentro de casa (perros) fecal Vocalización • Gemidos, gruñidos, gemidos (perros) • Siseo, maullido espontáneo, gruñido (gatos) © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 4-3. Tratamiento del dolor crónico 151 puede relacionarse con dolor. Los veterinarios también deben permitir a los técnicos y otros miembros del personal participar en la valoración. Estas personas suelen estar mejor capacitadas para precisar dolor y calidad de vida en animales porque pasan más tiempo con los pacientes en el hospital. En consecuencia, es más probable que ellos sean capaces de conversar de manera relajada e informal con los propietarios. La persona mejor capacitada y más importante en la valoración del comportamiento de un animal es el propietario. Muchas veces, los propietarios deben recibir orientación acerca de los signos que deben buscar o las conductas que pueden ser indicativas de dolor. Una vez que es posible identificar y registrar cambios del comportamiento específicos, éstos pueden usarse para vigilar la eficacia del tratamiento analgésico. Este método ha sido muy sensible para valorar el dolor crónico por artrosis. En casos en que el dolor no induce un cambio conductual específico y sólo se observan signos vagos, el propietario es aún el más indicado para determinar el dolor o la calidad de vida de la mascota. La retroalimentación proporcionada por el cliente también puede emplearse como un indicador de la eficacia y la propiedad del tratamiento. Se ha demostrado que variables fisiológicas como frecuencia cardiaca, frecuencia respiratoria, temperatura y tamaño pupilar son medidas poco confiables del dolor perioperatorio agudo en perros, y por tanto es improbable que revistan utilidad en pacientes con dolor crónico. Principios de alivio del dolor crónico © Editorial El manual moderno Fotocopiar sin autorización es un delito. La base del tratamiento del dolor crónico son fármacos, aunque se reconoce la importancia creciente de algunas terapias coadyuvantes no medicamentosas. La Organización Mundial de la Salud (OMS) ha delineado un método general para el tratamiento del dolor crónico por cáncer basado en el uso de los siguientes grupos de analgésicos: 1) no opioides (p. ej., antiinflamatorios no esteroideos [AINE] y paracetamol), 2) opioides débiles (p. ej., codeína), 3) opioides fuertes Opioide fuerte ± no opioide ± coadyuvantes Opioide débil ± no opioide ± coadyuvantes No opioide ± coadyuvantes DOLOR LEVE DOLOR CRÓNICO (el dolor persiste o aumenta) DOLOR INTENSO Figura 4-1. “Escalera analgésica” de la OMS para el tratamiento del dolor por cáncer en seres humanos. (p. ej., morfina); y 4) fármacos coadyuvantes (p. ej., corticoesteroides, antidepresivos tricíclicos, anticonvulsivos y antagonistas de N-metil-d-aspartato [NMDA]). El método general de la escalera de la OMS es una jerarquía de tres pasos (figura 4-1). Dentro de la misma categoría de fármacos puede haber diferentes efectos secundarios para los individuos. Por lo tanto, si es posible, tal vez sea mejor sustituir fármacos dentro de una categoría antes de cambiar de tratamiento. Siempre es mejor mantener la dosificación tan simple como sea posible. Cuanto más complicado sea el régimen, tanto más probable es el incumplimiento del propietario. Los fármacos deben administrarse con regularidad, no sólo cuando el dolor se torna moderado a intenso. La analgesia continua facilita el mantenimiento de la comodidad del paciente. A continuación pueden suministrarse dosis adicionales de analgésicos cuando el dolor adquiere más intensidad de manera intermitente. Es posible usar fármacos coadyuvantes para ayudar en aspectos fisiopatológicos específicos de dolor y ansiedad. Existen dos problemas potenciales con la utilización de la escalera analgésica de la OMS en medicina veterinaria. Primero, existe muy poca información de la medicina humana y virtualmente ninguna de la medicina veterinaria acerca de los fármacos que son más eficaces para un tipo particular de dolor crónico. Es probable que los fármacos del tercer escalón sean los más eficaces para un estado de dolor crónico particular. Muchas mascotas no son llevadas al veterinario sino hasta que se encuentran en una fase avanzada de enfermedad y por tanto sufren dolor intenso. Una vez que el dolor ha estado presente por un periodo prolongado, es posible que ya hayan ocurrido cambios en el sistema nervioso central (SNC) que alteran el modo de procesar las señales de dolor. Esta alteración del procesamiento (llamada sensibilización central) hace menos eficaces a los anestésicos tradicionales y requiere el uso simultáneo de múltiples clases de fármacos para minimizar el dolor. Esto se conoce como tratamiento analgésico multimodal. Una vez que el dolor se atenúa y se atienden los cambios centrales, pueden interrumpirse algunos fármacos. Este enfoque se ha denominado “método de la pirámide analgésica invertida”. En la actualidad se desconoce cuál de los dos acercamientos (la escalera de la OMS o la pirámide invertida) es más apropiado y, en realidad, uno puede ser mejor en una fase de la enfermedad y el otro en una fase posterior. El aspecto más importante del tratamiento del dolor crónico es que, en la mayor parte de las situaciones, se requiere el enfoque multimodal (el empleo concurrente de más de una clase de fármaco o modalidad física) para el alivio exitoso del dolor. AINE Por muchos años, los AINE han sido la base del tratamiento del dolor crónico en medicina veterinaria, en especial para la artrosis. Para el dolor crónico, la variedad de AINE disponibles puede ser abrumadora, pero no deben perderse de vista algunos puntos clave. En términos de población, todos los AINE tienen en apariencia la misma eficacia para mitigar el dolor relacionado con la artrosis, pero para un paciente particular un fármaco puede ser más eficaz que otro. Tal vez esto reviste especial relevancia para el dolor por cáncer, en el cual los mecanismos del dolor pueden variar en grado notable entre un paciente y otro. En pacientes humanos, los efectos secundarios gastrointestinales (GI) del uso de AINE parecen ser más comunes con fármacos que bloquean de modo preferencial la ciclooxigenasa 1 (COX-1) sobre la ciclooxigenasa 2 (COX-2), aunque los fármacos que inhiben la COX-2 tienen el potencial © Editorial El manual moderno Fotocopiar sin autorización es un delito. 152 Manual de anestesia y analgesia en. . Tratamiento del dolor crónico 153 de exacerbar la lesión GI cuando hay afectación preexistente. Esto se debe a la inhibición de una función favorable que la enzima COX-2 tiene probablemente en la curación del tubo digestivo. Aún se analizan en la farmacología veterinaria las implicaciones de la selectividad de COX y su relación con efectos secundarios GI. No hay casi nunca diferencia en los efectos tóxicos renales entre fármacos selectivos de COX-1 y COX-2. Unos y otros se expresan de manera constitutiva en el riñón. Los efectos hepatotóxicos de los AINE son un suceso idiosincrásico que puede ocurrir con cualquier AINE. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vigilancia del tratamiento con AINE Si el AINE elegido es eficaz y no produce efectos adversos significativos debe continuarse. En caso contrario, puede cambiarse por otro AINE siempre que el animal no haya experimentado un efecto adverso grave (como sangrado GI, hiperazoemia o hepatopatía). Si aparece cualquier efecto tóxico, el paciente debe ser evaluado de manera cuidadosa y ponderarse los beneficios de continuar el tratamiento con AINE contra la posibilidad de precipitar más efectos adversos. Cambiar el tratamiento a otra clase de fármacos (como opioides) puede ser la medida más segura si la tolerancia del paciente a los AINE es baja. Si se elige otro AINE, el paciente debe vigilarse de cerca en busca de efectos tóxicos. Esto implica informar al propietario sobre el potencial de causar más efectos tóxicos y los signos que exigen atención, como letargo, anorexia, depresión, vómito, melena y mayor ingestión de agua. También deben realizarse análisis periódicos de sangre (y orina) para evaluar el estado renal (urea, creatinina y densidad relativa urinaria) y hepático (fosfatasa alcalina y alanina aminotransferasa y, si estas enzimas están elevadas, ácidos biliares). Deben obtenerse valores de referencia cuando se inicia el tratamiento con AINE y vigilar los parámetros en lo sucesivo con regularidad. La revaloración se efectúa con más frecuencia si se administran múltiples fármacos. Se dispone de poca información sobre el potencial de efectos tóxicos clínicos cuando se prescriben de manera crónica combinaciones de analgésicos. AINE en gatos Los gatos tienen tiempos más largos pero más variables e inconsistentes de biotransformación y excreción de AINE en comparación con otras especies. La mayor parte de los estudios de cinética realizados en gatos se ha referido a dosis únicas. Dado que casi todos los AINE tienen semivida relativamente larga en gatos, es probable que la administración crónica a la dosificación y la frecuencia descritas para perros sea más peligrosa en gatos que en caninos. El meloxicam es el único AINE indicado para uso crónico en gatos (y sólo en la Unión Europea), a una dosis de 0.05 mg/kg VO cada 24 h. Dosis menores pueden inducir mejorías clínicas en muchos gatos. Debe señalarse que en EUA existe una advertencia indicada en letras negritas específica que advierte contra más de una inyección de meloxicam en gatos. Una medida para minimizar el riesgo relacionado con el uso crónico de AINE en gatos consiste en individualizar la dosificación y emplear la dosis más pequeña que resulte eficaz o ampliar el intervalo de dosificación respecto al de otras especies. Algunos gatos metabolizan el fármaco con rapidez y requieren dosificación más frecuente, mientras que otros lo acumulan a concentraciones tóxicas, a menos que el intervalo de dosificación se incremente o la dosis se reduzca. Esto parece en particular cierto en el caso del carprofeno. Los gatos son más propensos a los efectos tóxicos de los AINE que los perros; por lo tanto, es probable que deban analizarse sangre y orina incluso con mayor frecuencia de la recomendada para perros. 154 Manual de anestesia y analgesia en. . Otros analgésicos Si no se obtiene un alivio adecuado del dolor con AINE, pueden administrarse opioides orales como morfina o tramadol. También es posible utilizar parches transdérmicos de fentanilo o buprenorfina. Fentanilo, morfina o tramadol pueden emplearse en perros que no deben recibir AINE, aunque los efectos adversos son casi siempre más comunes. El paracetamol se ha suministrado junto con AINE (excepto en gatos), aunque no existen datos de seguridad del uso combinado. Otros compuestos para tratar el dolor crónico son amantadina (un antagonista de NMDA); anticonvulsivos, como gabapentina; y antidepresivos tricíclicos, como amitriptilina. Cada uno de éstos se ha combinado con AINE. Opioides Muchos veterinarios no están familiarizados con el uso de opioides fuera del periodo perioperatorio, pero éstos pueden ser una parte muy eficaz de un enfoque multimodal. Entre los efectos adversos de los opioides pueden incluirse cambios conductuales, diarrea, vómito, sedación ocasional, retención urinaria y estreñimiento con el uso prolongado. En apariencia, los propietarios rechazan más la retención urinaria, estreñimiento y la sedación. Esto es en particular problemático con la administración de morfina oral. Los opioides utilizados con más frecuencia en clínica para aliviar el dolor crónico por cáncer son morfina oral, fentanilo transdérmico, butorfanol oral, buprenorfina transmucosa y codeína oral. En fechas recientes se ha usado oxicodona para controlar el dolor intenso por cáncer en perros. Ninguno de estos fármacos se ha evaluado de manera completa en cuanto a toxicidad clínica o eficacia del alivio del dolor crónico. Es importante advertir que la dosificación debe realizarse de manera individual, y que el ajuste de la dosis para producir analgesia sin efectos secundarios indeseables requiere excelente comunicación con los clientes. Estudios recientes indican que determinados preparados orales de liberación sostenida de morfina y metadona podrían no alcanzar concentraciones plasmáticas eficaces en perros cuando se administran en las dosis que se recomiendan en la actualidad. Queda mucho trabajo por hacer para avaluar mejor la eficacia y seguridad de los opioides orales a largo plazo en perros. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Paracetamol El paracetamol es un AINE no ácido, aunque muchos farmacólogos no lo consideran un antiinflamatorio porque actúa por mecanismos distintos de los propios de la mayoría de los AINE que se comercializan en la actualidad. Aunque su mecanismo de acción se comprende mal, es probable que actúe sobre una variante de la enzima ciclooxigenasa (ciclooxigenasa 3 [COX-3]), que se encuentra en el tejido del SNC del perro. Con cualquier tipo de dolor crónico siempre son posibles los cambios en el SNC, de tal modo que los analgésicos de acción central pueden ser muy eficaces para un posible problema periférico. Si bien es muy tóxico en gatos, incluso en pequeñas cantidades, el paracetamol puede prescribirse de manera eficaz para controlar el dolor en perros. No se han realizado estudios sobre efectos tóxicos en éstos, pero si se los observa es probable que afecten el hígado. En consecuencia, el fármaco debe usarse con cautela en caninos con disfunción hepática. Puede emplearse solo o combinado con codeína y su dosis inicial es de 10 a 15 mg/kg VO cada 12 h. Los autores lo administran a menudo como tratamiento analgésico de primera línea en perros con afección renal, en los cuales no pueden emplearse AINE, o en perros que parecen ser susceptibles a los efectos secundarios digestivos de los AINE. Tratamiento del dolor crónico 155 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Uso de opioides en gatos En la actualidad no se dispone de información sobre el empleo a largo plazo de opioides orales para dolor crónico en gatos. Resulta interesante el hecho de que existe al parecer considerable variación individual en el grado de analgesia obtenido con determinados opioides, en especial morfina y butorfanol, en situaciones agudas. La buprenorfina produce analgesia predecible por vía sublingual en gatos. El uso de la vía sublingual tiene como resultado una biodisponibilidad cercana al 100% en gatos, tal vez a consecuencia de diferencias de ionización en el ambiente alcalino (pH 8 a 9) de la boca de esta especie en comparación con la del ser humano (pH 6.5 a 7.0). La administración sublingual de buprenorfina aceptada bien por gatos sin renuencia ni salivación, de tal modo que no es necesario mezclar la solución inyectable. El pequeño volumen requerido hace simple la administración. Con base en la realimentación clínica de los propietarios, se trata de una técnica muy aceptable para que ellos la realicen en casa. Sin embargo, es posible la inapetencia después de varios días de tratamiento. Este problema suele superarse con dosis ligeramente menores. Cuando se administra junto con otros fármacos, todo lo que se requiere al parecer para minimizar el potencial de efectos adversos son intervalos de dosificación más largos. Antagonistas de NMDA Dado que el receptor de NMDA es en apariencia importante para la inducción y el mantenimiento de la sensibilización central, el uso de antagonistas del receptor de NMDA puede tener ventajas cuando se ha establecido sensibilización central. Ketamina, tiletamina, dextrometorfano, amantadina y metadona tienen propiedades de antagonistas de NMDA, entre otras acciones. La ketamina no es útil para el tratamiento del dolor crónico en la formulación inyectable que se comercializa en la actualidad. No obstante, la ketamina en microdosis intraoperatoria tiene al parecer efectos benéficos en diversas intervenciones quirúrgicas, incluidas las amputaciones de extremidades, y puede reducir la incidencia de dolor crónico después de la operación. Otras publicaciones recientes sugieren una ventaja al usar ketamina en el perioperatorio (un bolo intravenoso de 0.5 mg/kg seguido de infusión intravenosa continua de 0.01 mg/kg/min antes y durante la intervención ), en particular en pacientes con dolor por neoplasia. Una infusión intravenosa continua más lenta (0.002 mg/kg/min) puede ser ventajosa en las primeras 24 h del posoperatorio, y una infusión aún más lenta (0.001 mg/kg/min) en las siguientes 24 h. En ausencia de bomba de infusión, la ketamina puede mezclarse en una bolsa de líquidos cristaloides para su administración durante la anestesia. El dextrometorfano ha recibido atención como un antagonista de receptores de NMDA por vía oral para su uso en pacientes humanos que sufren dolor crónico. Aunque es eficaz en algunas personas, los perros no producen el metabolito activo después de la administración oral, lo cual impide su empleo como analgésico en esta especie. La amantadina se ha suministrado para el tratamiento del dolor neuropático en seres humanos. En apariencia no tiene los efectos adversos en el SNC observados con la administración de ketamina. La amantadina se ha utilizado en perros como fármaco coadyuvante para el alivio del dolor crónico, en especial en artrosis y cáncer. Como coadyuvante de AINE parece contribuir a la analgesia con baja incidencia de efectos adversos (sobre todo agitación y diarrea en los primeros días de la administración). Puede tardar cinco a siete días en ser eficaz. Es probable que la amantadina no deba emplearse en pacientes con insuficiencia cardiaca congestiva o que reciben selegilina, sertralina o antidepresivos tricíclicos. 156 Manual de anestesia y analgesia en. . Anticonvulsivos La gabapentina es un análogo estructural del ácido g-aminobutírico (GABA) y se produjo como un fármaco antiepiléptico, aunque sus acciones GABAérgicas son en apariencia mínimas. Se presupone que actúa al modular la subunidad a2-d de los conductos del calcio, con lo que reduce la entrada de calcio y la liberación de neurotransmisor. Es útil para tratar dolor neuropático y sensibilización en algunos pacientes, aunque la eficacia en seres humanos (y tal vez en pacientes veterinarios) es impredecible. Se metaboliza con rapidez en perros y se usa más a menudo por sus propiedades anticonvulsivas. Al parecer tiene algunas propiedades analgésicas en dosis bajas administradas 2 o 3 veces al día. Un fármaco similar, pregabalina, recibió aprobación de la U.S Food and Drug Administration (FDA) para el tratamiento del dolor neuropático en pacientes humanos. Tiene el beneficio de absorción más predecible después de la administración oral. Su evaluación clínica en perros y gatos no se ha publicado hasta la fecha. Antidepresivos tricíclicos El antidepresivo tricíclico amitriptilina es eficaz en gatos para el alivio del dolor en la cistitis intersticial, y muchos veterinarios han informado de manera empírica eficacia en otras afecciones con dolor crónico en gatos y perros. La amitriptilina se ha administrado de forma diaria por periodos hasta de un año para cistitis intersticial y se han informado pocos efectos secundarios. No se dispone de otros estudios de sus posibles efectos analgésicos en perros o gatos. Es probable que los tricíclicos no deban usarse de manera concurrente con tramadol mientras no se conozcan del todo sus interacciones medicamentosas. Esteroides Éstos tienen acción analgésica leve, son antiinflamatorios y pueden producir un estado de euforia. Los esteroides se utilizan a menudo para paliar cáncer y dolor por cáncer en gatos y perros. No deben usarse junto con AINE debido al mayor riesgo de causar efectos adversos graves. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Analgésicos combinados El tramadol es un derivado sintético de la codeína y se clasifica como un fármaco opioidérgico–monoaminérgico. Se ha descubierto que es eficaz para aliviar el dolor de la artrosis en seres humanos como parte de un enfoque multimodal. Los estudios que establecen los regímenes de dosificación y la eficacia en especies veterinarias son limitados. El tramadol y su metabolito tienen acción agonista en el receptor de opioide m y también facilitan el sistema serotoninérgico descendente, que es parte del sistema analgésico endógeno del organismo. El tramadol se ha usado en muchas partes del mundo para tratar el dolor perioperatorio en animales y en ocasiones se prescribe para tratar el dolor crónico. Estudios farmacocinéticos recientes sugieren que en el perro sólo hay niveles bajos del metabolito activo O-desmetil-tramadol después de la administración oral. Si bien los gatos producen al parecer el metabolito activo, la depuración del fármaco es menor en esta especie. Para perros se recomienda la formulación de liberación inmediata, ya que la farmacocinética de la formulación oral de liberación sostenida no es favorable para la dosificación una vez al día. No se han evaluado de manera exhaustiva los efectos tóxicos en perros y gatos, pero la experiencia clínica sugiere que los efectos adversos suelen ser parecidos a los de otros opioides. Tratamiento del dolor crónico 157 Bisfosfonatos Se considera que el dolor óseo y el perióstico inducido por tumores óseos primarios o metastásicos se deben, sobre todo, a la actividad de los osteoclastos; en consecuencia, los fármacos que bloquean dicha actividad deben reducir en grado considerable el dolor óseo. Los bisfosfonatos inhiben la actividad de osteoclastos y por tanto pueden producir analgesia. Hay muy poca información sobre su uso en perros para paliación de dolor óseo, pero se emplean fármacos como el pamidronato, y los primeros informes empíricos sugieren eficacia en alrededor de 40% de los casos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Otras modalidades de alivio del dolor crónico La radiación local o a la totalidad del cuerpo puede favorecer la eficacia de los fármacos analgésicos al reducir la masa tumoral metastásica o primaria en pacientes con cáncer. La dosis de radiación debe equilibrarse entre la cantidad necesaria para destruir células tumorales y la que afectaría células normales. Puede desarrollarse mucositis de la cavidad bucal y la faringe después de radiación de cuello, cabeza o cavidad bucal, con deterioro ulterior de la capacidad de comer y beber. Los tratamientos de la mucositis incluyen analgésicos, sucralfato, lidocaína viscosa al 2% y enjuagues con té verde. También se ha demostrado que la administración intravenosa de estroncio 89 proporciona analgesia en caso de metástasis óseas en alrededor de 50% de las personas, pero su uso es raro en veterinaria. Puede usarse acupuntura como modalidad de alivio del dolor cuando los tratamientos ordinarios no funcionan. Mientras que algunos veterinarios tienen dificultad para aceptar la acupuntura porque las explicaciones de la medicina tradicional china pueden ser insostenibles en términos científicos, es importante recordar que existen teorías fisiológicas documentadas y pruebas de sus efectos clínicos en animales. En general, la analgesia por acupuntura es extremadamente útil para el tratamiento del dolor de pelvis, radio/cúbito y fémur, así como en las molestias cutáneas de la radioterapia. La acupuntura puede ayudar a aliviar las náuseas asociadas con quimioterapia y algunos analgésicos al tiempo que promueve el bienestar general. La analgesia por acupuntura puede obtenerse con la simple colocación de una aguja. La eficacia de la colocación de agujas puede favorecerse con la estimulación eléctrica de alta o baja frecuencia (la mayor parte de los tipos de dolor reacciona a la estimulación de baja frecuencia). Los productos nutracéuticos suelen contener una variedad de compuestos, pero los principales son glucosamina y sulfato de condroitina. Existen algunos indicios de que tienen ligeros efectos antiinflamatorios y analgésicos. Resulta interesante, con base en la experiencia de los autores, que el efecto analgésico parece ser más predecible en gatos que en perros. Revisado a partir de “Cancer Patients” por Duncan X. Lascelles y James S. Gaynor en Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 5 Equipo de anestesia Craig Mosley Introducción Seguridad y diseño Desde 2000, las máquinas de anestesia para uso en seres humanos comercializadas en EUA y Canadá deben satisfacer estándares mínimos de diseño y seguridad establecidos por organizaciones como la American Society for Testing and Materials (ASTM) y la Canadian Standards Association (CSA). No es indispensable que las máquinas de anestesia para uso veterinario satisfagan estándares de diseño o seguridad específicos, más allá de los relacionados con riesgos básicos para el operario (p. ej., requisitos de seguridad eléctrica). Las características de seguridad se agregan con frecuencia sobre una base ad hoc y no es necesario demostrar la eficacia del equipo. En condiciones ideales, las características de seguridad, como alarmas de presión en las vías respiratorias, deben estar integradas en la máquina de anestesia misma. La inclusión de algunos de estos sistemas de Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 158 © Editorial El manual moderno Fotocopiar sin autorización es un delito. La anestesia con fármacos inhalables constituye la base de la mayor parte de los protocolos de anestesia modernos en medicina veterinaria. La administración de anestésicos inhalables potentes requiere técnicas de suministro específicas. La máquina de anestesia permite infundir una combinación precisa y sin embargo variable de anestésico inhalable y oxígeno. Los componentes y las funciones básicos de todas las máquinas de anestesia son similares, pero entre ellos existen notables diferencias de diseño. Las máquinas pueden ser desde muy simples (p. ej., las usadas para aplicaciones móviles) hasta estaciones de trabajo de anestesia muy complejas con ventiladores, monitores y sistemas de seguridad integrados (figura 5-1). Cualquiera que sea la complejidad del diseño, todas las máquinas de anestesia tienen componentes en común: una fuente de oxígeno, un regulador de oxígeno (quizá como parte del sistema de suministro de gas), flujómetro de oxígeno y un vaporizador. Si se emplean gases adicionales (p. ej., óxido nitroso), también incluyen fuente, regulador y flujómetro para cada gas, por lo general dispuestos en paralelo a la trayectoria del oxígeno, con algunas excepciones (p. ej., válvula de oxígeno de urgencia). Para la administración de anestesia al paciente, la máquina básica se usa entonces junto con un circuito de respiración y un sistema evacuador de gases de anestesia de desecho. Equipo de anestesia 159 © Editorial El manual moderno Fotocopiar sin autorización es un delito. A B Figura 5-1. Las máquinas de anestesia para uso veterinario pueden variar en grado considerable en complejidad y versatilidad. (A) Estación de trabajo anestésico veterinario completa para animales grandes. (B) Sistema anestésico portátil para uso en el campo. Ambos sistemas cuentan con todos los componentes necesarios para el suministro controlado de anestésicos inhalables. Fotografía A cortesía de Hallowell EMC, Pittsfield, MA. seguridad en las máquinas de anestesia puede ayudar a prevenir accidentes relacionados con la anestesia susceptibles de prevención. Sin embargo, mientras los fabricantes de equipo anestésico veterinario no adopten normas de seguridad y diseño, no dejará de haber numerosas opciones de equipo de calidad, eficacia y seguridad variables para el suministro de anestésicos inhalables a los pacientes veterinarios. Tanto si existen normas como si no, los anestesiólogos veterinarios siempre deben comprender el funcionamiento de cada componente de la máquina de anestesia y asegurarse de que ésta tenga el diseño apropiado para realizar las tareas de manera segura. Rebasa los alcances de este capítulo describir de forma detallada todas las máquinas de anestesia y los equipos disponibles en la actualidad y usados en medicina veterinaria. Existen muchos libros de texto excelentes en los que se describe de manera muy minuciosa el equipo anestésico disponible para su uso en la anestesia humana.1,2 Este capítulo se enfoca en dar al lector un panorama funcional general de la máquina de anestesia, vaporizadores, circuitos de respiración y ventiladores. Además, están disponibles productos diseñados de manera específica para uso veterinario que no se describen en otras partes, y se les revisa aquí. 160 Manual de anestesia y analgesia en. . Sondas endotraqueales Por lo regular, las sondas endotraqueales se usan para mantener las vías respiratorias permeables en pacientes anestesiados con fármacos inhalables. No obstante, las mascarillas laríngeas se han evaluado en varias especies domésticas y pueden ser alternativas adecuadas en algunos casos.3–6 Una sonda endotraqueal colocada de forma correcta o una mascarilla laríngea con el manguito insuflado de manera apropiada aseguran la permeabilidad de las vías respiratorias, facilitan la ventilación con presión positiva, protegen las vías respiratorias contra la aspiración de líquidos y previenen la contaminación del ambiente de trabajo con gases anestésicos de desecho. Existen muchos estilos y tipos de sondas endotraqueales disponibles que pueden utilizarse en medicina veterinaria (figura 5-2A). La mayor parte se manufactura para seres humanos pero pueden usarse en casi todas las especies pequeñas. Para pacientes que requieren tamaños mayores y menores que los disponibles para uso humano están disponibles algunos productos específicos para uso veterinario. Las sondas endotraqueales fabricadas para uso en personas deben tener diversas marcas y abreviaturas directamente en el dispositivo que describen de manera completa cada sonda. Las marcas pueden indicar fabricante, diámetros interno (DI) y externo (DE) de la sonda, longitud y códigos que consignan efectos tóxicos tisulares o pruebas de implantación (p. ej., F29) (figura 5-2B). No existe el requisito de marcas similares en las sondas fabricadas sólo para uso veterinario, pero es común que como mínimo se indiquen diámetros y longitud. El tamaño de las sondas endotraqueales corresponde casi siempre a su DI. Por ejemplo, una sonda tamaño 6 tiene DI de 6.0 mm. El DE para cualquier tamaño de sonda varía de acuerdo con la construcción. Las sondas endotraqueales con paredes más gruesas tienen mayores diferencias entre DI y DE. Esto puede ser importante al seleccionar sondas para pacientes muy pequeños. Las sondas de pared muy gruesa reducen el diámetro interno efectivo más que las sondas de pared delgada, ya que en última instancia el tamaño de la sonda endotraqueal que puede colocarse en un paciente es limitado por el DE de la sonda y no por el DI. Pese a ello, las sondas blandas de pared muy delgada son susceptibles a la obstrucción por compresión externa (es decir, aplastamiento) o acodamiento (figura 5-3). Entre los materiales comunes de las sondas endotraqueales figuran policloruro de vinilo (PVC), silicona y caucho rojo. En general, se prefieren las sondas endotraqueales translúcidas, que pueden someterse a inspección visual en busca de moco o sangre en el intraoperatorio, o de desechos dentro de su luz después de la limpieza. Debe usarse la sonda endotraqueal del mayor tamaño que se ajuste a la tráquea del paciente. Aunque existen varias reglas empíricas para seleccionar el tamaño de la sonda, quizá es más fácil determinar el tamaño más apropiado si se palpa la tráquea del paciente individual. La sonda no debe extenderse en sentido distal más allá del estrecho torácico y, si es posible, no debe extenderse en sentido rostral mucho más allá de los incisivos del paciente, ya que esto incrementa el espacio muerto mecánico. Si la sonda endotraqueal es demasiado larga y la inserción supone la posibilidad de causar intubación endobronquial, puede cortarse y recolocarse el conector. El tipo de sonda endotraqueal que más se emplea, tanto en animales grandes como en pequeños, es el de Murphy con manguito que se muestra en la figura 5-2B. Las sondas de tipo Cole y reforzadas (con espiral embebida, blindadas) también se utilizan de manera ocasional en medicina veterinaria. Las sondas de Cole no poseen manguito y tienen menor diámetro en el extremo del paciente (distal) respecto del extremo de la máquina (proximal). La porción distal © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sondas endotraqueales y laringoscopios Equipo de anestesia 161 A B Características de las sondas endotraqueales comunes Marca radiopaca © Editorial El manual moderno Fotocopiar sin autorización es un delito. DI Ojo de Murphy Hacia la máquina (extremo proximal) DE Válvula Balón piloto Bisel = 38 ± 8º Hacia el paciente (extremo distal) Conector Ángulo del bisel 15 mm DE Radio de curvatura (12 a 16 cm) Figura 5-2. (A) Los tubos pueden ser de silicón, policloruro de vinilo y caucho rojo (de arriba abajo). (B) Diagrama que ilustra las partes y características deseables (p. ej., radio de curvatura y ángulo del bisel) de una sonda endotraqueal de Murphy. DE, diámetro externo; DI, diámetro interno. Tomado de Dorsch J.A., Dorsch S.E. Traqueal tubes. 1994. In: Understanding anesthesia equipment, 3rd ed. J.A. Dorsch and S.E. Dorsch, eds. Baltimore, MD: Williams and Wilkins, p. 439. 162 Manual de anestesia y analgesia en. . Figura 5-3. Las sondas endotraqueales de pared muy delgada son propensas a la oclusión por compresión externa o torsión. Es necesario evaluar de manera continua la sonda endotraqueal de pared delgada compresible para confirmar su permeabilidad. (de menor diámetro) de la sonda se inserta en la tráquea hasta un punto en que el hombro hace contacto con la laringe y forma un sello. Sin embargo, las sondas de Cole no producen el mismo grado de seguridad de las vías respiratorias que una sonda estándar con manguito, y por lo regular sólo se usan en pacientes muy pequeños para la intubación de corto plazo (figura 5-4). Las sondas reforzadas incorporan en su pared un alambre de refuerzo en espiral (de nailon o metal) que ayuda a prevenir el colapso y la oclusión. Son útiles en situaciones en que es probable que la sonda se comprima o acode, como en procedimientos que requieren flexión extrema de cabeza y cuello (p. ej., extracción de líquido cefalorraquídeo [LCR]) o que implican compresión de la tráquea (p. ej., retracción traqueal durante el acceso ventral a la médula espinal cervical). El extremo de la máquina contiene el conector de la sonda endotraqueal. La porción más proximal del conector es una conexión universal de tamaño uniforme (15 mm DE) para todos los circuitos anestésicos estándares. El extremo distal del conector varía en tamaño de acuerdo con el diámetro de la sonda endotraqueal. El extremo del paciente (distal) de la sonda endotraqueal suele ser biselado. Las sondas de tipo Murphy tienen un orificio en la pared opuesta al bisel, denominado ojo o agujero de Murphy. Su objetivo es constituir una vía alterna para el flujo de gas si la abertura biselada se ocluye. Las © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-4. Sonda endotraqueal de Cole de calibre 10 F, apropiada para pacientes veterinarios pequeños. Nótese el diámetro menor de la porción laringotraqueal de la sonda (extremo distal de la sonda, lado derecho de la figura). Equipo de anestesia 163 © Editorial El manual moderno Fotocopiar sin autorización es un delito. sondas endotraqueales sin ojo de Murphy se conocen como sondas de tipo Magill. En las sondas con manguito, éste se sitúa en sentido rostral al ojo de Murphy, y puede ser de bajo volumen-alta presión o de alto volumen-baja presión. En general, se prefieren los manguitos de alto volumenbaja presión para minimizar el riesgo de lesión traqueal isquémica por presión excesiva contra la pared traqueal. Cuando se usa una sonda endotraqueal de ajuste apropiado con un manguito de alto volumen-baja presión, la presión ejercida por el manguito contra la pared traqueal es similar a la presión dentro del manguito. Esto permite determinar mejor la presión anticipada en la pared traqueal ejercida por el manguito. Cuando éste es de alta presión-bajo volumen, la presión en su interior no refleja la presión en la pared traqueal sino más bien la presión creada por el rebote elástico del manguito, lo cual hace difícil calcular la presión ejercida por el manguito en la pared traqueal. Las presiones en la pared traqueal mayores de 48 cm H2O pueden impedir el flujo sanguíneo capilar, con el posible resultado de daño traqueal, y las presiones menores de 18 mm Hg pueden incrementar el riesgo de aspiración.7 El mejor método para asegurar que las presiones del manguito se encuentren dentro del intervalo recomendado consiste en usar un monitor especial para insuflarlo. Un monitor de manguito es en esencia un manómetro de baja presión similar a los empleados para medir la presión arterial por el método Doppler y se conecta al balón piloto del manguito para proporcionar un registro de la presión en el interior de éste. Otras guías de la insuflación del manguito disponibles para seres humanos se han adaptado al uso en veterinaria (figura 5-5). De manera alternativa, es común la utilización de una prueba de fuga, que se realiza insuflando el manguito hasta que un escape de aire deja de ser audible a presiones en las vías respiratorias de 20 a 30 cm H2O. El balón piloto empleado para insuflar el manguito de la sonda endotraqueal se conecta al manguito mediante un canal incorporado en la sonda y casi siempre incluye un sistema de válvula autosellante activado por jeringa. Sin embargo, también hay balones piloto no autosellantes que requieren algún tipo de oclusión manual con pinza o tapón. Laringoscopios Los laringoscopios consisten en un mango y una hoja iluminada; se emplean para auxiliar la intubación traqueal y la valoración bucofaríngea durante la intubación. Infortunadamente, los laringoscopios se consideran a menudo una pieza opcional del equipo anestésico pese a que su uso correcto puede ser vital para la intubación exitosa en algunos pacientes (p. ej., braquicefálicos, con traumatismo laríngeo/bucal). Sin importar cuál sea la necesidad absoluta de intubación asistida por laringoscopio, el uso de éste se recomienda en todas las intubaciones a fin de asegurar que el anestesiólogo conserve las capacidades motoras y la coordinación necesarias para utilizarlo de manera correcta y pueda realizar una revisión bucofaríngea rápida. Existen varios estilos y tipos de laringoscopios y hojas disponibles. Algunos laringoscopios desechables tienen una hoja fija (es decir, un tipo y tamaño) y son de plástico, mientras que otros están diseñados para su uso con múltiples tipos y estilos de hojas y están hechos de acero inoxidable. Dado que hay una amplia gama de tallas de pacientes, con diferentes configuraciones de la cavidad bucal en medicina veterinaria, la opción de emplear múltiples hojas es una clara ventaja al seleccionar un laringoscopio. El mango también puede variar en tamaño y, si bien esto rara vez incide en el uso funcional del laringoscopio, un mango más pequeño puede ser más confortable y fácil de manipular para algunos anestesiólogos, en particular cuando se emplea para intubar a pacientes muy pequeños. Los mangos son casi siempre específicos para iluminación por fibra óptica o bombilla en la hoja, aunque existen algunos mangos que aceptan cualquier tipo de iluminación de la hoja. No existe una ventaja clara de un sistema de iluminación sobre otro. Figura 5-5. Pueden usarse una guía o un monitor de insuflación de sonda endotraqueal para evaluar las presiones intramanguito de la sonda; son de ayuda para evitar lesiones traqueales por presión excesiva en la pared traqueal. Se dispone de varios estilos, incluidos (A) manómetro incorporado y (B) indicador visual. En medicina veterinaria se utilizan dos tipos principales de hojas, la MacIntosh y la Miller. Ambos están disponibles en una amplia gama de tamaños (000 a 5). La hoja de MacIntosh es curva con un reborde vertical prominente, mientras que la hoja de Miller es recta con reborde vertical más discreto; ambas son adecuadas para la intubación de la mayoría de los pacientes y la decisión de usar una u otra depende con frecuencia de la preferencia personal. No obstante, el reborde prominente de la hoja de MacIntosh puede interferir con la visualización laríngea cuando se usa para intubar a pacientes veterinarios. Además de las hojas de tamaño estándar disponibles © Editorial El manual moderno Fotocopiar sin autorización es un delito. 164 Manual de anestesia y analgesia en. . Equipo de anestesia 165 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-6. Mango de laringoscopio con hojas de Miller (arriba) y MacIntosh (abajo). Nótese el borde vertical más prominente en la hoja de MacIntosh. Este borde puede reducir la visualización de la laringe cuando se intuba a un paciente en decúbito esternal con la mano derecha. en medicina humana, también existen hojas similares a las de Miller extremadamente largas (~300 mm), útiles para intubar a porcinos, camélidos, ovinos y caprinos (figura 5-6). Resulta interesante el hecho de que la mayor parte de las hojas de laringoscopio y las sondas endotraqueales utilizadas en seres humanos está diseñada para que el anestesiólogo use la mano derecha para hacer pasar la sonda endotraqueal, al tiempo que sostiene con la izquierda el laringoscopio. El bisel de la sonda endotraqueal apunta hacia la izquierda cuando la sonda se ve desde el aspecto cóncavo y las más de las veces el reborde de la hoja del laringoscopio se halla en el lado derecho de la hoja cuando ésta se ve desde arriba. Esta configuración posibilita la visualización óptima de la laringe cuando se intuba a un paciente en decúbito dorsal o supino (acostado de espalda), en cuyo caso el laringoscopio se sostiene con la hoja en posición descendente (invertida) y la sonda endotraqueal se ase con la superficie cóncava dirigida hacia arriba. Pese a ello, la mayoría de los pacientes veterinarios se intuba en decúbito esternal o prono (acostados boca abajo), caso en el cual el reborde del laringoscopio (si se sostiene en la mano izquierda) puede dificultar la visualización, y el reborde de la sonda endotraqueal la mejora en escasa medida cuando se ase con la mano derecha. Se dispone de hojas de MacIntosh para la mano izquierda que pueden ser más apropiadas para la intubación de especies veterinarias. Estas hojas tienen el reborde en el lado izquierdo, lo cual mejora la visualización de la zona laríngea cuando el laringoscopio se sostiene con la mano izquierda en la posición vertical. Dado que el reborde de la hoja de Miller es mucho menos prominente, en realidad no es necesario un diseño para la mano izquierda. Suministro de gas para anestesia Por lo general, las máquinas de anestesia tienen dos suministros de gas, uno de tanques pequeños de alta presión conectados directamente a la máquina y una segunda fuente que a menudo procede 166 Manual de anestesia y analgesia en. . de una tubería central en el hospital. Los tanques pequeños conectados de manera directa a la máquina de anestesia se utilizan como fuentes de respaldo o reserva en caso de que el suministro por tubería falle, o para el trabajo en un área sin acceso a la tubería. El oxígeno es con mucho el gas que más se administra en anestesia, mientras que el óxido nitroso junto con oxígeno como gas portador para los agentes inhalantes se emplea mucho menos. La mayor parte de los gases suministrados en medicina se almacenan a presión elevada en cilindros de diversos tamaños o en tanques de almacenamiento criogénico masivo a baja presión aislados. Las características (p. ej., presión de trabajo) y capacidad de los cilindros varían con el gas específico que contienen (cuadro 5-1). De manera alternativa, pueden usarse concentradores de oxígeno para satisfacer las necesidades de oxígeno de un hospital en que la adquisición y el almacenamiento de tanques son inconvenientes, imposibles o muy costosos (p. ej., en comunidades remotas). La mayoría de los concentradores de oxígeno utiliza un sistema de absorción de nitrógeno del aire para producir gas con una concentración de oxígeno de 90 a 96%. Casi todas las instalaciones veterinarias modernas disponen de alguna forma de suministro central de gas y sistema de distribución por tubería para llevar gases médicos a diversos sitios de trabajo. La complejidad de estos sistemas puede variar en grado significativo, desde un pequeño lote de cilindros grandes (G o H) y un regulador hasta sistemas más complejos consistentes en múltiples tanques grandes de oxígeno líquido, distribuidores automáticos, reguladores, alarmas y lotes de grandes cilindros a presión alta como respaldo. El tamaño y la complejidad del sistema de distribución de gas dependen de las necesidades de gas, el área de distribución requerida y el número de sitios de trabajo por abastecer. La instalación apropiada de grandes sistemas de distribución de gas es esencial con fines de seguridad y eficacia. Todas las instalaciones de gas deben valorarse de manera apropiada por personal con experiencia en este campo antes de usarlas para administrar gas a pacientes. Existen varios documentos internacionales (ASTM), nacionales y locales acerca del uso, transporte y almacenamiento seguros de gases presurizados. También existen normas para la instalación de sistemas de tubería de gases médicos y algunas de estas consideraciones se han incorporado en los requisitos de acreditación de los hospitales veterinarios. Sin embargo, las directrices específicas pueden variar en grado significativo entre jurisdicciones y regiones. Se han documentado varios Cuadro 5-1. Características de los cilindros de gas médico Tamaño Gas Símbolo del gas Código de color (EUA) Capacidad y presión (a 21°C) Peso del cilindro vacío (kg) E Oxígeno O2 Verde 660 L 1 900 psi 6 E Óxido nitroso N2O Azul 1 590 L 745 psi 6 G Óxido nitroso N2O Azul 13 800 L 745 psi 44 H Oxígeno O2 Verde 6 900 L 2 200 psi 54 H Óxido nitroso N2O Azul 15 800 L 745 psi 54 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Seguridad de los gases médicos Equipo de anestesia 167 accidentes debidos al uso inapropiado de gases médicos. En consecuencia, se han desarrollado diversos sistemas de seguridad para contribuir a reducir y eliminar tales problemas. Por ejemplo, todo el equipo anestésico tiene un conector no intercambiable específico de gas que es parte de la unidad básica (máquina de anestesia, ventilador). Estos conectores –sistema de seguridad de índices de diámetro (DISS, en inglés), sistema de seguridad de índices de espigas (PISS, en inglés), y conectores rápidos– se describen a continuación. Código de colores Los cilindros y tuberías de gas tienen un código de colores para evitar conexiones incorrectas, pero los códigos pueden variar de un país a otro. Por ejemplo, al oxígeno le corresponde el color blanco en Canadá y el verde en EUA. Además del código de color, todos los tanques tienen un esquema de marcación consistente en etiquetas con diversas formas, palabras clave y colores, todos los cuales se usan para identificar riesgos relacionados con el gas que contienen. La mayor parte de los tanques procedentes de instalaciones de suministro de gases tiene etiquetas perforadas (lleno, en uso, vacío) que dan seguimiento al estado de uso del cilindro. © Editorial El manual moderno Fotocopiar sin autorización es un delito. DISS El DISS es un sistema de conexión de rosca (cuerda) no intercambiable específica de gas. Es el sistema que utilizan de manera casi universal todos los fabricantes de equipo y cilindros para gases médicos. Conectores rápidos Se han desarrollado muchos sistemas de conexión rápida patentados (específicos de fabricante). Son estándares para un fabricante individual pero no son compatibles en general con los sistemas de conexión rápida de otro fabricante. Estos sistemas facilitan la conexión y desconexión rápidas de mangueras de gas y son útiles en situaciones en que se requiere realizar conexiones y desconexiones con rapidez. PISS El sistema PISS emplea patrones de espigas específicos de gas que sólo permiten conexiones entre los recibidores o yugos de cilindro apropiados y cilindros de gas pequeños (tamaño E). Este sistema es común para los yugos montados en máquinas de anestesia y algunos reguladores/ flujómetros específicos de cilindro. Válvula reductora de presión (regulador) La válvula reductora de presión (regulador) es un componente clave necesario para convertir las altas presiones de los cilindros de gas en una presión de trabajo más controlable y segura (p. ej., 35 a 50 psi). Los reguladores también reducen o previenen fluctuaciones de presión a medida que el tanque se vacía. Se los encuentra siempre que está en uso un gas a presión elevada (es decir, tuberías de gas, un cilindro conectado directamente a una máquina de anestesia). Los reguladores empleados para tuberías son ajustables, mientras que los utilizados en la mayor parte de las máqui- 168 Manual de anestesia y analgesia en. . nas de anestesia son calibrados por el fabricante. La norma de la ASTM exige que los reguladores en máquinas de anestesia se calibren para el uso preferente de gases de tubería antes de usar gas del cilindro de respaldo. Sin embargo, dado que ni los sistemas de tubería ni las máquinas de anestesia de uso veterinario están obligados a satisfacer las normas de la ASTM, no es raro que las máquinas sean alimentadas de preferencia por el gas de reserva o respaldo y no por la tubería. Este problema puede evitarse si se asegura que la presión de la tubería se calibre en alrededor de 5 psi más que el regulador de las máquinas de anestesia para el cilindro de oxígeno de reserva. Manómetros Por lo regular se emplean manómetros para medir presiones de trabajo en cilindros, tuberías, máquina de anestesia en funcionamiento y sistema de respiración. Las presiones de trabajo en cilindro, tubería y máquina de anestesia casi siempre se expresan en libras por pulgada cuadrada (psi, del inglés pounds per square inch) o kilopascales (kPa), mientras que las presiones en el sistema de respiración de la máquina de anestesia más a menudo se expresan en centímetros de agua (cmH2O). El calibrador que cuantifica la presión del sistema de respiración se conoce también como manómetro de presión. La información proporcionada por estos manómetros es vital para la operación sin riesgos del equipo de anestesia. Flujo de gas dentro de la máquina de anestesia La máquina de anestesia básica consta de una serie de partes que funcionan de manera colectiva para suministrar de forma segura anestésicos inhalables y apoyar la respiración. Entre estos componentes figuran la máquina de anestesia básica (sistema de suministro de gas), el vaporizador, el circuito de respiración y el sistema evacuador de gases de desecho. Quizá la manera más sencilla de describir una máquina de anestesia consista en describir los componentes en el orden en que el gas fluye por ella, desde la fuente hasta el paciente. Sin embargo, antes de describir estos componentes, es importante reconocer que las presiones de gas varían en diferentes sitios de la máquina de anestesia, y el conocimiento de estas presiones facilita la valoración y el funcionamiento seguro de estas máquinas. Hay zonas de presión alta, intermedia y baja. La zona de presión elevada acepta gases a la presión del cilindro y reduce y regula la presión; esta zona incluye cilindros de gas, conectores, receptores, mangueras de alta presión, manómetros y reguladores, y en ella la presión puede ser hasta de 2200 psi. La zona de presión intermedia recibe gases desde la tubería central o los reguladores de la máquina de anestesia y los conduce a la válvula de oxígeno de urgencia y los flujómetros; esta zona comprende entradas de la tubería, salidas de potencia para los ventiladores, conductos de las entradas de la tubería a los flujómetros, conductos de los reguladores a éstos, el montaje de los flujómetros, y el aparato de oxígeno de urgencia. La presión varía entre 40 y 55 psi. La zona de baja presión comprende los conductos y componentes entre el flujómetro y la salida de gas común; incluye vaporizadores, tubería de los flujómetros al vaporizador, conducto desde el vaporizador hasta la salida de gas común, y sistema de respiración. La presión en la zona de baja presión equivale en esencia a la presión ambiental © Editorial El manual moderno Fotocopiar sin autorización es un delito. La máquina de anestesia moderna Equipo de anestesia 169 © Editorial El manual moderno Fotocopiar sin autorización es un delito. y las presiones que el paciente experimenta. En esta zona, las presiones pueden variar según sea el modo en que se use el sistema (p. ej., ventilación a presión positiva), pero en general nunca deben ser mayores de 30 cm H2O, ya que estas presiones se transmiten de manera directa a los pulmones del sujeto (figura 5-7). En anestesia veterinaria se emplean algunas veces múltiples fuentes de gases (p. ej., oxígeno, aire, óxido nitroso) con la máquina de anestesia. Sin embargo, por lo regular el oxígeno al 100% es el único gas administrado para inducir anestesia y accionar el equipo anestésico (p. ej., ventiladores). Si el lector planea usar múltiples gases para inducir anestesia, es responsabilidad del usuario entender todas las implicaciones de su empleo (indicaciones y contraindicaciones) y asegurarse de que el equipo anestésico tenga el diseño adecuado y esté bien vigilado, para prevenir la posibilidad de suministrar una mezcla hipóxica de gases al paciente. El flujo de gas dentro de una máquina de anestesia puede tomar múltiples vías una vez que ingresa en las zonas de presión intermedia. El flujómetro debe recibir una cantidad mínima de gas y desde ahí éste se dirige al vaporizador y luego al paciente. No obstante, además de esta vía de avance, puede haber varias más disponibles para la distribución del gas en la máquina de anestesia. En la mayor parte de las máquinas de anestesia, el gas a presión intermedia también se desvía casi siempre a una válvula de gas nuevo de urgencia que no pasa por flujómetro y vaporizador, y suministra gas nuevo de manera directa al circuito de respiración. Algunas máquinas de anestesia no cuentan con válvulas de gas de urgencia. Cuando existen, el gas de la zona de presión intermedia puede desviarse a una o más salidas auxiliares de oxígeno, que puede utilizarse como el gas impulsor para un ventilador integrado o externo o un flujómetro de oxígeno. Flujómetro Los flujómetros controlan la velocidad (gasto) del suministro de gas a la zona de baja presión de la máquina de anestesia y determinan el gasto del gas nuevo (GGN) al circuito anestésico. Debe haber un flujómetro separado para cada tipo de gas usado en la máquina de anestesia. Tipo de sistema de respiración empleado, volumen del circuito de respiración y talla del paciente son factores que influyen en el GGN. Se dispone de varios diseños de flujómetros, pero la mayoría se basa en un tubo ahusado de gas con un flotador móvil. Por lo regular, el gas entra por el fondo del tubo y sale por arriba. El tubo es más estrecho en el fondo y más ancho arriba, de tal modo que cuando el flotador asciende en el tubo más gas puede fluir alrededor de él y producir mayores gastos. Los gastos se expresan en litros por minuto. La distancia espacial entre marcas verticales en el flujómetro no siempre corresponde a cambios iguales en el gasto. En otras palabras, la distancia entre 0 y 1 000 ml medida en dirección vertical en el flujómetro puede no ser igual a la distancia vertical entre 1 000 y 2 000 mL. Esto es similar a la separación espacial de los porcentajes en muchos vaporizadores, en los cuales se asigna más espacio en los indicadores a los porcentajes de trabajo normal que a los usados rara vez. Algunas máquinas de anestesia también tienen dos flujómetros para el mismo gas dispuestos en serie, lo que hace posible una precisión aún mayor a menores valores de gasto. Vaporizador Los vaporizadores convierten el anestésico líquido en vapor y controlan la cantidad de éste que sale de ellos. Casi todos los vaporizadores modernos son específicos de anestésico, se calibran Cilindro de oxígeno Regulador del cilindro de oxígeno Válvula de oxígeno de urgencia MÁQUINA DE ANESTESIA BÁSICA Flujómetro para oxígeno Manómetro del cilindro Válvula del cilindro Vaporizador de precisión Entrada de gas común Salida de gas común Canastilla absorbente de dióxido de carbono Válvula limitadora de la presión o disparo ajustable Tubo de respiración inspiratorio Paciente SISTEMA CIRCULAR Válvula unidireccional inspiratoria Pieza en Y Bolsa reservorio Tubo de respiración espiratorio Válvula unidireccional espiratoria Tubería corrugada al sistema evacuador © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-7(A). Diagrama de la máquina de anestesia básica: el sistema circular. La posición exacta de los diversos componentes y características específicas pueden variar en gran medida entre un fabricante y otro. Ilustración de Kath Klassen, BSc (Agr), DVM. A 170 Manual de anestesia y analgesia en. . Equipo de anestesia 171 Gas de desecho del circuito del paciente, desde la válvula LPA circular o la válvula de derrame del ventilador B Entrada de evacuación Válvula de aguja o flujómetro para controlar el vacío en sistemas al vacío de flujo alto; no se encuentra en todas las interfaces Válvula de alivio de presión positiva Entrada de evacuación adicional que se usa para conectar la evacuación desde el ventilador. Debe estar tapada cuando no se usa. No se encuentra en todas las interfaces y la posición exacta varía. Manguera al sistema de evacuación al vacío Válvula de alivio de presión negativa Interfaz de evacuación © Editorial El manual moderno Fotocopiar sin autorización es un delito. Conexión para la bolsa reservorio de evacuación o el material absorbente de gases inhalables (canastilla de carbón activado) Bolsa reservorio del sistema de evacuación Canastilla con carbón activado SISTEMA DE EVACUACIÓN Figura 5-7(B). Diagrama de la máquina de anestesia básica: interfaz de evacuación. La posición exacta de los diversos componentes y las características específicas pueden variar en gran medida de un fabricante a otro. Ilustración de Kath Klassen, BSc (Agr), DVM. en concentración, son de desviación variable y flujo sobre la mecha, y se encuentran fuera del circuito; están compensados para registrar temperatura, gasto y contrapresión. En la anestesia veterinaria aún se encuentran vaporizadores de baja resistencia y escasa precisión dentro del circuito, pero sin vigilancia apropiada del gas inspirado estos vaporizadores representan riesgos innecesarios durante la anestesia y tal vez su uso deba desalentarse. En esencia, los vaporizadores 172 Manual de anestesia y analgesia en. . funcionan al dirigir (distribuir) el gas portador para que fluya por la cámara del vaporización, donde capta vapor anestésico, o por la cámara de desviación, donde no lo hace. El cociente de cantidad de gas con agente inhalante sobre cantidad de gas puro, junto con la presión de vapor del anestésico volátil, determinan la concentración final del gas que sale del vaporizador. La salida del vaporizador se expresa como una concentración (p. ej., porcentaje el volumen) de vapor en el gas que sale del vaporizador. Temperatura, gasto y presión son factores que pueden modificar la salida del vaporizador. Los mecanismos de la compensación para tomar en cuenta temperatura, gasto y presión varían entre los fabricantes y los modelos de vaporizadores. En general, los vaporizadores de mayor precisión (más compensados) mantienen una salida consistente a valores de gasto entre 0.5 y 10 L/min, temperaturas de 15 a 35°C, y cambios de presión relacionados con la ventilación a presión positiva y uso de la válvula de urgencia. Gasto Los cambios en el gasto a través del vaporizador podrían causar cambios en la salida. Por ejemplo, si el gasto fuera excesivo, no podría ocurrir la saturación completa del gas que pasa por la cámara de vaporización, con lo que se reduciría la salida. La compensación del gasto se logra al asegurar una saturación confiable y consistente de todo el gas que fluye por la cámara de vaporización mediante el uso de una serie de mechas, deflectores y trayectos en espiral para facilitar la vaporización de los anestésicos líquidos. Estas técnicas se emplean para incrementar el área superficial de la interfaz gas portador–líquido, con lo cual se asegura que todo el gas que sale de la cámara de vaporización esté completamente saturado. Todos los vaporizadores modernos que funcionan de modo correcto tienen salida muy predecible dentro de un intervalo de gastos útiles en clínica.2 Contrapresión Es posible la contrapresión en el vaporizador durante la ventilación a presión positiva intermitente o con el uso de la válvula de urgencia, y este efecto puede incrementar la salida del vaporizador en caso de que no funcionen los mecanismos de compensación. Existen varias maneras en que los efectos de la contrapresión se minimizan en los vaporizadores modernos. Uno consiste en reducir © Editorial El manual moderno Fotocopiar sin autorización es un delito. Compensación de temperatura La compensación de la temperatura se logra mediante el uso de materiales de construcción del vaporizador que suministran y conducen calor, con lo cual promueven de manera eficiente la termoestabilidad. Además, la mayor parte de los vaporizadores tiene sistemas mecánicos de termocompensación. Estos vaporizadores compensan los cambios de temperatura al modificar el cociente de distribución, de tal modo que se conduce una mayor o menor cantidad de gas por la cámara de vaporización conforme la temperatura cambia durante el uso. A medida que el vaporizador se enfría, el elemento térmico restringe el flujo de gas hacia la cámara de desviación, lo cual hace que más gas portador entre en la cámara de vaporización. Sucede lo contrario si el vaporizador se calienta demasiado. Los detalles exactos de los sistemas de termocompensación varían entre un fabricante y otro, pero el elemento térmico es casi siempre un metal termosensible que de manera confiable se expande y se contrae cuando experimenta cambios de temperatura. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Equipo de anestesia 173 el tamaño de la cámara de vaporización respecto de la cámara de desviación. Otra alternativa es usar un tubo largo en espiral o de gran diámetro hasta la cámara de vaporización; ambos reducen la cantidad de gas presurizado que llega a ésta. Las válvulas de retención unidireccionales inmediatamente corriente arriba del vaporizador también previenen los efectos de la contrapresión y están incorporadas en algunas máquinas. Esas válvulas también se emplean algunas veces corriente abajo de la válvula de urgencia (corriente arriba del vaporizador) para prevenir la contrapresión. Existen muchos vaporizadores disponibles para su uso en anestesia veterinaria, pero la mayoría se basa en tres estilos principales de vaporizadores: las series Ohmeda Tec (GE Healthcare, Fairfield, CT), Drager Vapor (Dräger Medical, Inc., Telford, PA) y Penlon Sigma (Penlon, Inc., Minnetonka, MN). Las principales diferencias entre estas series son capacidad de la cámara de vaporización (las cámaras más grandes permiten más tiempo entre llenados, lo que reviste especial utilidad para aplicaciones en animales grandes), susceptibilidad a variaciones en la salida por inclinación (rara vez un problema en circunstancias normales), y opciones de montaje. Casi todos los vaporizadores son dispositivos mecánicos que no requieren energía externa para funcionar de modo normal. Sin embargo, como resultado de las propiedades del desflurano en el estado de vapor, se requieren vaporizadores con calentamiento de diseño especial para asegurar una salida consistente. Además, hay vaporizadores electrónicos disponibles para uso en seres humanos y animales que funcionan como vaporizadores de desviación variable, pero el cociente de desviación del gas portador se determina de manera electrónica y no mecánica. Dado que el sistema es electrónico, pueden incorporarse diversas modalidades de alarma seleccionadas por el fabricante y el usuario. Por ejemplo, el vaporizador puede alertar al usuario si se suministran desde el vaporizador concentraciones inusualmente elevadas de anestésico o si los parámetros del vaporizador no se han modificado en un lapso específico, de tal modo que podrían evitarse sobredosis inadvertidas de anestésico (p. ej., la salida del vaporizador se incrementa de manera momentánea y el usuario olvida volver a reducirla). Aunque se ha aducido que los sistemas electrónicos proporcionan información adicional que puede ser valiosa para el anestesiólogo, también pueden ser más propensos a problemas y daño relacionados con el hecho de que dependen de la operación apropiada de los circuitos electrónicos para funcionar. Los vaporizadores pueden llenarse a través de un puerto con tapa de rosca estándar o un puerto de llenado con llave específico de fármaco. El objetivo de los puertos de llenado con llave es prevenir el llenado inadvertido del vaporizador con un anestésico incorrecto. La mayor parte de los vaporizadores modernos es en extremo confiable y durable, además de que requiere muy pocos cuidados y mantenimiento regular. Sin embargo, los cuidados y el mantenimiento habituales deben realizarse conforme a las recomendaciones del fabricante y a cargo de un técnico certificado. Oxígeno de urgencia Las válvulas de oxígeno de urgencia se encuentran en la mayoría de las máquinas de anestesia de uso veterinario. Su objetivo es suministrar con rapidez grandes volúmenes de gas libre de anestésico al circuito del paciente en situaciones de urgencia. El flujo se origina corriente abajo del regulador dentro de la zona de presión intermedia de la máquina de anestesia (~50 psi) y no pasa por flujómetro y vaporizador; administra gas a valores de gasto de 35 a 75 L/min al circuito del paciente. Para evitar la presión excesiva en el circuito del paciente, la válvula de urgencia no 174 Manual de anestesia y analgesia en. . debe usarse, o se utiliza con gran cautela, en circuitos sin recirculación, circuitos conectados a ventiladores mecánicos y circuitos con volúmenes muy bajos (p. ej., sistemas circulares pediátricos), ya que las presiones en el circuito de respiración pueden aumentar de manera temporal y crear presiones peligrosamente elevadas en los pulmones del paciente. Las válvulas limitantes de presión ajustables (LPA) deben estar completamente abiertas todo el tiempo para ayudar a prevenir la presión excesiva en el circuito de respiración. Salida de gas común La salida de gas común se dirige de la máquina de anestesia al circuito de respiración. El gas que llega a esta salida se ha desplazado desde el suministro (cilindro o tubería) hasta el regulador, flujómetro y vaporizador. El gas que fluye desde la salida de gas común casi siempre lleva el anestésico al circuito del paciente a la concentración y el gasto determinados por la lectura del vaporizador y el gasto del flujómetro. Sin embargo, la concentración de fármaco inhalable en la salida de gas común no es casi nunca equivalente a la concentración inhalada por el sujeto cuando se utilizan circuitos con recirculación, en particular si se emplean GGN bajos, debido a la dilución de los gases entrantes con los que ya se encuentran en el circuito del paciente. Cuando se oprime, la válvula de urgencia también envía gas a la salida de gas común, eludiendo el flujómetro y el vaporizador. Aunque algunos sistemas de respiración están integrados en las máquinas de anestesia (p. ej., sistema circular), a menudo se los considera por separado de la máquina de anestesia (es decir, los componentes regulador del gas y de suministro de fármaco inhalable). Ésta es una manera muy conveniente de analizar los sistemas de respiración de la medicina veterinaria, ya que en una máquina de anestesia particular cualquiera, el sistema de respiración puede cambiarse con frecuencia , según sean las necesidades del paciente o las circunstancias en que se suministra el anestésico. Los principales objetivos del circuito de respiración son administrar oxígeno al paciente, suministrar gas anestésico, extraer dióxido de carbono de los gases inhalados (o prevenir la recirculación significativa de dióxido de carbono), y aportar un medio para controlar la ventilación. Los sistemas de respiración se han clasificado en numerosos esquemas. Sin embargo, con fines de claridad, se sugiere clasificarlos en dos grupos: los diseñados para la recirculación de los gases exhalados (sistemas de recirculación o recirculación parcial) y los diseñados para su uso en circunstancias de recirculación mínima o nula (sistemas sin recirculación). Algunos han argumentado que esta clasificación es un tanto engañosa, dado que, de acuerdo con el sistema específico y los GGN utilizados, en un sistema de recirculación la recirculación puede ser mínima en realidad (esto es, GGN excesivamente altos), o un sistema sin recirculación puede no prevenir por completo la recirculación (es decir, GGN inadecuado/bajo). Para ayudar a resolver esta controversia se ha sugerido que además de describir el diseño del circuito de respiración, se proporcione el valor de GGN para describir de manera completa el modo en que se usa el sistema.8 El GGN debe expresarse en medicina veterinaria en mililitros por kilogramo por minuto, © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sistemas de respiración Equipo de anestesia 175 debido a la amplia gama de tallas de pacientes atendidos. Además, el grado de recirculación en los circuitos de respiración puede verse afectado por otros factores, como espacio muerto del equipo y patrón respiratorio del paciente. Basta decir que los sistemas de respiración se han diseñado para funcionar como sistemas con o sin recirculación, y deben utilizarse del modo en que se especificó de forma original. Recirculación (sistema circular) El sistema circular es el sistema de recirculación más usado y es el único que se describe aquí, aunque se han empleado otros tipos de sistemas de recirculación (p. ej., oscilante). El sistema circular está diseñado para producir un flujo unidireccional de gas y tiene un medio para absorber dióxido de carbono. Los componentes del sistema circular son: entrada de gas nuevo, válvula unidireccional inspiratoria, tubos de respiración, válvula unidireccional espiratoria, válvula LPA, bolsa reservorio y absorbedor de dióxido de carbono. Los GGN utilizados en un sistema circular determinan la cantidad de recirculación: completa (sistema cerrado), parcial (sistema semicerrado, flujo bajo) y mínima. Desde el punto de vista histórico, se han aplicado muchos términos para describir la cantidad de recirculación, pero no hay un estándar o una descripción universalmente aceptados para estos términos. Sin embargo, varios autores han sugerido abandonar el empleo de los términos abierto, semiabierto y semicerrado para evitar confusión.9 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Recirculación completa Se trata de un sistema circular en el que se usan gastos iguales al consumo metabólico del paciente de 3 a 14 mL/kg/min.10 Esto también se describe algunas veces como un sistema cerrado; no obstante, tal vez sea mejor no usar tales términos para evitar confusión. Recirculación parcial Ésta describe un sistema circular en el que se emplea un gasto mayor que el consumo metabólico de oxígeno (~20 mL/kg/min) pero menor que el requerido para prevenir la recirculación (~200 a 300 mL/kg/min). Dado que éste es un intervalo muy grande, a menudo se divide de manera arbitraria en gasto bajo (20 a 50 mL/kg/min), intermedio (50 a 100 mL/kg/min) y alto (100 a 200 mL/kg/min), si bien ello no se ha aceptado de manera universal. Sistema circular sin recirculación (o con recirculación mínima) En este caso, el sistema circular utiliza gastos mayores de 200 mL/kg/min, que en condiciones normales no se usarían en la mayor parte de las circunstancias. Sin embargo, estos gastos pueden resultar cuando se usan sistemas circulares para mantenimiento de la anestesia en pacientes de talla muy pequeña (<5 kg) con gastos de 1 000 mL/min o mayores. Con frecuencia, en medicina veterinaria se sugiere no recurrir a gastos menores de 1 000 mL/min, y aunque esta recomendación puede tener utilidad clínica para prevenir errores relacionados con la anestesia al incrementar el margen de seguridad anestésica, la mayoría de los sistemas de anestesia modernos (p. ej., vaporizadores) aún funciona de manera óptima a gastos de 500 mL/min. Con la disponibilidad de sistemas circulares pediátricos y neonatales de bajo volumen y bajo espacio muerto, es cada vez más común el uso de sistemas circulares con gastos de recirculación parcial (es decir, <1 000 mL/min) en pacientes pequeños (<5 kg). 176 Manual de anestesia y analgesia en. . Entrada de gas nuevo La entrada de gas nuevo es el sitio de suministro de gas al sistema circular desde la salida de gas común de la máquina de anestesia. La entrada de gas nuevo se halla casi siempre después del absorbedor de dióxido de carbono y antes de la válvula unidireccional inspiratoria. Válvula unidireccional inspiratoria Durante la inspiración, la válvula unidireccional inspiratoria se abre y posibilita el desplazamiento del gas desde la entrada de gas nuevo y la bolsa reservorio a través de la válvula hasta el lado inspiratorio del circuito de respiración. Durante la espiración, la válvula inspiratoria es forzada a abrirse, lo que impide la entrada de gas exhalado en el lado inspiratorio del circuito de respiración, y lo fuerza hacia el lado espiratorio. Circuito/tubería de respiración El circuito de respiración básico consiste en los lados o brazos inspiratorio y espiratorio, de plástico corrugado o caucho. La tubería corrugada ayuda a prevenir el acodamiento y permite © Editorial El manual moderno Fotocopiar sin autorización es un delito. Por supuesto, es más económico en términos de consumo de oxígeno y gas anestésico utilizar gastos bajos cuando sea posible. Gastos más bajos también se vinculan con menor contaminación ambiental por hidrocarburos halogenados (todos los anestésicos inhalables de amplia disponibilidad en el comercio) y mejor mantenimiento de la temperatura corporal. Sin embargo, gastos más bajos también se relacionan con menores volúmenes de anestésico suministrados al circuito, lo que ocasiona cambios más lentos de las concentraciones de gas inspirado por el paciente. Los bajos GGN pueden compensarse con el uso de registros más altos del vaporizador. La mayor parte de los anestésicos se suministra al principio a gastos relativamente altos de gas para asegurar el alcance rápido de una concentración suficiente de anestésico dentro del ciclo para mantener la anestesia en el paciente después de la inducción por vía intravenosa. Los gastos suelen reducirse después de los primeros 10 a 20 min para economizar gas y prevenir el desperdicio. El empleo de GGN altos permite al anestesiólogo suministrar grandes volúmenes de vapor anestésico durante el periodo inicial de captación por el paciente y hace posibles cambios rápidos en la profundidad de la anestesia. Esto asegura que la concentración de gas inspirado por el paciente refleje mejor la concentración de gas anestésico suministrada por el vaporizador. Esto contrasta con lo que ocurre si se utilizan bajos GGN, en cuyo caso la concentración de anestésico inspirado en el paciente no refleja en todos los casos la concentración de gas en el vaporizador hasta un punto cercano al equilibrio (esto es, captación, distribución y metabolismo de anestésico son casi iguales a su suministro). La interacción entre salida del vaporizador, volumen del circuito, talla del paciente y gasto es con frecuencia un concepto poco familiar y difícil de asimilar. Igualar el suministro de anestésico con una velocidad de infusión constante de un fármaco intravenoso es quizá una comparación más familiar para entender el suministro de anestésico inhalable. La configuración y las características reales de cada sistema circular varían un tanto entre un fabricante y otro, pero en general se sigue un patrón común de flujo de gas por la entrada de gas nuevo, la válvula unidireccional inspiratoria, los tubos de respiración inspiratorio y espiratorio, la válvula unidireccional espiratoria, la válvula LPA, la bolsa reservorio y la canastilla de absorción de dióxido de carbono de regreso a la entrada de gas nuevo. Equipo de anestesia 177 alguna expansión si el circuito se somete a cualquier compresión o tracción. Los dos brazos de respiración están conectados por una Y y ésta se conecta a las sondas endotraqueales y mascarillas. También existen diversos diseños coaxiales que colocan el brazo inspiratorio dentro del espiratorio del circuito de respiración. Los sistemas coaxiales reducen el tamaño del sistema de respiración y, al menos en teoría, el diseño facilita el calentamiento de los gases inspirados, fríos, por los gases espirados, calientes. El circuito F universal (un sistema de respiración coaxial) está diseñado para funcionar con sistemas circulares estándares (esto es, conectores de 22 mm de DE del sistema circular). La mayoría de los circuitos de respiración puede adaptarse para su uso con todos los sistemas circulares, ya que los diámetros de ajuste están estandarizados. No obstante, se dispone de un circuito coaxial patentado que utiliza conectores de tamaño no estándar, lo que hace necesario usar un sistema circular patentado. También existen varios tamaños de circuitos de respiración disponibles que varían en longitud, volumen y cantidad de espacio muerto, para satisfacer diversos requerimientos de anestesia. Los circuitos pediátricos y neonatales con recirculación son por lo regular sistemas de bajo volumen y escaso espacio muerto, lo cual les permite funcionar de manera óptima en pacientes pequeños (es decir, con pequeños volúmenes corrientes). © Editorial El manual moderno Fotocopiar sin autorización es un delito. Válvula unidireccional espiratoria La válvula unidireccional espiratoria funciona junto con la válvula unidireccional inspiratoria, cerrándose a la inspiración y abriéndose durante la espiración. Esta válvula ayuda a dirigir el gas hacia el brazo espiratorio del sistema de respiración, a través de la válvula espiratoria, y hacia la bolsa reservorio. Al menos un sistema también incorpora una válvula de alivio de presión negativa, con lo cual proporciona una trayectoria alternativa para el flujo de gas (aire ambiental) hacia el paciente en caso de que la válvula inspiratoria se trabe en la posición cerrada. Bolsa reservorio La bolsa reservorio también se denomina bolsa de respiración o bolsa de recirculación. Su objetivo es constituir un depósito distensible de gas que se expanda y colapse con la espiración y la inspiración del paciente. Muchas veces se recomienda que dicha bolsa tenga un volumen de seis o más veces el volumen corriente del sujeto (10 a 20 mL/kg). En última instancia, la bolsa reservorio debe tener una dimensión suficiente para contener un volumen razonable de gas, pero no tan grande que resulte difícil cuantificar el tamaño de la respiración al observar los movimientos de la bolsa. Además, una bolsa reservorio muy grande contribuye al volumen funcional global del sistema de recirculación (p. ej., sistema circular), y tiene como resultado un cambio más lento de la concentración de anestésico dentro del sistema de respiración cuando se modifica la salida del vaporizador. Esto no sucede cuando se emplea un sistema sin recirculación. Válvula LPA La válvula LPA también se conoce a menudo como válvula de derrame, disparo o alivio de presión. Es una válvula de seguridad que hace posible que el exceso de gas escape del circuito del paciente. Si funciona de manera adecuada, hay escape de gas si la presión excede los 1 a 3 cmH2O, y debe dejarse totalmente abierta todo el tiempo. Puede cerrarse un poco si la bolsa 178 Manual de anestesia y analgesia en. . A B de recirculación se colapsa por completo, pero aun así escapa gas si las presiones son mayores de 1 a 3 cmH2O. La válvula LPA puede cerrarse de forma temporal para suministrar ventilación a presión positiva, pero debe reabrirse de inmediato para prevenir la acumulación de presión excesiva en el circuito del paciente. En fecha reciente, varios fabricantes lanzaron productos que permiten el cierre momentáneo del sistema LPA. Ello ocurre cuando se oprime un botón, pero el sistema vuelve a abrirse por completo de manera automática una vez que el botón se libera. Estos sistemas de cierre momentáneo se construyen de manera directa en algunas válvulas LPA o se agregan a válvulas LPA ya en uso. Éstas son adiciones invaluables para el sistema de válvula APL y ayudan a prevenir el cierre inadvertido de ésta, que podría ocasionar la acumulación excesiva de presión en el circuito del paciente con el resultado de barotraumatismo o muerte (figura 5-8). Succionador de dióxido de carbono El succionador de dióxido de carbono contiene la sustancia química absorbente para eliminar dióxido de carbono de los gases exhalados. Existen muchos tipos (de canastilla doble, desechable, otros) y tamaños de absorbedores de dióxido de carbono disponibles. Todos contienen algún tipo de filtro para impedir que en el circuito de respiración ingresen gránulos de sustancia absorbente y casi todos contienen un sistema desviador que previene la canalización de gases dentro © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-8. (A) Ejemplo de válvula de cierre momentáneo integrada en la válvula limitante de presión ajustable (LPA) y (B) válvula de cierre momentáneo que puede agregarse a cualquier válvula LPA estándar; se demuestra su uso para generar una respiración. Equipo de anestesia 179 © Editorial El manual moderno Fotocopiar sin autorización es un delito. de la canastilla. Sin embargo, a pesar de los filtros, entran de manera ocasional en el circuito de respiración gránulos de sustancia absorbente, polvo o ambos; tal vez esto es más común en sistemas para animales grandes, en los cuales son más frecuentes flujos máximos de gas relativamente altos (vinculados con la inspiración y la espiración). En medicina veterinaria se sugiere que la canastilla del absorbedor tenga el doble del volumen corriente del sujeto para asegurar la absorción completa del dióxido de carbono, pero al parecer hay pocas pruebas que apoyen esta afirmación. En realidad, las canastillas para animales grandes rara vez tienen un volumen igual al doble del volumen corriente del sujeto, y en realidad muchos lo tienen equivalente a un volumen corriente del sujeto o menor. Además, muchos succionadores de dióxido de carbono de máquinas de anestesia para uso en seres humanos tienen por lo general volúmenes menores que el volumen corriente del individuo. Sin embargo, la eficiencia relativa de absorción (es decir, la carga de dióxido de carbono absorbida cuando el absorbente parece agotado) puede mejorar con absorbedores más grandes.11 El menor tamaño del absorbedor de dióxido de carbono reduce el volumen interno del circuito de respiración, lo cual hace que los cambios de concentración en el vaporizador se reflejen con mayor rapidez en la concentración del gas inspirado pero requiere cambios más frecuentes del absorbedor. Sustancias absorbentes de dióxido de carbono El principio general de la absorción de dióxido de carbono implica una base o álcali (sustancia absorbente) que neutraliza un ácido (CO2). Los productos finales de la reacción son agua, carbonato y calor. El componente principal de la mayoría de los absorbentes de uso común es hidróxido de calcio, que se encuentra más a menudo en cal cálcica (“cal grasa”) y cal bárica (de bario), con capacidades de absorción de 25 y 27 L de dióxido de carbono por cada 100 g, respectivamente. No obstante, con el uso continuo los absorbentes se agotan (el indicador cambia de color) antes de que se exceda la capacidad absorbente de los gránulos. Éstos suelen cambiar de blancos a púrpuras o rosados al agotarse, según sea el indicador usado. Violeta de etilo (púrpura) y fenolftaleína (roja) son indicadores sensibles al pH que se agregan a menudo a los gránulos para ayudar a identificar agotamiento del material absorbente. El cambio de color no debe usarse como el único indicador de ello. Es común que el absorbente que ha cambiado de color vuelva al blanco si se lo deja sin usar por varias horas. El absorbente nuevo es fácil de desmoronar bajo presión, mientras que el agotado se endurece (carbonato). Además, dado que la reacción de absorción de dióxido de carbono produce calor y agua, la actividad del absorbente puede evaluarse en busca de indicios tanto de calor como de humedad dentro de la canastilla. Asimismo, cuando se dispone de capnografía, puede usarse para detectar agotamiento del material absorbente. El ritmo de este agotamiento se determina por la talla del paciente (producción de CO2) y el GGN (mL/kg/min). El material absorbente se agota más rápido en pacientes más grandes y cuando se usan bajos GGN. En la mayoría de las circunstancias se adoptan diversos criterios (p. ej., horas de uso) para cambiar de manera sistemática el absorbente. La canastilla debe llenarse de manera cuidadosa para evitar derrames, con el resultado de adhesión de gránulos en la canastilla y derrame en el sistema de respiración. Ocurre alguna degradación de anestésicos inhalables con su exposición a absorbentes de dióxido de carbono. Esta degradación es insignificante. Sin embargo, el sevoflurano puede decomponerse en un compuesto potencialmente nefrotóxico, el compuesto A. Entre los factores relacionados con una mayor producción de compuesto A se incluyen alta concentración de se- 180 Manual de anestesia y analgesia en. . Sistemas sin recirculación Los sistemas sin recirculación se caracterizan por la ausencia de válvulas unidireccionales y un absorbedor de dióxido de carbono. En vez de depender de la absorción de dióxido de carbono para eliminar este gas, tales sistemas se basan en GGN altos. Los sistemas sin recirculación casi nunca se utilizan en pacientes mayores de 10 kg, ya que resultan mucho menos económicos de usar debido a lo altos GGN necesarios para prevenir la recirculación de CO2 en comparación con los que se observan en el sistema circular. Los gastos recomendados para prevenir la recirculación de CO2 espirado fluctúan entre 130 a 300 mL/kg/min, aunque también se han recomendado valores tan altos como 600 mL/kg/min. La amplia gama de valores de gasto sugeridos tal vez se relaciona con el hecho de que, además del GGN, el patrón respiratorio intrínseco del paciente influye en la aparición de recirculación (descrita más adelante). En términos históricos, se han recomendado sistemas sin recirculación, de manera un tanto arbitraria, para su uso en todos los pacientes de menos de 5 kg, al referir menor resistencia durante la respiración, menor espacio muerto en el equipo y menor volumen total del circuito. Sin embargo, si se emplean los circuitos con recirculación más recientes específicos para pacientes pediátricos, neonatales y pequeños, muchas de las ventajas atribuidas a los sistemas sin recirculación desaparecen y es posible mantener de manera segura a pacientes menores de 5 kg con sistemas de recirculación mientras el volumen corriente del sujeto sea adecuado para accionar las válvulas unidireccionales. Los circuitos específicos de pacientes pequeños no tienen casi nunca más espacio muerto y volumen total (y en algunos casos tienen en realidad menos) que los sistemas sin recirculación estándares (figura 5-9). No existe una talla mínima del sujeto aceptada de forma unánime entre los anestesiólogos para usar un sistema de recirculación. La talla mínima del paciente suele variar entre 3 y 7 kg, aunque un anestesiólogo individual puede elegir valores fuera de este intervalo de acuerdo con la vigilancia disponible (p. ej., capnografía para evaluar la recirculación) y el modo de ventilación deseado (espontánea, controlada). Si bien muchas veces se han descrito tres o más sistemas sin recirculación para su uso en medicina veterinaria en EUA, todos son casi idénticos en términos funcionales y se basan en dos de los seis sistemas de Mapleson descritos con anterioridad: D y F (figura 5-10). Algunas partes del sistema sin recirculación son tubería conductora de gas nuevo, conexión al paciente, tubería conductora de exhalación (casi siempre corrugada), sistema de escape de exceso de gas, y bolsa reservorio. Todos los sistemas de uso común tienen la entrada de GGN cerca de la boca del paciente y dependen del influjo de gas nuevo para impulsar el gas exhalado (con su CO2) © Editorial El manual moderno Fotocopiar sin autorización es un delito. voflurano, bajos GGN, absorbente seco, alta temperatura y uso de cal bárica. Las implicaciones de la producción de compuesto A para la salud del ser humano y otros animales se han revisado de forma amplia, pero al parecer sus efectos clínicos en perros y gatos son escasos. También es posible que se produzca monóxido de carbono cuando desflurano, enflurano o isoflurano pasan por absorbentes secos que contienen un álcali fuerte (hidróxido de potasio o sodio). Se ha informado que la mayoría de los casos de intoxicación por monóxido de carbono en seres humanos ocurre durante la primera anestesia general administrada con una máquina que se usa poco. En la anestesia humana se recomienda utilizar sólo absorbentes no desecados que no contengan hidróxido de potasio y con poco o nada de hidróxido de sodio. Aunque la intoxicación por monóxido de carbono relacionada con el uso de anestésicos en medicina veterinaria es al parecer muy rara (o ni siquiera se la reconoce), es probable que sean válidas recomendaciones similares. Equipo de anestesia 181 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-9. Pieza en Y de tres circuitos de sistema circular de diferentes tamaños; se demuestra la diferencia en espacio muerto. Los circuitos de sistema circular suelen estar disponibles en configuraciones neonatal/pediátrica y para adulto, en medio y a la derecha, respectivamente. El sistema circular de la izquierda es un circuito especial para veterinaria, diseñado de manera específica para pacientes muy pequeños, y su uso posee un espacio muerto mínimo. por la longitud variable de la tubería conductora hacia la bolsa reservorio y en última instancia hacia el sistema evacuador. El GGN se suministra a través de la tubería conductora de gas nuevo, y el gas exhalado y el exceso de GGN se desplazan por la tubería conductora de exhalación hacia la bolsa reservorio. Los altos GGN son necesarios para ayudar a minimizar la recirculación de gases espirados (es decir, CO2). Durante la pausa espiratoria, el alto GGN procedente de la tubería conductora de gas nuevo empuja el gas exhalado de la espiración previa por la tubería conductora de exhalación, desde el paciente hasta la bolsa reservorio. Cuando el paciente inspira, recibe gas tanto de la tubería conductora de gas nuevo como de la tubería conductora de exhalación. En circunstancias normales (esto es, paciente con patrón respiratorio normal), la mayor parte del gas inspirado proviene en realidad de la tubería conductora de exhalación. En algunos casos (p. ej., pacientes con patrones respiratorios inusuales), el sujeto vuelve a respirar gases exhalados pese a GGN en apariencia suficientes. Por ejemplo, un paciente con respiración profunda rápida puede no experimentar una pausa espiratoria de la duración necesaria para que el CO2 sea desplazado en sentido distal desde el extremo del tubo en que está el paciente lo suficiente para prevenir la recirculación, en particular si se realiza una inhalación lo bastante grande, con lo cual se genera un elevado gasto inspiratorio máximo. Los nombres “sistema de Bain” y “sistema modificado de Jackson–Rees” son quizá los que más se asignan a sistemas sin recirculación, pero no describen de manera adecuada los empleados a menudo en medicina veterinaria. Ninguno de ellos es un sistema específicamente definido porque no siempre se configuran de manera confiable y uniforme. Según las descripciones históricas, el circuito de Bain (basado en un sistema de Mapleson D) tendría una válvula LPA proximal a la bolsa de recirculación, mientras que el modificado de Jackson–Rees (basado en un sistema 182 Manual de anestesia y analgesia en. . a. Sistema de Bain con montaje de Bain y válvula LPA (configuración de tipo Mapleson D: coaxial) Al sistema evacuador Flujo de gas nuevo b. Sistema de Bain con válvula de compresión distal a la bolsa (configuración de Mapleson F: coaxial) Al sistema evacuador Flujo de gas nuevo c. Sistema modificado de Jackson–Rees con la válvula de alivio proximal a la bolsa (configuración de Mapleson D: no coaxial) Flujo de gas nuevo d. Sistema modificado de Jackson–Rees con la válvula de compresión distal a la bolsa (configuración de Mapleson F: no coaxial) Al sistema evacuador Flujo de gas nuevo CONFIGURACIONES USADAS CON FRECUENCIA DE SISTEMAS SIN RECIRCULACIÓN Figura 5-10. Diagramas de los sistemas de Mapleson (D y F) usados más a menudo como base para los sistemas sin recirculación modernos. La mayor parte de éstos son modificaciones de la clase de Mapleson y ya no pueden clasificarse de manera estricta como de un tipo u otro. Por ejemplo, un sistema de Bain es un sistema coaxial como el Mapleson D, pero puede configurarse con a) la salida del gas de escape antes de la bolsa de recirculación (Mapleson D) o b) después de dicha bolsa (Mapleson F). El sistema de Jackson–Rees, no coaxial, puede configurarse también con la salida de gas de escape c) antes de la bolsa de recirculación (Mapleson D) o d) después (Mapleson F). Ilustración de Kath Klassen, BSc (Agr), DVM. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Al sistema evacuador © Editorial El manual moderno Fotocopiar sin autorización es un delito. Equipo de anestesia 183 de Mapleson F) tendría una válvula de compresión o llave de paso distal a la bolsa de recirculación. Sin embargo, ambos sistemas de respiración pueden adaptarse para su uso con un bloque de montaje y diversas combinaciones de bolsa reservorio y sistema de escape, lo cual hace casi imposible una clasificación estricta. En esencia, la principal diferencia en el modo en que los dos sistemas pueden usarse de modo funcional es que uno tiene diseño coaxial (Bain), pero no así el otro (modificado de Jackson–Rees). Tal vez una manera menos confusa de clasificar los circuitos sin recirculación de uso común en medicina veterinaria se basaría en la configuración de la tubería conductora (es decir, coaxial o no coaxial), la ubicación del sistema evacuador (esto es, proximal o distal a la bolsa reservorio), y el método de evacuación (válvula LPA, válvula de compresión o llave de paso). El diseño coaxial del sistema de Bain reduce el volumen global y constituye un método para calentar en caso necesario los gases inspirados fríos. Los bloques de montaje son medios convenientes para disponer de sistemas sin recirculación y aportan puntos de conexión fijos para circuito de respiración, bolsa reservorio y tubería evacuadora. El uso de un bloque de montaje minimiza la probabilidad de conexiones erróneas, desconexiones o acodamiento de mangueras. La colocación fija respecto de la máquina de anestesia también permite al anestesiólogo evaluar con facilidad la integridad de todas las conexiones. Los sistemas sin recirculación que se utilizan sin un bloque de montaje pueden colocarse en cualquier sitio del área de trabajo anestésico y corren el riesgo de ser cubiertos con campos quirúrgicos, caer de la plancha, o ser derribados por las patas del animal o al mover otros equipos en el quirófano, todo lo cual incrementa la posibilidad de ocasionar complicaciones anestésicas. La mayoría de los bloques de montaje también tiene un manómetro integrado; ésta es una adición invaluable que permite al usuario vigilar y evaluar cambios de presión en las vías respiratorias. Casi ningún sistema sin recirculación que se expende a veterinarios está configurado con un manómetro como parte del sistema estándar, lo que, junto con los altos GGN y los volúmenes relativamente reducidos del circuito, expone a los pacientes al riesgo de barotraumatismo accidental. Una solución a este problema, si no se dispone de un bloque de montaje con manómetro, consiste en adquirir manómetros desechables diseñados para su uso con una bolsa de reanimación. Pueden instalarse con facilidad en todos los sistemas sin recirculación y usarse muchas veces; constituyen un método económico para determinar las presiones en las vías respiratorias (figura 5-11). Sistema evacuador de gases de desecho El sistema evacuador incluye la válvula LPA, una interfaz y un sistema de eliminación de gases de desecho. Este último puede ser activo o pasivo. Un sistema pasivo no usa presión negativa, mientras que uno activo emplea presión negativa alta o baja. El tipo de sistema de eliminación de gases de desecho determina la necesidad y el tipo de interfaz de gases de desecho requerido. Los sistemas de gases de desecho pasivos pueden usar una canastilla de carbón activado para desactivar anestésicos halogenados, o desviar los gases anestésicos de desecho a través de un corto conducto fuera del ambiente de trabajo directamente en la atmósfera. Los sistemas de evacuación de presión negativa (al vacío) se usan cada vez más en medicina veterinaria. Todos éstos requieren algún tipo de interfaz de evacuación para funcionar de manera apropiada. Lo ideal es que las interfaces de evacuación de gases de desecho tengan los medios para 184 Manual de anestesia y analgesia en. . A Figura 5-11. (A) Ejemplo de manómetro desechable para bolsa de reanimación que puede adaptarse para su uso con la mayoría de los sistemas sin recirculación. (B) Vista más próxima de las marcas en el manómetro. La presencia del manómetro permite al anestesiólogo evaluar mejor las presiones en las vías respiratorias. manejar excesos de presión positiva y negativa, un sistema reservorio para absorber cambios en el suministro de gases de desecho al sistema evacuador, y un medio para desactivar cualquier gas halogenado que escape del sistema de evacuación. La mayor parte de estas interfaces no cumple todas estas especificaciones en circunstancias extremas de uso (es decir, sistemas de evacuación de alta presión negativa, cambios de presión dentro del sistema de vacío, cambios notables en la velocidad con que los gases de desecho se expulsan al sistema evacuador), pero la mayoría funciona de manera adecuada en condiciones de operación normales. Los sistemas evacuadores de baja presión negativa (al vacío) funcionan bien con casi todas las interfaces de evacuación. Estos sistemas son específicos a menudo para eliminar gases de desecho, y pueden ser de ubicación central o situarse en la máquina misma. Los sistemas evacuadores de presión negativa alta se encuentran con más frecuencia en instalaciones grandes, con sistemas de vacío médico de ubicación central; el sistema evacuador activo trabaja a la presión negativa alta del sistema empleado para la aspiración médica. Aunque a menudo se considera que es más conveniente y eficaz, en términos de costo, usar el mismo sistema de vacío para to- © Editorial El manual moderno Fotocopiar sin autorización es un delito. B Equipo de anestesia 185 das las funciones realizadas en el hospital, existen algunos desafíos singulares relacionados con este tipo de instalación. Dado que estos sistemas están sometidos a una tremenda cantidad de presión negativa respecto de la necesaria para la evacuación, requieren interfaces de evacuación ajustables para regular el nivel de aspiración aquí, y ajustes menores frecuentes para prevenir el colapso de la bolsa reservorio (componente distensible) del sistema de respiración, que hace difícil o imposible para el paciente inspirar de manera completa. Cualquiera que sea el tipo de sistema evacuador usado, debe disponerse de canastillas de carbón activado para situaciones en que no se dispone de otros modos de evacuación de gases anestésicos de desecho (p. ej., cuando se traslada a pacientes conectados a la máquina de anestesia o cuando se trabaja en zonas sin instalaciones de evacuación). Procedimiento de revisión sistemática de la máquina de anestesia La valoración sistemática de la máquina de anestesia y los sistemas relacionados antes y durante del periodo anestésico debe ser parte de las intervenciones operatorias normales (ION) de cada anestesiólogo. Al parecer, las fallas del equipo son una causa relativamente común de morbilidad y mortalidad relacionadas con anestesia.12 En muchos países se han desarrollado y publicado normas de seguridad y recomendaciones de verificación preanestésica del equipo de anestesia humana, junto con regulaciones para la industria y el personal de anestesia. Infortunadamente, no hay una norma reconocida en general con recomendaciones de verificación preanestésica en medicina veterinaria. Sin embargo, existe una excelente lista de verificación para anestesiólogos veterinarios propuesta por Hartsfield basada en las Anesthesia Apparatus Checkout Recommendations del Center for Devices and Radiological Health de la U.S. Food and Drug Administration.10,13 En el cuadro 5-2 se presenta un resumen modificado de la lista de verificación de Hartsfield. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 5-2. Recomendaciones para la revisión de aparatos de anestesia veterinariaa Sistema de alta presión Los suministros centrales de gas (oxígeno, óxido nitroso, aire) deben ser adecuados en cantidad y presión. La presión de la tubería central no debe fluctuar y debe permanecer en su nivel predeterminado (por lo regular ~50 psi) cuando los flujómetros de la máquina de anestesia se ajustan a un gasto de 3 a 5 L/min. Los suministros portátiles de gas (cilindros de oxígeno en la máquina de anestesia) deben ser adecuados en cantidad y presión. Estos cilindros deben revisarse en busca de fugas. Con el flujómetro apagado y la válvula del cilindro abierta, no debe haber fugas audibles ni decremento de la presión del cilindro con el tiempo (p. ej., 10 min). Sistema de baja presión Probar los flujómetros de cada gas. Con el control de flujo apagado, el flotador debe reposar en el fondo del tubo de vidrio. Ajustar el flujómetro en toda su escala; el flotador debe moverse con suavidad, sin detenerse ni realizar movimientos erráticos. Los vaporizadores deben estar llenos, con las tapas apretadas y el selector de control en la posición de apagado. Las conexiones de entrada y salida deben estar colocadas y aseguradas. Revisar el sistema de baja presión en busca de fugas. 1) Conectar una “perilla de aspiración” a la salida de gas común. 2) Oprimir la perilla hasta que se colapse por completo. 3) Verificar que la perilla permanezca completamente colapsada por un mínimo de 10 s. 4) Abrir los vaporizadores, uno a la vez, si hay más de dos, y repetir los pasos 2 y 3 con cada uno. Sistema evacuador Asegurar la conexión correcta entre el sistema evacuador y la válvula LPA. Ajustar el flujo de vacío de gases de desecho, si es posible, para cubrir las necesidades de la intervención específica. 186 Manual de anestesia y analgesia en. . Cuadro 5-2. (Continuación) Sistema de respiración Sistema de recirculación (circular) Asegurarse de que el tamaño seleccionado del circuito y la bolsa reservorio sea apropiado para el paciente. Revisar que el sistema de respiración esté completo y sin daños y obstrucciones. Verificar que el material absorbente de dióxido de carbono sea el adecuado. Realizar una prueba de fuga del sistema de respiración. 1) Colocar en cero todos los flujos de gas (o en el valor mínimo). 2) Cerrar la válvula LPA y ocluir la pieza en Y. 3) Presurizar el sistema de respiración usando la válvula de oxígeno de urgencia a una presión aproximada de 30 cm H2O. 4) Asegurarse de que la presión permanezca en un valor fijo por un mínimo de 10 s. De manera alternativa, la rapidez de fuga necesaria para mantener la presión en 30 cm H2O debe ser menor de 300 ml/min. 5) Abrir la válvula LPA y asegurarse de que la presión disminuya de manera apropiada. Sistema sin recirculación Asegurarse de que el tamaño seleccionado de circuito y bolsa reservorio sea el apropiado para el paciente. Revisar que el sistema de respiración esté completo y sin daños y obstrucciones. Realizar una prueba de fuga del sistema de respiración. 1) Colocar en cero todos los gastos de gas (o en el valor mínimo). 2) Cerrar la válvula LPA y ocluir el puerto del paciente. 3) Presurizar el sistema de respiración usando la válvula de oxígeno de urgencia a una presión aproximada de 30 cm H2O. Si el sistema de respiración no cuenta con un manómetro, la bolsa reservorio debe permanecer completamente distendida sin pérdida de presión. 4) En el caso de los sistemas de Bain (Mapleson D coaxial), debe evaluarse la integridad del tubo interno. Con el flujómetro calibrado a 1 L/min, el tubo interno debe ocluirse brevemente y el flotador del flujómetro debe descender a un valor cercano a cero. 5) Abrir la válvula LPA y asegurarse de que la presión disminuya de manera apropiada. Ventilador Colocar una segunda bolsa reservorio en el circuito del paciente y asegurarse de que sea apropiada para la talla del sujeto. Fijar los parámetros del ventilador apropiados para el paciente. Conectar el ventilador del modo indicado por el fabricante y llenar el fuelle y la bolsa reservorio mediante la válvula de oxígeno de urgencia. Encender el ventilador y asegurarse de que se suministren volúmenes corrientes adecuados y que durante la espiración el fuelle se llene por completo. Verificar el funcionamiento correcto de las válvulas unidireccionales del sistema circular, si es aplicable. Manipular los parámetros de la ventilación para asegurarse de que todo funciona de manera normal. Apagar el ventilador y desconectarlo según indique el fabricante. Monitores Asegurarse de que se encuentran todos los cables y conectores. Asegurarse de que están programadas de manera apropiada las alarmas. Esta lista de verificación para el aparato de anestesia no sustituye la experiencia de un operario capaz que vigile de manera continua dicho equipo. Todas las partes de la máquina de anestesia y el sistema de respiración deben estar presentes, funcionar de manera apropiada, sin defectos y correctamente conectadas. Esta lista incluye la evaluación de ventiladores automatizados y monitores del paciente, si los hay. a Debido a la gran variabilidad y falta de estándares entre el equipo de anestesia veterinaria, no todos los procedimientos de verificación se aplican a todas las máquinas de anestesia. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Con la válvula LPA completamente abierta y la pieza en Y ocluida: 1) Permitir que el reservorio de evacuación vuelva al colapso completo y verificar que el manómetro del circuito indique aproximadamente cero. 2) Con la válvula de oxígeno de urgencia activada, permitir que la bolsa reservorio de evacuación se distienda por completo y luego verificar que el manómetro del circuito indique menos de 10 cm H2O. Si el sistema evacuador incluye una canastilla de carbón activado, es necesario asegurarse de la calidad del carbón absorbente. Equipo de anestesia 187 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Ventiladores para anestesia El ventilador para anestesia es un dispositivo automatizado que tiene el objetivo de ventilar al paciente en el periodo perianestésico. La mayor parte de estos ventiladores carece de la complejidad de control y funcionamiento que se observa en los ventiladores de las unidades de cuidados intensivos (UCI), y trabajan mejor cuando se usan para ventilar a pacientes con funcionamiento relativamente normal de los pulmones y necesidades de ventilación simples. Pese a ello, en la actualidad algunos ventiladores para anestesia específicos para uso humano y veterinario ofrecen características y desempeño que rivalizan con los de un ventilador de UCI básico. En EUA, los ventiladores de anestesia diseñados para uso en seres humanos están sujetos a una serie de normas internacionales y nacionales, en tanto que los diseñados para el mercado veterinario no están obligados a satisfacer normas de diseño similares. Una vez más, esto hace imperativo que el anestesiólogo veterinario no sólo comprenda a la perfección las implicaciones fisiológicas y prácticas del uso del ventilador, sino que debe conocer muy bien el diseño, funcionamiento y resolución de problemas de cada ventilador que use. Existen dos tipos principales de ventiladores utilizados en anestesia veterinaria: el ventilador de doble circuito, que usa gas para comprimir el fuelle (es decir, el segundo circuito de gas) y el ventilador impulsado por pistón, que carece de un segundo circuito de gas. Un ventilador para anestesia sustituye la bolsa reservorio y la válvula LPA por un fuelle (o pistón) y una válvula de derrame, respectivamente. Los ventiladores impulsados por pistón emplean pistones controlados electrónicamente para comprimir el gas en el circuito de respiración. El uso de un pistón controlado de manera electrónica elimina la necesidad de un segundo circuito (esto es, el gas impulsor), y esto permite al ventilador administrar de manera más precisa volúmenes corrientes, ya que no se altera por la presencia de un gas impulsor compresible. Se usa energía eléctrica para desplazar arriba y abajo el pistón por medio de un montaje de servomotor y tornillo esférico (activador lineal). Los ventiladores impulsados por pistón ofrecen al usuario una gama muy amplia de opciones elaboradas de ventilación que no están casi nunca disponibles en los ventiladores de doble circuito comunes. Cada ventilador impulsado por pistón es único en su diseño específico, pero muchos comparten algunas de las siguientes características: cilindro, pistón, activador lineal, diafragmas rodantes y válvulas de alivio de presión positiva/negativa. La configuración exacta de cada componente y el mecanismo para facilitar la espiración y la respiración espontánea varían entre los distintos fabricantes. El ventilador Tafonius para estación de trabajo anestésica de animales grandes (Hallowell EMC, Pittsfield, MA) es un ventilador impulsado por pistón específico para veterinaria, y se utiliza aquí como ejemplo para describir el funcionamiento de un ventilador anestésico impulsado por pistón. Las descripciones de otros ventiladores impulsados por pistón para uso humano, como los Drager Apollo, Divan o Fabius GS (Dräger Medical, Inc.), pueden consultarse en otra parte.14 Hay dos diafragmas rodantes que sellan el pistón del ventilador Tafonius para prevenir el mezclado de aire ambiental y gas del circuito del paciente. El diafragma inferior sella el gas respiratorio abajo del pistón en el sistema de respiración. El diafragma superior sella el lado de arriba del diafragma inferior al aire ambiental, de tal modo que crea un espacio entre los dos diafragmas. Se aplica un vacío a este espacio, lo que mantiene los dos diafragmas estrechamente aplicados contra el pistón y las paredes del cilindro. Conforme el pistón desciende, el espacio abajo del diafragma inferior se reduce y fuerza gas hacia los pulmones del paciente, y a medida que éste exhala, el 188 Manual de anestesia y analgesia en. . pistón asciende. Durante la ventilación controlada, el pistón impulsa la inspiración de acuerdo con los parámetros del ventilador. Cuando el paciente espira, el pistón se desplaza en respuesta a la presión en las vías respiratorias, medida en la pieza en Y del paciente. Cuando la presión en las vías respiratorias aumenta en 0.5 cm H2O, el pistón asciende lo suficiente para hacer de nuevo cero la presión en las vías respiratorias. Esta corrección se realiza cada 5 ms (200 veces por segundo). Ello asegura que, a menos que se desee, no habrá resistencia a la exhalación (es decir, presión teleespiratoria positiva [PTEP]). La mayoría de los fuelles ascendentes estándares posee una PTEP obligatoria (2 a 4 cm H2O) debido al diseño de la válvula de derrame del ventilador, necesaria para compensar el peso del fuelle. Durante la respiración espontánea, el pistón se mueve arriba (espiración) y abajo (inspiración) en respuesta a los cambios en la presión medida en las vías respiratorias, lo cual asegura que dicha presión se mantenga en cero. La espiración ocurre, como se mencionó antes, mientras que, a la inversa, durante la inspiración, cuando la presión en las vías respiratorias disminuye en 0.5 cm H2O, el pistón desciende lo suficiente para llevar de nuevo a cero dicha presión. Las válvulas de alivio de presión positiva y negativa electrónicas se localizan en el múltiple de evacuación para proteger contra excesos de presión positiva o negativa en el circuito del paciente (figura 5-12). DIAFRAGMA RODANTE SUPERIOR EL VACÍO MANTIENE EL DIAFRAGMA RODANTE DE SILICÓN FIRME CONTRA LAS PAREDES DEL CILINDRO Y EL PISTÓN PISTÓN DIAFRAGMA RODANTE INFERIOR CÁMARA RESPIRATORIA INFERIOR (CIRCUITO DE GAS DEL PACIENTE) ARTESA ABSORBENTE FLUJO DE GAS INSPIRATORIO FLUJO DE GAS ESPIRATORIO SISTEMA DE DIAFRAGMAS RODANTES DE TAFONIUS Figura 5-12. Configuración de un ventilador impulsado por pistón durante inspiración (izquierda) y espiración (derecha). Modificado a partir de un diagrama cortesía de Hallowell EMC, Pittsfield, MA. © Editorial El manual moderno Fotocopiar sin autorización es un delito. ACTIVADOR LINEAL Equipo de anestesia 189 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Ventiladores de doble circuito En esencia, los ventiladores de doble circuito constan del montaje del fuelle y el mecanismo de control para el gas impulsor. El mecanismo de control es casi siempre un microprocesador electrónico en los ventiladores más modernos, pero algunos modelos anteriores usaban sistemas neumáticos y mecánicos para controlar el gas impulsor. El montaje de los fuelles sustituye la bolsa reservorio y la válvula LPA y consta de los siguientes componentes: fuelles, carcasa, válvula de escape, válvula de derrame y conexión para la manguera del ventilador. El circuito primario es continuo con el circuito del paciente y consta del fuelle y la válvula de derrame. El segundo circuito contiene el gas impulsor utilizado para comprimir el fuelle. El circuito de respiración y el circuito del gas impulsor no están conectados; el fuelle actúa como una interfaz distensible entre estos dos circuitos. Se permite que el gas impulsor entre en la carcasa del fuelle por un lapso específico y se suministra a un ritmo específico para comprimir el fuelle y cerrar la válvula de derrame; esto fuerza el desplazamiento del gas desde el fuelle hasta los pulmones del paciente, lo cual expande el tórax. Durante la espiración, el suministro de gas impulsor se suspende (disminuye la presión en la carcasa y por tanto también en el circuito del paciente), y se permite que el gas en la carcasa del fuelle salga por una válvula de escape, lo cual hace posible que el paciente exhale de modo pasivo hacia el fuelle. La válvula de derrame vuelve a abrirse y ello permite que el exceso de GGN en el circuito del paciente escape, lo cual impide que se acumule presión dentro del circuito del paciente. Aunque existen diferencias de diseño específicas en el modo en que se realizan estas funciones entre los ventiladores de doble circuito, los principios generales son similares (figure 5-13). Fuelle (configuración) El fuelle es un dispositivo parecido a un acordeón unido a la parte superior o inferior de un ensamblaje. Los ventiladores para anestesia pueden tener el fuelle ascendente (levadizo) o descendente (suspendido). Los términos ascendente y descendente se refieren al sentido en que se mueve el fuelle durante la exhalación y se han usado históricamente para describir la orientación del fuelle. Sin embargo, cada vez es más frecuente sustituir estos términos por levadizo (ascendente) o suspendido (descendente) para describir la posición el fuelle durante la pausa espiratoria; muchas veces esto se considera una descripción más obvia de la configuración de fuelle. La mayoría de los ventiladores modernos utiliza una configuración de fuelle ascendente en la que éste se mueve hacia la base del ventilador durante la inspiración, y en la exhalación se expande hacia arriba. El volumen corriente puede determinarse al ajustar el tiempo o el gasto inspiratorios (o ambos), o por medio de un plato u otro dispositivo bloqueador que limite la excursión ascendente del fuelle (figura 5-13B). Las válvulas de derrame de estos ventiladores normalmente oponen poca resistencia (2 a 4 cmH2O) a la abertura, lo cual crea una ligera PTEP en el sistema. Esto se realiza para contrarrestar la tendencia del fuelle a colapsarse por su peso y su naturaleza elástica. En el caso de fuelles muy grandes y pesados, esto puede tener el efecto de producir una cantidad clínicamente relevante de PTEP. En algunas circunstancias, ello se considera deseable (p. ej., en caballos), pero al menos un fabricante ha desarrollado un método para vencer este efecto de PTEP al introducir la opción de aplicar un ligero vacío al interior de la carcasa del fuelle. Una característica deseable de la configuración de fuelle ascendente es que si ocurre una fuga en el sistema, el fuelle no se expande por completo y de manera progresiva se colapsa en la parte inferior. Es fácil para el anestesiólogo observador detectar una fuga. Además, es muy fácil determinar el volumen corriente del sujeto, en casi todos los casos al observar las marcas calibradas en la carcasa del fuelle. 190 Manual de anestesia y analgesia en. . A B Carcasa del fuelle del ventilador Plato limitante del volumen corriente; se usa para ajustar dicho volumen y no se encuentra en todos los ventiladores Circuito del gas impulsor Válvula de escape del gas impulsor del ventilador: puede liberar el gas de desecho al ambiente. Se cierra cuando el gas impulsor fluye y se abre cuando el flujo cesa. Circuito de gas del paciente: se conecta al puerto de la bolsa de recirculación del sistema circular Válvula de derrame del circuito del paciente: sustituye la válvula LPA del sistema. La válvula se cierra con la presión que se crea cuando el fuelle es comprimido por el gas impulsor y se abre cuando la compresión cesa. Gas de desecho del circuito del paciente: se conecta a la interfaz de evacuación VENTILADOR PARA ANESTESIA DE DOBLE CIRCUITO Figura 5-13. (A) Ejemplo de ventilador de fuelle ascendente, con un sistema de plato que puede usarse para limitar el volumen corriente. De manera alternativa, el volumen corriente puede limitarse al ajustar el flujo de gas inspiratorio, el tiempo inspiratorio o ambos. Cortesía de Mallard Medical, Redding, CA. (B) Esquema de un ventilador de doble circuito genérico que demuestra los flujos de gas dentro del ventilador durante inspiración y espiración. Nótese que la posición exacta y el diseño de diversos componentes varían entre los fabricantes. Ilustración de Kath Klassen, BSc (Agr), DVM. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fuelle © Editorial El manual moderno Fotocopiar sin autorización es un delito. Equipo de anestesia 191 El fuelle descendente (suspendido) está fijado a la parte alta del montaje del ventilador y se comprime hacia arriba durante la inspiración. En la exhalación, el fuelle desciende de manera pasiva; esto se facilita por un peso que se coloca en la parte más baja. Cuando el fuelle desciende, puede causar una ligera presión negativa en él mismo y el sistema de respiración. Si ocurren fuga o desconexión en el sistema de respiración, el peso en el fuelle hace que éste se expanda de manera normal y lleve aire ambiental al sistema de respiración a través de una válvula de alivio de presión negativa. Durante la inspiración ulterior, no sólo el gas en el circuito de respiración se diluye por el aire ambiental, sino que todo el gas inspirado o parte de él se pierde en el ambiente. Las fugas (en particular las grandes) en el sistema de respiración no se identifican con tanta facilidad de manera visual al inspeccionar el fuelle en esta configuración del ventilador en comparación con la configuración ascendente. Sin embargo, es posible reconocer fugas pequeñas, que se tornan más significativas debido a la presión elevada. Por ejemplo, una fuga pequeña entre el manguito de la SET y la tráquea del paciente se vuelve mucho más grande al aumentar las presiones en las vías respiratorias relacionadas con la ventilación a presión positiva intermitente (VPPI); esto dirige al entorno parte del volumen corriente que estaba destinado al sujeto. Al exhalar, un volumen de gas inadecuado para reponer el volumen perdido en el fuelle durante la inspiración se expulsa desde los pulmones del animal. A continuación, el fuelle tiende a caer pero lo hace con más lentitud si el ritmo de aspiración de aire ambiental a través de una pequeña fuga (y el volumen aportado al sistema a través del GGN) es menor que el necesario para que el fuelle descienda con normalidad. El resultado es un descenso muy lento o incompleto del fuelle antes de que ocurra la siguiente inspiración. Este efecto se reconoce más a menudo durante la ventilación de animales grandes, cuando la fuga es con frecuencia relativamente pequeña (y se eleva con presión positiva), el volumen corriente es relativamente grande, y los GGN son bajos respecto del volumen corriente del sujeto. Hay al menos un ventilador de doble circuito diseñado de manera específica para pacientes que requieren volúmenes corrientes menores de 100 mL y que sustituye el fuelle por un disco flotante. Éste separa el circuito de respiración del paciente y el circuito de gas impulsor. En esta configuración, estos circuitos no entran en contacto entre sí sino que se mueven atrás y adelante a través de la misma superficie del tubo de ventilación. Esta configuración requiere concordancia muy precisa del tubo de ventilación y el disco flotante para asegurar que el gas permanezca separado dentro de sus respectivos circuitos y que el disco se mueva con libertad sin resistencia alguna. Carcasa Una carcasa de plástico transparente cubre el fuelle y permite que el anestesiólogo observe su movimiento. Es un recipiente sellado alrededor del fuelle que puede estar presurizado, de tal modo que causa la compresión del fuelle. En un lado de la carcasa suele haber una escala que indica el volumen corriente aproximado que se suministra. Sin embargo, este volumen no siempre equivale al volumen corriente real recibido por los pacientes (véanse más adelante los factores que afectan el volumen corriente). Válvula de escape La válvula de escape se comunica con el interior de la carcasa y el ambiente en los ventiladores de doble circuito. Durante la inspiración, la válvula de escape está cerrada, lo cual permite que dentro de la carcasa se acumule presión proveniente del gas impulsor. En la exhalación la válvula 192 Manual de anestesia y analgesia en. . de escape se abre (y el suministro de gas impulsor cesa), lo cual posibilita que el gas impulsor presurizado escape y que el fuelle vuelva a expandirse. Los ventiladores impulsados por pistón no necesitan una válvula de escape. Válvula de derrame La válvula de derrame sustituye a la válvula LPA y algunas veces recibe los nombres de válvula respiradora, válvula vaciadora, válvula de rebose, salida de gas espirado, válvula de disparo, válvula de alivio o válvula de alivio de presión. Se usa para dirigir el exceso de aire nuevo desde el circuito de respiración hacia el sistema evacuador. Durante el ciclo inspiratorio del ventilador, la válvula de derrame está cerrada para prevenir el escape de gas hacia el sistema evacuador. Esto es similar al cierre de la válvula LPA para suministrar de manera manual una respiración mediante la bolsa reservorio. Durante la exhalación, y una vez que el fuelle se ha expandido por completo a su volumen preinspiratorio original, la válvula de derrame vuelve a abrirse. Con una configuración de fuelle ascendente, la válvula de derrame normalmente tiene una presión de abertura mínima de 2 a 4 cmH2O para contrarrestar la fuerza descendente creada por el peso del fuelle. Esto permite al fuelle llenarse por completo durante la exhalación. La válvula de derrame se controla de manera neumática en los ventiladores que utilizan gas para comprimir el fuelle, pero en el caso de los ventiladores impulsados por pistón puede abrirse y cerrarse de manera electrónica. Control del gas impulsor del ventilador El gas impulsor que se suministra al ventilador se encuentra a presión intermedia (es decir, 35 a 55 psi) y se envía a un gasto específico por un lapso específico a fin de producir un volumen de gas suficiente para comprimir el fuelle y ventilar los pulmones del sujeto. En condiciones normales, el gas impulsor es oxígeno al 100% y se usa para minimizar el peligro de que se reduzca la concentración de oxígeno del circuito de respiración en caso de fuga entre los dos circuitos del ventilador (de respiración y de gas impulsor). El flujo de gas impulsor hacia el ventilador se controla de manera electrónica mediante selectores rotulados de distintas maneras para ajustar tres variables esenciales: tiempo que se permite la presencia de gas impulsor en la carcasa del fuelle (tiempo inspiratorio), gasto del gas impulsor en la carcasa del fuelle (gasto inspiratorio), y pausa entre inhalaciones (tiempo espiratorio). Al manipular estas tres variables es posible controlar las variables más comunes de frecuencia respiratoria (f), volumen corriente (Vt) y cociente inspiratorio/espiratorio (I/E). Los ventiladores controlados de manera neumática son un poco más difíciles de operar, pero en esencia en ellos es posible controlar las mismas variables enumeradas antes a través de manipulaciones relacionadas con umbrales de presión, gastos y tiempo. Estos dispositivos también © Editorial El manual moderno Fotocopiar sin autorización es un delito. Conexión para la manguera del ventilador La conexión para la manguera del ventilador es una salida de tamaño estándar (pieza cónica macho de 22 mm) que se halla en la parte posterior del ensamblaje del fuelle del ventilador. Para conectar el ventilador al sistema de respiración se emplea un tramo de tubería de tamaño estándar entre la conexión para la manguera del ventilador y la pieza que habitualmente fija la bolsa reservorio a la máquina de anestesia. En máquinas de anestesia con ventiladores integrados, esta conexión se establece a menudo mediante el uso de un interruptor o selector, lo cual minimiza el riesgo de conexiones erróneas, desconexiones o acodamientos de mangueras (figura 5-14). Equipo de anestesia 193 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 5-14. En máquinas de anestesia con ventiladores integrados, a menudo se utiliza un interruptor sencillo para activar el ventilador. Esto minimiza el peligro de conexiones erróneas, desconexiones o acodamiento de mangueras. se denominan algunas veces ventiladores limitados por presión, ya que el volumen corriente se determina al alcanzar un límite de presión en vez de un límite de volumen. Factores que influyen en el volumen corriente suministrado A menos que el ventilador para anestesia tenga integrados mecanismos de compensación, diversos factores pueden afectar el volumen corriente real suministrado al paciente. En la mayor parte de las circunstancias, y si se siguen los procedimientos apropiados para ventilación, vigilancia y montaje, estos factores son insignificantes. GGN Aunque muchos ventiladores para anestesia modernos de uso en seres humanos compensan cambios en el GGN, la mayoría de los ventiladores de uso veterinario no lo hace. Los circuitos electrónicos de la mayor parte de los ventiladores para anestesia veterinaria están diseñados para suministrar una cantidad fija de gas impulsor sin importar la compresión real del fuelle. 194 Manual de anestesia y analgesia en. . Durante la inspiración, el GGN hacia el circuito del paciente no deja de contribuir al volumen corriente real del sujeto. Si se incrementa el GGN o se prolonga el tiempo inspiratorio, el resultado es volúmenes corrientes más grandes y, aunque este efecto es insignificante en la mayoría de los pacientes, puede ser relevante en sujetos muy pequeños, en los cuales un GGN de 1 000 mL/min aporta alrededor de 17 mL/s de gas al volumen corriente del paciente durante la inspiración. Distensibilidad y volúmenes de compresión Los cambios en la distensibilidad del sistema de respiración pueden acompañarse de cambios en el volumen corriente de gas suministrado al enfermo. Los aumentos de la distensibilidad de un sistema de respiración pueden acompañarse de decrementos en el volumen corriente a medida que se consume volumen de gas, lo cual expande los componentes respiratorios. Además, los cambios de las presiones en las vías respiratorias relacionados con la ventilación pueden modificar el volumen corriente real del gas que el paciente recibe, ya que el gas es compresible y su volumen se reduce cuando se somete a presiones crecientes. Alarmas No existen configuraciones de alarma estándares en los ventiladores para anestesia veterinaria. Algunas de las alarmas más comunes se describen a continuación. Alarma de baja presión del gas impulsor Algunas veces ésta se conoce también como alarma de baja presión y detecta el momento en que la presión del gas impulsor desciende por debajo de un valor predeterminado (p. ej., 35 psi). Este decremento puede hacer que decrezca el volumen corriente. Alarmas de presión en vías respiratorias Algunos ventiladores cuentan con alarmas de alta y baja presiones en las vías respiratorias. Éstas son variables importantes que pueden ayudar a proteger a un paciente de barotraumatismo (presión elevada en las vías respiratorias) y ayudar a detectar fugas o desconexiones. Estos registros de alarma puede predeterminarlos el fabricante o ajustarlos el usuario. En ocasiones, las alarmas predeterminadas no son compatibles con los requerimientos de ventilación en algunos pacientes. Por ejemplo, una alarma de presión mínima en las vías respiratorias predeterminada en 6 cmH2O puede exceder la presión máxima en las vías respiratorias que se obtiene cuando se ventila a pacientes muy pequeños con tórax extremadamente distensible (p. ej., gatitos, cachorros, reptiles y aves). © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fugas Las fugas dentro del sistema (es decir, alrededor de la sonda endotraqueal) afectan el volumen corriente suministrado dado que parte del volumen escapa y el resultado es la reducción del volumen corriente administrado. Si bien en las vías respiratorias los chorros laterales de gas que se dirigen a monitores no se consideran fugas, sí extraen un pequeño volumen de gas del sistema de respiración, el cual puede reducir en grado marginal el volumen corriente. Este efecto es insignificante, pero puede ser importante en animales que requieren volúmenes corrientes en extremo pequeños (es decir, <50 mL). Equipo de anestesia 195 Montaje correcto del ventilador y vigilancia © Editorial El manual moderno Fotocopiar sin autorización es un delito. Antes de usar un ventilador para anestesia es importante que el anestesiólogo determine con claridad los registros deseados del ventilador. El anestesiólogo debe tener una sólida comprensión de indicaciones, contraindicaciones y fisiología de la VPPI antes de iniciar la ventilación. Además, debe asegurarse de conocer todas las características y el funcionamiento correcto del ventilador que utiliza, revisando las instrucciones del fabricante. El uso incorrecto del equipo de ventilación a presión positiva supone una morbilidad y mortalidad innecesarias. Los pasos que siguen se presentan como una guía general para el montaje de un ventilador, y tal vez no sean aplicables a todos los ventiladores, pacientes y circunstancias. • Asegurarse de que el ventilador reciba potencia apropiada. La mayoría de los ventiladores requiere una fuente de gas comprimido y suministro eléctrico. • Conectar la manguera de evacuación desde el ventilador hasta el sistema evacuador. Muchas interfaces de evacuación tienen dos puertos de evacuación, uno para la máquina de anestesia y otro para un ventilador. • Vaciar la bolsa reservorio en el sistema de evacuación, quitar la bolsa reservorio y conectar la manguera de respiración del ventilador al montaje para la bolsa reservorio. Cerrar la válvula LPA. Algunas máquinas con ventiladores integrados no requieren el retiro de la bolsa reservorio y el cierre de la válvula LPA; en cambio, se usa un interruptor o selector para aislar la bolsa reservorio y la válvula del ventilador. • Permitir el llenado del fuelle. Esto puede facilitarse al incrementar de manera momentánea el GGN. Por lo general no debe usarse la válvula de oxígeno de urgencia con este fin, a menos que el GGN no pueda elevarse en grado adecuado para llenar el fuelle con relativa rapidez (p. ej., ventilación de animal grande). • Iniciar la ventilación con base en los parámetros ventilatorios predeterminados. Por lo regular es mejor comenzar con volúmenes corrientes en el extremo inferior del intervalo para evitar barotraumatismo o volutraumatismo. En todas las circunstancias es vital evaluar de inmediato y luego de manera sistemática las presiones máximas en las vías respiratorias que se generan durante la inspiración en busca de cambios en la distensibilidad respiratoria y evitar el barotraumatismo. • Deben hacerse ajustes adicionales en la ventilación después de evaluar presiones máximas en las vías respiratorias, CO2 corriente final, oximetría de pulso, análisis de gases en sangre arterial o alguna combinación de éstos. Referencias 1. Davey AJ, Diba A: Ward’s anaesthetic equipment. Philadelphia, PA: Elsevier Ltd, 2005A. 2. Dorsch JA, Dorsch SE: Understanding anesthesia equipment. New York: Lippincott Williams & Wilkins, 2008d. 3. Cassu RN, Luna SP, Teixeira Neto FJ, Braz JR, Gasparini SS, Crocci AJ: 2004. Evaluation of laryngeal mask as an alternative to endotracheal intubation in cats anesthetized under spontaneous or controlled ventilation. Vet Anaesth Analg 2004;31:213–221. 196 Manual de anestesia y analgesia en. . © Editorial El manual moderno Fotocopiar sin autorización es un delito. 4. Fulkerson PJ, Gustafson SB: Use of laryngeal mask airway compared to endotracheal tube with positive-pressure ventilation in anesthetized swine. Vet Anaesth Analg 2007;34:284–288. 5. Kazakos GM, Anagnostou T, Savvas I, Raptopoulos D, Psalla D, Kazakou IM: Use of the laryngeal mask airway in rabbits: placement and efficacy. Lab Anim (NY) 2007;36:29–34. 6. Wiederstein I, Moens YP: Guidelines and criteria for the placement of laryngeal mask airways in dogs. Vet Anaesth Analg 2008;35:374–382. 7. Stewart SL, Secrest JA, Norwood BR, Zachary R: A comparison of endotracheal tube cuff pressures using estimation techniques and direct intracuff measurement. AANA J 2003;71:443–447. 8. Hamilton WK: Nomenclature of inhalation anesthetic systems. Anesthesiology 1964;25:3–5. 9. Dorsch JA, Dorsch SE: The breathing system: general principles, common components, and classifications . In: Understanding anesthesia equipment. J.A. Dorsch and S.E. Dorsch, eds. New York: Lippincott Williams & Wilkins, 2008. 10. Hartsfield SM: Anesthetic machines and breathing systems. In: Lumb and Jones’ veterinary anesthesia and analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, 2007. 11. Davey AJ, Diba A: Working principles of breathing systems. In: Ward’s anaesthetic equipment. A.J. Davey and A. Diba, eds. Philadelphia, PA: Elsevier, 2005b. 12. Dorsch JA, Dorsch SE: Equipment checkout and maintenance. In: Understanding anesthetic equipment, 5th ed. J.A. Dorsch and S.E. Dorsch, eds. New York: Lippincott Williams & Wilkins, 2008b. 13. Hartsfield SM: Anesthesia equipment. In: Small animal anesthesia and analgesia. G.L. Carroll, ed. Ames, IA: Blackwell Publishing, 2008. 14. Dorsch JA, Dorsch SE: Anesthesia ventilators. In: Understanding anesthetic equipment, 5th ed. J.A. Dorsch and S.E. Dorsch, eds. New York: Lippincott Williams & Wilkins, 2008a. Capítulo 6 Vigilancia del paciente Steve C. Haskins © Editorial El manual moderno Fotocopiar sin autorización es un delito. Introducción El objetivo de la anestesia es producir una alteración reversible del funcionamiento del sistema nervioso central (SNC), caracterizada por inconciencia, amnesia, analgesia e inmovilidad adecuadas para la práctica de una amplia variedad de intervenciones, incluidas las quirúrgicas. Infortunadamente, los fármacos necesarios para inducir estos cambios en el funcionamiento del SNC también afectan la homeostasis del sujeto. En consecuencia, el manejo anestésico puede considerarse un acto de equilibrio en el cual la profundidad adecuada de la anestesia se pondera contra la depresión de otros aparatos y sistemas clave. La capacidad de vigilar el funcionamiento tanto del SNC como de estos aparatos y sistemas, en particular los aparatos circulatorio y respiratorio, es crucial para mantener dicho equilibrio. Las estadísticas sobre riesgo anestésico, morbilidad y mortalidad en perros y gatos se presentan en el capítulo 1. El método habitual para cuantificar los resultados de la anestesia en medicina veterinaria ha sido la mortalidad por anestesia. Si bien la mortalidad se ajusta con claridad a la definición del resultado anestésico adverso, la ausencia de mortalidad es, en el mejor de los casos, un referente muy pobre para definir un resultado exitoso. En realidad, a medida que el estándar de atención veterinaria ha avanzado, se ha observado una tendencia creciente a concentrarse en medidas más adecuadas de morbilidad anestésica. Al reducir al mínimo la morbilidad en el periodo perianestésico, la calidad de la atención puede mejorar en grado sustancial y las tasas de mortalidad decrecer de forma inevitable. Este enfoque se basa en la capacidad de definir e identificar anomalías fisiopatológicas clave que contribuyen a la morbilidad anestésica, como hipotensión, hipoxemia, hipercapnia e hipotermia, y de establecer medidas correctivas o cuidados de mantenimiento (o ambos). Con la finalidad de hacerlo de manera eficaz se requieren personal capacitado en vigilancia anestésica y equipo de vigilancia apropiado. Puede obtenerse más información en Recommendations for Monitoring Anesthetized Patients, publicado por el American College of Veterinary Anesthesiologists, en el sitio www.acva.org. Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 197 198 Manual de anestesia y analgesia en. . Vigilancia del funcionamiento del SNC En general, la transición de un plano de anestesia ligera (superficial) a otro de anestesia profunda se relaciona con lo siguiente: pérdida de la memoria, pérdida de la conciencia, incapacidad de moverse en respuesta a un estímulo doloroso y, por último, ausencia de respuesta hemodinámica o electroencefalográfica (EEG) a un estímulo doloroso. La profundidad de la anestesia representa el equilibrio entre las dosis administradas de fármacos anestésicos y coadyuvantes, la intensidad de la estimulación quirúrgica (que tiende a despertar a los pacientes), y la gravedad del trastorno (que propende a acentuar la anestesia). Para intervenciones más prolongadas, los requerimientos anestésicos disminuyen con el tiempo durante un mismo episodio anestésico. En estas situaciones, es apropiado hacer intentos repetidos por reducir de manera gradual la cantidad de anestésico administrada y observar la respuesta del paciente. 1) Es obligada la selección cuidadosa de la dosis administrada de fármacos anestésicos inyectables e inhalables, pero ello de ningún modo garantiza la eficacia de una profunda anestesia apropiada. Medir la concentración corriente final de anestésico inhalable (CFagente) es una modalidad de vigilancia relativamente nueva en anestesia clínica veterinaria y su objetivo es cuantificar la cantidad de anestésico en el sujeto. Es análogo a mensurar las concentraciones plasmáticas de fármacos inyectables, pero tiene aplicación clínica dado que proporciona al anestesiólogo datos continuos en tiempo real. Si bien la CFagente no es una medida de la profundidad anestésica, proporciona más información que el registro del vaporizador, el cual mide tan sólo la cantidad de fármaco suministrada al circuito de respiración. 2) El movimiento espontáneo es un signo confiable de un nivel superficial de anestesia para la mayor parte de los anestésicos, aunque existen varias excepciones a esta regla. El mioclono focal (fasciculación muscular) se ha vinculado con la administración de etomidato y propofol, y no debe interpretarse como un nivel superficial de anestesia. El movimiento muscular espontáneo es común en protocolos anestésicos basados en opioides y tampoco debe tomarse como una indicación de anestesia ligera. La hipertonía muscular puede ser una característica de protocolos basados en ketamina y no debe asumirse como anestesia superficial. 3) El movimiento reflejo en respuesta a la estimulación quirúrgica es un signo confiable de anestesia ligera. Sin embargo, no significa que el animal experimente dolor por un estímulo doloroso. 4) Un incremento súbito de la frecuencia cardiaca (FC), presión arterial (PA), frecuencia respiratoria (FR) o volumen corriente (VC), como respuesta específica a la estimulación quirúrgica, se considera en general un signo confiable de anestesia ligera. Por lo regular, © Editorial El manual moderno Fotocopiar sin autorización es un delito. Métodos subjetivos Los signos físicos de profundidad anestésica dependen en gran medida de la determinación del tono muscular y la actividad refleja. En perros y gatos, tales parámetros varían de un momento al siguiente, de un individuo a otro, y con fármacos anestésicos distintos. Dado que no existe un signo que de manera específica defina la profundidad de la anestesia, es importante valorar todos los signos que sea posible e integrar la información que proporcionan. Los siguientes son puntos clave para la determinación de los signos físicos de profundidad de la anestesia: Vigilancia del paciente 199 5) 6) 7) © Editorial El manual moderno Fotocopiar sin autorización es un delito. 8) 9) 10) estos parámetros fisiológicos tienden a aumentar conforme la anestesia se torna más ligera y a disminuir con anestesia más profunda. Sin embargo, no son indicadores predictivos confiables de la profundidad anestésica. En algunas situaciones, los parámetros fisiológicos permanecen relativamente estables hasta después de que el animal despierta de manera abrupta o sufre un colapso cardiovascular. Además, existen numerosos factores que modifican estos parámetros en cualquier sentido y que no guardan ninguna relación con la profundidad de la anestesia e introducen confusión al cuadro. Profundidad inapropiada de la anestesia es sólo un diagnóstico diferencial más que debe considerarse cuando un animal experimenta aumentos y disminuciones de FC, PA, FR, VC o alguna combinación de ellos. El tono muscular del maxilar inferior (“tono mandibular”) debe ser sustancial, moderado o inexistente en caso de anestesia ligera, intermedia o profunda, respectivamente. Las definiciones de tono sustancial, moderado e inexistente son relativas y varían en perros respecto de los gatos, y en razas caninas pequeñas en relación con las grandes. El tono mandibular se determina con base en la resistencia observada cuando se intenta abrir la boca. En cachorros y gatitos neonatos, el tono muscular mandibular es casi siempre mínimo y este parámetro es menos útil en dichos pacientes. El cambio a un patrón respiratorio abdominal (diafragmático) indica un nivel más profundo de anestesia; esto se acompaña de cambios en los parámetros fisiológicos, como el decremento de FR y VC. La presencia de un reflejo palpebral es un indicador confiable de un nivel ligero de anestesia en la mayoría de los pacientes. Su ausencia sugiere un nivel intermedio o profundo. No obstante, algunos individuos no muestran un reflejo palpebral aunque su nivel de anestesia sea ligero. Cuando se usa ketamina, el reflejo palpebral siempre está presente, de tal modo que este parámetro no es un indicador confiable del plano de anestesia en esta situación. El reflejo pupilar a la luz (constricción pupilar en respuesta a una luz intensa que incide en la retina) y el reflejo de deslumbramiento (parpadeo en respuesta a una luz intensa) son indicadores confiables de un nivel de anestesia ligero a ligero-intermedio. El reflejo pupilar a la luz puede atenuarse o eliminarse con la administración de anticolinérgicos (atropina o glucopirrolato), de maneta tal que este parámetro no es un indicador confiable del nivel anestésico en esta situación. La posición del globo ocular es central (y el tamaño de la pupila es intermedio) cuando el plano de anestesia es ligero, el ojo gira en sentido ventromedial cuando el nivel es intermedio, y vuelve a ser central (y la pupila se dilata) si el plano es profundo. El globo ocular no gira cuando se utiliza ketamina y por tanto este parámetro no es un indicador confiable del nivel de anestesia en esta situación. En condiciones normales no ocurre nistagmo a ningún plano anestésico en perros y gatos. Los reflejos laríngeo y de deglución son indicadores confiables de un nivel ligero de anestesia en virtualmente todas las circunstancias en perros y gatos anestesiados. Métodos objetivos La vigilancia neurofisiológica como instrumento para cuantificar la profundidad de la anestesia no es un campo de estudio nuevo. Un tipo de vigilancia neurofisiológica, el análisis del EEG, implica la interpretación de las ondas cerebrales registradas en la piel cabelluda durante el suministro de anestésico, y dicho registro revela cambios característicos que suceden durante la transición de niveles ligeros a intermedios de anestesia. En algunos casos, el EEG crudo se estudia de manera directa o, como alternativa, se analizan algunas características derivadas de él, como amplitud, distribución de frecuencia o potencia, o correlaciones entre señales registradas. Por desgracia, los análisis de señales y patrones del EEG son complejos y difíciles de realizar en tiempo real, lo que hace a este método impráctico en el ambiente clínico. Otro método para la vigilancia neurofisiológica es el estudio de potenciales evocados (PE). Tanto los PE auditivos (registros del tallo encefálico en respuesta a un estímulo auditivo) como los somatosensitivos (registros del tallo encefálico y la corteza en respuesta a estimulación eléctrica de un nervio periférico) muestran cambios progresivos al variar la profundidad de la anestesia. Este método tiene muchas de las mismas desventajas que el análisis de potenciales EEG espontáneos y no es útil para vigilar en clínica la profundidad de la anestesia en tiempo real. El sistema de vigilancia patentado Bispectral Index™ (BIS) (Covidien-Nellcor, Boulder, CO) salió al mercado en 1994 como una novedosa medida del nivel de conciencia y se basa en el análisis algorítmico del EEG de un paciente durante la anestesia. El BIS es un parámetro empírico estadístico basado en la suma ponderada de subparámetros del EEG seleccionados. Incluye un dominio de tiempo, un dominio de frecuencia y otras variables espectrales de orden superior. En esencia, el monitor BIS toma una señal compleja (el EEG), la analiza y procesa el resultado hasta un solo número adimensional entre 0 (equivalente a silencio EEG) y 100 (equivalente al estado despierto y alerta). El algoritmo de cálculo patentado que se emplea se basa en la determinación de numerosos registros EEG de personas sanas voluntarias en cuanto a criterios específicos de importancia clínica y a concentraciones plasmáticas específicas del anestésico. Si bien el cálculo es en extremo complejo, la más reciente disponibilidad de procesadores digitales más potentes, rápidos y eficaces en términos de costo ha facilitado la proyección de esta tecnología y otras similares para uso clínico. En clínica, el monitor BIS muestra un valor que cambia, con una demora mínima, conforme cambia la profundidad de la anestesia. En general, los valores de BIS mayores de 90 son compatibles con un estado despierto y alerta, los de 80 a 90 con ansiólisis, los de 60 a 80 con estado hipnótico o embotamiento moderado, los menores de 60 con pérdida de la memoria, los menores de 50 con arreactividad a los estímulos verbales, los inferiores a 20 con supresión de emisión de señales, y los de 0 con silencio cortical (EEG isoeléctrico). No todos los anestésicos afectan el BIS del mismo modo. Propofol, midazolam y tiopental lo deprimen en grado notable, los anestésicos inhalables tienen un efecto intermedio, los opioides lo afectan poco, y el óxido nitroso y ketamina tienden a elevarlo. El BIS no vigila la analgesia y no predice movimiento reflejo o actividad hemodinámica en respuesta a estimulación dolorosa. Otros sistemas comerciales recientes, también basados en índices EEG calculados, como el monitor Narcotrend™ (Arbeitsgruppe Informatik/ Biometrie der Anästhesie, Hannover, Alemania) y el monitor Cerebral State™ (danmeter, DK5000 Odense C, Dinamarca), funcionan al parecer de modo similar al monitor BIS. Pese a que el uso del BIS y otros monitores semejantes ha aumentado en quirófanos de práctica humana en todo el mundo, es importante hacer notar que no han sustituido a la valoración física de los pacientes y no es probable que lleguen a hacerlo. Entre los beneficios de la vigilancia cuantitativa de la profundidad de la anestesia se incluyen minimización del riesgo de que el paciente recupere la conciencia, reducción de las dosis de fármaco anestésico y menores tiempos de recuperación. Aunque estos instrumentos los emplean en la actualidad especialistas en anestesia veterinaria en instituciones académicas y la práctica privada, aún no se ha determinado su lugar en la práctica general. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 200 Manual de anestesia y analgesia en. . Vigilancia del paciente 201 Consecuencias fisiológicas de la anestesia No obstante los efectos farmacodinámicos específicos de los diversos fármacos anestésicos varían, los mecanismos por los cuales contribuyen a la morbilidad y mortalidad son similares. Bradicardia, arritmias, depresión miocárdica, vasodilatación, hipotensión, hipoventilación, hipoxemia e hipotermia excesivas son algunos de los ejemplos más comunes. Dado que todos estos efectos (excepto la hipotermia) pueden clasificarse como trastornos del funcionamiento cardiopulmonar y todos pueden afectar a otros aparatos y sistemas, la vigilancia perianestésica tiende a dar prioridad a la estabilidad cardiovascular y pulmonar. La función de estos dos sistemas, en un sentido muy amplio, es suministrar oxígeno (O2) y eliminar dióxido de carbono (CO2) de los tejidos. En el suministro de oxígeno (DO2) intervienen el aparato respiratorio, encargado de cargar O2 en la sangre arterial (es decir, oxigenación), y el aparato circulatorio, que bombea sangre oxigenada a los tejidos (es decir, circulación). La eliminación de dióxido de carbono también la realizan los pulmones a través del intercambio de gases atmosféricos (es decir, ventilación). Es útil considerar este cuadro completo al vigilar los parámetros individuales del paciente, y siempre esforzarse por poner en contexto una medición o tendencia específicas. La figura 6-1 es una ilustración simplificada de los factores clave que determinan circulación y oxigenación, incluidas sus relaciones mutuas y con el suministro de O2. La figura 6-2 muestra los factores clave que determinan la ventilación y el modo en que se relacionan con la eliminación de CO2. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vigilancia del DO2 El suministro de oxígeno (DO2) es el producto del gasto cardiaco (GC) y contenido de oxígeno en sangre arterial (CaO2), como se muestra más adelante. Los valores de DO2 que se informan están referidos al área de superficie corporal (es decir, mililitros de O2 por minuto por metro cuadrado) para facilitar las comparaciones, dado que el GC varía con la talla del paciente. Los cálculos para perros normales se aproximan a 800 mL/min/m2 (o unos 25 a 35 mL/min/kg). DO2 (mL O2/min) = GC (dL/min) × CaO2 (mL O2/dL) Debe señalarse que CaO2 representa la cantidad total de oxígeno presente en la sangre y es una función de la saturación de O2 en sangre arterial (definida como el porcentaje del total de sitios de unión de la hemoglobina que están ocupados por O2; SaO2), la concentración de hemoglobina y, en menor medida, la cantidad de oxígeno disuelto en sangre (definida como la presión parcial arterial de oxígeno; PaO2). Los valores normales de CaO2 son alrededor de 20 mL de O2 por decilitro de sangre, con base en la siguiente fórmula: CaO2 (mL O2/dL) = [SaO2 (decimal) × Hb (g/dL) × 1.34 mL O2/g] + [PaO2 (mm Hg) × 0.003 mL O2/dL/mm Hg] Con base en estas ecuaciones, un decremento de CaO2 no provoca en todos los casos un descenso de DO2 si GC aumenta. En los cuidados críticos de personas existe una tendencia al “suministro 202 Manual de anestesia y analgesia en. . Suministro de oxígeno Contenido de oxígeno en sangre arterial Gasto cardiaco Volumen sistólico Frecuencia y ritmo cardiacos Oxígeno unido a hemoglobina Oxígeno disuelto Concentración de hemoglobina Poscarga Tono arterial Resistencia vascular sistémica Precarga Perfusión cerebral y coronaria Volumen sanguíneo Presión venosa central Contractilidad miocárdica Figura 6-1. Factores clave de la circulación y la oxigenación. programado de oxígeno” u “optimización del suministro de oxígeno” perioperatorios en pacientes de alto riesgo como un modo para mejorar los resultados. Que tales medidas sean en realidad eficaces a nivel poblacional aún es tema de controversia y se requiere más investigación para determinar los criterios de valoración apropiados y el momento de las intervenciones. Dado que © Editorial El manual moderno Fotocopiar sin autorización es un delito. Perfusión visceral Presión arterial Vigilancia del paciente 203 Ventilación total = Ventilación alveolar + Ventilación de espacio muerto Ventilación en un minuto = Frecuencia respiratoria × Volumen corriente Presión parcial de CO2 en sangre arterial = 0.863* × Producción de CO2 Ventilación alveolar *Una constante que se agrega a la ecuación para corregir las diferentes unidades Figura 6-2. Factores clave de la ventilación. el cálculo de DO2 requiere la medición de GC, SaO2, hemoglobina y PaO2, se lo utiliza raras veces durante la vigilancia de la anestesia clínica veterinaria. El consumo de oxígeno (VO2) es la cantidad de oxígeno que los tejidos consumen cada minuto y puede calcularse al multiplicar la diferencia entre CaO2 y contenido de oxígeno en sangre venosa mixta (CvO2) por GC, como se muestra. Las determinaciones de VO2 en perros normales se aproximan a 150 mL/min/m2 (o unos 4 a 10 mL/min/kg). © Editorial El manual moderno Fotocopiar sin autorización es un delito. VO2 (mL O2/min) = [CaO2 – CvO2 (mL O2/dL)] × GC (dL/min) En condiciones normales, VO2 no se limita por DO2, ya que los tejidos pueden extraer una mayor proporción de oxígeno de la sangre arterial (es decir, la diferencia CaO2 – CvO2 aumenta) en caso de disminución de GC. Sin embargo, cuando GC desciende a valores críticamente bajos, VO2 se torna dependiente de DO2 (o del gasto). El cociente de extracción de oxígeno (CEO) es la proporción del O2 consumido para el O2 suministrado, como se muestra: CEO = VO2 [CaO2 − CvO2 ] × CO = DO2 CaO2 × CO Dado que GC aparece tanto en el numerador como en el denominador, y que se asume que la hemoglobina es la misma en la sangre arterial y la venosa, la ecuación anterior puede simplificarse para incluir sólo saturación en vez de contenido de oxígeno. La ecuación simplificada es: CEO = SaO2 − SvO2 SaO2 Para fines de exactitud, esta ecuación requiere la medición de SaO2 y SvO2 mediante cooximetría para analizar muestras de sangre arterial y venosa mixta extraídas del paciente. Si bien de manera sistemática se obtiene e informa un cálculo de SaO2 mediante analizadores de gases en sangre 204 Manual de anestesia y analgesia en. . arterial comerciales con base en los parámetros medidos (pH, PO2 y PCO2), una concentración de hemoglobina arbitraria y un algoritmo basado en la curva de disociación de oxihemoglobina, este método es menos exacto que la cooximetría. Puesto que los valores de SvO2 corresponden a la parte abrupta de la curva de disociación, calcular SvO2 con el método del analizador de gases en sangre supone un margen de error aún más grande. El hecho de que la curva de disociación de la oxihemoglobina usada por los analizadores de gases en sangre comerciales se base en datos de seres humanos adultos normales introduce un mayor error potencial cuando se extrapola a perros y gatos. El CEO es un método útil en clínica para determinar la propiedad del GC sin medirlo en realidad (aunque no requiere muestreo de sangre venosa mixta). Es útil sobre todo en ambientes de cuidados críticos, en oposición a la vigilancia de la anestesia clínica. En condiciones fisiológicas de reposo normales, el CEO es alrededor de 0.25 y los valores >0.4 sugieren deterioro grave del GC. Vigilancia de circulación, oxigenación y ventilación Vigilancia de la circulación Lo ideal es que la eficiencia circulatoria se vigile usando el GC como un indicador global del riego sanguíneo en combinación con mediciones del flujo específico de órganos para asegurar una perfusión adecuada de lechos tisulares individuales. Infortunadamente, en la actualidad esto no es factible en clínica. Lo que sí está disponibles son numerosos parámetros, tanto subjetivos como objetivos, que empleados en conjunto constituyen una aproximación razonable de la eficiencia circulatoria en la mayoría de los pacientes. Métodos subjetivos La determinación de color y tiempo de llenado capilar (TLC) de las membranas mucosas proporciona información subjectiva sobre el tono vascular periférico y la perfusión. La palidez de las membranas mucosas (en ausencia de anemia) sugiere vasoconstricción y deterioro de la perfusión, mientras que un color rosado oscuro o rojo señala vasodilatación y mayor perfusión. De modo similar, un TLC prolongado indica vasoconstricción y deterioro de la perfusión, pero un TLC rápido sugiere vasodilatación. Si bien son de naturaleza subjetiva y cualitativa, estas determinaciones deben ser parte de la valoración preanestésica del paciente y realizarse en todos los pacientes a intervalos regulares (por lo general cada 5 min) durante la anestesia y el periodo de recuperación inmediato. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Aunque suele estar indicado medir (o al menos precisar) DO2 y CEO en pacientes veterinarios en estado crítico, esto no es casi nunca práctico en el contexto de la vigilancia anestésica veterinaria común. En consecuencia, se requiere la medición de otros parámetros para asegurar y mantener la estabilidad cardiovascular y pulmonar. Estos parámetros pueden clasificarse de manera amplia en tres categorías: monitores de la circulación, monitores de la oxigenación y monitores de la ventilación. Cualesquiera que sean las técnicas usadas, la vigilancia del paciente debe incluir valoraciones repetidas con regularidad y documentación de las tendencias a fin de realizar interpretaciones apropiadas de las decisiones terapéuticas. Para todos los pacientes se recomienda que una persona específica con capacitación adecuada se concentre en la vigilancia anestésica y manejo del caso, siempre que sea posible. Vigilancia del paciente 205 La palpación de un pulso arterial periférico proporciona información cualitativa subjetiva acerca de la presión del pulso. La presión o “fuerza” del pulso depende de la diferencia entre las presiones arteriales sistólica (PAS) y diastólica (PAD). Los animales con gradientes grandes entre sus presiones sistólica y diastólica muestran presión del pulso elevada y su pulso periférico se percibe “fuerte”. Los pacientes con gradientes estrechos tienen menor presión del pulso y su pulso periférico se siente “débil”. Debe hacerse notar que esto no garantiza que los sujetos con pulso periférico fuerte tengan presión arterial media y perfusión periférica adecuadas. Por lo tanto, la palpación del pulso no sustituye a la medición cuantitativa de la PA. Pese a todo, la palpación de pulsos periféricos para determinar la frecuencia del pulso (FP) y el ritmo es un recurso valioso en clínica y debe realizarse a intervalos regulares cortos en animales anestesiados con este fin. Algunos sitios comunes en que se palpa el pulso periférico son las arterias dorsal pedia, digital y lingual. En gatos anestesiados, la identificación de pulsos periféricos en estos sitios puede ser desafiante y requiere práctica. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Métodos objetivos Existen varios parámetros diferentes que pueden utilizarse para vigilar de manera objetiva el estado circulatorio. Algunos proporcionan datos continuos, mientras que otros se realizan de manera intermitente, y la mayor parte requiere algún tipo de equipo especializado. FC o FP La FC es uno de los principales determinantes del GC y es necesario su mantenimiento dentro de un intervalo apropiado para el paciente individual y el escenario clínico a fin de asegurar la estabilidad circulatoria. La FC en reposo normal en perros conscientes varía entre razas, pero suele fluctuar entre 70 y 120 latidos por minuto (lpm). En gatos conscientes es difícil obtener una FC en reposo real en muchas situaciones clínicas, si bien es razonable un intervalo de 120 a 180 lpm. Bradicardia y taquicardia pueden tener efectos nocivos significativos en el GC y deben prevenirse, tratarse o ambas cosas cuando aparezcan. No obstante, el mantenimiento de la FC dentro de un intervalo “normal” de ningún modo garantiza un GC adecuado y se necesitan otros monitores para proporcionar un cuadro más completo del estado circulatorio. Existen numerosas técnicas para cuantificar FC y FP. Algunas exigen que el anestesiólogo interactúe de manera directa con el paciente, mientras que otras emplean dispositivos de vigilancia automatizados. Algunas técnicas facilitan las valoraciones intermitentes y otras generan datos visuales o señales auditivas (o ambos) continuos. Sin importar qué técnica se elija, FC o FP deben medirse al menos cada 5 min en todos los pacientes anestesiados. La auscultación torácica de los latidos cardiacos con un estetoscopio se realiza como parte de la valoración preanestésica sistemática del paciente, y puede usarse también para documentar la FC durante la anestesia. Esta técnica es simple e implica la interacción directa con el sujeto de manera intermitente. A menudo es un reto para el anestesiólogo acceder al tórax del paciente durante diversas intervenciones, quirúrgicas y de otros tipos, de tal modo que también debe disponerse de otras alternativas. La palpación del pulso arterial es otra técnica útil en pacientes anestesiados. En perros, algunos sitios comunes para la palpación del pulso son las arterias femoral, dorsal pedia, digital y lingual. En gatos, los pulsos periféricos son a menudo más difíciles de reconocer, pero pueden localizarse. Como en el caso de la auscultación, esta técnica implica interacción directa con el paciente a intervalos cortos y no requiere equipo. Dado que existen diversas arterias para elegir, se dispone al menos de una opción en pacientes que tienen los campos dispuestos para operación. Esta técnica se recomienda para todos los animales anestesiados, aun cuando se usan otros métodos complementarios para valorar la FC de manera simultánea. El empleo de un estetoscopio esofágico constituye otro método de bajo costo para precisar la FC. Esta técnica supone la colocación esofágica de una sonda que se fija a un audífono, lo que permite al anestesiólogo identificar los ruidos cardiacos de manera intermitente o semicontinua. Como alternativa, la sonda puede conectarse a un amplificador electrónico que proyecta una señal audible continua. Este método supera el problema de la inaccesibilidad en la mayoría de los pacientes e intervenciones, y se recomienda para uso sistemático complementario de otras técnicas de vigilancia automatizada. El sistema Doppler, si bien se utiliza en mayor medida como monitor de PA, también proporciona una señal audible de FP. Esta técnica implica la colocación de un cristal piezoeléctrico sobre una arteria periférica (como la palmar, dorsal pedia o coccígea) conectado a un detector de flujo ultrasónico Doppler, el cual traduce y amplifica el sonido del flujo sanguíneo periférico. Si el sistema Doppler también se utiliza para medir la presión arterial, deben aplicarse un manguito oclusivo y un esfigmomanómetro (véase más adelante). El detector de flujo puede dejarse colocado para señalización de audio continua, o encenderse y apagarse para realizar valoraciones intermitentes. No existen dispositivos digitales que registren la FP, de tal modo que el anestesiólogo debe determinarla con base en la señal audible. El electrocardiograma (ECG), pese a que se emplea más como monitor del ritmo cardiaco, también muestra una señal digital continua de la FC. Muchos monitores de ECG pueden programarse para emitir un pulso audible con cada latido. La exactitud de la FC revelada por el monitor de ECG depende de la unidad misma y de factores del paciente, como talla, colocación de los electrodos y morfología de las ondas ECG. En caso de complejos QRS de baja amplitud, altas frecuencias o ambas (como se observa a menudo en gatos), algunos monitores son inexactos a bajas FC o no las registran en absoluto. De modo similar, en caso de grandes amplitudes de onda T respecto del complejo QRS, algunos monitores duplican el conteo y muestran una FC excesiva. A menudo es posible rectificar estos problemas al ajustar los parámetros en la unidad de ECG, y de este modo obtener una imagen más confiable de la FC. Sin embargo, por estas razones es importante usar técnicas complementarias como auscultación o palpación del pulso para corroborar la FC mostrada por una unidad de ECG. El oxímetro de pulso, si bien se utiliza en especial como monitor de oxigenación para medir la saturación porcentual de hemoglobina, también registra de manera continua una FP digital. La mayor parte de los oxímetros de pulso tiene una opción de zumbido audible que corresponde a cada pulso detectado. La lengua es el sitio más común para la colocación de la sonda en perros y gatos anestesiados, aunque también son posibles otras ubicaciones. Algunas unidades proporcionan además una imagen de sonda pletismográfica la cual, si se muestra de modo consistente, suele sugerir que la FC es razonablemente exacta. A pesar de esto, se recomienda el uso de otras técnicas complementarias como auscultación o palpación del pulso para corroborar la FP mostrada en un oxímetro de pulso. Es importante recordar que la oximetría de pulso está diseñada para vigilar de manera no traumática la oxigenación y no es adecuada para precisar la propiedad circulatoria (más allá de la simple documentación de la presencia de un pulso y la determinación de la frecuencia). © Editorial El manual moderno Fotocopiar sin autorización es un delito. 206 Manual de anestesia y analgesia en. . Vigilancia del paciente 207 Intervalo P-R Intervalo Q-T R T P S Q Duración del complejo QRS © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 6-3. Componentes de la onda ECG normal. Ritmo cardiaco Las anomalías del ritmo cardiaco pueden afectar en grado significativo el volumen sistólico (VS) y el GC y, por tanto, el DO2. En algunas circunstancias, la documentación de un ritmo específico puede indicar la transición inminente a una arritmia más grave, incluso potencialmente letal. El reto se encuentra no sólo en reconocer que existe una anomalía, sino en determinar sus posibles implicaciones. La única técnica para la valoración cuantitativa del ritmo cardiaco consiste en observar la actividad eléctrica del corazón mediante el ECG. La figura 6-3 ilustra la morfología normal de las ondas del ECG. Es importante recordar que la actividad eléctrica del corazón no se correlaciona siempre con su funcionamiento mecánico. La documentación de ritmo cardiaco normal de ningún modo garantiza un GC adecuado y se requieren otros métodos para determinar la eficiencia circulatoria. El método más común de vigilancia ECG en perros y gatos anestesiados consiste en colocar tres electrodos superficiales, casi siempre en las extremidades anterior derecha (AD), anterior izquierda (AI) y posterior izquierda (PI) del paciente. Esto genera tres derivaciones bipolares de extremidad para su determinación. La derivación I es la diferencia de voltaje entre los electrodos AD y AI, la derivación II entre los electrodos AD y PI, y la derivación III entre los electrodos AI y PI. De manera alternativa, también puede colocarse un cuarto electrodo en la extremidad posterior derecha (PD), lo cual genera tres derivaciones más, llamadas derivaciones aumentadas o unipolares de extremidad (aVR, aVL y aVF). Es posible que los cardiólogos veterinarios coloquen electrodos torácicos adicionales (rV2, V2, V4 y v10) para generar derivaciones precordiales que proporcionan información diagnóstica aún más detallada acerca de una arritmia específica. En la mayoría de los pacientes anestesiados se usan como electrodos pinzas caimán con dientes romos y mecanismos de resorte blandos. De manera alternativa, pueden colocarse almohadillas adhesivas cutáneas después de afeitar una zona con pelo apropiada, o colocarse en los cojinetes plantares. Según sean la intervención por realizar y la posición del paciente, tal vez deba ajustarse la ubicación de los electrodos. Aplicar gel conductor o alcohol isopropílico al 70% en 208 Manual de anestesia y analgesia en. . Presión arterial La presión arterial (PA) es la fuerza ejercida por la sangre circulante contra las paredes arteriales y se mide en milímetros de mercurio (mm Hg). Durante cada ciclo cardiaco, la PA varía entre un máximo (PAS) y un mínimo (PAD). La presión arterial media (PAM) es la presión promedio en todo el ciclo cardiaco y, a FC de reposo, puede calcularse con base en los valores de PAS y PAD como sigue: PAM = PAD + 1/3(PAS – PAD) A FC elevadas, la PAM se acerca más a la media aritmética de PAS y PAD, ya que la forma de la curva de presión del pulso se estrecha. Los valores normales informados de PAS y PAD en perros y gatos varían de una publicación a otra, pero tienden a hallarse en los intervalos de 120 a 140 y 60 a 80 mm Hg, en ese orden. Los valores informados para PAM en perros y gatos conscientes son más consistentes y fluctúan en el intervalo de 90 a 100 mm Hg. La PAM es la presión de mayor importancia fisiológica y se considera que es la que impulsa la perfusión. Una PAM inadecuada por un tiempo prolongado puede causar isquemia de órgano final y debe evitarse. En estudios de hemodinámica, la PAM se determina a partir de tres factores: GC, resistencia vascular sistémica (RVS) y presión venosa central (PVC), como se ilustra en la figura 6-1 y se muestra a continuación: PAM = (GC × RVS) + PVC © Editorial El manual moderno Fotocopiar sin autorización es un delito. los sitios en que los electrodos hacen contacto con la piel mejora la transducción de señales, y tal vez deba repetirse en intervenciones prolongadas. Los electrodos ECG esofágicos son una alternativa a los electrodos de superficie estándares en situaciones en que no es factible la colocación cutánea (como en cirugías de partes proximales de una o ambas extremidades anteriores) o en que es probable que los electrodos se muevan durante la operación. El electrodo mismo se coloca en el esófago y se conecta a un cable de ECG estándar. Con la colocación superficial o esofágica, los electrodos se conectan a un cable principal que actúa como interfaz con un monitor. Éste puede ser un monitor ECG especializado o, con mayor probabilidad, un monitor multiparamétrico capaz de calcular otros parámetros del paciente, como PA, oximetría de pulso, capnometría, temperatura, u otros. El monitor muestra un trazo en tiempo real de la actividad eléctrica del corazón y el operador puede elegir cuál de las tres (o más) derivaciones ver. La derivación más empleada para el análisis del ritmo en anestesia es la II, pero puede utilizarse cualquier derivación que muestre ondas P, complejos QRS y ondas T bien definidos. La rapidez de los trazos puede ajustarla el operador y por lo regular se fija en 25 o 50 mm/s. También pueden controlarse otros parámetros, como el tamaño de los complejos registrados. Algunos monitores tienen la capacidad de imprimir trazos ECG en papel y muchos modelos recientes pueden interactuar con otros equipos de vigilancia y cuentan con recursos avanzados de almacenamiento de datos. Existen además varias unidades ECG pequeñas manuales que prescinden por completo de electrodos y cables (como Vet Biolog™ II, VetLogix, LLC, Plymouth, MN). Éstas son en particular útiles para la valoración preanestésica sistemática, para el diagnóstico rápido en situaciones de urgencia y para la vigilancia anestésica en cualquier situación en la cual el uso de un monitor ECG estándar con electrodos y cables es laborioso o no factible. Vigilancia del paciente 209 El GC es un determinante fundamental del DO2, mientras que la RVS es la resistencia al flujo de sangre en la vasculatura sistémica. Es sobre todo una función del tono vasomotor en arteriolas pequeñas. La PVC es la presión promedio en el compartimiento venoso y es uno de los determinantes principales de la presión de llenado del ventrículo derecho y la precarga, y por tanto del VS. Dado que PVC es casi siempre cero o un valor cercano, la relación anterior a menudo se simplifica como sigue: © Editorial El manual moderno Fotocopiar sin autorización es un delito. PAM = GC × RVS Es crucial tener presente esta relación para entender el modo en que la medición de PA se relaciona con el panorama circulatorio más general. Cuando se vigila la PA en pacientes anestesiados en ausencia de datos de GC, como suele ocurrir, debe considerarse el estado vasomotor del paciente. La PAM insuficiente se conoce como hipotensión y puede deberse a FC o VS inadecuados que causan decremento del GC, vasodilatación, o una combinación de ambos. La PAM alta se conoce como hipertensión y puede deberse al aumento de volumen sanguíneo y GC, según la relación de Frank–Starling, o a la vasoconstricción. Es importante reconocer que la observación de una PAM normal no implica que el GC sea adecuado. Con base en la relación anterior, un paciente puede tener GC muy deficiente pero ser normotenso si al mismo tiempo experimenta vasoconstricción. En consecuencia, el veterinario debe establecer el funcionamiento del miocardio del paciente y el estado vasomotor a fin de interpretar de manera completa las implicaciones de una medición de PA específica. La medición clínica de la PA puede incluir métodos no traumáticos (sin penetración corporal) como las técnicas oscilométrica o Doppler, o métodos traumáticos, como la colocación de un catéter arterial. Todas las técnicas no traumáticas proporcionan aproximaciones de la PA y no tienen exactitud absoluta en todas las situaciones. Sin embargo, en la mayor parte de los casos, los métodos no traumáticos reflejan de modo eficaz tendencias de la PA y se recomiendan para uso durante la vigilancia anestésica en todos los perros y gatos. La medición intracorporal de la PA es el método más exacto, pero no está exento de limitaciones o complicaciones. A continuación se considera cada una de estas opciones. El método oscilométrico para determinar la PA se basa en un sistema no penetrante (indirecto) automatizado en el que se coloca un manguito de oclusión neumática alrededor de una extremidad o de la base de la cola. El manguito se insufla de manera automática hasta una presión suprasistólica y luego se libera el aire de modo gradual hasta que se detectan oscilaciones arteriales características mediante un sensor electrónico. La computadora interpreta estas oscilaciones y muestra valores medidos de PAS, PAM y PAD. Los monitores oscilométricos también registran una FP. Pueden programarse para realizar el ciclo de manera automática a intervalos regulares, lo cual es conveniente cuando se vigila a pacientes anestesiados. La anchura del manguito de oclusión es crítico para efectuar mediciones exactas y debe ser de casi 40% de la circunferencia de la extremidad en que se coloca. Los manguitos demasiado pequeños sobreestiman la PA, mientras que los demasiado grandes la subestiman. De manera tradicional, los monitores oscilométricos de PA usados en veterinaria estaban diseñados para pacientes humanos adultos y los algoritmos no siempre eran capaces de detectar oscilaciones en las arterias de pacientes caninos y felinos muy pequeños. Además, el intervalo de FC no era apropiado para muchos pacientes veterinarios pequeños. En consecuencia, muchos de estos monitores eran inexactos o no eran capaces de realizar mediciones en pacientes pequeños. Conforme la vigilancia de la PA se ha vuelto cada vez más común en medicina veterinaria, han salido al mercado varios monitores oscilométricos específicos para animales (como el Cardell® [MidmarkAnimal Health, Versailles, OH], el PetMAP™ [Ramsey Medical, Inc. Tampa, FL] y el BP-AccuGard™ [Vmed Technology, Mill Creek, WA]). Al parecer, estos monitores funcionan de manera más confiable en una gama más amplia de pacientes veterinarios, aunque todavía es un problema la inexactitud en los extremos de PA. Se dispone de monitores oscilométricos de PA como unidades independientes o, a medida que la vigilancia anestésica veterinaria se torna cada vez más compleja, como parte de unidades multiparamétricas que también realizan ECG, oximetría de pulso, capnografía y medición de temperatura. El sistema Doppler de medición de la PA es no traumático (indirecto) e implica la colocación de un cristal piezoeléctrico sobre una arteria periférica como la digital, dorsal pedia o coccígea. La sangre que fluye hacia el cristal y desde él refleja las ondas sónicas, y genera un cambio de frecuencia que se detecta, traduce y amplifica en un altavoz. A fin de usar el sistema Doppler en la determinación de la PA, se coloca entonces un manguito oclusivo de tamaño apropiado (40% de la circunferencia de la extremidad) proximal al sitio de la sonda y se conecta a un esfigmomanómetro. El manguito se insufla hasta que se pierde la señal audible del flujo de sangre y a continuación se desinsufla poco a poco hasta que se detecta el retorno del flujo. La presión mostrada en el esfigmomanómetro en el punto en que esto ocurre corresponde a la PAS. Los sistemas Doppler (como el Parks Medical Model 811 [Parks Medical Electronics, Las Vegas, NV] y el VMed Vet -Dop™[Vmed Technology]) no son automatizados, de tal manera que el anestesiólogo debe realizar la determinación manual de la PAS a intervalos. No es posible cuantificar valores de PAM o PAD con este sistema y su exactitud para la determinación de la PAS se modifica por varios factores. En pacientes pequeños anestesiados (gatos y perros pequeños), los registros de presión Doppler tienden a subestimar la PAS. En algunos estudios con gatos se ha sugerido que los valores de PAS están subvaluados en alrededor de 15 mm Hg, y que en realidad la medición Doppler podría ser un reflejo más exacto de la PAM en estos pacientes. En consecuencia, como cualquier monitor de PA no traumático, el sistema Doppler es más útil como un indicador de tendencias cuando se usa en vigilancia anestésica. La medición traumática o directa de la PA posibilita la determinación continua cuantitativa y exacta de PAS, PAM y PAD, y también proporciona una representación gráfica de la onda de pulso arterial, como se ilustra en la figura 6-4. Esta técnica requiere la colocación de un catéter arterial, por lo general en una arteria periférica como la dorsal pedia, la carpal o la coccígea, y por tanto representa un desafío técnico mayor que los métodos no traumáticos. El catéter se conecta entonces a tubería de presión arterial semirrígida llena de solución salina, que a su vez se conecta a un transductor de presión electrónico del tipo de resistencia. El transductor debe colocarse al nivel de la aurícula derecha del paciente para obtener mediciones exactas de la PA. Los monitores modernos suelen tener una presión de compensación que permite mover el transductor a cualquier nivel conveniente, y el monitor puede compensar cualquier diferencia vertical entre transductor y paciente. El transductor se conecta a un cable que actúa como interfaz con un monitor multiparamétrico que registra la onda de presión arterial en tiempo real junto con valores digitales de PAS, PAM, PAD y FP. En fechas recientes han salido al mercado varios monitores multiparamétricos específicos para veterinaria capaces de medir de manera directa la presión. Si bien la medición directa de la PA se considera la técnica de referencia, no está exenta de fuentes potenciales de errores y complicaciones. La onda puede amortiguarse si la punta del catéter © Editorial El manual moderno Fotocopiar sin autorización es un delito. 210 Manual de anestesia y analgesia en. . Vigilancia del paciente 211 Presión sistólica Presión media Presión diastólica Onda expulsada Onda reflejada © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 6-4. Componentes de la onda de presión arterial normal. incide contra la pared arterial, si se forma un coágulo en la punta del catéter, si hay burbujas de aire dentro del catéter o la tubería, o si alguno de estos últimos se acoda. Ello tiene como resultado una onda arterial aplanada, valores más bajos de PAS, y cifras más altas de PAD. El uso de tubería de vigilancia arterial distensible en vez de la semirrígida también afecta la fidelidad del sistema. Asimismo, dado que esta técnica requiere cateterismo arterial, son posibles (aunque no comunes) complicaciones como formación de hematoma, infección, trombosis o necrosis de tejidos distales al sitio del catéter. En la mayoría de las situaciones se requiere heparinización del acceso para mantener su permeabilidad y esto puede ser causa de preocupación en pacientes muy pequeños. La medición directa de la PA también se vincula con mayor costo que los métodos no traumáticos, ya que requiere varios insumos (catéter, tubería y transductor), además del costo de inversión en el monitor. No obstante, en animales con inestabilidad circulatoria preexistente o potencial, este método es superior para la vigilancia durante la anestesia y en ambientes de cuidados críticos. Presión venosa central La presión venosa central (PVC) es una determinación de la presión media de la aurícula derecha y refleja el equilibrio entre GC y retorno venoso. Entre los principales factores que influyen en PVC figuran volumen sanguíneo, tono venoso, contractilidad cardiaca, FC, cambios en las presiones intratorácica o intrapericárdica, y posición corporal. En perros y gatos, la PVC normal varía entre 0 y 10 cm H2O. Los decrementos de la PVC indican por lo general hipovolemia absoluta o relativa, mientras que los aumentos señalan hipervolemia o depresión miocárdica con o sin insuficiencia cardiaca. Para la medición de la PVC es necesario colocar un catéter en la vena yugular, que se extienda hasta el nivel de la vena cava torácica o, de preferencia, la aurícula derecha. En gatos, las presiones en la vena cava caudal son un sustituto razonable de la PVC cuando no es posible colocar un catéter de la vena yugular. El catéter se lava con solución salina y se conecta a un manómetro 212 Manual de anestesia y analgesia en. . Gasto cardiaco El GC es un determinante fundamental del DO2 y un indicador importante de la propiedad de la circulatoria global. Infortunadamente, no es posible formular conclusiones verdaderamente definitivas acerca del GC a partir de mediciones de PA o PVC. Dado que GC es un parámetro de flujo y no un parámetro de presión, en términos de logística es mucho más complicado medirlo, y muchas veces ha requerido técnicas traumáticas como el cateterismo cardiaco. En consecuencia, no están bien establecidos los valores normales de GC para perros y gatos conscientes basados en grandes cantidades de animales y referidos a área de superficie corporal, pero es probable que sean del orden de 4.0 L/min/m2 (o alrededor de 140 a 160 mL/min/kg). Aunque la medición del GC ha sido impráctica en la mayor parte de los ambientes clínicos veterinarios, incluido el de la vigilancia anestésica, es posible que esto cambie en el futuro. La industria biomédica se esfuerza por encontrar nuevos métodos no traumáticos o de mínimo traumatismo para medir el GC en seres humanos, y los pacientes veterinarios pueden beneficiarse de ello de manera indirecta. Debe hacerse notar que la siguiente exposición abarca sólo unas cuantas técnicas seleccionadas y de ningún modo se intenta que sea una revisión exhaustiva del tema de la medición del GC. El método habitual para medir el GC en clínica se conoce como técnica de termodilución. Se lo considera traumático e implica colocar un catéter de arteria pulmonar con balón en la punta (de Swan–Ganz). Un volumen pequeño conocido de líquido a temperatura conocida se inyecta en el puerto proximal del catéter, y la temperatura de la sangre se mide entonces con un termistor localizado a una distancia conocida en el catéter. Una computadora genera e interpreta una curva de temperatura contra tiempo (de termodilución) y calcula el GC como inversamente proporcional al área bajo esta curva. El uso de este método en pacientes humanos ha declinado a medida que se desarrollan opciones menos penetrantes y lesivas para el usuario, con menos complicaciones potenciales. Un sistema más reciente, también basado en dilución de indicador, evita la necesidad del cateterismo cardiaco. Sólo requiere cateterismo de venas y arterias periféricas e incorpora la técnica © Editorial El manual moderno Fotocopiar sin autorización es un delito. comercial usando tubería llena de solución salina conectada a una llave de paso de tres vías. Una línea de administración de líquido llena de solución salina se conecta al puerto de la llave de paso inmediatamente antes del catéter, y el manómetro se conecta al puerto restante. Con la llave de paso cerrada para el paciente, el cilindro graduado se llena con solución salina. A fin de obtener una medición exacta la llave de paso de tres vías se coloca inmediatamente abajo de la base del corazón. En animales en decúbito lateral esto corresponde al esternón y en decúbito lateral a la punta del hombro. La llave de paso se cierra entonces a la posición de administración de líquido, y el valor resultante de PVC se registra en la escala graduada del manómetro en cm H2O. De manera alternativa, el catéter puede conectarse a un transductor de presión y en interfaz con un monitor multiparamétrico de modo similar a lo observado en la medición directa de la PA. Los valores de PVC y la onda de PVC característica se muestran de manera digital. Si se usa un canal de presión estándar, la mayoría de los monitores indica PVC en milímetros de mercurio, que deben convertirse a centímetros de agua para su interpretación (1 mm Hg =1.36 cm H2O). Si bien la medición de PVC no está indicada para la vigilancia anestésica sistemática en perros y gatos sanos, proporciona información útil en pacientes que requieren reposición enérgica de volumen, en especial en caso de disfunción miocárdica concurrente. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vigilancia del paciente 213 de dilución de litio (LiDCO™ , LidCO Ltd., Sawston, Cambridge UK). Una pequeña dosis de cloruro de litio se inyecta en el acceso venoso y la curva resultante de concentración arterial de litio contra tiempo se registra al extraer sangre después de un sensor de litio conectado al acceso arterial. La computadora calcula e informa un valor de GC. Una tecnología más reciente combina el sistema LiDCO con una variación del análisis de contorno de pulsos. Con los sistemas de análisis de contorno de pulsos comunes se intentaba medir el VS latido a latido analizando la onda de presión del pulso arterial. Se registraron varios contratiempos relacionados con este método, pero un nuevo sistema, llamado análisis de potencia del pulso arterial (PulseCO™ , LidCO Ltd.), emplea un algoritmo que supera muchos de los obstáculos. La combinación de estas dos tecnologías (LiDCO y PulseCO) en el LiDCOplus Hemodynamic Monitor (LidCO Ltd.) hace posible la valoración continua en tiempo real del GC para su uso en pacientes, y sólo requiere acceso a venas y arterias periféricas. Una técnica alternativa se basa en el principio de Fick y utiliza recirculación parcial de CO2. Este monitor (NICO®, Philips Respironics, Murrysville, PA) calcula el GC con base en cambios en la concentración corriente final de CO2 (CFCO2) causados por periodos intermitentes breves de recirculación en un circuito desechable específico. El monitor consiste en un sensor de dióxido de carbono (absorción de infrarrojo), un sensor de flujo entrante de aire (neumotacómetro diferencial) y un oxímetro de pulso. La recirculación parcial reduce la eliminación de CO2 y eleva CFCO2. Los pacientes deben recibir ventilación mecánica y se requiere muestreo de sangre arterial a fin de poder suministrar al monitor la presión parcial de oxígeno arterial (PaO2) para determinar el cortocircuito, que de otra manera sesgaría los resultados de GC. En la ecocardiografía transesofágica (ETE) se usa ultrasonografía Doppler para medir la velocidad de la sangre en la aorta descendente mediante un transductor situado en la punta de una sonda esofágica flexible. La integral de velocidad en función de tiempo que resulta se multiplica por el área de corte transversal medida de la aorta para obtener gasto sanguíneo, que entonces se multiplica por FC. Para mensurar el GC por este método se asume un cociente fijo de gasto sanguíneo en la aorta descendente y el infundíbulo (cono arterial) del ventrículo izquierdo, dado que en realidad sólo se mide el gasto en la aorta descendente. Esta técnica requiere capacitación para obtener imágenes ecocardiográficas apropiadas y realizar mediciones exactas de la aorta. En fecha más reciente se lanzó una tecnología de ultrasonido Doppler del todo atraumática específica para evaluar el GC (USCOM, USCOM Pty Ltd, Coffs Harbour, NSW, Australia). El monitor USCOM mide de manera transcutánea la integral de velocidad respecto del tiempo del perfil de flujo Doppler, pero utiliza antropometría para calcular el diámetro de las válvulas aórtica y pulmonar y así cuantificar los flujos derecho e izquierdo. Este método es sencillo desde el punto de vista técnico y no requiere adiestramiento avanzado en ultrasonografía. Si bien es improbable que la gradación antropométrica usada en el sistema USCOM para pacientes humanos se extrapole bien a todas las razas caninas, que varían mucho en alzada, sí es factible que en el futuro cercano se diseñe alguna forma de valoración no traumática del GC en medicina veterinaria. Vigilancia de la oxigenación En condiciones ideales debe vigilarse la eficiencia de la oxigenación mediante mediciones de CaCO2 total, dado que ésta incorpora la fracción de oxígeno unido a hemoglobina, así como la fracción disuelta en el plasma. Aunque los principales factores que contribuyen a CaO2 (es decir, Saturación de hemoglobina (%) 214 Manual de anestesia y analgesia en. . 100 90 80 70 60 50 40 30 20 0 50 100 150 200 250 Presión parcial de oxígeno (mm Hg) SaO2, [Hb] y PaO2) pueden medirse en realidad, en la práctica no siempre es necesario calcular todos en el contexto de la vigilancia anestésica. Puesto que PaO2 y SaO2 se relacionan entre sí a través de la curva de disociación de la oxihemoglobina, al medir o calcular un parámetro se obtienen indicios del otro. Sin embargo, nótese que la posición de la curva de disociación se afecta por acción de otros factores. Los aumentos de la concentración de iones hidrógeno (esto es, decrementos de pH), pCO2, temperatura y concentración de 2,3-difosfoglicerato (2,3-DPG) desplazan la curva a la derecha. La figura 6-5 ilustra la curva de disociación de la oxihemoglobina canina en condiciones normales (es decir, con un valor de P50 cercano a 28 a 30 mm Hg). La curva para los felinos en condiciones normales parece similar pero tiene un valor aproximado de P50 de 32 a 37 mm Hg y por tanto está desplazada a la derecha respecto de las de perros y seres humanos. La terminología que describe la oxigenación inadecuada puede ser confusa. La hipoxemia suele definirse de forma específica como decremento de PaO2, que de manera invariable se relaciona con disminución de SaO2. Debe señalarse que esta definición excluye un decremento de CaO2 causado por anemia, ya que la PaO2 no es abatida por la anemia. El término hipoxia es más general y se refiere a la menor disponibilidad de oxígeno; por lo tanto, incluye anemia como posible causa. En el contexto de la vigilancia anestésica clínica, se recomienda la valoración subjetiva y la objetiva de la eficiencia de la oxigenación. La [Hb] (o alguna medida sustituta relacionada, como el hematócrito) debe medirse como parte de la valoración preanestésica sistemática del paciente. Después de esto, la decisión de medir PaO2 o SaO2 de manera directa, o usar una determinación no traumática de la oxigenación, depende de varios factores que se consideran a continuación con mayor detalle. Métodos subjetivos La valoración del color de las membranas mucosas es una técnica cualitativa simple para evaluar la oxigenación. Las membranas mucosas rosadas sugieren SaO2 adecuada. El término cianosis se © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 6-5. Curva de disociación de la oxihemoglobina del perro en condiciones normales (P50 ≈28 a 30 mm Hg). Vigilancia del paciente 215 refiere al tono azulado debido a la presencia de hemoglobina desoxigenada y cuando hay demasiada presencia de hemoglobina desoxigenada se debe a hipoxemia. Nótese que, en virtud de que se requiere una cantidad absoluta de hemoglobina desoxigenada (por lo regular 5 g/dL) para que el paciente muestre cianosis, los pacientes anémicos pueden tener hipoxemia profunda pero no verse cianóticos. En general, la capacidad de detectar cianosis varía con las condiciones de iluminación del ambiente y con los observadores, y la cianosis se considera un signo muy tardío de insuficiencia de la oxigenación y circulatoria potencialmente letal. En consecuencia, el color de las membranas mucosas sólo debe usarse junto con otras medidas más objetivas de oxigenación para la vigilancia anestésica. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Métodos objetivos Como ya se indicó, la medición objetiva de la eficiencia de oxigenación durante la anestesia implica la medición directa de la PaO2 o SaO2 o el cálculo (indirecto) de la segunda. Es obligatorio medir la FR con regularidad a intervalos de 5 min en todos los pacientes anestesiados; esto se analiza más a fondo en la sección sobre vigilancia de la ventilación. Si bien bradipnea o apnea pueden causar hipoxemia (de acuerdo con la concentración de oxígeno inspirado), también es importante recordar que una FR normal de ningún modo garantiza una oxigenación adecuada. Oxígeno disuelto en sangre arterial En cualquier momento particular, la PaO2 constituye sólo 1 a 2% de la CaO2 total (véase la ecuación para calcular CaO2 en la sección sobre vigilancia de DO2). Sin embargo, debido a su bien definida relación con SaO2, y al hecho de que se mide de manera fácil y exacta mediante análisis de gases en sangre arterial, PaO2 es el parámetro referido con más frecuencia para determinar la oxigenación. Para interpretar las implicaciones de un valor particular de PaO2, deben considerarse al mismo tiempo varios factores. Primero, la concentración inspirada de oxígeno (FiO2) influye en PaO2. Debe esperarse que los pacientes que respiran mezclas enriquecidas con oxígeno (como ocurre en el caso de todos los pacientes intubados que reciben un anestésico inhalable a través de una máquina de anestesia y un sistema de respiración) tengan valores más altos de PaO2 que los pacientes que respiran aire ambiental (con 21% de oxígeno). En segundo lugar, la presión atmosférica (Patm) también influye. Se espera que los pacientes al nivel del mar (760 mm Hg) tengan mayores valores de PaO2 que los sujetos a mayores altitudes. Por último, la eficiencia de la ventilación también interviene. Los pacientes que hipoventilan muestran valores más altos de PaCO2 y en consecuencia más bajos de PaO2 en comparación con aquellos que ventilan de modo normal o hiperventilan. El efecto de estos factores en la presión parcial del oxígeno alveolar (PAO2), y por tanto en PaO2, se ilustra en la ecuación de los gases alveolares: PAO2 = FiO2 (Patm – PH2O) – PaCO2/R Nótese que PH2O se refiere a la presión parcial del agua, que se aproxima a 47 mm Hg a 37°C, y R es el cociente respiratorio, que se asume de 0.8 a 0.9. Esta ecuación determina en esencia el valor de referencia contra el cual se compara un valor particular de PaO2 según sean FiO2 , Patm y PaCO2. 216 Manual de anestesia y analgesia en. . Oxígeno unido a hemoglobina En cualquier momento particular, la cantidad de oxígeno unido a hemoglobina constituye 98 a 99% de la CaO2 total (véase la ecuación para calcular CaO2 que se presenta en la sección sobre vigilancia de DO2). Esta fracción depende de SaO2 y [Hb]. La medición de la hemoglobina (o hematócrito) siempre es un componente necesario de la evaluación preanestésica del paciente para descartar anemia, la cual puede tener un efecto muy perjudicial en CaO2 y DO2 en ausencia de anomalías en PaO2 o SaO2. Este efecto se ilustra en el cuadro 6-1. Administrar oxígeno complementario para incrementar PaO2 como una medida para mejorar CaO2 en un paciente anémico es ineficaz y, en cambio, los esfuerzos deben concentrarse en incrementar [Hb] y la capacidad de transporte de oxígeno. En sujetos que experimentan pérdida sanguínea perioperatoria están indicadas valoraciones seriadas de [Hb] o hematócrito para vigilar la hemorragia y la respuesta a las intervenciones terapéuticas. La SaO2, como la PaO2, es otra manera de vigilar la eficiencia de la oxigenación. En perros, los valores normales de PaO2 de 80 a 100 mm Hg se relacionan con valores de SaO2 de alrededor de 95 a 98%. A diferencia de lo que ocurre en el caso de PaO2, que cambia en grado impresionante, el incremento de FiO2 tiene efecto mínimo en SaO2 porque la curva de disociación de la oxihemoglobina ya se ha aplanado en este punto (figura 6-5). Si se asume una oxigenación normal, aumentar la FiO2 de 0.21 a 1.0 hace que la PaO2 cambie de 100 mm Hg a >500 mm Hg, © Editorial El manual moderno Fotocopiar sin autorización es un delito. En circunstancias normales, los valores calculados de PAO2 son de 90 a 110 mm Hg. Los valores medidos normales de PaO2 para pacientes en circunstancias similares son de unos 80 a 100 mm Hg. El gradiente alveoloarterial de PO2 (gradiente A-a) se define como la diferencia entre PAO2 y PaO2 y es un índice útil de la eficiencia de oxigenación. Para pacientes que respiran aire ambiental (es decir, FiO2 = 0.21), el gradiente A-a debe ser menor de 10 mm Hg. La situación es un tanto distinta cuando los pacientes inspiran mezclas enriquecidas con oxígeno. En esta situación, PAO2 es mayor de 600 mm Hg, de tal modo que la PaO2 esperada también es mucho mayor y los criterios para determinar el gradiente A-a difieren. Cuando FiO2 tiende a 1.0, el gradiente A-a se considera normal si es menor de 100 mm Hg. En la vigilancia anestésica clínica casi nunca es necesario en realidad realizar los cálculos de la ecuación de los gases alveolares y el gradiente A-a al analizar un valor dado de PaO2. Sin embargo, el veterinario siempre debe tomar en cuenta la FiO2 al interpretar valores de PaO2. Es imposible valorar de manera exacta la oxigenación con base en la PaO2 si se desconoce la FiO2. La medición de PaO2 se considera una técnica de mínima penetración corporal porque requiere muestreo de sangre arterial. Las arterias de las que se toman muestras de sangre en perros y gatos son la femoral y la dorsal pedia. Las muestras deben colectarse en una jeringa heparinizada, sellarse y analizarse de inmediato con una máquina analizadora de gas arterial. Los instrumentos para análisis de gases en sangre son cada vez más comunes en la práctica veterinaria clínica y se dispone de varios monitores portátiles que se colocan al lado del paciente. Tales unidades emplean cartuchos de un solo uso, los cuales miden pH, PO2 y PCO2, así como otros diversos parámetros. Aunque la determinación de PaO2 proporciona información cuantitativa exacta, la necesidad de muestreo repetido de sangre arterial y el costo implícito hacen impráctica la vigilancia anestésica sistemática en perros y gatos sanos. No obstante, en pacientes con enfermedad o lesión pulmonares preexistentes o en cualquier sujeto con sospecha de deterioro de la oxigenación se recomienda medir PaO2. Vigilancia del paciente 217 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 6-1. Efecto de la anemia en el contenido de oxígeno de la sangre arterial PaO2 (mm Hg) SaO2 (mm Hg) [Hb] (g/dL) CaO2 (mL de O2/dL) 100 100 100 100 100 100 98 98 98 98 98 98 15 12 10 8 6 4 20.0 16.1 13.4 10.8 8.1 5.6 mientras que la SaO2 sólo cambia de 97 a 99.9%. En consecuencia, la SaO2 es un índice menos diferenciador de la oxigenación en comparación con la PaO2 en pacientes que inspiran mezclas enriquecidas con oxígeno. El método más exacto para la medición de SaO2 implica el análisis de una muestra de sangre arterial para cuantificar de manera directa las concentraciones de cada especie de hemoglobina por medio de cooximetría. Este parámetro se denomina en ocasiones saturación fraccionaria de hemoglobina. De manera alternativa, se obtiene una determinación de la SaO2 funcional mediante analizadores de gases en sangre a partir de mediciones de pH, PaO2 y PaCO2 y un algoritmo basado en la curva de disociación de la oxihemoglobina humana. Esta determinación calculada se escribe algunas veces ScO2 para distinguirla de la SaO2 fraccionaria. Dado que la medición de SaO2 requiere muestreo de sangre arterial y acceso a un cooxímetro, no se usa de manera sistemática para valorar la oxigenación en perros y gatos sanos anestesiados. Sin embargo, el advenimiento reciente de cooxímetros de sangre entera portátiles que requieren volúmenes de sangre muy pequeños significa que esta tecnología se emplea cada vez más en animales en estado crítico para determinar de manera más exhaustiva la oxigenación. La oximetría de pulso es un método alternativo para vigilar la oxigenación de manera por completo atraumática y ofrece una valoración continua en tiempo real de SaO2. Un dispositivo espectrofotoeléctrico se aplica de manera directa a piel desprovista de pelo sobre un lecho arterial periférico (como lengua, esófago, recto, vulva, oreja o dígito). La fuente de luz emite longitudes de onda del rojo y el infrarrojo que pasan por el lecho tisular. Dado que la hemoglobina oxigenada absorbe más luz en la banda del infrarrojo, mientras que la hemoglobina desoxigenada absorbe más luz en la banda del rojo, es posible distinguir las dos especies. El monitor también separa los componentes pulsátiles de cada señal y usa los componentes constantes (no pulsátiles) para normalizarlos. Esto asegura que sólo se determine la hemoglobina arterial. Se calcula el cociente de estas dos señales normalizadas y se emplea un algoritmo empírico para calcular SaO2. Las determinaciones de SaO2 obtenidas por oximetría de pulso se indican como SpO2 para distinguirlas de las saturaciones medidas por cooximetría. Los valores de SpO2 consistentes con oxigenación normal son iguales a los valores para SaO2 y varían entre 95 y 98% para animales que inspiran aire ambiental. Debe hacerse notar que, dado que la oximetría de pulso calcula el cociente de oxihemoglobina sobre la suma de hemoglobina funcional, algunas veces se denomina a la SpO2 saturación funcional de hemoglobina. Esto contrasta con la SaO2, medida por cooximetría, que registra el cociente de oxihemoglobina sobre la suma de todas las especies de hemoglobina presentes (inclui- 218 Manual de anestesia y analgesia en. . das carboxihemoglobina y metahemoglobina), y por tanto se conoce como saturación fraccionaria de hemoglobina. En pacientes sin dishemoglobinemias, la diferencia entre saturaciones funcional y fraccionaria de hemoglobina debe ser muy pequeña, pero en pacientes con carboxihemoglobina o metahemoglobinemia el registro de SpO2 es inexacto. Cualquier factor que reduzca la fuerza de la señal pulsátil (como hipotensión, hipotermia y alteración de la RVS) puede limitar la capacidad del monitor de calcular SpO2. Como ya se mencionó, un valor normal de SpO2 en un paciente anémico no garantiza oxigenación adecuada, ya que [Hb] tiene un efecto importante en CaO2. Otras limitaciones son señales espurias (ruido o “artefactos”) por movimiento en pacientes conscientes y pérdida de señal después de que la sonda se deja colocada por periodos largos, lo que ocasiona lecturas erróneamente bajas. A menudo es posible rectificar esto último al mover la sonda a un sitio adyacente. Los oxímetros de pulso se encuentran entre los monitores anestésicos que más se usan en medicina veterinaria. En el aspecto técnico son fáciles de operar y, además de mostrar SpO2 de manera continua, también miden FP. Los oxímetros de pulso disponibles en el mercado son pequeñas unidades portátiles independientes o, como alternativa, es común que se los incorpore en monitores multiparamétricos más grandes. Si bien casi todas las unidades son exactas para los fines con que se usan, es importante recordar que el oxímetro de pulso no valora la propiedad de la circulación y con este fin se requieren otras modalidades de vigilancia (véase la sección sobre vigilancia de la circulación). Aunque se recomienda de manera enfática el uso de la oximetría de pulso en todos los pacientes caninos y felinos anestesiados, debe considerarse obligatorio para pacientes que inspiran sangre ambiental, ya que estos animales tienen el mayor riesgo de desaturación. En esta circunstancia, el reconocimiento temprano de la hipoxemia y el inicio de medidas de mantenimiento pueden salvar la vida del paciente. El término ventilación total (VT) se refiere al volumen de gas que fluye hacia dentro y fuera de los pulmones, que se relaciona con la eliminación de CO2. Sin embargo, no todo este gas participa en realidad en el intercambio gaseoso, de tal modo que la ventilación puede dividirse de forma adicional en ventilación alveolar (VA, la porción que participa en el intercambio gaseoso y que algunas veces se denomina ventilación efectiva) y la ventilación de espacio muerto (VD, la porción que no participa en el intercambio gaseoso y en ocasiones se llama ventilación desperdiciada). La ventilación de espacio muerto incluye el volumen relativamente constante de gas que de manera normal está presente en las vías respiratorias superiores (es decir, el espacio muerto anatómico) y el volumen más variable en los alvéolos, que son ventilados pero no reciben flujo sanguíneo pulmonar (es decir, especio muerto alveolar). Además de este espacio muerto fisiológico, la instrumentación de las vías respiratorias relacionada con la anestesia también puede contribuir a la ventilación desperdiciada y se conoce como espacio muerto del equipo. La ventilación en un minuto (VM) se refiere al volumen total de gas que fluye hacia dentro y fuera de los pulmones en un minuto, incluido el espacio muerto. Los valores normales de VM en perros y gatos conscientes se aproximan a 200 mL/kg/min. Los dos principales determinantes de VM son FR y VC. La eficacia de la ventilación se define en última instancia en términos de eliminación de CO2 por los pulmones. La PaCO2 tiene dos determinantes principales: producción de CO2 y VA. Dado © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vigilancia de la ventilación Vigilancia del paciente 219 © Editorial El manual moderno Fotocopiar sin autorización es un delito. que la producción de CO2 permanece relativamente estable en la mayor parte de las situaciones clínicas, la PaCO2 varía de manera inversa con los cambios en VA. Por consiguiente, la PaCO2 puede considerarse el resultado neto del proceso de la ventilación. Véase en la figura 6-2 un resumen de los factores importantes para la ventilación. Pese a que las consecuencias de la ventilación insuficiente (es decir, hipoventilación) para la homeostasis del sujeto pueden no ser tan evidentes como las relacionadas con el deterioro de la circulación o la oxigenación, a menudo son igual de importantes. La hipercapnia induce trastornos ácido–base (p. ej., acidosis respiratoria), activación del sistema nervioso simpático y vasodilatación cerebral, con el resultado de generar mayor flujo sanguíneo cerebral. Resulta importa el hecho de que, en sujetos que inspiran aire ambiental (p. ej., FiO2 = 0.21), la hipoventilación también puede causar desaturación e hipoxemia. Por esta razón, la oximetría de pulso puede considerarse un monitor indirecto de la ventilación en el sentido de que un valor normal de SpO2, en un paciente que sólo respira aire ambiental, sugiere que la ventilación es razonablemente normal. Sin embargo, en pacientes que inspiran una mezcla con más de 30% de oxígeno (esto es, FiO2 > 0.3), la hipoventilación no tiene como consecuencia hipoxemia, como lo ilustra la ecuación de los gases alveolares. Los métodos para establecer la eficiencia ventilatoria en perros y gatos anestesiados deben incluir valoraciones subjetivas y objetivas. Métodos subjetivos La valoración cualitativa del VC mediante observación de los movimientos de la pared torácica o las excursiones de la bolsa respiratoria se realiza de manera sistemática en perros y gatos anestesiados a intervalos regulares frecuentes. Además, debe establecerse el patrón respiratorio. En sujetos conscientes con tipos restrictivos de neumopatía (como edema pulmonar, neumonía intersticial o derrame pleural), muchas veces se observa un patrón respiratorio superficial rápido. A la inversa, en pacientes con obstrucción de vías respiratorias (como parálisis laríngea o broncoconstricción), puede identificarse un patrón respiratorio profundo y lento. Debe señalarse que la anestesia deprime en ocasiones la ventilación y que estos patrones están menos bien definidos, en especial a planos más profundos de anestesia. Debido a la naturaleza subjetiva de estos métodos y su falta de sensibilidad, se requieren otros métodos objetivos para valorar la ventilación. Métodos objetivos Los métodos objetivos para vigilancia ventilatoria pueden calcular los componentes de la VM (FR y VC) para formular conclusiones acerca de la PaCO2, o medir de manera directa o determinar la PaCO2 misma. Frecuencia respiratoria La FR es un determinante principal del VM y por tanto incide en la PaCO2. Los valores normales de FR en perros y gatos conscientes son de 10 a 20 y 20 a 30 respiraciones por minuto (rpm), respectivamente. Aunque los valores extremos de FR (bradipnea o taquipnea) pueden precipitar decrementos de VM y VA y ocasionar hipercapnia, el mantenimiento de FR dentro de un llamado intervalo normal de ningún modo garantiza un funcionamiento ventilatorio adecuado. Es necesario determinar FR y VC (véase más adelante) para calcular VM y hacer inferencias razonables acerca de la ventilación. 220 Manual de anestesia y analgesia en. . Volumen corriente El VC puede valorarse de manera cuantitativa con un dispositivo llamado ventilómetro (y algunas veces también respirómetro o espirómetro). Si se calculan tanto VC como FR es posible determinar VM y por tanto la eficiencia ventilatoria. En perros y gatos conscientes normales, los valores de VC son de 15 a 20 y 10 a 15 mL/kg, en ese orden. Los ventilómetros pueden ser dispositivos mecánicos muy simples (como el respirómetro de Wright) o monitores que se conectan a una computadora, en los cuales el flujo se convierte en una señal electrónica que se procesa y muestra de manera digital. En el caso del respirómetro de Wright, el dispositivo se inserta en el sistema de respiración en el lado espiratorio en que se une a la máquina de anestesia. El VC se registra en un manómetro y la FR debe contarse de manera manual. Se dispone de ventilómetros más elaborados como componentes de monitores multiparamétricos. Estas unidades utilizan espirometría de chorro lateral para medir de manera continua presiones, volúmenes, flujos, distensibilidad y resistencia pulmonares. Si bien la ventilometría avanzada no está indicada para la vigilancia anestésica sistemática en perros y gatos sanos, puede proporcionar información útil sobre la mecánica pulmonar en pacientes con anomalías pulmonares específicas. Presión parcial de CO2 en sangre arterial En última instancia, es la PaCO2 la que representa el resultado neto de la ventilación eficaz (es decir, VA), de tal modo que la medición directa de PaCO2 constituye la cuantificación más exacta de este proceso. De acuerdo con la relación que se ilustra en la figura 6-2, las elevaciones de PaCO2 implican hipoventilación, mientras que los decrementos de PaCO2 suponen hiperventilación. Comparados con los propios del ser humano, los intervalos normales para PaCO2 son marginalmente menores en perros y mucho menores en gatos (32 a 42 y 26 a 36 mm Hg, de manera respectiva). Como en el caso de la PaO2, la medición de PaCO2 se considera mínimamente traumática, ya que implica el muestreo de sangre arterial en arterias como la femoral o la dorsal pedia. Las muestras deben colectarse en una jeringa heparinizada, sellarse y analizarse de inmediato en una máquina analizadora de gases en sangre. La capacidad de realizar este análisis es cada vez más común en la práctica veterinaria clínica, y se dispone de varios monitores portátiles que se colocan © Editorial El manual moderno Fotocopiar sin autorización es un delito. Se dispone de varias técnicas para medir la FR. Algunas requieren tan sólo que se observe al paciente o el sistema de respiración, mientras que otras emplean dispositivos de vigilancia automatizada. Cualquiera que sea la técnica elegida, la FR debe medirse al menos cada 5 min en todos los sujetos anestesiados. La manera más fácil de valorar la FR consiste en observar las excursiones de la pared torácica, los movimientos de la bolsa respiratoria, o ambas cosas. De manera alternativa, es posible auscultar los ruidos respiratorios con un estetoscopio ordinario o uno esofágico. También puede valorarse de manera continua la FR con un dispositivo de vigilancia respiratoria. Esto supone la colocación de un sensor entre el adaptador de la sonda endotraqueal y el sistema de respiración para reconocer cambios en la temperatura o el flujo de gas en las vías respiratorias. Las unidades muestran de manera digital la FR sobre una base continua o pueden programarse para emitir un zumbido audible con cada respiración. La mayor parte de los monitores también cuenta con alarmas que pueden programarse para advertir al anestesiólogo si la FR disminuye por abajo de un punto predeterminado. Vigilancia del paciente 221 40 Meseta alveolar CO2 0 Espiración Inspiración Tiempo Figura 6-6. Componentes de la onda capnográfica normal. © Editorial El manual moderno Fotocopiar sin autorización es un delito. al lado del paciente (como los IRMA TruPoint e i-Stat). Tales unidades emplean cartuchos de un solo uso que miden pH, PO2 y PCO2, así como otros parámetros diversos. Si bien la medición de PaCO2 proporciona datos cuantitativos exactos, la necesidad de muestreo repetido de sangre arterial y los costos implícitos hacen impráctica la vigilancia anestésica sistemática en perros y gatos sanos. En pacientes en los cuales la determinación del estado ventilatorio es crítica, o cuando es probable que otros monitores menos traumáticos como el que mide el CO2 corriente final (véase más adelante) sean inexactos, está indicado cuantificar la PaCO2. CO2 al final del volumen corriente Dado que la difusión del CO2 en los pulmones es muy eficiente, la PaCO2 y la presión parcial alveolar de CO2 (PACO2) son en esencia iguales. Además, la presión parcial de CO2 en las vías respiratorias superiores al final de la espiración es muy cercana a la PACO2 y recibe el nombre de presión parcial (tensión) de CO2 al final del volumen corriente (CO2CF). Por lo tanto, la CO2CF constituye un sustituto razonable de PaCO2 y puede medirse de manera continua y no traumática (aunque requiere intubación endotraqueal en perros y gatos). La capnometría es la medición y el registro numérico de las concentraciones de CO2 durante el ciclo respiratorio y el capnómetro es el dispositivo que realiza la medición y muestra las cifras de CO2. La capnografía es el registro gráfico de concentraciones de CO2 en una pantalla o en papel y el capnógrafo es el dispositivo que genera la onda real. La figura 6-6 es una representación esquemática de una capnografía normal. La mayoría de los dispositivos de vigilancia informan de manera específica el valor de CO2CF (es decir, la concentración al final de la meseta espiratoria) y la expresan como una presión parcial (es decir, en mm Hg). Las unidades actuales cuentan con capnometría y capnografía. Los capnómetros utilizan tecnología de infrarrojo para medir concentraciones de CO2CF. Los capnómetros de desviación o de chorro lateral requieren un acceso de muestreo conectado a un adaptador que se conecta al extremo del paciente de la sonda endotraqueal. Se muestrea el gas de manera continua y la muestra se transfiere al monitor para análisis y registro. De manera alternativa, los capnómetros sin desviación o de chorro principal utilizan un analizador pequeño que de modo similar se conecta al extremo del paciente de la sonda endotraqueal, pero analiza el gas localmente y luego transmite la información al monitor para su registro. Aunque ambos tipos de capnómetros son de uso frecuente en perros y gatos, existen algunas limitaciones que deben considerarse cuando se emplean en pacientes muy pequeños. Los monitores de chorro lateral ordinarios con altas velocidades de muestreo (150 a 200 mL/min) tienden a subestimar la PaCO2 debido al VC relativamente bajo en estos sujetos, de lo que resultan cifras de CO2CF falsamente bajas. Este problema puede atenuarse mediante el uso de un capnómetro con menor velocidad de muestreo (50 mL/min) en esos sujetos. A la inversa, la capnografía de chorro principal compite a menudo por el VC en sujetos muy pequeños debido al mayor espacio muerto creado por el adaptador en las vías respiratorias. El uso de adaptadores neonatales de bajo volumen en pacientes pequeños reduce al mínimo este problema. En circunstancias normales, el CO2CF es un cálculo no traumático razonable de la PaCO2. Se esperan valores normales de CO2CF 4 a 6 mm Hg menores que la PaCO2 (es decir, 27 a 37 y 22 a 32 mm Hg en perros y gatos, respectivamente) debido a la ventilación del espacio muerto fisiológico normal. En la mayoría de los pacientes anestesiados, los incrementos de CO2CF acompañados de una onda capnográfica normal son resultado de hipoventilación (figura 6-7A). Sin embargo, en algunos pacientes no es apropiado inferir la ventilación adecuada sólo con base en un valor normal de CO2CF. Cualquier factor que aumente de manera proporcional con el espacio muerto (alveolar, anatómico o del equipo) incrementa el gradiente PaCO2–CO2CF y hace a CO2CF menos útil como un indicador de la ventilación. Resulta interesante el hecho de que los trastornos que incrementan la fracción de cortocircuito (p. ej., perfusión de los alvéolos en ausencia de ventilación) tienden a ejercer un efecto mínimo en el gradiente. En el cuadro 6-2 se resumen los factores clave que pueden contribuir a este fenómeno y que deben considerarse al interpretar CO2CF en ausencia de valores de PaCO2 medidos al mismo tiempo. Además de su uso principal como monitores de la ventilación, capnometría y capnografía proporcionan información útil adicional sobre otros aspectos del funcionamiento pulmonar, circulatorio y del equipo anestésico, lo cual las hace monitores muy versátiles. La falta de CO2CF y de una onda capnográfica normal indica de manera confiable la intubación esofágica en un paciente con flujo sanguíneo pulmonar razonable. De modo similar, la presencia de CO2CF y una onda capnográfica normal se interpretan como signos de colocación correcta de la sonda. La obstrucción parcial de las vías respiratorias tiene como resultado un capnograma anormal con posibles decremento de CO2CF y aumento del gradiente PaCO2–CO2CF (figura 6-7B). Se observa un ascenso sistólico inspiratorio progresivamente prolongado, que comienza antes de terminar la espiración, lo cual reduce la cifra de CO2CF. Como ya se mencionó, el trastorno de la circulación por una amplia variedad de razones también influye en CO2CF. En ausencia de un incremento de la ventilación, es posible identificar una declinación exponencial de CO2CF con una onda capnográfica normal en caso de decremento del GC; si no se resuelve, puede indicar colapso cardiovascular inminente (figura 6-7C). Por lo regular se observa el retorno de las concentraciones de CO2CF durante la reanimación cardiopulmonar cerebral al recuperarse la circulación espontánea. La onda capnográfica también puede proporcionar valiosa información acerca del funcionamiento del sistema de respiración durante la anestesia. En circunstancias normales, ya sea que se use un sistema con o sin recirculación, la concentración de CO2 en el gas inspirado debe ser © Editorial El manual moderno Fotocopiar sin autorización es un delito. 222 Manual de anestesia y analgesia en. . Vigilancia del paciente 223 A 40 CO2 0 Tiempo B 40 CO2 0 Tiempo C 40 CO2 0 Tiempo D © Editorial El manual moderno Fotocopiar sin autorización es un delito. 40 CO2 0 Tiempo E 40 CO2 0 Tiempo Figura 6-7(A–E). Variaciones en la capnografía normal. (A) Hipoventilación inducida por anestésico: CO2CF elevada con onda normal. (B) Obstrucción parcial de las vías respiratorias: prolongación progresiva del ascenso sistólico inspiratorio y posible decremento de CO2CF. (C) Colapso cardiovascular: decremento exponencial de CO2CF con onda normal. (D) Recirculación de CO2 por fallo del sistema de respiración: aumento de CO2 inspirado y CO2CF. (E) Sistema sin recirculación con VS bajo o fuga alrededor de la sonda endotraqueal: meseta alveolar estrecha o ausente con decremento de CO2CF. 224 Manual de anestesia y analgesia en. . F 40 CO2 0 Tiempo G 40 CO2 0 Tiempo Figura 6-7(F–G). Variaciones en la capnografía normal. (F) Esfuerzos ventilatorios espontáneos durante la ventilación mecánica: muescas en diversos sitios durante inspiración y espiración. (G) Oscilaciones cardiógenas: pequeñas depresiones escalonadas regulares al final de la fase espiratoria. Aumento del espacio muerto alveolar • Hipoperfusión (decremento de GC/flujo sanguíneo pulmonar por cualquier causa) • Embolia pulmonar (aire o trombo) • Neumopatía obstructiva • Insuflación pulmonar excesiva Aumento del espacio muerto anatómico • Respiración superficial (reducción del VC por cualquier causa) cero o casi cero. Si se utiliza un sistema circular (con recirculación), una válvula unidireccional defectuosa o un absorbedor de CO2 agotado pueden causar inspiración o recirculación de CO2 espirado. Esto se reconoce en el capnógrafo como un aumento del valor basal y el monitor indica elevación del CO2 al final del volumen corriente e inspirado (figura 6-7D). Con un sistema de Mapleson (sin recirculación), un gasto inadecuado de gas nuevo puede producir un efecto similar. Los indicios de inspiración de CO2 y la observación de la onda capnográfica anormal deben llevar de inmediato a investigar el funcionamiento del sistema de respiración. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 6-2. Factores que incrementan el gradiente entre el CO2 arterial y el CO2 al final del volumen corriente Vigilancia del paciente 225 Puede observarse estrechez o ausencia de las mesetas con valores reducidos de CO2CF en pacientes pequeños en caso de bajos VC cuando se emplean sistemas sin recirculación (figura 6-7E). En esta circunstancia, una FR alta puede en realidad causar alguna recirculación de CO2 espirado a pesar de gastos adecuados de gas nuevo. Una fuga alrededor de la sonda endotraqueal produce una onda similar a la que se ilustra en la figura 6-7E. En pacientes sometidos a ventilación mecánica, los esfuerzos ventilatorios espontáneos se identifican como pequeñas muescas o hendiduras en diversos puntos de la capnografía durante inspiración y espiración (figura 6-7F). Esto puede indicar la necesidad de revalorar los parámetros del ventilador. Las oscilaciones cardiogénicas se ven como pequeñas protuberancias regulares en forma de dientes al final de la fase espiratoria y se relacionan con cambios de la presión intratorácica en cada ciclo cardiaco (figura 6-7G). Rara vez tienen implicaciones clínicas, pero muchos capnómetros indican una FR erróneamente alta y una CO2CF variable falsamente baja. Este patrón tiende a ser más común en pacientes pequeños debido al mayor tamaño del corazón respecto de la cavidad torácica. El uso de capnografía para la vigilancia anestésica sistemática en perros y gatos ha aumentado en grado impresionante en los años recientes. Las pequeñas unidades manuales de chorro principal, solas o combinadas con oximetría de pulso, ofrecen la ventaja de ser portátiles (como la Tidal Wave®, Philips Respironics). De manera alternativa, se dispone de unidades de chorro principal o lateral como parte de monitores multiparamétricos más grandes específicos para veterinaria con capacidades de registro de ECG, PA, oximetría de pulso y temperatura. La capnografía no es traumática, resulta simple de realizar en términos técnicos y es muy superior a otros métodos sin penetración corporal para valorar la ventilación (como FR y valoración subjetiva de VC). Además, tiene la ventaja adicional de cuantificar también elementos del estado circulatorio y el funcionamiento del equipo al mismo tiempo. Por estas razones, se recomienda la capnografía para la vigilancia anestésica en todos los pacientes caninos y felinos, siempre que sea posible. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Vigilancia de la termorregulación La actividad termorreguladora se deprime cuando se administran anestésicos y es común que se produzca hipotermia en animales anestesiados, en especial en intervenciones más prolongadas. La hipotermia significativa reduce la necesidad de anestésico y demora la recuperación. Si el paciente presenta escalofrío como una respuesta termogénica, el consumo de oxígeno aumenta en gran proporción. Aunque es menos común, también puede ocurrir hipertermia, y suele presentarse en perros de razas grandes con pelaje abundante que se cubren con múltiples campos y se exponen a alguna forma de dispositivo calefactor activo. Dado que el mantenimiento de la normotermia durante la anestesia se considera óptimo, debe vigilarse la temperatura central del cuerpo para detectar anormalidades y guiar el uso de dispositivos de calentamiento. La manera más fácil de medir la temperatura consiste en usar un simple termómetro rectal, que puede insertarse con la mano de manera intermitente (cada 20 a 30 min). Como alternativa, puesto que el acceso al paciente es a menudo limitado bajo los campos quirúrgicos, es posible insertar un termistor esofágico o rectal y dejarse colocado. Un cable conecta el termistor a un monitor que de manera continua registra una lectura digital de temperatura. La mayor parte de los monitores multiparamétricos usados para determinar el funcionamiento cardiopulmonar también cuenta con una sonda de temperatura. 226 Manual de anestesia y analgesia en. . Vigilancia de otros parámetros Como se ha señalado ya, la vigilancia de la profundidad de la anestesia, circulación, oxigenación, ventilación y termorregulación debe considerarse un estándar de atención en todos los pacientes caninos y felinos. Además, existen otros parámetros que deben vigilarse en pacientes o circunstancias seleccionados. En seguida se los revisa de manera sinóptica. Valores de laboratorio Además de las pruebas efectuadas de manera sistemática antes de anestesia para determinar el estado físico del paciente y el riesgo anestésico, puede estar indicado repetir pruebas de laboratorio específicas durante la anestesia y después en diversos pacientes e intervenciones. Los animales con pérdida sanguínea previa, hemorragia relacionada con la operación, o choque por cualquier causa, deben someterse a evaluaciones seriadas de [Hb] o hematócrito durante la anestesia para vigilar el sangrado y la respuesta a la reposición del volumen. Muchas veces se cuantifican al mismo tiempo proteína total o sólidos totales. También pueden ser útiles las determinaciones seriadas de lactato como indicadores de la perfusión en estos pacientes. Es común el descenso de la presión coloidosmótica (PCO) en animales en estado crítico y se exacerba con la anestesia general. Puede estar indicada la valoración seriada de la PCO en sujetos seleccionados anestesiados para guiar la fluidoterapia. Los pacientes con trastornos de la homeostasis de la glucosa (p. ej., diabetes o insulinomas) pueden requerir mediciones frecuentes de la glucosa sanguínea (GS) o glucemia durante la anestesia para guiar el tratamiento y mantener la glucosa dentro de un intervalo aceptable. Los pacientes neonatos, aunque sean por lo demás sanos, están predispuestos a la hipoglucemia, y en ellos debe valorarse la GS durante la anestesia y quizá después para todas las intervenciones, salvo las más breves. En animales en estado crítico, también está indicada a menudo la cuantificación del estado ácido–base, electrolitos séricos y coagulación durante la anestesia en diversos contextos. Bloqueo neuromuscular El funcionamiento neuromuscular debe vigilarse con un estimulador nervioso siempre que se administre un relajante muscular de acción periférica. Reflujo gastroesofágico El reflujo gastroesofágico (RGE) es común en perros y gatos anestesiados, pero no suele producir signos clínicos (reflujo silencioso). Entre los posibles efectos adversos del RGE se incluyen as- © Editorial El manual moderno Fotocopiar sin autorización es un delito. Funcionamiento renal El funcionamiento renal se determina como parte de la valoración preanestésica sistemática mediante cuantificación de creatinina, nitrógeno ureico sanguíneo, densidad relativa urinaria, o alguna combinación de éstos. En animales sanos que se anestesian para intervenciones comunes casi nunca se necesita mayor vigilancia renal durante la anestesia. Sin embargo, en pacientes con nefropatía o inestabilidad hemodinámica preexistentes, o en sujetos que serán anestesiados para operaciones muy prolongadas, tal vez esté indicada la vigilancia de la diuresis mediante un sistema de recolección cerrado. Vigilancia del paciente 227 piración del reflujo del contenido gástrico y disfunción esofágica posanestésica. La medición del pH esofágico con una sonda de pH flexible es un método práctico para detectar cambios de pH relacionados con reflujo silencioso. Esto alerta al anestesiólogo sobre el problema, de tal modo que pueden realizarse lavado y aspiración gastroesofágicos. Presión de insuflación de la sonda endotraqueal En perros y gatos se emplean con frecuencia sondas endotraqueales con manguitos de baja presión y alto volumen diseñadas para uso en personas. En pacientes humanos se recomienda que la presión ejercida por el manguito contra la pared lateral de la tráquea se mantenga en 25 a 30 cm H2O. Presiones más altas pueden relacionarse con daño isquémico de la mucosa traqueal y presiones más bajas pueden no ser eficaces para prevenir la aspiración. En medicina veterinaria, las presiones del manguito se cuantifican de manera indirecta cerrando la válvula de disparo y oprimiendo la bolsa respiradora para determinar la presión en las vías respiratorias a la cual se reconoce una fuga audible. A continuación se insufla más aire en el manguito, según se requiera. En un método cuantitativo más directo se usa un manómetro manual portátil que puede conectarse al puerto de insuflación del manguito para medir y mantener la presión en éste (Posey® Cufflator, Posey Respiratory Therapy, Arcadia, CA). © Editorial El manual moderno Fotocopiar sin autorización es un delito. Manejo de complicaciones anestésicas comunes En la sección anterior se expusieron con algún detalle los principios de la vigilancia de profundidad de la anestesia, circulación, oxigenación, ventilación y termorregulación. Aunque puede parecer obvio, vale la pena señalar una vez más que para realizar lo anterior de manera eficaz y optimizar el estándar de atención del paciente es necesario que un individuo capacitado se encargue de la vigilancia y el manejo de la anestesia. Está difundida la percepción errónea de que la morbilidad anestésica es rara en pacientes por lo demás sanos sometidos a intervenciones comunes y que reciben dosis apropiadas de fármacos anestésicos. Esta idea fue perpetuada por el hecho de que en la práctica general no era común realizar valoraciones objetivas basadas en equipo. En otras palabras, debido a que no se medían de manera sistemática parámetros como PA y CO2CF, en muchos pacientes no se detectaban morbilidades como hipotensión e hipoventilación. Sin embargo, a medida que continúan en evolución los estándares de la vigilancia anestésica, es cada vez más evidente que la situación es distinta. Los veterinarios que vigilan de manera sistemática estos parámetros reconocen que hipotensión e hipoventilación, por ejemplo, son en realidad comunes durante la anestesia. En un estudio retrospectivo basado en los registros de unos 100 perros y gatos sanos anestesiados para operación programada común mediante diversos protocolos anestésicos habituales en ambientes de práctica general, la incidencia aproximada de hipotensión fue de 26%. Es probable que la incidencia de hipoventilación en esta población fuera de la misma magnitud, cuando no mayor. Pese a que el uso de monitores exactos objetivos para valorar circulación, oxigenación y ventilación es el primer paso para minimizar la morbilidad anestésica, el veterinario también debe saber cómo reaccionar cuando se detectan anormalidades. En la siguiente sección se pro- 228 Manual de anestesia y analgesia en. . Cuadro 6-3. Fármacos administrados para controlar las alteraciones de la FC y el ritmo Fármaco Dosis intravenosa Indicación Atropina 0.02 a 0.04 mg/kg Bradicardia Glucopirrolato 0.005 a 0.01 mg/kg Bradicardia Lidocaína Perro: bolo de 2 a 4 mg/kg seguido de infu- Arritmias ventriculares sión de 40 a 80 μg/kg/min Gato: 0.5 a 1 mg/kg durante 5 min Procainamida Perro: bolo de 3 a 6 mg/kg seguido de infu- Arritmias ventriculares sión de 10 a 40 μg/kg/min Gato: (¿?) Diltiazem Infusión IV LENTA de 0.05 a 0.15 mg/kg se- Arritmias supraventriculares guida de 1 a 5 μg/kg/min si se requiere Verapamilo Infusión IV LENTA de 0.05 a 0.15 mg/kg Esmolol Infusión IV LENTA de 0.25 a 0.5 mg/kg segui- Arritmias supraventriculares da de 50 a 200 μg/kg/min Arritmias supraventriculares Bradicardia y bradiarritmias No existe un valor específico de FC por abajo del cual se lo considere inaceptable y por arriba adecuado. La relevancia de un valor individual de FC en ausencia de otros parámetros de vigilancia e información contextual es mínima. La FC ideal para el paciente es aquella a la que el funcionamiento circulatorio es óptimo. Corresponde al veterinario realizar este juicio basado en otros parámetros cuantificados, como PA y ritmo cardiaco, además de algunas presuposiciones clave acerca del individuo y los fármacos administrados. En general, es probable que valores de FC <50 lpm en perros y <100 lpm en gatos se relacionen con deterioro cardiovascular y ameriten consideración. En determinadas circunstancias, y de acuerdo con otros parámetros de vigilancia, valores de PC por arriba de tales cifras también pueden ser causa de preocupación. La bradicardia sinusal puede deberse a incrementos inducidos por fármacos del tono vagal, reflejos de mediación vagal, hiperpotasemia, profundidad excesiva de la anestesia, o hipotermia. Si se requiere tratamiento, los aumentos del tono vagal suelen reaccionar a los anticolinérgicos (véanse las dosis en el cuadro 6-3). En caso de profundidad excesiva de la anestesia o hipotermia significativa, los anticolinérgicos a menudo son ineficaces, y el tratamiento debe concentrarse en corregir la causa subyacente (es decir, reducir la profundidad de la anestesia, calentar activamente al sujeto o ambas cosas). En algunos casos, la reversión de la anestesia, de ser posible, está indicada para restaurar un grado adecuado de FC. En pacientes anestesiados, la decisión de tratar la bradicardia sinusal con un anticolinérgico puede depender de la PA del animal. Los pacientes con bradicardia e hipotensión (véase la sección sobre hipotensión, más adelante) se benefician hemodinámicamente casi con toda certeza © Editorial El manual moderno Fotocopiar sin autorización es un delito. porcionan lineamientos para algunas complicaciones comunes que ocurren durante la anestesia en perros y gatos. Vigilancia del paciente 229 A B Figura 6-8. (A) Bloqueo AV de primer grado: prolongación del intervalo P-R. (B) Bloqueo AV de segundo grado tipo I: alargamiento progresivo del intervalo P-R seguido por bloqueo de la onda P. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 6-9. Bloqueo AV de tercer grado. del tratamiento porque al elevarse la FC se incrementa el GC, lo que a su vez eleva la PA. En pacientes que tienen bradicardia, pero permanecen normotensos, la decisión de administrar un anticolinérgico suele depender de la magnitud de la bradicardia y la presencia simultánea de bradiarritmias. No es probable que los pacientes con bradicardia e hipertensión experimenten beneficios hemodinámicos con anticolinérgicos; incrementar la FC en esta situación sólo sirve para aumentar el trabajo miocárdico en presencia de mayor poscarga. Las bradiarritmias, como los bloqueos auriculoventriculares (AV) de primero y segundo grados, ocurren con mucha frecuencia en perros y gatos sanos anestesiados debido a la administración de fármacos vagotónicos (opioides, a2-agonistas) (figura 6-8). La decisión de tratar estos trastornos depende una vez más de su efecto en el GC y es función de la frecuencia del bloqueo y la frecuencia ventricular efectiva. El bloqueo AV de segundo grado esporádico o intermitente no requiere tratamiento si se mantienen FC y PA eficaces razonables. A la inversa, si el bloqueo se torna más frecuente y se relaciona con hipotensión, tal vez se necesite un anticolinérgico. Debe hacerse notar que, en caso de hiperpotasemia, tal vez la bradicardia y el bloqueo AV no reaccionen a un anticolinérgico. En esta situación, deben iniciarse medidas para reducir los valores séricos de potasio y, en presencia de arritmias potencialmente letales, administrarse gluconato de calcio al 10% (0.5 a 1.0 mL/kg en infusión intravenosa [IV] lenta por 2 a 5 min). En algunos pacientes caninos puede haber enfermedad del nodo AV preexistente. En casos de bloqueo AV de segundo o tercer grados grave, la bradicardia es evidente durante la exploración física preanestésica y debe llevar a realizar una valoración ECG exhaustiva y una investigación cardiaca antes de la anestesia (figura 6-9). Estos pacientes no deben anestesiarse sin un marcapasos, ya que el ritmo ventricular puede suprimirse por cualquier protocolo anestésico, y la bradicardia no reacciona a los anticolinérgicos. 230 Manual de anestesia y analgesia en. . Taquicardia y taquiarritmias En muchos casos, la taquicardia es tan perjudicial para el funcionamiento circulatorio como la bradicardia. En términos generales, es probable que los valores de FC >160 lpm en perros y >200 lpm en gatos se vinculen con algún grado de deterioro cardiovascular. En determinadas circunstancias, y de acuerdo con otros parámetros de vigilancia, los valores de FC por debajo de estos umbrales también pueden ser causa de preocupación. La taquicardia sinusal sostenida se relaciona con decremento de VS y GC, lo que puede ocasionar descenso de PA e hipoperfusión. En perros y gatos anestesiados, la taquicardia sinusal puede deberse a fármacos anestésicos (ketamina, tiobarbitúricos, anticolinérgicos, agonistas b-adrenérgicos, otros), profundidad inadecuada de la anestesia, hipercapnia, hipopotasemia, hipertermia, hipovolemia, anemia, hipertiroidismo, feocromocitoma y anafilaxis. Es claro que el tratamiento debe enfocarse en la posible causa subyacente. Si la profundidad de la anestesia es inadecuada, puede estar indicado ajustar de forma ascendente el anestésico inyectable o inhalable. De manera alternativa, la administración complementaria de opioide o lidocaína suele reducir la respuesta simpática a la estimulación dolorosa. Si se sospecha hipovolemia, está indicada la reposición de volumen con cristaloides, coloides o ambos. Menos a menudo se requiere un bloqueador b-adrenérgico como esmolol (véanse las dosis en el cuadro 6-3) para controlar la taquicardia en animales con hipertiroidismo o feocromocitoma. Los complejos ventriculares prematuros aislados o esporádicos no son raros en perros y gatos sanos anestesiados, y pocas veces requieren intervención farmacológica ya que su efecto en el GC es mínimo (figura 6-10). Los pacientes con desequilibrio ácido–base, trastornos electrolíticos (hipopotasemia), hipoxemia, traumatismo, septicemia, choque o miocardiopatía primaria pueden desarrollar taquicardia ventricular (TV) sostenida, paroxística o polimórfica. La TV es una arritmia grave y por lo regular exige tratamiento cuando ocurre en pacientes anestesiados. La identificación y corrección de factores contribuyentes (como hipoxemia, hipopotasemia, hipovolemia, otros), cuando es posible, es crucial. Aunque se usa cardioversión con corriente directa para tratar la TV en seres humanos, el abordaje farmacológico es aún el más común en pacientes veterinarios. La lidocaína es el tratamiento de primera línea y la procainamida está indicada para casos resistentes (véanse las dosis en el cuadro 6-3). Los complejos auriculares o de la unión prematuros aislados también son comunes en pacientes por lo demás sanos durante la anestesia y a menudo tienen implicaciones hemodinámicas mínimas (figura 6-11). La taquicardia supraventricular (TSV) sostenida y la fibrilación auricular (FA) pueden afectar el GC y el estado circulatorio si su frecuencia es alta (figura 6-12). La cardioversión eléctrica es el tratamiento más eficaz para TSV o FA de inicio agudo en personas, pero puede no ser factible en muchos ambientes veterinarios. Como en el caso de otras arritmias, está © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 6-10. Complejo ventricular prematuro. Vigilancia del paciente 231 Figura 6-11. Complejo auricular prematuro. Figura 6-12. Fibrilación auricular. © Editorial El manual moderno Fotocopiar sin autorización es un delito. indicada una evaluación exhaustiva de las posibles causas subyacentes. En perros y gatos anestesiados, las intervenciones farmacológicas se concentran en convertir la TSV de vuelta a ritmo normal o, en el caso de la FA, en reducir la frecuencia de respuesta ventricular para mejorar VS y GC. Los fármacos usados con más frecuencia para el tratamiento agudo de estas arritmias son bloqueadores de los conductos del calcio (diltiazem y verapamilo) y bloqueadores b-adrenérgicos (esmolol) (véanse las dosis en el cuadro 6-3). Debe hacerse notar que en pacientes con disfunción sistólica subyacente (como miocardiopatía dilatada) ambas clases de fármacos deben utilizarse con cautela debido a sus potenciales efectos inotrópicos negativos. En esta situación es prudente comenzar con la dosis más baja posible y ajustar de modo ascendente y cuidadoso mientras se vigila el estado circulatorio. Hipotensión Según se ha indicado ya, la hipotensión es una de las complicaciones anestésicas más comunes en perros y gatos y sólo puede reconocerse si la PA se mide en verdad. La hipotensión se define como una PAM <60 mm Hg, y valores en el intervalo de 60 a 70 mm Hg hacen a menudo necesario modificar el manejo anestésico para evitar la tendencia descendente. Si se emplea un sistema Doppler para medir la PA, la hipotensión se define como una PAS <80 mm Hg, y valores en el intervalo de 80 a 90 mm Hg pueden de modo similar hacer necesarios ajustes en el plan anestésico. Recuérdese que en gatos y otros pacientes pequeños, el sistema Doppler puede subestimar la PAS en unos 15 mm Hg, y esto debe tomarse en cuenta al analizar valores Doppler en estos pacientes. Los decrementos sostenidos de la PA por debajo de estas cifras se relacionan algunas veces con trastorno de la perfusión y posible daño isquémico de órganos, por lo cual debe realizarse todo esfuerzo posible por evitar la hipotensión. La PAM es el producto de GC y RVS. En consecuencia, cualquier factor que reduzca uno o ambos determinantes puede causar hipotensión. Entre los escenarios comunes que pueden reducir el GC se incluyen bradicardia, hipovolemia y deterioro de la contractilidad miocárdica. La alteración de la contractilidad puede deberse a cardiopatía primaria, depresión miocárdica inducida por anestésico, septicemia o síndrome de respuesta inflamatoria sistémica (SRIS). Algunas causas de reducción de la RVS son vasodilatación por anestésico, septicemia y SRIS. Muchos anestésicos de uso común pueden provocar hipotensión incluso cuando se administran en dosis apropiadas. Isoflurano y sevoflurano son los dos anestésicos inhalables más utilizados en la actualidad en la práctica veterinaria, y ambos pueden ocasionar depresión significativa dependiente de la dosis y vasodilatación cuando se administran a pacientes por lo demás sanos. 232 Manual de anestesia y analgesia en. . 1) Evaluar la profundidad de la anestesia y considerar reducirla. Menos anestésico inhalable significa menos depresión miocárdica y vasodilatación, lo que a su vez mejora la PA. En pacientes por lo demás sanos este abordaje es a menudo todo lo necesario para restablecer grados aceptables de PA. Incluso pequeños ajustes en los parámetros del vaporizador pueden tener un efecto significativo. En algunos casos, la adición de agentes complementarios sin efectos vasodilatadores o depresores del miocardio significativos pueden facilitar una mayor reducción de los parámetros del vaporizador. 2) Evaluar la FC y considerar elevarla. Como ya se mencionó, la bradicardia puede contribuir a reducir el GC y la hipotensión. Debe considerarse el uso de anticolinérgicos (atropina o glucopirrolato) si el paciente tiene hipotensión y bradicardia. Debe tenerse cautela, ya que puede ocurrir taquicardia de rebote y ser tan perjudicial para el GC como la bradicardia (aunque casi siempre es de corta duración). Debe señalarse que no es racional administrar un anticolinérgico para tratar la hipotensión si el paciente tiene FC normal o taquicardia. Véanse las dosis en el cuadro 6-3. 3) Determinar el volumen circulatorio y considerar incrementar la administración de líquidos. El ritmo promedio de administración IV de cristaloides durante la anestesia en perros y gatos normovolémicos es de unos 10 mL/kg/h. Si bien se ha recomendado administrar bolos IV de cristaloides a pacientes anestesiados normovolémicos pero hipotensos como una medida para mejorar la PA, nueva evidencia sugiere que esto podría no ser benéfico e incluso inducir efectos secundarios negativos relacionados con hemodilución. Sin embargo, en animales con verdadera deficiencia de volumen por deshidratación, pérdida de volumen o pérdidas a tercer espacio, debe iniciarse la reposición de volumen para restablecer la precarga y GC. Con ese fin se requiere la administración de cristaloides, coloides sintéticos, productos hemáticos o alguna combinación de éstos. 4) Valorar el funcionamiento miocárdico y considerar elevar la contractilidad cardiaca. Si las tres primeras medidas no han mejorado la PA o si el paciente tiene disfunción miocárdica documentada o probable, está indicado el tratamiento con un inotrópico positivo para mejorar VS y GC. Por lo regular se utiliza efedrina en pacientes por lo demás sanos que experimentan hipotensión inducida por anestésico. Tiende a ser menos eficaz en presencia de acidosis o hipovolemia. La efedrina estimula a receptores a-adrenérgicos y b-adrenérgicos y puede administrarse en bolo, lo cual la hace conveniente para el uso sistemático. La dilución de la solución estándar de 50 mg/mL a 5 mg/mL hace factible la dosificación exacta en pacientes pequeños. Dobutamina y dopamina también se emplean con frecuencia por sus propiedades inotrópicas, pero sus semividas breves hacen necesario que se las administre por infusión con- © Editorial El manual moderno Fotocopiar sin autorización es un delito. La acepromazina, en virtud de sus efectos de bloqueador a-adrenérgico, también causa vasodilatación y puede precipitar hipotensión, en especial cuando se administra junto con un fármaco inhalable. En pacientes afectados, los efectos adversos de estos fármacos son algunas veces incluso más profundos. En consecuencia, se recomienda un protocolo anestésico equilibrado, ya que esto reduce al mínimo las dosis necesarias de ellos y el riesgo de hipotensión. Si se documenta hipotensión o una propensión a ella, deben considerarse las posibles causas de tal modo que puedan tratarse. Deben realizarse esfuerzos por optimizar oxigenación y ventilación en pacientes hipotensos. En seguida se delinea un abordaje razonable de la hipotensión en la mayor parte de las situaciones: Vigilancia del paciente 233 Cuadro 6-4. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fármaco Fármacos usados para la hipotensión Dosis intravenosa Indicación Atropina 0.02 a 0.04 mg/kg Hipotensión por bradicardia Glucopirrolato 0.005 a 0.01 mg/kg Hipotensión por bradicardia Efedrina 0.05 a 0.2 mg/kg Hipotensión debida a depresión de la contractilidad miocárdica inducida por anestésico Dobutamina IRC de 2 a 15 μg/kg/min (comenzar con Hipotensión por depresión de la condosis baja y ajustar hasta obtener el efecto tractilidad miocárdica, bradicardia o deseado) ambas Dopamina IRC de 2 a 10 μg/kg/min (comenzar con Hipotensión por depresión de la condosis baja y ajustar hasta obtener el efecto tractilidad miocárdica, bradicardia o deseado) ambas Adrenalina IRC de 0.05 a 0.3 μg/kg/min (comenzar Hipotensión por vasodilatación procon dosis baja y ajustar hasta obtener el funda efecto deseado) Noradrenalina IRC de 0.05 a 0.3 μg/kg/min (comenzar Hipotensión por vasodilatación procon dosis baja y ajustar hasta obtener el funda efecto deseado) Fenilefrina IRC de 0.5 a 3 μg/kg/min (comenzar con Hipotensión por vasodilatación prodosis baja y ajustar hasta obtener el efecto funda deseado) Vasopresina 0.5 a 0.8 U/kg Hipotensión por vasodilatación profunda tinua. Tienden a ser los fármacos de elección para animales con inestabilidad hemodinámica o cardiopatía orgánica. La disponibilidad de una bomba de jeringa facilita la administración de fármacos por infusión continua. Véanse las dosis en el cuadro 6-4. 5) Valorar el tono vasomotor y considerar elevar la RVS. En pacientes con vasodilatación masiva e hipotensión, como los que tienen anafilaxis, acidosis grave, septicemia y SRIS, puede ser apropiado administrar un vasopresor para elevar la RVS hasta un punto en el que la PA pueda sostener una perfusión razonable. Estos pacientes son resistentes a las otras medidas terapéuticas delineadas con anterioridad. Entre los vasopresores de uso común figuran adrenalina, noradrenalina y fenilefrina. Puede usarse vasopresina para tratar el choque por vasodilatación. Si la PA se sobrecompensa, la vasoconstricción resultante tiene el potencial de sacrificar el flujo sanguíneo a determinados órganos, de tal modo que este tratamiento requiere vigilancia intensiva. Véanse las dosis en el cuadro 6-4. Hipertensión La hipertensión es una complicación mucho menos frecuente que la hipotensión en perros y gatos anestesiados. En pacientes sanos pueden observarse valores de PAM > 120 mm Hg o de PAS > 160 mm Hg en respuesta a estimulación dolorosa con planos anestésicos más superficiales. Esto 234 Manual de anestesia y analgesia en. . Hipoxemia La hipoxemia es una complicación anestésica grave con consecuencias potencialmente letales si no se reconoce y trata con prontitud. Se define como un valor de PaO2 < 60 mm Hg o de SaO2/ SpO2 < 90%. En algunas situaciones, valores de PaO2 en el intervalo de 60 a 80 mm Hg y de SaO2/ SpO2 en el intervalo de 90 a 95% pueden hacer necesario considerar si reflejan una tendencia descendente de la oxigenación. En animales anestesiados, la hipoxemia puede no acompañarse de anomalías en otros parámetros de vigilancia, pero en sus etapas terminales tal vez se hagan evidentes bradicardia o bradiarritmias. En general, hay cuatro mecanismos principales de hipoxemia por considerar: 1) disminución de FiO2 por debajo de 0.21, 2) hipoventilación si el paciente respira aire ambiental (es decir, FiO2 = 0.21), 3) discordancia ventilación–perfusión (V/Q), y 4) cortocircuito (también llamado mezcla venosa; cociente V/Q = 0). La respuesta del paciente a la administración de oxígeno complementario puede variar según sea el mecanismo que interviene (de los cuatro posibles). FiO2 inadecuada e hipoventilación se corrigen con facilidad al administrar oxígeno. La discordancia V/Q presenta una respuesta variable, mientras que el verdadero cortocircuito muestra respuesta mínima. En el cuadro 6-5 se enumeran algunas causas de hipoxemia en perros y gatos anestesiados y se las clasifica conforme a tales mecanismos, sin perder de vista que en muchos casos en un escenario clínico particular puede intervenir más de uno. En pacientes sanos anestesiados las causas más comunes de hipoxemia son funcionamiento defectuoso de la máquina de anestesia o el sistema de respiración, hipoventilación (si el animal respira aire ambiental), cierre inadvertido de la válvula de disparo, intubación endobronquial, aspiración del contenido gástrico, y uso inapropiado de óxido nitroso. Éstos son, en mayor medida, susceptibles de prevención. Nunca se insistirá demasiado en la importancia de comprender el funcionamiento del sistema de respiración y la máquina de anestesia. Es esencial confirmar el funcionamiento correcto antes de iniciar una operación y vigilar de manera continua el funcionamiento del sistema durante ésta. Es común la hipoventilación en animales anestesiados que inspiran aire ambiental y puede prevenirse al vigilar la ventilación y proporcionar oxígeno complementario. La aplicación de los principios de manejo prudente de las vías respiratorias © Editorial El manual moderno Fotocopiar sin autorización es un delito. debe tratarse con la administración de más anestésicos, analgésicos o ambos. En general, el uso de protocolos anestésicos equilibrados reduce la incidencia de esta complicación. La hipertensión sistémica puede ser una característica de ciertas afecciones, como hipercorticalismo, hipertiroidismo, nefropatía o feocromocitoma. Estos animales pueden tener la PA elevada antes de la anestesia o, de manera alternativa, ser normotensos a la presentación pero experimentar episodios hipertensivos agudos durante la anestesia. En situaciones en las que se ha iniciado bloqueo a-adrenérgico (casi siempre con fenoxibenzamina) antes de la anestesia, algunas veces es útil el bloqueo b-adrenérgico con un fármaco como esmolol para tratar taquiarritmias e hipertensión aguda durante la anestesia. Los pacientes con hipertensión crónica también pueden desarrollar hipotensión durante la anestesia, en especial con anestésicos inhalables, y requerir apoyo de la PA. En estos sujetos, la hipotensión puede afectar la perfusión tisular aun en mayor grado, ya que los mecanismos autorreguladores normales ya no funcionan a bajas presiones. En consecuencia, tal vez sea prudente mantener la PAM en el intervalo de 80 a 100 mm Hg de ser posible. Vigilancia del paciente 235 Cuadro 6-5. Causas de hipoxemia en perros y gatos anestesiados Causa Mecanismo Comentario Suministro de concentraciones excesi- FiO2 inadecuada vas de óxido nitroso Se recomienda una FiO2 mínima de 0.3 (es decir, suministro de óxido nitroso al 70%) para pacientes con funcionamiento pulmonar normal; no debe usarse óxido nitroso en pacientes con disfunción pulmonar preexistente FR o VC (o ambos) inadecuados en Hipoventilación pacientes que inspiran aire ambiental La anestesia inyectable cuando no se administra oxígeno complementario (es decir, FiO2 = 0.21) se relaciona con mayor riesgo de hipoxemia; la anestesia con fármacos inhalables cuando el paciente se desconecta de manera inadvertida de la máquina de anestesia puede ocasionar hipoxemia hipercápnica si no se detecta Apnea sostenida en pacientes con vías Discrepancia V/Q Decremento de V/Q; el inicio de la hirespiratorias permeables que reciben poxemia se demora si continúa el suoxígeno al 100% ministro de oxígeno a una FiO2 alta Intubación endobronquial Discrepancia V/Q Decremento de V/Q por intubación inadvertida de un bronquio Trastornos del espacio pleural (derra- Discrepancia V/Q Decremento de V/Q me pleural, neumotórax) y neumopatía (neumonía, edema pulmonar, neoplasia) © Editorial El manual moderno Fotocopiar sin autorización es un delito. Embolia pulmonar Discrepancia V/Q Aumento de V/Q (espacio muerto) Obstrucción de vías respiratorias (ta- Hipoventilación, La hipercapnia puede contribuir en papones mucosos, aspiración de conte- discrepancia V/Q cientes con obstrucción de vías respiratorias que inspiran aire ambiental; el nido gástrico, acodamiento de sonda y cortocircuito decremento de V/Q es un mecanismo endotraqueal, defectos anatómicos) importante; V/Q = 0 es posible en caso de obstrucción completa Válvula de disparo cerrada o sistema Cortocircuito de respiración obstruido Decremento de V/Q por aumento de las presiones en las vías respiratorias y apnea; de manera simultánea ocurren decrementos progresivos en el retorno venoso, y se produce colapso cardiovascular si no se los reconoce atenúa el riesgo de intubación endobronquial y aspiración del contenido gástrico. Por último, es necesaria la vigilancia expectante de los flujos de gas nuevo en todos los pacientes, pero en especial en aquellos en los que el protocolo anestésico incluye óxido nitroso. En pacientes con enfermedad del espacio pleural, enfermedad del parénquima pulmonar, tromboembolia pulmonar o cortocircuitos de derecha a izquierda, la hipoxemia es común incluso si están intubados e inspiran oxígeno al 100%. Si la causa subyacente puede tratarse, entonces la 236 Manual de anestesia y analgesia en. . 1) Asegurar una FiO2 adecuada en pacientes conectados a máquinas de anestesia. Confirmar el suministro de oxígeno (es decir, verificar la fuente) y asegurarse de que el flujómetro registra un gasto. Si se utiliza óxido nitroso, suspenderlo y proporcionar oxígeno al 100%. 2) Suministrar oxígeno complementario a pacientes que inspiran aire ambiental, para contrarrestar el efecto de la hipoventilación. En pacientes no intubados, el suministro de oxígeno por mascarilla facial puede contrarrestar la hipoxemia debida a hipoventilación; sin embargo, en la mayoría de las situaciones se recomienda la intubación endotraqueal. Los pacientes ya intubados pero que no reciben oxígeno deben conectarse a un sistema de respiración y una máquina de anestesia. Debe valorarse la ventilación mediante capnometría o análisis de gases en sangre arterial. 3) Determinar la permeabilidad de las vías respiratorias y reintubar en caso necesario. Si el paciente no está intubado, colocar una sonda endotraqueal y ofrecer oxígeno complementario, como antes. Si el paciente ya está intubado, valorar la permeabilidad de la sonda por observación directa y suministrar ventilación a presión positiva (VPP) con bolsa Ambu o máquina de anestesia y sistema de respiración. Si hay cualquier duda acerca de la permeabilidad de la sonda, retirar ésta y reintubar con una nueva. Administrar oxígeno complementario y determinar la ventilación con capnometría o análisis de gases en sangre. 4) Confirmar la colocación correcta de la sonda endotraqueal en pacientes intubados. Considerar la posibilidad de intubación esofágica y reintubar si es necesario. Considerar la posibilidad de intubación endobronquial y, en caso de cualquier duda, desinsuflar el manguito y con cuidado hacer retroceder la sonda hasta que la punta pueda palparse en el estrecho torácico. Si la sonda tiene una longitud excesiva, se la extrae y se inserta otra de la dimensión apropiada. Suministrar oxígeno complementario y cuantificar la ventilación con capnometría o análisis de gases en sangre arterial. 5) Asegurar el funcionamiento correcto del sistema de respiración en pacientes conectados a una máquina de anestesia. Asegurarse de que la válvula de disparo esté completamente abierta y de que las presiones en las vías respiratorias no sean elevadas. Asegurarse de que el paciente no se haya desconectado de la máquina. Verificar que el sistema de respiración no esté obstruido. 6) Valorar el espacio pleural y realizar toracocentesis, si está indicado. Los pacientes con neumotórax significativo o derrame pleural se benefician de la toracocentesis para mejorar la concordancia V/Q. En algunos pacientes debe colocarse una sonda de toracostomía para facilitar el drenaje torácico repetido. 7) Instituir VPP. En pacientes en quienes la causa de la discordancia V/Q no puede dilucidarse o corregirse con facilidad, la VPP puede mejorar la concordancia V/Q. 8) Evaluar el funcionamiento cardiovascular y considerar el soporte inotrópico para mejorar el riego sanguíneo pulmonar. En sujetos en los que la causa de la discordancia V/Q no puede discernirse o corregirse con facilidad y el funcionamiento cardiovascular es dudoso, la administración de dobutamina o dopamina puede mejorar la concordancia V/Q. © Editorial El manual moderno Fotocopiar sin autorización es un delito. oxigenación debe mejorar. En animales en los que el factor subyacente no puede corregirse de inmediato, pueden estar indicadas medidas ventilatorias avanzadas, apoyo circulatorio y vigilancia intensiva. Tales técnicas de atención rebasan los alcances de este capítulo. Cuando surge hipoxemia durante la anestesia, los siguientes pasos delinean un abordaje terapéutico razonable. El orden en que estos pasos se ejecutan es variable, según sea la situación clínica. Vigilancia del paciente 237 © Editorial El manual moderno Fotocopiar sin autorización es un delito. 9) Determinar la concentración de hemoglobina y considerar administrar productos hemáticos si está indicado. Aunque la anemia por sí misma no provoca hipoxemia, puede reducir en grado significativo la CaO2 y afectar el DO2. Si no hay un trastorno concurrente del intercambio gaseoso, PaO2 o SaO2/SpO2 permanecen dentro de los límites normales en esta situación. Hipoventilación e hipercapnia La hipercapnia por hipoventilación es una de las complicaciones anestésicas más comunes en perros y gatos. Pese a que todavía es tema de controversia la definición de lo que constituye hipercapnia significativa en pacientes por lo demás normales, el umbral referido con más frecuencia es una PaCO2 > 60 mm Hg. Esto corresponde a un valor de CO2CF cercano a 55 mm Hg, tras asumir un gradiente PaCO2–CO2CF normal. Aunque la hipercapnia leve es bien tolerada en la mayoría de los pacientes que reciben oxígeno complementario, los que tienen afectación intracraneal pueden experimentar un aumento peligroso del flujo sanguíneo cerebral y la presión intracraneal. Por ello, en la actualidad se recomienda que la PaCO2 se mantenga entre 30 y 32 mm Hg en estos sujetos. Recuérdese que en animales que respiran aire ambiental, hipoventilación/hipercapnia también pueden provocar hipoxemia. Dado que los incrementos patológicos de la producción de CO2 (como en la hipertermia maligna) son en extremo raros, la hipercapnia durante anestesia se debe a: 1) hipoventilación, 2) recirculación de CO2 que se exhaló antes o, menos a menudo 3) captación de CO2 del peritoneo o la cavidad torácica presurizados durante laparoscopia o toracoscopia. La hipoventilación es muy común porque todos los anestésicos deprimen en alguna medida el impulso ventilatorio. Opioides, anestésicos inyectables (como propofol y tiopental) y anestésicos inhalables (como isoflurano y sevoflurano) en particular causan potente hipoventilación dependiente de la dosis. Estos efectos se exacerban a menudo en animales obesos o braquicefálicos. Posiciones o instrumentación que elevan la presión diafragmática (como la posición de Trendelenburg o la colocación de retractores grandes en la parte craneal del abdomen) también pueden tener efectos adversos. Puede ocurrir recirculación de CO2 con el resultado de hipercapnia en animales con VA normal si existe un problema con el sistema de respiración. Algunas posibles causas son absorbedor de CO2 agotado o válvulas unidireccionales incompetentes en sistemas circulares, o bien gastos de gas nuevo insuficientes en sistemas de Mapleson. Estos problemas se identifican con facilidad mediante capnografía, como ya se expuso. Si bien es común usar CO2CF como sustituto de PaCO2, es importante recordar que un valor normal de CO2CF no siempre corresponde a una PaCO2 normal. Ya se consideraron las posibles causas de elevación del gradiente PaCO2–CO2CF. En situaciones en que no se dispone de capnometría, las valoraciones de la ventilación sólo pueden basarse en FR e impresiones cualitativas de VC, que a menudo son engañosas. Es importante reconocer que los valores adecuados de SpO2 (>95%) en pacientes que inspiran oxígeno al 100% de ningún modo descartan la posibilidad de hipoventilación/hipercapnia. Cuando se observa hipercapnia en pacientes anestesiados con base en valores de PaCO2 o CO2CF, el siguiente constituye un abordaje razonable para el manejo: 1) Determinar si el paciente inspira CO2 y, en tal caso, localizar el problema en el sistema de respiración. Valorar la onda capnográfica y revisar si el monitor registra CO2 inspirado. Si es así y el paciente está conectado a un sistema circular, hacer lo siguiente: a) analizar la inte- 238 Manual de anestesia y analgesia en. . Hiperventilación e hipocapnia Debido a los efectos depresores de los anestésicos sobre el centro respiratorio, la hiperventilación durante la anestesia es mucho menos común que la hipoventilación. Debe hacerse notar que la FR aumenta a menudo en pacientes con planos más superficiales de anestesia pero, debido a que la VC es superficial, muchas veces estos animales hipoventilan. En virtud de la mayor ventilación de espacio muerto, CO2CF no refleja de manera exacta la PaCO2 en esta situación y en realidad puede ser normal o estar disminuida. La causa más común de hipocapnia en perros y gatos anestesiados es hiperventilación yatrógena por VPP demasiado enérgica. Entre los efectos secundarios de la hipocapnia se incluyen alcalemia y reducciones del flujo sanguíneo cerebral. En consecuencia, se recomienda vigilar la ventilación mediante PaCO2 o CO2CF y hacer ajustes apropiados a los parámetros del ventilador para mantener el CO2 dentro de un intervalo apropiado. Hipotermia La hipotermia es un efecto secundario frecuente de la anestesia en perros y gatos. Entre los factores que contribuyen a la hipotermia se incluyen talla pequeña del paciente (es decir, mayor cociente área superficial/masa), duración prolongada de la anestesia, vasodilatación inducida por anestésico, cavidades corporales abiertas (p. ej., laparotomía o toracotomía), uso de soluciones de preparación quirúrgica frías, y administración de líquidos IV fríos. Además de calentar las soluciones IV de preparación quirúrgica y los líquidos IV, los pacientes anestesiados para intervenciones que durarán más de 20 a 30 min se benefician de alguna forma de calentamiento activo. Entre las opciones más eficaces y seguras figuran las siguientes: 1) frazadas con agua caliente circulante, 2) calentadores de aire forzado (como el sistema BairHugger® System, Arizant Healthcare Inc., Eden Prairie, MN) y 3) calentadores textiles conductores (como el HotDog® Patient Warming System, Augustine Temperature Management, Eden Prairie, MN). © Editorial El manual moderno Fotocopiar sin autorización es un delito. gridad y el funcionamiento de las válvulas unidireccionales y hacer los ajustes necesarios, b) cuantificar la actividad del absorbedor de CO2 y reemplazarlo en caso necesario, o 3) ambas cosas. Si la sustancia absorbente está agotada, los aumentos de CO2 inspirado suelen ser menos pronunciados y a menudo se compensan al incrementar el gasto de gas nuevo si no es factible cambiar el absorbedor o pasar a otra máquina de anestesia a la mitad de la operación. Si se detecta CO2 inspirado y el paciente está conectado a un sistema de Mapleson, se valora el gasto de gas nuevo y se eleva para asegurar una eliminación adecuada de CO2. 2) Valorar la profundidad de la anestesia y considerar reducirla. Menos anestésico inhalable tiene como resultado menos depresión del centro respiratorio del tallo encefálico y puede mejorar la ventilación. No se recomienda revertir los opioides administrados como una medida para contrarrestar la hipoventilación durante la anestesia, excepto en casos de sobredosis. 3) Administrar VPP. Pese a que la apnea constituye una indicación absoluta para VPP, esta medida también se recomienda en cualquier paciente que hipoventila, al margen de la FR. Los animales que reciben opioides complementarios durante la anestesia, en especial infusiones continuas a ritmo moderado a alto, suelen requerir VPP. Se realizan ajustes a los parámetros del ventilador (FR, VC y presión inspiratoria máxima) con base en la PaCO2 o, en pacientes en que se asumen gradientes PaCO2–CO2CF normales, en CO2CF. Vigilancia del paciente 239 En particular, esta última opción es en extremo eficaz para mantener la normotermia incluso en animales pequeños anestesiados por periodos prolongados. Es importante vigilar la temperatura del sujeto mientras se usa cualquiera de estas modalidades de calentamiento, para asegurar que no sufra hipertermia. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Hipertermia La hipertermia durante anestesia, en ausencia de calentamiento activo, es poco común. Si bien se ha informado un síndrome parecido a la hipertermia maligna en perros y gatos, la base genética de tal síndrome no se ha establecido y el trastorno es aún en extremo raro. La hipertermia yatrógena es posible si no se vigila la temperatura y los dispositivos de calentamiento no se ajustan de conformidad durante la intervención. Puede observarse hipertermia posanestésica en gatos, y al parecer se relaciona con la administración de fármacos como opioides (en particular hidromorfona y morfina) y tal vez ketamina. Este fenómeno parece ser transitorio, ocurre entre 1 y 5 h después de extubación traqueal y puede presentarse en gatos con hipotermia significativa durante la anestesia. No son raras temperaturas mayores de 40°C, y se ha informado hipertermia extrema (>42°C). Estos datos subrayan la importancia de vigilar la temperatura en el periodo posanestésico para reconocer a estos pacientes y proporcionarles enfriamiento activo si está indicado. Si la temperatura es de 40°C o mayor, debe considerarse reducir la temperatura ambiental, colocar un ventilador para hacer circular el aire, enfriar las almohadillas plantares con agua o alcohol, administrar líquidos IV a la temperatura ambiental, o administrar acepromazina a pacientes agitados. Revisado a partir de “Monitoring Anesthetized Patients” por Steve C. Haskins en Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 7 Equilibrio ácido–base y fluidoterapia William W. Muir , Helio S.A. de Morais y David C. Seeler Introducción Regulación del equilibrio ácido–base Los animales producen grandes cantidades de ácido cada día en sus procesos metabólicos, las cuales deben excretarse o metabolizarse para mantener el equilibrio ácido–base. A pesar de esta producción sustancial, la concentración de iones hidrógeno en los líquidos corporales se mantiene en un valor extremadamente bajo (40 nEq/L). Dado que el ion hidrógeno se encuentra en estas concentraciones minúsculas, variaciones incluso pequeñas tienen efectos significativos. Por ejemplo, un cambio en la concentración de iones hidrógeno de 35 a 45 nEq/L se vincula con un cambio de pH de sólo 0.1 unidades, pero esto representa un incremento de 22% en su concentración. La importancia del ion hidrógeno en el mantenimiento de la homeostasis no depende de su concentración en un compartimiento hídrico dado, sino de su efecto en la ionización. Esto reviste importancia crítica dentro del espacio intracelular. Casi sin excepción, todas las moléculas pequeñas Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 240 © Editorial El manual moderno Fotocopiar sin autorización es un delito. La homeostasis requiere el mantenimiento de un volumen de líquido relativamente constante y una composición estable de todos los compartimientos de líquido. La práctica de la anestesia, incluso en pacientes de la categoría I de la American Society of Anesthesiologists (ASA) sometidos a intervenciones comunes, puede precipitar trastornos en este equilibrio. En sujetos en estado crítico, todos los compartimientos de líquido (compartimientos hídricos) pueden estar muy afectados y es posible que existan trastornos graves potencialmente letales del equilibrio ácido–base. Estos trastornos se exacerban por la administración de anestésicos si no se diagnostican con exactitud los problemas subyacentes, se cuantifican los desequilibrios hídricos y ácido–base y se instituyen las medidas de control apropiadas. La interacción entre equilibrio ácido–base y fluidoterapia es compleja y la administración irreflexiva de líquidos parenterales durante el periodo perianestésico puede tener un efecto perjudicial en el estado ácido–base. En este capítulo se presentan los fundamentos del equilibrio ácido–base y la fluidoterapia, así como los lineamientos clínicos para diagnosticar trastornos ácido–base y proporcionar fluidoterapia perianestésica apropiada a caninos y felinos. Equilibrio ácido–base y fluidoterapia 241 intermediarias del metabolismo se encuentran ionizadas al pH fisiológico. Esto tiene como resultado la captura iónica, que minimiza la pérdida por difusión y es crucial para el mantenimiento de la homeostasis celular. Además, la ionización de aminoácidos (en especial histidina) en moléculas de proteína (en particular enzimas) determina la forma tridimensional de las moléculas y modifica sus características de unión y su funcionamiento general. Terminología ácido–base Ion hidrógeno (H+). Un protón libre aislado que se libera de un átomo de hidrógeno; nótese que en realidad no existen protones “desnudos” en solución, ya que reaccionan con moléculas de agua circundantes; sin embargo, esta notación simbólica se emplea aún por conveniencia. Ácido (HA). Molécula que contiene átomos de hidrógeno, los cuales pueden liberar H+. Base (A–) Ion o molécula que acepta H+. pH Escala logarítmica usada por convención para expresar concentración de H+ ([H+]) en soluciones; el pH se relaciona con [H+] (expresada en equivalentes por litro) como sigue: pH = log(1/[H+]) = –log[H+] Por ejemplo, la [H+] normal es 40 nEq/L; por lo tanto: © Editorial El manual moderno Fotocopiar sin autorización es un delito. pH normal = –log[0.00000004] = 7.4 Ácido fuerte. Ácido que se disocia con rapidez y libera grandes cantidades de H+ en solución; un ejemplo es el ácido clorhídrico (HCl à H+ + Cl–). Ácido débil. Ácido que se disocia de manera incompleta y libera cantidades limitadas de H+ en solución; un ejemplo es el ácido carbónico (H2CO3 à H+ + HCO3–). Base fuerte. Base que reacciona de manera rápida con H+, que extrae de la solución; un ejemplo es el hidróxido (OH– + H+ à H2O). Base débil Base que se une débilmente con H+ en solución; un ejemplo es el bicarbonato (HCO3– + H+ à H2CO3). Constante de disociación de un ácido (Ka). Constante de equilibrio para reacciones de disociación que proporciona una medida cuantitativa de la fuerza de un ácido en solución. pKa. Escala logarítmica utilizada por convención para expresar valores de Ka, donde pKa = –log Ka; en general, los ácidos débiles tienen valores de pKa grandes, mientras que los ácidos fuertes tienen valores reducidos de pKa. Ecuación de Henderson–Hasselbalch. Ecuación derivada a partir de Ka, que describe la cantidad de H+ disponible para reaccionar con bases: pH = pKa + log{[A–]/[HA]} Ácido respiratorio o volátil. Ácido que se excreta de los pulmones; se refiere de manera específica a dióxido de carbono (CO2). Sin embargo, el CO2 no es técnicamente un ácido (según la definición de Brønsted) porque carece de H+ y no puede ser un donador de protones, por lo cual se piensa que el CO2 puede crear una cantidad equivalente de ácido carbónico (H2CO3). Ácido metabólico o fijo. Todos los ácidos producidos por el organismo que no se excretan de los pulmones (es decir, cualquier ácido que no sea CO2/H2CO3), y que a menudo se nombran como sus aniones (p. ej., lactato, fosfato, sulfato, acetoacetato o b-hidroxibutirato) en vez 242 Manual de anestesia y analgesia en. . de denominarse como ácidos (es decir, ácido láctico, ácido fosfórico, ácido sulfúrico, ácido acetoacético y ácido b-hidroxibutírico, respectivamente), lo cual puede ser una fuente de confusión. Acidosis. Proceso o estado anormales que reducirían el pH de la sangre arterial si no fuera por cambios secundarios en respuesta al factor etiológico primario. Alcalosis. Proceso o estado anormales que elevarían el pH de la sangre arterial si no fuera por cambios secundarios en respuesta al factor etiológico primario. Acidemia pH sanguíneo bajo; es el resultado de la acidosis. Alcalemia pH sanguíneo alto; es el efecto de la alcalosis. Aparatos y sistemas encargados de mantener la concentración de iones hidrógeno La regulación de [H+] en los líquidos corporales para prevenir acidemia o alcalemia implica tres mecanismos primarios: 1) los sistemas amortiguadores químicos ácido–base presentes en los líquidos corporales, 2) el centro respiratorio y 3) los riñones. El sistema amortiguador químico reacciona a cambios en [H+] en una fracción de segundo y tiene gran capacidad de unirse a H+ hasta que otros sistemas pueden reaccionar y restablecer de manera definitiva el equilibrio ácido–base. La segunda línea de defensa es el aparato respiratorio, que actúa en minutos para eliminar el ácido volátil (es decir, CO2) del organismo mediante hiperventilación. La tercera línea de defensa son los riñones, encargados en última instancia de la excreción de ácidos fijos y de iniciar cambios compensatorios en la concentración plasmática de HCO3– en presencia de trastornos ácido–base respiratorios. H+ + A– ↔ HA El H+ libre se combina con la base aniónica (A–) para formar un ácido débil (HA), el cual puede permanecer en este estado o disociarse de vuelta a A– y H+, dependiendo de [H+]. Un amortiguador particular es más eficaz cuando el pH local tiene una diferencia no mayor de una unidad de pH respecto de su pKa (cuadro 7-1). Los sistemas amortiguadores químicos se encuentran en todo el organismo en diversos líquidos y tejidos, como se muestra en el cuadro 7-1. Los tres amortiguadores químicos más importantes son bicarbonato, fosfato, y sistemas amortiguadores proteínicos. Sistema amortiguador de bicarbonato. El sistema de bicarbonato se encarga de casi 80% de la amortiguación del líquido extracelular (LEC) y contribuye con 10 a 15% de la capacidad de amortiguación química total. El sistema consiste en una solución acuosa de H2CO3 (un ácido débil) y su base conjugada, HCO3– (por lo regular como sal sódica NaHCO3). El sistema completo puede representarse como sigue: CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3– + Na+ ↔ NaHCO3 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Amortiguación química para regular el equilibrio ácido–base Un amortiguador se define como cualquier sustancia capaz de unirse de modo reversible a H+, y una solución amortiguadora consiste en un ácido débil y su base conjugada. Una reacción de amortiguación genérica se representa como sigue: Equilibrio ácido–base y fluidoterapia 243 Cuadro 7-1. Lugar Principales sistemas amortiguadores del organismo % del ACT pH local Amortiguador pKa del amortiguador Comentario Sistemas amortiguadores extracelulares Líquido 25 intersticial Plasma 8 7.4 7.4 Bicarbonato 6.1 Importante para ácidos metabólicos/fijos Proteínas intersticiales 6.4 a 7.9a No es importante; concentración demasiado baja Fosfato 6.8 No es importante; concentración demasiado baja Bicarbonato 6.1 Importante para ácidos metabólicos/fijos Proteínas plasmáticas: Orina <1 5.5 a 7.0 Albúmina 6.4 a 7.9a Amortiguador menor Globulinas 6.4 a 7.9a No es importante Fosfato 6.8 No es importante; concentración demasiado baja Fosfato 6.8 Encargada de la mayor parte de la “acidez titulable” Amoniaco 9.2 Amortiguador importante debido a la formación de amonio Oxihemoglobina 6.7 Importante para ácidos respiratorios/volátiles Desoxihemoglobina 7.9 Todas las demás 6.4 a 7.9a Amortiguadores importantes Fosfato 6.8 Sistemas amortiguadores intracelulares © Editorial El manual moderno Fotocopiar sin autorización es un delito. LIC 67 7.0 a 7.4 Proteínas intracelulares: Amortiguador importante ACT, agua corporal total. a El anillo imidazol de la histidina tiene pK de 6.4 a 7.0, mientras que el grupo a-amino posee pK de 7.4 a 7.9. a a La formación de H2CO3 a partir de CO2 y H2O se cataliza por acción de la enzima anhidrasa carbónica, que abunda en las células del epitelio alveolar y tubular renal y en los eritrocitos. A continuación, el H2CO3 se ioniza débilmente para formar cantidades muy pequeñas de H+ y HCO3–. El segundo componente del sistema, NaHCO3, se ioniza casi por completo y forma grandes cantidades de HCO3– y Na+. Con base en el valor de pKa muy bajo de 6.1 y las concentraciones limitadas de los dos componentes principales del sistema (H2CO3 y HCO3–), es razonable suponer que el sistema del bicarbonato carece de capacidad amortiguadora significativa. Sin embargo, dado que el sistema es “abierto en ambos extremos” (es decir, pCO2 y [HCO3–] pueden ajustarse por mecanismos 244 Manual de anestesia y analgesia en. . respiratorios y renales, respectivamente), la eficacia del sistema amortiguador de bicarbonato aumenta en gran medida. Sistema amortiguador proteínico. Las proteínas son los amortiguadores que más abundan en los líquidos corporales. Pese a que las proteínas plasmáticas, en particular la albúmina, hacen una contribución discreta a la amortiguación del LEC, es sin duda el aporte de las proteínas intracelulares el más importante. Alrededor de 60 a 70% de la capacidad amortiguadora química total del organismo se encuentra en el LIC y la mayor parte se atribuye a proteínas. Ello se debe a la concentración alta de proteínas en las células y al hecho de que la mayor parte de los amortiguadores proteínicos tiene valores de pKa muy cercanos a los del LIC. El grupo disociable de proteína más importante es el anillo imidazol de la histidina (pKa, 6.4 a 7.0), mientras que los grupos a-amino (pKa, 7.4 a 7.9) también ejercen una función secundaria relevante. La hemoglobina es un amortiguador proteínico intracelular clave. Dado que se encuentra confinada a los eritrocitos, a menudo se clasifica como un amortiguador sanguíneo junto con las proteínas plasmáticas. La hemoglobina representa más de 80% de la capacidad de amortiguación por sistemas distinta del bicarbonato en la sangre entera, mientras que la albúmina contribuye con la mayor parte del 20% restante. Esto se debe a que la hemoglobina se encuentra en una concentración cercana al doble y contiene unas tres veces el número de residuos histidina por molécula que tiene la albúmina. La desoxihemoglobina es un amortiguador más eficaz que la oxihemoglobina y esto explica alrededor de 30% del efecto Haldane (la mayor capacidad de la desoxihemoglobina para formar compuestos carbamino explica el otro 70%). Ello significa que la descarga de oxígeno en realidad mejora la capacidad amortiguadora justo en el sitio en que se produce H+ adicional por disociación de H2CO3 para facilitar el transporte de CO2 en la forma de HCO3–. Otros factores que influyen en la amortiguación intracelular. Si bien en la exposición previa se hizo referencia a LEC y LIC como dos compartimientos del todo distintos, es importante reconocer que los cambios de [H+] se comunican de manera eficaz entre ambos. La transferencia © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sistema amortiguador de fosfato. El sistema amortiguador de fosfato no es importante en el LEC, pero tiene una función importante en la amortiguación del líquido tubular renal y el líquido intracelular (LIC). Los principales componentes del sistema son H3PO4 (ácido fosfórico, un ácido triprótico débil) y sus bases conjugadas, H2PO4–, HPO42– y PO43– (fosfato diácido, fosfato ácido y fosfato, de manera respectiva, casi siempre en la forma de sales sódicas). A valores de pH fisiológicos, las dos especies prevalecientes son H2PO4– y HPO42–. Si bien el pKa del sistema amortiguador de fosfato es de 6.8, lo cual lo hace un posible amortiguador importante en el LEC, su concentración aquí es sólo una fracción de la concentración del amortiguador de bicarbonato, de tal modo que su aporte a la amortiguación del LEC es insignificante. En contraste, este sistema tiene una función central en la orina porque el fosfato se concentra en gran medida en los túbulos renales, y el líquido tubular tiene pH más bajo que el LEC, lo cual lo hace un compartimiento hídrico ideal para este amortiguador. El sistema de fosfato también es importante en el LIC por razones similares (es decir, se disponen de concentraciones elevadas y el pH del LIC es muy cercano a 6.8). Equilibrio ácido–base y fluidoterapia 245 de sustancias clave a través de las membranas celulares tiene un efecto significativo en la amortiguación y la facilitan tres procesos principales. Primero, debido a su gran liposolubilidad, el CO2 cruza las membranas celulares con facilidad al disolverse en el H2O para formar H2CO3–, que entonces se disocia en H+ y HCO3–. Debido a la ineficacia del sistema de bicarbonato para amortiguar el CO2 (es decir, ácido volátil) en el LEC, casi toda la amortiguación de la acidosis y la alcalosis respiratorias ocurre dentro de la célula. En segundo lugar, las membranas celulares contienen diversos cotransportadores protón–catión, que facilitan la entrada de H+ en las células en intercambio por otros cationes, como Na+ y K+, para mantener la electroneutralidad. Los sistemas de fosfato y proteínico amortiguan a continuación a los H+ suministrados. Más de la mitad de la amortiguación de la acidosis metabólica y alrededor de un tercio de la amortiguación de la alcalosis metabólica tienen lugar dentro de la célula. Por último, la presencia del cotransportador HCO3–/Cl– (o bomba de cloruro) facilita el movimiento del HCO3– producido por la disociación de H2CO3 fuera de la célula a cambio de Cl–. Esto se conoce como desplazamiento (o corrimiento) del cloruro. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Principio isohídrico. Los sistemas amortiguadores químicos no operan de modo independiente, sino de manera conjunta en equilibrio entre sí. Dado que sólo hay una [H+] en un compartimiento particular, cualquier factor que modifique el equilibrio de un sistema amortiguador afecta el equilibrio de todos los otros. Esto se conoce como principio isohídrico. En términos clínicos, significa que al medir las concentraciones de cualquier par ácido–base se obtiene una representación del equilibrio ácido–base general en el organismo. Por convención, se miden los componentes del sistema de bicarbonato (es decir, H2CO3 medido como pCO2 y HCO3–) porque son accesibles y fáciles de determinar. Los analizadores de gases en sangre miden pH y pCO2 de manera directa, y [HCO3–] se calcula por tanto mediante la ecuación de Henderson–Hasselbalch. Regulación respiratoria del equilibrio ácido–base En la segunda línea de defensa contra los trastornos ácido–base interviene el aparato respiratorio, que es capaz de excretar ácido volátil (CO2) y controlar [H+] al activar cambios en la ventilación. Los cambios ventilatorios suceden con rapidez y tienen profundos efectos en [H+]. Los cambios en la ventilación alveolar son inversamente proporcionales a los cambios en pCO2 arterial (PaCO2) y directamente proporcionales a la producción corporal total de CO2. Los cambios en PaCO2, a su vez, son inversamente proporcionales al pH, según la ecuación de Henderson–Hasselbalch. Por lo tanto, un decremento de la ventilación alveolar da lugar a un incremento de PaCO2 y un decremento de pH, mientras que un aumento de la ventilación alveolar genera una disminución de PaCO2 y un incremento de pH. No sólo la ventilación alveolar modifica el pH, sino que también ocurre lo contrario. Un decremento del pH estimula el impulso ventilatorio, en tanto que un aumento del pH lo inhibe. En consecuencia, el aparato respiratorio opera en un ciclo de retroinhibición (retroalimentación negativa) típico para mantener PaCO2 y por tanto [H+] dentro de un estrecho intervalo. Quimiorreceptores periféricos y centrales detectan cambios en PaCO2, el centro respiratorio del bulbo raquídeo integra esta información y los músculos de la respiración reaccionan en consecuencia. Este tipo de regulación ácido–base se conoce como amortiguación fisiológica porque es un sistema abierto, en contraste con la amortiguación química, que es un sistema cerrado. En general, la capacidad de amortiguación global del aparato respiratorio es una a dos veces mayor que el poder amortiguador de todos los amortiguadores químicos del LEC combinados. Regulación renal del equilibrio ácido–base Aunque los pulmones se encargan de la eliminación del ácido volátil (CO2), los riñones son el principal medio por el cual se eliminan del organismo ácidos metabólicos fijos. A pesar del hecho de que la cantidad de ácido fijo que se produce al día es mucho menor que la cantidad de CO2 generada, el sistema renal es crítico dado que no hay otro mecanismo para la excreción de esos ácidos. Desde un punto de vista cuantitativo, aún más importante que la excreción de ácidos fijos es la capacidad de los riñones de resorber bicarbonato, con lo cual conservan el principal sistema amortiguador del LEC. Los riñones logran estos dos objetivos mediante tres procesos fundamentales: 1) secreción activa de H+ en la luz tubular, 2) resorción indirecta del HCO3– filtrado hacia las células tubulares y al final hacia la sangre, y 3) producción de nuevo HCO3– en las células tubulares con la participación de los sistemas amortiguadores de fosfato y amoniaco. Los dos primeros mecanismos están interrelacionados porque el proceso de secreción activa de H+ en la luz de los túbulos renales tiene como resultado final la resorción de HCO3–. Los mecanismos celulares de la secreción de H+ dependen del sitio intrarrenal. En los túbulos proximales, el asa de Henle ascendente gruesa y el túbulo distal incipiente el H+ se secreta por transporte activo secundario. En las células intercalares, el H+ se libera por transporte activo primario. En ambos casos, el H+ secretado se combina con HCO3– filtrado y forma H2CO3, que se disocia en CO2 y H2O. El CO2 se difunde con facilidad en la célula tubular, donde se recombina con H2O bajo la influencia de la anhidrasa carbónica para generar una nueva molécula de H2CO3, que a su vez se disocia en HCO3– y H+. El HCO3– se desplaza a continuación a través de la membrana basolateral por cotransporte de Na+–HCO3– o intercambio de Cl––HCO3–. En circunstancias normales, cada vez que se forma un H+ en una célula tubular también se forma HCO3–, y al final se libera de regreso a la sangre. Por lo tanto, puede afirmarse que HCO3– y H+ “se ajustan” uno al otro en los túbulos. En la acidosis hay un exceso de H+ respecto del HCO3–, pero sólo una pequeña parte de él puede excretarse en la forma iónica, ya que el pH urinario tiene un límite inferior aproximado de 4.5. En consecuencia, la excreción urinaria de grandes cantidades de H+ se realiza al combinarse con amortiguadores fosfato y amoniaco en la luz tubular. Esta amortiguación tiene como resultado en realidad la formación de HCO3– “nuevo” (es decir, no filtrado antes), que en última instancia pasa a la sangre. El sistema de amoniaco es cuantitativamente más importante que el sistema de fosfato urinario. En las células tubulares proximales, la glutamina se metaboliza para formar amonio y HCO3–. El amonio se secreta en la luz tubular, mientras que el nuevo HCO3– se transporta de regreso a través de la membrana basolateral. En los túbulos colectores, el H+ se secreta en la luz tubular, como ya se describió, pero ahora se combina con amoniaco, que puede difundirse con facilidad a través de la membrana luminal. El resultado es amonio, que es mucho menos difusible y queda atrapado en la orina, con lo que constituye un medio para la excreción de H+. Por cada amonio que se excreta, se forma un nuevo HCO3– y se añade de vuelta a la sangre. En clínica es posible cuantificar la excreción renal neta de ácido al determinar la excreción de HCO3–, la cantidad de HCO3– nuevo agregado a la sangre (que se calcula al cuantificar la concentración urinaria de amonio) y el ácido titulable urinario. El término ácido titulable se refiere al resto del amortiguador distinto de HCO3– y amonio excretado en la orina (es decir, sobre todo fosfato). Puesto que la secreción de H+ en la luz tubular es un paso clave en todos los aspectos del equilibrio ácido–base renal, no es sorprendente que este proceso esté regulado de manera estrecha. Entre los factores clave que pueden incrementar o disminuir la secreción de H+ figuran cambios en lo siguiente: pCO2, [H+], volumen del LEC, concentración de angiotensina II, concentración de aldosterona y valores de potasio. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 246 Manual de anestesia y analgesia en. . © Editorial El manual moderno Fotocopiar sin autorización es un delito. Equilibrio ácido–base y fluidoterapia 247 Efectos de la temperatura en el equilibrio ácido–base Para la valoración del equilibrio ácido–base en un ambiente clínico casi siempre es necesario medir algunos componentes del LEC, tan sólo porque la sangre es un líquido de fácil acceso. Sin embargo, se ha sugerido que el ambiente intracelular es, en realidad, un compartimiento clave debido al fenómeno de atrapamiento iónico. Existen dos teorías antagónicas que tratan de explicar la regulación del pH intracelular mediante variaciones en temperatura: la hipótesis de ionización constante y la hipótesis de pH constante. Si bien no es posible aquí analizar a fondo estas teorías, se presenta una breve definición de cada una porque son importantes para la interpretación clínica de los valores de gases en sangre. La hipótesis de ionización constante establece que el grado de ionización de los grupos imidazol de las proteínas intracelulares permanece constante a pesar de los cambios de temperatura. En otras palabras, el pH intracelular ideal es el pH de la neutralidad (esto es, el estado en que [H+] = [OH–]), y este pH varía con los cambios de temperatura. Si la teoría de ionización constante es correcta, entonces los valores de gases en sangre no deben corregirse para la temperatura del paciente. La teoría de pH constante señala que el pH intracelular debe mantenerse constante a pesar de los cambios de temperatura. Si la teoría de pH constante es correcta, entonces para la interpretación deben usarse valores de gases en sangre corregidos para la temperatura. Debe indicarse que los analizadores de gases en sangre se programan a 37°C y todas las mediciones se realizan a esta temperatura. Cuando se indican otras temperaturas del paciente, la computadora de la máquina utiliza diversas fórmulas de corrección a fin de calcular los llamados valores corregidos. Pese a que todavía se utilizan ambos métodos en la práctica clínica, la realidad es que, cuando sobrevienen variaciones significativas en la temperatura del paciente, no se comprende del todo la complejidad de sus efectos en el metabolismo celular, funcionamiento vascular y respiración. Por consiguiente, mientras no se disponga de pruebas definitivas, tanto los valores de gases en sangre corregidos como los no corregidos son de utilidad cuestionable en pacientes con temperatura muy distinta de 37°C. Método regular para el análisis ácido–base Un método para el análisis ácido–base clínico debe identificar de manera exacta la presencia de un trastorno, cuantificar su magnitud y ofrecer indicios sobre la naturaleza y causa subyacentes. La fisiología y el análisis ácido–base tienen una larga historia, con más de 100 años de investigación y nuevas adiciones a la bibliografía cada día. Los métodos nuevos tienden a desarrollarse a partir de los previos o son modificaciones de ellos, de tal modo que no es sorprendente que la evolución de la teoría ácido–base haya causado considerable confusión a estudiantes y profesionales por igual. El primer método que surgió se conoce ahora como método tradicional o basado en bicarbonato. Se debe al trabajo de Henderson y Hasselbalch a principios del año de 1900 y se concentra en pCO2 y HCO3– como componentes clave. Este método formuló en buena medida la terminología ácido–base que aún se encuentra en los libros de texto y aún se emplea en muchas situaciones clínicas. En consecuencia, aquí se incluye una breve exposición del método tradicional y la terminología relacionada. 248 Manual de anestesia y analgesia en. . Causas de los trastornos ácido–base en perros y gatos clasificadas por el método Acidosis metabólica • Diarrea • Acidosis tubular renal • Acidosis por dilución (administración rápida de NaCl al 0.9%) • Inhibidores de la anhidrasa carbónica • Administración de cloruro de amonio • Administración de aminoácidos catiónicos • Hipocorticalismo • Acidosis láctica • Acidosis urémica • Cetoacidosis diabética • Hiperfosfatemia • Intoxicación – etilenglicol – salicilatos – metaldehído Alcalosis metabólica • Vómito • Aspiración gástrica • Diuréticos tiazídicos o de asa • Alcalosis poshipercápnica • Hiperaldosteronismo primario • Hipercorticalismo • Administración oral de NaHCO3 • Administración oral de otros aniones orgánicos • Síndrome de realimentación • Altas dosis de antibióticos derivados de penicilina • Deficiencia grave de potasio o magnesio Alcalosis respiratoria • Hipoxia – Por ejemplo, hipotensión grave, anemia graAcidosis respiratoria ve, insuficiencia cardiaca congestiva • Obstrucción de vías respiratorias • Enfermedad del parénquima pulmonar – Por ejemplo, aspiración, masa, colapso tra– Por ejemplo, neumonía, tromboembolia pulqueal monar • Depresión respiratoria central • Hiperventilación de mediación central – Por ejemplo, enfermedad neurológica indu– Por ejemplo, hepatopatía, hipercorticalismo cida por fármaco • Síndrome de respuesta inflamatoria sistémica • Enfermedad neuromuscular • Ejercicio, excitación, dolor, ansiedad – Por ejemplo, miastenia grave, tétanos • Ventilación mecánica demasiado drástica • Mayor producción de CO2 con deterioro de la ventilación – Por ejemplo, golpe de calor, hipertermia maligna, paro cardiaco • Trastornos extrapulmonares restrictivos – Por ejemplo, hernia diafragmática, enfermedad del espacio pleural • Neumopatía intrínseca – Por ejemplo, neumonía, tromboembolia pulmonar • Ventilación mecánica ineficaz • Obesidad grave (síndrome de Pickwick) Trastornos ácido–base simples Un trastorno ácido–base simple es aquel en el cual existe una sola causa primaria. Según el enfoque tradicional, hay cuatro trastornos ácido–base simples que deben considerarse: 1) acidosis respiratoria, 2) acidosis metabólica, 3) alcalosis respiratoria y 4) alcalosis metabólica. Los trastornos respiratorios se deben a procesos anormales que alteran los valores de pCO2, mientras que los trastornos metabólicos son efecto de procesos anormales que alteran [HCO3–]. En el cuadro 7-2 se presenta una lista de causas comunes de los cuatro trastornos ácido–base primarios en perros y gatos, clasificadas con base en este enfoque. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 7-2. tradicional Equilibrio ácido–base y fluidoterapia 249 Los cambios ácido–base secundarios o compensatorios surgen casi siempre en respuesta a la mayoría de los trastornos ácido–base primarios, en un esfuerzo por restablecer una [H+] normal. En los trastornos ácido–base simples, estas respuestas compensatorias son predecibles y se realiza un análisis por pasos conforme a la figura 7-1. En las anomalías metabólicas primarias, la compensación respiratoria implica hiperventilación o hipoventilación. En la mayor parte de los casos, la respuesta respiratoria ocurre con rapidez y se completa en horas, tras asumir que el trastorno metabólico permanece estable. En las anomalías respiratorias primarias, la respuesta compensatoria es bifásica. En el caso agudo, la respuesta metabólica se limita a la amortiguación química, que tiene un efecto muy discreto en [HCO3–]. En el caso de trastornos respiratorios más crónicos, los riñones reaccionan y son capaces de excretar o resorber HCO3– según sea apropiado. Esta respuesta renal es de inicio lento y tarda dos a cinco días en alcanzar su máximo potencial. El grado de compensación esperado para trastornos ácido–base varía entre las especies. En pacientes caninos en clínica suelen usarse los lineamientos basados en perros de laboratorio sanos que se presentan en el cuadro 7-3. Se dispone de datos limitados para valorar las respuestas compensatorias en gatos, pero pruebas experimentales basadas en una pequeña cantidad de animales sugieren que los gatos no inician al parecer una respuesta ventilatoria a la acidosis metabólica. En consecuencia, la extrapolación de valores caninos a pacientes felinos puede ser engañosa y no es posible recomendarla. Muestra de sangre arterial pH © Editorial El manual moderno Fotocopiar sin autorización es un delito. ↓ 7.4 ↑ 7.4 Alcalosis Acidosis ↓ HCO3– Trastorno primario Respuesta compensatoria Metabólica Hiperventilación ↓ PCO2 ↑ PCO2 Respiratoria Amortiguación química (AGUDA) Regulación renal (CRÓNICA) ↑ HCO3– ↑ HCO3– Metabólica Hipoventilación ↑ PCO2 ↓ PCO2 Respiratoria Amortiguación química (AGUDA) Regulación renal (CRÓNICA) ↓ HCO3– Figura 7-1. Análisis de los trastornos ácido–base simples según el método tradicional. 250 Manual de anestesia y analgesia en. . Cuadro 7-3. Cambios compensatorios esperados en respuesta a los trastornos ácido–base primarios en perros según el método tradicional Compensación esperada Acidosis metabólica Alcalosis metabólica Acidosis respiratoria (aguda) Acidosis respiratoria (crónica) ↓PaCO2 de 0.7 mm Hg por 1 mEq/L ↓HCO3– ↑PaCO2 de 0.7 mm Hg por 1 mEq/L ↑HCO3– ↑HCO3– de 0.15 mEq/L por 1 mm Hg ↑PaCO2 ↑HCO3– de 0.35 mEq/L por 1 mm Hg ↑PaCO2 Alcalosis respiratoria (aguda) Alcalosis respiratoria (crónica) ↓HCO3– de 0.25 mEq/L por 1 mm Hg ↓PaCO2 ↓HCO3– de 0.55 mEq/L por 1 mm Hg ↓PaCO2 Trastornos ácido–base mixtos Existe un trastorno ácido–base mixto cuando hay dos o más alteraciones primarias al mismo tiempo. Los trastornos mixtos pueden ser aditivos (p. ej., acidosis respiratoria y metabólica) o compensatorios (p. ej., alcalosis respiratoria y acidosis metabólica) con respecto a sus efectos en el pH. Un trastorno triple es un ejemplo de trastorno ácido–base complejo en el que una alteración respiratoria complica aún más la acidosis metabólica y la alcalosis metabólica concurrentes. En el enfoque tradicional para distinguir un trastorno ácido–base mixto de uno simple y su respuesta compensatoria se determina la magnitud de la compensación, como se expuso antes y se muestra en el cuadro 7-3. Si la respuesta compensatoria no se encuentra dentro del intervalo esperado para el trastorno primario, entonces se diagnostica un trastorno mixto. Debe tenerse cautela al valorar la propiedad de la compensación metabólica a un trastorno respiratorio primario, ya que depende de la cronicidad del trastorno respiratorio, que puede ser difícil de dilucidar en clínica. En general, debe sospecharse la posibilidad de un trastorno ácido–base mixto si se observa uno o más de los siguientes signos: 1) presencia de un pH normal con PCO2 o [HCO3–] (o ambos) anormales, 2) cambio de pH en un sentido opuesto al predicho para el trastorno primario conocido, y 3) pCO2 y [HCO3–] que cambian en sentidos opuestos. Los trastornos ácido–base mixtos son más difíciles de descifrar que los simples y el diagnóstico debe establecerse en el contexto de los signos clínicos del paciente y otra información diagnóstica. En la mayoría de los casos, las implicaciones clínicas de las alteraciones ácido–base dependen de las causas subyacentes, que deben convertirse en el objetivo del tratamiento. Limitaciones del método tradicional Si bien parece lógico y de naturaleza relativamente simple, el método tradicional basado en bicarbonato es todavía en esencia descriptivo. A mediados de la década de 1960, un grupo de investigadores expandió este concepto en un intento de cuantificar y predecir mejor la naturaleza de diversos trastornos ácido–base. Este enfoque, en el que se usan mapas o nomogramas ácido– base, llegó a conocerse como el método de Boston, y dichos nomogramas aún se encuentran en muchos textos. Por desgracia, el método de Boston/tradicional tiene notorias limitaciones. No toma en cuenta la influencia de sistemas amortiguadores distintos del de bicarbonato (p. ej., los basados en proteínas plasmáticas y fosfato) ni el efecto de los electrolitos séricos (en especial Na+, K+ y Cl–). Además, de manera incorrecta presupone que tanto pCO2 como HCO3– son variables independientes, cuando en realidad sólo pCO2 lo es. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Trastorno primario Equilibrio ácido–base y fluidoterapia 251 Por lo anterior, el método tradicional no proporciona indicios sobre los trastornos ácido–base mixtos complejos y puede en realidad ser engañoso en determinadas circunstancias. En particular, la acidosis metabólica plantea importantes problemas para el método tradicional. Se ha informado que esta alteración es el trastorno ácido–base más común en perros y gatos y acompaña a afecciones tan diversas como septicemia, traumatismo, insuficiencia renal y urgencias endocrinas. En estas situaciones, el método tradicional no es de utilidad. Aunque tiene todavía una función en el análisis ácido–base clínico, su uso debe reservarse para pacientes con trastornos ácido–base simples y concentraciones séricas normales de albúmina y fosfato. Métodos alternativos para el análisis ácido–base Una creciente observación de la frecuencia y complejidad de los trastornos ácido–base clínicos significa que se buscaban mejores métodos para la valoración clínica. Algunos puntos culminantes en la evolución de la teoría ácido–base son el método de exceso de base, el método de la brecha aniónica y el método de iones fuertes y sus diversas modificaciones. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Método del exceso de base para el análisis ácido–base El método del exceso de base (también llamado método de Copenhague) lo describió SigaardAndersen a finales de la década de 1950 como un intento de distinguir mejor las contribuciones relativas de los componentes respiratorio y metabólico, al tiempo que se permanecía fiel a los conceptos tradicionales. El déficit o exceso de base (DEB) se definió como la cantidad de ácido por unidad de volumen que debe agregarse para lograr un pH normal a una PaCO2 de 40 mm Hg usando sangre entera. Este método se modificó en la década de 1960 para usar sólo exceso de base en suero y el parámetro se llamó exceso de base estandarizado (EBE). Como el grupo de Boston, el grupo de Copenhague generó datos basados en grandes cantidades de personas, lo que llevó al desarrollo de nomogramas EBE para facilitar la valoración ácido–base clínica. La mayoría de los analizadores de gases en sangre automatizados modernos registra un valor EBE que se calcula a partir de esta base de datos humana. Si bien se ha desarrollado un nomograma EBE canino con base en este enfoque, rara vez se utiliza porque los analizadores de gases en sangre comerciales están programados de manera específica para sangre humana. En un sentido más amplio, este enfoque también se ha enfrentado a críticas porque el parámetro EBE representa el efecto neto de todos los trastornos ácido–base metabólicos. En caso de coexistencia de acidosis y alcalosis metabólicas, por ejemplo, el EBE por sí solo podría no identificar ninguna anomalía ácido–base, ya que al parecer estos dos trastornos podrían anularse entre sí. Método de la brecha aniónica para el análisis ácido–base El método de la brecha aniónica lo desarrollaron en 1975 Emmit y colaboradores y se ha demostrado que es una herramienta útil en el análisis de determinados trastornos ácido–base mixtos. 252 Manual de anestesia y analgesia en. . La brecha aniónica (BA) se calcula en clínica como la diferencia entre los principales cationes y aniones que suelen medirse en el plasma, como sigue: BA = ([Na+] + [K+]) – ([Cl–] + [HCO3–]) En realidad, dado que debe mantenerse la electroneutralidad, no existe una diferencia real entre el número total de cationes y aniones en el plasma, de tal modo que en realidad lo que BA representa es la diferencia entre cationes y aniones no cuantificados. Como en clínica no ocurren cambios en los cationes no medidos que tengan la magnitud necesaria para incidir en la BA, éste es en esencia un instrumento empleado para calcular la concentración de aniones no medidos. En circunstancias normales, las proteínas plasmáticas constituyen la mayor parte de los aniones no medidos representados por la BA, y los valores normales de BA son de 12 a 24 mEq/L en perros y 13 a 27 mEq/L en gatos. En la acidosis metabólica, el cálculo de la BA puede ser útil para identificar la causa subyacente, dado que diferentes estados patológicos alteran la BA de modo distinto. En el caso de la acidosis orgánica, ácidos fijos como el ácido láctico o los cetoácidos se agregan al plasma, donde se disocian con rapidez en sus aniones (que no se miden como parte de un perfil bioquímico típico) y H+ (que es amortiguado por HCO3–). El efecto neto es un decremento de los aniones medidos (es decir, HCO3–) sin cambio en Cl–, lo que ocasiona un incremento de BA. Por lo tanto, estos tipos de acidosis se clasifican como acidosis metabólica con aumento de BA o normoclorémica. En contraste, la pérdida de HCO3– que puede acompañar a la pérdida de líquido gastrointestinal o acidosis tubular renal se relaciona con retención de Cl–, de tal manera que la BA no cambia. En consecuencia, estos tipos de acidosis se clasifican como acidosis metabólica con BA normal o hiperclorémica. En el cuadro 7-4 se presentan las causas de acidosis metabólica clasificada por el método de la BA. Causas de la acidosis metabólica en perros y gatos clasificadas por el método de BA Acidosis metabólica BA normal (hipercloremia) • Diarrea • Acidosis tubular renal • Acidosis por dilución (administración rápida de NaCl al 0.9%) • Inhibidores de la anhidrasa carbónica • Administración de cloruro de amonio • Administración de aminoácidos catiónicos • Hipocorticalismo Aumento de la BA (normocloremia) • Acidosis láctica • Acidosis urémica • Cetoacidosis diabética • Hiperfosfatemia • Intoxicación – Etilenglicol – Salicilatos – Metaldehído © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 7-4. Equilibrio ácido–base y fluidoterapia 253 Un factor importante que hace confusa la interpretación de la BA es la hipoalbuminemia. Dado que la albúmina es el principal anión no medido en el estado normal, la presencia de hipoalbuminemia reduce la BA y oscurece la presencia de aniones, que de otro modo la incrementarían. En otras palabras, un paciente con acidosis láctica e hipoalbuminemia simultáneas puede tener una BA calculada normal y esto sería confuso en clínica. En perros, la BA puede ajustarse para tomar en cuenta cambios en la concentración de proteína mediante la siguiente fórmula: BAaj alb = BA + 4.2(3.77 – [albúmina medida en g/dL]) Aunque su efecto no es tan sustancial como el de la albúmina, el fosfato también puede influir en la BA. En perros, la BA puede ajustarse para considerar tanto albúmina como fosfato mediante la fórmula: BAaj alb fos = BA + 4.2(3.77 – [albúmina medida en g/dL]) + (2.52 – 0.58 [fósforo medido en mg/dL]) Pese a que la BA es una herramienta útil en determinadas situaciones, aún es limitada en su capacidad de dilucidar trastornos ácido–base mixtos complejos. Se han hecho intentos de optimizar su utilidad en personas y han llevado al concepto de coeficiente D o brecha D. Con ambos parámetros se intenta relacionar el cambio en BA con el cambio en [HCO3–], cada uno a partir de sus respectivos valores de referencia. Ni el coeficiente D ni la brecha D se han estudiado en perros o gatos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Método de iones fuertes para el análisis ácido–base En 1983, Stewart publicó su modelo hoy aceptado de forma amplia para la fisiología ácido–base, al que se conoce con diversos nombres, entre ellos método de Stewart, método cuantitativo, método fisicoquímico y método de iones fuertes. Según Stewart, hay tres determinantes independientes del equilibrio ácido–base: 1) pCO2, 2) diferencia entre cationes fuertes y aniones fuertes (diferencia de iones fuertes o DIF), y 3) concentración total de ácidos débiles (ATOT). Como en el método tradicional, la variable pCO2 es el principal determinante del componente respiratorio del pH plasmático. Las variables DIF y ATOT constituyen medidas independientes del componente metabólico del pH plasmático. Por lo tanto, de acuerdo con el método de iones fuertes, hay cuatro posibles trastornos ácido–base metabólicos primarios en vez de sólo los dos del método tradicional. La acidosis metabólica se debe a un decremento de DIF o un aumento de ATOT, mientras que la alcalosis metabólica es efecto de un aumento de DIF o un decremento de ATOT. En el cuadro 7-5 se presentan los trastornos ácido–base metabólicos comunes clasificados según el método de iones fuertes. Diferencia de iones fuertes Los iones fuertes (también llamados iones no amortiguadores) se definen como cualquier ion que se disocia por completo al pH fisiológico, y entre ellos se incluyen Na+, K+, Ca2+, Mg2+ y Cl–, así como iones no medidos, como lactato, b-hidroxibutirato, acetoacetato y sulfato. Diferencia 254 Manual de anestesia y analgesia en. . Causas de los trastornos ácido–base metabólicos clasificadas por el método de io- Acidosis por DIF (↓ DIF) Acidosis por dilución (↓ Na+) • Con hipervolemia – Hepatopatía grave – Insuficiencia cardiaca congestiva – Síndrome nefrótico • Con normovolemia – Polidipsia psicógena – Infusión de líquido hipotónico • Con hipovolemia – Vómito – Diarrea – Hipocorticalismo – Pérdida en tercer espacio – Administración de diurético Acidosis hiperclorémica (↑ Cl–corr) • Pérdida de Na+ respecto de Cl– – Diarrea • Ganancia de Cl– respecto de Na+ – Fluidoterapia (NaCl al 0.9%, NaCl al 7.2%, líquidos con KCl) • Retención de Cl– – Insuficiencia renal – Hipocorticalismo Acidosis orgánica (↑ iones fuertes no medidos) • Acidosis urémica, cetoacidosis o acidosis láctica • Intoxicación – Etilenglicol – Salicilato Alcalosis por DIF (↑ DIF) Alcalosis por concentración (↑ Na+) • Pérdida de agua pura – Privación de agua – Diabetes insípida • Pérdida hídrica hipotónica – Vómito – Insuficiencia renal no oligúrica – Diuresis posobstructiva Alcalosis hipoclorémica (↓ Cl–corr) • Ganancia de Na+ respecto de Cl– – Isotónica o hipertónica Administración de NaHCO3– • Pérdida de Cl– respecto de Na+ – Vómito – Diuréticos tiazídicos o de asa Acidosis por ATOT (↑ ATOT) Hiperalbuminemia • Privación de agua Hiperfosfatemia • Transposición – Lisis de células tumorales – Traumatismo/rabdomiólisis tisulares • Aumento del consumo – Enemas con fosfato – Fosfato intravenoso • Disminución de la pérdida – Insuficiencia renal – Obstrucción uretral – Uroabdomen Alcalosis por ATOT (↓ ATOT) Hipoalbuminemia • Decremento de la producción – Hepatopatía crónica – Respuesta de fase aguda a la inflamación – Desnutrición/inanición • Pérdida extracorporal – Nefropatía con pérdida de proteína – Enteropatía con pérdida de proteína • Secuestro – Derrames inflamatorios – Vasculitis © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 7-5. nes fuertes Equilibrio ácido–base y fluidoterapia 255 de iones fuertes (DIF) es un término que se emplea para describir la diferencia entre la suma de cationes fuertes y la suma de aniones fuertes. Por lo regular se representa como sigue (donde [A–] se refiere a todos los aniones fuertes no medidos): DIF = ([Na+] + [K+] + [Ca2+] + [Mg2+]) – ([Cl–] + [A–]) En condiciones fisiológicas normales, la DIF del plasma es de 40 a 44 mEq/L y esta diferencia se equilibra por la carga negativa en HCO3– y ATOT. En condiciones fisiológicas, se acumulan aniones fuertes adicionales y [A–] se hace importante en clínica, lo cual indica acidosis orgánica. La DIF puede calcularse al medir tantos iones fuertes como sea posible y sumar sus cargas. Esta definición original se conoce ahora como la DIF aparente (DIFapa), que se distingue de la DIF efectiva (que se expone más adelante). Dada la posibilidad de mensurar de manera sistemática las concentraciones de lactato en el ambiente clínico, algunos recomiendan la adición de [lactato] al cálculo de DIFapa como sigue: DIFapa = ([Na+] + [K+] + [Ca2+] + [Mg2+]) – ([Cl–] + [lactato]) En realidad, puesto que Na+ y Cl– son cuantitativamente los iones fuertes de mayor importancia, a menudo DIFapa se simplifica aún más en situaciones clínicas como sigue: © Editorial El manual moderno Fotocopiar sin autorización es un delito. DIFapa simpl = [Na+] - [Cl–] Concentración de ácidos débiles (ATOT) Stewart usó el término ATOT para reflejar la suma de todos los ácidos débiles en los estados disociado y no disociado (es decir, A– más HA) conforme a la ley de la conservación de la masa. Los principales contribuyentes a ATOT son albúmina, globulinas y fosfato inorgánico, y estos ácidos débiles también se denominan algunas veces iones amortiguadores. Los cambios en las concentraciones de cualquiera de ellos, ya sea de manera directa o a través de cambios en el contenido plasmático de agua libre, modifican el pH. Simplificaciones del método de iones fuertes El método de iones fuertes proporciona un marco mecánico sólido para explicar por qué cambia el pH plasmático en cualquier circunstancia e integra de manera exitosa la fisiología de electrolitos y ácido–base. Infortunadamente, las ecuaciones matemáticas de Stewart son complejas y por tanto resultan difíciles de aplicar al entorno clínico. En consecuencia, se han desarrollado varias modificaciones simplificadas para facilitar el uso clínico del método de iones fuertes de Stewart. Modificación de DIF efectiva Unos 10 años después de que Stewart publicó su teoría de los iones fuertes, Figge y colaboradores propusieron una modificación al método de Stewart, con la que se intentó cuantificar los efectos de aniones fuertes no medidos con un parámetro al que llamaron brecha iónica fuerte (BIF). El término DIF efectiva (DIFefe) se propuso para representar la contribución de ácidos débiles. Por consiguiente, los aniones fuertes no medidos (es decir, la BIF) puede determinarse al restar la 256 Manual de anestesia y analgesia en. . DIFefe (que se calcula mediante fórmulas en que intervienen los ácidos débiles HCO3–, albúmina y fosfato) de la DIFapa (que se calcula con la ecuación presentada antes). A pesar de su utilidad potencial en seres humanos, las fórmulas de Figge para calcular DIFefe son complejas y no se han valorado en perros y gatos, por lo que este método no es factible en la actualidad en medicina veterinaria. Sin embargo, otros especialistas han revisada el concepto general de la BIF y se describe más adelante. Modificación de exceso de base En 1993, Fencl y colaboradores publicaron una modificación adicional del método de Stewart, la cual revivió el concepto de EBE y la combinaron con los principios de la teoría de los iones fuertes. El llamado método de Fencl–Stewart utiliza un conjunto de ecuaciones para determinar la magnitud del efecto de cambios en DIF y ATOT sobre el valor de EBE informado por analizadores de gases en sangre. Se han propuesto ecuaciones para cuatro parámetros distintos que pueden calcularse con datos de mediciones comunes de laboratorio: 1) efecto de la albúmina o EBEAlb, 2) efecto del fosfato o EBEFos, 3) efecto del agua libre o EBEAL (basado en sodio), y 4) efecto del cloruro o EBECl. Dado que se dispone de analizadores de lactato, también puede calcularse un quinto parámetro, el efecto del lactato o EBELact. Un sexto efecto, el de los iones fuertes no medidos o EBEXA, puede calcularse entonces al restar la suma de los efectos EBE individuales al valor EBE informado o EBEinformado (cuadro 7-6). Algunos autores usan una terminología diferente y se refieren al EBEXA como la brecha de exceso de base (BEG). Los valores de EBEXA menores de –5 mEq/L sugieren un aumento de los aniones fuertes no medidos. Cuadro 7-6. Fórmulas para calcular las contribuciones de los parámetros clave según la modificación del exceso de base del método de iones fuertes Efecto de EBE (en mEq/L) Fórmulas 1) EBEAlb 3.7([Albref normal] – [Albmedida]) en g/dL 0.37([Albref normal] – [Albmedida]) en g/L]) 2) EBEFos 1.8([Fosref normal] – [Fosmedida]) en mmol/L 0.58([Fosref normal] – [Fosmedida]) en mg/dL Efectos relacionados con DIF: 3) EBEAL Perros 0.25([Na+medida] – [Na+ref normal]) en mEq/L Gatos 0.22([Na+medida] – [Na+ref normal]) en mEq/L 4) EBECl [Cl–ref normal] – [Cl–corr] en mEq/L, donde Cl–corr = [Cl–medida] × ([Na+ref normal]/[Na+medida]) 5) EBELact –1[Lactmedida] en mmol/L 6) EBEXA (también llamada BEB) EBEinformado – (EBEAlb + EBEFos + EBEAL + EBECl + EBELact) Véanse más definiciones en el texto. Albref normal, punto medio del intervalo de referencia de la albúmina; Albmedida, concentración de albúmina del paciente; Fosref normal, punto medio del intervalo de referencia del fósforo; Fosmedida, concentración de fósforo del paciente; Na+ref normal, punto medio del intervalo de referencia del sodio; Na+medida, concentración de sodio del paciente; Cl–ref normal, punto medio del intervalo de referencia del cloruro; Cl–corr, cloruro corregido; Cl–medida, concentración de cloruro del paciente; Lactmedida, concentración de lactato del paciente. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Efectos relacionados con ATOT: Equilibrio ácido–base y fluidoterapia 257 Cuadro 7-7. Resumen de las influencias ácido–base metabólicas identificadas por la modificación de exceso de base del método de iones fuertes Influencias acidificantes Hiperalbuminemia Hiperfosfatemia Exceso de agua libre (hiponatremia) Hipercloremia Hiperlactatemia Aumento de aniones fuertes no medidos Efecto individual del EBE ↓EBEAlb ↓EBEFos ↓EBEAL ↓EBECl ↓EBELact ↓EBEXA (<–5 mmol/L es clínicamente significativo) Influencias alcalinizantes Hipoalbuminemia Déficit de agua libre (hipernatremia) Hipocloremia Efecto individual del EBE ↑EBEAlb ↑EBEAL ↑EBECl © Editorial El manual moderno Fotocopiar sin autorización es un delito. Este método facilita la identificación de diversas influencias ácido–base metabólicas y permite establecer su contribución al EBE global (cuadro 7-7). Además, da al veterinario un cuadro más completo del estado ácido–base del paciente porque toma en cuenta más factores contribuyentes. Aunque en la actualidad no existen estudios controlados en los que se valore la exactitud de estas fórmulas en perros y gatos, sí hay informes empíricos que sugieren que este método es útil para comprender trastornos ácido–base complejos en estas especies. Modificación de BIF simplificada Como ya se indicó, la BIF representa la diferencia entre todos los cationes y aniones fuertes no medidos. Aunque la BIF es sin lugar a dudas un concepto útil, el cálculo de este parámetro con las fórmulas de Figge para DIFefe (ya expuestas) es todavía un desafío matemático y no es aplicable en clínica para perros y gatos. Por fortuna, se ha desarrollado una simplificación de la BIF (BIFsimpl) en la que se incorpora la BA y que es útil en estas especies. La BIFsimpl ofrece un método más exacto para identificar aniones fuertes no medidos en plasma que la BA porque ésta no es específica de iones fuertes. A diferencia de BIFsimpl, la BA no corregida también incluye los efectos de iones amortiguadores no volátiles como albúmina, globulinas y fosfato. Dado que la albúmina es el más importante de estos amortiguadores en plasma, se incluye en la fórmula para calcular la BIFsimpl. En perros con pH plasmático de 7.4, el cálculo es como sigue: BIFsimpl = [albúminamedida en g/dL] × 4.9 – BA En gatos con pH plasmático de 7.35, el cálculo es el siguiente: BIFsimpl = [albúminamedida en g/dL] × 7.4 – BA Se sospecha un aumento de aniones fuertes no medidos cuando la BIFsimpl es menor de –5 mEq/L. Sin embargo, en pacientes con hiperfosfatemia significativa, la BA debe corregirse para tomar en cuenta el fósforo (véase la sección sobre BA) antes de calcular la BIFsimpl. Si bien hasta el momento no se han publicado estudios controlados en perros y gatos en los que se valore 258 Manual de anestesia y analgesia en. . la BIFsimpl, este método es al parecer muy promisorio como instrumento clínico para el análisis ácido–base en esas especies. Regulación del equilibrio hídrico Terminología del equilibrio hídrico Agua corporal total (ACT). La suma del agua corporal comprende alrededor de 60% del peso corporal. Compartimiento del LIC. Suma del agua corporal contenida en las células; constituye cerca de 40% del peso corporal o un 67% del ACT. Compartimiento del LEC. Suma del agua corporal no contenida en las células; constituye casi 20% del peso corporal o un 33% del ACT. Compartimiento hídrico intersticial. Subcompartimiento del LEC que contiene agua corporal en los espacios que circundan a las células; comprende un 15% del peso corporal, 25% del ACT o 75% del LEC. Compartimiento hídrico intravascular (plasma). Subcompartimiento del LEC que contiene agua corporal dentro de los vasos sanguíneos; constituye alrededor de 5% del peso corporal, 8% del ACT o 25% del LEC. Volumen sanguíneo. Suma del volumen de agua plasmática y el volumen de los eritrocitos; comprende un 8 a 9% del peso corporal en perros (es decir, 80 a 90 mL/kg) y 6 a 7% del peso corporal en gatos (esto es, 60 a 70 mL/kg). Compartimiento hídrico transcelular. Subcompartimiento del LEC que contiene líquido cefalorraquídeo (LCR), líquido gastrointestinal, bilis, secreciones glandulares, secreciones respiratorias, líquido sinovial y líquido tubular renal; comprende alrededor de 1% del peso corporal. Electrolito. Sustancia que se disocia en solución para formar partículas con carga eléctrica, o iones; por lo regular se expresa en milimoles por litro o miliequivalentes por litro. Ósmosis. Proceso por el cual el agua se desplaza en favor de un gradiente de concentración a través de una membrana semipermeable. Presión osmótica. Presión requerida para impedir que el agua se desplace en favor de un gradiente de concentración a través de una membrana semipermeable. Osmol (Osm). Unidad de presión osmótica equivalente a 1 mol de cualquier sustancia no disociable. Osmolaridad. Número de osmoles por kilogramo de solvente; se expresa en miliosmoles por kilogramo. Osmolalidad. Número de osmoles por litro de solución; se expresa en miliosmoles por litro; en líquidos biológicos, la diferencia entre osmolalidad y osmolaridad es insignificante. © Editorial El manual moderno Fotocopiar sin autorización es un delito. La fluidoterapia es una medida complementaria de uso común en el tratamiento de trastornos de líquidos, electrolitos y ácido–base en medicina veterinaria. Como en otras modalidades de tratamiento sintomático, siempre es necesario identificar y corregir la causa subyacente para restablecer de manera definitiva el equilibrio hídrico normal. La capacidad de diseñar un plan de fluidoterapia apropiado para un paciente requiere al menos una comprensión básica de la fisiología aplicada de los líquidos corporales. Equilibrio ácido–base y fluidoterapia 259 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Osmol ineficaz. Osmol que es capaz de cruzar membranas de compartimientos hídricos y por tanto no genera presión osmótica; por ejemplo, urea. Osmol eficaz. Osmol que es incapaz de cruzar membranas de compartimientos hídricos y por tanto no genera presión osmótica; por ejemplo, glucosa. Tonicidad. Medida de la osmolalidad eficaz de una solución; la tonicidad de una solución puede ser menor que la osmolalidad medida si hay presentes osmoles eficaces e ineficaces. Presión coloidosmótica (PCO). Componente de la presión osmótica total en plasma aportado por coloides que se miden con un oncómetro; también se denomina presión oncótica. Distribución de líquidos y electrolitos Aunque es conveniente compartimentar los líquidos corporales como se delineó en las definiciones anteriores, en realidad el agua y los solutos en estos espacios están en equilibrio dinámico a ambos lados de las membranas celulares del endotelio capilar y de otras células de recubrimiento especializadas. Los electrolitos no se distribuyen de manera uniforme en los principales compartimientos porque la permeabilidad de las membranas varía para diferentes solutos. En el cuadro 7-8 se presentan las concentraciones aproximadas de algunos electrolitos en cada uno de los tres principales compartimientos hídricos. En estados patológicos, volúmenes hídricos y concentraciones de electrolitos pueden fluctuar en grado notable y los cambios en un compartimiento invariablemente influyen en los otros. La pérdida de líquido hipotónico (pérdida hipotónica) es la pérdida de más agua que soluto, lo cual causa el desplazamiento de agua desde el espacio intracelular hasta el espacio intersticial y al final hacia el espacio intravascular. Por lo tanto, la osmolalidad del LEC aumenta respecto de la del LIC. La pérdida de líquido hipotónico se caracteriza en clínica por signos de deshidratación como sequedad y adhesividad de membranas mucosas y menor turgencia cutánea. La pérdida de líquido hipertónico (pérdida hipertónica) es la pérdida de más soluto que de agua, lo cual provoca el desplazamiento de agua desde los espacios intravascular e intersticial hasta el interior de las células en favor de un gradiente osmótico. En clínica, esto se caracteriza por hipoperfusión e hipovolemia. La pérdida de líquido isotónico (pérdida isotónica) es la pérdida de agua y soluto en proporciones comparables, de tal modo que no ocurren desplazamientos osmóticos de agua entre el Cuadro 7-8. tes por litro) Ion + Na K+ Ca2+ Mg2+ Cl– HCO3– Fosfatos Sulfatos Proteína Distribución aproximada de electrolitos en compartimientos hídricos (miliequivalenPlasma Líquido intersticial LIC 142 5 5 2 106 24 2 1 16 145 4 3 2 115 30 2 1 1 13 155 2 35 2 10 113 20 60 260 Manual de anestesia y analgesia en. . LIC y el LEC. Los signos clínicos de esta pérdida, si es de magnitud suficiente, pueden ocasionar hipoperfusión e hipovolemia. Consideraciones para la fluidoterapia perianestésica El acto de inducir y mantener la anestesia, incluso en un animal sano, altera los mecanismos normales del equilibrio hídrico en alguna medida. En un paciente deshidratado o hipovolémico, esta alteración puede tener graves consecuencias durante la anestesia y después. La fluidoterapia se recomienda como una medida complementaria en perros y gatos anestesiados por las siguientes razones: 1) establecer y mantener un acceso venoso, 2) contrarrestar cambios fisiológicos relacionados con los anestésicos, 3) reponer la pérdida insensible de líquidos que ocurre durante la anestesia, y 4) corregir las pérdidas hídricas causadas por enfermedad preexistente o traumatismo y restituir las pérdidas continuas relacionadas con la intervención (a menudo quirúrgica). Hipovolemia Se desarrolla hipovolemia en una amplia gama de traumatismos y estados patológicos y puede deberse a 1) pérdida hídrica específica desde el espacio intravascular (p. ej., hemorragia), 2) pérdida hídrica desde múltiples compartimientos hídricos (p. ej., deshidratación), o 3) deficiencia hídrica relativa por decremento del tono vascular (p. ej., vasodilatación inducida por anestésicos en animales con equilibrio hídrico por lo demás normal). La consecuencia más grave de la hipovolemia es el decremento de la precarga cardiaca, cuyos efectos son el gasto cardiaco (GC), perfusión tisular inadecuada y trastorno del suministro de oxígeno. El término choque se usa para describir el deterioro global de la perfusión y oxigenación tisulares. Según sean la gravedad y la naturaleza del déficit hídrico, la hipovolemia puede tratarse de manera eficaz con cristaloides, coloides sintéticos, productos hemáticos o alguna combinación de ellos. En caso de hemorragia aguda, la pérdida hasta de 30% del volumen sanguíneo puede tratarse de manera típica con cristaloides, con o sin coloides, mientras que la pérdida de 50% del volumen sanguíneo probablemente exige la administración de componentes hemáticos, además de las opciones anteriores. Las medidas específicas para la reposición de líquidos en el paciente hipovolémico varían de acuerdo con la causa (p. ej., hemorrágica o no hemorrágica) y el marco temporal (p. ej., aguda o crónica). © Editorial El manual moderno Fotocopiar sin autorización es un delito. Estado del paciente Antes de inducir anestesia es deseable que el equilibrio hídrico del paciente sea normal o tan cercano al normal como sea posible. En animales sanos programados para intervenciones programadas esto no es un problema. Sin embargo, en situaciones de urgencia, puede haber uno o más trastornos hídricos relacionados o no con el problema de presentación original. Es imperativo reconocerlos, atenderlos e iniciar un plan de fluidoterapia apropiado. Algunos trastornos hídricos requieren intervención inmediata y drástica, en tanto que muchas alteraciones crónicas o prolongadas se corrigen mejor de manera más gradual. En la siguiente exposición se ponen de relieve algunas de las anomalías electrolíticas más comunes en perros y gatos. Equilibrio ácido–base y fluidoterapia 261 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anemia Puede ocurrir anemia en ausencia total de cambios en el volumen plasmático (p. ej., en caso de destrucción de eritrocitos) o acompañarse de hipovolemia (p. ej., en caso de hemorragia grave). En ambas circunstancias puede verse afectado el suministro adecuado de oxígeno a los tejidos. En el animal normovolémico con anemia crónica y funcionamiento cardiovascular normal se inician aumentos compensatorios en el GC y cambios en la afinidad de la hemoglobina por el oxígeno a fin de mantener el suministro de oxígeno. En animales anémicos con disfunción cardiovascular simultánea, esta capacidad de compensar está atenuada. La administración de anestésicos a un animal anémico por lo demás compensado también puede precipitar descompensación, ya que tanto los anestésicos inyectables como los inhalables deprimen el aparato circulatorio. En animales que sufren anemia e hipovolemia, lo que ocurre en caso de hemorragia grave, el efecto sobre el suministro de oxígeno en la situación aguda puede ser profundo. Aunque la mayoría de los textos recomienda “considerar” la administración de un producto hemático cuando el hematócrito desciende por debajo de 20 a 25% en perros y de 18 a 20% en gatos, no es posible identificar un valor “índice” individual de hemoglobina o hematócrito para ninguna especie. La decisión de iniciar la transfusión de eritrocitos sólo puede tomarse en casos particulares y debe considerar todos los factores fisiológicos relacionados con el paciente, así como cualesquiera factores de intervención, por ejemplo si se planea o no una operación mayor. Hipoproteinemia La hipoproteinemia (por lo regular hipoalbuminemia) tiene como resultado un decremento de la PCO, el cual favorece el desplazamiento de líquido del compartimiento intravascular al intersticial. La administración de cristaloides intravenosos eleva la presión hidrostática y, en presencia de PCO baja, aumenta el potencial de fuga capilar y desarrollo de edema tisular. Esto es en particular problemático en pacientes en estado crítico, ya que están predispuestos a la hipoalbuminemia y a una mayor permeabilidad capilar relacionadas con procesos inflamatorios. El manejo del equilibrio hídrico en estados hipoproteinémicos suele incluir pequeños volúmenes de cristaloides, coloides sintéticos y otros líquidos con albúmina, como plasma almacenado, plasma congelado reciente (PCR) y tal vez albúmina sérica humana. En animales en estado crítico, casi siempre se recomienda que las concentraciones séricas de albúmina se mantengan >1.5 a 2.0 g/dL (15 a 20 g/L). Hiponatremia La hiponatremia se define como una concentración sérica de sodio <140 mEq/L en perros y <149 mEq/L en gatos. Los signos clínicos pueden ser sutiles o estar ausentes en trastornos crónicos caracterizados por decrementos más lentos de sodio y osmolalidad plasmática. Por lo regular, concentraciones <125 mEq/L causan signos tempranos de intoxicación, mientras que concentraciones <120 mEq/L se vinculan con signos graves como convulsiones o edema cerebral. El tratamiento de la hiponatremia debe concentrarse en identificar y tratar la enfermedad subyacente y, sólo si es necesario, incrementar la concentración sérica de sodio y la osmolalidad plasmática. Cristaloides isotónicos, coloides sintéticos y en ocasiones solución salina hipertónica son opciones terapéuticas. Los incrementos rápidos de sodio pueden causar síndrome de mielini- 262 Manual de anestesia y analgesia en. . zación osmótica o mielinosis, uno a varios días después del tratamiento. En pacientes sin déficits neurológicos, la concentración sérica de sodio no debe aumentar más de 0.5 mEq/L/h (nótese que esto se refiere a la concentración de sodio informada por el laboratorio en el paciente, no al ritmo de su reposición). En pacientes con signos de edema cerebral, las concentraciones séricas de sodio pueden corregirse con mayor rapidez (a razón de 1 a 2 mEq/L/h) hasta que los síntomas neurológicos se resuelvan, y luego vuelven a reducirse a 0.5 mEq/L/h. En la mayoría de los casos, la concentración sérica de sodio objetivo es de 120 a 125 mEq/L. Hipopotasemia La hipopotasemia en perros y gatos se define como una concentración sérica de potasio <3.6 mEq/L y se documenta más a menudo en gatos. Entre los signos clínicos de hipopotasemia se incluyen debilidad muscular, arritmias cardiacas, hipotensión e insuficiencia renal con acidosis metabólica. Es importante reconocer que los antiarrítmicos de la clase I (p. ej., lidocaína, procainamida) son ineficaces en pacientes hipopotasémicos. En general se recomienda que el ritmo máximo de administración de complementos de potasio (por lo regular en la forma de cloruro de potasio) sea de 0.5 mEq/kg/h, aunque pueden usarse ritmos más altos (hasta 1 mEq/kg/h) si el déficit es grave y el paciente puede vigilarse. Debe hacerse notar que a fin de alcanzar estos ritmos de administración, las soluciones infundidas tienen grandes concentraciones de potasio y por tanto elevada osmolalidad. En consecuencia, puede estar indicado administrarlas a través de un acceso central. Hiperpotasemia La hiperpotasemia se define como una concentración sérica de potasio >5.5 mEq/L en el perro y >5.0 mEq/L en el gato. Entre los signos clínicos se incluyen debilidad muscular y arritmias cardiacas; los efectos más graves se relacionan con afección del aparato urinario. Los animales con hiperpotasemia moderada (6 a 7 mEq/L) tienen mayor probabilidad de sufrir arritmias durante la anestesia aunque no hayan presentado anomalías electrocardiográficas con anterioridad. Entre las posibles medidas terapéuticas para la hiperpotasemia figuran infusión de cristaloides en casos de colapso circulatorio; administración de cloruro de calcio o gluconato de calcio para restablecer temporalmente el gradiente entre potenciales de membrana en reposo y umbrales y estabilizar © Editorial El manual moderno Fotocopiar sin autorización es un delito. Hipernatremia La hipernatremia se define como una concentración sérica de sodio >155 mEq/L en perros y >162 mEq/L en gatos. Los aumentos de las concentraciones de sodio >170 mEq/L causan signos tempranos de intoxicación, mientras que concentraciones >180 mEq/L se relacionan con déficits neurológicos graves. El tratamiento de la hipernatremia debe concentrarse en la corrección del problema subyacente y otros trastornos del equilibrio hídrico. Los cristaloides isotónicos e hipotónicos son opciones terapéuticas. La corrección rápida puede causar edema cerebral agudo, que algunas veces se manifiesta como convulsiones o coma. En general, cuando el sodio sérico es >165 a 170 mEq/L, la corrección debe proceder con lentitud y la concentración sérica de sodio no debe disminuir más de 0.5 mEq/L/h, según sean la causa primaria y el equilibrio hídrico en ese momento. Equilibrio ácido–base y fluidoterapia 263 la actividad eléctrica cardiaca; dextrosa con insulina regular para facilitar el desplazamiento de potasio al interior de las células al tiempo que se evita la hiperglucemia; y bicarbonato de sodio para tratar la acidemia. Hipocalcemia La hipocalcemia se define como una concentración sérica total de calcio <2.0 mmol/L (8 mg/dL), tanto en perros como en gatos. Cuando sea posible también debe medirse el calcio ionizado; los valores normales suelen ser de 50% del calcio sérico total. Entre los signos clínicos de hipocalcemia están tetania, convulsiones, hipertermia y arritmias cardiacas. Los trastornos eléctricos cardiacos pueden manifestarse en la forma de un intervalo QT prolongado, arritmias ventriculares o ambas cosas. El tratamiento incluye complementos de gluconato de calcio en infusión lenta por 10 a 30 min mientras se vigila el ECG, seguida por infusión de mantenimiento si es necesario en pacientes en estado crítico. La fluidoterapia con un cristaloide está indicada para restablecer el equilibrio hídrico y contrarrestar la hipertermia. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Hipercalcemia La hipercalcemia se define como una concentración sérica de calcio en ayuno >3.0 mmol/L (12 g/dL), tanto en perros como en gatos. Más a menudo se relaciona con lesiones neoplásicas, ingestión de toxinas o hiperparatiroidismo. Entre los signos clínicos se incluyen debilidad muscular, convulsiones y, con menos frecuencia, arritmias cardiacas. Algunos posibles trastornos del ritmo son bradicardia, intervalo PR prolongado, complejos QRS amplios y acortamiento del intervalo QT. El tratamiento de la hipercalcemia depende de la causa subyacente y, si está indicada, se realiza resección de neoplasia o paratiroidectomía. Cuando es posible, se recomienda reducir el calcio sérico antes de la anestesia y la operación. Las formas de lograrlo incluyen el uso de cristaloides, agentes fijadores de fósforo, furosemida, prednisona, calcitonina de salmón y bicarbonato de sodio. Hipoglucemia La hipoglucemia se define como una concentración sanguínea de glucosa (glucemia) <65 mg/dL (3.5 mmol/L) en perros y gatos. Los signos clínicos varían, según sea que la glucemia disminuya de manera rápida o lenta. Las declinaciones rápidas se acompañan de dilatación pupilar, taquicardia, temblores, vocalización y apetito intenso. Las declinaciones más lentas pueden provocar hipotermia, deterioro visual, debilidad, ataxia, depresión, somnolencia, convulsiones y bradicardia. Es claro que el paciente anestesiado no presenta estos signos y, a menos que se vigile la glucemia, la hipoglucemia puede pasar inadvertida. La hipoglucemia se reconoce con más frecuencia en recién nacidos, pacientes con insulinomas o sujetos con cortocircuitos portosistémicos. El tratamiento de la hipoglucemia depende de la situación clínica, pero incluye casi siempre jarabe de maíz Karo® (ACH Food Companies Inc., Cordova, TN) al 50% aplicado a las encías, bolos intravenosos de dextrosa, o infusiones de dextrosa al 2.5 a 5%. Hiperglucemia Es común documentar hiperglucemia moderada en perros y gatos estresados o diabéticos. En casos de cetoacidosis diabética, las concentraciones de glucosa suelen ser >300 mg/dL (17 mmol/L), 264 Manual de anestesia y analgesia en. . mientras que en el síndrome hiperosmolar hiperglucémico las concentraciones por lo regular son >600 mg/dL (33 mmol/L) con osmolalidad sérica eficaz >320 a 330 mOsm/L. Las medidas terapéuticas para estas afecciones potencialmente letales son complejas y requieren vigilancia intensiva por un lapso prolongado. Los tratamientos incluyen cristaloides con complementos de electrolitos, bicarbonato de sodio, insulina y dextrosa. Acidosis o alcalosis metabólicas Los trastornos ácido–base metabólicos deben tratarse con la corrección de la causa subyacente cuando sea posible y la estabilización del equilibrio hídrico con un cristaloide (una solución acidificante o alcalinizante, según sea apropiado), junto con otros tipos de líquidos si está indicado. Estados patológicos preexistentes El equilibrio hídrico puede alterarse casi en cada estado patológico caracterizado por disfunción de aparatos o sistemas o endocrina, y los planes de fluidoterapia varían demasiado de acuerdo con el trastorno subyacente. Enfermedad cardiovascular. El equilibrio hídrico es absolutamente crítico en pacientes con disfunción cardiaca, ya que el corazón en insuficiencia es incapaz de manejar los déficits o excesos de líquido. El objetivo del plan de fluidoterapia es optimizar el equilibrio hídrico y el funcionamiento cardiovascular, y debe tomar en cuenta lo siguiente: 1) el tipo de cardiopatía (p. ej., disfunción sistólica o diastólica), 2) la gravedad de la disfunción (p. ej., enfermedad compensada o descompensada), 3) la presencia simultánea de otros defectos que modifican el equilibrio hídrico (como hipovolemia, anemia, deshidratación, trastornos electrolíticos, etc.), y 4) la naturaleza de cualquier intervención planeada (p. ej. operación mayor). Nefropatía. Dado que los riñones tienen una función clave en el mantenimiento de la homeostasis hídrica y ácido–base, en el paciente con nefropatía crónica o aguda invariablemente se afecta el © Editorial El manual moderno Fotocopiar sin autorización es un delito. Deshidratación La deshidratación es la pérdida neta de líquido del organismo. Según sea la causa subyacente, el líquido perdido puede ser hipotónico, isotónico o hopertónico. Por lo tanto, la deshidratación puede afectar los compartimientos intravascular, intersticial e intracelular en grados variables. La magnitud de la deshidratación se calcula a menudo en clínica con base en antecedentes y exploración física y se clasifica en términos de porcentaje (casi siempre <5%, 5 a 6%, 6 a 8%, 8 a 10%, 10 a 12% y >12%). Los pacientes en que se calcula una deshidratación >12% se consideran en choque. El volumen requerido (en litros) para corregir la deshidratación puede establecerse al multiplicar este porcentaje (expresado como un decimal) por el peso corporal del paciente (en kilogramos). El plan de fluidoterapia para tratar la deshidratación depende de la magnitud del déficit, el marco temporal y otros factores diversos específicos de la situación clínica. Los cristaloides son la piedra angular del tratamiento en la mayor parte de los casos, junto con complementos electrolíticos, según esté indicado. Equilibrio ácido–base y fluidoterapia 265 equilibrio hídrico. La orina constituye la principal pérdida hídrica sensible en el estado normal, y los cambios en la producción de orina (aumento o disminución) son indicios de insuficiencia renal. El objetivo de la fluidoterapia en estos pacientes es restablecer el equilibrio hídrico si es posible y prevenir mayor daño renal, que puede tener como resultado hipoperfusión. Trastornos hemostásicos. Entre los trastornos de la hemostasis comunes en perros y gatos figuran trombocitopenia hemolítica inmunitaria, coagulación intravascular diseminada, enfermedad de von Willebrand, intoxicación por raticida e insuficiencia hepática. En todos estos casos es necesario corregir el equilibrio hídrico y tratar los trastornos electrolíticos y ácido–base. Puede estar indicada la vitamina K en casos de hepatopatía crónica o intoxicación por raticida, mientras que se administra a menudo PCR para reponer factores de la coagulación y prevenir hemorragias. Puede estar indicada la transfusión de componentes celulares sanguíneos (concentrado eritrocítico o sangre entera reciente) en animales anémicos, y la transfusión de productos con plaquetas (sangre entera reciente o plasma rico en plaquetas) en animales con trombocitopenia significativa. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Endocrinopatía. Entre las enfermedades endocrinas comunes que afectan el equilibrio hídrico en perros y gatos deben mencionarse diabetes insípida, diabetes mellitus, hipercorticalismo, hipocorticalismo, hipertiroidismo e hipotiroidismo. En todos los casos, la valoración del equilibrio hídrico, electrolítico y ácido–base debe ser parte de la valoración diagnóstica inicial, y el plan de fluidoterapia debe considerar todos estos defectos en el contexto de la enfermedad específica del paciente. Consideraciones para suministro y administración de líquidos Al igual que la práctica de la medicina veterinaria se ha tornado cada vez más compleja, la fluidoterapia en pacientes caninos y felinos ha evolucionado. Si bien las vías subcutánea e intraósea tienen ventajas en determinadas situaciones clínicas, la vía intravenosa ha surgido como la vía de elección para la fluidoterapia parenteral en una amplia variedad de sujetos. Los líquidos que se administran por vía intravenosa deben calentarse a 37°C antes de infundirse, en especial si se administran con rapidez o en grandes volúmenes (o ambas cosas). El acceso intravenoso puede lograrse con uno de los siguientes tipos de catéteres: 1) catéteres con aguja alada, 2) catéteres sobre la aguja, (3) catéteres dentro de la aguja y 4) catéteres colocados con la ayuda de un introductor y un alambre guía. La selección del catéter depende de la indicación para administrar líquido, el tipo y volumen de líquido requeridos, el sitio planeado de colocación del catéter (vena periférica o central), el tiempo planeado de permanencia del catéter, la talla del paciente, la experiencia del operador, la disponibilidad de tipos de catéteres, y el costo. Algunos materiales comunes de los catéteres son polietileno, poliuretano, elastómero de silicón, y policloruro de vinilo (PVC). Éstos varían en su reactividad, rigidez y trombogenicidad. Los catéteres sobre la aguja se usan de forma amplia en la práctica clínica regular porque son fáciles de insertar en las venas periféricas caninas y felinas, son eficaces en términos de costo, y son adecuados en situaciones en que se requiere fluidoterapia a corto plazo (es decir, por lo regular menos de 72 h). Para perros y gatos, los tamaños estándares de los catéteres sobre la aguja tienen calibres del 24 al 14; los calibres más usados son 22, 20 y 18. 266 Manual de anestesia y analgesia en. . Si está indicada la administración rápida de volumen es importante colocar el catéter con el mayor diámetro posible. El gasto máximo de líquido aumenta con el radio de la luz del catéter. Para catéteres con diámetro menor del calibre 14, esta relación es lineal, pero para catéteres más grandes el gasto aumenta de manera geométrica con el tamaño y es proporcional al radio de la luz elevado a la cuarta potencia (r4). Se dispone de muchos tipos diferentes de equipos de administración de líquido. Casi todos tienen uno o más puertos de inyección o conexión que facilitan la infusión simultánea de múltiples soluciones compatibles a través de un mismo catéter. Todos los equipos emplean una cámara de goteo en línea para visualizar y calcular el gasto. De acuerdo con la marca, los tamaños de gota están calibrados de tal modo que 1 mL es igual a 10, 15, 20 o 60 gotas. Si no se dispone de una bomba automatizada, el número de gotas por minuto necesarias para suministrar un volumen particular en un tiempo específico puede calcularse mediante la siguiente fórmula: Gotas/minuto = (volumen de infusión total × gotas/mL del equipo de goteo)/tiempo total de infusión en minutos Valoración del equilibrio hídrico y vigilancia de la respuesta al tratamiento Dado que no existe un método cuantitativo único que mida de manera definitiva el equilibrio hídrico en un compartimiento particular, los planes de fluidoterapia son empíricos por necesidad. En consecuencia, es importante reunir toda la información posible acerca del paciente, efectuar una valoración informada, diseñar un plan racional y estar preparado para modificar el plan con base en la respuesta del paciente. La manera esencial de valorar el equilibrio hídrico implica la cuantificación de los parámetros físicos, como frecuencia cardiaca, frecuencia respiratoria, presión del pulso, tiempo de llenado capilar, color y humedad de las membranas mucosas, turgencia cutánea, estado mental y color y temperatura de las extremidades. Es importante hacer notar que las alteraciones de estos parámetros no son indicadores sensibles de hipovolemia, por lo que deben obtenerse otros datos cuando sea posible. La presión venosa central (PVC) es una medida de la presión hidrostática dentro de la vena cava intratorácica y refleja la interacción entre volumen sanguíneo intravascular, funcionamiento cardiaco, distensibilidad venosa y presión intratorácica. Debido a la sencillez y disponibilidad de la vigilancia de la PVC, y a pesar de sus numerosas limitaciones, esta técnica es de uso común para guiar la fluidoterapia en pacientes en estado crítico. La presión arterial media (PAM) se relaciona con GC y resistencia vascular sistémica (RVS) como sigue: PAM = GC × RVS © Editorial El manual moderno Fotocopiar sin autorización es un delito. La frecuencia de goteo puede programarse a continuación de modo manual mediante la pinza en la línea para controlar el gasto en la cámara de goteo. En la actualidad es común encontrar bombas electrónicas en muchas prácticas veterinarias, que aseguran un suministro más exacto de líquido. Se recomienda el uso de una bomba en línea o una bomba de jeringa en pacientes muy pequeños, que pueden sobrehidratarse con facilidad, o bien en sujetos en estado crítico que requieren fluidoterapia intensiva. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Equilibrio ácido–base y fluidoterapia 267 En consecuencia, aunque PA se vincula con GC, no es una medida específica del volumen intravascular. En las fases iniciales de una pérdida sanguínea aguda, por ejemplo, el sistema nervioso simpático (si está intacto) reacciona con rapidez y en grado impresionante para incrementar la actividad del miocardio e iniciar la vasoconstricción, de tal manera que la PA puede permanecer normal. Por lo tanto, una medición aislada de PA puede ser engañosa a menos de que se interprete como parte del cuadro general. El GC proporciona una valoración real del volumen, a diferencia de la medición de presión que se usa como sustituto del volumen. Si bien no es factible en casos comunes y no carece de limitaciones, la vigilancia del GC es valiosa en pacientes en estado crítico seleccionados que requieren reposición de líquidos. Es esencial realizar valoraciones de referencia y seriadas de hematócrito (HTC) y sólidos totales (ST) en pacientes con pérdida sanguínea significativa o desplazamientos entre compartimientos que requieren restitución de volumen. Una vez más, una medición individual puede ser engañosa y puede estar indicada la revaloración a intervalos regulares (en ocasiones tan cortos como cada 15 a 20 min) durante la fase inicial de la reanimación para determinar las pérdidas continuas y la respuesta al tratamiento. Aunque no es útil valorar el volumen intravascular en el momento de la presentación, sí lo es medir la diuresis junto con la densidad relativa urinaria cuando se maneja el equilibrio hídrico en lapsos más prolongados (p. ej., a intervalos de 1 h o más). Cuando el funcionamiento de los riñones es por lo demás normal, una diuresis menor de 1 mL/kg/h sugiere decremento de la filtración glomerular por hipoperfusión renal debida a hipovolemia, deshidratación, o ambas. Con la fluidoterapia intravenosa se induce la expansión del volumen intravascular, con lo cual se incrementa la diuresis. Se ha descubierto que la concentración sanguínea de lactato es un indicador útil de la perfusión durante la reposición de volumen en perros y gatos. Con un suministro inadecuado de oxígeno a los tejidos, las células vuelven al metabolismo anaeróbico y aumenta la producción de lactato. Pese a que existen otras causas potenciales de hiperlactatemia que deben descartarse, las más comunes son hipoperfusión e hipoxia tisular. Las concentraciones sanguíneas normales de lactato son <2.0 mmol/L en perros y <1.46 mmol/L en gatos. En perros, concentraciones en el intervalo de 3 a 5 mmol/L representan un incremento leve, concentraciones en el intervalo de 5 a 8 mmol/L suponen un incremento moderado, y concentraciones >8 mmol/L implican un aumento grave. El restablecimiento de una perfusión adecuada durante la reposición de volumen tiene como resultado un descenso de los valores sanguíneos de lactato. En el paciente traumatizado o en estado crítico deben realizarse valoraciones frecuentes del estado ácido–base por medio de análisis de gases en sangre y determinación de las concentraciones de electrolitos en suero, ya que equilibrio ácido–base, equilibrio electrolítico y equilibrio hídrico están inextricablemente vinculados. Un plan de fluidoterapia eficaz debe considerar todos estos trastornos. Antes en este capítulo se revisaron los métodos clínicos para el equilibrio ácido–base y se presentó una revisión de trastornos electrolíticos comunes en perros y gatos. En animales normales, los cambios en los volúmenes intravascular e intersticial ocurren en paralelo; sin embargo, en estados patológicos, el patrón de distribución del líquido puede verse afectado. La coloidosmometría es la técnica utilizada para medir la PCO en clínica. Ésta permite al veterinario distinguir entre decremento de la PCO y elevación de la presión hidrostática como una causa de pérdida hídrica intravascular o formación de edema. La PCO de la sangre entera en perros normales se aproxima a 20 mm Hg, mientras que la PCO del plasma es de unos 268 Manual de anestesia y analgesia en. . 17.5 mm Hg. La PCO de la sangre entera en el gato normal es casi de 25 mm Hg y la del plasma en este animal es de unos 20 mm Hg. Tipos de líquidos Los líquidos disponibles para uso intravenoso en animales pequeños pueden clasificarse en términos amplios en tres categorías: 1) cristaloides, 2) coloides y 3) productos hemáticos. Soluciones de reposición Estas soluciones se emplean para reponer déficits de agua y electrolitos debidos a hipovolemia, deshidratación, o ambos. Todas son isotónicas, con concentraciones de Na+ similares a las del LEC. En consecuencia, su distribución se limita al LEC y es proporcional a los volúmenes de los compartimientos intravascular e intersticial. Esto significa que sólo 20 a 25% del volumen de un cristaloide de reposición que se infunde por vía intravenosa permanece dentro del espacio intravascular 1 h después. En la fase de urgencia de la reposición de volumen pueden estar indicadas ritmos de administración hasta de 90 mL/kg/h en perros y 60 mL/kg/h en gatos (es decir, alrededor de un volumen sanguíneo por hora). Durante esta fase, el paciente debe revalorarse a intervalos de 5 a 10 min, y el gasto ajustarse según esté indicado. Una vez que se han alcanzado los criterios de valoración de la fase de urgencia, puede comenzar la fase de rehidratación para tratar los déficits en el compartimiento intersticial mediante gastos de administración menos radicales. En perros y gatos anestesiados, las soluciones de cristaloides para reposición se recomiendan en la mayoría de los casos regulares. La rapidez de administración estándar de SEB en perros y gatos anestesiados es de unos 10 a 20 mL/kg/h. En pacientes con trastornos del equilibrio hídrico específicos pueden estar indicados otros gastos o tipos de líquidos. Entre las soluciones de reposición de uso común en perros y gatos figuran las SEB PlasmaLyte® 148 y Plasma-Lyte® A (Baxter, Deerfield, IL), Normosol® R (Hospira, Lake Forest, IL), y solución de Ringer con lactato. Todas ellas contienen uno o más amortiguadores (acetato, gluconato o lactato) y por tanto se las conoce como soluciones alcalinizantes. El cloruro de sodio al 0.9% es una solución de reposición electrolítica no balanceada y también se denomina solución acidificante. En el cuadro 7-9 puede consultarse más información sobre soluciones de reposición específicas. Soluciones de mantenimiento Estas soluciones tienen el objetivo de satisfacer las necesidades de agua y electrolitos de pacientes que no pueden mantener un consumo adecuado de líquido y electrolitos. Casi siempre © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cristaloides Son el tipo de líquido que más se administra. Una solución de cristaloide consiste en una base de sodio o dextrosa disuelta en agua. Según sea el tipo específico de cristaloide, pueden agregarse otros diversos electrolitos o amortiguadores (o ambos). Si la composición electrolítica de la solución se aproxima a la del plasma, entonces la solución se conoce como solución electrolítica balanceada (SEB). Los cristaloides pueden subdividirse en cuatro subtipos: 1) soluciones de reposición, 2) soluciones de mantenimiento, 3) soluciones hipertónicas, y 4) soluciones de agua libre. En el cuadro 7-9 se presentan la composición y propiedades importantes de cristaloides seleccionados. 0 13 0 Normosol® M en dextrosa 40 al 5%a 154 140 140 140 NaCl al 0.9% Plasma-Lyte® 148 Plasma-Lyte® A Normosol® R 0 0 77 Dextrosa al 5% NaCl al 0.45% 0 0 3 0 0 0 0 0 0 5 0 0 0 Ca2+ b Se requieren complementos de potasio. Se requieren complementos de potasio y dextrosa. SEB, solución electrolítica balanceada. a 4 Solución de Ringer con 130 lactato 0 0 Dextrosa al 2.5% en NaCl 77 al 0.45%a 5 5 5 13 Plasma-Lyte® 56 en dex- 40 trosa al 5%a 0 16 855 513 NaCl al 5% NaCl al 3% 0 K+ Plasma-Lyte® M en dex- 40 trosa al 5%a 1 199 NaCl al 7% Na+ 77 0 109 77 98 98 98 154 40 40 40 513 855 1 199 Cl– Composición de cristaloides seleccionados Líquido Cuadro 7-9. © Editorial El manual moderno Fotocopiar sin autorización es un delito. 0 0 0 0 3 3 3 0 3 3 3 0 0 0 Mg2+ 0 50 0 25 0 0 0 0 50 50 50 0 0 0 Glucosa (g/L) 0 170 170 180 0 0 0 Cal/L 0 0 28 lactato 0 0 170 9 85 27 acetato 18 23 gluconato 27 acetato 17 23 gluconato 27 acetato 17 23 gluconato 0 16 acetato 16 acetato 12 acetato 12 lactato 0 0 0 Amortiguador (mEq/L) 5.0 4.0 6.5 4.5 6.4 7.4 5.5 5.0 5.0 5.0 5.0 5.0 5.0 5.0 pH 154 252 273 280 294 294 294 308 363 363 377 1 026 1 711 2 400 mOsm/L no Mantenimientob Agua libre Reposición; SEB Mantenimientoa Reposición; SEB Reposición; SEB Reposición; SEB Reposición; balanceado Mantenimiento Mantenimiento Mantenimiento Hipertónico Hipertónico Hipertónico Clasificación Equilibrio ácido–base y fluidoterapia 269 270 Manual de anestesia y analgesia en. . son hipotónicas pero isoosmóticas, con menores concentraciones de Na+ y Cl– y mayores de K+ y dextrosa que las soluciones de reposición. En consecuencia, rara vez se infunden a ritmos mayores que las necesarias para satisfacer las necesidades de mantenimiento del paciente. Los requerimientos de líquido de mantenimiento de perros y gatos hospitalizados pueden calcularse con la siguiente fórmula: Volumen de mantenimiento total/día (mL) = 1.2[70 × PC (kg)0.75] Esta fórmula es válida para 27 a 84 mL/kg/día en pacientes de 90 g a 1 kg, respectivamente. Por consiguiente, la determinación ya citada de 60 mL/kg/día sobreestima las necesidades de mantenimiento en perros grandes, al tiempo que las subestima en perros pequeños y gatos. Entre las soluciones de mantenimiento comunes disponibles en el comercio para perros y gatos pueden mencionarse Plasma-Lyte 56, Plasma-Lyte M, y Normosol M. Dado que en muchos establecimientos veterinarios no es económico tener siempre a la mano soluciones de mantenimiento comerciales, puede preparárselas al momento diluyendo una solución de reposición SEB con agua estéril o dextrosa al 5% en una proporción 1:1 y complementar con cloruro de potasio a 20 a 25 mEq/L. Soluciones de agua libre La solución de dextrosa al 5% en agua (D5%) no contiene electrolitos y, una vez que la dextrosa se metaboliza, sólo queda agua libre. No se la considera una solución de reposición, ya que no son comunes los déficits verdaderos de agua pura y la infusión de grandes volúmenes de D5% pueden propiciar la dilución de los electrolitos séricos y la formación de edema. En consecuencia, la D5% se usa más a menudo como un vehículo para la infusión de otros medicamentos o para suministrar agua pura en casos graves de hipernatremia. Coloides Los coloides son suspensiones de partículas de alto peso molecular (PM) que no salen con facilidad del espacio intravascular intacto. La administración de coloide incrementa la PCO y el volumen intravascular de manera directa y, puesto que sus partículas tienen carga negativa, también extrae Na+ y por tanto agua del intersticio, lo cual incrementa aún más el volumen intravascular. Las soluciones de coloides están indicadas para una rápida expansión del volumen intravascular o mejorar la PCO en pacientes con bajas concentraciones séricas de albúmina. Muchas veces, los © Editorial El manual moderno Fotocopiar sin autorización es un delito. Soluciones hipertónicas Las soluciones salinas hipertónicas (por lo regular con 5 o 7% de NaCl) se usan de manera ocasional en perros y gatos durante la fase de urgencia de la reposición de volumen para incrementar con rapidez el volumen intravascular. La administración de solución salina hipertónica intravenosa inicia un desplazamiento transitorio de líquido, que dura hasta 30 min, desde el compartimiento intersticial hasta el intravascular. Esto puede mejorar GC, PA y perfusión mientras se realiza la reposición de volumen definitiva. La dosis y rapidez máximas recomendadas para NaCl al 7% son de 4 a 7 mL/kg en perros y de 2 a 4 mL/kg en gatos, a razón de 1 mL/kg/min. Equilibrio ácido–base y fluidoterapia 271 coloides se clasifican en sintéticos y biológicos. Los coloides biológicos son un subgrupo de productos hemáticos capaces de ejercer PCO, como plasma, albúmina y sangre entera. Se los considera más adelante en la sección de productos hemáticos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Coloides sintéticos Los coloides sintéticos son soluciones polidispersadas con moléculas de tamaño variable, desde algunos cientos hasta varios millones de daltones. El PM citado para un producto en particular representa el PM promedio de las moléculas en esa solución. Los coloides sintéticos pueden administrarse en la forma de bolos pequeños (5 mL/kg en perros o 2.5 mL/kg en gatos) hasta obtener el efecto deseado en un lapso que oscila entre algunos minutos (en caso de choque hipovolémico) y varias horas (si se trata edema intersticial, hipoproteinemia, otros). Numerosas referencias veterinarias refieren una dosis máxima de 20 a 30 mL/kg/día, lo cual se basa en preocupaciones de que dosis mayores afecten la coagulación. En el cuadro 7-10 se presentan la composición y propiedades importantes de cristaloides sintéticos seleccionados. Algunos coloides sintéticos de uso común en perros y gatos son los dextranos (Dextran 70), los hetaalmidones (HESpan [B. Braun Medical Inc., Irvine, CA] y Hextend [Hospira]), las gelatinas (Gelofusine [B. Braun Australia Pty. Ltd., Castle Hill, NSW, Australia] y Haemaccel [Intervet/Schering-Plough Animal Health, Walton, Milton Keynes, Buckinghamshire, RU]), el pentaalmidón (Pentaspan, Bristol-Myers Squibb Canada, Montreal, Canadá), y el tetraalmidón (Voluven, Hospira). Productos hemáticos Pueden estar indicados productos hemáticos para reponer déficit de eritrocitos, proteínas plasmáticas, volumen intravascular, plaquetas, factores de la coagulación o alguna combinación de ellos. Los productos hemáticos más usados en la práctica con especies pequeñas son: 1) plasma reciente o congelado reciente, 2) sangre entera reciente o congelada, y 3) concentrado eritrocítico. También pueden estar indicados en situaciones clínicas específicas plasma rico en plaquetas, concentrado plaquetario, crioprecipitado y albúmina sérica al 25%. De éstos, las soluciones que contienen albúmina (sangre entera, plasma, albúmina sérica) se clasifican como coloides biológicos debido a su capacidad de influir en la PCO, mientras que sangre entera y concentrado eritrocítico se conocen como productos hemáticos celulares. Plasma El plasma se separa de la sangre entera y se utiliza de inmediato o como PCR. El PCR contiene proteínas plasmáticas y factores de la coagulación (si se usa en las horas que siguen a la descongelación), pero no plaquetas. La albúmina representa alrededor de 80% de la actividad coloidal del plasma. Dado que se equilibra con el compartimiento intersticial más rápido y en mayor medida que los coloides sintéticos, se requieren volúmenes muy grandes de plasma para modificar la PCO plasmática. En consecuencia, se prefieren coloides sintéticos sobre el plasma si el principal objetivo clínico es incrementar la PCO. Sangre entera Está indicada la transfusión de sangre entera en cualquier circunstancia caracterizada por pérdida de eritrocitos y volumen plasmático. Se prefiere la sangre entera reciente sobre la sangre almace- ND 0.5 ND ND 0.4 ND Dextrano 70 al 6% en 70 NaCl al 0.9% Pentalmidón al 10% 200 en NaCl al 0.9% (Pentaspan) Gelatina líquida suc- 30 cinilada al 4% (Gelofusine) Gelatina unida por 35 enlaces cruzados a urea al 3.5% (Haemaccel) 6% 130 Tetralmidón (Voluven) Portador de oxígeno 200 basado en hemoglobina (Oxyglobin, OPK Biotech LLC., Cambridge, MA) 130 60 35 40 100 60 60 60 Coloide (g/L) © Editorial El manual moderno Fotocopiar sin autorización es un delito. al 0.75 Hetalmidón al 6% en 670 SEB (Hextend) Sustitución molar 0.7 PM medio (kDa) Hetalmidón al 6% en 600 NaCl al 0.9% (HESpan) Líquido 150 154 145 154 154 154 143 154 Na+ 4 0 5.1 0.4 0 0 3 0 K+ 0 0 6.3 0.4 0 0 5 0 Ca2+ 118 154 145 125 154 154 124 154 Cl– 27 lactato 0 0 0 0 0 28 lactato 0 Amortiguador (mEq/L) Cuadro 7-10. Propiedades fisicoquímicas y composición de coloides sintéticos seleccionados 307 309 mOsm/L 279 326 7.8 300 4.0 a 5.5 308 7.2 a 7.3 310 7.4 5.0 5.1 a 5.7 310 5.9 5.5 pH 43.3 ± 0.1 37.1 ± 0.8 25.6 a 28.6 34 32 ± 1.4 61.7 ± 0.5 37.9 ± 0.1 32.7 ± 0.2 PCO (mm Hg) 272 Manual de anestesia y analgesia en. . Equilibrio ácido–base y fluidoterapia 273 nada si están indicados de modo específico factores de la coagulación y plaquetas, ya que estos componentes se deterioran en las 24 h que siguen a la obtención. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Concentrado eritrocítico Una unidad de concentrado eritrocítico contiene las células más la pequeña cantidad de plasma y anticoagulante que queda después de que se extrae el plasma de una unidad de sangre entera. Como monoterapia, los concentrados eritrocíticos sólo están indicados para el tratamiento de la anemia, pero suelen transfundirse en combinación con plasma, cristaloides, coloides sintéticos o alguna combinación de ello para corregir la pérdida de sangre entera. Revisado a partir de “Acid–Base Physiology” por William W. Muir and Helio S.A. de Morais; y “Fluid, Electrolyte, and Blood Component Therapy” por David C. Seeler in Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 8 Manejo anestésico de perros y gatos Richard M. Bednarski Para el manejo anestésico exitoso de perros y gatos es necesario entender la fisiología y farmacología básicas integradas con diversas competencias clínicas que se relacionan con anestesia y analgesia. El abordaje del manejo anestésico siempre debe ser sistemático y seguir un plan secuencial, como se delinea en el cuadro 8-1. En algunas situaciones es útil un formulario estandarizado para organizar datos importantes del paciente (figura 8-1). De modo similar, los detalles del plan anestésico también pueden organizarse en una hoja de trabajo estandarizada (figura 8-2). A primera vista, este método puede parecer innecesariamente complicado e impráctico. Sin embargo, los veterinarios experimentados efectúan en realidad este proceso todos los días y se limitan tan sólo a realizar los pasos con gran rapidez y eficiencia al atender a pacientes jóvenes sanos programados para intervenciones quirúrgicas comunes. Al adoptar este método o alguno similar para cada animal que requiere anestesia, el proceso se convierte en algo natural. Más adelante, cuando se enfrente a casos más desafiantes y complejos, el veterinario estará mejor preparado para identificar los puntos clave y formular un plan racional. En vez de intentar abordar todos los pasos delineados en el cuadro 8-1, este capítulo se concentra en especial en consideraciones sobre protocolos farmacológicos y selección de la técnica clínica. Los otros pasos se revisan en otras partes de este libro y se remite al lector a los capítulos sobre valoración del paciente, fisiología, farmacología, cuidados de vías respiratorias, equipo, vigilancia, fluidoterapia, técnicas analgésicas y anestesia para intervenciones o enfermedades específicas, donde se encuentra información más detallada. Selección del protocolo farmacológico Con base en el cuadro 8-1, resulta evidente que la selección del protocolo farmacológico constituye sólo un componente del panorama general del manejo anestésico. Si bien la selección de un protocolo farmacológico inapropiado puede contribuir sin duda a un resultado adverso, lo opuesto no es válido en todos los casos. La selección de un protocolo farmacológico perfectamente razonable no asegura que no habrá complicaciones. Cualesquiera que sean los fármacos elegidos, es Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 274 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Introducción Manejo anestésico de perros y. . . 275 FORMULARIO DE VALORACIÓN PREANESTÉSICA DEL PACIENTE CASO NÚMERO 123456 ANTECEDENTES Generales Edad 10 meses Sexo F entera Raza Labrador X Peso 19.6 kg Problema de presentación-motivo de la anestesia: Ovariohisterectomía programada ¿Medicación concurrente? SÍ NO X En caso AFIRMATIVO, describir NOMBRE DEL PACIENTE Manchas Ramírez ¿Datos históricos significativos? SÍ NO X En caso afirmativo, describir: ¿Anestesia previa? SÍ NO X En caso AFIRMATIVO, describir EXPLORACIÓN FÍSICA Aparato circulatorio FC 110 lpm Ritmo sinusal normal Calidad fuerte mm/TLC rosado, <2 s ¿Auscultación cardiaca anormal? SÍ NO X En caso AFIRMATIVO, describir: Aparato respiratorio FR 24 rpm Esfuerzo normal ¿Auscultación pulmonar anormal? SÍ NO X En caso AFIRMATIVO, describir: Sistema termorregulador 38.3°C Temp Valoración de dolor ¿Dolor preexistente? SÍ NO X En caso AFIRMATIVO, describir: Otros aparatos y sistemas Neuro DNS Renal DNS Hepático DNS Digestivo DNS © Editorial El manual moderno Fotocopiar sin autorización es un delito. RESULTADOS DE PRUEBAS DE LABORATORIO + Hct 0 42 Na 0.42 Creatinina C 1 1 ALT 1.1 48 SG orina + ALP Otros K NUS Hb ClLeuc Glucosa 87 AST Ca2+ Plaquetas CK TP/TPT Proteína T 71 Amil/lip RESULTADOS DE PRUEBAS AUXILIARES ECG? ¿Radiografías torácicas? SÍ NO X SÍ NO X En caso AFIRMATIVO, describir: En caso AFIRMATIVO, describir: ¿Radiografías abdominales? SÍ NO X En caso AFIRMATIVO, describir: ¿Ultrasonido? SÍ NO X En caso AFIRMATIVO, describir: ¿Otros? SÍ NO X En caso AFIRMATIVO, describir: CLASIFICACIÓN DE LA ASA DEL ESTADO FÍSICO I II III IV V E RESUMEN DE PROBLEMAS DEL PACIENTE RELACIONADOS CON LA ANESTESIA Paciente sano que se presenta para intervención programada. No se anticipan complicaciones relacionadas con la anestesia. Figura 8-1. Formulario de valoración preanestésica del paciente. DNS: datos no significativos. 276 Manual de anestesia y analgesia en. . Cuadro 8-1. Paso 1. Valoración paciente Método sistemático para el manejo anestésico de perros y gatos Detalles del Integrar toda la información del sujeto, incluidos: • Datos generales • Antecedentes • Inspección general y temperamento • Exploración física completa • Valoración en busca de dolor • Interpretación de pruebas de laboratorio • Interpretación de otras pruebas diagnósticas Determinar el estado físico con base en lo anterior 2. Revisión de la Integrar toda la información del procedimiento pertinente, como: intervención pla- • Grado de penetración corporal neada • Intensidad esperada del dolor • Posibles complicaciones • Duración • Posición requerida del paciente 4. Formulación de Generar un plan amplio basado en lo anterior que incluya: un plan anesté- • Selección del protocolo farmacológico sico y analgési– Fármacos preanestésicos co – Agentes de inducción – Agentes de mantenimiento – Anestésicos complementarios – Fármacos analgésicos – Otros fármacos para cuidados paliativos • Selección de técnicas y equipo de anestesia clínica – Suministro de fármacos inyectables • Catéteres IV y accesorios – Manejo de vías respiratorias • Sondas endotraqueales y accesorios – Suministro de anestésicos inhalables • Máquina de anestesia • Sistema de respiración – Técnicas anestésicas/analgésicas locales, regionales • Fármacos, agujas, localizador de nervios, otros • Selección de técnicas y equipo para vigilancia del paciente – Profundidad de la anestesia – Parámetros cardiopulmonares básicos – Presión arterial © Editorial El manual moderno Fotocopiar sin autorización es un delito. 3. Preparación del Iniciar maniobras de estabilización, de ser necesario, para tratar: paciente • Dolor • Deshidratación • Hipovolemia • Anemia • Trastornos electrolíticos o ácido–base • Neumotórax, derrame pleural • Arritmias cardiacas • Otros estados patológicos descompensados Establecer un intervalo de ayuno preanestésico apropiado Manejo anestésico de perros y. . . 277 Cuadro 8-1. Paso Método sistemático para el manejo anestésico de perros y gatos (continuación) Detalles • Sistema oscilométrico, Doppler o directo – Dióxido de carbono corriente final • Capnómetro – Saturación de hemoglobina • Oxímetro de pulso – Electrocardiograma (ECG) • Monitor de ECG – Temperatura corporal central • Termómetro – Concentraciones de anestésico inhalable y de oxígeno en las vías respiratorias • Monitor de gas en vías respiratorias – Parámetros de gases en sangre arterial • Analizador de gases en sangre – Otros © Editorial El manual moderno Fotocopiar sin autorización es un delito. • Selección de técnicas y equipo de cuidados paliativos – Manejo de líquidos y electrólitos • Líquidos y accesorios • Bombas y bombas de jeringa para líquidos – Apoyo de la termorregulación • Frazada de agua circulante, calentador de aire forzado, calentador de tejido conductor – Ventilación mecánica • Ventilador – Otro apoyo farmacológico • Fármacos, bombas de jeringa, otros 5. Ejecución del plan Llevar a cabo el plan como se delineó antes e iniciar lo siguiente: • Vigilancia del paciente – Documentación de los parámetros vigilados – Interpretación de parámetros vigilados y tendencias – Reconocimiento de trastornos significativos • Manejo de complicaciones relacionadas con el paciente – Inicio de intervenciones, suministro de cuidados paliativos o ambas cosas cuando sea apropiado • Manejo de complicaciones relacionadas con el equipo – Reconocer fallos del equipo y corregirlos • Manejo del paciente en recuperación – Manejo de vías respiratorias – Tratamiento del dolor – Tratamiento de excitación/disforia – Tratamiento de la hipotermia – Reconocimiento y tratamiento de otras complicaciones – Vigilancia y cuidados paliativos continuos • Registros – Documentación de toda la información relacionada con el caso 6. Valoración retrospectiva Completar una valoración objetiva del plan de anestesia y analgesia y sus resultados 278 Manual de anestesia y analgesia en. . HOJA DE TRABAJO PARA PLANEACIÓN DE LA ANESTESIA CASO NÚMERO 123456 NOMBRE DEL PACIENTE Manchas Ramírez PESO 19.6 kg PERIODO PREANESTÉSICO ¿Se requieren estabilización/corrección/valoración de problemas preexistentes? SÍ NO X En caso AFIRMATIVO, delinear el plan: Fármacos preanestésicos Dosificación (mg/kg) Dosis (mg) Volumen (mL) Vía Sedante Acepromazina 0.05 mg/kg 0.98 mg 0.1 mL IM Opioide Hidromorfona 0.1 mg/kg 1.96 mg 0.98 mL IM Anticolinérgico Disociativo Otro PERIODO ANESTÉSICO Fármacos anestésicos Inducción inyectable Tiopental Inducción inhalable Agente NE inhalable Mantenimiento inyectable Agente(s) inyectable(s) Volumen (mL) Vía 10 mg/kg 196 mg 7.8 mL hasta el efecto IV % suministrado Gasto de O2 (mL/kg/min) Gasto de O2 (mL/min) Vía Dosificación (mg/kg) Dosis (mg) Volumen (mL) Vía Gasto de O2 (mL/kg/min) 50 mL/kg/min; 3% inicial; ↓ a 1 o ↓ a 20 mL/kg/min 2% hasta el efecto Dosificación (mg/kg) Dosis (mg) Gasto de O2 (mL/min) 1 L/min inicial; ↓ a 400 mL/min Volumen (mL) Vía Gasto (mL/kg/h) Gasto (mL/h) Frec goteo (gt/s) Vía 10 mL/kg/h 196 mL/h NE Mantenimiento inhalable Agente Isoflurano inhalable Analgesia complementaria Anestésico local Dosificación (mg/kg) Dosis (mg) % suministrado Sistema circular Vía NE Opioide Otro Fluidoterapia Cristaloide Plasmalyte 148 Coloide 0.54 gt/h IV (10 gt/ml equipo de goteo) Producto hemático Técnicas de vigilancia ECG____X Oscilométrica PA____ X PA Doppler____ Temperatura___ _X Oximetría de pulso____ X Capnometría____ X PERIODO POSANESTÉSICO Fármacos posanestésicos Dosificación (mg/kg) Dosis (mg) Volumen (mL) Vía Opioide Hidromorfona 0.05 mg/kg 0.98 mg 0.49 mL IV AINE Carprofeno 4 mg/kg 78.4 mg 1.57 mL SC Sedante Otro Figura 8-2. Hoja de trabajo para planeación de la anestesia. PA directa____ Otra__________ © Editorial El manual moderno Fotocopiar sin autorización es un delito. Agente(s) inyectable(s) Manejo anestésico de perros y. . . 279 necesaria la vigilancia activa del paciente anestesiado y, cuando esté indicado, deben instituirse intervenciones sintomáticas. El veterinario de hoy dispone de numerosos fármacos, los cuales pueden combinarse y administrarse de muchas maneras. La mayoría de los veterinarios no necesita tener todos ellos a la mano y el uso de muchos protocolos farmacológicos distintos no siempre implica un cuidado anestésico superior. No obstante, estar familiarizado con una sola técnica anestésica limita, en el mejor de los casos, la capacidad del veterinario de efectuar todos los procedimientos diagnósticos y quirúrgicos comunes en la práctica actual y, en el peor, puede poner en peligro a determinados pacientes. Anestesia equilibrada © Editorial El manual moderno Fotocopiar sin autorización es un delito. En gran medida, los protocolos anestésicos de un solo fármaco se han abandonado en favor de protocolos que incorporan múltiples fármacos de diferentes clases para inducir inconciencia, analgesia y relajación muscular. Este enfoque se conoce como anestesia equilibrada. La mayor parte de los protocolos de anestesia equilibrada tiene cuatro fases distintas: 1) preanestesia, 2) inducción, 3) mantenimiento y 4) recuperación. En última instancia, la selección de fármacos y técnicas clínicas para cada una de estas fases depende de factores relacionados con el paciente, factores vinculados con la intervención, disponibilidad de los fármacos, experiencia personal y costo. A continuación se consideran las cuatro fases del manejo anestésico en términos generales y después se presenta un resumen de factores clave relacionados con el paciente y la intervención. Medicación preanestésica Casi todos los pacientes se benefician de la administración de uno o más fármacos preanestésicos antes de la inducción de un anestésico inyectable o inhalable. Los objetivos de la medicación preanestésica exitosa en perros y gatos se resumen en el recuadro 8-1. En perros y gatos sanos, la mayoría de los fármacos preanestésicos se administra por las vías intramuscular (IM) o subcutánea (SC), 15 a 20 min antes de la inducción de la anestesia. Esto reduce el estrés y la ansiedad en el animal y facilita la sujeción para colocar el catéter intravenoso (IV). En sujetos con necesidades especiales en que ya está colocado un catéter IV, esta vía también puede usarse para la medicación preanestésica. En casi todos los perros y gatos sanos jóvenes a maduros, la medicación preanestésica suele implicar una combinación de un sedante y un analgésico. En pacientes que requieren grados moderados a profundos de sedación, las opciones que más se emplean son la fenotiazina acepromazina o el agonista a2-adrenérgico dexmedetomidina. En pacientes geriátricos, debilitados o hemodinámicamente inestables, o en cualquier paciente que requiera menos sedación, es posible emplear en cambio la benzodiazepina midazolam. Los opioides se incluyen de manera sistemática como parte de la medicación preanestésica incluso en pacientes que no tienen dolor o no programados para intervenciones dolorosas. La sinergia entre opioide y sedante tiene como resultado mejor sedación y reduce la necesidad de anestésico para la inducción y el mantenimiento. Los opioides más utilizados para medicación preanestésica en perros y gatos son los agonistas puros hidromorfona, oximorfona y morfina; el agonista–antagonista butorfanol; y el agonista parcial 280 Manual de anestesia y analgesia en. . Recuadro 8-1. Objetivos de la fase preanestésica en perros y gatos Reducir al mínimo el estrés y la ansiedad del paciente • Facilita la sujeción • Promueve la seguridad para el paciente y quien lo manipula Reducir las necesidades de anestésicos inyectables e inhalables • Uniforma las fases de inducción, mantenimiento y recuperación • Mejora la estabilidad cardiopulmonar Favorecer la analgesia perioperatoria • Tiene un efecto analgésico preventivo • Reduce la necesidad intraoperatoria y posoperatoria de analgésicos buprenorfina. En pacientes en los que la sedación profunda no es una prioridad o la administración de sedantes está contraindicada (o ambas cosas), muchas veces se administra un opioide solo. Ha sido común incluir los anticolinérgicos atropina o glucopirrolato en protocolos preanestésicos en perros y gatos para prevenir la bradicardia, limitar las secreciones salivales o ambas cosas. La necesidad de administración preventiva sistemática de anticolinérgicos en el periodo preanestésico se ha cuestionado en años recientes, con el desarrollo de protocolos farmacológicos anestésicos y normas de vigilancia. Como ocurre con cualquier fármaco, la decisión de usar un anticolinérgico debe basarse en la comprensión de sus ventajas y desventajas, y tomarse caso por caso. Los antiinflamatorios no esteroideos (AINE) como carprofeno, meloxicam, deracoxib, firocoxib y tepoxalina son componentes comunes de los planes analgésicos para perros y gatos sometidos a operación y se administran con frecuencia antes de la anestesia. Si bien no contribuyen a la sedación preanestésica y al parecer no tienen efectos ahorradores de anestésico de consideración, los AINE inyectables (p. ej., carprofeno o meloxicam) pueden suministrarse junto con otra medicación preanestésica 15 a 20 min antes de la inducción. Como alternativa, también pueden inyectarse en el momento de la recuperación si hay temor acerca de hipotensión o hemostasia intraoperatorias. En la figura 8-3 se presenta un diagrama de flujo que delinea el proceso mental para el diseño de protocolos preanestésicos en perros y gatos. Las dosis de fármacos preanestésicos de uso común de cada una de las tres categorías principales (sedantes, opioides y anticolinérgicos) se indican en los cuadros 8-2 y 8-3. En el capítulo 2 puede encontrarse información más detallada sobre farmacología, indicaciones y contraindicaciones de todos estos fármacos. Inducción de anestesia Los objetivos de la inducción de anestesia óptima en perros y gatos se resumen en el recuadro 8-2. La transición del estado consciente al anestesiado se logra casi siempre con la administración de uno o más fármacos inyectables. En situaciones específicas, también puede estar indicada la © Editorial El manual moderno Fotocopiar sin autorización es un delito. Atenuar la actividad neurovegetativa refleja • Induce un plano de anestesia más estable • Genera menor potencial arritmógeno Manejo anestésico de perros y. . . 281 PASO 1: ¿Requiere sedación este paciente? SÍ NO Sedación mínima Sedación profunda Considerar opioide sólo para medicación preanestésica Sedación moderada Considerar dexmedetomidina Considerar midazolam Considerar acepromazina PASO 2: ¿Requiere este paciente anestesia significativa? ¿Analgesia? © Editorial El manual moderno Fotocopiar sin autorización es un delito. SÍ NO Considerar un opioide agonista-antagonista o agonista parcial PASO 3: ¿Requiere este paciente la administración preventiva de un anticolinérgico? SÍ Considerar glucopirrolato o atropina NO Vigilar frecuencia cardiaca y administrar un anticolinérgico si está indicado Figura 8-3. Pasos para seleccionar medicación preanestésica en perros y gatos. 282 Manual de anestesia y analgesia en. . Cuadro 8-2. Medicación preanestésica comúna en perros Dosis IM, SC en mg/kg Dosis IV en mg/kg Sedantes: Midazolamb Acepromazinac Dexmedetomidinad Fármaco 0.1 a 0.3 0.02 a 0.1 0.005 a 0.01 0.1 a 0.2 0.01 a 0.05 0.001 a 0.005 Opioides: Hidromorfona Oximorfona Morfina Butorfanol Buprenorfina 0.05 a 0.1 0.05 a 0.1 0.3 a 1.0 0.2 a 0.4 0.005 a 0.02 0.05 a 0.1 0.05 a 0.1 0.3 a 0.5 lentamente 0.2 a 0.4 0.005 a 0.01 0.04 0.01 0.02 0.005 Anticolinérgicos: Atropina Glucopirrolato b c d Véanse en la figura 8-1 sugerencias sobre el modo de combinar fármacos de cada una de las tres categorías; también puede administrarse un AINE inyectable (carprofeno, meloxicam) como parte de la medicación preanestésica si está indicado. La dosis máxima total se reduce a menudo a unos 7 mg para prevenir sobredosis en perros de razas grandes. La dosis máxima total se reduce con frecuencia a unos 3 mg para prevenir sobredosis en perros de razas grandes. La dosis máxima total se reduce a menudo a unos 0.5 mg para prevenir sobredosis en perros de razas grandes. Cuadro 8-3. Medicación preanestésica comúna en gatos Dosis IM en mg/kg Dosis IV en mg/kg Sedantes: Midazolam Acepromazina Dexmedetomidina Fármaco 0.1 a 0.2 0.05 a 0.2 0.01 a 0.03 0.1 a 0.2 0.02 a 0.05 0.003 a 0.01 Opioides: Hidromorfona Oximorfona Morfina Butorfanol Buprenorfina 0.05 a 0.1 0.05 a 0.1 0.1 a 0.3 0.2 a 0.4 0.005 a 0.02 0.05 a 0.1 0.05 a 0.1 0.1 a 0.3 lentamente 0.2 a 0.4 0.005 a 0.01 0.04 0.01 0.02 0.005 Anticolinérgicos: Atropina Glucopirrolato a Véanse en la figura 8-1 sugerencias sobre el modo de combinar fármacos de cada una de las tres categorías; también puede administrarse un AINE inyectable (carprofeno, meloxicam) como parte de la medicación preanestésica si está indicado. © Editorial El manual moderno Fotocopiar sin autorización es un delito. a Manejo anestésico de perros y. . . 283 Recuadro 8-2. Objetivos de la fase de inducción de anestesia en perros y gatos Facilitar una transición rápida y uniforme a la anestesia general • Evita o reduce al mínimo la excitación (etapa 2 de la anestesia) • Induce relajación muscular adecuada para la intubación endotraqueal si está indicada • Proporciona duración adecuada del efecto para permitir la intervención completa o la transferencia a la fase de mantenimiento © Editorial El manual moderno Fotocopiar sin autorización es un delito. Mantener una estabilidad cardiopulmonar adecuada inducción con un agente inhalable como isoflurano o sevoflurano por mascarilla facial o en una cámara de inducción. No se recomienda con este fin el uso sistemático de agentes inhalables porque es difícil controlar de manera precisa la concentración suministrada de fármaco, y la contaminación de la atmósfera local con vapor anestésico es significativa. Los protocolos de inducción con fármacos inyectables pueden usar las vías IM o IV. En términos técnicos, la vía IM es directa y se prefiere en determinadas situaciones en las que se anestesia a muchos pacientes sanos relativamente jóvenes para intervenciones regulares breves (p. ej., programas de esterilización en refugios de animales). En la mayoría de los casos, con esta vía se requieren dosis totales más altas de fármaco y no existe la posibilidad de ajustar la dosis con base en el efecto. Si bien la vía IV exige la colocación de un catéter, tiene la ventaja de permitir dosificar de acuerdo con el efecto y se relaciona con inducciones y recuperaciones más rápidas. Dado que de cualquier modo el acceso IV se recomienda para casi todos los pacientes sometidos a anestesia general, la colocación de un catéter antes de la inducción es una buena práctica. Por estas razones, se prefieren los protocolos de inducción IV para la mayor parte de los perros y gatos que requieren anestesia general. Entre los compuestos de inducción inyectables IM de uso común en perros y gatos se encuentran combinaciones con ketamina, tiletamina–zolazepam (Telazol®, Pfizer Animal Health, New York), y alfaxalona-CD. Se han informado numerosos protocolos IM para anestesia general en perros y gatos, y la mayoría combina la medicación preanestésica y los fármacos de inducción en una sola inyección IM. Casi todas estas combinaciones incluyen diversas mezclas de agentes disociativos, benzodiazepinas, a2-agonistas y opioides. En los cuadros 8-4 y 8-5 se presentan algunos protocolos seleccionados, aunque esta lista de ningún modo es exhaustiva. Los fármacos de inducción inyectables IV de empleo común en perros y gatos son ketamina, tiletamina–zolazepam (Telazol®), propofol, tiopental, etomidato y alfaxalona-CD. También pueden administrarse al mismo tiempo otros fármacos complementarios, llamados agentes coinductores o de coinducción. En el caso de la ketamina, esta práctica es bien reconocida, ya que casi siempre se coadministra una benzodiazepina (diazepam o midazolam) para contrarrestar la rigidez muscular y el potencial de actividad convulsiva inducidos por ketamina. Aunque ello no es obligatorio, los agentes de coinducción también pueden utilizarse con propofol, tiopental, etomidato y alfaxalona-CD para minimizar la dosis necesaria de éstos. Esto beneficia a los pacientes al hacer menos abrupta la fase de inducción y reducir el potencial de efectos adversos cardiopulmonares. Diazepam, midazolam y lidocaína (sólo en perros) son los compuestos de coinducción más usados en especies pequeñas. La combinación de un agente de coinducción con propofol, tiopental, etomidato o alfaxalona-CD tiende a ser más útil en pacientes que no están profundamente sedados después del periodo preanestésico y cuando se anticipan mayores 284 Manual de anestesia y analgesia en. . Cuadro 8-4. Protocolos anestésicos IM seleccionadosa para perros Combinación Dosis IM en mg/kgb Dexmedetomidina 0.005 a 0.01 Ketamina 3–6 Opioide Véase el cuadro 8-2 Telazol® 2–10 Opioide Véase el cuadro 8-2 Dexmedetomidina 0.005 a 0.01 Telazol® 2a4 Opioide Véase el comentario b Reconstituir Tiletamina/Zolazepam (Telazol®), conforme al instructivo anexo en el empaque, y administrar el opioide por separado Para reducir el volumen inyectado, Telazol® también puede reconstituirse como sigue: 2.5 mL de dexmedetomidina más 2.5 mL de butorfanol (10 mg/mL) o 2.5 mL de hidromorfona (2 mg/mL) o 2.5 mL de morfina (15 mg/mL) La combinación se administra a razón de 0.02 a 0.04 mL/kg Los tiempos de recuperación pueden ser prolongados con cualquier protocolo IM basado en un agente disociativo. El uso del extremo inferior del intervalo de dosificación tiene como resultado sedación/inmovilización profundas, mientras que el uso del extremo superior produce anestesia general de duración variable. dosis de fármaco de inducción IV. Debe hacerse notar que si se ha administrado midazolam IM como parte de la medicación preanestésica, tal vez sea apropiado reducir o eliminar la dosis de benzodiazepina por vía IV como agente coinductor. Las dosis de los fármacos de inducción y coinducción inyectables e inhalables de uso común en perros y gatos se presentan en los cuadros 8-6 y 8-7. En el capítulo 2 puede consultarse información más detallada sobre farmacología, indicaciones y contraindicaciones de todos estos fármacos. En pacientes debilitados, hemodinámicamente inestables o ambas cosas, la inducción con un opioide (por lo regular fentanilo, remifentanilo, oximorfona o hidromorfona) combinado con una benzodiazepina (midazolam o diazepam) en incrementos IV alternantes hasta obtener el efecto deseado produce a menudo una inducción suave y facilita la transferencia a la fase de mantenimiento de la anestesia. Este método se revisa con más detalle en una sección posterior. Mantenimiento de la anestesia Los objetivos de la fase de mantenimiento de la anestesia en perros y gatos se resumen en el recuadro 8-3. A menos que se recurra a un protocolo de inducción con sustancias inyectables IM, la mayor parte de las intervenciones con más de 15 min de duración requiere más agentes anestésicos para extender o mantener la anestesia. Esto puede lograrse con anestésicos inyectables o inhalables. Cualquiera de los fármacos inyectables IV enumerados en la sección anterior puede usarse en dosis “una sobre otra” más pequeñas hasta obtener el efecto deseado, siempre que sólo sea necesario extender la anestesia unos cuantos minutos. No se recomienda la redosificación repetida con tiopental, ya que los sitios de redistribución pueden saturarse, lo que tiene como resultado una recuperación lenta. © Editorial El manual moderno Fotocopiar sin autorización es un delito. a Comentarios Puede administrarse dexmedetomidina y opioide primero y seguir con ketamina 10 min después Manejo anestésico de perros y. . . 285 Cuadro 8-5. Protocolosa anestésicos IM seleccionados para gatos Combinación Dexmedetomidina 0.01 a 0.02 Ketamina 5 a 10 Opioide Véase el cuadro 8-3 Telazol® 2 a 10 Opioide Véase el cuadro 8-3 Dexmedetomidina 0.005 a 0.01 Telazol® Opioide © Editorial El manual moderno Fotocopiar sin autorización es un delito. Dosis IM en mg/kgb 1a2 Telazol® 5 a 10 Ketamina 4a8 Opioide Véase el cuadro 8-3 Dexmedetomidina 0.002 a 0.004 Telazol® 2a4 Ketamina 1a3 Opioide Véase el cuadro 8-3 Ketamina 8 a 10 Midazolam 0.2 a 0.3 Opioide Véase el cuadro 8-3 Alfaxalona-CD 10 a 12 Opioide Véase el cuadro 8-3 b Reconstituir Telazol® conforme al instructivo anexo y administrar el opioide por separado Para reducir el volumen inyectado, el Telazol® también puede reconstituirse como sigue: 2a4 2.5 mL de dexmedetomidina más Véase el comentario 2.5 mL de butorfanol (10 mg/mL) o o el cuadro 8-3 2.5 mL de hidromorfona (2 mg/mL) o 2.5 mL de morfina (15 mg/mL) La combinación se administra a razón de 0.02 a 0.04 mL/kg Xilazina a Comentarios Pueden administrarse primero dexmedetomidina y opioide y seguirse con ketamina 10 min después Para reducir el volumen inyectado, el Telazol® puede reconstituirse como sigue: 4 mL de ketamina (100 mg/mL) más 1 mL de xilazina (100 mg/mL) La combinación se administra entonces a razón de 0.04 a 0.08 mL/kg y el opioide se administra por separado Para reducir el volumen inyectado, el Telazol® puede reconstituirse como sigue: 4 mL de ketamina (100 mg/mL) más 1 mL de dexmedetomidina (0.5 mg/mL) La combinación se administra entonces a razón de 0.02 a 0.04 mL/kg y el opioide se administra por separado Tal vez no sea apropiada para cirugía Los tiempos de recuperación pueden ser prolongados con cualquier protocolo IM basado en un agente disociativo. El uso del extremo inferior del intervalo de dosificación tiene como resultado sedación/inmovilización profundas, mientras que el uso del extremo superior produce anestesia general de duración variable. Si es necesario un mantenimiento más prolongado con agentes inyectables, el propofol se considera el fármaco de elección y puede administrarse como una infusión a ritmo constante (IRC) por periodos extendidos. Después de la medicación preanestésica e inducción IV apropiadas, las dosis de propofol en IRC para mantenimiento anestésico en perros y gatos oscilan entre 0.2 y 286 Manual de anestesia y analgesia en. . Fármacos de inducción y coinducción de anestesia en perros Fármacos de inducción inyectablesa Propofol Tiopental Midazolamb/ketamina Telazol® Etomidato Alfaxalona-CD Fármacos de coinducción Midazolamb Lidocaína Fármacos de inducción inhalables Sevoflurano (CAM, 2.3%) Isoflurano (CAM, 1.3%) Posibles combinaciones de los anterioresc Propofol solo Tiopental solo Telazol® solo Etomidato solo Alfaxalona-CD sola Midazolam/ketamina Sevoflurano solo Isoflurano solo Midazolam/propofol Midazolam/tiopental Midazolam/etomidato Midazolam/alfaxalona-CD a b c Dosis IV en mg/kg 2 a 10 5 a 15 0.1 a 0.4/3 a 10 2a8 0.5 a 2 1a3 Dosis IV en mg/kg 0.1 a 0.4 2a4 Concentración para inducción (%) 4a5 2.5 a 3.5 Lidocaína/propofol Lidocaína/tiopental Lidocaína/Telazol® Lidocaína/etomidato Lidocaína/alfaxalona-CD Lidocaína/midazolam/ketamina Midazolam/lidocaína/propofol Midazolam/lidocaína/tiopental Midazolam/lidocaína/etomidato Midazolam/lidocaína/alfaxalona-CD Midazolam/sevoflurano Midazolam/isoflurano Por lo general es factible usar el extremo inferior del intervalo de dosificación si se administró medicación preanestésica o si se incluyen agentes de coinducción. Puede sustituirse por diazepam a la misma dosis. Por lo regular se recomienda administrar los agentes de coinducción y ajustar de inmediato el fármaco de inducción principal hasta el efecto. 0.8 mg/kg/min y muchas veces se complementan con ketamina, midazolam, dexmedetomidina, opioides o alguna combinación de ellos, según esté indicado. En la actualidad, la mayoría de los hospitales para especies pequeñas está equipada con máquinas de anestesia que funcionan con fármacos inhalables, por lo cual la manera más común de mantener la anestesia en perros y gatos consiste en usar isoflurano o sevoflurano. Para intervenciones más prolongadas o más traumáticas, también es una práctica común complementar la anestesia por agentes inhalables con otros fármacos durante la fase de mantenimiento para reducir la necesidad de anestésicos inhalables una vez que se ha consumido la medicación preanestésica. Esto puede lograrse de varias maneras, como el empleo de anestesia local y regional o de técnicas analgésicas, o bien la administración de fármacos sistémicos complementarios como hidromorfona, oximorfona, morfina, fentanilo, remifentanilo, lidocaína, ketamina, midazolam y dexmedetomidina. Estas técnicas se revisan más adelante en este capítulo. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 8-6. Manejo anestésico de perros y. . . 287 Cuadro 8-7. Fármacos de inducción y coinducción de anestesia en gatos Fármacos anestésicos/de coinduccióna Propofol Tiopental Midazolamb/ketamina Telazol® Etomidato Alfaxalona-CD Fármacos de coinducción Midazolamb Fármacos anestésicos inhalables Sevoflurano (CAM, 2.6%) Isoflurano (CAM, 1.6%) Posibles combinaciones de los anterioresc Propofol solo Tiopental solo Telazol® solo Etomidato solo Alfaxalona-CD sola Midazolam/ketamina Sevoflurano solo a b c Dosis IV en mg/kg 4 a 10 5 a 15 0.1 a 0.3/3 a 10 2a8 0.5 a 2 2a5 Dosis IV en mg/kg 0.1 a 0.3 Concentración para inducción (%) 4.5 a 5.5 3a4 Isoflurano solo Midazolam/propofol Midazolam/tiopental Midazolam/etomidato Midazolam/alfaxalona-CD Midazolam/sevoflurano Midazolam/isoflurano Casi siempre es factible usar el extremo inferior del intervalo de dosificación si se administró medicación preanestésica o si se incluyen agentes de coinducción. Puede sustituirse por diazepam a la misma dosis. Por lo general se recomienda administrar los agentes de coinducción y ajustar de inmediato el fármaco de inducción principal hasta el efecto. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Recuadro 8-3. Objetivos de la fase de mantenimiento de la anestesia en perros y gatos • Mantener un nivel adecuado de inconciencia, analgesia y relajación muscular durante toda la intervención • Mantener una estabilidad cardiopulmonar adecuada • Facilitar el ajuste de la profundidad de la anestesia si está indicado • Asegurar una recuperación predecible sin fluctuaciones Recuperación tras la anestesia La recuperación anestésica ideal debe ser rápida, completa y sin estrés para el paciente. En casos seleccionados está indicado revertir los efectos de los anestésicos para favorecer la recuperación. Algunos fármacos susceptibles de reversión de uso común son dexmedetomidina (que se revierte con atipamezol), midazolam y diazepam (que se revierten con flumazenilo), y opioides agonistas (que se revierten con antagonistas puros como naloxona o el agonista–antagonista butorfanol). En otras situaciones, puede requerirse sedación complementaria con dosis bajas de dexmedetomidina, acepromazina o midazolam para prevenir o tratar disforia o agitación. En todos los casos, el control del dolor debe ser una prioridad y los analgésicos posanestésicos de uso más común son opioides y AINE. En ocasiones también están indicados coadyuvantes de analgésicos como parte del plan de analgesia. En los cuadros 8-8 y 8-9 se presentan las dosis recomendadas para analgésicos posoperatorios inyectables orales. 288 Manual de anestesia y analgesia en. . Cuadro 8-8. Analgésicos posoperatorios inyectables en perros y gatos Fármaco Perros (mg/kg) Gatos (mg/kg) Opioides: Hidromorfona 0.05 a 0.2 IM, SC 0.05 a 0.1 IV 0.05 a 0.1 IM, SC, IV Oximorfona 0.05 a 0.2 IM, SC 0.05 a 0.1 IV 0.05 a 0.1 IM, SC, IV Morfina 0.3 a 1.0 IM, SC 0.1 a 0.3 IM, SC o IV lentamente 0.3 a 0.5 IV lentamente 0.1 a 0.2 IV dosis de carga seguida de 0.1 a 0.3 IV IRC/h Butorfanol 0.2 a 0.4 IM o IV 0.2 a 0.4 IM o IV Buprenorfina 0.005 a 0.02 IM 0.005 a 0.02 IM 0.005 a 0.01 IV 0.005 a 0.01 IV a Fentanilo 0.002 a 0.003 IV dosis de carga se- 0.002 a 0.003 IV dosis de carga seguida de 0.001 a 0.01 IV IRC/h guida de 0.001 a 0.01 IV, IRC/h AINE: Carprofeno 4.0 IM, SC, IV c/24 h Meloxicam 0.2 IM, SC, IV dosis de carga, luego 0.1 a 0.2 SC reducir a 0.1 c/24 h También puede administrarse por vía transdérmica a razón de 0.002 a 0.005 mg/kg/h. Es importante recordar que la vigilancia del paciente y la institución de cuidados sintomáticos no terminan al concluir la administración de anestésicos. Todos los pacientes se benefician de la inhalación de oxígeno complementario en la fase de recuperación inmediata para contrarrestar la hipoxemia. En animales sanos anestesiados para intervenciones breves, esto puede considerarse opcional, pero en sujetos con defectos de las vías respiratorias o deterioro de la oxigenación, la ventilación o ambas, debe proporcionarse oxígeno complementario. La oximetría de pulso es en particular útil para detectar hipoxemia en pacientes durante la transición de concentraciones de oxígeno inspirado de >90 a 21%. El paciente debe observarse de cerca hasta que pueda mantener el decúbito esternal y los signos vitales se vigilan hasta que vuelvan a la normalidad. En sujetos en estado crítico o con inestabilidad hemodinámica pueden estar indicados vigilancia intensiva y cuidados sintomáticos por un periodo extendido. Otras complicaciones posanestésicas que pueden encontrarse son hipotermia, hipertermia, obstrucción de vías respiratorias y aspiración de contenido gastroesofágico regurgitado. Selección de fármacos: factores relacionados con el paciente Muchos de los factores relacionados con el paciente que deben considerarse se exponen en otras partes de este texto y se remite al lector a los capítulos 11 a 17, en los que está disponible más información. A continuación se presentan algunas consideraciones especiales, ya que se vinculan con la selección de fármacos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. a 1.0 IM, SC, IV una vez al día Manejo anestésico de perros y. . . 289 Cuadro 8-9. Fármaco Analgésicos posoperatorios orales en perros y gatos Perros (mg/kg) Gatos (mg/kg) AINE: Carprofeno 4.0 VO c/24 h 1.0 VO sólo una vez (duración variable) Meloxicam 0.2 VO, luego reducir a 0.1 c/24 h 0.1 a 0.2 SC sólo una vez (EUA) Deracoxib 3.0 a 4.0 VO c/24 h por cinco a siete No establecida días o 1.0 a 2.0 VO c/24 h de manera crónica Firocoxib 5.0 VO c/24 h Tepoxalina 10 a 20 VO, luego reducir a 10 c/24 h No establecida No establecida Opioides: Morfinaa 1.5 a 3.0 VO c/12 h No recomendada Codeína 0.5 a 2.0 VO c/6 h 0.2 a 0.5 VO c/6 h Oxicodona 0.1 a 0.3 c/8 a 12 h No recomendada Coadyuvantes de 5 a 10 VO c/8 a 12 h analgésicos: 5 a 10 VO c/8 a 12 h Tramadol 2 a 10 VO c/8 a 12 h 2 a 10 VO c/8 a 12 h Gabapentina 3 a 5 VO c/24 h 3 a 5 VO c/24 h © Editorial El manual moderno Fotocopiar sin autorización es un delito. a Productos de liberación sostenida (MS Contin, Purdue Pharma L.P., Stamford, CT). Diferencias entre especies: gatos y perros En general, los gatos tienden a requerir dosis más altas de sedantes (sobre una base de kilogramo por kilogramo) que los perros para experimentar un efecto clínico comparable. Esto se debe en gran medida a su mayor relación área de superficie corporal (ASC)/masa, pero también refleja la variación entre especies en densidad de receptores del sistema nervioso central. Cuando se calculan con base en ASC, y no en peso corporal, las dosis clínicamente eficaces de dexmedetomidina y acepromazina tienden a ser similares en perros y gatos. Esto explica también por qué los perros de razas grandes y gigantes requieren dosis menores sobre una base de kilogramo por kilogramo que los de razas pequeñas y toy. Mientras que el midazolam produce casi siempre un ligero efecto sedante o calmante en los perros, en los gatos la respuesta es impredecible. En gatos sanos jóvenes, la administración de midazolam solo o con un opioide puede causar excitación y en realidad hacer al paciente más difícil de tratar. Sin embargo, en gatos maduros, debilitados o ambas cosas, la combinación de una benzodiazepina y un opioide puede tener un efecto calmante deseable sin efectos adversos cardiopulmonares. Respecto de los opioides, de manera tradicional se ha considerado que los gatos son más propensos a respuestas excitatorias cuando se administran opioides agonistas puros como morfina e hidromorfona a animales sin dolor en el periodo preanestésico. En consecuencia, en dicho periodo los opioides se administran más a menudo a gatos sanos jóvenes en combinación con un sedante como acepromazina o dexmedetomidina. Debe hacerse notar que esta respuesta excitatoria no suele ser evidente cuando se administran dosis apropiadas de opioides agonistas puros a felinos con debilidad o dolor a causa de enfermedad, dolor u operación. 290 Manual de anestesia y analgesia en. . Pacientes agresivos El temperamento del sujeto tiene una participación importante en la selección de anestésicos. Los animales que sólo están atemorizados o ansiosos reaccionan con frecuencia de modo favorable a los protocolos de sedante y analgésico habituales cuando se les proporciona un lugar seguro y tranquilo para reposar mientras los fármacos hacen efecto. Sin embargo, es posible que los sujetos en verdad agresivos no sean sedados de manera adecuada para permitir el manejo seguro con las combinaciones habituales de fármacos. En estos casos muchas veces es eficaz una combinación IM de dexmedetomidina–opioide en el extremo superior del intervalo de dosificación recomendado o más (cuadros 8-2 y 8-3). En algunas ocasiones es necesario un protocolo basado en un fármaco disociativo por vía IM para inducir sedación e inmovilización adecuadas (cuadros 8-4 y 8-5). En general, las combinaciones acepromazina–opioide y en particular midazolam–opioide no son sedantes confiables en perros y gatos extremadamente agresivos. En la mayor parte de las situaciones, el objetivo de la administración IM de fármacos a un paciente agresivo es facilitar el manejo seguro y una exploración física exhaustiva y permitir ajustar las dosis de anestésicos IV adicionales hasta el efecto, si es necesario. Pacientes geriátricos En general, los animales geriátricos tienden a ser más susceptibles a los efectos depresivos de sedantes y anestésicos que los sujetos más jóvenes. Por esta razón, a menudo las dosis de sedantes se reducen en gran medida o se eliminan del todo en ellos. Según sea el temperamento del animal, opioides y benzodiazepinas producen con frecuencia sedación y analgesia adecuadas sin causar depresión notable del funcionamiento cardiopulmonar. La incorporación de opioides con o sin benzodiazepinas también reduce las dosis necesarias de anestésicos inyectables e inhalables y mejora la estabilidad cardiopulmonar. En pacientes geriátricos debilitados, deprimidos o con inestabilidad hemodinámica, la combinación de un opioide (fentanilo, remifentanilo, hidromorfona u oximorfona) con una benzodiazepina (midazolam o diazepam) ajustados por vía IV conforme al efecto es adecuada para inducir anestesia general y facilitar la transferencia suave a un agente inhalable. La decisión de incluir un anticolinérgico (p. ej., atropina o glucopirrolato) debe efectuarse sobre una base caso por caso. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Pacientes sanos jóvenes Es importante reconocer que las dosis publicadas para la mayor parte de los sedantes y anestésicos inyectables o inhalables se basan en estudios en animales sanos jóvenes que tienen peso corporal normal. Existen numerosos fármacos solos y combinados que son apropiados para su uso en esta población de pacientes; pueden encontrarse ejemplos en los cuadros 8-2 a 8-7. En general, la mayoría de estos casos se beneficia de un protocolo anestésico equilibrado que incorpore una combinación de sedante y analgésico administrados como medicación preanestésica, uno o más anestésicos inyectables para inducción, y un agente inhalable para mantener la anestesia. El empleo preventivo sistemático de un anticolinérgico (p. ej., atropina o glucopirrolato) como parte de la medicación preanestésica es un tanto controvertido y se practica cada vez menos en la veterinaria clínica de pequeñas especies. En la actualidad, muchos anestesiólogos recomiendan un enfoque de observación expectante, en el cual los parámetros cardiovasculares se vigilan de cerca y se administra un anticolinérgico si está indicado. Las necesidades de analgesia varían demasiado en esta población de pacientes, y el plan analgésico debe formularse sobre una base caso por caso. Manejo anestésico de perros y. . . 291 Pacientes neonatales o pediátricos Los pacientes neonatales y pediátricos son los perros y gatos de menos de 12 semanas de edad. Como los animales geriátricos, los neonatos son más susceptibles a los efectos depresores de sedantes y anestésicos que los jóvenes a adultos maduros. Además, es más probable que sufran hipotermia, hipoglucemia o ambas, de tal modo que deben estar a la mano las medicas para evitar o tratar estas complicaciones. Los fármacos de acción breve o reversible revisten especial utilidad y son de uso común dosis bajas de opioides, benzodiazepinas, fármacos disociativos, propofol y agentes inhalables. Rara vez están indicadas acepromazina y dexmedetomidina. Ésta es una de las pocas circunstancias en las que casi siempre se recomienda la administración preventiva de un anticolinérgico para contrarrestar la bradicardia y mantener el gasto cardiaco. Riesgos anestésicos relacionados con la raza En la medicina veterinaria y entre los criadores son lugar común los mitos e ideas erróneas acerca de sensibilidades específicas de raza a diversos fármacos o técnicas de anestesia. A pesar del volumen de información que puede encontrarse en internet y la bibliografía para legos en relación con las distintas razas, muy pocas de estas opiniones populares se han fundamentado alguna vez en pruebas científicas. En realidad, sólo hay unos cuantos riesgos específicos de raza reales. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sabuesos y tiobarbitúricos. Por lo regular se recomienda evitar los tiobarbitúricos (p. ej., tiopental) en sabuesos y otros perros oteadores debido a la posibilidad de recuperación prolongada e irregular. Puede emplearse cualquier otro agente inyectable o inhalable (cuadro 8-6) para la inducción de anestesia, de acuerdo con los otros factores vinculados con el paciente o la intervención. Perros braquicefálicos y obstrucción de vías respiratorias superiores. Los defectos anatómicos de las vías respiratorias superiores son comunes en perros braquicefálicos, sobre todo el buldog inglés, y causan una constelación de signos llamada síndrome de vías respiratorias braquicefálicas. Debido al potencial de obstrucción de vías respiratorias en el periodo perianestésico, estos perros presentan un mayor riesgo anestésico incluso si por lo demás son sanos. Asimismo, muchas razas braquicefálicas tienen al parecer un alto tono vagal en reposo, de tal modo que está indicada la administración preventiva de un anticolinérgico. La selección de fármacos en estos pacientes debe incluir uno o más anestésicos inyectables para facilitar la inducción rápida y la pronta intubación endotraqueal. Las inducciones con mascarilla mediante fármacos inhalables no son apropiadas en estos sujetos. Bóxers y acepromazina. Algunos perros bóxer pueden experimentan una mayor respuesta o una respuesta vasovagal excesiva a la acepromazina. Aunque no se han realizado estudios controlados, existen informes anecdóticos de colapso cardiovascular en perros bóxer al parecer sanos a los que se les administraron dosis estándares de acepromazina. Por esta razón, muchos anestesiólogos recomiendan cautela cuando utilizan acepromazina en esta raza, y algunos proponen evitarla por completo. Pacientes con traumatismo o inestabilidad hemodinámica Como en cualquier paciente, corregir defectos preexistentes antes de la anestesia se vincula con mejores resultados. El acceso IV debe asegurarse desde el principio y todos los fármacos sedantes, 292 Manual de anestesia y analgesia en. . analgésicos y anestésicos deben administrarse por esta vía. Casi siempre están contraindicados los sedantes potentes con efectos adversos cardiopulmonares significativos, como acepromazina y dexmedetomidina. Muchos pacientes traumatizados o hemodinámicamente inestables tienen taquicardia en la presentación y rara vez están indicados los anticolinérgicos. Opioides agonistas puros y benzodiazepinas forman la base de la mayor parte de los protocolos anestésicos para estos pacientes y se complementan con dosis bajas de agentes inyectables o inhalables. Es obligatoria la vigilancia cardiopulmonar expectante y con frecuencia se requieren intervenciones sintomáticas drásticas. En los cuadros 8-10 y 8-11 se presentan ejemplos de protocolos de inducción y mantenimiento. Afecciones preexistentes Los pacientes con afecciones preexistentes exigen anestesia por razones relacionadas o no con su proceso patológico. Pueden verse afectados los aparatos o sistemas cardiovascular, respiratorio, hepático, renal, digestivo, endocrino o nervioso central, y no son raras las anomalías que afectan múltiples aparatos o sistemas. Según sea el estado patológico, la capacidad de reserva de uno o más aparatos o sistemas puede verse afectada, lo cual hace a estos pacientes más susceptibles Fármacos Dosis IV en mg/kg Opioides agonistas puros Fentanilo Remifentanilo Hidromorfona Oximorfona 0.005 a 0.01 0.006 a 0.012 0.05 a 0.1 0.05 a 0.1 Benzodiazepinas Midazolama Lidocaína 0.1 a 0.3 2 a 4 (sólo perros) Anestésicos inyectables Propofol en dosis bajas Ketamina en dosis bajas Etomidato en dosis bajas 1a3 3a5 0.3 a 1 Posibles combinaciones de los anteriores Opioide/midazolamb Opioide/midazolam/propofol en dosis bajas Opioide/midazolam/lidocaína/propofol en dosis bajas Opioide/midazolam/ketamina en dosis bajas Opioide/midazolam/lidocaína/ketamina en dosis bajas Opioide/midazolam/etomidato en dosis bajas Opioide/midazolam/lidocaína/etomidato en dosis bajas a b Puede sustituirse por diazepam en las mismas dosis. Repetir en incrementos alternantes para lograr el efecto hasta que sea posible la intubación; para todas las demás combinaciones, administrar opioide y agente de coinducción y luego ajustar propofol, ketamina o etomidato IV hasta el efecto. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Cuadro 8-10. Protocolos de inducción para pacientes con traumatismo o inestabilidad hemodinámica Manejo anestésico de perros y. . . 293 Cuadro 8-11. Protocolos de mantenimiento anestésico para pacientes con traumatismo o inestabilidad hemodinámica Fármacos Dosis IV, IRC en mg/kg/h Anestésicos inhalables Isoflurano en dosis bajas Sevoflurano en dosis bajas Administrar según el efecto Administrar según el efecto Opioides agonistas puros Fentaniloa,d Remifentanilob,d 0.005 a 0.05 0.006 a 0.06 Benzodiazepina Midazolam 0.2 a 0.4 Anestésico local Lidocaínac 3 a 12 (sólo perros) Fármacos disociativos Ketamina 0.1 a 1 Posibles combinaciones de los anteriores Fármaco inhalable en dosis bajas con uno o más agentes complementarios Fentanilo o remifentanilo con uno o más agentes complementarios no opioides a b c © Editorial El manual moderno Fotocopiar sin autorización es un delito. d Por lo regular después de una dosis de carga de 0.002 a 0.003 mg/kg IV. Por lo general después de una dosis de carga de 0.003 a 0.004 mg/kg IV. Casi siempre después de una dosis de carga de 1 a 2 mg/kg IV; reducir la IRC al extremo inferior del intervalo de dosificación luego de 1 h. Se usan IRC más lentas para complementar la analgesia y reducir las necesidades de agentes inhalables; ritmos mayores producen analgesia profunda adecuada para cirugía; se requiere apoyo ventilatorio a mayores tasas de dosificación. a efectos secundarios relacionados con la administración de anestésicos. La anestesia general también tiene el riesgo de causar descompensación de un estado patológico antes compensado. La selección de un protocolo farmacológico apropiado debe implicar una comprensión básica de enfermedad, fisiopatología y modo en que fármacos específicos modifican el aparato o sistema en cuestión. Es posible la depresión profunda del sistema nervioso central y el aparato respiratorio con la administración de sedantes y dosis altas de anestésicos inyectables e inhalables, pero las recomendaciones específicas varían de acuerdo con el tipo de enfermedad. Selección de fármacos: factores relacionados con la intervención Las indicaciones para administrar sedantes, analgésicos y anestésicos en perros y gatos son numerosas y diversas. Comprender la intervención por realizar, incluido su grado de penetración corporal y la posibilidad de inducir dolor, así como su duración, tendrá un efecto significativo en el protocolo farmacológico y la selección de la técnica clínica. 294 Manual de anestesia y analgesia en. . Grado de penetración corporal de la intervención Intervenciones de mínimo traumatismo que requieren anestesia general. Esta categoría incluye intervenciones como tomografía computarizada (TC), resonancia magnética nuclear (RMN), limpieza dental y endoscopia. En perros y gatos, estas intervenciones necesitan un grado de relajación y cooperación del paciente que no es posible sólo con sedación y analgesia, y por lo regular está indicada la anestesia general. Aunque estas intervenciones son breves y relativamente atraumáticas, es importante recordar que cada vez que un paciente se somete a anestesia general, sin importar cuál sea el procedimiento a realizar, es obligatorio vigilar la profundidad de la anestesia y el funcionamiento cardiopulmonar. En la mayoría de los casos se recomienda un protocolo anestésico equilibrado, casi siempre con alguna forma de medicación preanestésica. Aunque el dolor no es un componente importante de la mayor parte de estas intervenciones, a menudo se incluyen opioides en la medicación preanestésica para mejorar la sedación y reducir la cantidad necesaria de fármacos de inducción y mantenimiento. En la mayoría de los casos se recomienda el cateterismo IV y las decisiones acerca de manejo de las vías respiratorias y otros tipos de cuidados paliativos, como fluidoterapia, dependen en gran medida del tiempo de la intervención y los riesgos relacionados con ésta y con el paciente. En los cuadros 8-2 a 8-7 se presentan las dosis para preanestesia, inducción y mantenimiento. Intervenciones traumáticas relacionadas con dolor leve a moderado. Esta categoría incluye intervenciones quirúrgicas como castración, lumpectomía menor y extracciones dentales menores. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Intervenciones sin penetración corporal que requieren cooperación del paciente. Esta categoría incluye procedimientos diagnósticos como radiografías y ultrasonido e intervenciones terapéuticas como cambios de vendajes. Para estos procedimientos rápidos es suficiente una combinación de sedante y analgésico similar a la que se usaría como medicación preanestésica. Sin embargo, en determinados pacientes está indicada la anestesia general con anestésicos inyectables o inhalables. Aunque puede no haber dolor, muchas veces se recomienda incluir un opioide en el protocolo con fines de sinergia con el sedante y optimizar el nivel de sedación. No está indicada la colocación de un catéter IV para sedación y analgesia regulares, pero tal vez sea recomendable en pacientes en los que son más probables efectos secundarios. Como la medicación preanestésica IV, estas combinaciones se administran 15 a 20 min antes de la intervención planeada y el animal se deja en un sitio tranquilo sin perturbarlo mientras los fármacos alcanzan su efecto máximo. En otras situaciones se prefiere la administración IV si el paciente la tolera. Por lo regular están indicadas dosis menores si se utiliza la vía IV y el efecto máximo se alcanza en 2 a 5 min. La duración del efecto es variable, de acuerdo con la combinación, la dosis y la vía de administración, pero en la mayoría de los casos es de 45 min a 2 h. El uso de dexmedetomidina ofrece la ventaja de la reversibilidad con atipamezol, lo que facilita una recuperación pronta y predecible. En la mayoría de los casos no es necesario revertir el opioide. La decisión de coadministrar un anticolinérgico con la combinación de sedante y analgésico debe tomarse caso por caso. Los lineamientos para seleccionar combinaciones de sedante y analgésico son en esencia los mismos que para elegir la medicación preanestésica, y se presentan en la figura 8-3. Las recomendaciones de dosificación también son similares a las usadas para la medicación preanestésica (cuadros 8-2 y 8-3). Según sean el temperamento del animal y la intervención planeada, tal vez estén indicadas dosis para sedación y analgesia en el extremo superior del intervalo preanestésico recomendado o por arriba de él si el paciente no está programado para anestesia general. Manejo anestésico de perros y. . . 295 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Estos procedimientos necesitan anestesia general con consideración adicional del manejo del dolor perioperatorio. Una intervención quirúrgica particular, como una ovariohisterectomía, puede causar dolor leve, moderado o intenso, según sean el cirujano, la presencia de dolor preexistente no relacionado con la intervención y la tolerancia al dolor del animal específico. Estos factores deben tomarse en cuenta al diseñar un plan terapéutico y, en caso de cualquier interrogante, debe darse al paciente el beneficio de la duda. Por lo regular se recomiendan colocación de un catéter IV, intubación endotraqueal y fluidoterapia para todas las intervenciones, salvo las más breves. La selección de fármacos para las fases preanestésica, de inducción y de mantenimiento depende de factores relacionados con el paciente y la duración de la operación. Para intervenciones relacionadas sólo con dolor leve a moderado basta la administración de un opioide agonista–antagonista (p. ej., butorfanol) o agonista parcial (p. ej., buprenorfina). Para procedimientos que pueden causar cuando menos dolor moderado es recomendable considerar un opioide agonista puro (p. ej., hidromorfona, oximorfona o morfina). Además de los opioides, también son de uso común los AINE para el dolor perioperatorio, si se asume que no hay contraindicaciones para su uso. El AINE puede administrarse de manera preventiva o durante la fase de recuperación, y muchas veces se suministran dosis adicionales por varios días en el posoperatorio. Las técnicas anestésicas o analgésicas locales y regionales son apropiadas en algunos casos, y deben incluirse cuando sea posible. En la figura 8-3 se presentan lineamientos para la selección de combinaciones de sedante y analgésico, y en los cuadros 8-2 a 8-7 dosis recomendadas de agentes preanestésicos, de inducción y de mantenimiento. Intervenciones con penetración corporal relacionadas con dolor moderado a intenso. Esta categoría incluye anestesia para cualquier operación mayor y en el caso de un paciente con dolor significativo preexistente por enfermedad, lesión o traumatismo. Todas las consideraciones enumeradas en la sección anterior son pertinentes aquí; sin embargo, el anestesiólogo debe reconocer la necesidad de tratar de manera proactiva y drástica el dolor en la totalidad de los periodos preoperatorio, intraoperatorio y posoperatorio. Un enfoque multimodal para el abordaje del dolor que incorpore diversos fármacos y técnicas analgésicos es la mejor manera de conseguirlo. En general, los opioides agonistas–antagonistas o agonistas parciales (p. ej., butorfanol y buprenorfina) no son opciones apropiadas para el tratamiento del dolor moderado a intenso en la mayoría de los pacientes. Los opioides agonistas puros (p. ej., morfina, hidromorfona, oximorfona y fentanilo) son los opioides se elección para el tratamiento del dolor perioperatorio en estos casos, y pueden administrarse por diversas vías, por ejemplo IM intermitente, SC, IV, IRC, epidural o transdérmica. Los opioides son un componente necesario de la medicación preanestésica en esta población de pacientes, y con frecuencia se administran dosis complementarias durante toda la intervención si es prolongada. Los opioides también se usan en el periodo posoperatorio inmediato y se continúan al menos por las primeras 24 h después de la operación. En algunos casos, las necesidades de opioide posanestésico persisten por días o incluso semanas. Además de opioides, otros fármacos complementarios como lidocaína y ketamina son de empleo común durante la fase de mantenimiento. En el cuadro 8-12 se presentan dosis y posibles combinaciones. Las técnicas anestésicas y analgésicas locales y regionales también son coadyuvantes comunes de la anestesia general. Véase en el recuadro 8-4 una lista de técnicas comunes en perros y gatos. Si no está contraindicado, a menudo se incluye un AINE en el plan analgésico, y puede continuarse por varios días en el posoperatorio (véanse los cuadros 8-9 y 8-10). 296 Manual de anestesia y analgesia en. . Cuadro 8-12. Analgésicos sistémicos complementarios que pueden usarse durante la fase de mantenimiento de la anestesia Fármacos Opioides agonistas puros Hidromorfona Oximorfona Fentaniloa,e Remifentanilob,e Morfinac Anestésico local Lidocaínad Fármaco disociativo Ketamina Dosis IV en mg/kg 0.05 a 0.1 c/4 h 0.05 a 0.1 c/4 h IRC de 0.002 a 0.05/h IRC de 0.003 a 0.06/h IRC de 0.1 a 0.3/h (por lo regular sólo perros) IRC de 3 a 12/h (sólo perros) IRC de 0.1 a 1/h Posibles combinaciones de los anteriores para uso con un agente inhalable o propofol, IRC Opioide solo Lidocaína sola Opioide/lidocaína Opioide/lidocaína/ketamina Opioide/ketamina b c d e Por lo general después de una dosis de carga de 0.002 a 0.003 mg/kg IV. Casi siempre después de una dosis de carga de 0.003 a 0.004 mg/kg IV. Por lo regular después de una dosis de carga de 0.1 a 0.2 mg/kg IV lenta. Por lo general después de una dosis de carga de 1 a 2 mg/kg IV; reducir IRC al extremo inferior del intervalo de dosificación en 1 h. Se usan menores tasas de IRC para complementar la analgesia y reducir las necesidades de agentes inhalables; tasas más altas producen analgesia profunda adecuada para cirugía; se requiere apoyo ventilatorio a mayores tasas de dosificación. Recuadro 8-4. Técnicas anestésicas y analgésicas locales y regionales de uso común en perros y gatos • • • • • • • • • • Anestesia–analgesia epidurales Bloqueos de nervios mandibulares y maxilares (para intervenciones dentales) Bloqueos de parte distal de la extremidad para oniquectomía en gatos Bloqueos de plexo braquial Bloqueos de nervios de parte proximal de extremidad posterior (femoral, peroneal) Infiltración anestésica local continua Anestesia interpleural Bloqueos de nervios intercostales Anestesia regional IV Bloqueos de nervios proximales de la extremidad anterior (radial, mediano, cubital, musculocutáneo) © Editorial El manual moderno Fotocopiar sin autorización es un delito. a Manejo anestésico de perros y. . . 297 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Duración de la operación Intervenciones breves que duran menos de 15 min. En esta categoría se clasifican de manera arbitraria todas las intervenciones de anestesia general, sean quirúrgicas o de otros tipos, que duren menos de 15 min. Aún se recomienda la medicación preanestésica con una combinación de sedante y analgésico para la mayoría de los pacientes programados para intervenciones breves, ya que reduce la necesidad de anestésico inyectable. Los fármacos de efecto breve o reversible (o ambas cosas) son preanestésicos útiles, ya que no prolongan en grado significativo la recuperación. Las necesidades analgésicas varían en relación con el paciente y la intervención, y se han abordado en secciones previas. Por lo general se administra medicación preanestésica IM o SC, pero también puede aplicarse por vía IV si las características del paciente lo permiten. La mayoría de los anestésicos inyectables (tiopental, propofol, ketamina–benzodiazepina, etomidato, Telazol®, alfaxalona-CD) es apropiada para inducción y mantenimiento por periodos muy breves (es decir, 5 a 15 min). En consecuencia, no está indicada la transferencia a un anestésico inhalable. En pacientes seleccionados, tal vez sea apropiada la inducción con mascarilla o en cámara mediante isoflurano o sevoflurano seguida de una fase de mantenimiento muy breve, pero este método no se recomienda para uso regular. Si bien se prefiere la vía IV para la administración de anestésicos inyectables por las razones que ya se expusieron, la vía IM con un protocolo basado en un agente disociativo es una opción si el paciente no puede tratarse de otra manera. Debe recordarse que la fase de recuperación es significativamente más prolongada si se utiliza la vía IM. Véanse las recomendaciones sobre medicación preanestésica, fármacos de inducción y analgésicos en los cuadros 8-2 a 8-7. En casi cualquier situación se recomienda colocar un catéter IV antes de la inducción con un anestésico IV. La intubación endotraqueal se considera opcional en pacientes por lo demás sanos anestesiados para intervenciones muy breves, pero los sujetos con vías respiratorias de alto riesgo (p. ej., perros braquicefálicos) siempre deben intubarse. Incluso si la intubación no es parte del plan anestésico, el anestesiólogo debe estar preparado para colocar una sonda endotraqueal de inmediato en caso de alguna complicación. Esto significa que debe tenerse acceso inmediato a sondas endotraqueales, laringoscopio y un medio de ventilación a presión positiva (p. ej., bolsa Ambú o máquina de anestesia y sistema de respiración) de tamaño apropiado. En la mayoría de los casos en que el equilibrio hídrico es por lo demás normal, no está indicada la fluidoterapia durante la intervención en sí. Sin embargo, en animales con trastornos del equilibrio hídrico, un plan de fluidoterapia que cubra las necesidades del paciente es parte obligatoria del plan anestésico, incluso para anestesia de duración breve. Instrumentar al paciente con numerosas piezas de equipo de vigilancia no es práctico para intervenciones que duren menos de 15 min, y en realidad puede demorar en inicio de la operación. No obstante, siempre es obligatorio vigilar la profundidad de la anestesia y los parámetros cardiopulmonares básicos, y es útil incluir uno o dos equipos clave de vigilancia como oximetría de pulso, medición no traumática de la presión arterial, o capnometría (si el paciente está intubado). Es importante recordar que los animales anestesiados con fármacos inyectables respiran aire ambiental (es decir, oxígeno al 21%), a menos que se les proporcione una fuente complementaria de oxígeno. En estas circunstancias, es mucho más probable que la hipoventilación cause desaturación e hipoxemia respecto de cuando el paciente está intubado e inspira oxígeno casi al 100%. En el caso de sujetos anestesiados que inspiran aire ambiental, la oximetría de pulso puede ser en particular útil para detectar hipoxemia antes de que el paciente presente cianosis clínica. En esta 298 Manual de anestesia y analgesia en. . situación, el tratamiento puede implicar suministro de oxígeno complementario por mascarilla facial o, si el paciente tiene bradipnea o apnea, intubación endotraqueal inmediata y ventilación a presión positiva con oxígeno al 100%. Intervenciones de larga duración (más de 60 min). Esta categoría incluye cualquier intervención de anestesia general, quirúrgica o de otro tipo, que dure más de 1 h. Las consideraciones sobre medicación preanestésica, inducción y analgesia son en esencia las mismas que ya se expusieron. En el caso de intervenciones prolongadas, la selección de un anestésico apropiado para la fase de mantenimiento resulta cada vez más importante. En la mayoría de los pacientes que requieren anestesia prolongada, los agentes inhalables como isoflurano y sevoflurano son los fármacos de elección para el mantenimiento ya que tienen una recuperación rápida y predecible. Cateterismo IV, intubación endotraqueal y fluidoterapia IV son requisitos habituales y otras intervenciones complementarias están indicadas para determinados pacientes o situaciones clínicas. Si bien es necesario vigilar profundidad de la anestesia y funcionamiento cardiopulmonar en todos los pacientes sometidos a anestesia general, el nivel de atención de vigilancia suministrado se hace cada vez más importante conforme aumenta el tiempo de la operación. De manera sistemática están indicadas modalidades de vigilancia como capnometría, medición de la presión arterial, oximetría de pulso, electrocardiografía y temperatura corporal. Otras modalidades que son útiles en casos específicos son análisis de gas en vías respiratorias y en sangre, medición de la presión venosa central, medición del gasto cardiaco y valoración en busca de bloqueo neuromuscular. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Intervenciones de duración intermedia (15 a 60 min). Esta categoría incluye cualquier intervención de anestesia general, quirúrgica o de otros tipos, que dure entre 15 min y 1 h. Las consideraciones para medicación preanestésica, inducción y analgesia son en esencia las mismas que ya se expusieron. Respecto de las intervenciones breves, la principal diferencia es que deben administrarse fármacos adicionales después de la inducción para ampliar la fase de mantenimiento de la anestesia. En la mayoría de los casos, esto se logra al cambiar al paciente a un anestésico inhalable como isoflurano o sevoflurano. De manera alternativa, también es posible el mantenimiento con un fármaco inyectable como propofol administrado en IRC. En todos estos pacientes deben realizarse cateterismo IV e intubación endotraqueal. Los pacientes que reciben anestesia IV total con IRC de propofol por más de 15 min también deben intubarse para proteger las vías respiratorias. Asimismo se recomienda suministrar oxígeno complementario, dado que es común la hipoventilación y puede tener como resultado hipoxemia si los pacientes inspiran aire ambiental. Todos los sujetos anestesiados por más de 15 a 20 min se benefician de la fluidoterapia IV sistemática, y aquéllos con defectos del equilibrio hídrico preexistentes necesitan tratamiento más radical. Como en todos los casos, es estándar la vigilancia básica de profundidad de la anestesia y parámetros cardiopulmonares. Además, el uso de equipo de vigilancia como capnometría, medición de la presión arterial, oximetría de pulso, electrocardiografía y temperatura corporal suministra información adicional que facilita el manejo óptimo del caso. Son comunes complicaciones como hipotensión e hipoventilación incluso en pacientes sanos jóvenes a los que se les administran dosis razonables de anestésicos estándares. Comprender los principios de la vigilancia del paciente y el funcionamiento del equipo de vigilancia regular hace más fácil reconocer y corregir los trastornos antes de que pongan la vida en peligro. Manejo anestésico de perros y. . . 299 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Registros El registro anestésico es un documento legal que forma parte del expediente médico permanente del individuo. Permite al anestesiólogo documentar tendencias durante la intervención y tomar decisiones de manejo informadas. También facilita la valoración retrospectiva del plan anestésico y analgésico, de tal modo que puedan hacerse cambios apropiados en operaciones futuras de ser necesario. Revisado a partir de “Dogs and Cats” por Richard M. Bednarski in Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 9 Anestesia e inmovilización de mamíferos pequeños Paul A. Flecknell, Claire A. Richardson, Aleksandar Popovic, Rachael E. Carpenter y David B. Brunson Introducción La anestesia de mamíferos pequeños representa algunos desafíos singulares para los anestesiólogos veterinarios. Además de los factores habituales que deben considerarse cuando se selecciona un plan anestésico, es necesario ponderar las interacciones potenciales entre el anestésico y las necesidades particulares del protocolo de investigación al trabajar en medicina de animales de laboratorio. Es importante revisar el régimen anestésico propuesto con el grupo de investigación y tratar de indicar cualesquiera propiedades farmacológicas específicas del anestésico que puedan ser relevantes. Consideraciones generales Casi todos los animales de laboratorio son adultos sanos jóvenes, aunque en algunas circunstancias se recurre a animales enfermos. Los veterinarios de laboratorio deben ser capaces de proporcionar información sobre el estado de salud de los animales y la incidencia de enfermedad clínica y subclínica. En la mayor parte de los laboratorios es preciso que los animales pasen por un periodo de aclimatación, por lo general de una a dos semanas, antes de intervenir en investigaciones. Esto ofrece una excelente oportunidad para que se habitúen a la manipulación y la sujeción. También concede tiempo al anestesiólogo y el personal que atiende a los especímenes para valorar el comportamiento y el temperamento de los animales, realizar una revisión clínica general y obtener datos básicos, como rapidez de crecimiento y consumo de alimento y agua. Esta información tiene valor considerable al valorar la recuperación posoperatoria. En el cuadro 9-1 se presentan algunos datos biológicos básicos para roedores comunes y conejos. Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 300 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestesia de mamíferos de laboratorio Anestesia e inmovilización de. . . 301 Cuadro 9-1. Datos fisiológicos para roedores y conejos Criceto Gerbo Peso corporal adulto (g) 25 a 40 Ratón 300 a 500 2 000 a 6 000 700 a 1 200 85 a 150 Rata Conejo Cobayo 85 a 150 Temperatura corporal (°C) 37.5 38 38 38 37.4 39 Frecuencia respiratoria (rpm) 80 a 200 70 a 115 40 a 60 50 a 140 80 a 135 90 Frecuencia cardiaca (lpm) 350 a 600 250 a 350 135 a 325 150 a 250 250 a 500 260 a 300 Fuente: Flecknell P.A., Richardson C.A., Popovic A. 2007. Laboratory animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 766. © Editorial El manual moderno Fotocopiar sin autorización es un delito. La administración de anestésico o analgésico puede causar malestar, irritación o ulceración de piel, membranas mucosas, endotelio vascular o músculos debido a pH bajo o alto, temperatura (si el fármaco se tomó directamente del refrigerador) o uso de una vía inapropiada (p. ej., pentobarbital por la vía intramuscular [IM]). La inyección intravenosa (IV) o la colocación de catéteres IV para administrar anestésico en roedores conscientes puede ser un reto incluso para veterinarios experimentados. El uso de la sujeción física (p. ej., tubos de restricción) o anestésicos volátiles para inducción puede proporcionar la restricción deseada para facilitar esta tarea. Sistemas de suministro de anestésico Una ventaja importante de utilizar anestésicos volátiles en mamíferos pequeños es la facilidad de administración mediante una cámara de inducción de anestesia. Lo ideal es disponer de cámaras de diferentes tamaños (p. ej., para animales con peso menor de 100 g y especímenes hasta de 1 kg). A fin de reducir el periodo de excitación involuntaria durante la inducción, la cámara debe llenarse con rapidez a la máxima concentración para inducción que sea segura del fármaco. Después de la pérdida de la conciencia, el animal puede extraerse de la cámara y recibir mantenimiento con una menor concentración del agente por mascarilla facial. Puede ser difícil la evacuación eficaz de gases de anestesia de desecho cuando se emplea una mascarilla facial, pero en el mercado existen diversos sistemas que ayudan con esta tarea, por ejemplo el sistema de doble mascarilla. También puede inducirse anestesia con mascarilla facial; ésta es una técnica rápida y conveniente cuando se usa sevoflurano en ratas y ratones. Por lo general, los anestésicos volátiles provocan una respuesta de retención del aliento en conejos, que a menudo se relaciona con forcejeo violento a menos que se administren agentes preanestésicos. Después de la sedación, el animal debe observarse de manera cuidadosa al administrar el anestésico y retirarse brevemente la mascarilla si el animal retiene el aliento. Algunas unidades de animales de laboratorio (bioterios) sólo están equipadas para suministrar aire comprimido como gas portador del anestésico, pero ello no es aconsejable. Todos los anestésicos inhalables disponibles en la actualidad producen algún grado de depresión respiratoria, pero la hipoxia puede prevenirse con el suministro del anestésico en oxígeno. Durante la recuperación 302 Manual de anestesia y analgesia en. . Agentes inyectables Una diferencia notable del uso de anestésicos inyectables en roedores pequeños en comparación con perros y gatos es la dificultad del acceso IV. Esto tiene como resultado la administración frecuente de combinaciones de anestésicos como inyecciones únicas por las vías intraperitoneal (IP), subcutánea (SC) o IM en vez de la IV para conseguir el efecto. Aunque ésta es una manera simple y rápida de producir anestesia, tiene consecuencias inevitables relacionadas con la seguridad de determinados anestésicos, en especial aquellos cuya dosis anestésica es cercana a la dosis letal. Dado que existe considerable variación entre diferentes cepas de roedores en su respuesta a los anestésicos, las combinaciones de anestésicos que tienen un margen de seguridad amplio o que son del todo o parcialmente reversibles se prefieren cuando se dispone de ellas. La elevada tasa metabólica de los mamíferos pequeños puede hacer necesarias dosis relativamente altas de algunos anestésicos para producir inconciencia. Aunado a la ineficacia relativa de fármacos como la ketamina, esto puede hacer necesario administrar dosis muy altas (p. ej., 100 mg/kg ketamina). Dado que las formulaciones farmacológicas para uso veterinario se optimizan para suministrar volúmenes convenientes a un perro o un gato, el volumen de fármaco por inyectar puede ser grande y, si se usa la vía IM, daña el tejido y causa dolor al inyectar. En seguida se consideran las combinaciones de anestésicos más empleadas en roedores y conejos, y las dosis sugeridas se presentan en el cuadro 9-2. No se recomienda el uso de ketamina como anestésico único en roedores y conejos, pero cuando se combina con coadyuvantes como acepromazina, dexmedetomidina u opioides pueden inducir planos variables de anestesia. Las combinaciones con tranquilizantes sólo producen a menudo anestesia ligera, que es insuficiente para las operaciones, mientras que las combinaciones con a2-agonistas como dexmedetomidina y xilazina producen anestesia quirúrgica. En contraste, en conejos, las combinaciones de ketamina con acepromazina y diazepam inducen con regularidad planos quirúrgicos de anestesia. El empleo de dexmedetomidina o xilazina con ketamina tiene la ventaja de que el componente sedante–analgésico de la combinación puede revertirse con a2-antagonistas como atipamezol. Puesto que esta combinación de anestésicos produce depresión cardiovascular y respiratoria, además de otros efectos sistémicos como hiperglucemia y diuresis, es común administrar el antagonista. Por supuesto, revertir el a2-agonista reduce el grado de analgesia posoperatoria inducido, de tal modo que deben administrarse compuestos adicionales (p. ej., carprofeno o buprenorfina). En cobayos (conejillos de Indias o cuyos), los efectos de ketamina y xilazina, con o sin dexmedetomidina, son más variables y es posible que no se produzca anestesia quirúrgica. En todas las especies, si el plano de anestesia es insuficiente, administrar dosis adicionales de la combinación puede tener efectos impredecibles. Es preferible recurrir a una baja concentración de un anestésico inhalable para profundizar la anestesia. Este mismo método puede usarse para prolongar el periodo de anestesia quirúrgica. Como alternativa, el sitio quirúrgico puede infiltrarse con anestésico local. Como en otras especies, no se recomienda administrar atropina de manera sistemática cuando se utilizan dosis altas de a2-agonistas. En ratas se ha informado hipertensión grave causante de muerte. La combinación de tiletamina y zolazepam (Telazol®, Pfizer Animal Health, New York) se ha recomendado como anestésico para roedores y conejos. Como en el caso de las combinaciones © Editorial El manual moderno Fotocopiar sin autorización es un delito. tras la anestesia debe continuarse el flujo de oxígeno hasta que el animal comience a recuperar la conciencia. De otro modo, algunos individuos experimentan hipoxia grave. Anestesia e inmovilización de. . . 303 Cuadro 9-2. Anestésicos y fármacos relacionados utilizados en roedores y conejosa Fármaco Dosis Efecto Duración de la anestesia (min) Tiempo de sueño (min) Anestésicos y fármacos relacionados para uso en ratones Fentanilo–fluanisona y diazepam 0.3 mL/kg IM + 5 mg/kg IP Anestesia quirúrgica 30 a 40 120 a 240 Fentanilo–fluanisona y midazolamb 10 mL/kg IP Anestesia quirúrgica 30 a 40 120 a 240 Ketamina y medetomidina 75 mg/kg + 1 mg/kg IP Anestesia quirúrgica 20 a 30 60 a 120 Ketamina y xilazina 80 mg/kg + 10 mg/kg IP Anestesia quirúrgica 20 a 30 60 a 120 Tiletamina–zolazepam 80 a 100 mg/kg IM Inmovilización Tribromoetanol 240 mg/kg IP Anestesia quirúrgica 60 a 120 15 a 45 60 a 120 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestésicos y fármacos relacionados para uso en ratas a-Cloralosa 50 a 65 mg/kg IP Anestesia ligera 480 a 600 Sólo sin recuperación Hidrato de cloral 400 mg/kg IP Anestesia ligera/quirúrgica 60 a 120 120 a 180 Fentanilo–fluanisona y diazepam 0.3 mL/kg IM + 2.5 mg/kg IP Anestesia quirúrgica 20 a 40 120 a 240 Fentanilo–fluanisona y midazolamb 2.7 mL/kg IP Anestesia quirúrgica 20 a 40 120 a 240 Ketamina y medetomidina 75 mg/kg + 0.5 mg/kg IP Anestesia quirúrgica 20 a 30 120 a 240 Ketamina y xilazina 75 mg/kg + 10 mg/kg IP Anestesia quirúrgica 20 a 30 120 a 240 Tiletamina–zolazepam 40 a 50 mg/kg IP Anestesia ligera 15 a 25 60 a 120 Uretano 1 000 mg/kg IP Anestesia quirúrgica 360 a 480 Sólo sin recuperación Anestésicos y fármacos relacionados para uso en conejos Alfaxalona–alfadolona 6 a 9 mg/kg IV Anestesia ligera 5 a 10 10 a 20 Fentanilo–fluanisona y diazepam 0.3 mL/kg IM + 2 mg/kg IP o IV Anestesia quirúrgica 20 a 40 60 a 120 Fentanilo–fluanisona y midazolamb 0.3 mL/kg IM + 2 mg/kg IM o IV Anestesia quirúrgica 20 a 40 60 a 120 Ketamina y acepromazina 50 mg/kg IM + 1 mg/kg IM Anestesia quirúrgica 20 a 30 60 a 120 Ketamina y medetomidina 15 mg/kg SC + 0.25 mg/kg SC Anestesia quirúrgica 20 a 30 90 a 180 304 Manual de anestesia y analgesia en. . Cuadro 9-2. Anestésicos y fármacos relacionados utilizados en roedores y conejosa (continuación) Fármaco Dosis Efecto Duración de la anestesia (min) Tiempo de sueño (min) Ketamina y xilazina 35 mg/kg IM + 5 mg/kg IM Anestesia quirúrgica 20 a 30 60 a 120 Propofol 10 mg/kg IV Anestesia ligera 5 a 10 10 a 15 Tiopentona 30 mg/kg IV Anestesia quirúrgica 5 a 10 10 a 15 Anestésico y fármacos relacionados para uso en cobayos Alfaxalona–alfadolona 40 mg/kg IP Inmovilización 90 a 120 Fentanilo–fluanisona y diazepam 1 mL/kg IM + 2.5 mg/kg IP Anestesia quirúrgica 45 a 60 120 a 180 Fentanilo–fluanisona y midazolamb 8 mL/kg IP Anestesia quirúrgica 45 a 60 120 a 180 Ketamina y medetomidina 40 mg/kg + 0.5 mg/kg IP Anestesia moderada 30 a 40 90 a 120 Ketamina y xilazina 40 mg/kg + 5 mg/kg IP Anestesia quirúrgica 30 90 a 120 Fentanilo–fluanisona y midazolamb 4 mL/kg Anestesia quirúrgica 20 a 40 60 a 90 Ketamina y medetomidina 100 mg/kg + 0.25 mg/kg IP Anestesia quirúrgica 30 a 60 60 a 120 Ketamina y xilazina 100 a 200 mg/kg + Anestesia 10 mg/kg IP quirúrgica 30 a 60 90 a 150 Anestésicos y fármacos relacionados para uso en gerbos Fentanilo–fluanisona y mi- 8 mL/kg dazolamb Anestesia quirúrgica 20 60 a 90 Ketamina y medetomidina 75 mg/kg + 0.5 mg/kg IP Anestesia intermedia 20 a 30 90 a 120 Ketamina y xilazina 50 mg/kg + 2 mg/kg IP Inmovilización a 20 a 60 Debe señalarse que hay considerable variación entre cepas, por lo que las dosis sólo deben considerarse como una guía general. b Dosis (en mililitros por kilogramo) de una mezcla de una parte de Hypnorm® (fentanilo–fluanisona) más dos partes de agua inyectable, y una parte de midazolam (concentración inicial de 5 mg/mL). Fuente: Flecknell P.A., Richardson C.A., Popovic A. Laboratory Animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 775. IM, intramuscular; IP, intraperitoneal; IV, intravenoso; SC, subcutáneo. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestésicos y fármacos relacionados para uso en cricetos © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestesia e inmovilización de. . . 305 de ketamina y benzodiazepina, la profundidad de la anestesia producida no siempre es suficiente para posibilitar intervenciones quirúrgicas. Combinar la mezcla con xilazina incrementa la profundidad de la anestesia, pero los efectos son aún variables. Las combinaciones etorfina–metotrimeprazina (Immobilon®, VetaPharma Ltd. Sheburn-inElmet, LEEDS, UK), fentanilo–fluanisona (Hypnorm®, VetaPharma Ltd.) y fentanilo–droperidol (Innovar-Vet®, Shering-Plough Animal Health, Union, NJ) se han usado en roedores y conejos. Todos estos agentes producen inmovilidad y analgesia profunda cuando se administran solos, pero también causan depresión respiratoria significativa. Fentanilo–fluanisona, cuando se combina con midazolam o diazepam, produce anestesia quirúrgica en todas las especies. Los intentos de desarrollar mezclas similares con las otras combinaciones neuroleptoanalgésicas disponibles en el comercio han sido menos exitosos. La combinación fentanilo–fluanisona–midazolam tiene la ventaja de que puede mezclarse y administrarse en una misma inyección, pero los componentes activos deben diluirse con agua estéril antes de combinarse. La mezcla es estable por varias semanas, pero algunas veces se cristaliza. Si se observa esto, la mezcla debe desecharse. El componente fentanilo puede revertirse con naloxona, pero esto también revierte todos los efectos analgésicos de la combinación. Es preferible revertir el fentanilo con un agonista–antagonista mixto como butorfanol o nalbufina, o con el agonista parcial buprenorfina. Esto revierte cualquier depresión respiratoria, aunque la recuperación completa puede prolongarse debido a los efectos sedantes de midazolam y fluanisona. El flumazenilo revierte al midazolam, pero su semivida relativamente breve supone la posibilidad de resedación. En conejos es mejor administrar la combinación por separado, primero fentanilo–fluanisona para producir sedación, analgesia y vasodilatación periférica. Esto facilita la colocación de un catéter IV, por ejemplo en la vena auricular marginal, y hace posible la administración IV lenta del midazolam para conseguir los efectos deseados. En ratas, conejos y cobayos, las mezclas de opioides potentes (p. ej., fentanilo o sufentanilo) pueden combinarse con dexmedetomidina u otros a2-agonistas para producir anestesia quirúrgica. En algunos casos, la adición de una benzodiazepina mejora el grado de relajación muscular. Estas combinaciones tienen la ventaja de que pueden revertirse por completo mediante antagonistas específicos. El tiobutabarbital (Inactin®, Sigma-Aldrich Corp., St. Louis, MO) se ha usado de forma amplia para inducir anestesia de duración intermedia a prolongada en ratas. Se considera que tiene efectos mínimos en el aparato cardiovascular; sin embargo, en muchos sentidos se asemeja a otros barbitúricos, al reducir el gasto cardiaco y el riego sanguíneo de órganos. El uretano es un hipnótico que produce anestesia prolongada y estable con depresión cardiovascular y respiratoria mínima. Induce narcosis y relajación muscular apropiadas, pero el componente analgésico puede no ser adecuado. Por lo regular se utiliza en experimentos terminales (el animal muere) para estudios del funcionamiento nervioso central y periférico en que deben preservarse las respuestas reflejas. Cuando se administra por vía IP, la más común, el uretano tiene profundos efectos endocrinos y metabólicos, y produce daño superficial y necrosis de órganos intraabdominales además de escape masivo de plasma a la cavidad peritoneal. El inicio de estos efectos es rápido. No se han observado efectos similares cuando se administra por las vías SC, IV o intraarterial. El uretano es carcinógeno y potencialmente mutágeno; por lo tanto, sólo debe usarse si no se dispone de otras alternativas adecuadas, y únicamente en estudios sin recuperación. 306 Manual de anestesia y analgesia en. . Vigilancia y cuidados intraoperatorios Reviste particular importancia proporcionar estándares elevados de atención perioperatoria a los animales de laboratorio, no sólo porque problemas como hipotermia pueden prolongar la recuperación, sino porque tienen efectos fisiológicos generalizados que pueden interferir en los objetivos específicos de la investigación. Como en la práctica clínica veterinaria, es posible que un miembro del personal deba actuar como anestesiólogo y como cirujano, por lo cual tal vez no se disponga de vigilancia clínica detallada. Por lo tanto, el uso de dispositivos de vigilancia electrónica (monitores) puede ser de considerable utilidad. El tipo de vigilancia debe seleccionarse con base en la especie, la duración de la anestesia, el tipo de operación y la valoración del riesgo de complicaciones o urgencias. La talla pequeña se correlaciona con elevada frecuencia cardiaca (>300 latidos por minuto [lpm]), que puede exceder los límites superiores de algunos monitores, y la baja potencia de la señal puede ser indetectable. Además, la talla pequeña limita intervenciones como la vigilancia intracorporal de la presión arterial y hace ineficaces la mayor parte de los dispositivos extracorporales. En la actualidad se dispone de algunos equipos que superan estos problemas y el uso sistemático de la vigilancia electrónica es cada vez más común. Valoración de la actividad respiratoria La observación clínica de la frecuencia y el patrón respiratorios es relativamente directa, pero puede complicarse con la colocación de campos quirúrgicos, en especial en roedores pequeños. En © Editorial El manual moderno Fotocopiar sin autorización es un delito. La cloralosa se emplea para producir anestesia prolongada, en particular en estudios en que se requiere mantenimiento de las respuestas cardiovasculares. Es un agente hipnótico y la profundidad de la anestesia producida puede ser insuficiente para intervenciones quirúrgicas. La inducción y la recuperación cuando se utiliza cloralosa son muy prolongadas, de tal manera que sólo se recurre a ella para intervenciones terminales. A fin de evitar problemas relacionados con el inicio de acción prolongado, muchas veces se induce la anestesia con otro agente (p. ej., isoflurano). La cloralosa se administra después de la canulación IV y cualquier otra intervención quirúrgica. Aunque en la actualidad se emplea sólo de modo ocasional, el hidrato de cloral, en virtud de sus efectos mínimos sobre el aparato cardiovascular, aún se emplea para anestesiar animales de laboratorio. También se utiliza en estudios neurofarmacológicos porque tiene al parecer baja probabilidad de interactuar con otros compuestos. Produce anestesia de duración intermedia, cuya profundidad varía entre diferentes cepas de roedores y puede ser suficiente para practicar operaciones. En algunas cepas de ratas, el hidrato de cloral puede causar íleo posanestésico potencialmente letal. El uso de una solución diluida de hidrato de cloral (36 mg/mL) reduce la incidencia de íleo. El tribromoetanol (Avertin®, Aldrich Chemical Co., Milwaukee, WI) es un hipnótico que produce anestesia quirúrgica en ratas y ratones con duración aproximada de 15 a 20 min. Ha ganado gran aceptación para la anestesia de ratones en experimentos de transferencia de embriones y producción de animales transgénicos, y se ha informado que es seguro y eficaz. Sin embargo, si se prepara o almacena de manera incorrecta, el tribromoetanol puede ocasionar trastornos gastrointestinales. En fechas más recientes se ha informado que puede causar irritación peritoneal leve, incluso si se prepara y almacena de modo correcto. En vista de estos efectos adversos potenciales, es mejor sustituir el tribromoetanol por otras combinaciones de anestésicos. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestesia e inmovilización de. . . 307 estas especies diminutas, el circuito anestésico no contiene casi nunca una bolsa reservorio, por lo que no es posible usar la observación de los movimientos de la bolsa para vigilar la respiración. Por desgracia, muchos monitores electrónicos no reaccionan a los movimientos respiratorios relativamente pequeños y los bajos volúmenes corrientes, en particular en animales que pesan menos de 200 g. En estos mamíferos pequeños, la observación directa de la frecuencia y el patrón respiratorios puede ser la única opción disponible. Como en otras especies, patrón, frecuencia y profundidad de la respiración varían con el plano de la anestesia y el régimen anestésico empleado. Con anestésicos inhalables y la mayoría de los regímenes inyectables, la frecuencia respiratoria disminuye. Las frecuencias respiratorias típicas durante la anestesia son de 50 a 100 rpm para roedores pequeños y de 30 a 60 rpm para conejos. Dado que muchos de estos animales presentan taquipnea muy notable relacionada con estrés antes de la inducción, el grado de depresión respiratoria se valora con base en cálculos de la frecuencia normal en reposo (cuadro 9-1) o se establece al observar a los animales en el preoperatorio, cuando no están alterados. Un decremento a menos de 50% de la frecuencia respiratoria normal prevista debe suscitar preocupación. Los cambios graduales en la frecuencia, en vez de una reducción súbita, son más comunes, por lo que es recomendable llevar un registro anestésico. La propiedad de la oxigenación y la frecuencia del pulso puede valorarse con un oxímetro de pulso, pero las altas frecuencias cardiacas en roedores pueden exceder los límites superiores del monitor. Se requiere un monitor con límite superior de al menos 350 lpm y el funcionamiento adecuado también puede depender del tipo de sonda usado. Es recomendable probar varios instrumentos, sondas y posiciones de la sonda para encontrar la combinación más confiable. En la experiencia de los autores, es posible obtener una señal de la pata trasera en roedores o de la cola. En conejos también son útiles dígitos, cola, lengua y oreja. En particular, el uso de una sonda angulada en la boca ha sido bastante confiable. El dióxido de carbono corriente final es difícil de medir en mamíferos pequeños. El volumen de gas muestreado por capnógrafos de chorro lateral puede ser muy grande respecto del volumen corriente del animal, y los capnógrafos de chorro principal introducen demasiado espacio muerto en el circuito anestésico-de respiración. En conejos, el equipo diseñado para uso pediátrico humano funciona bien. El mantenimiento de las vías respiratorias mejora con la colocación de una sonda endotraqueal, pero la talla reducida de muchas especies de laboratorio hace esto técnicamente difícil. Los conejos pueden intubarse con un otoscopio para visualizar la laringe o con técnica ciega. Antes de la intubación, el animal debe respirar oxígeno al 100% por 1 a 2 min. Se utilizan sondas endotraqueales sin manguito para maximizar el diámetro interno (DI) de las vías respiratorias; una sonda con diámetro de 3 a 3.5 mm es adecuada para un conejo de 3 a 4 kg. Se requieren sondas con diámetro menor de 2.5 mm para conejos muy pequeños (<800 g), y deben adquirirse de proveedores especializados. Cuando se usa un otoscopio, el conejo se coloca sobre su dorso. Se abre la boca y se tira de la lengua hacia el espacio entre incisivos y premolares. Debe tenerse cuidado de no lesionar la lengua contra el borde de los incisivos. El espejo del otoscopio se inserta en el espacio entre los dientes en el lado de la boca opuesto a la lengua y se hace avanzar hasta que son visibles el extremo del paladar blando o la laringe. En algunos animales, la epiglotis se coloca atrás del paladar blando u oculta la laringe de la vista. Para exponer la laringe, se usa un introductor para desplazar la epiglotis y el paladar blando. Se asperja la laringe con anestésico local. El introduc- 308 Manual de anestesia y analgesia en. . tor se hace avanzar entonces a través del espejo del otoscopio, la laringe y hasta la tráquea. Se extrae el otoscopio y la sonda endotraqueal se desplaza a lo largo del introductor hasta la tráquea. Entonces se extrae el introductor. Para insertar una sonda con técnica ciega, el conejo se coloca en decúbito esternal, con cabeza y cuello extendidos hacia arriba (figura 9-1). La sonda endotraqueal se introduce en el espacio entre los incisivos y premolares y se hace avanzar hasta la faringe. Cuando se alcanza la laringe se percibe cierto aumento de la resistencia. Entonces es posible hacer avanzar la sonda por laringe y tráquea. La colocación exitosa se acompaña de una ligera tos. En algunos casos, la sonda pasa al esófago y es necesario extraerla y volver a colocarla. El paso de la sonda se facilita a menudo al girarla suavemente 45° al entrar en la laringe. Es posible vigilar la posición de la sonda escuchando por su extremo. Si pueden oírse ruidos respiratorios, la sonda debe estar en la faringe o la tráquea. Como una alternativa a la intubación, puede emplearse una mascarilla laríngea. Esta técnica es más fácil de dominar que la intubación endotraqueal, pero la ventilación manual o mecánica puede ser ineficaz. Si tan sólo se requiere oxígeno complementario, puede introducirse una sonda nasal y colocarse en la parte posterior de la faringe. La intubación de roedores pequeños se facilita con el uso de un aparato especializado. Una técnica en la que se emplea un espejo de otoscopio modificado para visualizar la laringe y un catéter sobre la aguja como sonda endotraqueal es relativamente fácil de dominar. Aunque se han descrito muchos otros métodos, la técnica de otoscopio modificado permite una intubación atraumática rápida y el estuche incluye un video instructivo. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 9-1. Intubación de un conejo con la “técnica ciega”. El conejo se halla en decúbito esternal y se administra oxígeno por un mínimo de 2 min antes de intubar. Para ello, la sonda endotraqueal se coloca en la boca del conejo hasta el nivel de la laringe. A la inspiración, la sonda endotraqueal se introduce con suavidad en la laringe en el sentido de los ruidos respiratorios más intensos. Fuente: Flecknell P.A., Richardson C.A., Popovic A. 2007. Laboratory animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 778. Anestesia e inmovilización de. . . 309 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Después de la intubación, los animales pueden mantenerse en un circuito anestésico apropiado, por ejemplo una pieza en T con poco espacio muerto para roedores pequeños, o una pieza en T pediátrica o un circuito de Bain no modificado para conejos. Valoración de la actividad cardiovascular La vigilancia clínica del aparato cardiovascular es complicada en roedores pequeños debido a su talla. Es difícil o imposible palpar pulsos periféricos y muchas veces la frecuencia cardiaca es mayor de 250 lpm. En conejos y cobayos puede auscultarse o palparse el tórax, pero esto se complica en roedores más pequeños. En conejos puede utilizarse un estetoscopio esofágico. Cuando se usan monitores electrónicos, a menudo se exceden los límites superiores de frecuencia cardiaca (p. ej., 250 o 300 lpm) y algunos instrumentos no detectan la señal electrocardiográfica de baja amplitud. Resulta práctico realizar otras valoraciones clínicas, como el tiempo de llenado capilar. En todas las especies, la valoración del color de las membranas mucosas suministra algún indicio del riego periférico y la saturación de la hemoglobina con oxígeno. La presión arterial puede medirse mediante sistemas sin penetración corporal en conejos grandes o con manguitos pediátricos o equipo veterinario de diseño especial. En ratas se efectúa de este modo, con un manguito para la cola, pero se requiere un aparato especial. En todas las especies es posible medir la presión arterial de manera traumática, pero en roedores es necesaria la exposición quirúrgica del vaso, lo cual tiende a limitar el uso de esta técnica a intervenciones sin recuperación. En conejos puede colocarse un catéter sobre la aguja en la arteria auricular central. En todas estas especies, el volumen sanguíneo se aproxima a 70 mL/kg de peso corporal, de tal modo que los roedores pequeños tienen muy bajos volúmenes sanguíneos totales (p. ej., 2 mL en un ratón de 30 g). Por ello reviste importancia crítica minimizar la pérdida de sangre mediante hemostasis cuidadosa y vigilar dicha pérdida pesando de manera exacta los apósitos y evaluando otras pérdidas en el sitio quirúrgico. Termorregulación Los mamíferos pequeños tienen un mayor cociente área superficial/peso corporal, que tiene como resultado un enfriamiento rápido durante la anestesia. Es importante mantener la temperatura corporal y vigilar con cuidado para asegurarse de que esto ocurra en verdad. La hipotermia puede demorar la recuperación tras la anestesia y, si es intensa, ocasionar paro cardiaco. Debe vigilarse la temperatura rectal con un termómetro electrónico. El tamaño de la sonda de los instrumentos más económicos es apropiado para animales que pesan 250 g o más, pero se requieren instrumentos especializados para roedores muy pequeños (p. ej., ratones y cricetos). Para atenuar la pérdida, debe reducirse al mínimo el área de pelaje que se afeita durante la preparación del sitio quirúrgico, y el uso de desinfectantes de la piel debe limitarse al mínimo necesario para mantener la asepsia. Los animales deben colocarse en una estera calentadora que se mantiene a 37 a 39°C. Es importante que las medidas para conservar la temperatura corporal se continúen hasta el periodo posoperatorio. 310 Manual de anestesia y analgesia en. . Cuidados posoperatorios Si es posible, debe contarse con un área de recuperación aparte porque ello facilita un ambiente óptimo durante este periodo. También favorece la atención individual y los cuidados especiales, si se requieren. La mayor parte de los anestésicos de uso común causan aún cierto grado de depresión respiratoria en el periodo posoperatorio inmediato. Además de continuar la vigilancia del funcionamiento respiratorio, debe tenerse cuidado de que no ocurra obstrucción respiratoria. Roedores pequeños y conejos pueden intentar ocultarse y abrirse paso hasta la esquina de la jaula de recuperación, lo que podría obstruir las vías respiratorias. Además, cuando se les permite recuperarse en grupo, los roedores suelen hacinarse, lo cual puede reducir la disponibilidad de oxígeno para los animales en el centro del grupo. Aunque la recuperación es más rápida a menudo después del uso de agentes inhalables, es posible una hipoxia significativa (saturación de oxígeno de menos de 90%), lo cual debe prevenirse manteniendo al animal en un ambiente enriquecido con oxígeno, ya sea por medio de una mascarilla facial o por el suministro de oxígeno en la incubadora hasta que se juzgue que la actividad respiratoria es apropiada. Es importante continuar las medidas para mantener la temperatura corporal normal en el periodo de recuperación. Muchas veces esto puede lograrse si se le permite a los animales recuperarse en un área o jaula en una sala apropiada (que se mantiene a alta temperatura ambiental, © Editorial El manual moderno Fotocopiar sin autorización es un delito. Urgencias Todas las medidas para enfrentar las urgencias anestésicas en los animales de compañía pueden aplicarse a las especies de laboratorio; empero, como en el caso de muchas otras técnicas, la talla reducida puede limitar o complicar algunos de esos procedimientos. Para favorecer la ventilación de un animal no intubado se extienden cabeza y cuello, se tira de la lengua y se oprime con suavidad el tórax entre el pulgar y el índice. Si es difícil tomar la lengua, puede llevarse hacia el frente mediante un aplicador con punta de algodón. Cuando un animal se ha intubado es relativamente fácil asistir la respiración. Por lo regular son infructuosos los esfuerzos por promover la ventilación con una mascarilla facial, pero en roedores pequeños puede colocarse sobre nariz y boca un tramo de tubo de caucho blando, y los pulmones se insuflan soplando con suavidad por el tubo. Como ya se indicó, dado que en los roedores pequeños el volumen sanguíneo total es bajo, debe efectuarse todo esfuerzo posible por minimizar la pérdida sanguínea y evitar la hidratación excesiva. Si se requiere fluidoterapia, puede administrarse con un catéter sobre la aguja en la vena de la cola en ratas, la vena tarsal medial en cobayos o las venas auricular marginal, cefálica o yugular en conejos. Si se requiere sangre entera, tal vez se disponga de un donador adecuado en el instituto de investigación. Todos los líquidos disponibles con regularidad pueden administrarse de manera segura a mamíferos pequeños y otras especies de laboratorio. En los roedores más pequeños, en los cuales no es práctico el acceso IV, los déficit hídricos pueden reponerse con lentitud mediante la administración IP o SC de soluciones electrolíticas tibias, pero su beneficio es mínimo en caso de hemorragia masiva. En estas especies más pequeñas, la colocación de un catéter intraóseo es una vía alternativa para la restitución de líquidos. Si sobreviene paro cardiaco, en los intentos de reanimación pueden usarse masaje cardiaco externo y fármacos de urgencia como adrenalina. Anestesia e inmovilización de. . . 311 © Editorial El manual moderno Fotocopiar sin autorización es un delito. con calentamiento adicional de la jaula si es necesario) o en una incubadora. Se requiere una temperatura de 25 a 30 °C para animales adultos y de 35 a 37 °C para neonatos. Si no se dispone de una incubadora, deben proporcionarse almohadillas calentadoras y lámparas. Puesto que los mamíferos pequeños se calientan con rapidez, debe tenerse cuidado de no sobrecalentar o quemar al paciente, y debe colocarse un termómetro cerca del animal para vigilar la temperatura en su entorno inmediato. Durante la recuperación tras la anestesia, debe proporcionarse a los animales un lecho, por ejemplo badana sintética. Si no se dispone de ello, deben usarse toallas o una frazada. Aserrín y virutas de madera son inadecuadas porque este tipo de lecho se adhiere a menudo a ojos, nariz y boca del animal. Con frecuencia se coloca papel higiénico como lecho para roedores pequeños, pero es relativamente ineficaz porque los animales lo echan a un lado durante la recuperación tras la anestesia y terminan en el piso de la jaula de plástico cubierta de orina y heces. Debe disponerse de agua para beber, pero es necesario impedir que se derrame o se encuentre en un recipiente en el cual el animal pueda ahogarse. Si la piel del animal se moja, éste pierde calor con rapidez. Los roedores pequeños están habituados a beber de botellas, de tal forma que esto rara vez es un problema, pero puede plantear dificultades en el caso de conejos, cobayos, hurones y especies mayores. Tal vez también se requiera fluidoterapia en el posoperatorio. Puede administrarse por infusión IV en animales mayores, pero en roedores pequeños es más conveniente ofrecer dextrosa/ solución salina tibia (37°C) por vía SC o IP al final de la intervención (cuadro 9-3). En la mayor parte de las especies de laboratorio, debe proporcionarse alimento de inmediato una vez que recuperan la conciencia; el riesgo de aspiración es mínimo. Una papilla formada con alimento comprimido humedecido en agua caliente la consumen a menudo con rapidez los roedores pequeños y aporta líquido adicional además de la alimentación. Valoración del dolor Si se administran analgésicos de manera apropiada es esencial hacer intentos por valorar la intensidad del dolor posoperatorio. Sólo después de esto es posible determinar si se administró una dosis apropiada de analgésico. La valoración del dolor también es esencial para precisar si se seleccionó un tipo adecuado de analgésico, cuándo volver a administrar, y cuándo suspender el tratamiento. Cuadro 9-3. Volúmenes de líquido para administrar a roedores y conejos Vía Ratón Rata Conejo Cobayo Criceto Gerbo Intraperitoneal (mL) 2 5 50 20 3 2a3 Subcutánea (mL) 1a2 5 30 a 50 10 a 20 3 1a2 Los volúmenes son valores sugeridos para animales adultos. Todos los líquidos deben calentarse a la temperatura corporal antes de su administración. Fuente: Flecknell P.A., Richardson C.A., Popovic A. 2007. Laboratory animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 781. 312 Manual de anestesia y analgesia en. . Alivio del dolor Dado que todos los analgésicos disponibles para uso en animales y personas se han desarrollado y probado en cuanto a seguridad y eficacia en animales de laboratorio, pueden sugerirse dosis eficaces probables para la mayoría de ellos. No obstante, la valoración de la eficacia efectuada durante el desarrollo de fármacos se basa muchas veces en pruebas que dependen de estímulos dolorosos agudos (p. ej., calor o presión dolorosos breves). Éstos difieren del dolor clínico. Las dosis sugeridas en el cuadro 9-4 se basan en experiencia clínica y datos publicados que incluyen el modo en que se valoró el dolor posoperatorio, o datos de ensayos analgesimétricos, como la prueba de formalina de fase tardía, que al parecer es más pertinente para el dolor clínico. Antiinflamatorios no esteroideos. Todos los antiinflamatorios no esteroideos (AINE) disponibles para uso en animales pueden administrarse a especies de laboratorio. Las consideraciones generales relacionadas con su uso en otras especies se aplican por igual a especies de laboratorio; sin embargo, dado que la mayor parte de los animales de laboratorio sometidos a operaciones corresponde a adultos jóvenes sanos, las preocupaciones acerca de enfermedad preexistente son a menudo mínimas. De los agentes disponibles, el preparado oral de meloxicam tiene especial utilidad debido a su excelente sabor para muchos roedores pequeños, en particular si se agrega a un alimento favorito. La duración del efecto de los AINE en roedores y conejos es incierta, pero carprofeno y meloxicam duran en apariencia al menos 8 h y tal vez 24 h. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Desafortunadamente, en muchas especies es difícil determinar el dolor. En la actualidad, la única opción práctica consiste en juzgar la probable intensidad del dolor con base en el tipo de operación y la habilidad del cirujano, y usar esto para formular un protocolo analgésico (método antropomórfico crítico). Como en el caso de la selección de la anestesia, al elegir el plan analgésico deben considerarse los objetivos del proyecto de investigación específico. Es claro que la eficacia analgésica varía en grado considerable entre diferentes cepas de roedores, lo cual refuerza la necesidad de emplear sistemas de puntuación del dolor. Al momento de escribir esto se han desarrollado esquemas de puntaje de dolor para ratas después de una operación abdominal. En esta especie, arqueo del lomo, contracción de los músculos abdominales, marcha vacilante y caídas (sin relación con la recuperación tras la anestesia) y fasciculaciones de la piel de dorso y abdomen se vinculan al parecer con dolor. Si en un periodo de 5 min se ven más de uno o dos arqueos de lomo, contracciones abdominales o titubeos de la marcha, es probable que se requiera analgesia adicional. Puede consultarse material ilustrativo en www.digires.co.uk. En ratones se han observado conductas similares y decremento de actividades normales como la de trepar, pero estas conductas aún no se incorporan en un sistema de puntaje de dolor formal. Algunos conejos también experimentan contracciones abdominales después de laparotomía, pero en esta especie los cambios conductuales posoperatorios son en apariencia mucho más variables, y en algunos animales se inhiben por la presencia de un observador. Prácticamente no existe información sobre conductas relacionadas con dolor en cobayos, cricetos y gerbos. En ratas, y tal vez en otros roedores pequeños, la eficacia analgésica puede valorarse de manera retrospectiva al cuantificar el consumo de alimento y agua y el peso corporal. Estos parámetros disminuyen después de muchos tipos de operaciones en varias cepas de ratas, y la administración de analgésicos atenúa este efecto. Sin embargo, los cambios no siempre son consistentes, en particular en animales jóvenes. 2.5 mg/kg SC c/12 2.5 mg/kg h c/12 h 5 mg/kg SC por 4 h 1 a 2 mg/kg SC o 0.2 mg/ kg SC al ¿? 4 mg/ kg VO día 2 a 5 mg/kg SC ¿? 10 a 20 mg/kg SC 10 a 20 mg/kg SC 10 mg/kg SC o IM 10 a 20 mg/kg SC o IM por 2 a 3 h o IM por 2 a 3 h por 2 a 3 h o IM Meloxicam Morfina Oximorfona Petidina SC ¿? ¿? ¿? ¿? ¿? ¿? ¿? ¿? 0.1 mg/kg SC Criceto ¿? ¿? ¿? ¿? ¿? ¿? ¿? 0.1 mg/kg SC Gerbo IM, intramuscular; IV, intravenoso; VO, vía oral; SC, subcutáneo. Las dosis se basan en gran medida en ensayos clínicos no controlados y una gama limitada de intervenciones, por lo que es probable que deban revisarse. “¿?” indica que la información es insuficiente para emitir una recomendación firme de una dosis apropiada. Fuente: Flecknell P. A., Richardson C. A., Popovic A. 2007. Laboratory Animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W. J. Tranquilli, J. C. Thurmon, and K. A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 767. 0.2 a 0.3 mg/kg 0.1 a 0.2 mg/kg ¿? SC IM o IV 2 a 5 mg/kg SC 2 a 5 mg/kg SC o 2 a 5 mg/kg SC o por 4 h IM por 4 h IM por 4 h SC 1.1 mg/kg c/12 h 4 mg/kg SC c/24 2.5 mg/ kg h o 1.5 mg/kg VO al día Flunixina 5 mg/kg SC 10 mg/kg SC Carprofeno Cobayo 2 mg/kg SC por 4 h 2 mg/kg SC por 0.1 a 0.5 mg/kg 2 mg/kg SC 4h SC Conejo Butorfanol Rata 0.1 mg/kg SC por 6 0.01 a 0.05 mg/kg 0.01 a 0.05 mg/ 0.05 mg/kg SC a 12 h SC por 6 a 12 h kg SC Ratón Dosis sugeridas de analgésicos para roedores y conejos Buprenorfina Analgésico Cuadro 9-4. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Anestesia e inmovilización de. . . 313 314 Manual de anestesia y analgesia en. . Control eficaz del dolor Cualquiera que sea el plan analgésico, es importante administrar fármaco suficiente para aliviar el dolor de manera eficaz y valorar a los pacientes con frecuencia. Se recomienda la administración de analgésicos antes de una operación programada. Además de conferir alivio más eficaz del dolor, también puede reducir la dosis de anestésico necesaria. La experiencia con roedores pequeños y conejos ha demostrado que el uso de buprenorfina de esta manera reduce en 25 a 50% la concentración de isoflurano o halotano necesaria para lograr anestesia quirúrgica. Debe tenerse cautela cuando se administren por vía IP o IM anestésicos inyectables. Como se expuso con anterioridad, en estas circunstancias la dosis de anestésico no puede ajustarse para satisfacer las necesidades individuales, y es claro que los opioides pueden potenciar los efectos de los anestésicos. Cuando se emplean neuroleptoanalgésicos, el componente opioide genera analgesia que de manera conveniente puede revertirse en parte con la administración de buprenorfina o butorfanol. Este último opioide ejerce mejor reversión, pero tiene efecto más breve, de tal forma que debe administrarse una dosis adicional, o combinarse con un AINE. Como en otras especies, las combinaciones de diferentes agentes (método multimodal) puede tener especial eficacia: por ejemplo, un bloqueo nervioso local al momento de una toracotomía, junto con la administración de opioides sistémicos y AINE y seguido de la administración repetida de opioides y AINE, según se requiera. A medida que la intensidad del dolor cede, los opioides pueden reducirse y controlarse el dolor sólo con AINE. Anestesia de roedores neonatos Los roedores recién nacidos pueden anestesiarse de manera segura y eficaz con anestésicos inhalables, como isoflurano o sevoflurano. La mayoría de los anestésicos inyectables se relaciona con elevada mortalidad, pero la combinación fentanilo–fluanisona se ha usado en ratas neonatales y juveniles. La hipotermia aún se utiliza como una técnica anestésica para neonatos en algunos laboratorios de investigación. Esta técnica es todavía tema de controversia, pero su mortalidad es baja. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Opioides. Éstos son eficaces para aliviar el dolor posoperatorio, pero se han notificado algunos efectos específicos de especie. También pueden causar sedación o excitación y sus efectos varían demasiado entre diferentes especies animales. Los efectos sobre el comportamiento también dependen de la dosis. La morfina seda a las ratas, pero en ratones produce excitación y, en dosis altas, la característica cola elevada y rígida (respuesta de la cola de Straub). Aunque es un analgésico eficaz, se ha informado que el uso de buprenorfina en algunas cepas de rata en determinados institutos de investigación provoca pica, que se manifiesta en la forma de ingestión compulsiva de material del lecho. Es más intensa cuando se administran dosis inapropiadamente altas, pero también se observa a dosis menores. Aunque el problema se previene al colocar a los animales en pisos enrejados, puede indicar malestar abdominal o náusea, de tal modo que debe usarse un analgésico alterno para esa cepa específica. Este efecto secundario no ocurre de manera consistente y, en vista del efecto prolongado y la seguridad de la buprenorfina, a menudo se lo considera el analgésico opioide de elección en ratas y otras especies de laboratorio. Anestesia e inmovilización de. . . 315 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Sólo debe recurrirse a ella cuando se ha demostrado que los métodos alternativos son inadecuados. Reducir la temperatura corporal a unos 4 a 5°C colocando a los roedores neonatos en un refrigerador o sobre hielo picado los inmoviliza y reduce su actividad cardiaca y respiratoria a grados virtualmente indetectables. A tales temperaturas, la conducción nerviosa se desacelera o bloquea por completo, de tal modo que se presupone que la operación puede realizarse sin que los animales experimenten dolor o malestar. Roedores y conejos Roedores pequeños y conejos no vomitan, por lo que no es necesario en general retirarles el alimento o el agua antes de la anestesia. Suspender el alimento a roedores pequeños por periodos prolongados puede ser perjudicial porque puede predisponerlos a hipoglucemia. Conejos y cobayos tienen mayor probabilidad de sufrir trastornos digestivos posoperatorios si se les suspende el alimento. En cobayos anestesiados, muchas veces se encuentran pequeñas cantidades de alimento en la boca, y ello no es impedido por la suspensión del alimento. Dado que en roedores la anestesia se induce a menudo con una cámara anestésica o la inyección de fármacos por las vías IP o SC, no es frecuente que se les administre medicación preanestésica. En conejos, puede considerarse la inducción con un agente volátil suministrado por mascarilla facial, pero debe incluirse un fármaco sedante (p. ej., dexmedetomidina, diazepam o acepromazina) porque muchas veces los animales se estresan con este procedimiento. Aunque no se usen agentes volátiles, los sedantes o tranquilizantes pueden tener beneficios significativos porque los conejos se estresan con facilidad cuando se manipulan y restringen. Se aconseja la administración del fármaco antes de extraer al animal de su jaula. En el cuadro 9-5 se enumeran los compuestos apropiados. Cuando sólo se requiere inmovilización y no anestesia, son eficaces las dosis altas de alguno de los fármacos enumerados en el cuadro 9-5, pero a menudo son más útiles dosis bajas de combinaciones de anestésico (p. ej., ketamina–dexmedetomidina). La medicación preanestésica con un analgésico puede ser aconsejable en todas estas especies, como parte de un régimen de manejo perioperatorio del dolor, y las dosis de los analgésicos apropiados se enumeran en el cuadro 9-4. Como en otras especies, pueden suministrarse atropina o glucopirrolato para reducir las secreciones bronquiales y salivales, aunque esto rara vez se requiere en roedores sin infección respiratoria. Sin embargo, estos agentes pueden ser útiles para bloquear la inhibición vagal de la frecuencia cardiaca sinusal causada por algunas intervenciones quirúrgicas (p. ej., manipulación de vísceras o canulación carotídea, que pueden implicar manipulación vagal directa). Es recomendable emplear glucopirrolato en conejos porque la atropina es con frecuencia relativamente ineficaz en esta especie. La vía IP de administración es la más fácil en roedores pequeños, dado que pueden suministrarse mayores cantidades de líquidos. Sin embargo, son muy comunes los errores durante la administración por esta vía. (p. ej., administración intravisceral, SC o en el tejido adiposo). Tales errores pueden causar daño de órganos o demora en el inicio del efecto del anestésico. Las inyecciones se aplican en el cuadrante abdominal inferior izquierdo. Los roedores se inmovilizan en decúbito dorsal, como se muestra en la figura 9-2. La mayoría de los analgésicos y anestésicos disponibles en el comercio se encuentra en altas concentraciones, de tal manera que para la inyección de roedores pequeños sólo se necesitan volúmenes muy pequeños. La dosificación precisa es más fácil si se utilizan jeringas de insulina. 0.5 mL/kg IM 1.5 mL/kg IM 0.4 mL/kg IM 0.5 mL/kg SC o IP 0.3 a 0.5 mL/kg SC o IM 30 a 100 μg/kg SC o IP 100 a 500 μg/kg SC o IP 5 mg/kg IP 2.5 mg/kg IP 1 a 2 mg/kg IM 5 mg/kg SC o IM 2.5 mg/kg SC o IM Ratón Criceto Cobayo Ratón, criceto, gerbo, rata, cobayo Conejo Ratón, criceto, rata Conejo Ratón, criceto, gerbo, cobayo Rata Conejo Ratón, criceto, rata Conejo Diazepam Efecto Sedación y algo de analgesia, inmovilización a dosis mayores Sedación Sedación y alguna analgesia; inmovilización a dosis mayores Sedación y analgesia; a menudo inmovilización suficiente para operaciones menores Reducción de secreciones bronquiales y salivales, inhibe respuestas vagales Sedación y analgesia; a menudo inmovilización suficiente para operaciones menores Reducción de secreciones bronquiales y salivales, inhibe respuestas vagales, ineficaz en muchos conejos Sedación Sedación, a menudo inmovilización Sedación, a menudo inmovilización, algo de analgesia Sedación, pero el animal continúa activo © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fuente: Flecknell P. A., Richardson C. A., Popovic A. 2007. Laboratory animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W. J. Tranquilli, J. C. Thurmon, K. A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 767. IM, intramuscular; IP, intraperitoneal; IV, intravenoso; SC, subcutáneo. Xilazina Midazolam Medetomidina Hypnorm® (fentanilo–fluanisona) Innovar-Vet® (fentanilo–droperidol) Conejo Ratón, criceto, gerbo, cobayo Rata Conejo Conejo Atropina Glucopirrolato 5 mg/ kg IP 2.5 mg/kg IP 1 a 2 mg/kg IM 0.01 mg/kg IV o 0.1 mg/kg SC o IM 0.22 mL/kg IM Ratón, criceto, gerbo, rata, cobayo Acepromazina + butorfanol Dosis 2.5 mg/kg IP o SC 3 a 5 mg/kg IP o SC 1 mg/kg SC o IM 0.5 mg/kg + 1.0 mg/kg IM o SC 40 μg/kg SC o IM Rata, cobayo Ratón, criceto, gerbo Conejo Conejo Acepromazina Especie Agentes preanestésicos para uso en roedores y conejos Fármaco Cuadro 9-5. 316 Manual de anestesia y analgesia en. . Anestesia e inmovilización de. . . 317 Figura 9-2. Inyección IP en una rata. La rata es inmovilizada en decúbito dorsal por un asistente. Se inyecta en el cuadrante inferior derecho del abdomen. Fuente: Flecknell P.A., Richardson C.A., Popovic A. 2007. Laboratory Animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 769. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Como alternativa, un preparado comercial puede diluirse para obtener un volumen que pueda administrarse con exactitud. Para el suministro IV es posible emplear catéteres de mariposa o sobre la aguja, con o sin equipos de extensión, para la inducción inicial y el mantenimiento de la anestesia por infusión. Cricetos Los cricetos o hámsters pueden sujetarse con ambas manos, inmovilizando la cabeza para evitar mordeduras. De manera alternativa, se sujeta con firmeza la piel laxa alrededor del cuello y en la región del dorso. Puede utilizarse la vena safena para la administración IV. Véanse otras vías en el cuadro 9-6. Gerbos Los gerbos o gerbillos son en general fáciles de manipular y pueden acunarse en la palma de la mano. De manera alternativa, se los puede tomar con suavidad por la base de la cola, pero sujetar el extremo distal de la cola puede desprender la piel. A los jerbos les disgusta ser sujetados o puestos de espalda. Para la administración IV pueden usarse el aspecto lateral de la cola o las venas safenas. En el cuadro 9-6 se presentan otras vías. Cobayos Los cobayos (conejillos de Indias, cuyos) son fáciles de levantar asiéndolos con suavidad alrededor del tórax y los hombros con una mano mientras se soportan los cuartos traseros con la otra mano. Para la administración IV pueden emplearse las venas aural, safena o peniana (sólo bajo anestesia). 318 Manual de anestesia y analgesia en. . Cuadro 9-6. Sitio de inyección Intramuscular Intravenosa Subcutánea Vías de inyección para roedores y conejos Especie Localización Tamaño de la aguja (calibre) Precauciones Roedores Cuádriceps o mús- 25 a 27 culos posteriores del muslo La masa muscular es muy reducida; evitar el nervio ciático Conejos Cuádriceps, dorsal 24 a 27 lumbar, o músculos posteriores del muslo Evitar el nervio ciático Ratones y ratas Aspecto lateral de la 24 a 28 cola o vena safena Conejos Venas auricular mar- 23 a 25 ginal, cefálica o safena Usar una crema anestésica local (crema EMLA®, AstraZeneca® LP. Wilmingotn, DE) antes de la inyección Roedores Región interescapu- 21 a 25 lar o inguinal Los líquidos muy viscosos pueden causar molestia y son difíciles de inyectar Conejos Interescapular o flan- 21 a 25 cos Ratones Los ratones no se habitúan con tanta facilidad a la sujeción como otros roedores y existen grandes variaciones entre diferentes cepas. Algunos son relativamente dóciles y fáciles de atrapar, mientras que otros son en extremo activos. Los ratones suelen tomarse por la base de la cola y levantarse de la jaula. Cuando se colocan en una superficie no resbaladiza, como la tapa de la jaula o una bata de laboratorio, se los puede asir por la piel laxa del lomo, con la piel restringida entre los dedos del operador. Esta forma de sujeción es en particular conveniente para la administración de fármacos por las vías IP, IM y SC. Ratas La forma más fácil y humanitaria de levantar a una rata consiste en sostener con una mano los cuartos traseros y la cabeza con la otra, con el pulgar bajo la pata delantera y la mandíbula. Las ratas pueden sujetarse por la piel laxa de cuello y lomo, en caso necesario. Conejos Se acerca al conejo con suavidad en la jaula y se sujeta la piel del cuello y el lomo con firmeza, sosteniendo el abdomen y las patas traseras con la otra mano. Cuando se transportan conejos, la cabeza se mantiene entre el brazo y el pecho del manejador. Envolver al conejo en una toalla o © Editorial El manual moderno Fotocopiar sin autorización es un delito. Fuente: Flecknell P.A., Richardson C.A., Popovic A. 2007. Laboratory animals. En: Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed. W.J. Tranquilli, J.C. Thurmon, and K.A. Grimm, eds. Ames, IA: Blackwell Publishing, p. 770. Anestesia e inmovilización de. . . 319 un dispositivo de restricción diseñado con este fin facilita el manejo y reviste especial utilidad cuando se aplican inyecciones IV. Consideraciones anestésicas para otros mamíferos no domésticos y exóticos © Editorial El manual moderno Fotocopiar sin autorización es un delito. Chinchillas Las chinchillas se extraen con facilidad de sus jaulas sujetándolas por la base de la cola y levantándolas del piso. La anestesia puede inducirse con sevoflurano o isoflurano. Midazolam (5 mg/ kg) más ketamina (15 a 20 mg/kg) por vía IM producen relajación y analgesia hasta por 2 h y facilitan la inducción de anestesia. Puede administrarse tiopental IV en solución diluida hasta el efecto deseado para operaciones menores. Se ha administrado anestesia epidural para operaciones cesáreas porque la fosa lumbosacra se localiza con facilidad y es comparativamente grande. Las técnicas de anestesia epidural son similares a las observadas para perros y gatos y pueden practicarse con anestésicos locales como lidocaína. En un estudio de 2004, una combinación IM de midazolam (1.0 mg/kg), medetomidina (0.05 mg/kg) y fentanilo (0.02 mg/kg) se comparó con la inyección IM de xilazina (2.0 mg/kg) con ketamina (40.0 mg/kg) o medetomidina (0.06 mg/kg) con ketamina (5.0 mg/kg) para valorar los efectos de combinaciones de anestésicos en chinchillas. Las combinaciones xilazina–ketamina y medetomidina–ketamina proporcionaron mayor tolerancia quirúrgica, pero en general se prefirió la combinación midazolam–medetomidina–fentanilo porque indujo menor depresión cardiopulmonar y generó anestesia adecuada con el potencial de reversión completa. Ardillas Las ardillas pueden anestesiarse con isoflurano o sevoflurano administrados en una cámara de inducción. La ketamina (10 a 20 mg/kg) es el anestésico inyectable de uso más común en las ardillas gris y negra. Induce inmovilización adecuada para exploración física y procedimientos diagnósticos. Una combinación de medetomidina y ketamina también se ha empleado para inmovilizar ardillas. Perrillos de pradera En los perrillos de pradera, la ketamina (100 a 150 mg/kg) más xilazina (20 mg/kg) por vía IV produce 1.5 a 2.0 h de anestesia quirúrgica satisfactoria. La xilazina puede administrarse 10 min antes de la ketamina o al mismo tiempo. Para anestesia más prolongada, también pueden administrarse anestésicos inhalables con mascarilla o después de intubación endotraqueal. Dado que los perrillos de pradera son respiradores nasales obligatorios, sólo es necesario ponerles la nariz en la mascarilla para inducción y mantenimiento de anestesia por agentes inhalables. La visualización de la laringe es difícil sin el uso de un otoscopio o laringoscopio modificados. Si todo lo que se requiere es un breve periodo de sedación, una menor dosis de ketamina (40 mg/kg) puede combinarse con acepromazina (0.4 mg/kg) y administrarse por vía IM. Pueden utilizarse butorfanol (2 mg/kg SC) o buprenorfina (0.02 mg/kg SC) para inducir efectos analgésicos en estos animales. 320 Manual de anestesia y analgesia en. . Marmotas Las marmotas son similares a los perrillos de pradera y se han anestesiado con éxito mediante combinaciones de xilazina–ketamina, medetomidina–ketamina y xilazina–Telazol®. Agutíes Los agutíes son roedores ágiles y excitables grandes que pueden lesionarse a sí mismos o a los operadores si no se sujetan con cuidado. Se ha usado ketamina sola (25 a 35 mg/kg) para inmovilizarlos. Puede coadministrarse con analgésicos o sedantes–analgésicos para intervenciones dolorosas. Los anestésicos inhalables (isoflurano o sevoflurano) suministrados por mascarilla facial o sonda endotraqueal producen anestesia quirúrgica adecuada después de inmovilización con ketamina. Ratones campestres Los ratones campestres o topillos se han anestesiado por unas 3 h con pentobarbital a una dosis IP de 0.06 mg/g de peso corporal. La anestesia quirúrgica puede inducirse por 15 a 20 min en topillos de pradera con una dosis de 0.06 a 0.09 mg/g de pentobarbital inyectados por vía IM. En años recientes, el uso de pentobarbital IM o IP para anestesia se ha sustituido por combinaciones inyectables y anestésicos inhalables en la mayor parte de las especies de roedores. Murciélagos Los murciélagos deben manipularse con guantes de piel gruesa para prevenir mordeduras. Estos animales portan varios virus que pueden causar enfermedad e incluso la muerte en seres humanos. Por lo tanto, se recomiendan sedación y anestesia si se requiere manipulación extensiva. Los murciélagos frugívoros (Eidolon helvum) se han sedado con una fenotiazina tranquilizante (clorpromazina, 2.5 mg/100 g IM). Después de que el tranquilizante ha surtido efecto, el murciélago puede colocarse en un tablero de restricción con las alas extendidas, y se administra un anestésico inhalable por mascarilla. Otros métodos de inmovilización química incorporan la administración © Editorial El manual moderno Fotocopiar sin autorización es un delito. Nutrias La nutria o coipú es difícil de sujetar para inyección IV. No tiene venas superficiales de fácil acceso. Puede realizarse la intubación endotraqueal en animales anestesiados mediante un tubo ligeramente flexible con un estilete curvo. Es posible intubar sin visualizar la abertura laríngea. Los animales con peso de 3 a 5 kg requieren una sonda endotraqueal de 5 mm. Tras la inserción puede sobrevenir apnea. Después de la intubación puede mantenerse la anestesia con un anestésico inhalable. Se ha valorado la combinación de ketamina (10 a 20 mg/kg) más 2 mg de xilazina en nutrias de 4 a 5 kg para operación de amputación de la cola. Se produjo anestesia prolongada con 20 mg/kg de ketamina, mientras que 10 mg/kg fueron insuficientes para la intervención. La administración de medetomidina (0.1 mg/kg IM) más ketamina (5 mg/kg IM) induce anestesia rápida en nutrias. La inmovilización dura unos 40 a 60 min. El atipamezol (0.5 a 0.7 mg/kg IM) despierta a los animales en 5 a 10 min. La dosis de atipamezol debe ser 4 a 5 veces la de medetomidina. La atropina (0.1 mg/kg) es eficaz como preanestésico para reducir las secreciones salivales. Anestesia e inmovilización de. . . 321 © Editorial El manual moderno Fotocopiar sin autorización es un delito. de xilazina (2 a 3 mg/kg IM), que induce 30 a 40 min de sedación. Puede administrarse ketamina IM en dosis de 10 a 20 mg/kg junto con esta dosis de xilazina para inducir una inmovilización más completa con relajación muscular y una recuperación tranquila. También se ha administrado medetomidina (50 mg/kg IM) combinada con ketamina (5 mg/kg IM) para inmovilización a corto plazo. El Telazol® (tiletamina–zolazepam) puede ser una alternativa adecuada para la inmovilización con una dosis IM de 8 a 10 mg/kg. La inyección IP de pentobarbital en dosis de 0.05 mg/g de peso corporal se ha usado en varios géneros de murciélagos (Rhinolophus, Hipposideros, Tadarida, Molussus, Eptesicus, Chilonycteris y Artibeus) para implantar de manera quirúrgica electrodos en la ventana oval del caracol o en el encéfalo. Se han empleado dosis menores (0.03 a 0.045 mg/g) en Myotis lucifugus y Pleocotus townsendii. Pueden administrarse de manera segura isoflurano o sevoflurano por mascarilla o en una cámara de inducción para anestesiar murciélagos. Después de la inducción por mascarilla, los megaquirópteros pueden intubarse (2 a 3 mm DI) para mantener la anestesia. Al intubar murciélagos debe tenerse cuidado de evitar laceraciones con los dientes y contacto directo con la saliva. El acceso IV es factible a través de los vasos braquiales que se encentran sobre la parte distal del húmero. Armadillos Hay 10 géneros vivos de armadillos. Dasypus novemcinctus, el más común, pesa 4 a 5 kg en la edad adulta. Los armadillos deben sujetarse cerca de la base de la cola, para evitar las garras posteriores. Dado que estos especímenes pueden sustraer una gran cantidad de oxígeno, es posible que permanezcan completamente quietos sin respirar por largos periodos. Los armadillos también tienen la capacidad de recuperarse de manera espontánea de episodios repetidos de fibrilación ventricular. Pueden administrarse anestésicos en los tejidos subcarpales o los músculos paraespinales insertando una aguja entre dos bandas, apenas a un lado de la línea media. El sitio debe desinfectarse para evitar el riesgo de formación de absceso. Las inyecciones IV pueden realizarse en las dos evidentes venas femorales superficiales. La vena femoral es la única vena superficial accesible que puede cateterizarse con facilidad. Al parecer, combinaciones de neuroleptoanalgésicos (p. ej., fentanilo–droperidol, 0.20 a 0.25 mL/kg IM) producen suficientes depresión y analgesia para operaciones. Se han realizado intervenciones más prolongadas con la infusión IV lenta de tiopental. Infundidos en un periodo de 1 h, 5 mL de solución al 0.5% son adecuados y seguros para la mayoría de los adultos. La dosis habitual es de 5 a 6 mg/h. De manera alternativa, se ha administrado pentobarbital (25 mg/ kg IV) en la vena femoral superficial. La mitad de la dosis se administra con rapidez, seguida del resto hasta obtener el efecto. No se ha informado que apnea y retención del aliento sean un problema con esta técnica. Se han valorado Telazol® (8.5 mg/kg IM), xilazina (1 mg/kg) con ketamina (7.5 mg/kg) y medetomidina (75 mg/kg) con ketamina (7.5 mg/kg) por sus efectos anestésicos después de la administración IM. Las tres combinaciones indujeron anestesia en 5 min. Los armadillos se inmovilizaron por unos 45 min y la recuperación requirió 2 a 3 h. Cuando se usó atipamezol para antagonizar la medetomidina, la recuperación se redujo a 15 min o menos. La anestesia por inhalación con isoflurano o sevoflurano se logra fácilmente en una cámara de inducción. Puede usarse premedicación con atropina (dosis total, 0.1 mg IM) para reducir las secreciones. Una sonda endotraqueal suave de polietileno de 4 a 8 mm DI se coloca con facilidad 322 Manual de anestesia y analgesia en. . en la abertura laríngea con el uso de un laringoscopio. Después de la intubación, la anestesia puede mantenerse con agentes inhalables. Hurones En hurones se induce por lo regular anestesia con sevoflurano o isoflurano en una cámara de inducción. Puede administrarse atropina (0.04 mg/kg) SC o IM antes de la inducción. Para mantener la anestesia se administran entonces agentes inhalables por mascarilla o sonda endotraqueal. Algunas mezclas inyectables para producir periodos breves de anestesia en hurones son ketamina (26 mg/kg IM) más acepromazina (0.22 mg/kg IM); ketamina sola (20 a 30 mg/kg IM) para producir anestesia quirúrgica ligera por 40 a 60 min; alfaxalona/alfadolona (12 a 15 mg de esteroide total/kg IM), que es una mezcla (3:1) de alfaxalona con acetato de alfadolona, para producir 15 a 30 min de anestesia ligera; y Telazol® en dosis de 5 a 10 mg/kg IM. Una mezcla de Telazol® (250 mg de tiletamina y 250 mg de zolazepam) solubilizada en 4 mL de ketamina (400 mg) y 1 mL de xilazina al 10% (100 mg/mL), diseñada para uso en gatos exóticos, puede usarse en hurones y gatos ferales en una dosis de 0.03 a 0.04 mL/kg IM. Esta mezcla se ha usado para castración, recorte de garras y operaciones intraabdominales. La medetomidina (0.1 mg/kg IM) también puede combinarse con ketamina (5 mg/kg IM) para inducir un breve periodo de anestesia en hurones. Zorrillos En general, para anestesiar zorrillos se prefieren anestésicos volátiles de efecto rápido como isoflurano o sevoflurano. En el caso de individuos pequeños, una bolsa de plástico transparente desechable es un recipiente ideal para la inducción con sevoflurano o isoflurano. La anestesia se induce mientras el zorrillo se halla en la bolsa. Una vez inmovilizado, el zorrillo se extrae y la bolsa se desecha. Este procedimiento debe realizarse en un recinto bien ventilado para minimizar la exposición de las personas a gases anestésicos y almizcle del zorrillo. La mejor edad para extirpar las glándulas odoríferas en estos animales parece ser la semana quinta a sexta, cuando el peso aproximado del zorrillo es de 1 kg. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Visón Para inmovilizar al visón es conveniente un tubo de metal o plástico transparente. Las dimensiones del tubo varían con la talla del visón que se inmovilice. Un extremo del tubo se cubre con cinta para ductos y el otro se deja abierto. El animal se introduce de cabeza en el tubo. Es posible administrar vacunas u otras inyecciones por las vías SC o IM en la superficie interna de la pata posterior mientras el visón está inmovilizado. Se ha inducido anestesia con isoflurano o sevoflurano. Se prefiere el mantenimiento de la anestesia mediante sistemas de suministro, con o sin recirculación. En situaciones de campo se ha inmovilizado y anestesiado con éxito a visones y turones mediante una combinación de ketamina (10 mg/kg IM) y medetomidina (0.20 mg/kg IM) para implantarles radiotransmisores. Se logró la inducción en menos de 4 min y la inmovilización duró 28 a 54 min. Informes más antiguos indican que puede administrarse reserpina (0.036 a 0.05 mg) VO en alimento para hacer al visón menos nervioso y excitable. Al parecer, el margen de seguridad es amplio, con pocos efectos tóxicos acumulativos. Anestesia e inmovilización de. . . 323 Se ha descrito una técnica anestésica para zorrillos silvestres capturados con trampas en la que se emplea una jeringa en el extremo de una extensión de 2.7 m. El operador permanece a esa distancia mientras realiza la inyección IM, lo cual facilita el manejo sin exponerse al almizcle y mordeduras. La combinación inmovilizante de ketamina (16 mg/kg IM) más xilazina (8 mg/kg IM) ha sido eficaz en zorrillos. La anestesia se induce en menos de 3 min y la inmovilización dura unos 30 min. Es menos probable que los zorrillos lancen almizcle si el operador realiza movimientos lentos y deliberados. Cuando los zorrillos lanzan almizcle lo dirigen contra la jeringa en la extensión al inyectarse el fármaco. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Armiño y comadreja El armiño (Mustela erminea) y la comadreja (Mustela nivalis) son en extremo feroces y difíciles de manipular. Su mordedura atraviesa los guantes de piel más gruesos y, si se los oprime con fuerza, pueden asfixiarse. Un método satisfactorio y no traumático para inducir anestesia consiste en colocar estos animales en una cámara de inducción unida al extremo de la jaula por medio de una división removible. A continuación se introducen isoflurano o sevoflurano en la cámara mediante una línea de gas nuevo desde el vaporizador. Las concentraciones de inducción seguras oscilan entre 2.5 y 4.0%. Una vez que el animal es incapaz de incorporarse, puede extraerse de la cámara y mantenerse con anestesia inhalable a concentraciones más bajas mediante mascarilla facial o sonda endotraqueal. La técnica de intubación es similar a la que se usa en hurones. Puede mantenerse anestesia quirúrgica ligera con concentraciones de 1.5 a 2.0% de isoflurano o 2 a 3% de sevoflurano. Como alternativa, se han empleado medetomidina (0.1 mg/kg IM) más ketamina (5 mg/kg IM) para inmovilizar armiños, con éxito variable. Tejones Los tejones (Taxidea taxus), de disposición feroz, se han inmovilizado con éxito por medio de ketamina. La dosis eficaz promedio es de 20 mg/kg IM y algunas veces se administran dosis más pequeñas repetidas. La recuperación completa tiene lugar en 90 a 180 min, según sea la dosis total administrada. En varios estudios se han comparado combinaciones de anestésicos en tejones contra la ketamina sola (20 mg/kg). La adición de midazolam a dosis más bajas de ketamina (10 a 15 mg/kg) no mejoró la anestesia y tampoco lo hizo la combinación de medetomidina (80 mg/ kg) con sólo 5 mg/kg de ketamina. Sin embargo, la combinación de butorfanol, medetomidina y ketamina mejoró en general la relajación muscular y anestesia. Después de la inmovilización con ketamina (15 a 25 mg/kg IM) más xilazina (0.5 a 1.0 mg/kg) o Telazol® (8 a 12 mg/kg) más xilazina (0.5 a 1.0 mg/kg), la anestesia puede mantenerse con isoflurano o sevoflurano administrados por mascarilla o sonda endotraqueal. Prociónidos silvestres Entre los miembros de esta familia figuran el cacomiztle, mapache, coatimundi, coatí de montaña, pequeño panda y gran panda. Las técnicas anestésicas usadas en estas especies se basan en mayor medida en la experiencia obtenida con inmovilización y anestesia de mapaches. Estas técnicas anestésicas parecerían aplicables a la mayoría de los prociónidos. La anestesia IV no es práctica por la dificultad para sujetar a estos especímenes. Se han usado extensamente 324 Manual de anestesia y analgesia en. . Marsupiales Zarigüeyas y falangeros pertenecen a varias familias de marsupiales. De estos marsupiales, la especie más común en cautiverio es la ardilla voladora marsupial. Estos pequeños animales se anestesian mejor con sevoflurano o isoflurano en una cámara o por mascarilla. Los agentes inhalables pueden administrarse con un sistema cerrado o por mascarilla una vez que el paciente está sedado de manera adecuada. Para intervenciones prolongadas puede administrarse tiopental para inducción de anestesia e intubación, seguido de isoflurano o sevoflurano. Para especies más pequeñas, como la ardilla voladora marsupial, la técnica preferida es el uso de una cámara de inducción con un anestésico inhalable de efecto rápido (isoflurano o sevoflurano), pero puede ser difícil de valorar la presencia de depresión del sistema nervioso central cuando estas especies están estresadas (entran en sueño fisiológico) y dejan de reaccionar a los estímulos externos. Como alternativa, pueden usarse ketamina (20 mg/kg IM) o Telazol® (5 a 6 mg/kg IM) solos. Se han empleado ketamina (20 a 25 mg/kg IM) y fentanilo–droperidol (0.75 a 1.0 mL/kg IM) para inmovilizar zarigüeyas de manera satisfactoria para manipulación. En otro informe se produjo anestesia quirúrgica en zarigüeyas con 5 mg/kg IM de xilazina combinada con ketamina, 20 a 30 mg/kg IM. Los koalas también se han inmovilizado de manera segura y rápida con alfaxalona– alfadolona (Althesin®) en dosis de 3 a 6 mg/kg IM o 1 a 2 mg/kg IV. Insectívoros Erizos y otros insectívoros, como tenrecs, musarañas y topos, son fáciles de anestesiar con isoflurano o sevoflurano en oxígeno en una cámara de inducción o una caja. La anestesia puede mantenerse al suministrar el fármaco inhalable por mascarilla facial o sonda endotraqueal a una concentración de 0.5 a 1.5% para isoflurano y 2.5 a 3.5% para sevoflurano. Los erizos pueden intubarse con relativa facilidad. El anestésico inyectable más utilizado es ketamina (5 a 20 mg/ kg IM), sola o combinada con diazepam (0.5 a 2.0 mg/kg IM), xilazina (0.5 a 1.0 mg/kg IM) o medetomidina (100 mg/kg IM). El Telazol® también es eficaz en dosis de 1 a 5 mg/kg IM. La hipotermia es un peligro en virtud de la pequeña talla del erizo. Pueden administrarse líquidos IV o SC en el tejido laxo que subyace a las espinas. La grasa SC puede representar © Editorial El manual moderno Fotocopiar sin autorización es un delito. ketamina o Telazol® y resultan más eficaces cuando se complementan con un a2-agonista (p. ej., xilazina o dexmedetomidina). Una fenotiazina (acepromazina) o una benzodiazepina (diazepam) tranquilizante también pueden combinarse con ketamina. Cuando esta última se ha utilizado sola en dosis de 20 a 30 mg/kg IM, la inducción tarda 3 a 7 min, y puede esperarse que ocurra la recuperación en 45 a 90 min. Más a menudo se usa una combinación de ketamina en dosis más baja (10 mg/kg IM) con xilazina (2 mg/kg IM) u otro a2-agonista para inmovilizar prociónidos silvestres en la actualidad. La inducción ocurre en 3 a 5 min después de inyección IM. Al parecer, la anestesia es adecuada, dura 15 a 20 min, y puede prolongarse con la administración de ¼ a ½ de la dosis IM combinada original o bien isoflurano o sevoflurano por mascarilla facial o sonda endotraqueal. Se ha usado Telazol® en diversos prociónidos para inmovilización química y operaciones menores breves. Una dosis de 10 mg/kg IM induce anestesia por 20 a 60 min. Con esta dosis persisten los reflejos (incluidos palpebral, corneal, auricular, faríngeo y laríngeo). Anestesia e inmovilización de. . . 325 © Editorial El manual moderno Fotocopiar sin autorización es un delito. hasta 50% del peso corporal del erizo y demorar la absorción de líquidos y anestésicos cuando se inyectan en este tejido. Las inyecciones IM requieren una longitud de la aguja suficiente para rebasar los tejidos adiposos SC. Pueden administrarse buprenorfina (0.01 mg/kg) o butorfanol (0.2 a 0.4 mg/kg IM o SC) con fines de analgesia después de operaciones. Revisado a partir de “Laboratory Animals” por Paul A. Flecknell, Claire A. Richardson y Aleksandar Popovic; y “Exotic and Zoo Animal Species” por Rachael E. Carpenter y David B. Brunson in Lumb and Jones’ Veterinary Anesthesia and Analgesia, Fourth Edition. Capítulo 10 Anestésicos locales y técnicas analgésicas regionales Roman T. Skarda y William J. Tranquilli Los anestésicos locales son un grupo de compuestos químicamente relacionados que se unen de manera reversible a conductos de sodio y bloquean la conducción de impulsos en fibras nerviosas. La interrupción de la transmisión neural en nervios o haces aferentes sensitivos por un fármaco anestésico local después de infiltración de tejido local, bloqueos de nervios regionales o inyección epidural o intratecal (subaracnoidea) previene o reduce de manera singular y muy eficaz las señales aferentes de dolor o nociceptivas durante la operación y después. Con tales técnicas no sólo es completa la analgesia en la zona desensibilizada, sino que además se elimina la sensibilización secundaria (central) inmediata al dolor y se reduce la facilitación central de la vía nociceptiva. El uso de un anestésico local es esencial si se practica la intervención en un sujeto consciente y para aliviar el dolor relacionado con traumatismo e inflamación. El empleo de una técnica anestésica local antes del procedimiento también beneficia a los pacientes al evitar la anestesia general o reducir la cantidad necesaria de anestésico general. La analgesia sostenida en el periodo de recuperación es un gran beneficio para los pacientes cuando se usa un anestésico local con efecto anestésico más prolongado. El conocimiento de la farmacología clínica de anestésicos locales individuales hace posible un bloqueo nervioso eficaz y seguro. Las técnicas anestésicas locales que se consideran aquí tienen sus propios tiempos de inicio del efecto, duración de acción y riesgo de complicaciones. Electrofisiología La conducción de impulsos en membranas excitables requiere un flujo de iones sodio a través de conductos de sodio selectivos hacia el nervio en respuesta a la despolarización de la membrana del nervio. Los conductos de sodio controlados por voltaje de los mamíferos constan de una gran subunidad a que contiene cuatro dominios homólogos (D1 a D4), cada uno con seis segmentos transmembrana de hélice a sustitutos (S1 a S6) y 1 o 2 subunidades b auxiliares más pequeñas. En condiciones de reposo, los iones sodio se encuentran a mayor concentración fuera del nervio que dentro, y a ambos lados de la membrana axónica existe una diferencia de potencial (voltaje), Essentials of Small Animal Anesthesia and Analgesia, Second Edition. Edited by Kurt A. Grimm, William J. Tranquilli, Leigh A. Lamont. © 2011 John Wiley & Sons, Inc. Published 2011 by John Wiley & Sons, Inc. 326 © Editorial El manual moderno Fotocopiar sin autorización es un delito. Introducción Anestésicos locales y. . . 327 B H+ B B H+ B + H+ B H+ B H+ + H+ Epineuro B B + H+ Axoplasma © Editorial El manual moderno Fotocopiar sin autorización es un delito. Figura 10-1. Sitio de acción de anestésicos locales aminoéster y aminoamida. La forma base, sin carga, se difunde con mayor facilidad a través de las barreras lipídicas e interactúa en la porción intermembrana del conducto de sodio. La forma con carga (BH+) accede a un receptor específico a través de la superficie axoplásmica del poro del conducto de sodio. Modificado a partir de Carpenter y Mackey, pág. 414, con autorización. conocida como potencial de reposo, de 270 mV. Cuando se estimula el nervio, la permeabilidad de la membrana a los iones sodio aumenta de manera transitoria, y el sodio atraviesa la membrana por medio de conductos iónicos selectivos para sodio que existen en diversas conformaciones (es decir, de reposo, abierta e inactiva), de tal modo que se despolariza la membrana plasmática. Durante la despolarización, el potencial de acción se desplaza de manera obligatoria a lo largo del axón y ello posibilita que el impulso se propague a lo largo de la membrana nerviosa. Después de algunos milisegundos, la membrana se repolariza como resultado de la desactivación o “cierre” de los conductos de sodio. Durante la repolarización, la membrana deja de ser permeable a los iones sodio, pero los conductos de potasio se abren, y los iones potasio fluyen en favor de su gradiente electroquímico hacia fuera de la célula. Mecanismos de acción Se desconoce el modo de acción preciso de los anestésicos locales, pero quizá la teoría más aceptada es la combinación de expansión de membrana y receptor específico. En esta teoría, los anestésicos locales que son compuestos de amonio cuaternario (amidas) y ésteres pasan primero por la membrana celular como la base sin carga (B) para llegar al sitio intracelular en que dicha base se protona y el catión (ácido conjugado, BH+) se une al receptor y “tapona” el conducto (figura 10-1). Quizá la idea mejor aceptada señala que los anestésicos locales se unen a conductos iónicos selectivos para sodio en los nervios, de tal manera que se inhibe la permeabilidad al sodio 328 Manual de anestesia y analgesia en. . que subyace al potencial de acción y la despolarización de la membrana celular. La transmisión eléctrica a través de un axón mielinizado cesa cuando se aplica suficiente concentración del anestésico para bañar al menos tres nodos de Ranvier consecutivos. Bloqueo dependiente de frecuencia Los anestésicos locales pueden diferir en su capacidad de unirse a conductos de sodio, según sea el estado del conducto. Los canales de sodio conductores (abiertos) y desactivados tienen mayor afinidad por los anestésicos locales que los no conductores (en reposo). La estimulación repetitiva de fibras nerviosas incrementa la afinidad de unión del sitio receptor por anestésicos locales y facilita el bloqueo neural, un fenómeno llamado bloqueo dependiente de uso, bloqueo dependiente de frecuencia o bloqueo fásico. Actividad antimicrobiana Entre los beneficios adicionales (y algunas veces controvertidos) de los anestésicos locales, que se administran de manera sistemática antes de operaciones cutáneas menores y para el alivio del dolor posoperatorio, se encuentran un potente efecto antimicrobiano y una mejor cicatrización de heridas. La administración de lidocaína al 1, 2 y 4% inhibe (de manera proporcional a la dosis) la proliferación de todas las cepas de bacterias que se han examinado (p. ej., Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa y Enterococcus faecalis); la susceptibilidad de las bacterias a la lidocaína no cambia con la adición de adrenalina. De modo similar, la administración de lidocaína al 2 y 5% y prilocaína al 1% ejerce un potente efecto antimicrobiano en diversas bacterias, como E. coli, S. aureus, P. aeruginosa y Candida albicans. En contraste, la bupivacaína al 0.25 y 0.5% muestra escasa eficacia antimicrobiana, y la ropivacaína carece de efecto antimicrobiano en estos microorganismos. Estructura química Todos los anestésicos locales contienen un anillo aromático en un extremo de la molécula y una amina en el otro, separados por una cadena de hidrocarburo (cuadro 10-1). El extremo aromático © Editorial El manual moderno Fotocopiar sin autorización es un delito. Otros mecanismos de acción Los anestésicos locales se unen a muchos sitios distintos que pueden contener diversos conductos de sodio diferentes. Los conductos de sodio de corazón, encéfalo y axones no son idénticos. Sin embargo, si los anestésicos locales alcanzan la suficiente concentración tisular, afectan a todas las membranas excitables, incluidas las de corazón, encéfalo y unión neuromuscular. Los mecanismos moleculares por medio de los cuales los anestésicos locales producen analgesia epidural o raquídea (subaracnoidea) pueden incluir unión del anestésico local a conductos de sodio y potasio dentro de las astas dorsal y ventral y unión a conductos de calcio neurales, lo que causa hiperpolarización de membranas celulares. Las alteraciones del ion calcio (Ca2+) en la membrana podrían causar la deformación o expansión de la membrana celular, y por tanto la transmisión o conducción de impulsos nerviosos. Los anestésicos locales podrían inhibir la unión de la sustancia P e inducir aumentos del calcio intracelular y potenciar corrientes de cloruro mediadas por ácido g-aminobutírico (GABA) al inhibir la captación de GABA. Anestésicos locales y. . . 329 proviene del ácido benzoico o la anilina y es lipófilo. El extremo amino procede del alcohol etílico o el ácido acético y es hidrófilo. La sustitución de grupos alquilo en el anillo aromático o el extremo amino incrementa la liposolubilidad y la potencia. © Editorial El manual moderno Fotocopiar sin autorización es un delito. Quiralidad En general, los anestésicos locales se expenden en el comercio como mezclas racémicas de estereoisómeros ópticos R-(+) y S-(–). Las diferencias de estructura tienen como resultado diversas acciones farmacodinámicas y farmacocinéticas. La ropivacaína se comercializa como clorhidrato del enantiómero S-(–) puro. Posee una baja incidencia de efectos tóxicos cardiovasculares y en el sistema nervioso central (SNC), una preocupación con el uso de la bupivacaína racémica. Además, la ropivacaína epidural es similar a la bupivacaína en inicio, profundidad, duración y grado de bloqueo sensitivo, aunque el bloqueo motor es menos intenso y más breve. La levobupivacaína es un enantiómero S-(–) puro similar a la ropivacaína y también es menos tóxica que la bupivacaína, lo cual es atribuible a una menor afinidad por tejido encefálico y miocárdico respecto del enantiómero R-(+) o la bupivacaína racémica. Grupos químicos Los anestésicos locales de utilidad clínica se dividen en esencia en aminoésteres y aminoamidas, con base en el enlace químico entre la parte aromática y la cadena de hidrocarburo (cuadro 10-1). Los aminoésteres tienen un enlace éster y las aminoamidas un enlace amida. La naturaleza del enlace (éster o amida) ejerce un notable efecto en la estabilidad química y la vía metabólica. Entre los anestésicos locales con enlace éster figuran cocaína, benzocaína, procaína, cloroprocaína y tetracaína. La mayor parte de los ésteres se hidrolizan con facilidad por acción de la colinesterasa plasmática y tienen semividas breves cuando se almacenan en solución sin conservadores. Entre los anestésicos locales con enlace amida se incluyen lidocaína, prilocaína, dibucaína, etidocaína, mepivacaína, bupivacaína, levobupivacaína, ropivacaína y articaína. Los agentes amida son muy estables, no los hidroliza la colinesterasa, y dependen de la degradación enzimática en el hígado. La estructura amida de la articaína es similar a la de otros anestésicos locales, pero contiene un grupo éster adicional, que las esterasas hidrolizan rapidez, lo que acorta la duración de su efecto. Ropivacaína y levobupivacaína se sintetizan como isómeros ópticos sólo S-(–). Otros anestésicos locales existen como racematos o carecen de carbonos asimétricos. La acción clínica de los anestésicos locales puede describirse con base en su liposolubilidad, potencia anestésica, rapidez de inicio, duración del efecto y tendencia al bloqueo diferencial. Estas propiedades no son independientes entre sí y su relevancia mutua puede compararse en el cuadro 10-2. Bloqueo nervioso diferencial Aún existe controversia en torno de la susceptibilidad diferencial de las fibras nerviosas a anestésicos locales y su relación con déficits funcionales selectivos. Es evidente que existe bloqueo Duranest® Carbocaine® Marcaine® Chirocaine® Etidocaína Mepivacaína Bupiva