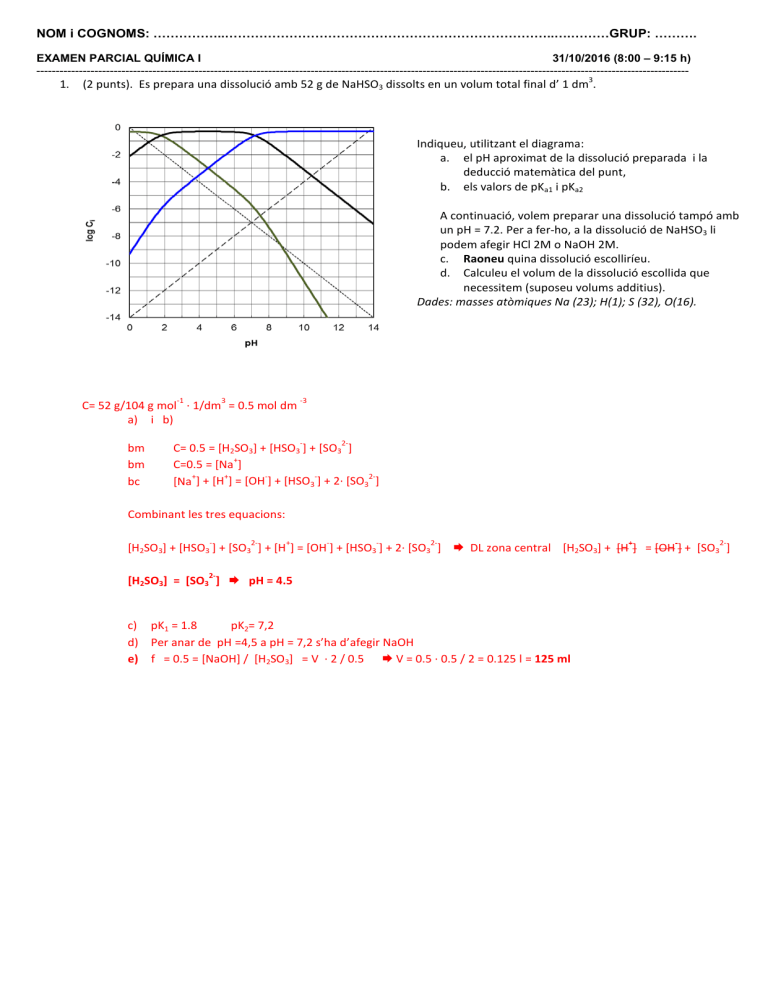
NOM i COGNOMS: ……………..…………………………………………………………………..….………GRUP: ………. EXAMEN PARCIAL QUÍMICA I 31/10/2016 (8:00 – 9:15 h) ------------------------------------------------------------------------------------------------------------------------------------------------------------------------- 1. 3 (2 punts). Es prepara una dissolució amb 52 g de NaHSO3 dissolts en un volum total final d’ 1 dm . Indiqueu, utilitzant el diagrama: a. el pH aproximat de la dissolució preparada i la deducció matemàtica del punt, b. els valors de pKa1 i pKa2 A continuació, volem preparar una dissolució tampó amb un pH = 7.2. Per a fer-ho, a la dissolució de NaHSO3 li podem afegir HCl 2M o NaOH 2M. c. Raoneu quina dissolució escolliríeu. d. Calculeu el volum de la dissolució escollida que necessitem (suposeu volums additius). Dades: masses atòmiques Na (23); H(1); S (32), O(16). -1 3 C= 52 g/104 g mol · 1/dm = 0.5 mol dm a) i b) bm bm bc -3 - 2- C= 0.5 = [H2SO3] + [HSO3 ] + [SO3 ] + C=0.5 = [Na ] 2+ + [Na ] + [H ] = [OH ] + [HSO3 ] + 2· [SO3 ] Combinant les tres equacions: - 2- + - - 2- + - 2- [H2SO3] + [HSO3 ] + [SO3 ] + [H ] = [OH ] + [HSO3 ] + 2· [SO3 ] DL zona central [H2SO3] + [H ] = [OH ] + [SO3 ] 2- [H2SO3] = [SO3 ] pH = 4.5 pK2= 7,2 c) pK1 = 1.8 d) Per anar de pH =4,5 a pH = 7,2 s’ha d’afegir NaOH e) f = 0.5 = [NaOH] / [H2SO3] = V · 2 / 0.5 V = 0.5 · 0.5 / 2 = 0.125 l = 125 ml 2. (1 punt). A partir del diagrama logarítmic de l’àcid carbònic justifica utilitzant balanços de massa i de càrrega quina de les següents respostes és correcta: a) b) c) d) El punt S2 és el punt on coincideixen la línia de la forma àcida i la dels ions hidrogen. La concentració de la forma àcida és més gran a la zona de la dreta del punt S2. El pH del carbonat de sodi vindrà donat per l’abscissa del punt on es talla la línia del HCO3 i la dels OH . El pH d’una dissolució de carbonat de sodi és 8,3. Resposta c) El pH del carbonat vindrà donat per l’abscissa del punt on es talla la línia del HCO3 i la del OH bc [Na+] + [H+] = [OH-] + [HCO3-] + 2 [CO3 2-] bm C = [H2CO3] + [HCO3-] + [CO3 2-] bm C = ½ [Na+] Combinant les equacions: 2 [H2CO3] + 2 [HCO3-] + 2 [CO3 2-] + [H+] = [OH-] + [HCO3-] + 2 [CO3 2-] 2 [H2CO3] + [HCO3-] + [H+] = [OH-] DL zona dreta del diagrama abscissa del punt [HCO3-] = [OH-] 3. (1 punt). Justifiqueu quin parell àcid-base escolliríeu per preparar una dissolució tampó de pH = 10. 2Dades: pKa1(H2CO3/ HCO3 ) = 6.3 pKa2 (HCO3 /CO3 ) = 10.3 + pKa (NH4 /NH3) = 9.3 pKa (CH3COOH/ CH3COO ) = 4.8 a) àcid carbònic-hidrogen carbonat de sodi b) àcid acètic-acetat de sodi c) amoníac i hidròxid de sodi d) clorur d’amoni-amoníac Resposta: d) Parell clorur d’amoni-amoníac (àcid/base conjugada) de pKa = 9,3 pH = 9,3 ±1 4. (1 punt) Classifiqueu les següents dissolucions segons siguin àcides, bàsiques o neutres i ordeneu-les de més àcida a més bàsica, suposant que totes tenen la mateixa concentració: NaOH, NH4Cl, HNO3, CH3COONa, NH3, H2CO3, NaClO4, CH3COOH, Na2CO3 , NaCl + Dades: pKa (NH4 /NH3 )= 9,3 pKa1= (H2CO3/ HCO3 )= 6,3 - pKa (CH3COOH/CH3COO ) = 4,8 2pKa2 = (HCO3 /CO3 ) = 10,3 Reposta HNO3 > CH3COOH > H2CO3 > NH4Cl > NaClO4 = NaCl > CH3COONa > NH3 > Na2CO3 > NaOH Àcids Neutres Bases 5. (1 punt) La cinètica de la reacció: A Productes, és de primer ordre. Justifica a partir de l’equació de velocitat quina de les següents respostes és correcta: a) En representar ln [A] vs. t, s’obté una recta de pendent k b) El t ½ és inversament proporcional a [A]0 c) El t ½ és independent de la concentració inicial de reactiu d) En representar [A] vs. t, s’obté una recta de pendent - k e) El t ½ és directament proporcional a [A]0 Per a una reacció de primer ordre: 𝑑𝑑[𝐴𝐴] 𝑣𝑣 = − = 𝑘𝑘[𝐴𝐴] 𝑑𝑑𝑑𝑑 Agrupant variables i integrant: ln[𝐴𝐴] = ln[𝐴𝐴]0 − 𝑘𝑘 𝑡𝑡 Per t = t1/2 [A] = [A]0 /2. Substituint a l’equació anterior s’obté c) t1/2 és constant i independent de la concentració 𝒕𝒕𝟏𝟏/𝟐𝟐 = 𝐥𝐥𝐥𝐥 𝟐𝟐 𝒌𝒌 6. ( 2 punts) Considera la següent reacció exotèrmica: Br2(g) + N2(g) + O2(g) ⇆ 2NOBr(g) (+calor) a) Escriu la corresponent expressió de la constant d’equilibri. b) Calcula la constant d’equilibri de la reacció anterior sabent que té lloc segons les següents dues etapes: 30 2NO(g) ⇆ N2(g) + O2(g) K1= 2,4·10 NO(g) + ½ Br2(g) ⇆ NOBr(g) K2 = 1,4 c) Cap a on està desplaçat l’equilibri en cadascuna de les tres reaccions anteriors. Justifica la resposta. d) Justifica com es modificarà l’equilibri de la reacció global si: La pressió del sistema disminueix S’introdueix O2 en el sistema Augmenta la temperatura a) b) c) d) 𝐾𝐾𝑅𝑅 = 𝑃𝑃𝑁𝑁𝑁𝑁𝑁𝑁𝑁𝑁 2 𝑃𝑃𝐵𝐵𝐵𝐵2 𝑃𝑃𝑁𝑁2 𝑃𝑃𝑂𝑂2 log KR = 2 log K2 – log K1 = 2 · 0,146 – 30,38 = -30,09 KR = 10-30,09 KR << 1. L’equilibri està desplaçat cap a l’esquerra K1 >> 1. L’equilibri està desplaçat cap a la dreta K2 > 1. L’equilibri està desplaçat lleugerament cap a la dreta Si la pressió disminueix, l’equilibri es desplaça cap a on hi ha més nombre de mols en estat gasós (cap a l’esquerra). Si s’introdueix O2, la relació de pressions (Q), Q > K R i el sistema evoluciona disminuint Q. La reacció es desplaça cap a la dreta. Si augmenta la temperatura, la reacció es desplaça cap a l’esquerra per ser una reacció exotèrmica. 7. (2 punts). Donat el següent element 79 35𝑋𝑋 a) Escriu la configuració electrònica de l’estat fonamental i indica de quin element es tracta. b) Escriu i justifica la configuració electrònica de tres dels possibles estats d’oxidació d’aquest element. c) Escriu la reacció de l’element anterior amb aigua i hidrogen. a) L’element amb Z = 35 correspon al Br. Configuració electrònica: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 b) Configuració 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4px2 4py2 4pz2 1s2 2s2 2p6 3s2 3p6 3d10 1s2 2s2 2p6 3s2 3p6 3d10 4s2 1s2 2s2 2p6 3s2 3p6 3d10 4s1 4px1 4py1 4pz1 c) Br2 (g) + H2O HBr (aq) + HBrO (aq) Br2 (g) + H2 (g) 2 HBr (g) Estat d’oxidació -1 Configuració de gas noble següent (Kr) +7 Subcapes plenes +5 Subcapa s plena +3 Subcapa s i p semiplenes









