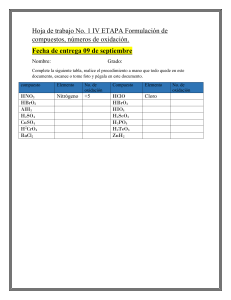
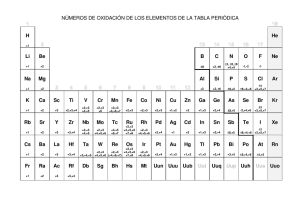
Formulas empíricas y estados de oxidación Samhantha Martínez Gayosso 305521 1. La aspirina es un analgésico muy conocido. Su composición, al analizar 1 gr de aspirina comercial es la siguiente: 0.6 g de C,0.44 g de H y el resto de oxígeno. Determina su fórmula empírica y molecular (Masa molecular M=180u) Puedes utilizar la siguiente ecuación para determinar la fórmula molecular M= n*Mempìrica, donde Mempirica= (No átomos A*masa átomo A +No átomo B*masa átomo B…), n=moles 2. Un compuesto de masa molecular 126 contiene 25.4% de azufre, 38.1% de oxígeno y 36.5 de sodio. ¿Cuál es su fórmula? (S=32, O=16, Na=23). Una vez calculada la formula, investiga a que compuesto pertenece y que propiedades o usos tiene. El compuesto Na2SO3 es el sulfito de sodio. Es un compuesto incoloro, producto de la reacción del ácido sulfuroso u óxido de azufre con hidróxido de sodio. En agua se disuelve con reacción ligeramente básica. Es utilizado en el tratamiento de aguas negras y eliminación de oxígeno disuelto en el agua para calderas. 3. Asignar, de acuerdo a reglas establecidas, el número de oxidación de: a) P en H3 PO4 (H= +1 P=X O= -2 3(+1) + X+ 4(-2) = 0 +3 + X+ (-8) =0 X + -5 =0 X=5) P=+5 b) N en NH4 + N= +3 c) Cl en ClO4 – (X+ 4(-2) = -1 X+ -8 = -1 X=+7 +7 +) Cl=+7 d) P en Na3PO4 P=+3 e) Mn en MnO4 + Mn=+7 4. Calcular los números de oxidación de cada constituyente en: N= +2 O= -2 O= -2 H= -1 P= +5 K= +1 Cl= +5 5. Investiga los conceptos de oxidación y reducción de los elementos químicos y sus principales características de estos fenómenos químicos. La oxidación es una reacción donde un átomo, ión o molécula pierde electrones mientras que la reducción corresponde a la ganancia de electrones de un átomo, ión o molécula. Tanto la oxidación como la reducción dependen del cambio del estado de oxidación del átomo, esto es, de la diferencia de la carga del átomo en una reacción. Las reacciones de oxidación y de reducción siempre ocurren simultáneamente por lo que generalmente se conocen como reacciones de oxido-reducción o reacciones redox. Por ejemplo, la combustión y la corrosión son reacciones de oxido-reducción. La oxidación es la pérdida de electrones por una molécula, átomo o ión. Un elemento se oxida cuando en una reacción pierde electrones; esto se verifica por el aumento en el estado de oxidación del átomo. Mientras mayor es el estado de oxidación de un átomo será mayor el grado de oxidación. La palabra "oxidación" fue usada por primera vez en el siglo XVIII gracias al trabajo del químico francés Antoine Lavoisier cuando identificó el oxígeno en el aire. Para esa época, toda reacción en donde el oxígeno era un reactante se describía como reacciones de oxidación. Hoy sabemos que no todas las reacciones de oxidación involucran la participación del oxígeno. Un agente oxidante es aquel que causa que otro químico sea oxidado. Por ejemplo, cuando el magnesio reacciona con oxígeno para formar óxido de magnesio: 2Mg(s) + O2(g)→ 2MgO(s), el oxígeno causa que el magnesio pierda electrones, por lo tanto, el oxígeno es el agente oxidante y el magnesio es el químico oxidado. Los metales, como el hierro, el cobre y el magnesio son fácilmente oxidados. La reducción es la ganancia de electrones por una molécula, átomo o ión. Un elemento se reduce cuando en una reacción este gana electrones. Esto se verifica por la disminución en el estado de oxidación. Mientras menor es el estado de oxidación de un átomo, mayor es el grado de reducción. Por ejemplo, el cambio de ión cobre, con estado de oxidación 2+, pasa a cobre sólido, con estado de oxidación 0: Cu2+(ac) + 2e- → Cu(s) La palabra "reducción" proviene del latín reduco que significa "restaurar". El proceso de extracción de metales se consideraba como la recuperación del metal a partir de sus compuestos minerales, tal como el hierro a partir del óxido de hierro o el cobre a partir del óxido de cobre (II). Un agente reductor causa que otro químico sea reducido. Por ejemplo, cuando el magnesio reacciona con oxígeno para formar óxido de magnesio: 2Mg(s) + O2(g)→ 2MgO(s), el magnesio causa que el oxígeno gane electrones, por lo que el magnesio viene a funcionar como agente reductor mientras que el oxígeno es reducido. Los metales tienden a perder electrones por lo que actúan como agentes reductores. Bibliografía: 1. Tabla periódica con números de oxidación. Recuperado de: https://quimica.uaq.mx/docs/TP_valencias.pdf 2. Sulfito de Sodio. Recuperado de: https://manuchar.com.mx/productos/papel/sulfito-de-sodio/ 3. Ana Z., Dr. en bioquímica. Oxidación y reducción. Diferenciador. Recuperado de: https://www.diferenciador.com/oxidacion-yreduccion/