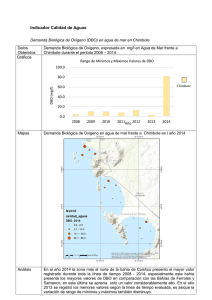
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA EN GEOLOGÍA, MINAS, PETRÓLEOS Y AMBIENTAL CARRERA DE INGENIERÍA AMBIENTAL “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS” LISSETTE ESTEFANÍA CAMPOVERDE PINEDA SERGIO RICARDO LOAYZA PROAÑO Quito D.M., Julio, 2015 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA EN GEOLOGÍA, MINAS, PETRÓLEOS Y AMBIENTAL CARRERA DE INGENIERÍA AMBIENTAL “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS” Proyecto del trabajo de grado presentado como requisito parcial para optar el título de Ingeniero Ambiental LISSETTE ESTEFANIA CAMPOVERDE PINEDA [email protected] SERGIO RICARDO LOAYZA PROAÑO [email protected] TUTOR Dr. Carlos Ordoñez Campain Quito D.M., Julio, 2015 AGRADECIMIENTO A la Universidad Central del Ecuador y a la Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental, por la formación académica recibida durante los años estudiantiles. A la Asociación Hazen & Sawyer- Pi Èpsilon, por permitirnos realizar esta investigación, y a todo el personal por el apoyo constante, logístico y técnico. En especial a los consultores Dr. PhD Fabián Yánez, Dr. PhD Alonso Griborio, Dr. PhD Andre Van Niekerk y Dr. PhD Francisco Carranza por la colaboración y el aporte de sus conocimientos en la realización de esta investigación internacionales. Al Dr. Carlos Ordoñez por su guía en la estructuración de este trabajo de tesis. A todas las personas que de una u otra manera colaboraron con nosotros en la investigación. Lissette Campoverde Ricardo Loayza ii DEDICATORIA A las personas que me enseñaron a ser una persona de bien, responsable y a no darme por vencido por más duras que sean las adversidades, mi abuelo Carlos, mis padres José y Susana y mis hermanos Jorge y Victoria. Ricardo iii DEDICATORIA A Dios, por todas las bendiciones recibidas durante toda la carrera y la elaboración de este proyecto de tesis. A mi familia: Yolanda, Evelyn, Madeleyn y Astrid, por el soporte en mi formación humana y profesional, y el apoyo constante que he recibido día a día. Las amo. Lissette iv AUTORIZACIÓN DE LA AUTORÍA INTELECTUAL Lissette Estefanía Campoverde Pineda y Sergio Ricardo Loayza Proaño; en calidad de autores del trabajo de tesis “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS”, por la presente autorizamos a la UNIVERSIDAD CENTRAL DEL ECUADOR, hacer uso de todos los contenidos que nos pertenecen o parte de los que contienen esta obra, con fines estrictamente académicos o de investigación. Los derechos que como autores nos corresponde, con excepción de la presente autorización, seguirán vigentes a nuestro favor, de conformidad con lo establecido en los artículos 5, 6, 8, 19 y más pertinente de la Ley de Propiedad Intelectual y su Reglamento. Quito, a los 24 días del mes de junio del 2015 Lissette Campoverde Ricardo Loayza CC. 1715011894 CC. 1721829917 v INFORME DE APROBACIÓN DEL TUTOR En mi carácter de Tutor de Trabajo de Grado, presentado por los señores LISSETTE ESTEFANIA CAMPOVERDE PINEDA y SERGIO RICARDO LOAYZA PROAÑO, para optar por el título de INGENIERO AMBIENTAL, cuyo tema es: “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS”, considero que dicho Trabajo reúne los requisitos y méritos suficientes para estar sometido a la presentación pública y evaluación por parte del jurado que se designe. En la ciudad de Quito a los 27 días del mes de mayo de 2015 Dr. Carlos Ordoñez TUTOR vi ABREVIATURAS Y SIGLAS Cía. Ltda.: Compañía Limitada DBO: Demanda biológica de oxígeno d: Día DO: Demanda de oxígeno DQO: Demanda química de oxígeno EPMAPS: Empresa Publica Metropolitana de Agua Potable y Saneamiento F/M: Relación alimento / microorganismo INP: Instituto Nacional de Preinversión K: Velocidad específica de consumo de sustrato Kd: Coeficiente de declinación endógena Kg O2/día: Kilogramos de oxígeno por día Kg SSV/día: Kilogramos de sólidos en suspensión volátiles por día L/día: Litros por día MAE: Ministerio del Ambiente del Ecuador mg/L: Miligramos por Litro Msnm: Metros sobre el nivel del mar N: NKT en el efluente N0: NKT en el afluente NH3-N: Nitrógeno amoniacal NKT: Nitrógeno Kjeldahl Total NO2-N: Nitrito NO3-N: Nitrato ºC: Grados Celsius OD: Oxígeno Disuelto pH: Potencial hidrógeno PO4-P: Fosfato vii Px: Producción de biomasa PVC: Policloruro de vinilo Qa: Caudal del afluente Qe: Caudal del efluente Qw: Caudal de descarte de lodo RAS: del inglés “Returned activated sludge”, lodo de recirculación rg: Tasa de crecimiento bacteriano rsu: Tasa de utilización de sustrato S: Concentración de DBO en el efluente S0: Concentración de DBO en el afluente SST: Sólidos en suspensión totales SSV: Sólidos en suspensión volátiles SSVLM: Sólidos en suspensión volátiles en el licor mezclado TPRC: Tiempo promedio de retención celular TRH, θ: Tiempo de retención hidráulico TULSMA: Texto Unificado de Legislación Secundaria del Ministerio del Ambiente USEPA: United States Environmental Protection Agency UTN: Unidad de turbidez nefelométrica V: Volumen del reactor aeróbico WAS: del inglés “Waste activated sludge”, lodo de descarte X: Sólidos suspendidos volátiles en el reactor aeróbico X e: Sólidos suspendidos volátiles en el efluente Y: Coeficiente de producción de biomasa por consumo de sustrato θc: Tiempo de retención celular viii ÍNDICE GENERAL ÍNDICE GENERAL IX ÍNDICE DE FIGURAS XI ÍNDICE DE TABLAS XII CAPÍTULO I 2 1. PLANTEAMIENTO DEL PROBLEMA 2 1.1. ENUNCIADO DEL PROBLEMA 1.2. ENUNCIADO DEL TEMA 1.3. FORMULACIÓN DEL PROBLEMA 1.4. INTERROGANTES DE LA INVESTIGACIÓN 1.5. HIPÓTESIS 1.6. OBJETIVOS 1.6.1. OBJETIVO GENERAL 1.6.2. OBJETIVOS ESPECÍFICOS 1.7. FACTIBILIDAD Y ACCESIBILIDAD 1.7.1. FACTIBILIDAD 1.7.2. ACCESIBILIDAD 1.8. JUSTIFICACIÓN 2 2 2 2 3 3 3 3 3 3 4 4 CAPÍTULO II 5 2. MARCO TEÓRICO 5 2.1. MARCO INSTITUCIONAL 2.1.1. INSTITUTO NACIONAL DE PREINVERSIÓN (INP) 2.1.2. HAZEN & SAWYER ENVIRONMENTAL ENGINEERS AND SCIENTISTS 2.1.3. EMPRESA PUBLICA METROPOLITANA DE AGUA POTABLE Y SANEAMIENTO (EPMAPS) 2.2. MARCO LEGAL 2.2.1. LEGISLACIÓN NACIONAL 2.2.1.1. Constitución de la República 2.2.1.2. Plan Nacional para el Buen Vivir 2013 – 2017 2.2.1.3. Ley de Gestión Ambiental 2.2.1.4. Texto Unificado de Legislación Secundaria del Ministerio del Ambiente 2.2.1.5. Ley Orgánica De Recursos Hídricos, Usos Y Aprovechamiento Del Agua 5 5 5 5 6 6 6 6 7 7 7 ix 2.2.1.6. Ley de Prevención y Control de la Contaminación Ambiental 2.2.1.7. Acuerdo Ministerial 061 Ministerio del Ambiente Sustituyese el Libro VI del Texto Unificado de Legislación Secundaria. 2.3. MARCO ÉTICO 2.4. MARCO CONCEPTUAL 2.4.1. AGUA RESIDUAL 2.4.2. CARACTERIZACIÓN DE LAS AGUAS RESIDUALES 2.4.2.1. Características Físicas 2.4.2.2. Características Químicas 2.4.2.3. Características Biológicas 2.5.3. TIPOS DE AGUAS RESIDUALES 2.5.4. TRATAMIENTO DE AGUAS RESIDUALES POR LODOS ACTIVADOS 2.5.4.1. Metas básicas del Proceso 2.5.4.2. Tipos De Lodos Activados 2.5.4.3. Operación básica 2.5.4.4. Factores relacionados con el Proceso de Lodos Activados 2.5.5. DETERMINACIÓN DE COEFICIENTES CINÉTICOS 8 9 9 9 9 9 12 15 16 17 17 21 24 25 30 CAPÍTULO III 33 3. DISEÑO METODOLÓGICO 33 3.1. DISEÑO DE LA INVESTIGACIÓN 3.2. IDENTIFICACION DE VARIABLES 3.2.1. VARIABLE DEPENDIENTE 3.2.2. VARIABLE INDEPENDIENTE 3.3. POBLACIÓN Y MUESTRA 3.4. INSTRUMENTOS 3.5. PROCEDIMIENTOS 3.5.1. METODOLOGÍA GENERAL 3.5.1.1. Etapa 1. Instalación, operación y control de la planta piloto 3.5.1.2. Etapa 2. Resultados de laboratorio, procesamiento de datos y cálculo de parámetros 3.5.1.3. Etapa 3. Análisis de resultados 3.6. LIMITACIONES 3.6.1. RECURSOS MATERIALES 3.6.2. TIEMPO 3.6.3. RECURSOS FINANCIEROS 33 33 33 33 33 34 34 34 34 59 63 64 64 65 65 CAPÍTULO IV 66 4. ANÁLISIS DE RESULTADOS 66 4.1. RESULTADOS DE LABORATORIO Y PROCESAMIENTO DE DATOS 4.1.1. Selección de muestras válidas 4.1.2. Muestras seleccionadas para la determinación de los coeficientes cinéticos 66 68 78 x 8 4.2. 4.3. 4.4. 4.5. 4.6. 4.7. PARÁMETROS “IN SITU” CÁLCULO DE PARÁMETROS OBTENCIÓN DE LA GRÁFICA Y DETERMINACIÓN DE COEFICIENTES CINÉTICOS CÁLCULO DE LA PRODUCCIÓN DE BIOMASA CÁLCULO DE REQUISITO DE OXÍGENO CORRELACIÓN ENTRE EL REQUISITO DE OXÍGENO Y LA PRODUCCIÓN DE BIOMASA 83 89 91 92 93 95 CAPÍTULO V 97 5. CONCLUSIONES Y RECOMENDACIONES 97 5.1. CONCLUSIONES 5.2. RECOMENDACIONES 97 99 CAPÍTULO VI 100 6. BIBLIOGRAFÍA 100 GLOSARIO 104 ANEXOS 108 ÍNDICE DE ANEXOS ANEXO A: Protocolo para toma y entrega de muestras de la planta piloto. ANEXO B: Cronograma de actividades ANEXO C: Presupuesto ANEXO D: Resumen de Resultados Fase 1 ANEXO E: Programación de los comandos ejecutables Microsoft Excel 2013 (Visual Basic) ANEXO F: Currículo Vitae de los Autores ÍNDICE DE FIGURAS Figura 1: Lodos activados ....................................................................................................... 17 Figura 2: Proceso de nitrificación ........................................................................................... 18 Figura 3: Mezcla completa ...................................................................................................... 21 Figura 4: Flujo pistón (Convencional) .................................................................................... 22 Figura 5: Estabilización de contacto ....................................................................................... 23 Figura 6: Alimentación Escalonada ........................................................................................ 24 Figura 9: Esquema de sistema operacional en Fase 1 ............................................................. 38 Figura 10: Interfaz del Programa de captura y procesamiento de datos. ................................. 61 xi Figura 11: Línea de tiempo proyecto Planta Piloto ................................................................. 67 Figura 12: Criterios discrecionales para exclusión de datos ................................................... 74 Figura 13: Determinación de Y y Kd ...................................................................................... 79 Figura 14: Valores típicos de coeficientes cinéticos. .............................................................. 79 Figura 15: Variaciones de pH.................................................................................................. 83 Figura 16: Variaciones de alcalinidad ..................................................................................... 84 Figura 17: Oxígeno Disuelto del afluente ............................................................................... 85 Figura 18: Oxígeno Disuelto en los Reactores Aeróbicos ...................................................... 86 Figura 19: Temperatura en los Reactores Aeróbicos .............................................................. 87 Figura 20: Caudal de operación .............................................................................................. 88 Figura 21: Sustrato en el sistema............................................................................................. 90 Figura 22: Obtención de Y y Kd ............................................................................................. 91 Figura 23 Producción de Biomasa y Sustrato (DBO) en el sistema ........................................ 93 Figura 24: Requisito de oxígeno ............................................................................................. 94 Figura 25 Correlación entre el requisito de oxígeno y la producción de biomasa .................. 95 ÍNDICE DE TABLAS Tabla 1: Instituciones colaboradoras en el proyecto ................................................................. 5 Tabla 2: Parámetros típicos de diseño ..................................................................................... 20 Tabla 3: Valores típicos de coeficientes cinéticos para el proceso de lodos activados ........... 32 Tabla 4: Resumen de Parámetros Operacionales de las Fases de Planta Piloto ...................... 37 Tabla 5: Resumen de análisis y pruebas en todas las fases ..................................................... 50 Tabla 6: Principales descargas monitoreadas de la ciudad de Quito ....................................... 59 Tabla 7: Valores Característicos Medios del colector central Iñaquito ................................... 60 Tabla 8: Parámetros físicos y químicos a determinar en el desecho del afluente y efluente... 61 Tabla 9: Parámetros físicos y químicos a determinar en reactores aeróbicos y lodo de exceso.62 Tabla 10: Resumen de resultados por campaña de muestreo .................................................. 68 Tabla 11: Detalle de eventualidades presentadas en Fase 1 .................................................... 69 Tabla 12: Resumen de eventualidades presentadas durante el muestreo ................................ 73 Tabla 13: Check list empleado para descartar muestreos........................................................ 74 Tabla 14: Muestras seleccionadas ........................................................................................... 77 Tabla 15: Cálculos para la determinación de los coeficientes cinéticos ................................. 78 Tabla 16: Análisis y Pruebas del Desecho del Efluente Primario ........................................... 80 Tabla 17: Análisis y Pruebas del Efluente Final ..................................................................... 81 Tabla 18: Análisis y Pruebas de los Reactores Aeróbicos ...................................................... 82 Tabla 19: Variaciones de pH ................................................................................................... 83 Tabla 20: Variaciones de alcalinidad ...................................................................................... 84 Tabla 21: Oxígeno Disuelto del afluente................................................................................. 85 Tabla 22: Oxígeno Disuelto en los Reactores Aeróbicos ........................................................ 86 Tabla 23: Temperatura en los Reactores Aeróbicos ................................................................ 87 Tabla 24: Caudal de operación ................................................................................................ 88 Tabla 25: Datos para determinación de los coeficientes cinéticos Y y Kd .............................. 89 Tabla 26: Cálculo para la determinación de sustrato en el sistema ......................................... 90 Tabla 27: Cálculos para la obtención de los coeficientes Y y Kd ........................................... 91 Tabla 28: Resultados de los Coeficientes cinéticos................................................................. 92 xii Tabla 29: Resultados de Producción de Biomasa ................................................................... 92 Tabla 30: Cálculos para determinar el requisito de oxígeno ................................................... 94 Tabla 31: Correlación entre el requisito de oxígeno y la producción de biomasa................... 95 ÍNDICE DE FOTOGRAFÍAS Fotografía 1 Ubicación de planta piloto ............................................................................. 35 Fotografía 2 Bomba de succión protegida por canastilla de metal ........................................ 39 Fotografía 3 Sistema de poleas de la bomba sumergible y bypass de flujo ........................... 40 Fotografía 4: Tanque de criba (izquierda) .............................................................................. 40 Fotografía 5: Rejillas removibles ........................................................................................... 41 Fotografía 6: Tanque de igualación ........................................................................................ 41 Fotografía 7: Tanque de reserva ............................................................................................. 42 Fotografía 8: Vista interior Planta Piloto ............................................................................... 42 Fotografía 9: Sedimentador primario ..................................................................................... 43 Fotografía 10: Caja de distribución de flujo ........................................................................... 43 Fotografía 11: Tanque Anóxico 1 .......................................................................................... 44 Fotografía 12: Vista superior de Tanque Aeróbico ................................................................ 45 Fotografía 13: Vista frontal de Tanque Aeróbico .................................................................. 45 Fotografía 14: Sistema de aireación reactores ........................................................................ 46 Fotografía 15: Tuberías de salida, rebose y drenaje de los reactores ..................................... 46 Fotografía 16: Vista lateral Sedimentador secundario ........................................................... 47 Fotografía 17: Vista superior Sedimentador secundario ........................................................ 47 Fotografía 18: Vista frontal Tanque Efluente Final ............................................................... 48 Fotografía 19: Toma de muestra para efluente final .............................................................. 48 Fotografía 20: Tablero de control PLC .................................................................................. 49 Fotografía 21: Apertura de muestreador ................................................................................ 52 Fotografía 22: Extracción del botellón con muestra .............................................................. 52 Fotografía 23: Trasvase de contenido de muestra .................................................................. 53 Fotografía 24: Homogenización y llenado de muestras ......................................................... 53 Fotografía 25: Etiquetado de envases ..................................................................................... 54 Fotografía 26: Preservación de muestra ................................................................................. 54 Fotografía 27: Aforo manual de caudales .............................................................................. 55 Fotografía 28: Control visual de caudales mediante rotámetros ............................................ 56 Fotografía 29: Medidor óptico de oxígeno disuelto ............................................................... 56 Fotografía 30: Medición de oxígeno disuelto en Reactor Aeróbico ....................................... 57 Fotografía 31: Medidor portátil de pH ................................................................................... 57 Fotografía 32: Titulación de muestras .................................................................................... 58 Fotografía 33: Finalización del ensayo .................................................................................. 58 Fotografía 34: Ensayo de IVL en los reactores ...................................................................... 59 xiii UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA EN GEOLOGÍA, MINAS, PETRÓLEOS Y AMBIENTAL CARRERA DE INGENIERÍA AMBIENTAL “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS” Autores: Lissette Campoverde Ricardo Loayza Tutor: Dr. Carlos Ordoñez Junio, 2015 RESUMEN La “Determinación de los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados”; tiene como objetivo general determinar los coeficientes cinéticos de oxígeno y producción de biomasa. El problema radica en el desconocimiento del esquema general con datos reales que permita dimensionar de manera objetiva la Planta de Tratamiento Final para lo cual resulta imprescindible la obtención de los coeficientes cinéticos. La ejecución del presente proyecto tuvo lugar en una planta piloto de lodos activados al final del colector central de Iñaquito en la descarga del Batán, seleccionado tanto por la representatividad de la calidad del agua residual como por la disponibilidad y accesibilidad de servicios. La evaluación de la planta piloto se realizó por medio del procesamiento de datos a través de las múltiples campañas de muestreo, efectuando pruebas experimentales en el laboratorio para obtener las condiciones promedio de operación con el fin de caracterizar el afluente y obtener la cinética del proceso, es decir se seleccionó el lugar de investigación, se procedió al ensamble y operación de la planta piloto, la recolección de muestras y determinación de parámetros “in situ”, el procesamiento de resultados de laboratorio y de campo, selección de muestras para el análisis, cálculo de parámetros para la cinética, obtención de gráficas y determinación de coeficientes cinéticos, y finalmente al cálculo de producción de biomasa y requisito de oxígeno. Los valores de producción de biomasa y requisito de oxígeno se obtuvieron una vez que se determinaron los coeficientes cinéticos Y (producción celular) y Kd (declinación endógena), obteniendo valores para cada tiempo de retención celular, siendo los valores promedio 0,584 Kg de SSV/día y 2,389 Kg O2/día, respectivamente. DESCRIPTORES: <Planta piloto>;<Lodos activados >; <Coeficientes cinéticos>; <Producción de biomasa>; <requisito de oxígeno>; <alimentación escalonada> xiv UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA EN GEOLOGÍA, MINAS, PETRÓLEOS Y AMBIENTAL CARRERA DE INGENIERÍA AMBIENTAL “DETERMINACIÓN DE LOS COEFICIENTES CINÉTICOS DE OXÍGENO Y PRODUCCIÓN DE BIOMASA PARA EL TRATAMIENTO DE LAS AGUAS RESIDUALES DE LA DESCARGA DEL BATÁN POR EL PROCESO DE LODOS ACTIVADOS” Authors: Lissette Campoverde Ricardo Loayza Tutor: Dr. Carlos Ordoñez June, 2015 ABSTRACT "Determination of kinetics coefficients of oxygen and biomass production for treating wastewater of Batán discharge by the activated sludge process"; general objective is to determine the kinetic coefficients of oxygen and biomass production. The problem lies in the ignorance of the general scheme with real data that allow objectively dimension Final Treatment Plant which is essential for obtaining the kinetic coefficients. The implementation of this project took place in a pilot activated sludge plant at the end of the central collector Iñaquito in Batán discharge, selected by both the representativeness of the wastewater quality as the availability and accessibility of services. The evaluation of the pilot plant was conducted by processing data through multiple sampling campaigns conducting experimental tests in the laboratory for average operating conditions in order to characterize the influent and obtain the kinetics of the process, the research site was selected “in situ” parameters, processing of results of laboratory and field selection of samples for analysis, calculation of parameters for kinetics, obtaining graphs and determination of kinetic coefficients proceeded, and finally the calculation of biomass production and oxygen requirement. Values of biomass production and oxygen requirement were obtained once the kinetic coefficients Y (cell production) and Kd (endogenous decline) were determined, obtaining values for each cell retention time, the average values being 0,584 kg VSS / day and 2,389 Kg O2 / day, respectively. KEYWORDS: <Pilot plant> ;< Activated sludge >; < Kinetic Coefficients>; <Biomass production>;<oxygen request>; <step feed > xv INTRODUCCIÓN El crecimiento poblacional acelerado en la ciudad de Quito ha generado desde hace mucho tiempo un desafío para la disposición de efluentes líquidos y sólidos que muchas veces a falta de voluntad política, presupuesto apropiado o simplemente por falta de la mejor técnica ha ocasionado el arrojo indiscriminado de los mismos al medio ambiente, incrementando de este modo la contaminación de los ríos Machángara, San Pedro y Monjas pertenecientes a la cuenca del río Guayllabamba y afectando indirectamente las cuencas aguas abajo (Diario El Comercio, 2012). La problemática de la contaminación de los ríos de Quito ha sido tratada desde inicios de los años 90 mediante estudios integrales y planes de saneamiento que han sido incluidos dentro los Planes Maestros de Agua Potable y Saneamiento en sus respectivos periodos. Se conoce actualmente que desde el 2010 se vienen ejecutando los diseños definitivos de las obras de intercepción y tratamiento de las aguas residuales de parroquias rurales que descargan a los ríos de la cuenca alta del río Guayllabamba (Diario El Hoy, 2013). La propuesta final de este plan comprende el diseño, implementación y manejo de 30 plantas de tratamiento, PTAR (1 metropolitana, 4 medianas y 25 pequeñas) (Hazen & Sawyer, 2014). Para el diseño de dichas obras, es necesaria la medición de ciertos parámetros e indicadores (coeficientes), a lo largo de todo el tratamiento, que se obtienen a partir de una planta piloto que va a ser implementada para la descarga del Batán, motivo de la presente investigación. La construcción de la planta piloto, que será dimensionada a escala técnica, fue propuesta por los ejecutores del proyecto, la Asociación Hazen y Sawyer – Pi Épsilon, con la finalidad de definir con precisión los coeficientes cinéticos requeridos para simular, modelar y validar los procesos seleccionados mediante modelos matemáticos en la fase de factibilidad, y para su posterior uso en la Planta Metropolitana de Tratamiento de Aguas Residuales ubicada en Vindobona. La ubicación de la planta piloto será en la descarga del Batán al final del colector central de Iñaquito (Hazen & Sawyer, 2014), seleccionado tanto por la representatividad de la calidad del agua residual como por la disponibilidad y accesibilidad de servicios. 1 CAPÍTULO I 1. PLANTEAMIENTO DEL PROBLEMA 1.1. ENUNCIADO DEL PROBLEMA La “Determinación de los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados”, es requisito fundamental para el diseño de la planta de tratamiento definitiva, la misma que aportará al programa de descontaminación de los ríos de la cuenca del Río Guayllabamba. 1.2. ENUNCIADO DEL TEMA “Determinación de los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados” Quito, Ecuador, Julio 2015. 1.3. FORMULACIÓN DEL PROBLEMA La ciudad de Quito desde hace mucho tiempo enfrenta un desafío para la disposición de efluentes líquidos y sólidos, ya que ha dispuesto indiscriminadamente los mismos al medio ambiente, incrementando de este modo la contaminación de los ríos. Estos efluentes se constituyen de materia orgánica, componentes tóxicos y microorganismos patógenos procedentes de desechos humanos y actividades industriales, las cuales se originan en una industria o en una comunidad. (Morales, 2013); parte de la solución a este gran problema es la implantación de una planta piloto que simule el tratamiento de aguas residuales mediante lodos activados. El propósito de dicha planta es tener un esquema general con datos reales que permita dimensionar de manera objetiva la Planta de Tratamiento Final para lo cual resulta imprescindible la obtención de los coeficientes cinéticos, lo que constituiría el problema principal. 1.4. INTERROGANTES DE LA INVESTIGACIÓN ¿Cuáles son los parámetros de las muestras recolectadas que se deben medir “in situ”? ¿Cuál es la frecuencia con la que se deberán guardar los datos recolectados? 2 ¿Qué metodología se debe emplear para la determinación de los coeficientes cinéticos? ¿La correlación de los coeficientes de la demanda de oxígeno y de la producción de biomasa es buena? 1.5. HIPÓTESIS ¿Es posible la determinación de los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados? 1.6. OBJETIVOS Determinar los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados. Medir los parámetros “in situ” de las muestras recolectadas. Almacenar los datos diarios en archivos digitales semanalmente. Realizar el tratamiento estadístico de datos de las muestras analizadas por el laboratorio. Calcular los coeficientes cinéticos del requisito de oxígeno y producción de biomasa. Obtener el coeficiente de correlación de la demanda de oxígeno y de la producción de biomasa 1.7. Evaluar los resultados obtenidos. FACTIBILIDAD Y ACCESIBILIDAD La presente investigación es factible porque se cuenta con el talento humano de los estudiantes y con la colaboración de especialistas en el área de consultoría sanitaria y medio ambiente quienes dirigirán de manera coherente y precisa dicha investigación, también se cuenta con los recursos bibliográficos y el tiempo necesario para su elaboración. 3 Se cuenta además con el talento humano de las autores, el tutor asignado por parte de la Facultad, los recursos bibliográficos y el tiempo necesario para su elaboración. En tanto a lo económico, el estudio será financiado por el INP a través de la empresa Hazen & Sawyer -Pi Épsilon en todas sus etapas. Los gastos en los que se incurran por rubros administrativos, materiales, suministros y servicios generales serán asumidos por los investigadores. La presente investigación es accesible ya que se cuenta con un grupo de expertos en el tema, base bibliográfica proveniente de estudios anteriores realizados en varios países y recopilados en artículos científicos, estudios publicados y revistas indexadas, dos laboratorios acreditados que analizarán las muestras obtenidas “in situ”, además del equipo necesario y la tecnología requerida para aquello. 1.8. JUSTIFICACIÓN El presente proyecto de tesis surge del interés principal de la Asociación Hazen & Sawyer – Pi Épsilon por determinar los coeficientes cinéticos de oxígeno y producción de biomasa mediante una planta piloto en el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados; estos coeficientes obtenidos servirán no solamente para el diseño definitivo de la Planta de Tratamiento Vindobona sino que sentará un precedente histórico en estudios de este tipo, brindando un aporte técnico científico a la investigación académica de la ciudad de Quito. Cabe recalcar que el aporte de la presente investigación no consiste únicamente en los resultados objetivos obtenidos, ya que la contribución incluye la metodología utilizada para futuros trabajos o proyectos similares. 4 CAPÍTULO II 2. MARCO TEÓRICO 2.1. MARCO INSTITUCIONAL El presente proyecto de tesis se realiza con la colaboración de las siguientes instituciones: Tabla 1: Instituciones colaboradoras en el proyecto INSTITUCIÓN Instituto Nacional de Preinversión (INP). Asociación Hazen & Sawyer- Pi Épsilon Empresa Publica Metropolitana de Agua Potable y Saneamiento (EPMAPS) Laboratorios GRUNTEC y L3C Universidad Central del Ecuador Fuente: Asociación Hazen & Sawyer- Pi Épsilon Elaborado por: Campoverde, Loayza, 2015. FUNCIÓN DENTRO DEL PROYECTO Financiamiento Ejecución técnica del proyecto Beneficiarios y dueños del proyecto Análisis de muestras Aporte técnico - científico 2.1.1. Instituto Nacional de Preinversión (INP) El Instituto Nacional de Preinversión como ente referente de los procesos y estudios de preinversión como eje estratégico para el desarrollo del Ecuador tiene dos funciones dentro de la ejecución del proyecto: dar seguimiento y financiamiento a las distintas fases. 2.1.2. Hazen & Sawyer Environmental Engineers and Scientists Es una firma internacional de ingeniería ambiental técnicamente centrada, especializada en aguas residuales. Actualmente asociada con la la firma Pi Epsilon, ejecutan lo Diseño Definitivo de las Obras de Intercepción y Tratamiento de las Aguas Residuales para Quito y Parroquias Anexas. 2.1.3. Empresa Publica Metropolitana de Agua Potable y Saneamiento (EPMAPS) La Empresa Pública Metropolitana de Agua Potable y Saneamiento (EPMAPS) a través del Programa de Saneamiento Ambiental (PSA) con el objetivo de cumplir con el Programa de Descontaminación 5 de Ríos de Quito, son beneficiarios y a su vez fiscalizadores del proyecto de Diseño Definitivo de las Obras de Intercepción y Tratamiento de las Aguas Residuales para Quito y Parroquias Anexas. 2.2. MARCO LEGAL El marco legal define el ámbito institucional, de competencias de control y seguimiento de las actividades realizadas durante la presente investigación; para lo cual se han considerado leyes, reglamentos nacionales internacionales vigentes de acuerdo a las características del proceso que son: 2.2.1. Legislación Nacional 2.2.1.1. Constitución de la República Registro Oficial Nº 449, 20 de octubre de 2008. A escala general, el principal articulado de la Constitución aplicable al proyecto es el siguiente: TÍTULO II, DERECHOS, Capítulo segundo, Derechos del buen vivir Sección segunda: Ambiente sano Art. 14. Se reconoce el derecho de la población a vivir en un ambiente sano y ecológicamente equilibrado, que garantice la sostenibilidad y el buen vivir, sumak kawsay. Art. 15. El Estado promoverá, en el sector público y privado, el uso de tecnologías ambientalmente limpias y de energías alternativas no contaminantes y de bajo impacto. La soberanía energética no se alcanzará en detrimento de la soberanía alimentaria, ni afectará el derecho al agua. Art. 74. Las personas, comunidades, pueblos y nacionalidades tendrán derecho a beneficiarse del ambiente y de las riquezas naturales que les permitan el buen vivir. Los servicios ambientales no serán susceptibles de apropiación; su producción, prestación, uso y aprovechamiento serán regulados por el Estado. 2.2.1.2. Plan Nacional para el Buen Vivir 2013 – 2017 Registro Oficial Suplemento 78 de 11-sep-2013. Es la planificación y hoja de ruta del Gobierno Nacional. Manifiesta su postura política y constituye la guía a escala nacional para la consecución de metas y objetivos que permitan alcanzar el Buen Vivir. 6 El Objetivo 7, “Garantizar los derechos de la naturaleza y promover la sostenibilidad ambiental territorial y global”, reconoce los derechos de la naturaleza, orientando esfuerzos a su respeto, mantenimiento y regeneración de sus procesos, como condición indispensable para el desarrollo integral del ser humano y la consecución del Buen Vivir. 2.2.1.3. Ley de Gestión Ambiental Registro Oficial Suplemento 418 ,10 de septiembre de 2004. Establece las directrices de la política ambiental y niveles de participación y obligación del sector público y privado en la gestión ambiental. Es el cuerpo legal específico más importante para la protección del medio ambiente del Ecuador. Contiene normativa referente a prevención, mitigación, control y regulación de actividades contaminantes sobre los recursos naturales. 2.2.1.4. Texto Unificado de Legislación Secundaria del Ministerio del Ambiente Registro Oficial N° E 2, 31 de marzo de 2003. Este documento unifica la legislación secundaria ambiental, facilitando su acceso. Fue expedido mediante Decreto Ejecutivo No.3516. Incluye en el libro VI De La Calidad Ambiental, Título IV, el Reglamento a la Ley de Gestión Ambiental para la Prevención y Control de la Contaminación Ambiental. Este reglamento de la Ley de Gestión Ambiental prevé las normas generales nacionales aplicables a la prevención y control de la contaminación ambiental y de los posibles impactos ambientales negativos que se pueden generar. En este documento se especifica los instrumentos que permiten el control ambiental, tales como, Estudios de Impacto Ambiental, Planes de Manejo Ambiental, Auditorías Ambientales de Cumplimiento, etc., y los tiempos de presentación de estos documentos por parte de las instituciones reguladas por este reglamento. De manera complementaria, este reglamento dispone los criterios para los muestreos y tomas de muestras y demás responsabilidades de los regulados. 2.2.1.5. Ley Orgánica De Recursos Hídricos, Usos Y Aprovechamiento Del Agua Registro Oficial No. 305, 06 de agosto de 2014. El objeto de la presente Ley es garantizar el derecho humano al agua así como regular y controlar la autorización, gestión, preservación, conservación, restauración, de los recursos hídricos, uso y aprovechamiento del agua, la gestión integral y su recuperación, en sus distintas fases, formas y 7 estados físicos, a fin de garantizar el sumak kawsay o buen vivir y los derechos de la naturaleza establecidos en la Constitución. 2.2.1.6. Ley de Prevención y Control de la Contaminación Ambiental Registro Oficial 418, 10 de septiembre de 2004. Establece la prohibición de emitir sustancias contaminantes, sin sujetarse a las correspondientes normas técnicas y regulaciones definidas por los Ministerios de Salud y del Ambiente. Respecto a la prevención y control de la contaminación de agua, prohíbe la descarga de aguas residuales que contengan contaminantes nocivos a redes de alcantarillado, quebradas, acequias, ríos, lagos naturales o artificiales, aguas marítimas o infiltración de terrenos, sin sujetarse a las normas técnicas y regulaciones correspondientes. Respecto a la prevención y control de la contaminación de suelos, prohíbe la descarga de cualquier tipo de contaminantes que alteren la calidad del suelo y afecten la salud humana, flora, fauna, recursos naturales y otros bienes sin sujetarse a las correspondientes normas técnicas y regulaciones. 2.2.1.7. Acuerdo Ministerial 061 Ministerio del Ambiente Sustituyese el Libro VI del Texto Unificado de Legislación Secundaria. Registro Oficial 316, 04 de mayo de 2015. El presente Libro establece los procedimientos y regula las actividades y responsabilidades públicas y privadas en materia de calidad ambiental. Se entiende por calidad ambiental al conjunto de características del ambiente y la naturaleza que incluye el aire, el agua, el suelo y la biodiversidad, en relación a la ausencia o presencia de agentes nocivos que puedan afectar al mantenimiento y regeneración de los ciclos vitales, estructura, funciones y procesos evolutivos de la naturaleza. El acuerdo ministerial modifica, reforma y reconceptualiza tanto cualitativamente como cuantitativamente el Libro VI de Calidad Ambiental del TULSMA. 8 2.3. MARCO ÉTICO La presente tesis de grado busca determinar los coeficientes cinéticos de oxígeno y producción de biomasa para el tratamiento de las aguas residuales de la descarga del Batán por el proceso de lodos activados, logrando de esta manera mejorar establecer los parámetros de diseño de la planta a escala real y contribuir al Programa de Descontaminación de Ríos de la ciudad de Quito. Establecerá también un referente de investigación en estudios de este tipo, por lo que se estructurará de una manera ética, responsable, sin perjudicar a terceras personas ni a las instituciones que colaboran con el trabajo. 2.4. MARCO CONCEPTUAL 2.4.1. Agua residual Las aguas residuales son todas aquellas que han sido utilizadas para diversos fines, cuyo destino son las cloacas y son transportadas mediante sistemas de alcantarillado. Las fuentes de aguas residuales pueden ser de origen doméstico, municipal o industrial. Aguas residuales domésticas se considera a todos los líquidos que provienen diversos lugares como: viviendas, edificios comerciales e institucionales. Aguas residuales municipales se conoce a los residuos líquidos que son transportados por el sistema alcantarillado y tratados en una planta de tratamiento municipal. Mientras que a las aguas que se generan de las descargas de industrias se conoce como aguas residuales industriales, (Davis, 2010). Se denomina también aguas negras a las aguas residuales que provienen de inodoros, es decir, contienen excretas humanas y orina, éstas se caracterizan por tener cantidades grandes de sólidos en suspensión, nitrógeno y coliformes fecales; mientras que se denominan aguas grises a las aguas residuales que provienen de duchas, lavamanos, lavadoras, las cuales presentan cantidades considerables de DBO, sólidos suspendidos, fósforo, grasa y coliformes fecales (Romero, 2004). 2.4.2. Caracterización de las Aguas residuales 2.4.2.1. Características Físicas a. Temperatura El agua residual presenta una temperatura más elevada que el agua de suministro, debido a la incorporación de aguas de diversas fuentes o de diferentes usos las cuales son más calientes. Las temperaturas que se registran durante la mayor parte del año en las aguas residuales son más altas 9 que el agua normal, y solo son menores cuando se presentan climas calurosos, esto se debe a que el calor específico del agua es mucho mayor que la del aire. El momento en que la temperatura de las aguas residuales se ha incrementado de forma anormal se da una proliferación de plantas acuáticas y hongos (Metcalf & Eddy, 2004). Cuando el agua presenta niveles elevados de temperatura la vida acuática es afectada debido a que la concentración de oxígeno disuelto, la velocidad de las reacciones químicas así como la actividad bacteriana se modifican. Mientras que la tasa de sedimentación de sólidos en aguas cálidas es mayor que en aguas frías ocasionado por el cambio de viscosidad (Davis, 2010). El crecimiento de la vida bacteriana se desarrolla óptimamente a temperaturas entre los 25ºC a 35ºC. La digestión aeróbica y la nitrificación se suspenden cuando la temperatura alcanza los 50ºC. Cuando la temperatura es menor de 15ºC la digestión metanogénica es muy lenta, y a temperatura de 5ºC las bacterias autotróficas nitrificantes dejan de operar (Romero, 2004). b. Densidad La densidad del agua residual es igual a su masa por unidad de volumen expresada en kg/m3. La potencial formación de fangos de sedimentación y otras instalaciones de tratamiento depende de la densidad, por lo que es una característica física importante del agua residual. Habitualmente la densidad del agua residual doméstica que no presenta cantidades grandes de residuos industriales es la misma que la del agua limpia a la misma temperatura (Metcalf & Eddy, 2004). c. Olor El olor es producido por la descomposición de la materia orgánica y por los gases que producto de éste proceso son liberados. El agua residual que ha sido descargada recientemente tiene un olor propio, a pesar de ser desagradable, resulta más tolerable que el olor del agua residual séptica, en esta última debido a la acción de microorganismos anaerobios, los cuales producen sulfuro de hidrógeno y dan el olor propio a la misma, esto ocurre por la reducción de los sulfatos a sulfitos (Metcalf & Eddy, 2004). d. Color El agua presenta dos tipos de color: el color de la muestra una vez que se ha removido su turbidez se conoce como color verdadero, y el color que incluye las sustancias que se encuentran en solución, coloidales y también el color debido al material suspendido se conoce como color aparente, éste se determina sobre la muestra original, sin filtración o centrifugación previa (Romero, 2004). 10 El color característico del agua residual que ha sido recientemente generada es grisáceo, pero éste color cambia de gris a gris oscuro y finamente a negro al aumentar el tiempo de generación, transporte dentro de los sistemas de alcantarillado y al producirse condiciones cercanas a las anaerobias debido a la descomposición de materia orgánica (Metcalf & Eddy, 2004). El color en las aguas residuales industriales es un indicador de su contaminación, de igual manera muestra si los procesos que se sigue en su tratamiento son correctos o presentan algún deterioro. La formación de sulfuros metálicos en las aguas residuales sépticas son los que provocan su color negro. Las aguas industriales que presentan colores fuertes son las provenientes de la industria textil y papelera (Romero, 2004). e. Turbiedad Determina la transmisión de la luz en el agua. Este parámetro se lo mide llevando a cabo una comparación entre la intensidad de luz disipada en la muestra de agua y la registrada en una suspensión de referencia en las mismas condiciones (Eckenfelder & Ford, 1970). Constituye una medida visual del material que se encuentra suspendido en las aguas residuales a ser analizadas. Las aguas residuales generalmente son turbias; en aguas residuales tratadas puede ser un factor importante para el control de calidad (Romero, 2004). f. Sólidos Conforman la materia sólida presente en el agua residual. Sólidos totales. Después del proceso de evaporación y secado a 103°C realizado con el agua, queda una materia como residuo, a éste se lo conoce como sólidos totales. Los sólidos totales están formado por material disuelto y no disuelto (sólidos suspendidos). Sólidos disueltos. También conocidos como residuo filtrable. Son determinados directamente o se los puede realizar por diferencia de pesos entre los sólidos totales y los sólidos suspendidos. Sólidos suspendidos. Conocidos también como residuo no filtrable o material no disuelto, los mismos que pueden ser determinados efectuando una filtración por medio de un filtro de asbesto o de fibra de vidrio, en un crisol pesado previamente. Sólidos volátiles y sólidos fijos. Esta determinación se la hace con el fin de conocer la cantidad de materia orgánica presente, se la realiza generalmente en aguas residuales y lodos. Sólidos sedimentables. Son aquellos sólidos que se encuentran en suspensión en el agua residual y posteriormente sedimentarán, sin acción de ningún agente externo, en condiciones tranquilas y por efecto de la gravedad (Romero, 2004). 11 2.4.2.2. Características Químicas a. Materia Orgánica Son sólidos que provienen del reino animal y vegetal, así como de actividades humanas relacionadas con la síntesis de compuestos orgánicos. Generalmente contienen combinaciones de carbono, oxígeno e hidrógeno, y en algunos casos nitrógeno. También pueden estar presentes otros elementos como el azufre, hierro o fósforo, pero en cantidades menores (Liu & Lien, 2001). Entre las principales sustancias orgánicas que se pueden encontrar en el agua residual están: las proteínas (40 – 60%), los hidratos de carbono (25 – 50%), y las grasas y aceites (10%). La urea es otro compuesto orgánico con importante presencia en el agua residual. Sin embargo, la velocidad del proceso de descomposición de la urea es relativamente lenta por lo que es poco común que esté presente en las aguas residuales que no sean muy recientes (Metcalf & Eddy, 2004). b. Hidratos de Carbono Los hidratos de carbono están distribuidos en la naturaleza abundantemente e incluyen azúcares, almidones, celulosa y fibra de madera, y todos estos están presentes en el agua residual. Contienen carbono, oxígeno e hidrógeno. Ciertos carbohidratos como los azúcares son solubles en el agua, mientras que otros son insolubles como los almidones (Metcalf & Eddy, 2004). c. Demanda bioquímica de oxígeno (DBO) La oxidación microbial o mineralización de la materia orgánica es una de las principales reacciones que se producen en los cuerpos naturales de agua, la cual se produce por acción de microorganismos heterotróficos, a los cuales hay que cuantificar (Romero, 2004). Materia orgánica + O2 + nutrientes => CO2 + H2O + nuevas células + Nutrientes + energía Para conocer la concentración de materia orgánica en las aguas residuales el ensayo más importante para su determinación es la DBO a cinco días. La DBO es el oxígeno utilizado por los microorganismos durante la transformación de la materia orgánica presente en el agua residual, la determinación de la DBO se la realiza en condiciones aeróbicas en un período de 5 días a 200 °C. El valor de la DBO en aguas residuales domésticas a 5 días, representa en promedio un 65 a 70% del total de materia orgánica oxidable (Romero, 2004). d. Demanda Química de Oxígeno (DQO) La demanda química de oxígeno es la cantidad de oxígeno disuelto consumido por una determinada cantidad de agua residual durante la oxidación, la cual se la realiza empleando agentes químicos, los 12 cuales se caracterizan por ser fuertemente oxidante. Su determinación es más rápida que la DBO, realizándola una o dos horas si se efectúa en frío o, bien 30 minutos si se la realiza con dicromato en caliente (Metcalf & Eddy, 2004). e. Oxígeno Disuelto (OD) El oxígeno disuelto es un parámetro indispensable para el control de aguas residuales. Constituye la fuente de energía para los seres vivos y puede incrementarse por los siguientes factores: Captación de oxígeno en la interfase aire – agua Acción fotosintética por la presencia de algas verdes Bajas de temperatura Dilución Producto de la respiración de microorganismos, algas y organismos macroscópicos, la cantidad de oxígeno disminuye, a más de estos factores, la cantidad de oxígeno disuelto se ve afectada por incrementos en la temperatura, reacciones químicas, y por la acción metabólica de los organismos (Metcalf & Eddy, 2004). f. Grasas y Aceites Son sustancias poco solubles que se separan del agua residual y flotan formando natas, películas y capas sobre el agua, muy ofensivas estéticamente. Las grasas, aceites y ceras son los principales lípidos que se encuentran en un agua residual. Las bacterias las emplean como alimento, debido a que pueden ser hidrolizadas en los ácidos grasos y alcoholes correspondientes (Romero, 2004). Los aceites y grasas generalmente son biodegradables ya que en su mayoría son de origen animal y vegetal y se los puede tratar en plantas biológicas. Sin embargo grandes cantidades de grasas emulsificadas como las que provienen de mataderos, frigoríficos, lavanderías y otras industrias ocasionan graves problemas al momento de realizar el mantenimiento en las plantas de tratamiento (Lin, 2007). Cuando se trata de grasas y aceites de origen mineral se debe realizar un tratamiento previo ya que en su gran mayoría no son biodegradables y deben ser removidos antes de ingresar al tratamiento biológico. Sin embargo, aún no se conoce algún tipo de proceso que se emplee para diferenciar las grasas y aceites vegetales o animales de las de origen mineral (Romero, 2004). g. pH 13 Son muy difíciles de tratar biológicamente aguas residuales que presenten concentraciones adversas de pH ya que alteran la biota de las fuentes receptoras y en muchos de los casos se acaba con la vida de los microorganismos. En un tratamiento biológico, si el agua tiene un pH menor a 6, se produce la proliferación de hongos sobre las bacterias. A pH bajo el cloro se hace presente ya que predomina el ácido hipocloroso (HClO), el cual tiene poder bactericida; por el contario si las aguas residuales presentan pH alto éstas tendrán nitrógeno en forma gaseosa no iónica (NH3), la cual es tóxica sin embargo se la puede remover mediante arrastre con aire, especialmente cuando el pH presenta valores entre 10,5 y 11,4. Para que un determinado tratamiento sea ideal y para que la existencia de la mayoría de vida biológica sea la adecuada los valores de pH que debe presentar el agua deben ser generalmente de 6,5 a 8,5 (Romero, 2004). h. Alcalinidad La alcalinidad es la capacidad del agua para reaccionar con los iones H+ a un pH correspondiente a la formación estequiométrica del ácido carbónico (ó CO2 y H2O), y se debe principalmente a sales de ácidos débiles y/o a bases fuertes, tales sustancias actúan como amortiguadores (buffers), causando resistencia a la disminución del pH que resultaría de la adición de un ácido. La alcalinidad es por tanto una medida de la capacidad de amortiguamiento y en este sentido se usa ampliamente en la práctica de la depuración del agua (Ordoñez, 2001). La alcalinidad en el agua residual resulta de la presencia de hidróxidos (OH-), carbonatos (CO32-), y bicarbonatos (HCO3-) de elementos como calcio, magnesio, sodio, potasio y amonio. De éstos, los bicarbonatos de calcio y magnesio son los más comunes. Boratos, silicatos, fosfatos y componentes similares también pueden contribuir a la alcalinidad (Romero, 2004). El agua residual es normalmente alcalina, recibiendo su alcalinidad del suministro de agua, de las aguas subterráneas, y los materiales adicionados durante el uso doméstico. La concentración de la alcalinidad en el agua residual es importante donde vaya a ser usado tratamiento químico o biológico, en remoción de nutrientes biológicos y donde sea removido amonio por separación de aire (Liu & Lien, 2001). La alcalinidad es determinada por medio de la titulación de un ácido estándar, los resultados se expresan en términos de carbonatos de calcio (mg CaCO3/L). (Metcalf y Eddy, 2004) i. Índice volumétrico de lodos (IVL) Conocido también como SVI por si siglas en inglés sludge volumen index, la sedimentabilidad de lodos se determina permitiendo la sedimentación de un litro de lodo activado en una probeta graduada 14 de un litro. Para control de la planta se toma el volumen ocupado por el lodo sedimentado después de un periodo de 30 minutos. (Romero, 2004) 2.4.2.3. Características Biológicas a. Microorganismos patógenos Habitualmente se los encuentra en las aguas residuales domésticas, se los puede encontrar en todas sus formas como bacterias, virus, protozoarios y helmintos. Algunos de ellos son descargados al ambiente por portadores. Es poco común que se encuentren en las aguas residuales ya que algunos de estos microorganismos son causantes de enfermedades severas, pero por seguridad se asume que están presentes en un número considerable y son un peligro para la salud. Ventajosamente se cual sea el tratamiento que se le dé al agua residual pocos o casi ningún microorganismo sobrevive (Valdez, 2003). b. Bacterias Son microorganismos unicelulares los cuales constituyen la menor forma de vida capaz de sintetizar el protoplasma a partir de su ambiente y no presentan coloración alguna. Presentan diversas formas: cilíndrica o de bastón (bacilos), oval o esférica (cocos) o espirales (espirilos). Cuando se trata de descomposición y estabilización de la materia orgánica, las bacterias cumplen el rol más importante (Romero, 2004). La mayoría de los desórdenes intestinales están relacionados a las enfermedades provocadas por bacterias patógenas transportadas por el agua (Valdez, 2003). c. Virus Son estructuras biológicas inferiores las cuales poseen toda la información genética necesaria para efectuar su propia reproducción. Son parásitos obligados que requieren de un huésped en donde alojarse para poder iniciar con la reproducción y causar una infección. Los desórdenes en el sistema nervioso son los principales síntomas cuando ha ocurrido una infección a causa de virus (Valdez, 2003). Los virus representan uno de los riesgos más importantes para la salud, para poder ser eliminados se necesita de dosis de cloro que superen a las normales o a las del punto de quiebre, para lo cual es necesario que se vuelva a clorar a las aguas residuales (Romero, 2004). 15 d. Protozoarios Son organismos unicelulares más complejos que las bacterias y los virus a pesar de representar el nivel inferior de la vida animal. Se caracterizan por adaptarse a cualquier medio con facilidad, los protozoarios se distribuyen ampliamente en las aguas naturales y solo algunos de ellos son patógenos cuando se encuentran en sistemas acuosos (Valdez, 2003). El principal alimento de los protozoarios son las bacterias y otros microorganismos, por esta razón son de mucha importancia al momento de realizar un tratamiento biológico de las aguas residuales ya que mejoran la calidad de las aguas y la eficiencia del tratamiento biológico (Romero, 2004). 2.5.3. Tipos de Aguas Residuales Aguas Residuales Urbanas Son todas las descargas que se generan dentro del núcleo de población urbana como producto de sus actividades cotidianas que se realizan dentro de éstas. Las aguas residuales urbanas están compuestas por: Aguas negras o fecales Aguas de lavado doméstico Aguas provenientes del sistema de drenaje de calles y avenidas Aguas de lluvia y lixiviados Dependiendo de la composición y la carga contaminante del agua residual se conoce su homogeneidad. Pero esta homogeneidad no es la misma debido a que cambia al momento de realizar los respectivos análisis de los vertidos, ya que en ésta influye el tipo de población en el que se generen las descargas, en el cual se analiza el número de habitantes, la presencia o no de industrias dentro del núcleo y si existen industrias conocer de qué tipo de industria se trata, etc. (Valdez, 2003). Aguas Residuales Industriales Son todas aquellas que se producen al realizar cualquier actividad en el que se emplee agua para diversos procesos de industria como producción, transformación o manipulación. El caudal y composición de las aguas residuales van a depender del tipo industria y de los procesos que se realicen dentro de las mismas, también va a depender de las características de las descargas ya que estas varían de una industria a otra así como dentro de las mismas por la variación que puedan ocurrir en sus procesos (Valdez, 2003). 16 Antes de que las aguas residuales industriales sean descargadas al sistema de alcantarillado, en la mayoría de los casos requieren un tratamiento previo; ya que las características de estas aguas cambian constantemente, por lo que los procesos de tratamiento también son cambiantes. Sin embargo, muchas de las veces los tratamientos empleados para tratar aguas residuales municipales se utilizan también con las aguas residuales industriales (Valdez, 2003). 2.5.4. Tratamiento de aguas residuales por Lodos Activados Figura 1: Lodos activados Fuente: Himmelblau & Riggs, 1997 El proceso de lodos activados es un método de tratamiento aeróbico, biológico y de crecimiento suspendido; usa las reacciones metabólicas de los microorganismos para producir un efluente de alta calidad por la conversión y remoción de sustancias que tienen gran demanda de oxígeno. Este método de tratamiento, que es usualmente un proceso de tratamiento secundario, puede también ser considerado un proceso de tratamiento avanzado. Generalmente contiene un clarificador primario, aunque dependiendo de las características del agua residual y el diseño de la planta, el clarificador puede ser omitido. Este proceso es talvez el proceso más ampliamente usado para reducir la concentración de contaminantes orgánicos particulados, coloidales y disueltos. Actualmente, el proceso de lodos activados ha sido también usado como un proceso de nitrificación para reducir la concentración de amonio en el efluente. El amonio es un contaminante inorgánico que es tóxico para la vida acuática en altas concentraciones y ejerce alta demanda de oxígeno en el cuerpo receptor (WCPF, 1990). 2.5.4.1. Metas básicas del Proceso Como se dijo anteriormente, el proceso de lodos activados puede ser usado para remover DBO carbonácea y también para la oxidación de amonio (nitrificación). Es por eso que la demanda de oxigeno de agua residual puede separarse en dos categorías: carbonácea y nitrogenada, que pueden ocurrir simultáneamente (WCPF, 1990). 17 a. Remoción de DBO carbonácea La demanda de carbonácea debería ser expresado como función del número de días en que va a ser medida: 5 días (más común) y 20 días son los periodos de tiempo más frecuentemente usados. Para la obtención de la demanda de oxigeno solamente, la prueba de DBO5 inhibe la nitrificación con químicos agregados (WCPF, 1990). Con agua residual municipal típica, un proceso de lodos activados bien diseñado debería alcanzar un efluente carbonoso, soluble con DBO5 de 5mg/l o menos. Similarmente con clarificadores diseñados para maximizar la remoción de sólidos en caudales pico y un adecuado control del proceso, el valor promedio de solidos suspendidos en el efluente no debería exceder los 15mg/l. En una práctica común, un efluente con un DBO5 de 20 mg/l y sólidos suspendidos de 20mg/l debería poder ser alcanzados, con la correcta operación. Las capacidades potenciales del proceso son DBO5 de 10mg/l y solidos suspendidos de 15mg/l y, posiblemente menores; es importante recalcar que para la obtención de valores menores a 10 y 15 mg/l, algún tipo de tratamiento terciario es usualmente requerido (WCPF, 1990). b. Nitrificación De la total demanda de oxigeno ejercida por el agua residual, una fracción medible a menudo se deriva de la oxidación del amonio en nitrato como se muestra en las ecuaciones de la figura posterior. Las bacterias autótrofas Nitrosomonas sp. y Nitrobacter sp. logran esta conversión de 2 etapas (WCPF, 1990). Figura 2: Proceso de nitrificación Fuente: (Marais y Eckama, 1975) Como organismos autótrofos, estos nitrificadores buscan reducir componentes de carbono oxidado en el agua residual tal como dióxido de carbono (CO2) y sus formas iónicas relacionadas (HCO3- y CO3-) para el crecimiento celular. Como resultado esta característica afecta marcadamente la 18 habilidad de los organismos nitrificadores para competir en una cultura mixta (Marais y Eckama, 1975). 𝑵𝒊𝒕𝒓𝒐𝒔𝒐𝒎𝒐𝒏𝒂𝒔 𝟐𝑵𝑯+ 𝟒 +𝟑𝑶𝟐 → + 𝟐𝑵𝑶− 𝟐 + 𝟐𝑯𝟐 𝑶 + 𝟒𝑯 (1) Fuente: Marais & Ekama, 1975 𝑵𝒊𝒕𝒓𝒐𝒃𝒂𝒄𝒕𝒆𝒓𝒊𝒂𝒔 𝟐𝑵𝑶− 𝟐 +𝑶𝟐 → 𝟐𝑵𝑶− 𝟑 (2) Fuente: Marais & Ekama, 1975 Las bacterias oxidantes del amoniaco (Nitrosomonas sp.) obtienen su energía oxidando nitrógeno amoniacal a nitrito y las baterías oxidantes del nitrito (Nitrobacter sp.) gracias a la oxidación del nitrito a nitrato. Estas reacciones de oxidación producen poca energía (Marais y Eckama, 1975) Debido a que la energía es necesaria para la conversión de CO2 a carbono celular, la población de bacterias nitrificadoras en lodos activados es relativamente pequeña, cuando se compara a las bacterias heterotróficas en lodos activados, las bacterias nitrificadoras tienen una tasa de reproducción baja (WCPF, 1990). c. Eficiencia del sistema de tratamiento La eficiencia del proceso de lodos activados para conseguir la remoción de DBO carbonácea y nitrificación dependerá de: Que tan fácilmente el material orgánico pueda ser metabolizado por los microorganismos, El SRT y radio F:M El número y tipo de microorganismos activos presentes en el tanque de aireación El tiempo de retención hidráulica Factores ambientales como la concentración OD, nutrientes, alcalinidad, pH, temperatura y la presencia de materiales tóxicos. Adecuación el diseño original de ingeniería para el mezclado, bombeo de recirculación y de desecho, y la capacidad de aireación; Mantenimiento apropiado de los equipos de la planta; y Entrenamiento apropiado del personal de planta, incluyendo: laboratorio, mantenimiento, operación y administración (WCPF, 1990). 19 d. Variaciones del proceso de Lodos Activados Las variaciones de lodos activados están definidas básicamente por el rango de proceso de carga o dicho de otra forma por la materia orgánica disponible para los microrganismos, y de acuerdo a esto se clasifican en tres categorías: alto, medio y bajo (WCPF, 1990). Con estos tres rangos de proceso de carga, la forma y número de tanques de aireación pueden ser modificados para variar el patrón de flujo. Esencialmente, estas variaciones hidráulicas, que pueden ser diseñados en regímenes de mezcla completa y flujo pistón, incluyen sistemas de mezcla completa, flujo pistón (convencional), estabilización por contacto, alimentación escalonada, aireación extendida, zanja de oxidación, aireación modificada, aireación de alta tasa, oxigeno de alta pureza, nitrificación de una etapa, y nitrificación de una etapa (WCPF, 1990). La Tabla 2 muestra parámetros típicos de diseño para cada uno de estas variaciones. Sin embargo, los valores para específicos para cada planta varían y pueden separarse de estos valores. Tabla 2: Parámetros típicos de diseño SRT días F:M Kg DBO5/Kg SSVLM.día Carga volumétrica Kg DBO5/m3.día Convencional 3 - 15 0,2 - 0,4 20 - 40 Mezcla completa 3 - 15 0,2 - 0,6 50 - 120 Alimentación escalonada 53- 15 0,2 - 0,4 40 - 60 Aireación modificada 0,2 0,5 1,5 - 50 75 - 150 Estabilización por contacto 5 - 15 0,2 - 0,6 60 - 75 Aireación extendida 20 - 30 0,05 - 0,15 10 - 25 Aireación de tasa alta 5 - 10 0,4 - 1,5 100 - 1000 Oxígeno de alta pureza 3 - 10 0,25 - 1 100 - 200 Zanja de oxidación 10 - 30 0,05 - 0,3 5 - 30 Modificación al proceso Nitrificación de una etapa Nitrificación de dos etapas Fuente: WCPF, 1990 8 - 20 15 100 0,1 - 0,25 0,02-0,15 0,05 - 0,2 0,04 - 0,15 20 5 - 20 3-9 SSLM Mg/L 1500 3000 2500 4000 2000 3500 200 1000 1000 – 3000 4000 10000 3000 6000 4000 10000 2000 5000 3000 6000 2000 3500 2000 3500 TRH horas 4-8 3-5 3-5 3-5 1,5 – 3 0,5 1,0 3-6 18 - 36 2-4 1-3 8 – 36 6 - 15 3-6 2.5.4.2. Tipos De Lodos Activados a. Mezcla Completa En un proceso de mezcla completa de lodos activados, las características del licor mezclado son similares a lo largo del tanque de aireación; esto es, el afluente es rápidamente distribuido a lo largo de del tanque y las características de operación son medidas en términos de sólidos, tasa de consumo de oxigeno (OUR), SSLM y, la concentración de DBO5 soluble son idénticas en todo el tanque. Debido a que todo el contenido tanque tiene la misma calidad que el mismo efluente, existe un nivel bajo de comida disponible en cualquier tiempo para n gran masa de microorganismos. Esta es probablemente la razón principal por la cual la mezcla completa puede soportar sobretensiones en la carga orgánica sin producir un cambio en la calidad del efluente. Una desventaja de la mezcla completa es que es más propensa al hinchamiento de lodos (Spencer, 2005). Otro concepto que ha ganado reconocimiento para la prevención y el control del crecimiento de organismos filamentosos es el uso de un selector en combinación con el proceso de mezcla completa de lodos activados. El selector es un tanque de contacto o compartimento que precede el tanque de aireación y provee termporalmente (rango común de 10-30 min) una condición de mezcla del lodo en retorno y del agua residual cruda y sedimentada. El acondicionamiento puede ocurrir bajo condiciones completamente aeróbicas, de bajo nivel de OD, anoxica o anaeróbica en el selector (WCPF, 1990). Figura 3: Mezcla completa Fuente: Curso Operadores Planta Piloto, Hazen & Sawyer b. Flujo pistón (Convencional) Los tanques de flujo pistón son los más antiguos y la forma más común de tanques de aireación ya que fueron diseñados para alcanzar los requerimientos de mezcla y transferencia de oxígeno de los sistemas de aireación difusa. Los tanques largos pueden ser ubicados lado a lado o en un arreglo plegado manteniendo la longitud del trazado. La variación del flujo pistón es también conocida como lodo activado convencional. 21 Una característica de la configuración del flujo pistón es que el SSLM (MLSS, en inglés) en la parte inicial del tanque tiene una alta carga orgánica. La carga luego decrece en medida que el material orgánico en el agua cruda sea oxidada. En la mitad posterior del tanque, dependiendo del tiempo de retención, el consumo de oxigeno puede ser resultado primordialmente de la respiración endógena o de la nitrificación. Las mismas características están presentes cuando los tanques de aireación están divididos en una serie de compartimentos. Cada compartimento debe tener el suministro necesario de oxígeno para mantener las reacciones en ese lugar (Sherrard & Lawrence, 1973). Un diseño de aireación usado para regular el suministro de oxígeno como función del largo del tanque ha sido referido como “aireación gradual”. La configuración de aireación para el tanque permanece intacta mientras el suministro de oxígeno varia para alcanzar las necesidades individuales de los compartimentos del tanque de aireación. Este enfoque es comúnmente asociado con sistemas de aireación difusa donde el suministro de aire puede estrecharse desde el extremo del afluente hasta el final del efluente ya que el flujo pasa a través del tanque (WCPF, 1990). Configuraciones convencionales de flujo pistón tiene la habilidad para evitar fugas o el paso de orgánicos o tratados durante caudales máximos. Estas configuraciones son preferidas cuando los niveles de oxígeno disuelto del efluente del tanque de alta aireación son buscados (como cuando se reduce el proceso de denitrificación en un clarificador) porque solo una pequeña sección del tanque operara a un nivel alto del OD. En una configuración de mezcla completa, el tanque completo debe operar a un elevado nivel de OD; la configuración e flujo pistón puede ser menos propensa al hinchamiento de lodos por filamentosas (WCPF, 1990). Figura 4: Flujo pistón (Convencional) Fuente: Curso Operadores Planta Piloto, Hazen & Sawyer c. Estabilización de contacto El proceso de lodos activados por estabilización de contacto es simultáneamente un proceso y una configuración especifica de tanque. Como se muestra en la figura, la estabilización por contacto tiene un tanque temporal de contacto donde la comida es absorbida, un clarificador secundario y tanque de estabilización de lodo que es cercano a 6 veces el tiempo de retención del tanque de contacto en el cual la comida es absorbida (Goodman & Englande, 1972). 22 La estabilización por contacto es común en plantas con flujos pequeños y SRTs largos. La aireación del lodo de recirculación puede reducir los requerimientos del tanque en un 30 a 40% del requerido en un sistema convencional de lodos activados. La estabilización por contacto tiene ventajas adicionales con residuos de alta resistencia en caudales picos debido a que el tanque de estabilización provee mayor tiempo para la síntesis y presupone el lavado de la biomasa entera (Orhon et al., 2009). Los tanques de aireación pueden ser repartidos y ser de igual tamaño y arreglo que el efluente secundario. Consecuentemente, pueden operar tanto en serie como en paralelo, como una instalación de flujo pistón o una unidad de estabilización de contacto; esta flexibilidad los hace apropiados para futuras expansiones a lodo activado convencional sin incrementar el volumen de tanque de aireación simplemente adicionando más capacidad de clarificación (WCPF, 1990). Figura 5: Estabilización de contacto Fuente: Curso Operadores Planta Piloto, Hazen & Sawyer d. Alimentación Escalonada La alimentación escalonada también referida como aireación escalonada es una modificación de la configuración de flujo pistón. El afluente secundario es alimentado en dos o tres puntos a lo largo del tanque de aireación. Con este arreglo, los requerimientos del consumo de oxigeno son relativamente iguales y la necesidad de aireación gradual es eliminada. Las configuraciones de alimentación escalonada generalmente usan equipos para aireación difusa (Sherrard & Lawrence, 1973). El tanque de alimentación escalonada es usualmente el diseño largo rectangular o el plegado. El caudal del efluente secundario puede ser adicionado en dos o más puntos para el tanque de aireación, usualmente en el primer 50 a 75% de la longitud. Es también posible usar el mismo enfoque del proceso repartiendo el tanque y direccionando el flujo longitudinalmente a través de los compartimentos. Usualmente el último compartimento no recibe ningún residuo crudo (WCPF, 1990). 23 Una ventaja de la alimentación escalonada es que la carga de sólidos en el clarificador secundario puede ser disminuida durante periodos de problemas de sedimentación moviendo el punto de alimentación de residuos al final del tanque de aireación (WCPF, 1980). Las plantas de alimentación escalonada pueden ser diseñadas con la flexibilidad para operar como estabilización por contacto, flujo pistón y si es alimentado en todos los puntos igualmente, una condición aproximada a mezcla completa (WCPF, 1980). Figura 6: Alimentación Escalonada Fuente: Curso Operadores Planta Piloto, Hazen & Sawyer 2.5.4.3. Operación básica En adición a los métodos de control básico diario para descarte, recirculación y control de OD, algunas de las operaciones importantes pueden corregir las condiciones del proceso que excedan los límites normales de control de procedimientos. Estas operaciones dependen, en gran parte, en la flexibilidad ofrecida para el diseño de la planta de tratamiento y, generalmente envuelve ya sea un cambio en la distribución de alimentación, el tanque de aireación o a un cambio en el número de unidades operativas de tratamiento (WCPF, 1990). Las alternativas de operación pueden involucrar: - Cambios en el número de clarificadores secundarios - Cambios en el número de tanques de aireación, y - Cambios en el modo de proceso: flujo pistón, alimentación escalonada, y estabilización por contacto. Estos cambios operacionales son generalmente más difícil que los ajustes de rutina y que normalmente no son efectuadas hasta que todas las alternativas son agotadas. Adicionalmente, el lujo de inicializar unidades adicionales de tratamiento esta usualmente solo disponible durante los primeros años siguiendo los planes de expansión o construcción de la planta cuando el sistema opere por debajo de su capacidad de diseño (WCPF, 1990). 24 2.5.4.4. Factores relacionados con el Proceso de Lodos Activados a. Factor de carga (FC) El concepto original del parámetro (FC) nació como la relación entre alimento o sustrato a microorganismos. Como representativo de sustrato se toma la carga orgánica del desecho afluente (kg DBO/d) y como representativo de microorganismos se asume convencionalmente la masa de sólidos en suspensión vo1áti1es en el tanque de aireación (kg SSVTA). La racionalidad de uso de las cantidades anteriores ha sido cuestionada por varios autores y, principalmente, por Marais y Ekama, en base a que una adecuada descripción de sustrato podría ser la DQO en lugar de DBO y la más adecuada descripción de microorganismos serían los sólidos volátiles activos (Xa) (Marais & Ekama, 1975). La relación alimento/microorganismo se define como: 𝑭 ⁄𝑴 = 𝑄𝑆𝑜 𝑋𝑉 (3) Fuente: Marais & Ekama, 1975 Donde F/M = relación alimento/microorganismos, d-1. Q = caudal de entrada, m3/d. 𝑆0 = concentración de DQO o DBO en el afluente, Kg/m3. X = concentración de sólidos suspendidos volátiles en el tanque de aireación, Kg/m3. V = volumen del tanque de aireación, m3. b. Edad de lodo (EL) La edad de lodo es uno de los parámetros más representativos del estado del proceso y es de gran utilidad tanto a nivel de diseño como de operación. Se define a la edad de lodo como la relación de la masa de sólidos en suspensión volátiles en el tanque de aireación y 1a masa de sólidos en suspensión volátiles desechada por día en el lodo de exceso (Marais & Ekama, 1975): 𝑬𝑳 = 𝑀𝑋 𝑀𝑋𝑣 𝑣 𝑒𝑥𝑐𝑒𝑠𝑜⁄𝑑í𝑎 Fuente: Marais &Ekama, 1975 Donde 𝑀𝑋𝑣 = masa de sólidos en suspensión volátiles, kg/m3. 25 (4) MXv exceso/día = masa de sólidos en suspensión volátiles desechada por día en el lodo de exceso, kg/m3. c. Tiempo medio de retención celular (θc) Este parámetro es comúnmente reportado en la literatura técnica con las siglas (SRT = solids retention time), su definición es: La relación de biomasa en el tanque de aireación (Kg SSVTA) dividido entre la masa de sólidos volátiles que abandonan el sistema (Kg SSV lodo de exceso + Kg SSV efluente) (Lawrence & McCarty, 1970). En muchas circunstancias, sobre todo en procesos tratando a una alta edad de lodo, se obtiene una muy pequeña cantidad de sólidos en suspensión en el efluente final y ya sea por esta razón o por simplicidad, se desprecia el segundo término del denominador, en este caso θc = EL. 𝜽𝒄 = 𝑄 𝑉𝑟 𝑋 𝑤 𝑋𝑤 +𝑄𝑒 𝑋𝑒 (5) Fuente: Sherrard & Lawrance, 1973 Donde θc = tiempo medio de retención celular, día. Vr = volumen del tanque de aireación, m3. X = concentración de sólidos suspendidos volátiles en el tanque de aireación, Kg/m3. Qw = caudal de lodo purgado, m3/día. Xw = concentración de sólidos suspendidos volátiles en el lodo purgado, Kg/m3. Qe = caudal de efluente tratado, m3/día. Xe = concentración de sólidos suspendidos volátiles en el efluente tratado, Kg/m3. Aunque el uso de este parámetro se ajusta más que la edad de lodo al desarrollo de un modelo matemático exacto y a generalizarse para diseño y control, es conveniente puntualizar lo siguiente: - La cantidad de sólidos en el efluente final es dependiente de un buen diseño y operación del sedimentador secundario y no en función del proceso biológico en sí. O sea que un valor bajo del θc puede no representar un mal estado del sistema biológico, sino solo una mala operación del retorno de lodos. - El θc requiere de un número mayor de mediciones y determinaciones que la EL, como parámetro de control. - Para casos prácticos, SSVe es pequeño y puede ser despreciado. Las consideraciones anteriores favorecen el uso de la edad de lodo como parámetro más 26 representativo del estado del proceso. En cuanto a los valores más comunes de θc, estos pueden adaptarse como similares a los dados para EL (Sherrard & Lawrance, 1973). d. Tiempo de retención hidráulico Este parámetro también conocido como período de retención nominal. 𝑉 𝜽=𝑄 (6) Fuente: Sherrard & Lawrance, 1973 Donde θ = tiempo de retención hidráulico, día. V = volumen del tanque de aireación, m3. Q = caudal del afluente, m3/día. Incluye únicamente el concepto idealizado sin considerar la recirculación, o sea basado en flujo de agua residual únicamente. Este factor es de importancia para propósitos de comparación solamente. Tiene mayor uso para desechos domésticos en vista de que el dimensionamiento con su uso olvida otros factores importantes como: concentración de DBO del desecho y distribución de sustrato. Por esta razón este parámetro no debe usarse nunca sólo para propósitos de diseño. Su relación con la eficiencia del proceso no es aparente (Sherrard & Lawrance, 1973). e. Producción de Biomasa El conocimiento de la producción diaria de lodo es importante puesto que afecta al diseño de las instalaciones de tratamiento y evacuación del lodo de exceso (purga) (Metcalf & Eddy, 2004). La producción diaria de lodo se puede estimar mediante la expresión: 𝑷𝒙 = 𝑄𝑌(𝑆0 −𝑆) 1+ 𝑘𝑑 𝜃𝑐 (7) Fuente: Metcalf & Eddy, 2004 Donde Px = producción diaria de lodo, medida en términos de SSV, Kg/d. Y = coeficiente de producción celular, Kg de células producidas/Kg de materia orgánica eliminada. Q = caudal de entrada, m3/d. S0 = concentración de DQO o DBO en el afluente, Kg/m3. 27 S = concentración de DQO o DBO en el efluente, Kg/m3. kd = coeficiente de degradación endógena, día-1. Efectos del metabolismo endógeno En los sistemas bacterianos que se emplean en el tratamiento biológico del agua residual, la distribución de edades de las células es tal que no todas las células del sistema están en la fase de crecimiento exponencial. Consecuentemente, la expresión de la tasa de crecimiento se debe corregir para tener en cuenta la energía necesaria para el mantenimiento celular. Otros factores, tales como la muerte y la depredación, también deben ser objeto de consideración. Generalmente, estos factores se engloban en uno solo, y se supone que la disminución de la masa celular causada por ellos es proporcional a la concentración de organismos presentes. A esta disminución se la denomina descomposición endógena (Metcalf & Eddy, 2004). Oxidación y síntesis: 𝑏𝑎𝑐𝑡𝑒𝑟𝑖𝑎𝑠 𝐶𝑂𝐻𝑁𝑆 + 𝑂2 + 𝑛𝑢𝑡𝑟𝑖𝑒𝑛𝑡𝑒𝑠 → 𝐶𝑂2 + 𝑁𝐻3 + 𝐶5 𝐻7 𝑁𝑂2 + 𝑜𝑡𝑟𝑜𝑠 𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑜𝑠 𝑓𝑖𝑛𝑎𝑙𝑒𝑠 Respiración endógena: 𝑏𝑎𝑐𝑡𝑒𝑟𝑖𝑎𝑠 𝐶5 𝐻7 𝑁𝑂2 + 5𝑂2 → 113 5(32) Células 1 1,42 f. 5𝐶𝑂2 + 2𝐻2 𝑂 + 𝑁𝐻3 + 𝑒𝑛𝑒𝑟𝑔í𝑎 Necesidad de oxígeno La necesidad teórica de oxígeno se puede determinar a partir de la DBO del agua residual y de la cantidad de organismos purgados diariamente del sistema. El razonamiento es el siguiente. Si toda la DBO se convirtiera en productos finales, la demanda total de oxígeno se podría calcular convirtiendo la DBO5 en DBOL utilizando un factor de conversión adecuado. Por otro lado, se sabe que parte del residuo se convierte en tejido celular nuevo que, posteriormente, se purga del sistema, de modo que, si la DBOL del tejido celular se resta del total, la cantidad remanente corresponde a la cantidad de oxígeno que es necesario suministrar al sistema (Metcalf & Eddy, 2004). Teniendo en cuenta la ecuación que se muestra a continuación, se sabe que la DBOL de un mol de células es igual a 1,42 veces la concentración de células: Por lo tanto, la demanda teórica de oxígeno para la eliminación de la materia orgánica carbonosa presente en el agua residual de un sistema de lodos activados se puede calcular mediante la expresión: 𝐾𝑔 𝑂2 ⁄𝑑 = (𝑀𝑎𝑠𝑎 𝑑𝑒 𝐷𝐵𝑂𝐿 𝑡𝑜𝑡𝑎𝑙 𝑢𝑡𝑖𝑙𝑖𝑧𝑎𝑑𝑎) − 1.42(𝑀𝑎𝑠𝑎 𝑑𝑒 𝑜𝑟𝑔𝑎𝑛𝑖𝑠𝑚𝑜𝑠 𝑝𝑢𝑟𝑔𝑎𝑑𝑜𝑠) Utilizando términos anteriormente definidos, 28 𝑲𝒈 𝑶𝟐 ⁄𝒅 = 𝑄(𝑆0 −𝑆) − 𝑓 1,42(𝑃𝑥 ) (8) Fuente: Metcalf & Eddy, 2004 Donde 𝑓 = factor de conversión de DBO5 en DBOL (0,45 – 0,68). En casos que se deban considerar la nitrificación, la demanda total de oxígeno se puede calcular como la suma de la demanda necesaria para la eliminación de la materia orgánica carbonosa más la demanda de oxígeno necesaria para la conversión del nitrógeno (de amoníaco a nitrato), según la expresión: 𝑲𝒈 𝑶𝟐 ⁄𝒅 = 𝑄(𝑆0 −𝑆) − 𝑓 1,42(𝑃𝑥 ) + 4,57(𝑁0 − 𝑁)𝑄 (9) Fuente: Metcalf & Eddy, 2004 Donde 𝑁0 = NKT del afluente, mg/L. 𝑁 = NKTdel efluente, mg/L 4,57 = Factor de conversión para la demanda de oxígeno necesario para la oxidación completa del NKT. Los requisitos de oxígeno en sistemas aeróbicos de bioxidación, deben ser suficientes para los siguientes propósitos: Oxidar aquella parte de la DBO removida (sustrato), con el objeto de proveer energía requerida para síntesis (o crecimiento del lodo); Mantener los requisitos basales del proceso o la respiración endógena; Proveer oxígeno adicional para una completa nitrificación si se desea; y Proveer oxígeno para abastecer una demanda inmediata, como es en el caso de algunos desechos industriales (Eckenfelder & Ford, 1970). g. Coeficiente de Correlación de Pearson En estadística, el coeficiente de correlación de Pearson es una medida de la relación lineal entre dos variables aleatorias cuantitativas. A diferencia de la covarianza, la correlación de Pearson es independiente de la escala de medida de las variables (Colin Cameron et al., 1997). De manera menos formal, podemos definir el coeficiente de correlación de Pearson como un índice que puede utilizarse para medir el grado de relación de dos variables siempre y cuando ambas sean cuantitativas (Colin Cameron et al., 1997). 29 𝜎2 𝑹𝟐 = 𝜎2𝑋𝑌 𝜎2 𝑋 𝑌 (10) Fuente: Colin Cameron et al, 1997 Donde R2 = Coeficiente de determinación σXY = Covarianza de (X,Y) σX = Desviación típica de la variable X σY = Desviación típica de la variable Y 2 𝑹 = √𝑅 2 (11) Fuente: Colin Cameron et al, 1997 Donde R = Coeficiente de correlación de Pearson 2.5.5. Determinación de coeficientes cinéticos Para poder utilizar modelos cinéticos de procesos biológicos es necesario disponer de los valores de los parámetros Y, k, Ks y kd. Para determinar los valores de dichos parámetros se emplean reactores a escala de laboratorio, o en sistemas a escala piloto (Metcalf & Eddy, 2004). El procedimiento habitual en la determinación de los valores de estos parámetros, consiste en hacer funcionar las unidades de diferentes concentraciones de substrato en el efluente. De esta forma, se debería elegir varios valores diferentes de θc, variables entre 1 y 10 días (Metcalf & Eddy, 2004). Utilizando los datos obtenidos en el funcionamiento en condiciones estacionarias, se determinan los valores medios de Q, S0, X y rsu (tasa de utilización de sustrato, masa/volumen*tiempo) (Metcalf & Eddy, 2004). Si analizamos el balance de masas para los microorganismos del sistema global. 1. Planteamiento general: Velocidad de acumulación de microorganismos dentro de los límites del sistema Crecimiento neto Cantidad de Cantidad de de microorganismos microorganismos = + - microorganismos que entran que salen dentro de los al sistema del sistema límites del sistema Fuente: Metcalf & Eddy, 2004 30 (12) 2. Planteamiento simplificado: 𝐴𝑐𝑢𝑚𝑢𝑙𝑎𝑐𝑖ó𝑛 = 𝐸𝑛𝑡𝑟𝑎𝑑𝑎 – 𝑆𝑎𝑙𝑖𝑑𝑎 + 𝐶𝑟𝑒𝑐𝑖𝑚𝑖𝑒𝑛𝑡𝑜 𝑛𝑒𝑡𝑜 (13) Fuente: Metcalf & Eddy, 2004 3. Representación simbólica 𝑑𝑋 𝑉 𝑑𝑡 𝑟 = 𝑄𝑋0 − [𝑄𝑤 𝑋 + 𝑄𝑒 𝑋𝑒 ] + 𝑉𝑟 (𝑟´𝑔 ) (14) Fuente: Metcalf & Eddy, 2004 4. Sustituyendo (𝑟´𝑔 = −𝑌𝑟𝑠𝑢 − 𝐾𝑑 𝑋) por la tasa de crecimiento y suponiendo que la concentración de células en el afluente es nula y que prevalecen condiciones estacionarias (𝑑𝑋⁄𝑑𝑡 = 0), se obtiene: 𝑄𝑤 𝑋+𝑄𝑒𝑋𝑒 𝑉𝑟 𝑋 = −𝑌 𝑟𝑠𝑢 𝑋 − 𝐾𝑑 (15) Fuente: Metcalf & Eddy, 2004 El término de la izquierda de la ecuación 15 representa el inverso del tiempo medio de retención celular definido anteriormente. Empleando la ecuación 5, la ecuación 15 se puede simplificar y reordenar para obtener: 1 𝜃𝑐 = −𝑌 𝑟𝑠𝑢 𝑋 − 𝐾𝑑 (16) Fuente: Metcalf & Eddy, 2004 El término 𝑟𝑠𝑢 se determina por medio de la siguiente expresión: 𝑄 𝑟𝑠𝑢 = − 𝑉 (𝑆0 − 𝑆) = − 𝑟 𝑆0 −𝑆 𝜃 (17) Fuente: Metcalf & Eddy, 2004 Los valores de Y y kd se pueden determinar empleando la siguiente expresión: 1 𝜃𝑐 =𝑌 𝑆0 −𝑆 𝜃𝑋 − 𝑘𝑑 (18) Fuente: Metcalf & Eddy, 2004 La pendiente de la recta que se ajusta a los datos experimentales corresponde al valor de Y, y el punto de corte con el eje de ordenadas es kd (Metcalf & Eddy, 2004). 31 2.5.5.1. Coeficientes Cinéticos Tabla 3: Valores típicos de coeficientes cinéticos para el proceso de lodos activados Coeficientes Unidades Y mg SSV/mg DBO5 Kd d-1 Nota: Valores típicos para 20 ºC. Fuente: Metcalf & Eddy, 2004 Elaborado por: Campoverde, Loayza, 2015. 32 Rangos 0,4 - 0,8 0,025 - 0,075 Típicos 0,6 0,06 CAPÍTULO III 3. DISEÑO METODOLÓGICO 3.1. DISEÑO DE LA INVESTIGACIÓN El estudio a realizarse constituye principalmente una investigación de campo ya que se realizó un análisis directo a la realidad (Dirección General de Investigación y Postgrado UCE, 2010), que consiste en el muestreo de agua “in situ”, en la planta Piloto de lodos activados, caracterización y análisis de laboratorio para la obtención de resultados. Se considera que el carácter del mismo es de tipo experimental longitudinal, debido a que se recolectaron datos sobre las variables o las relaciones entre ellas para evaluar su cambio (Hernández Sampieri et al., 2003) y de tipo descriptivo debido al aporte teórico y metodológico que representa para estudios posteriores. 3.2. IDENTIFICACION DE VARIABLES 3.2.1. Variable dependiente Determinación de los coeficientes cinéticos de oxígeno y producción de biomasa 3.2.2. Variable independiente Caudal de las aguas residuales de la descarga del Batán. 3.3. POBLACIÓN Y MUESTRA La población o unidad de análisis del presente trabajo de investigación constituye el caudal de descarga del colector del Batán, mientras que la muestra que se consignó de tipo no probabilística debido a que el esquema de investigación y objeto de estudio busca conseguir los muestreos más idóneos y representativos para el cálculo de la cinética, se denominó a todas las campañas de muestreo recolectadas para Fase 1. 33 3.4. INSTRUMENTOS Los instrumentos con los que se contó para el desarrollo de la investigación fueron: planta piloto experimental de tratamiento de agua residual, equipos de muestreo y medición de parámetros, software para el procesamiento de datos, registros de operación de planta y custodia de muestras, equipo de protección personal, y vehículo para transporte de muestras; instrumentos que se detallan posteriormente en la descripción de los procedimientos de operación de la planta piloto. 3.5. PROCEDIMIENTOS 3.5.1. Metodología general La evaluación de la planta piloto se realizó por medio del procesamiento de datos a través de las múltiples campañas de muestreo, efectuando pruebas experimentales en el laboratorio para obtener las condiciones promedio de operación con el fin de caracterizar el afluente y obtener la cinética del proceso. El desarrollo de la presente investigación se estructuró en tres etapas detalladas a continuación: ETAPA 1 INSTALACION, OPERACION Y CONTROL DE LA PLANTA PILOTO ETAPA 2. PROCESAMIENTO DE DATOS Y SELECCION DE MUESTRAS ETAPA 3. ANÁLISIS DE RESULTADOS Lugar de investigación y muestreo Ensamble y operación de la planta piloto Procesamiento de resultados de laboratorio y de campo Selección de muestras para el análisis Cálculo de parámetros para la cinética Obtención de gráficas y determinación de coeficientes cineticos Recoleccion de muestras y determinación de parámetros in situ Cálculo de producción de biomasa y requisito de oxígeno Figura 7: Esquema de investigación Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015 3.5.1.1. Etapa 1. Instalación, operación y control de la planta piloto a. Lugar de investigación y muestreo La ejecución del presente proyecto de investigación tuvo lugar en una planta piloto de lodos activados al final del colector central de Iñaquito en la descarga del Batán, seleccionado tanto por la representatividad de la calidad del agua residual como por la disponibilidad y accesibilidad de servicios. 34 Figura 8: Ubicación georeferencial de la descarga del Batán Fuente: Informe de caracterización de las descargas de aguas residuales, Asociación Hazen & Sawyer- Pi Epsilon 2015 Fotografía 1: Ubicación de planta piloto Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) El acceso a la planta piloto se realiza en transporte particular contratado, desde las oficinas de Hazen & Sawyer hasta las instalaciones ubicadas en la calle Gonzalo Rubio Orbe y pasaje s/n ubicadas al norte de Quito (sector Gonzales Suárez). 35 Debido a la ubicación de la planta piloto y a factores variables como el clima, el sistema de ingreso de agua residual hacia la planta piloto fue estratégicamente situado de manera sea efectivo para tiempo seco o lluvioso, esporádicas descargas contaminantes industriales; y a su vez no interfiera con la homogeneidad del afluente. b. Ensamble y operación de la planta piloto La operación del sistema consistió en la alimentación diaria con agua residual cruda a través de tratamiento primario y secundario; y la recolección del agua tratada en el tanque del efluente final. Para la evaluación y control de la calidad del afluente y efluente se recolectaron muestras compuestas de 24 horas con la ayuda de muestreadores automáticos ubicados en las salidas del desecho crudo, efluente primario y efluente final. Se realizaron determinaciones de parámetros físico-químicos de control rutinario en todos los tanques, esto es: temperatura, pH, oxígeno disuelto y sólidos sedimentables, alcalinidad y demás, realizados con una frecuencia diaria o interdiaria, medidos con la ayuda de equipos portátiles y ensayos de laboratorio. El conocimiento de estos parámetros permitió hacer un seguimiento y control general del sistema. Adicionalmente se realizaron determinaciones de contenido de material orgánico, específicamente Demanda Bioquímica de Oxígeno (DBO5) y Demanda Química de Oxígeno (DQO) en el afluente (desecho crudo), efluente primario (efluente del sedimentador primario) y efluente final, así como sólidos suspendidos volátiles en el reactor o licor mezclado (SSVLM). Al final de cada una de las condiciones de operación se realizaron determinaciones de nutrientes, específicamente nitrógeno en todas sus formas y ortofosfatos. La operación de la planta Piloto se compone de una fase inicial y tres fases experimentales; el presente trabajo de tesis orientó su investigación a la primera fase del proyecto. A continuación se describe brevemente las fases del proyecto y el objetivo de cada una, centrándose a partir de esto en la Fase 1. Fase Inicial y de arranque de Planta Piloto, designada como la fase de aclimatación, permite desarrollar un cultivo saludable de lodos activados (licor mezclado) y lograr una operación estable con todos los aspectos mecánicos/eléctricos/hidráulicos/instrumentación resueltos. Fase 1, ideada para demostrar e investigar un tratamiento confiable para remover DBO5/DQO/SST. Fase 2 (a) para demostrar e investigar un tratamiento confiable para remover amoníaco por el proceso de denitrificación. 36 Fase 2 (b) para operar la planta piloto bajo condiciones críticas hasta que se observe el punto de quiebre de amoníaco. Fase 3 para demostrar e investigar remoción de nitrógeno por el proceso de nitrificación / denitrificación. Los parámetros operacionales de los principales procesos de tratamiento están resumidos en el Tabla 4, para cada una de las fases. Tabla 4: Resumen de Parámetros Operacionales de las Fases de Planta Piloto Número y objetivo de cada fase i Caudal de Entrada L/día 9000 Lodo Activado Edad SSLM de Lodo mg/l Días 1500 – 2600 3 Lodo de Exceso l/día Variable Duración estimada Días 28 FASE INICIAL REMOCION DE 1 7000-9000 1500 – 3500 2-5 900-1000 28 DBO/DQO 2a NITRIFICACION 5000 – 6000 2200 – 4600 6-8 230-290 28 NITRIFICACION 2b 5000 – 6000 Variable <4 Variable 28 INTENSA NITRIFICACION/ 11 3 5000 – 6000 2600 – 5400 190 – 210 42 DESNITRIFICACION 13 Nota: Los valores de lodos de exceso y de duración de las fases son aproximados ya que el volumen de extracción de lodos depende de la concentración y el desarrollo en el tiempo del licor mezclado y la duración en días de la fase depende del tiempo real para lograr las condiciones de licor mezclada y la edad de lodos deseados. Fuente: Protocolo Básico Experimental: Operación y Monitoreo, Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito b.1. Descripción de la Fase 1: Remoción de Materia Carbonácea DBO5 / DQO Una vez culminada la Fase inicial y conseguido un nivel de biomasa de por lo menos 1500 mg/L, se procedió al inicio de la Fase 1, con un caudal entre 7000 y 9000 L/día, una edad de lodo entre 2 y 5 días, una duración propuesta de 28 días y tres reactores de igual tamaño en serie. La función de esta Fase es la remoción de material carbonáceo, manteniendo la biomasa en el Reactor Aeróbico 3 en una concentración entre 1500 y 2000 mg/L y ajustando la recirculación en aproximadamente 50% del caudal del desecho crudo, en condiciones estables y operando con una descarga de lodo de exceso aproximada a 1/3 del volumen total del licor mezclado, directamente desde el último reactor (tanque de aeración No. 3). El proceso esquemático de esta Fase, se detalla posteriormente en la Figura 9. 37 Figura 9: Esquema de sistema operacional en Fase 1 Fuente: Protocolo Básico Experimental: Operación y Monitoreo Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito, Hazen & Sawyer. 38 A continuación se detalla el proceso operacional utilizado para la Fase 1 de la Planta Piloto. b.2. Sistema de alimentación de desecho crudo a la planta piloto La alimentación de desecho crudo a la planta se estableció de la siguiente manera: El agua residual cruda fue captada del colector El Batán por medio de una bomba sumergible. La bomba estuvo dentro de una canastilla de metal que no permite la entrada de sólidos grandes, además dicha canastilla se diseñó con un peso suficiente para evitar que la bomba sea arrastrada por la fuerza de la corriente. Adicionalmente se instalaron sistemas de poleas automático y manual para bajar o subir la bomba cuando se necesite mantenimiento de la misma o limpieza de la canastilla metálica, y un set de sensores en el canal del Batán para inactivar y subir la bomba en caso de incremento de la turbulencia en el canal. La tubería de succión de la bomba sumergible es una manguera de plástico transparente suficientemente flexible para el funcionamiento del sistema de poleas. Esta tubería de plástico se acopla a una tubería de PVC de 2 pulgadas de diámetro ubicada sobre la losa superior del canal, el sistema fue provisto de un salida adicional (bypass) para regulación del caudal de ingreso. Fotografía 2: Bomba de succión protegida por canastilla de metal Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 39 Fotografía 3: Sistema de poleas de la bomba sumergible y bypass de flujo Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) La bomba sumergible succiona el agua a la estructura de rejillas, la cual es un tanque cuadrado equipado con dos rejillas removibles de diferente diámetro de malla. Fotografía 4: Tanque de criba (izquierda) Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 40 Fotografía 5: Rejillas removibles Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Después de eso, el tanque de criba envía el agua residual hacia el tanque de igualación y/o compensación. Fotografía 6: Tanque de igualación Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 41 El tanque de compensación se diseñó para un tiempo de retención de aproximadamente 120 minutos, en condiciones de tiempo seco, sin embargo, debido a las condiciones climáticas de la fase de arranque de la planta piloto se consideró pertinente la instalación de un tanque reserva. Esta reserva se utilizó para periodos de inoperancia de la bomba sumergible de aproximadamente 6 horas. Tanto el tanque de cribado como el de compensación y reserva están provistos de una salida rebose que se utilizó como protección de los procesos y proporciona una circulación continua de agua asegurando que siempre se tenga “agua fresca”. Fotografía 7: Tanque de reserva Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) b.3. Ingreso del afluente e inicio de tratamiento Fotografía 8: Vista interior Planta Piloto Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 42 El afluente previamente tamizado ingresa a la planta mediante un sistema de bombeo, con un caudal de 9000 L/día, hacia el sedimentador primario, el cual es un tanque de forma cilíndrica y fondo cónico, que simula a escala un sedimentador con alimentación a una tolva central de lodos, que dirige el flujo hacia abajo. (Ver Fotografía 9). El objetivo del sedimentador primario es que los sólidos del afluente sedimenten mientras el agua decantada fluya sobre un vertedero circular a un canal circular que dirige el agua hacia la tubería del efluente. Fotografía 9: Sedimentador primario Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) La Fotografía 9 muestra al sedimentador primario, con las tuberías de entrada y salida y el medidor de flujo en línea. El efluente del sedimentador primario se destinó hacia una caja de distribución de flujo (splitter box) que dividió el caudal para los tres reactores, el material de la caja es acrílico. Fotografía 10: Caja de distribución de flujo Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 43 La función de la caja de distribución de flujo es dividir el efluente del sedimentador primario hacia los tanques reactores aeróbicos y anóxicos, de acuerdo a la fase respectiva. Como se pudo observar en el esquema anterior (Figura 9), el caudal de Fase 1 fue distribuido hacia los tanques Anóxico 1, Reactor 2 y Reactor 3. Fotografía 11: Tanque Anóxico 1 Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) El tanque Anóxico /Selector 1 está equipado con un mezclador o agitador con motor de frecuencia variable que permite variar la velocidad de 0 a 1750 rpm. La función del tanque Anóxico 1 en la configuración del proceso de alimentación escalonada es mejorar la sedimentabilidad de los lodos activados. El tanque Selector recibe la recirculación de lodos del fondo del Sedimentador Secundario. El flujo de aguas residuales del Tanque Selector alimenta al primer Tanque Reactor Aeróbico. Los reactores aeróbicos son unidades de fibra de vidrio de forma cilíndrica con tuberías de entrada y salida. Poseen una zona anóxica y zona aeróbica. La zona anóxica incorporada representa aproximadamente el 15% del volumen total del reactor, y al igual que el reactor Anóxico 1 se instaló para mejorar la sedimentabilidad de los lodos. Los reactores aeróbicos poseen un sistema de aireación continua, por medio de una red de tubería de PVC en forma cuadrada con orificios de aproximadamente de 1mm, y válvulas al ingreso para la regulación del mismo, los cuales proveen aire para mezclado y para proveer de oxígeno a los microorganismos que oxidan la materia orgánica. El aire es trasmitido a los reactores gracias a dos compresores de anillo (blowers). 44 Fotografía 12: Vista superior de Tanque Aeróbico Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Fotografía 13: Vista frontal de Tanque Aeróbico Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 45 Fotografía 14: Sistema de aireación reactores Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Cabe aclarar que todos los tanques de la planta piloto ya sean sedimentadores, reactores anóxicos o aeróbicos cuentan con salidas para el rebose (2” Ø) y drenaje (4” Ø) de los mismos tal como se puede apreciar en la siguiente fotografía. Fotografía 15: Tuberías de salida, rebose y drenaje de los reactores Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) El efluente proveniente del último tanque de aireación alimenta al tanque sedimentador secundario, el cual separa los sólidos del agua residual tratada. 46 El sedimentador secundario es una unidad de fibra de vidrio de forma circular y fondo cónico, que simula un sedimentador secundario a escala con alimentación a un tonel central que dirige el flujo hacia abajo. Cuando el agua retorna hacia arriba y hacia afuera, los sólidos sedimentan mientras el agua decantada fluye sobre un vertedero circular a un canal circular que dirige el agua hacia la tubería del efluente de PVC de 2” Ø. Fotografía 16: Vista lateral Sedimentador secundario Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Fotografía 17: Vista superior Sedimentador secundario Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) El efluente recolectado en la tolva del sedimentador secundario rebosa hacia al tanque del efluente final. El lodo sedimentado del fondo del Sedimentador Secundario es recirculado aguas arriba hacia el Tanque Selector (Anóxico 1) con un caudal de 4500 L/día que equivale al 50% del caudal del 47 afluente. El exceso de lodos activados es extraído diariamente del tercer Tanque Reactor aireado hacia el tanque del efluente final. El tanque del efluente final es una unidad de fibra de vidrio de forma circular que almacena las aguas tratadas sobrenadantes del Sedimentador Secundario. Para facilidad en la Fase 1, se utilizó el tanque para almacenar el lodo descartado, y el efluente final proveniente del sedimentador secundario tuvo un almacén temporal para efectos de la toma de muestra. La fotografía a continuación evidencia lo descrito previamente. Fotografía 18: Vista frontal Tanque Efluente Final Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Fotografía 19: Toma de muestra para efluente final Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 48 b.4. Otras Facilidades de Apoyo En el ensamble final se tuvieron en cuenta la instalación de planta eléctrica y diseño y construcción de la caja matriz de controles eléctricos, incluyendo temporizadores y alarma en tiempo lluvioso integrados a un PLC. Fotografía 20: Tablero de control PLC Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 49 c. Muestreo y determinación de parámetros “in situ” El muestreo y control de parámetros “in situ” ejecutado para esta investigación se basó en las determinaciones previamente establecidas por los expertos de Hazen & Sawyer para la Fase 1, como se puede observar en la siguiente tabla:Tabla 5: Resumen de análisis y pruebas en todas las fases º A 1 1,1 1,2 1,3 2 2,1 2..2 3 3,1 3,2 4 4,1 4,2 4,4 4,6 5 5,1 5,2 6 7 B 1 2 3 4 5 6 7 8 9 DETERMINACIONES DE LABORATORIOS Analisis de laboratorio DQO DQO total DQO soluble DQO floculado y filtrado DBO DBO total DBO soluble SOLIDOS EN SUSPENSION Sólidos en suspensión totales Sólidos en suspensión volátiles NITROGENO N amoniacal soluble (NH3-N) Kjeldahl total (NKT) Nitritos (Fase 1) Nitratos (Fase 1) FOSFORO Orthofosfato (PO4-P) Fósforo total EVALUACION MICROBIOLÓGICA HELMINTOS DETERMINACIONS NEN LA PLANTA Mediciones y determinaciones de campo Caudal Temperatura Turbiedad pH Oxígeno Disuelto Alcalinidad Lectura de Interfase en Sedimentación de zona Columna de sedimentación (SST) SVI Unidad Crudo Efluente Primario Efluente Final mg/l mg/l mg/l Diario 2/sem 2/sem Diario 2/sem 2/sem Diario 2/sem 2/sem mg/l mg/l 2/sem 2/sem 2/sem 2/sem 2/sem 2/sem mg/l mg/l Diario 3/sem Diario 3/sem Diario 3/sem mg/l mg/l mg/l mg/l Diario 1/sem 1/sem 1/sem Diario 1/sem 1/sem 1/sem Diario 1/sem 1/sem 1/sem mg/l mg/l Diario 1/sem Diario 1/sem Diario 1/sem #/400 ml 1/sem 1/sem Efluente Final Unidad Crudo Efluente Primario ml/h °C NTU Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario Diario mg/l mg/l cm mg/l ml/g Reactor Aeróbico 1 Diario 3/sem Reactor Aeróbico 2 Diario 3/sem Reactor Aeróbico 3 Lodo Primario Lodo Secundario 1/sem 1/sem Diario 3/sem Diario 3/sem 1/sem 1/sem Reactor Lodo Aeróbico 3 Primario Lodo Lodo de Secundario exceso Diario 3/sem 2/mes 2/mes Reactor Aeróbico 1 Reactor Aeróbico 2 Diario Diario Diario 2/mes Horario Horario Diario Diario Horario Lodo de exceso (10x3)/Fase (6x3)/Fase 3/Sem 3/Sem 3/Sem Fuente: Protocolo Básico Experimental: Operación y Monitoreo Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito, Hazen & Sawyer. Elaborado por: Asociación Hazen & Sawyer –Pi Épsilon, 2015 50 c.1. Recolección de muestras Las campañas de muestreo para la fase propósito de la presente investigación se efectuaron de acuerdo a un protocolo establecido durante el ensamble de la planta piloto. El procedimiento, los equipos y materiales utilizados para el muestreo se describen a continuación. c.1.1. Equipos y materiales 3 muestreadores automáticos marca ISCO proporcionados por el PSA. 1 congelador 3 baldes plásticos Probetas de 1000mL, 500mL y 250mL Jarras plásticas graduadas de 250mL y 500mL Botellas plásticas proporcionadas por el L3C (2L) Envases plásticos 250mL Envases plásticos proporcionados por Gruentec de 1L y 125mL Membretes adhesivos Icepacks c.1.2. Procedimiento 1. Preparar el área de llenado de muestras con el material necesario (probetas, envases etiquetados, coolers, etc.). El cooler deberá contener los ice packs antes del inicio de la toma de la muestra. 2. Abrir los muestreadores (previamente programados por el PSA). Extraer el botellón que contendrá el volumen total del agua residual a ser muestreada, la cual debe estar preservada por el uso de ice packs. 51 Fotografía 21: Apertura de muestreador Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) Fotografía 22: Extracción del botellón con muestra Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 3. Verter el contenido del botellón proveniente de cada muestreador ISCO en cada uno de los baldes plásticos previamente asignados y rotulados de acuerdo al muestreador que corresponda. Posteriormente, enjuagar cada balde con un pequeño volumen del agua a ser muestreada. 52 Fotografía 23: Trasvase de contenido de muestra Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 4. Colocar los ice packs extraídos del muestreador a congelación. Dependiendo la frecuencia del muestreo (diaria, semanal, quincenal, etc) de la fase en ejecución, se colocarán nuevos icepacks congelados en el muestreador de manera que la calidad de la muestra no se vea afectada. 5. Homogenizar los envases a llenarse con una pequeña cantidad del agua objeto del muestreo. Los frascos estériles no se enjuagan, y se procede al muestreo directo. 6. Llenar los envases con la muestra respectiva de acuerdo al requerimiento volumétrico de cada laboratorio (Grüentec / L3C). Fotografía 24: Homogenización y llenado de muestras Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 53 7. Limpiar los excedentes de agua residual con una toalla papel, una vez que ha sido cerrado el frasco. 8. Llenar la etiqueta del envase con marcador permanente para las etiquetas del L3C y con lápiz para las etiquetas de Gruentec. Fotografía 25: Etiquetado de envases Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 9. Colocar las muestras conjuntamente con los icepacks en los coolers respectivos. Fotografía 26: Preservación de muestra Fuente: Trabajo de campo, 2015 Autores: Campoverde & Loayza (2015) 54 10. Limpiar el área de muestreo y los materiales utilizados. 11. Disponer los guantes y mascarillas utilizadas en el recipiente de desechos peligrosos. 12. Llenar la cadena de custodia tanto para el laboratorio L3C como para el laboratorio Gruentec de acuerdo al formato que corresponda. Éstas deben ser llenadas y firmadas con la fecha y hora de salida de las muestras de la Planta Piloto hacia los laboratorios. Archivar una copia de las cadenas de custodia. 13. Transportar los coolers con las muestras inmediatamente después de finalizado el muestreo, hacia los laboratorios respectivos. 14. Informar al encargado de la Planta, de la culminación del muestreo y las novedades suscitadas. 15. Registrar en la bitácora las novedades del muestreo. El protocolo detallado que incluye normas generales, responsables, procedimientos, materiales y cadenas de custodia utilizadas se detalla ampliamente en el Anexo A Protocolo para toma y entrega de muestras de la planta piloto. c.2. Parámetros determinados “in situ” Caudal Los caudales de ingreso, recirculación y descarte fueron controlados mediante regulación manual de las bombas y aforos con frecuencias diarias e interdiarias. Fotografía 27: Aforo manual de caudales Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) 55 Fotografía 28: Control visual de caudales mediante rotámetros Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) Oxígeno disuelto y temperatura El control de temperatura se realizó en conjunto con el oxígeno disuelto por medio del uso de un equipo portátil. Los valores registrados se reportan para obtener promedios diarios para su análisis posterior. Las mediciones de oxígeno disuelto y temperatura se realizaron para los tres reactores aeróbicos, además de ciertas mediciones esporádicas a todos los tanques para control operacional. Fotografía 29: Medidor óptico de oxígeno disuelto Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) 56 Fotografía 30: Medición de oxígeno disuelto en Reactor Aeróbico Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) pH y Alcalinidad La alcalinidad en la planta piloto fue determinada mediante titulación de ácido sulfúrico en el desecho crudo, efluente primario y final. Al mismo tiempo se registraron los valores de pH y temperatura. Fotografía 31: Medidor portátil de pH Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) 57 Fotografía 32: Titulación de muestras Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) Fotografía 33: Finalización del ensayo Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) Índice volumétrico de lodos (IVL-SVI) El índice volumétrico de los lodos es un parámetro que sirve para medir la calidad de sedimentabilidad (en un periodo de 30 minutos) del licor mezclado de los reactores. Se obtiene dividiendo el volumen sedimentado para los sólidos suspendidos totales. 58 Fotografía 34: Ensayo de IVL en los reactores Fuente: Trabajo de laboratorio, 2015 Autores: Campoverde & Loayza (2015) 3.5.1.2. Etapa 2. Resultados de laboratorio, procesamiento de datos y cálculo de parámetros a. Caracterización de la Quebrada El Batán La Asociación Hazen & Sawyer- Pi Épsilon, previo al inicio de la presente investigación realizó un compilado de la caracterización de las descargas de aguas residuales de la ciudad de Quito desde el año 2008 hasta el año 2014 en el cual se incluyen las 21 descargas principales monitoreadas corresponden a las cuencas de los ríos: Machángara, Monjas, San Pedro y Guayllabamba. A continuación se detallan las descargas monitoreadas dentro de la caracterización efectuada según el rio de afectación. Tabla 6: Principales descargas monitoreadas de la ciudad de Quito Descargas al Río Machángara Río Machángara Sector El recreo Colector Teodoro Gómez de la Torre Corporación Vida para Quito, descarga en la Tola Baja Corporación Vida para Quito, descarga en la Tola Baja Descarga del Colector Anglo French Descarga Central de Iñaquito, quebrada El Batán Descargas al Río Monjas Colector El Colegio Descarga de El Peaje Descarga de Pomasqui Descarga Principal de San Antonio Descargas a los Ríos San Pedro y Guayllabamba Descarga de Calderón zona norte #1 Descarga de Calderón zona norte #2 Descarga en Zámbiza Descarga Eloy Alfaro y Eucaliptos Descarga de San Antonio Puente Piscinas Descarga en Comité del Pueblo #1 Descarga de San Antonio, La Internacional Descarga de Comité del Pueblo #2 59 Descargas al Río Machángara Descargas al Río Monjas Descarga de Carcelén Alto (Corazón de Jesús) Descargas a los Ríos San Pedro y Guayllabamba Descarga de La Bota Colector Carcelén Bajo Descargas al Río Villorita Fuente: Informe de caracterización de aguas residuales, Asociación Hazen & Sawyer- Pi Epsilon Elaborado por: Campoverde, Loayza, 2015. Tabla 7: Valores Característicos Medios del colector central Iñaquito Iñaquito – El Batán PARÁMETRO UNIDAD Temperatura Caudal Medio, (Qmed.) Demanda Bioquímica de Oxígeno, (DBO5) Demanda Química de Oxígeno (DQO) Potencial Hidrógeno (pH) Nitrógeno Amoniacal, (NH3 – N) Nitrógeno Kjehldal Total, (NKT) Sólidos Suspendidos Totales (SST) Sólidos Suspendidos Volátiles (SSV) Detergentes (MBAS) Grasas y Aceites Sulfatos, (SO42-) Coliformes Totales (CT) 2008 2013 2014 ºC l/s 1 440,10 15,5 2185,3 18,1 1518,93 mg/l 161 256,3 157,9 mg/l 350 570,1 430,7 Unidad 7,4 7,3 6,94 mg/l 19,3 18,8 16,8 mg/l 31,8 25,5 21,1 mg/l 152 209,0 177,7 mg/l 93 188,9 146,7 mg/l 5,6 21,5 7,9 mg/l 20,0 33,8 2,9 mg/l 53,5 25,6 41,2 NMP/100 5,17E+07 1,30E+08 9,62E+08 mL NMP/100 Escherichia coli 1,29E+07 2,83E+07 8,43E+07 mL Fosfatos (PO4)2mg/l 3.4 2.8 Color UNC 3,71E+02 475,0 Turbiedad UC 9,91E+01 99,5 Fuente: Informe de caracterización de aguas residuales, Asociación Hazen & Sawyer- Pi Epsilon Elaborado por: Campoverde, Loayza, 2015. b. Procesamiento de resultados de laboratorio y de campo La compilación de los resultados, tanto los reportados por los laboratorios Gruntec y L3C como los medidos in-situ, se realizaron semanalmente mediante la utilización de los comandos ejecutables de Microsoft Excel 2013 con el lenguaje de programación Visual Basic. Ver Anexo E. 60 En la Figura 10 se muestra la interfaz del programa de la captura y el procesamiento de datos, con el cual se ingresaron los datos de los resultados mencionados anteriormente. Figura 10: Interfaz del Programa de captura y procesamiento de datos. Fuente: Procesamiento de datos, Planta Piloto de lodos activados. Hazen & Sawyer. Tal como se detalló en la sección c Muestreo y determinación de parámetros “in situ”, el control de los parámetros operacionales se realizó en el desecho crudo, efluente final, reactores aeróbicos y lodo de exceso. A continuación se detallan los parámetros físico y químicos que se determinaron para el procesamiento de datos: Tabla 8: Parámetros físicos y químicos a determinar en el desecho del afluente y efluente. Parámetro Unidad Frecuencia DQO total mg/L Diario DQO soluble mg/L Diario DBO total mg/L Diario DBO soluble mg/L Diario SST mg/L Diario SSV mg/L Diario NH3-N mg/L Diario NKT mg/L Diario 61 Parámetro Unidad Frecuencia NO2-N mg/L 2/sem NO3-N mg/L 2/sem PO4-P mg/L Diario PT mg/L Diario Alcalinidad mgCaCO3/L Diario pH Diario Fuente: Protocolo Básico Experimental: Operación y Monitoreo Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito, Hazen & Sawyer. Elaborado por: Campoverde, Loayza, 2015. Tabla 9: Parámetros físicos y químicos a determinar en reactores aeróbicos y lodo de exceso. Parámetro Unidad Frecuencia Reactores SST mg/L Diario SSV mg/L Diario Temperatura °C Diario OD mg/L Diario Lodo de exceso Qw L/día Diario SST mg/L Diario SSV mg/L Diario Fuente: Protocolo Básico Experimental: Operación y Monitoreo Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito, Hazen & Sawyer. Elaborado por: Campoverde, Loayza, 2015. Cabe mencionar que los parámetros de pH, temperatura, alcalinidad y OD fueron medidos in – situ, los demás fueron analizados y reportados por los laboratorios Gruntec y L3C. c. Selección de muestras para el análisis La selección de muestras idóneas para la obtención de la cinética se basaron en dos tipos de errores: errores de proceso y errores experimentales; se denominaron errores de proceso a los efectos adversos al tratamiento provocados por modificaciones a la operación normal de la planta o alteraciones climáticas, ocurridas previa o durante el muestreo que implique algún grado de afectación a los resultados, tales como pérdidas de biomasa, suspensión del sistema de aireación, etc. y errores experimentales a los resultados que presenten valores fuera del rango normal y que no tengan relación a ningún error de proceso en particular. La metodología utilizada para la selección y descarte de muestras se basó en el procedimiento posteriormente detallado: 1. La compilación de datos tanto de los parámetros “in situ” como de los reportados por el laboratorio de toda la Fase 1. 62 2. El detalle de eventualidades reportadas en la bitácora de la planta de acuerdo al día de muestreo respectivo. 3. El resumen las eventualidades presentadas durante el muestreo en el cual se identifican los principales eventos que causaron mayor inoperancia o pérdida de datos. 4. Cada eventualidad presentada se vincula a su posible causa originaria. 5. Se identifican las causas más relevantes y se establecen como criterio de descarte de datos por medio de un check list. 6. A partir de las muestras válidas obtenidas del check list, se procede a realizar los cálculos respectivos para la determinación de los coeficientes cinéticos. 7. Una vez obtenidos los valores de 1/θc y (So-S)/Xθ se procede a realizar la gráfica (So-S)/Xθ vs 1/θc, de acuerdo a la literatura. 8. Para relacionar de una manera más congruente los datos y descartar datos fuera de rango normal, se realiza el trazo de una recta teórica, basada en los valores típicos de dichos coeficientes e ir descartando los valores atípicos. 9. Se seleccionan los puntos que definirán los valores de los coeficientes cinéticos Y y Kd. 3.5.1.3. Etapa 3. Análisis de resultados a. Cálculo de parámetros para la cinética a.1. Cálculo de 𝜽𝒄 Para el cálculo de θc se tomará en cuenta la decisión de los expertos de despreciar los sólidos volátiles en el efluente final, tal como se menciona en la literatura. Para el cálculo de 𝜃𝑐 se utilizará la ecuación 3: 𝜽𝒄 = 𝑉𝑟 𝑋 𝑄𝑤 𝑋𝑤 a.2. Tiempo de retención hidráulico Para el cálculo de 𝜃 se utilizará la ecuación 4 considerando el volumen de un reactor aeróbico. 𝜽= 𝑉 𝑄 a.3. Sustrato en el sistema El sustrato en el sistema se obtendrá mediante la diferencia de la concentración de DBO del efluente y el afluente (So-S). 63 b. Determinación de coeficientes cinéticos El procedimiento recomendado por Metcalf y Eddy involucra la operación de una planta piloto en diferentes tiempos de retención, por lo menos para cinco valores diferentes, dentro de un intervalo de uno a diez días (Metcalft y Eddy, 2004). Una vez obtenidos los parámetros preliminares se procede a elaborar una gráfica de 𝑺𝟎 −𝑺 𝑿𝜽 en las 𝟏 abscisas y 𝜽 en las ordenadas, en donde la pendiente de dicha recta nos permitirá obtener el valor de 𝒄 Y y la ordenada en el origen el valor de Kd. Los valores de Y y Kd se obtendrán mediante una regresión lineal. b.1. Cálculo de producción de biomasa Para el cálculo de la producción de biomasa se utilizará la ecuación 7: 𝑷𝒙 = 𝑄𝑌(𝑆0 − 𝑆) 1 + 𝑘𝑑 𝜃𝑐 b.2. Cálculo de requisito de oxígeno Para el cálculo del requisito de oxígeno se utilizará la ecuación 9: 𝑫𝑶 = 𝑄(𝑆0 − 𝑆) − 1,42(𝑃𝑥 ) + 4,57(𝑁0 − 𝑁)𝑄 𝑓 c. Cálculo del coeficiente de correlación entre el requisito de oxígeno y la producción de biomasa Para el cálculo del coeficiente de correlación entre el requisito de oxígeno y la producción de biomasa se utilizará el valor del coeficiente de determinación (R2) calculado con la función de Microsoft Excel 2013 y se lo reemplazará en la ecuación 11: 𝟐 𝑹 = √𝑹𝟐 3.6. LIMITACIONES 3.6.1. Recursos Materiales En la fase de muestreo se contó con materiales proporcionados por la empresa Hazen & Sawyer. Al igual que los análisis de laboratorio, que fueron realizados en el laboratorio Gruentec Cía. Ltda y L3C. 64 3.6.2. Tiempo El presente trabajo fue realizado en un periodo de 9 meses, siguiendo el cronograma establecido en el Anexo B. 3.6.3. Recursos financieros El estudio fue financiado por la empresa Hazen & Sawyer en la etapa de muestreo y análisis de laboratorio de las muestras recolectadas, mientras que la etapa de investigación y aprobación, fue financiada por los investigadores. El presupuesto consta en el Anexo C. 65 CAPÍTULO IV 4. ANÁLISIS DE RESULTADOS 4.1. Resultados de laboratorio y procesamiento de datos De acuerdo a lo detallado en la metodología anterior, durante la campaña de muestreo efectuada se encontraron tanto errores de proceso como errores experimentales. El criterio mayormente utilizado se basó en la no estabilización del sistema de lodos activados; por lo cual se consideraron no aptas para el procesamiento las muestras de los días que presentaron eventos de lluvias intensas, alteraciones de caudal de recirculación, pérdidas de biomasa, suspensión del sistema de aireación, daños de bombas, variabilidad del caudal de descarte de lodos y descargas esporádicas de altas cargas contaminantes. Este criterio en conjunto con la opinión de los representantes técnicos de Hazen & Sawyer determinaron las muestras más representativas, para que a partir de éstas se realice el cálculo de los coeficientes cinéticos. En la Figura 11 se representó la línea de tiempo que detalla las actividades desde el inicio del proyecto hasta el fin de la Fase 1 en la Planta Piloto. 66 Año Mes Actividades Importación de equipos y compras locales Finalización de infraestructura de la Planta Piloto Prueba de Kla: metodología y compra de materiales requeridos Rectificación de medidas de tanques de acuerdo al perfil hidráulico Calibración y recalibración al equipo medidor óptico de OD marca PASCO Adecuación y modificación del mecanismo de difusión de aire en tanques de aireación Control de fugas en tanques de aireación Pruebas de aireación - Arranque del sistema con agua residual (Fase Inicial) Control de espuma en los tanques de aireación Instalación de muestreadores Adecuación del sistema eléctrico de la Planta Piloto Generación de biomasa Inicio Fase 1 Pérdida de biomasa Lluvias intensas Suspensión de muestreo por posible cambio a Fase 2 Lluvias intensas - Toma de muestras First Flush Figura 11: Línea de tiempo proyecto Planta Piloto Fuente: Bitácora Planta Piloto Hazen & Sawyer 2015 Elaborado por: Campoverde, Loayza, 2015. 67 Julio Agosto Septiembre 2015 Octubre Noviembre Diciembre Enero Febrero Marzo Semana 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 Fase Inicial Primera toma de muestras de la Fase Inicial Reubicación de bomba sumergible de alimentación de crudo_ Instalación tanque reservorio Daño de estructura metálica que sostiene a la canastilla de la bomba sumergible Pérdida de biomasa Inyección de inóculo para recuperación de biomasa Generación de biomasa Inicio de control nocturno de planta Fase 1 2014 4.1.1. Selección de muestras válidas Tabla 10: Resumen de resultados por campaña de muestreo FECHA Unidad M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra M ue s tra 15 16 17 18 19 20 21 22 23 24 M ue s tra 25 05/01/2015 06/01/2015 07/01/2015 08/01/2015 09/01/2015 10/01/2015 11/01/2015 12/01/2015 13/01/2015 14/01/2015 15/01/2015 DESECHO CRUDO DQO total mg/l 776,3 511,2 415,9 404,8 451,1 429,7 401,5 383,2 508,2 647,65 441,4 DQO soluble mg/l 270,2 186,2 277,4 269,7 373,8 248,3 321,4 178,5 362 413,45 330,1 DBO total mg/l 280,4 216,6 131 130,5 208,3 148,5 150,6 104,7 130,86 183,4 183,7 DBO soluble mg/l 80,7 75,5 76 107 89,2 62,73 98 62,1 65,58 119,6 88,1 Sólidos en suspensión totales mg/l 380 260 148 122 128 134 126 122 120 198 146 Sólidos en suspensión volátiles mg/l 300 204 132 116 122 132 120 110 106 160 136 DQO total mg/l 434,8 339 446,7 470 529,1 267,4 366,2 408,2 611,2 661,05 619,7 DQO soluble mg/l 188,5 181,6 238 315 396,4 255,4 263,6 138,7 353,3 386,5 341,8 DBO total mg/l 187 172 139,6 166,1 193,1 170 155 145 158,91 203,3 209,2 DBO soluble mg/l 49,7 65,1 69 114,9 87 72,2 86 67,4 84,61 198,3 75,8 Sólidos en suspensión totales mg/l 176 132 162 148 150 174 162 144 220 246 228 Sólidos en suspensión volátiles mg/l 156 128 144 134 132 160 148 130 168 186 196 DQO total mg/l 98,5 83,9 129,4 152,9 245,3 147,6 128,8 99,9 284,7 310,8 299,9 DQO soluble mg/l 35,8 34,2 24,3 124,5 55 86,7 35,4 32,9 208 206,5 198,6 DBO total mg/l 39,4 49 43,5 63,6 83,8 33,6 53,5 37,7 67,98 83,9 88,5 DBO soluble mg/l 7,8 3,4 5,8 37,6 9,6 8,4 9,4 13,3 35,49 75,5 28,1 Sólidos en suspensión totales mg/l 54 46 30 42 38 52 102 52 76 112 88 Sólidos en suspensión volátiles mg/l 54 44 30 42 38 50 66 52 76 88 88 Sólidos en suspensión totales mg/l 3280 3040 2900 2760 2660 2900 2720 2520 2260 2180 1660 Sólidos en suspensión volátiles mg/l 2540 2420 2380 2380 2300 2580 2320 2200 1880 1820 1520 Sólidos en suspensión totales mg/l 2600 2420 2200 2220 2160 2300 2000 2060 1540 1760 1440 Sólidos en suspensión volátiles mg/l 2040 1920 1840 1880 1920 2100 1820 1740 1340 1440 1280 Sólidos en suspensión totales mg/l 1980 2060 1720 1800 1720 1900 1660 1640 1520 1400 1200 Sólidos en suspensión volátiles mg/l 1660 1600 1480 1600 1560 1780 1520 1460 1340 1200 1160 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 375,1 457,25 454,6 486,97 436,39 438,94 439,59 438,71 439,82 439,59 437,17 Sólidos en suspensión totales mg/l 1980 2060 1720 1800 1720 1900 1660 1640 1520 1520 1200 Sólidos en suspensión volátiles mg/l 1660 1600 1480 1600 1560 1780 1520 1460 1340 1340 1160 Fuente: Procesamiento de datos planta piloto Hazen & Sawyer 2015 Elaborado por: Campoverde, Loayza, 2015. Ver Anexo D Resumen de Resultados Fase 1. 68 Tabla 11: Detalle de eventualidades presentadas en Fase 1 ENERO lu. ma. mi. ju. 1 vi. 2 sá. do. 3 4 5 Inicio de Fase 1M015❶ 6 M016 7 M017 8 9 M018. Remoción de M019 DBO <95% 10 M020 11 M021- Remoción de DBO <95% 12 M022Recirculacion al 70%- Remoción de DBO <95% 13 M023 Remoción de DBO <95% 14 M024 Remoción de DBO <95% 15 M025- Pérdida de biomasa - Remoción de DBO <95% 17 M027 Remoción de DBO <95% 18 M028 Remoción de DBO <95% 19 M029- Lluvia intensa- Muestreo First Flush 2 20 21 M030 - Se suspende M031 - No existe el sistema de registro de caudal aireación 22 M032❷ 16 M026- Lluvia intensa- Muestreo First FlushRemoción de DBO <95% 23 M033- Pérdida de biomasa 24 M034- Pérdida de biomasa 25 M035- Pérdida de biomasa 26 M036 - No existe registro de caudal 27 M037 - No existe registro de caudal 29 Alteración de caudales de descarteAlimentación con reservorio- Cambio de bomba de alimentación 30 M039 31 M040 ❸ 28 M038 - Fuente: Bitácora Planta Piloto Hazen & Sawyer 2015 Elaborado por: Campoverde, Loayza, 2015. 69 FEBRERO lu. ma. mi. ju. vi. sá. do. 1 M041 - No existe registro de caudal 2 M042- Alta cantidad de espuma en el canal 3 4 M043- Bajo nivel de M044 OD producto de descarga contaminante 5 M045 - No existe registro de caudal 9 M048- Falla en bomba de recirculación 10→ Se suspende el muestreo. Ensayos para posible cambio a Fase 2 11→ 16→ 17→│ 23 M054 ❹ 24 M055 7 Operación del sistema con la reserva. 8 M047-Lluvia intensa. Operación del sistema con la reserva. 12→ 13→ Prueba de Kla Agua Prueba de Kla Clara Efluente final 14→ 15→ 18 M049 Se retoma el muestreo, no existe registro de caudal 19 20 M050 - Muestreo M051- Lluvia First Flush 3. Lluvia intensa intensa 21 M052 - Lluvia intensa 22 M053 - No existe registro de caudal 25 M056 ❺ 26 M057 - No existe registro de caudal 28 M059 Remoción de DBO <95% Fuente: Bitácora Planta Piloto Hazen & Sawyer 2015 Elaborado por: Campoverde, Loayza, 2015. 70 6 M046- Daño de la bomba de alimentacion 27 M058 - No existe registro de caudal MARZO lu. ma. mi. ju. vi. sá. do. 1 M060 2 M061 - Se opera con la reserva. Lluvia intensa 3 4 M062 - Sin M063 - No existe alimentación (17h00 registro de caudal - 20h00) Falla de operación 5 M064 ❻ 6 M065 - No existe registro de caudal 7 M066 - No existe registro de caudal 8 M067 - ❼ 9 M068 - ❽ 10 M069 - ❾ 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 Fuente: Bitácora Planta Piloto Hazen & Sawyer 2015 Elaborado por: Campoverde, Loayza, 2015. 71 72 Tabla 12: Resumen de eventualidades presentadas durante el muestreo Eventualidad presentada Frecuencia Porcentaje 10 22% 1 2% 4 9% 7 15% 1 2% 12 26% 1 2% 4 3 9% 7% Descargas contaminantes 1 2% Descargas contaminantes Falta de control operacional TOTAL Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. 1 2% 1 2% 46 100% Remoción de DBO <95% Recirculación al 70% Pérdida de biomasa Lluvia intensa Suspensión del sistema de aireación No existe registro de caudal Alteración de caudales de descarte Alimentación con reservorio Cambio y/o avería de bombas Alta cantidad de espuma en el canal Bajo nivel de OD Sin alimentación (17h00 20h00) Posible Causa Inestabilidad del sistema Falta de control operacional Falta de control operacional Periodo invernal Falla mecánica Falta de control operacional Falta de control operacional Periodo invernal Falla mecánica Como se puede evidenciar en la tabla superior la mayoría (26%) de inconvenientes presentados durante las campañas de muestreo de Fase 1 se debieron a la falta de un registro y/o control apropiado de los caudales en el sistema; esto, seguido de las lluvias intensas debido al periodo invernal en la que se desarrolló el proyecto (19%) desencadenaron que en numerosas ocasiones se alimente el sistema con el tanque reservorio (9%) que si bien no constituye un problema en operación, provoca ligeras alteraciones en las características fisicoquímicas esperadas para los efluentes primario y final. Un análisis posterior al compendio de datos con los resultados de laboratorio mostró que la remoción de DBO, propósito principal de Fase 1, fue menor al 95% en ciertas fechas, motivo por el cual se consideró como criterio de descarte Los llamados washouts o pérdidas súbitas de biomasa constituyeron otra considerable (9%) eventualidad durante la operación de la planta debido al periodo de recuperación que implica. De acuerdo a la eventualidad presentada se realizó en términos generales el análisis respectivo a la posible causa que lo origina. 73 Inestabilidad del sistema Falta de control operacional Periodo invernal Falla mecánica 9% 22% 24% 41% Figura 12: Criterios discrecionales para exclusión de datos Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. De la Figura 12 se puede evidenciar que el 41% de los datos descartados fueron por la falta de control operacional, siendo este el criterio de mayor importancia en dicho descarte, el 24% por período invernal, el 22% por la inestabilidad del sistema y el 9% por las fallas mecánicas presentadas. A partir de esto, se elaboró un check list para de acuerdo a los criterios previamente mencionando realizar el descarte de muestras no válidas. 1 2 3 4 5 6 7 8 9 10 11 12 Muestras válidas Total Fallas operacionales Fallas mecánicas Descargas contaminantes Remoción de DBO < 95% Precipitacione s (Periodo invernal) Muestra Tabla 13: Check list empleado para descartar muestreos 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 74 1 1 1 1 1 Muestras válidas Total Fallas operacionales Fallas mecánicas Descargas contaminantes Remoción de DBO < 95% Precipitacione s (Periodo invernal) Muestra 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 75 Total 1 1 1 1 TOTAL Muestras válidas Fallas operacionales Fallas mecánicas Descargas contaminantes Remoción de DBO < 95% Precipitacione s (Periodo invernal) Muestra 51 52 53 54 55 1 1 1 17 Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. A continuación se presentan las muestras seleccionadas y los datos analizados en dichas muestras para el desecho del efluente primario, efluente final, reactores aeróbicos y lodo de exceso: 76 Tabla 14: Muestras seleccionadas Muestra EFLUENTE PRIMARIO DQO total, mg/L DQO soluble, mg/L DBO total, mg/L DBO soluble, mg/L Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L EFLUENTE FINAL DQO total, mg/L DQO soluble, mg/L DBO total, mg/L DBO soluble, mg/L Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L REACTOR 1 Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L REACTOR 2 Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L REACTOR 3 Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L LODO DE EXCESO Volumen, L/día Sólidos en suspensión totales, mg/L Sólidos en suspensión volátiles, mg/L 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 434,8 339 446,7 529,1 188,5 181,6 238 396,4 187 172 139,6 193,1 49,7 65,1 69 87 176 132 162 150 156 128 144 132 267,4 255,4 170 72,2 174 160 531,8 284,9 156,9 55,6 120 120 711 189,8 168,9 48,2 244 192 600,4 153,7 183,1 67,1 276 226 567,8 213,9 136,3 55,9 242 206 696,1 293,3 144,4 50,8 216 174 537,2 133,2 146,4 51,3 158 142 320,6 107,7 119,8 43,6 140 120 358 117,3 128,9 54,7 94 90 323,5 107,4 160,9 62,2 118 112 419 76,2 198 23,03 218 176 412,4 100,2 183,5 38,2 202 182 439 130,2 188,8 73,5 190 166 98,5 35,8 39,4 7,8 54 54 83,9 34,2 49 3,4 46 44 129,4 245,3 24,3 55 43,5 83,8 5,8 9,6 30 38 30 38 147,6 86,7 33,6 8,4 52 50 278,3 196,9 66,4 3,8 60 60 185,6 99,8 39 1 24 24 225,4 64,4 98,9 0,5 86 86 76,9 37,2 27,7 2,2 14 14 217,8 170,1 26,4 0,7 38 38 189 125,9 12,8 1,6 26 26 58,8 51,1 23,3 1,7 6 4 91 66,5 39,8 3,2 18 18 92,4 63,4 22,1 2,5 4 4 35,7 14,8 23,4 0,18 22 22 68,4 31,4 31,8 1,1 42 42 80,4 25,5 25 3,2 22 22 3280 2540 3040 2420 2900 2380 2660 2300 2900 2580 1980 1840 1910 1570 2270 1900 2050 1720 2240 1740 1890 1610 1640 1430 1250 1060 2070 1670 2410 1920 2530 2100 2250 1840 2600 2040 2420 1920 2200 1840 2160 1920 2300 2100 1560 1460 1560 1280 1690 1460 1370 1190 1690 1330 1420 1250 1380 1170 1020 880 1520 1270 1690 1430 1760 1470 1710 1380 1980 1660 2060 1600 1720 1480 1720 1560 1900 1780 1280 1240 1280 1120 1330 1140 1130 1010 1380 1090 1120 1040 1090 960 920 800 1180 1040 1410 1220 1450 1200 1430 1200 375,1 457,25 454,6 436,39 438,94 430,56 424,15 385,81 392,65 628,42 549,24 567,32 570,62 574,43 574,43 574,65 580,62 1980 2060 1720 1720 1900 1280 1280 1330 1130 1380 1120 1090 920 1180 1410 1450 1430 1660 1600 1480 1560 1780 1240 1120 1140 1010 1090 1040 960 800 1040 1220 1200 1200 Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. 77 4.1.2. Muestras seleccionadas para la determinación de los coeficientes cinéticos Con los datos de las 17 muestras seleccionadas se realizó los cálculos para la determinación de los coeficientes cinéticos: Tabla 15: Cálculos para la determinación de los coeficientes cinéticos θc día θ día So - S Xθ mg SSV/L/día 1/θc (So-S)/(Xθ) 5,207 0,058 179,2 360,833 0,192 0,497 4,219 0,058 168,6 343,486 0,237 0,491 4,402 0,058 133,8 329,607 0,227 0,406 4,412 0,058 183,5 363,146 0,227 0,505 4,296 0,058 161,6 373,555 0,233 0,433 4,418 0,058 153,1 262,529 0,226 0,583 4,342 0,058 167,9 229,569 0,230 0,731 5,316 0,058 182,6 260,216 0,188 0,702 5,136 0,058 134,1 226,677 0,195 0,592 3,156 0,058 143,7 240,556 0,317 0,597 3,548 0,058 144,8 225,521 0,282 0,642 3,396 0,058 118,1 205,860 0,294 0,574 3,119 0,058 125,7 158,443 0,321 0,793 3,462 0,058 158,4 230,147 0,289 0,688 3,388 0,058 197,8 264,264 0,295 0,749 3,594 0,058 182,4 275,829 0,278 0,661 255,590 0,303 0,726 3,296 0,058 185,6 Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. Una vez obtenidos los valores de 1/θc y (So-S)/Xθ se procedió a realizar la gráfica (So-S)/Xθ vs 1/θc, como demanda la literatura: 78 0,35 0,30 y = 0,189x + 0,1395 0,25 0,20 1/θ 0,15 0,10 0,05 0,00 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55 0,60 0,65 0,70 0,75 0,80 0,85 (So-S)/Xθ Figura 13: Determinación de Y y Kd Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. Debido a que los valores de los coeficientes que se muestran en la Figura 13 Y= 0,18 y Kd= 0,13 están fuera del rango de los valores que describe la literatura (0,4 – 0,8 y 0,025 – 0,075, respectivamente), se realizó el trazo de una recta teórica, basada en los valores típicos de dichos coeficientes (Y=0.6 y Kd=0.06), para ir descartando los valores que se encuentren lejanos a dicha recta, como se muestra a continuación: 0,35 0,30 0,25 0,20 0,15 1/θ 0,10 0,05 0,00 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55 0,60 0,65 0,70 0,75 0,80 0,85 -0,05 -0,10 (So-S)/Xθ Figura 14: Valores típicos de coeficientes cinéticos. Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. 79 En la Figura 14 se puede observar que 8 puntos se encuentran lejanos a la recta, mientras que 9 se encuentran cercanos a la misma, por consiguiente estos 9 puntos serán los que definirán los valores de los coeficientes cinéticos Y y Kd. Muestra 9 Muestra 8 Muestra 7 Muestra 6 Muestra 5 Muestra 4 Muestra 3 Muestra 2 Muestra 1 Tabla 16: Análisis y Pruebas del Desecho del Efluente Primario 05/01/15 22/01/15 31/01/15 23/02/15 25/02/15 05/03/15 08/03/15 09/03/15 10/03/15 EFLUENTE PRIMARIO DQO total, mg/L 434,8 531,8 567,8 537,2 358 323,5 419 412,4 439 DQO soluble, mg/L 188,5 284,9 213,9 133,2 117,3 107,4 76,2 100,2 130,2 DBO total, mg/L 187 156,9 136,3 146,4 128,9 160,9 198 183,5 188,8 DBO soluble, mg/L 49,7 55,6 55,9 51,3 54,7 62,2 23,03 38,2 73,5 SST, mg/L 176 120 242 158 94 118 218 202 190 SSV, mg/L 156 120 206 142 90 112 176 182 166 NH3-N, mg/L 19 20 29 18 22 18 18 19 22 NKT, mg/L 29 30 49 38 25 38 33 39 36 NO2-N, mg/L ND 0,1 ND ND ND ND ND ND ND NO3-N, mg/L ND 0,1 ND ND ND ND ND ND ND PO4-P, mg/L 4,8 3,9 3,7 4,4 2,7 ND ND 5,4 ND Fósforo total, mg/L 5,1 4,8 5,2 4,6 3,7 ND ND 4,4 ND Alcalinidad, mg CaCO3/L 188 178 222 176 194 164 174 178 182 pH 7,31 7,4 7,52 7,51 7,36 7,33 7,39 7,46 7,47 Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. 80 Muestra 9 Muestra 8 Muestra 7 Muestra 6 Muestra 5 Muestra 4 Muestra 3 Muestra 2 Muestra 1 Tabla 17: Análisis y Pruebas del Efluente Final 05/01/15 22/01/15 31/01/15 23/02/15 25/02/15 05/03/15 08/03/15 09/03/15 10/03/15 EFLUENTE FINAL DQO total, mg/L 98,5 278,3 76,9 189 91 92,4 35,7 68,4 80,4 DQO soluble, mg/L 35,8 196,9 37,2 125,9 66,5 63,4 14,8 31,4 25,5 DBO total, mg/L 39,4 66,4 27,7 12,8 39,8 22,1 23,4 31,8 25 DBO soluble, mg/L 7,8 3,8 2,2 1,6 3,2 2,5 0,18 1,1 3,2 SST, mg/L 54 60 14 26 18 4 22 42 22 SSV, mg/L 54 60 14 26 18 4 22 42 22 NH3-N, mg/L 9,1 1,2 7,9 3,9 2,7 4,9 2,4 1,6 1,7 NKT, mg/L 13 3,8 14 9,5 7 9,4 9,5 9,7 7,2 NO2-N, mg/L ND 4,7 ND ND ND ND ND ND ND NO3-N, mg/L ND 31 ND ND ND ND ND ND ND PO4-P, mg/L 3,7 2,1 1,6 4 2,4 ND ND 3,7 ND Fósforo total, mg/L 2,9 2,7 1,8 2,2 2 ND ND 2,3 ND Alcalinidad, mg CaCO3/L 118 66 72 80 70 72 64 64 80 pH 7,58 7,23 7,36 7,34 7,22 7,35 7,19 7,23 7,21 Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. 81 10/03/15 Muestra 9 09/03/15 Muestra 8 08/03/15 Muestra 7 05/03/15 Muestra 6 25/02/15 Muestra 5 23/02/15 Muestra 4 31/01/15 Muestra 3 22/01/15 Muestra 2 05/01/15 Muestra 1 Tabla 18: Análisis y Pruebas de los Reactores Aeróbicos SST, mg/L 3280 1980 2050 1890 1250 2070 2410 2530 2250 SSV, mg/L 2540 1840 1720 1610 1060 1670 1920 2100 1840 Temperatura, ºC 18,6 18,6 19,1 19,9 19,5 19 19,3 20 20,1 OD, mg/L 2,37 3,31 2,13 3,02 3,38 2,88 1,83 2,42 2,31 Reactor 1 Reactor 2 SST, mg/L 2600 1560 1370 1420 1020 1520 1690 1760 1710 SSV, mg/L 2040 1460 1190 1250 880 1270 1430 1470 1380 Temperatura, ºC 18,6 18,6 19,1 19,9 17,7 19 19,2 20 20 OD, mg/L 2,28 3,55 2,54 3,19 2,88 2,62 1,95 1,84 1,77 SST, mg/L 1980 1280 1130 1120 920 1180 1410 1450 1430 SSV, mg/L 1660 1240 1010 1040 800 1040 1220 1200 1200 Temperatura, ºC 18,6 18,6 19 19,8 19,2 18,8 19,2 19,7 20 OD, mg/L LODO DE EXCESO 2,43 3,45 2,3 3,05 2,98 2,93 2,05 2,15 2,24 SST, mg/L 375, 1 1980 430,5 6 1280 392,6 5 1130 549,2 4 1120 570,6 2 920 574,4 3 1180 574,4 3 1410 574,6 5 1450 580,6 2 1430 SSV, mg/L 1660 1240 1010 1040 800 1040 1220 1200 1200 Reactor 3 Volumen, L/día Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. 82 4.2. Parámetros “in situ” 4.2.1. Variaciones de pH en el afluente y en el efluente Tabla 19: Variaciones de pH θc Afluente día 1 5,207 7,31 2 5,136 7,52 3 4,418 7,40 4 3,594 7,46 5 3,548 7,51 6 3,462 7,33 7 3,388 7,39 8 3,296 7,47 9 3,119 7,36 7,52 Máximo 7,31 Mínimo 7,42 Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. N° Afluente Efluente 7,58 7,36 7,23 7,23 7,34 7,35 7,19 7,21 7,22 7,58 7,19 7,30 Efluente 7,70 7,60 7,50 pH 7,40 7,30 7,20 7,10 7,00 6,90 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (TPRC), días Figura 15: Variaciones de pH Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. La Figura 15 representa los valores medidos de pH en el afluente y en el efluente, indicando que el valor del afluente fue mayor que en el efluente, a excepción de dos campañas de muestreo, los valores se encuentran dentro del rango de 7.19 - 7.58, es decir se encuentran dentro de los valores típicos de pH para aguas residuales. 83 4.2.2. Variaciones de alcalinidad en el afluente y en el efluente Tabla 20: Variaciones de alcalinidad θc Afluente día 1 5,207 188 2 5,136 222 3 4,418 178 4 3,594 178 5 3,548 176 6 3,462 164 7 3,388 174 8 3,296 182 9 3,119 194 222 Máximo 164 Mínimo 184 Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. N° Alcalinidad, (mg CaCO3/L) Afluente Efluente 118 72 66 64 80 72 64 80 70 118 64 76 Efluente 250 200 150 100 50 0 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (TPRC), días Figura 16: Variaciones de alcalinidad Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. En la Figura 16 se representan los valores medidos de alcalinidad en el afluente y en el efluente, y se puede apreciar que los valores del afluente fueron más altos que los del efluente, los valores máximos en el afluente y en el efluente fueron 222 y 118, respectivamente, mientras que los valores mínimos en cada desecho fueron 164 en el afluente y 64 en el efluente, indicando que existe un buen amortiguamiento por parte de las sales de ácidos débiles. 84 4.2.3. Oxígeno disuelto del afluente (Efluente primario) Tabla 21: Oxígeno Disuelto del afluente N° 1 2 3 4 5 6 7 8 9 10 11 12 13 Hora ºC 06h00 08H00 10h00 12H00 14H00 16H00 18H00 20H00 22H00 24H00 00H00 02H00 04H00 Máximo Mínimo Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. OD mg/L 1,81 0,6 0,76 0,92 0,84 0,9 0,87 0,8 1,63 1,72 1,58 1,81 1,80 1,81 0,60 1,23 SEDIMENTADOR PRIMARIO OD (mg/L) 2 1,5 1 0,5 0 Horas Figura 17: Oxígeno Disuelto del afluente Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. En la Figura 17 se encuentran los valores correspondientes a las concentraciones promedio de Oxígeno Disuelto a lo largo de la jornada diaria, se puede evidenciar un nivel bajo (menor a 1mg/L) durante el día y el incremento del mismo en la noche y madrugada. 85 4.2.4. Oxígeno disuelto en los Reactores Aeróbicos Tabla 22: Oxígeno Disuelto en los Reactores Aeróbicos θc día 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 N° 1 2 3 4 5 6 7 8 9 OD mg/L 3,43 2,36 1,94 2,32 3,08 2,81 2,14 3,09 2,11 3,43 1,94 2,59 Máximo Mínimo Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. OD ( mg/L) OD 4,00 3,50 3,00 2,50 2,00 1,50 1,00 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (TPRC), días Figura 18: Oxígeno Disuelto en los Reactores Aeróbicos Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. En la Figura 18 se encuentran los valores correspondientes a las concentraciones promedio de Oxígeno Disuelto en las nueve campañas de muestreo, los cuales se mantuvieron entre 1.94 y 3.43 mg/L, valores que se encuentran dentro de las rangos óptimos para el tratamiento de aguas residuales por lodos activos. 86 4.2.5. Temperatura en los Reactores Aeróbicos Tabla 23: Temperatura en los Reactores Aeróbicos θc día 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 N° 1 2 3 4 5 6 7 8 9 T °C 18,6 19,1 18,6 19,9 19,8 18,9 19,2 20,0 18,8 20,0 18,6 19,2 Máximo Mínimo Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. T (°C) T °C 20,5 20,0 19,5 19,0 18,5 18,0 17,5 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (días) Figura 19: Temperatura en los Reactores Aeróbicos Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. La temperatura en los reactores aeróbicos fue similar en cada día de muestreo, por lo que la Figura 19 representa el promedio de los valores de los tres reactores, se puede apreciar que a medida que disminuye el TPRC la temperatura tiende a aumentar, debido a la actividad microbiana, siendo el valor mínimo 18.6 °C y el valor máximo 20 °C. 87 4.2.6. Caudal de operación Tabla 24: Caudal de operación θc día 5,207 4,418 5,136 3,548 3,119 3,462 3,388 3,594 3,296 N° 1 2 3 4 5 6 7 8 9 Máximo Mínimo Promedio Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. Q L/día 8985,6 9014,4 8971,2 9028,8 8985,6 9014,4 8985,6 9028,8 8956,8 9028,80 8956,80 8996,80 Q L/día Caudal (L/día) 9030 9010 8990 8970 8950 5,207 4,418 5,136 3,548 3,119 3,462 3,388 3,594 3,296 Tiempo promedio de retención celular (días) Figura 20: Caudal de operación Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. Los valores del caudal de operación para cada una de las campañas de muestreo están representados en la Figura 20, mismos que se encuentran dentro del rango 8956,8 – 9028,8 L/día y cuyo promedio es 8996,8 L/día, lo cual indica que el valor del caudal bordeo el valor requerido para la Fase 1 (9000L/día). 88 4.3. Cálculo de parámetros 4.3.1. Cálculo de 𝜽𝒄 Para el cálculo de 𝜃𝑐 se despreció los sólidos volátiles en el efluente final, tal como se menciona en la literatura; a continuación se presenta los cálculos para la determinación de 𝜃𝑐 en las nueve campañas de muestreo: 𝜽𝒄 = 𝜽𝒄 = 𝑉𝑟 𝑋 𝑄𝑤 𝑋𝑤 519.6 𝐿 ∗ (2540 + 2040 + 1160) 𝑚𝑔⁄𝐿 (375.1 𝐿⁄𝑑í𝑎 ∗ 1160 𝑚𝑔⁄𝐿) 𝜽𝒄 = 𝟓, 𝟐𝟎𝟕𝒅í𝒂𝒔 Los datos empleados en este cálculo corresponden a los de la Muestra N°1. Tabla 25: Datos para determinación de los coeficientes cinéticos Y y Kd Nº DBO afluente So, mg/L DBO efluente S, mg/L θc día 1 187,0 7,80 5,21 2 136,3 2,20 5,14 3 156,9 3,80 4,42 4 183,5 1,10 3,59 5 146,4 1,60 3,55 6 160,9 2,50 3,46 7 198,0 0,18 3,39 8 188,8 3,20 3,30 9 128.9 3.20 3.12 Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. θ día X mg SSV/L 0,058 0,058 0,058 0,058 0,058 0,058 0,058 0,058 0.058 6240 3920 4540 4770 3900 3980 4570 4420 2740 4.3.2. Tiempo de retención hidráulico Para el cálculo de 𝜃 se utilizó la ecuación 4: 𝜽= 𝜽= 𝑉 𝑄 (519,6)𝐿 9000 𝐿⁄𝑑í𝑎 𝜽 = 𝟎, 𝟎𝟓𝟖 𝒅í𝒂 Para el cálculo del tiempo de retención hidráulico, se utilizó el volumen de un reactor aeróbico. 89 4.3.3. Sustrato en el sistema Estos valores se obtuvieron experimentalmente, y a partir de los mismos se realizó el cálculo de acuerdo a lo anteriormente descrito en la sección 3.6. Análisis de Resultados obteniendo los siguientes resultados: Tabla 26: Cálculo para la determinación de sustrato en el sistema θc DBO afluente DBO efluente día So, mg/L S, mg/L 1 5,207 187,0 7,80 2 5,136 136,3 2,20 3 4,418 156,9 3,80 4 3,594 183,5 1,10 5 3,548 146,4 1,60 6 3,462 160,9 2,50 7 3,388 198,0 0,18 8 3,296 188,8 3,20 9 3,119 128,9 3,20 198,0 7,80 Máximo 128,9 0,18 Mínimo Promedio 165,2 2,84 Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. Nº DBO efluente S, mg/L 179,2 134,1 153,1 182,4 144,8 158,4 197,8 185,6 125,7 197,8 125,7 162,3 So - S 225 200 175 150 125 100 75 50 25 0 250,0 200,0 150,0 100,0 50,0 So-S (mg/L) DBO (mg/L) DBO afluente So, mg/L So - S 0,0 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (días) Figura 21: Sustrato en el sistema Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. La Figura 21 representa los valores de la DBO en el afluente y en el efluente, cuyos valores se encuentran dentro de los rangos 128,9 – 198 mg/L y 0,18 – 7,8 mg/L, respectivamente, y además los valores de sustrato en el sistema que oscilan entre 125,7 y 197,8 mg/L. 90 4.3.4. Cálculos para la obtención de los coeficientes Y y Kd Tabla 27: Cálculos para la obtención de los coeficientes Y y Kd So - S Xθ mg SSV/L/día 1/θc 179,2 360,256 0,192 134,1 226,315 0,195 153,1 262,109 0,226 182,4 275,388 0,278 144,8 225,160 0,282 158,4 229,779 0,289 197,8 263,841 0,295 185,6 255,181 0,303 125,7 158,189 0,321 Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. (So-S)/(Xθ) 0,497 0,593 0,584 0,662 0,643 0,689 0,750 0,727 0,795 4.4. Obtención de la gráfica y determinación de coeficientes cinéticos 0,40 0,35 y = 0,4776x - 0,0506 0,30 0,25 0,20 1/θc 0,15 0,10 0,05 0,00 -0,10-0,050,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55 0,60 0,65 0,70 0,75 0,80 0,85 -0,05 -0,10 -0,15 So-S/Xθ Figura 22: Obtención de Y y Kd Fuente: Base de datos Planta Piloto, Hazen & Sawyer (2015) Elaborado por: Campoverde, Loayza, 2015. Mediante una regresión lineal se obtuvo los siguientes valores: 91 Tabla 28: Resultados de los Coeficientes cinéticos Coeficientes Cinéticos Y (producción de biomasa por consumo de sustrato) 0,4776 Kd (consumo de biomasa por respiración endógena) mg SSV⁄mg DBO 0,0506 d−1 Elaborado por: Campoverde, Loayza, 2015. Al comparar los valores obtenidos de las constantes cinéticas dentro del proceso de lodos activos con lo propuesto por Metcalf & Eddy se pudo ver que los valores de Y y kd se encuentran dentro del rango establecido, indicando que hay una buena producción de biomasa (0,4776 mg SSV/mg DBO) como consecuencia de la declinación endógena (0,0506 d-1). 4.5. Cálculo de la producción de biomasa 𝑷𝒙 = 𝑷𝒙 = 𝑄𝑌(𝑆0 − 𝑆) 1 + 𝑘𝑑 𝜃𝑐 9000 𝐿⁄𝑑í𝑎 ∗ 0,4776 𝑑í𝑎−1 ∗ (187 − 7,8) 𝑚𝑔⁄𝐿 ∗ 10−6 1 + 0,0506 ∗ 5,21 𝑑í𝑎 𝑷𝒙 = 𝟎, 𝟔𝟏 𝑲𝒈 𝑺𝑺𝑽⁄𝒅í𝒂 Los datos empleados en este cálculo corresponden a los de la Muestra N°1, A continuación se presenta los cálculos para la determinación de la producción de lodo en las nueve campañas de muestreo: Tabla 29: Resultados de Producción de Biomasa Nº 1 2 3 4 5 6 7 8 9 θc día 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Px Kg/día 0,610 0,458 0,538 0,663 0,528 0,579 0,726 0,684 0,467 0,726 0,458 0,584 Máximo Mínimo Promedio Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. 92 So - S 0,750 220,0 0,700 200,0 0,650 0,600 180,0 0,550 160,0 0,500 0,450 140,0 So-S (mg/L) Producción de Biomasa (Kg/día) Px Kg/día 0,400 120,0 0,350 0,300 100,0 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (días) Figura 23 Producción de Biomasa y Sustrato (DBO) en el sistema Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. En la Figura 23 se representa la producción de biomasa en función del TPRC y se la analiza con el valor de sustrato (DBO) en el sistema, indicando que cuando el sustrato es alto la producción de biomasa también lo es, debiéndose a la actividad microbiana en el consumo de sustrato. 4.6. Cálculo de requisito de oxígeno 𝑫𝑶 = 𝑫𝑶 = 𝑄(𝑆0 − 𝑆) − 1,42(𝑃𝑥 ) + 4,57(𝑁0 − 𝑁)𝑄 𝑓 9000 𝐿⁄𝑑í𝑎 ∗ (187 − 7,8) 𝑚𝑔⁄𝐿 ∗ 10−6 − 1,42(0,61 𝐾𝑔⁄𝑑í𝑎) + 4,57 ∗ (29 − 13) 𝑚𝑔⁄𝐿 0,68 ∗ 9000 𝐿⁄𝑑í𝑎 𝑫𝑶 = 𝟐, 𝟏𝟔𝟒 𝑲𝒈 𝑶𝟐 ⁄𝒅í𝒂 Los datos empleados en este cálculo corresponden a los de la Muestra N°1 A continuación se presenta los cálculos para la determinación del requisito de oxígeno en las nueve campañas de muestreo: 93 Tabla 30: Cálculos para determinar el requisito de oxígeno θc día 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 So - S Px Kg/día 0,610 0,458 0,538 0,663 0,528 0,579 0,726 0,684 0,467 NKT, mg/L Afluente 29,0 30,0 49,0 38,0 25,0 38,0 33,0 39,0 36,0 49 25 35,2 NKT, mg/L Efluente 13,0 3,8 14,0 9,5 7,0 9,4 9,5 9,7 7,2 14 3,8 9,2 179,2 134,1 153,1 182,4 144,8 158,4 197,8 185,6 125,7 Máximo Mínimo Promedio Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. 1 2 3 4 5 6 7 8 9 Requisito de oxígeno, Kg O2/día DO Kg O/día No-N 16,0 26,2 35,0 28,5 18,0 28,6 23,5 29,3 28,8 35,0 16,0 26,0 DO Kg O2~/día 2,164 2,203 2,702 2,644 1,907 2,450 2,554 2,691 2,186 2,702 1,907 2,389 No-N 3,000 40 35 2,500 30 2,000 25 1,500 20 15 1,000 No - N, mg/L Nº 10 0,500 5 0,000 0 5,207 5,136 4,418 3,594 3,548 3,462 3,388 3,296 3,119 Tiempo promedio de retención celular (TPRC), días Figura 24: Requisito de oxígeno Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. La Figura 24 representa los resultados de la cantidad de oxígeno requerido al día durante las nueve campañas de muestreo con TPRC diferente, teniendo como valores máximo y mínimo 2,702 y 1,907 Kg O2/día, respectivamente, y los resultados de NKT removidos en el proceso endichas campañas, lo que indica que existió nitrificación durante esta fase, el valor máximo de NKT removido fue de 35 mg/L, mientras que el valor mínimo fue de 16 mg/L. 94 4.7. Correlación entre el requisito de oxígeno y la producción de biomasa Tabla 31: Correlación entre el requisito de oxígeno y la producción de biomasa N° 1 2 3 4 5 6 7 8 9 Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. Px Kg/día 0.61 0.46 0.54 0.66 0.53 0.58 0.73 0.68 0.47 DO Kg O/día 2.164 2.203 2.702 2.644 1.907 2.450 2.554 2.691 2.186 Requisito de oxígeno (Kg O2/día) 3,0 -0,10 R² = 0,3519 2,5 2,0 1,5 1,0 0,5 0,0 0,00 0,10 0,20 0,30 0,40 0,50 0,60 0,70 Producción de Biomasa (Kg/día) Figura 25 Correlación entre el requisito de oxígeno y la producción de biomasa Fuente: Trabajo de investigación, 2015 Elaborado por: Campoverde, Loayza, 2015. Coeficiente de determinación: 𝑹𝟐 = 𝟎, 𝟑𝟓 Coeficiente de correlación: 2 𝑹 = √𝑅 2 2 𝑹 = √0,35 𝑹 = 𝟎, 𝟓𝟗 95 0,80 La Figura 25 representa la correlación que existe entre el requisito de oxígeno y la producción de biomasa, misma que presenta un coeficiente de 0,59 lo que indica que existe una relación lineal con pendiente positiva. 96 CAPÍTULO V 5. CONCLUSIONES Y RECOMENDACIONES 5.1. CONCLUSIONES En base a la experimentación realizada fue posible determinar los coeficientes cinéticos propios para el agua residual de la descarga del Batán, Y = 0,4776 mg SSV/mg DBO y Kd = 0,0506 día-1, las cuales presentan una buena producción de biomasa como consecuencia de la declinación endógena. Los parámetros que se midieron“in situ” durante las campañas de muestreo fueron pH, alcalinidad, oxígeno disuelto, temperatura, y caudal. Los valores medidos de pH se hallan dentro del rango de 7,19 - 7,58 tanto en el afluente como en el efluente, mientras que los valores de alcalinidad en el afluente fueron mayores a los del efluente, dichos valores estuvieron dentro los rangos 164 - 222 y 64 - 118 mg CaCO3/L, respectivamente. Los valores en los reactores aeróbicos de OD estuvieron dentro del rango de 1,9 – 3,5 mg/L, mientras que la temperatura oscilo entre 18 - 20 °C. El valor promedio del caudal en el afluente fue de 8996 L/día. Los datos reportados por los laboratorios Gruntec y L3C fueron ingresados en una hoja de cálculo del software Microsoft Excel 2013, y mediante la utilización de comandos ejecutables guardados en formato .txt, con el fin de tener un solo archivo de resultados por cada muestra recolectada, este procedimiento se lo efectuó semanalmente. El método para la determinación de coeficientes cinéticos empleado en esta investigación, se basó en el modelo de Lawrence & McCarty descrito en la literatura. El procedimiento recomendado involucra la operación de una planta piloto en diferentes tiempos de retención, por lo menos para cinco valores diferentes. El rechazo de datos se realizó mediante la estructuración de un esquema multicriterio o check list, de acuerdo al tipo y objeto de estudio que fue de tipo no probabilístico, de esta manera se obtuvo el cálculo final de los coeficientes cinéticos. 97 Los valores de producción de biomasa y requisito de oxígeno se obtuvieron una vez que se determinaron los coeficientes cinéticos Y (producción celular) y Kd (declinación endógena) para cada tiempo de retención celular, con un valor medio final de 0,584 Kg de SSV/día y 2,389 Kg O2/día, respectivamente. La nitrificación en el proceso fue un factor considerado para el cálculo de requisito de oxígeno; los valores de NKT en el afluente fluctuaron entre 25 - 49 mg/L, mientras que en el efluente entre 3,8 - 14 mg/L. El valor del coeficiente de correlación entre el requisito de oxígeno y la producción de biomasa fue de 0,59, es decir existe una relación lineal con pendiente positiva. Si bien este cálculo no está descrito en la literatura, se lo tomó en cuenta para apreciar la relación entre ambos parámetros. La estabilidad del proceso de tratamiento de aguas residuales depende de un buen control operacional para dar solución a los problemas que se pueden presentar, sin embargo a escala piloto existen limitaciones, debido a que existen varios factores que afectan al sistema, así: en base a las caracterizaciones efectuadas anteriormente al colector El Batán, la dilución de la materia orgánica debido a períodos eventuales de precipitaciones y/o descargas representativas de contaminantes industriales produce una alteración a los niveles de oxígeno disuelto en los tanques de aireación y a la carga de DBO que ingresa al sistema; la presencia de organismos filamentosos, ocasiona el hinchamiento del lodo y afecta a la sedimentación y por ende a la calidad del efluente. 98 5.2. RECOMENDACIONES Para la determinación de los coeficientes cinéticos, cuando el proceso de tratamiento presente períodos de inestabilidad no se debe incluir en el procesamiento de datos resultados de operación registrados en dichos períodos. En las alternativas de diseño, ubicación y esquemas de tratamiento en una planta piloto se debe considerar todas las condiciones climáticas a las que puede estar sometido el proyecto, de igual manera los retrasos en tiempos de ejecución por motivos externos. Debido a la importancia del oxígeno disuelto como parte del control operacional y del tratamiento al afluente en sí, es necesario efectuar todas las pruebas necesarias previo al inicio de las fases tanto al sistema de aireación (compresores de capacidad adecuada, diámetro y material de tubería, válvulas y rotámetros instalados, etc.,), mecanismo de difusión (tipo de difusores, tamaño de orificios y/o poros) y al sistema eléctrico regular y de emergencia. El almacenamiento de datos debe ser ordenado y continuo para que el procesamiento de los mismos sea eficaz y confiable. Tomar en cuenta todos los problemas presentes durante el período de toma de muestras para comprender resultados que pudieran afectar de manera directa en la investigación, por ejemplo la dilución de la materia orgánica a causa de precipitaciones, y así facilitar el descarte de dichos resultados que no aportan al tratamiento estadístico y al cálculo de parámetros. Verificar si los cálculos planteados tienen un sustento científico y si son importantes dentro de la investigación. El mantenimiento de las máquinas, equipos y sistema eléctrico en una planta piloto es vital para evitar períodos de inoperancia. Para evitar pérdidas ocasionales y/o imprevistas de biomasa “washouts” se recomienda: disponer de un sistema de reserva con recirculación continúa para evitar acumulación de lodo al fondo; no recircular un caudal superior al de ingreso y no extraer el lodo más rápido de lo que se reproduce. En un proceso de mezcla completa con recirculación no se debe confundir el tiempo de retención hidráulica con el tiempo de retención celular, ya que ambos son diferentes, Para que el tiempo de aclimatación (generación de biomasa) sea lo más corto posible, se debe optar por un alto flujo de agua de alimentación al proceso y un adecuado flujo de aire para satisfacer la producción de biomasa. 99 CAPÍTULO VI 6. BIBLIOGRAFÍA 1. Acuerdo Ministerial 061 Ministerio del Ambiente Sustituyese el Libro VI del Texto Unificado de Legislación Secundaria. Registro Oficial 316, (2015, 04 de mayo). Ministerio del Ambiente Ecuador. 2. APHA; AWWA; WPCF. (1989). Glossary Water and Wastewater Control Engineering. 3. APHA; AWWA; WPCF. (1989). Standard Methods for the examination of water and wastewater. AWWA: Estados Unidos. 4. Asociación Hazen & Sawyer – Pi Epsilon (2014). Informe de caracterización de aguas residuales. Quito: Ecuador. 5. Colin Cameron, A.; Windmeijer, Frank A.G.; Gramajo, H; Cane, DE; Khosla, C (1997). “An R-squared measure of goodness of fit for some common nonlinear regression models”. Journal of Econometrics. 6. Constitución de la República del Ecuador. Registro Oficial Nº 449, (2008, 20 de octubre). Asamblea Nacional Constituyente de Ecuador. 7. Davis, M. (2010). Water and Wastewater Engineering. McGraw-Hill: Estados Unidos. 8. Diario El Comercio (2012, 4 de julio) Cuatro ríos soportan la descarga de las aguas residuales de Quito. Actualidad Consultado el 30 de junio de 2014 en http://www.elcomercio.com.ec/actualidad/quito/cuatro-rios-soportan-descarga-de.htmL 9. Diario El Hoy, (2013, 11 de noviembre) Machángara: una planta limpiará el extremo sur. Noticias Ecuador. Consultado el 30 de junio de 2014 en http://www.hoy.com.ec/noticiasecuador/machangara-una-planta-limpiara-el-extremo-sur-594710.htmL 10. Dirección General de Investigación y Postgrado (2010). Instructivo para la elaboración de trabajos de Tesis de Grado. Material de apoyo. Universidad Central del Ecuador: Quito. 11. Eckenfelder, W. (2000). Industrial Water Pollution Control. McGraw-Hill: Estados Unidos. 100 12. Eckenfelder, W.W. & Ford, D.L. (1970). Water pollution control: experimental procedures for process design. The Pemberton Press:Austin. 13. Eckenfelder, W.W. (1970). Water Quality for Practicing Engineers. Barnes & Noble: New York. 14. Empresa Publica Metropolitana de Agua Potable y Saneamiento, (2013, 10 de diciembre) Programa de descontaminación de los rios de Quito. Datos Generales. Consultado el 30 de junio de 2014 en: 15. Goodman, B.L., Englande, A.J. (1972). A unified model of the activated sludge process. Paper presented at the XII AIDIS Congress: Paraguay. 16. Hazen & Sawyer (2014). Curso para Operadores de Plantas de Tratamiento de Aguas Residuales. Quito: Ecuador. 17. Hazen & Sawyer (2014). MT05-PTAR Análisis de Alternativa de Proceso de Tratamiento y Selección de la Alternativa Óptima. INP: Quito- Ecuador 18. Hazen & Sawyer (2014). Protocolo Básico Experimental: Operación y Monitoreo, Planta Metropolitana Piloto de Tratamiento de Aguas Residuales de Quito. Quito: Ecuador. 19. Himmelblau, D., Riggs, J. (2003). Basic Principles and Calculations in Chemical Engineering. Prentice Hall: Estados Unidos. http://aguaquito.gob.ec/RespaldoJoomLa/index.php?option=com_content&view=article&i d=102&Itemid=297 20. Lawrence, A.W. & McCarty P.L. (1970). Unified Basis for Biological Treatment Design and Operation. Journal of the Sanitary Engineering Division, Proc!- A.S.C.E. 21. Ley de Gestión Ambiental. Registro Oficial Suplemento 418, (2004, 10 de septiembre). H. Congreso Nacional. 22. Ley de Prevención y Control de la Contaminación Ambiental. Registro Oficial 418, (2004, 10 de septiembre). H. Congreso Nacional. 23. Ley Orgánica De Recursos Hídricos, Usos Y Aprovechamiento Del Agua. Registro Oficial No. 305, (2014, 06 de agosto). Asamblea Nacional Constituyente de Ecuador. 24. Lin, S. (2007). Water and Wastewater Calculations Manual.McGraw-Hill: Estados Unidos. 25. Liu, J.C., Lien, C.S. (2001). Pretreatment of bakery wastewater by coagulation-flocculation and dissolved air flotation. Water Sci. Technol. 26. Marais, C.R. & Ekama, C.A. (1975). The activated sludge process, part 1: Steady, State Behaviour. Department of Civil Engineering, University of Cape Town, Research Report No. W12: Cape Town, South Africa. 101 27. Metcalf & Eddy, (2004). Wastewater Engineering: Treatment and Reuse. McGraw-Hill: Estados Unidos. 28. Morales, Eduardo (2013). Estudio Experimental y Modelización de los Parámetros Biocinéticos en la Evaluación de un Reactor de Lodos Activos de una Planta de Tratamiento Alimentaria. Tesis de Grado. Universidad Politécnica del Litoral. Guayaquil 29. Ordoñez G, (2001). Apuntes de la química del agua, Facultad de Ingeniería. Universidad de Cuenca: Cuenca. 30. Orhon, D., Germirli, F., Karahan, O. (2009). Industrial Wastewater Treatment by Activated Sludge. IWA publishing: Londres. 31. Plan Nacional para el Buen Vivir 2013 – 201. Registro Oficial Suplemento 78, (2013,11 de septiembre). Secretaría Nacional de Planificación de Desarrollo. 32. Romero, J. (2008). Tratamiento de aguas residuales, Teoría y principios de diseño. Editorial Escuela Colombiana de Ingeniería: Colombia. 33. Sherrard, J.H. & Lawrence, A.W. (1973). Design and operation model of activated sludge. Journal of the Environmental Engineering Division, Proc_ASCE. 34. Spencer, P. (2005). The Biological Basis of Wastewater Treatment. Strathkelvin Instruments Ltd: Reino Unido. 35. Texto Unificado de Legislación Secundaria del Ministerio del Ambiente. Decreto Nº 3516, Registro Oficial Suplemento Nº 2. (2003, 31 de marzo). Ministerio del Ambiente Ecuador. 36. Texto unificado, Libro VI de la calidad ambiental, Anexo I [En línea], 2003, Ecuador: Ministerio del Ambiente, <http://web,ambiente,gob,ec> [2014, 10 de junio]. 37. Valdez, E. et al.. (2003). Ingeniería de los sistemas de tratamiento y disposición de aguas residuales. Fundación ICA: México D.F – México. 38. Villarreal, M. (1990). Assessment of Non-Linear Least Squares Estimation of Monod Kinetic Parameters from Batch Reactor Experiments, Tesis (Master of Engineering). McGill University: Montreal. 39. Water Pollution Control Federation. (1980). Clean water for today: what is wastewater treatment. WPCF: Washington. 40. WCPF. (1990). Operation of municipal wastewater treatment plants. Manual of practice O/M 11, Volume 2. 41. Yim, B. et al.. (1975). Bakery Waste: Its Characteristics and Treatability. Part II, Indust, Wastes. 102 103 GLOSARIO Aeróbico: Presencia de oxígeno libre (elemental). Agua residual: El agua usada previamente por una ciudad o comunidad. Desde el punto de vista de fuente, puede definirse como la combinación del líquido y desechos acarreados desde residencias, edificios comerciales, plantas industriales e instituciones junto con cualquier agua subterránea, agua superficial y agua de lluvia que pueda estar presente. Aireación por aire difuso: Aireación producida en un líquido por aire a través de un difusor. Aireación: Efecto provocado del contacto íntimo entre el aire y un líquido por uno o más de los métodos siguientes: (a) esparcir el líquido en el aire, (b) burbujear aire a través del líquido, (c) agitar el líquido para promover la absorción superficial de aire. Amoniaco: Combinación química de hidrógeno (H) y nitrógeno (N) que ocurre ampliamente en la naturaleza. La combinación se utiliza en el agua y las aguas residuales de ingeniería se expresan como NH3. Análisis químico: Análisis por métodos químicos para mostrar la composición y concentración de sustancias Bacterias aeróbicas: Bacterias que crecen sólo en presencia de oxígeno elemental. Bacterias: Grupo de distribución universal de organismos microscópicos rígidos, esencialmente unicelulares que carecen de clorofila. Las bacterias suelen aparecer como esferoide, de varilla similar, o entidades curvas, pero en ocasiones aparecen como hojas, cadenas o filamentos ramificados. Las bacterias son generalmente consideradas como plantas. Bypass (válvula): Válvula piloto pequeña usada en conexión con una válvula más grande para equilibrar la presión en ambos lados antes de que la vavlvula de mayor tamaño sea abierta. Calibración: Determinación, chequeos o rectificación de la graduación de cualquier instrumento que de la medida de cantidad haciendo observación para establecer la relación entre dos cantidades. Canal: Canal abierto artificial o por vías construidas para uno o más de los siguientes propósitos: (a) transporte de agua, (b) conectar dos o más cuerpos de agua, y (c) que sirve como canal para embarcaciones. Clarificación: Cualquier proceso o combinaciones de procesos cuyo propósito primordial es reducir la concentración de material suspendido en un líquido. 104 Clarificador: Unidad en la cual el propósito primordial es asegurar la clarificación. Usualmente aplicado a los tanques de sedimentación. Coeficiente: Cantidad numérica determinada por métodos analíticos o experimentales interpuesta en una fórmula que expresa la relación entre dos o más variables para incluir el efecto de las condiciones especiales o para corregir una relación teórica a alguna encontrada por experimentación o practica actual. Demanda bioquímica de oxigeno (DBO): Se refiere a la cantidad de oxígeno utilizado en la bioquímica de la materia orgánica en un tiempo determinado, a la temperatura específicas y bajo condiciones específicas. Una prueba estándar utilizado en la evaluación de la fuerza de las aguas residuales. Demanda química de oxigeno (DQO): Medida de la capacidad de consumo de oxigeno de material orgánico e inorgánico presente en el agua o agua residual. Es expresado como la cantidad de oxigeno consumido por un oxidante químico en una ensayo especifico. No diferencia entre materia orgánica estable o inestable and no necesariamente correlaciona con la demanda bioquímica de oxígeno. Difusor: Plato o tubo poroso, o cualquier otro dispositivo donde el aire es forzado y dividido en minúsculas burbujas para difusión en líquidos. Comúnmente fabricados de material de carbonato o plástico Efluente clarificado: Efluente del cual la mayoría de los sólidos sedimentables han sido removidos por medio de sedimentación. Floc biológicamente activo: Formado por la acción de los organismos biológicos; por ejemplo, lodo activado. Licor mezclado: Mezcla de lodo activado y materia orgánica sometida a tratamiento por lodos activados en el tanque aireación. Lodos activados: Tratamiento biológico de agua residual en el cual una mezcla de agua residual y lodo activado es agitado y aireado. El lodo activado es posteriormente separado del agua residual tratada (licor mezclado) por sedimentación y descartada o recirculada al proceso de ser necesario. Muestra compuesta: Combinación de muestras individuales de agua o agua residual tomadas a intervalos predeterminados a fin de minimizar los efectos de variabilidad de la muestra individual. La función de las muestras compuestas es la de minimizar el efecto de las variaciones puntuales de la concentración de los elementos que se están analizando. Generalmente son recogidas en el mismo sitio. 105 Muestra simple: Es una muestra recogida en un tiempo y lugar específicos, y puede representar la composición de la fuente sólo en este tiempo y lugar. No obstante, pueden existir casos en los que la composición no cambie y en este caso una muestra simple tomada al azar es representativa Muestreador automático: Equipo utilizado con o sin medición de caudal para obtener una porción alícuota de agua o agua residual para propósitos analíticos, puede ser diseñado para tomar muestras simples, compuestas, muestreo permanente o periódico. Nitrificación: (1) la conversión de materia nitrogenada en nitratos por acción de las bacterias (2) el tratamiento de un material con ácido nítrico. Nitrobacteria: Bacteria que por medio de oxidación convierte nitrito a nitrato. Nitrógeno amoniacal: Es el resultado de la primera transformación del nitrógeno orgánico. Esta forma del nitrógeno es soluble en agua y queda retenido por el poder absorbente del suelo. Es una forma transitoria, que se transforma en nitrógeno nítrico. Nitrógeno Kjedahl total: El nitrógeno total Kjeldahl es un indicador utilizado en ingeniería ambiental. Refleja la cantidad total de nitrógeno en el agua analizada, suma del nitrógeno orgánico en sus diversas formas (proteínas y ácidos nucleicos en diversos estados de degradación, urea, aminas, etc.) y el ion amonio NH4+. También se utiliza para determinar proteínas en alimentos. Nitrosomonas: Género de bacteria que convierte por medio de oxidación amonio a nitrito. Oxidación biológica: Proceso mediante el cual los organismos vivos en presencia de oxígeno convierten la materia orgánica contenida en las aguas residuales en un componente más estable o forma mineral. Proceso biológico: (1) El proceso por el cual las actividades de la vida de las bacterias y otros microorganismos, en la búsqueda de alimentos, se descomponen los materiales orgánicos complejos en sustancias simples y más estables. Autodepuración de ríos contaminados, la digestión de lodos, y todos los llamados tratamientos de aguas residuales secundarios resultan de este proceso. (2) Proceso que involucra organismos vivos y sus actividades de la vida. También se llama proceso bioquímico. Respiración endógena: Supone la oxidación de la materia celular con objeto de proporcionar energía para el mantenimiento de los microorganismos cuando la fuente externa de materia orgánica (sustrato) ha sido consumida. Tanque de aireación: Tanque en el que los lodos, aguas residuales, u otro líquido se airean. Tiempo de aireación: Período teórico, generalmente expresada en horas, en el cual se mezcla el licor; se somete a aireación en un tanque de aireación mientras se somete a tratamiento de lodos 106 activados. Es igual al volumen del tanque dividido por la tasa volumétrica de flujo de los lodos de aguas residuales y de retorno. (2) El tiempo teórico durante el cual el agua se somete a aireación. Zona de aireación: La zona de aireación comprende el área donde el agua sometida a aireación se encuentra. 107 ANEXOS ANEXO A: Protocolo para toma y entrega de muestras de la planta piloto. PROTOCOLO PARA TOMA Y ENTREGA DE MUESTRAS DE AGUA DE LA PLANTA PILOTO 1. APLICACIÓN Este protocolo será aplicado durante todas las fases de experimentación (Fases Inicial, Primera, Segunda y Tercera) para la toma de muestras. La frecuencia de aplicación estará determinada por el programa de muestreo establecido para cada fase. A excepción de la frecuencia del muestreo establecida según la fase en ejecución, el protocolo a seguir para la toma y entrega de muestras de la Planta Piloto es el mismo en todas las fases y se desarrolla de acuerdo a los siguientes lineamientos. 2. GLOSARIO Muestra simple: Se denomina a una muestra simple aquella que representa solamente las características del agua residual para el instante de muestreo, es decir 1 solo punto de muestreo a un determinado tiempo. Muestra compuesta: Se denomina a una muestra compuesta aquella que representa las características del agua residual para conocer un resultado promedio. Puede considerarse un conjunto de muestras simples tomadas en un mismo punto durante un lapso de tiempo. Responsable: Se denomina responsable a aquella/s persona/s encargada/s de una actividad o tarea durante la toma y entrega de muestras de agua de la planta piloto. 3. RESPONSABLES Los responsables de aplicar el presente protocolo serán Operadores: Serán encargados de ejecutar las actividades de muestreo y seguir las normas especificadas en el presente protocolo. Director de la planta piloto: Será encargado de supervisar la ejecución del cumplimiento del presente protocolo. Personal de apoyo: Serán encargados de ejecutar las actividades de soporte para el muestreo (Programación de muestreadores automáticos), y seguir las normas especificadas en el presente protocolo. 4. NORMAS GENERALES Durante la ejecución del muestreo no se podrá recibir visitas externas de ninguna institución, a excepción del personal colaborador de muestreo del PSA. El muestreo sólo podrá ser efectuado por el personal de operación de la Planta Piloto. El personal que efectúe el muestreo sólo podrá hacerlo haciendo uso del respectivo equipo de protección personal, esto es: mandil, mascarilla y guantes. Los equipos muestreadores instalados (ISCO6712-1, ISCO6712-2 e ISCO6712-3) sólo serán programados y manejados por el personal colaborador del muestreo del PSA. El material y equipo de la Planta Piloto, así como las pruebas y ensayos que se realicen con éstos, sólo la puede realizar el personal de operación de la planta. De ser necesario efectuar una prueba in situ, la institución solicitante comunicará y solicitará el permiso respectivo al encargado de la Planta Piloto. 5. CONSIDERACIONES SOBRE LA TOMA Y CONSERVACIÓN DE MUESTRA La muestra deberá ser almacenada en recipientes que aseguren el volumen y preservación de la misma. Independientemente del laboratorio destino, la/s muestra/s deberán ser claramente etiquetadas conteniendo la información necesaria para su procesamiento. Se muestra a continuación los membretes utilizados tanto por el laboratorio Gruentec como por el L3C. Las muestras son enviadas a los laboratorios en coolers (con ICE PACKS incluidos) siguiendo la cadena de frío. 6. EQUIPOS Y MATERIALES 6.1. Equipos 6.2. 3 muestreadores automáticos marca ISCO proporcionados por el PSA. 1 congelador Materiales - 3 baldes plásticos - Probetas de 1000ml, 500ml y 250ml - Jarras plásticas graduadas de 250ml y 500ml - Botellas plásticas proporcionadas por el L3C (2L) - Envases plásticos 250ml - Envases plásticos proporcionados por Gruentec de 1L y 125ml - Membretes adhesivos - Icepacks 7. PROCEDIMIENTO DE TOMA DE MUESTRAS 1. Preparar el área de llenado de muestras con el material necesario (probetas, envases etiquetados, coolers, etc.). El cooler deberá contener los icepacks antes del inicio de la toma de la muestra. 2. Destapar los muestreadores (previamente programados por el PSA). Sacar el botellón que contiene el volumen total del agua residual a ser muestreada, la cual debe estar preservada por el uso de icepacks. Esta tarea es efectuada por personal del PSA ayudado, de ser el caso, por un operador de la planta piloto. La validez de las muestras se detalla ampliamente en la sección 6.2 Protocolo Específico de Muestreo y Análisis y Hoja de Ruta de Muestreo del Protocolo Experimental de la Planta Piloto. 3. Verter el contenido del botellón proveniente de cada muestreador ISCO en cada uno de los baldes plásticos previamente asignados y rotulados de acuerdo al muestreador que corresponda. 4. Colocar los icepacks extraídos del muestreador a congelación. Dependiendo la frecuencia del muestreo (diaria, semanal, quincenal, etc) de la fase en ejecución, se colocarán nuevos icepacks congelados en el muestreador de manera que la calidad de la muestra no se vea afectada. 5. Homogenizar los envases a llenarse con una pequeña cantidad del agua objeto del muestreo. Los frascos estériles no se enjuagan, y se procede al muestreo directo. 6. Llenar los envases con la muestra respectiva de acuerdo al requerimiento volumétrico de cada laboratorio (Grüentec / L3C). A continuación se detalla el volumen requerido por cada laboratorio en relación con el tipo de desecho y/o los parámetros a analizarse correspondientes a la Fase Inicial. TABLA N° 7.1 REQUERIMIENTOS VOLUMÉTRICOS DE ACUERDO AL PUNTO DE MUESTREO1 Efluente primario Lodo primario 2L 250ml Reactor 1 250ml Reactor 2 250ml 1 Total Total Borde libre Borde libre Borde libre C S S S Envase homogenizado Envase homogenizado Envase homogenizado Envase homogenizado 1L. Total C 125ml Borde libre C 1L Total C Consideración especial Tipo de muestra Volumen llenado C Envase homogenizado GRUENTEC Volumen del envase Consideración especial 2L Tipo de muestra Crudo Volumen llenado Tipo de Desecho / Punto de Muestreo Volumen del envase L3C Envase homogenizado Envase NO homogenizado Envase homogenizado - - - - - - - - - - - - Existen dos tipos de muestras: las Compuestas (C), que son tomadas con alícuotas horarias con la ayuda de los equipos muestreadores instalados para el desecho crudo, efluente primario y final; y las Puntuales o Simples (S) provenientes de los reactores internos y lodos. Efluente final 2L Total C Envase homogenizado Consideración especial Envase homogenizado Tipo de muestra S Volumen llenado Consideración especial Borde libre Tipo de muestra 250ml GRUENTEC Volumen del envase Reactor 3 Volumen llenado Tipo de Desecho / Punto de Muestreo Volumen del envase L3C - - - - 1L Total C 125ml Borde libre C Envase homogenizado Envase NO homogenizado Lodo secundario Lodo en exceso Elaborado por: HAZEN & SAWYER 7. Limpiar los excedentes de agua residual con una toalla papel, una vez que ha sido cerrado el frasco. 8. Llenar la etiqueta del envase con marcador permanente para las etiquetas del L3C y con lápiz para las etiquetas de Gruentec. 9. Colocar las muestras conjuntamente con los icepacks en los coolers respectivos. 10. Limpiar el área de muestreo y los materiales utilizados. 11. Disponer los guantes y mascarillas utilizadas en el recipiente de desechos peligrosos. 12. Llenar la cadena de custodia tanto para el laboratorio L3C como para el laboratorio Gruentec de acuerdo al formato que corresponda. Las cadenas de custodia de cada laboratorio se encuentran en el Anexo N°1 y Anexo N°2. Éstas deben ser llenadas y firmadas con la fecha y hora de salida de las muestras de la Planta Piloto hacia los laboratorios. Archivar una copia de las cadenas de custodia. 13. Transportar los coolers con las muestras inmediatamente después de finalizado el muestreo, hacia los laboratorios respectivos. 14. Informar al encargado de la Planta, de la culminación del muestreo y las novedades suscitadas. 15. Registrar en la bitácora las novedades del muestreo. ANEXO No. 1 CADENA DE CUSTUDIA Y REQUERIMIENTO DE ANÁLISIS L3C CRUDO E.PRIMARIO E.FINAL L.PRIMARIO REACTOR1 REACTOR2 REACTOR3 Tipo de envases: C C C C S S S Plastico ( X ) Vidrio ( ) REGISTRO DE CUSTODIA Enviado por: (Firma) Fecha/Hora Recicibido por: (Firma) Fecha/Hora Observaciones: 13/11/2014 Tipo de desecho: Crudo ( C ); Efluente prim ario (Ep); Efluente final (Ef); Reactor ( R ); Lodo prim ario (Lp); Lodo en exceso (Le); Lodo secundario (Ls) HELMINTOS Fósforo total Orthofosfato (PO4-P) Nitratos solubles Nitritos solubles Kjeldahl soluble (NKS) Volumen Kjeldahl total (NKT) No. envases/ muestra N amoniacal soluble (NH3-N) Identificación de la muestra Sólidos totales volátiles (STV) Tipo de muestra Sólidos Totales (ST) Hora de entrega DBO soluble Tipo de Desecho DQO soluble No. DQO total CORREO: [email protected] DBO total TELEFONO: DQO floculado y filtrado CONTACTO: Leila Palacios SST para SVI FIRMA: Sólidos en suspensión volátiles RESPONSABLE DE ENTREGA: Dr. Fabián Yánez Sólidos en suspensión totales FORMULARIO DE CADENA DE CUSTODIA Y REQUERIMIENTO DE ANÁLISIS LABORATORIO DESTINO: L3C Requerimiento de Análisis FECHA: ANEXO No. 2 CADENA DE CUSTUDIA Y REQUERIMIENTO DE ANÁLISIS GRUENTEC ANEXO B: Cronograma de actividades JUNIO MAYO ABRIL MARZO FEBRERO ENERO DICIEMBRE NOVIEMBRE OCTUBRE SEPTIEMBRE AGOSTO JULIO Actividad JUNIO Orden CRONOGRAMA DE ACTIVIDADES 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Obtención de la documentación universitaria requerida Determinación del tema Reuniones con los especialistas de la Asociación Hazen & Sawyer Elaboración del Plan de Tesis Aprobación del Plan de Tesis Capacitación por parte de la Asociación Hazen & Sawyer Capacitación en el laboratorio Gruentec Finalización de obras de infraestructura de Planta Piloto Pruebas iniciales: Perfil hidráulico, Nivel de tanques, fugas, ensayos previos al arranque,etc. Operación de la Planta Piloto de lodos activados para descarga del Batán Toma de muestras para análisis de laboratorio Procesamiento de información obtenida Análisis e interpretación de datos Determinación de coeficientes cinéticos Discusión y conclusiones Revisión y aprobación Presentación trabajo escrito Aprobación del trabajo por parte del Tribunal Defensa de grado oral ANEXO C Presupuesto RUBRO CANTIDAD UNIDAD VALOR UNITARIO (USD) RUBROS ADMINISTRATIVOS Derechos de Tutor y Tribunal 2 Unidades 400 Derechos por Notas 2 Semestres 5 Derecho de Capa 2 Unidades 150 Certificado de Biblioteca 2 Unidades 2 Certificado de Bodega 2 Unidades 30 Papel Universitario 20 Unidades 1 USD SUBTOTAL 1 MATERIALES Y SUMINISTROS Impresiones 1000 Unidades 0.05 Empastado 6 Unidades 10 CD 6 Unidades 2 USD SUBTOTAL 2 SERVICIOS GENERALES Alimentación 11 Meses 50 Internet y teléfono 11 Meses 30 Transporte 11 Meses 20 USD SUBTOTAL 3 Imprevistos USD TOTAL USD VALOR TOTAL (USD) 800 10 300 4 60 20 1194 50 60 12 122 550 330 220 1100 200 2616 ANEXO D Resultados Fase 1 FECHA Unidad Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra 15 16 17 18 19 20 21 22 23 24 Muestra 25 05/01/2015 06/01/2015 07/01/2015 08/01/2015 09/01/2015 10/01/2015 11/01/2015 12/01/2015 13/01/2015 14/01/2015 15/01/2015 DESECHO CRUDO DQO total mg/l 776,3 511,2 415,9 404,8 451,1 429,7 401,5 383,2 508,2 647,65 441,4 DQO soluble mg/l 270,2 186,2 277,4 269,7 373,8 248,3 321,4 178,5 362 413,45 330,1 DBO total mg/l 280,4 216,6 131 130,5 208,3 148,5 150,6 104,7 130,86 183,4 183,7 DBO soluble mg/l 80,7 75,5 76 107 89,2 62,73 98 62,1 65,58 119,6 88,1 Sólidos en suspensión totales mg/l 380 260 148 122 128 134 126 122 120 198 146 Sólidos en suspensión volátiles mg/l 300 204 132 116 122 132 120 110 106 160 136 DQO total mg/l 434,8 339 446,7 470 529,1 267,4 366,2 408,2 611,2 661,05 619,7 DQO soluble mg/l 188,5 181,6 238 315 396,4 255,4 263,6 138,7 353,3 386,5 341,8 DBO total mg/l 187 172 139,6 166,1 193,1 170 155 145 158,91 203,3 209,2 DBO soluble mg/l 49,7 65,1 69 114,9 87 72,2 86 67,4 84,61 198,3 75,8 Sólidos en suspensión totales mg/l 176 132 162 148 150 174 162 144 220 246 228 Sólidos en suspensión volátiles mg/l 156 128 144 134 132 160 148 130 168 186 196 DQO total mg/l 98,5 83,9 129,4 152,9 245,3 147,6 128,8 99,9 284,7 310,8 299,9 DQO soluble mg/l 35,8 34,2 24,3 124,5 55 86,7 35,4 32,9 208 206,5 198,6 DBO total mg/l 39,4 49 43,5 63,6 83,8 33,6 53,5 37,7 67,98 83,9 88,5 DBO soluble mg/l 7,8 3,4 5,8 37,6 9,6 8,4 9,4 13,3 35,49 75,5 28,1 Sólidos en suspensión totales mg/l 54 46 30 42 38 52 102 52 76 112 88 Sólidos en suspensión volátiles mg/l 54 44 30 42 38 50 66 52 76 88 88 Sólidos en suspensión totales mg/l 3280 3040 2900 2760 2660 2900 2720 2520 2260 2180 1660 Sólidos en suspensión volátiles mg/l 2540 2420 2380 2380 2300 2580 2320 2200 1880 1820 1520 Sólidos en suspensión totales mg/l 2600 2420 2200 2220 2160 2300 2000 2060 1540 1760 1440 Sólidos en suspensión volátiles mg/l 2040 1920 1840 1880 1920 2100 1820 1740 1340 1440 1280 Sólidos en suspensión totales mg/l 1980 2060 1720 1800 1720 1900 1660 1640 1520 1400 1200 Sólidos en suspensión volátiles mg/l 1660 1600 1480 1600 1560 1780 1520 1460 1340 1200 1160 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 375,1 457,25 454,6 486,97 436,39 438,94 439,59 438,71 439,82 439,59 437,17 Sólidos en suspensión totales mg/l 1980 2060 1720 1800 1720 1900 1660 1640 1520 1520 1200 Sólidos en suspensión volátiles mg/l 1660 1600 1480 1600 1560 1780 1520 1460 1340 1340 1160 FECHA Unidad Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra 26 27 28 29 30 31 32 33 34 35 Muestra 36 16/01/2015 17/01/2015 18/01/2015 19/01/2015 20/01/2015 21/01/2015 22/01/2015 23/01/2015 24/01/2015 25/01/2015 26/01/2015 DESECHO CRUDO DQO total mg/l 644,1 819,1 609,3 425,7 486,2 759,9 510,2 454,2 572,9 645,4 403,6 DQO soluble mg/l 389,8 312 333,8 249,9 353,7 464,8 270,8 267 252,8 446,3 287,1 DBO total mg/l 204,5 219,1 199,5 104,3 151,9 254,6 156,4 184 182,6 184 118,6 DBO soluble mg/l 112,05 76,6 86,4 43,9 62,1 148,7 55,5 40,6 43 43,1 37,3 Sólidos en suspensión totales mg/l 184 286 134 124 120 192 116 120 244 124 122 Sólidos en suspensión volátiles mg/l 170 234 128 110 104 144 116 120 174 120 116 DQO total mg/l 734,7 668 709,3 478,5 541,8 810 531,8 500,9 670,5 660,4 517,9 DQO soluble mg/l 401,5 289,7 367,9 223,7 311,9 452,1 284,9 258,9 216,3 365,9 257,2 DBO total mg/l 238,8 176,2 215,4 129,2 178,9 274,4 156,9 167,8 212,9 212,9 114,6 DBO soluble mg/l 127,22 60,3 105,3 31,6 46,4 118,7 55,6 43,5 34,6 31,6 30 Sólidos en suspensión totales mg/l 260 218 172 168 118 220 120 148 286 182 160 Sólidos en suspensión volátiles mg/l 218 190 158 140 104 154 120 148 202 154 140 DQO total mg/l 303,8 242,4 257,8 237,9 283,5 343 278,3 284,6 281 367,3 343,8 DQO soluble mg/l 200 189,3 179,6 172,5 198,2 180 196,9 181 180 305,6 216,6 DBO total mg/l 103,3 73,2 63,2 58,6 103,5 66,9 66,4 78,3 81,5 81,5 83,4 DBO soluble mg/l 34,37 27,8 23,1 4,3 6,2 4,3 3,8 4,2 5,4 5,1 0 Sólidos en suspensión totales mg/l 84 58 48 50 84 60 60 80 86 78 102 Sólidos en suspensión volátiles mg/l 84 58 48 50 80 60 60 80 82 78 98 Sólidos en suspensión totales mg/l 1900 2120 2340 1760 1900 2260 1980 1480 1290 1280 960 Sólidos en suspensión volátiles mg/l 1780 1880 2100 1580 1640 1920 1840 1360 1140 1100 830 Sólidos en suspensión totales mg/l 1580 1720 1960 1660 1480 1760 1560 1140 1070 1100 780 Sólidos en suspensión volátiles mg/l 1520 1600 1720 1460 1360 1540 1460 1060 990 970 710 Sólidos en suspensión totales mg/l 1300 1440 1660 1760 1200 1420 1280 1040 830 870 660 Sólidos en suspensión volátiles mg/l 1300 1340 1560 1540 1120 1320 1240 980 820 780 630 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 436,51 433,59 430,54 416,43 436,29 429 430,56 426,58 430,1 429,22 428,56 Sólidos en suspensión totales mg/l 1300 1440 1660 1760 1200 1420 1280 1040 830 870 660 Sólidos en suspensión volátiles mg/l 1300 1340 1560 1540 1120 1320 1240 980 820 780 630 FECHA Unidad Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra 37 38 39 40 41 42 43 44 45 46 Muestra 47 27/01/2015 28/01/2015 30/01/2015 31/01/2015 01/02/2015 02/02/2015 03/02/2015 04/02/2015 05/02/2015 06/02/2015 08/02/2015 DESECHO CRUDO DQO total mg/l 501,5 550,9 644,1 628,1 565,1 523,1 720,2 613,3 635,8 569,9 315,2 DQO soluble mg/l 238,7 148,1 186,1 128,4 212,3 149,7 409,8 287 185,7 119,7 191,9 DBO total mg/l 149,2 150,8 198,9 229,7 211,9 167 120,6 142,7 215,4 216,6 150,5 DBO soluble mg/l 53,1 48,4 69,8 59,2 58,4 37,2 56,3 50,7 72 46,4 38,4 Sólidos en suspensión totales mg/l 154 198 234 204 234 216 118 174 184 188 110 Sólidos en suspensión volátiles mg/l 134 162 206 168 168 174 110 154 166 164 92 DQO total mg/l 553,5 711 600,4 567,8 681,5 621,7 799,2 696,1 647,4 706,1 437,4 DQO soluble mg/l 188,5 189,8 153,7 213,9 161,5 156,3 414,8 293,3 148,1 271,4 185 DBO total mg/l 173,7 168,9 183,1 136,3 256,4 159,3 161,8 144,4 270,3 259,5 166,2 DBO soluble mg/l 56,8 48,2 67,1 55,9 61,4 35,6 37 50,8 67 62,4 62,4 Sólidos en suspensión totales mg/l 224 244 276 242 322 258 196 216 246 204 178 Sólidos en suspensión volátiles mg/l 174 192 226 206 204 196 176 174 208 174 136 DQO total mg/l 148,5 185,6 225,4 76,9 145,4 215,6 426,8 217,8 154,8 327,8 327,8 DQO soluble mg/l 20,8 99,8 64,4 37,2 64,9 199,1 345,2 170,1 117,4 106,4 106,4 DBO total mg/l 74,1 39 98,9 27,7 49,1 65,8 48,5 26,4 36,8 28,7 101,4 DBO soluble mg/l 3,1 1 0,5 2,2 5,3 0,5 13,8 0,7 3,8 5 10,8 Sólidos en suspensión totales mg/l 46 24 86 14 33 50 56 38 30 20 116 Sólidos en suspensión volátiles mg/l 46 24 86 14 31 50 56 38 28 20 108 Sólidos en suspensión totales mg/l 1630 1910 2270 2050 2620 2310 2010 2240 2500 2500 1000 Sólidos en suspensión volátiles mg/l 1320 1570 1900 1720 2000 1810 1660 1740 2090 2200 840 Sólidos en suspensión totales mg/l 1300 1560 1690 1370 1960 1720 1460 1690 1890 1840 490 Sólidos en suspensión volátiles mg/l 1060 1280 1460 1190 1530 1390 1280 1330 1590 1620 460 Sólidos en suspensión totales mg/l 1120 1280 1330 1130 1490 1370 1370 1380 1480 1460 380 Sólidos en suspensión volátiles mg/l 940 1120 1140 1010 1180 1110 1110 1090 1280 1360 370 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 430,04 424,15 385,81 392,65 ND 648,11 615,91 628,42 626,94 621,42 605,76 Sólidos en suspensión totales mg/l 1120 1280 1330 1130 1490 1370 1370 1380 1480 1460 380 Sólidos en suspensión volátiles mg/l 940 1120 1140 1010 1180 1110 1110 1090 1280 1360 370 FECHA Unidad Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra 48 49 50 51 52 53 54 55 56 Muestra 57 09/02/2015 18/02/2015 19/02/2015 20/02/2015 21/02/2015 22/02/2015 23/02/2015 24/02/2015 25/02/2015 26/02/2015 DESECHO CRUDO DQO total mg/l 426,5 288,7 533,6 312,9 331,8 475,8 366,7 389,3 348,1 361,9 DQO soluble mg/l 179,1 79,5 140,2 120,3 105,8 182 150,1 98,2 118,9 117,7 DBO total mg/l 99,2 151,2 264,8 80,2 145,2 265,9 163,2 133,3 125,8 153,8 DBO soluble mg/l 23,1 34,6 61,3 28,1 47,4 82,8 45,9 43,6 48,3 49 Sólidos en suspensión totales mg/l 142 176 252 90 90 148 154 176 98 120 Sólidos en suspensión volátiles mg/l 142 144 210 80 90 148 138 142 92 118 DQO total mg/l 446,1 331,3 371,4 228,8 396,1 456,8 537,2 320,6 358 453,2 DQO soluble mg/l 293,3 73 122,3 135,1 118,3 129,2 133,2 107,7 117,3 112,7 DBO total mg/l 104,3 178,5 157,8 63,2 182,7 241 146,4 119,8 128,9 245 DBO soluble mg/l 19,8 31 50,2 13,2 53,5 57,9 51,3 43,6 54,7 47,7 Sólidos en suspensión totales mg/l 220 194 124 66 148 182 158 140 94 150 Sólidos en suspensión volátiles mg/l 210 150 122 66 132 176 142 120 90 134 DQO total mg/l 148,1 31,3 79 105,9 56,9 48 189 58,8 91 108,4 DQO soluble mg/l 142,2 27,7 48,7 62,6 45,8 47,2 125,9 51,1 66,5 47,1 DBO total mg/l 45,2 22,1 26,8 23,4 28,2 28,9 12,8 23,3 39,8 33,1 DBO soluble mg/l 21,3 2,7 1,1 0,7 2,3 6,9 1,6 1,7 3,2 2,1 Sólidos en suspensión totales mg/l 76 15 20 36 6 6 26 6 18 14 Sólidos en suspensión volátiles mg/l 76 15 20 36 6 6 26 4 18 14 Sólidos en suspensión totales mg/l 1270 1710 1820 1190 1360 1770 1890 1640 1250 1340 Sólidos en suspensión volátiles mg/l 1070 1360 1530 1000 1100 1590 1610 1430 1060 1200 Sólidos en suspensión totales mg/l 1020 1380 1440 950 1080 1340 1420 1380 1020 1090 Sólidos en suspensión volátiles mg/l 980 1130 1240 820 950 1250 1250 1170 880 970 Sólidos en suspensión totales mg/l 810 1150 1610 780 920 1120 1120 1090 920 870 Sólidos en suspensión volátiles mg/l 790 960 1390 720 810 1050 1040 960 800 800 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 626,94 620,05 617,9 619 608,19 584,39 549,24 567,32 570,62 571,13 Sólidos en suspensión totales mg/l 810 1150 1610 780 920 1120 1120 1090 920 870 Sólidos en suspensión volátiles mg/l 790 960 1390 720 810 1050 1040 960 800 800 FECHA Unidad Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra Muestra 58 59 60 61 62 63 64 65 66 67 68 Muestra 69 27/02/2015 28/02/2015 01/03/2015 02/03/2015 03/03/2015 04/03/2015 05/03/2015 06/03/2015 07/03/2015 08/03/2015 09/03/2015 10/03/2015 382 DESECHO CRUDO DQO total mg/l 337,6 386,8 367,3 356,7 315,2 374,1 334,4 261,3 328,3 366,4 313,6 DQO soluble mg/l 116 132,2 114,9 204,4 156,6 93,8 102,9 91,9 86,8 98,8 100,9 101 DBO total mg/l 157 119,4 180,9 215,8 158,4 174,9 162,2 136,5 169,5 171,3 159,5 146,1 DBO soluble mg/l 68,3 63,5 41,7 65,9 39,1 48,7 50,4 46,1 38,05 31,5 33 42,8 Sólidos en suspensión totales mg/l 114 138 148 162 148 164 138 80 104 136 112 122 Sólidos en suspensión volátiles mg/l 110 132 148 128 108 136 116 76 104 130 106 118 DQO total mg/l 398,9 448,5 381,7 323,2 325,6 422,3 323,5 384,1 413,4 419 412,4 439 DQO soluble mg/l 116,4 111 113,4 82,2 93,2 113,1 107,4 104,3 96,8 76,2 100,2 130,2 DBO total mg/l 189 72,9 175,6 134,5 169,3 184,2 160,9 200,2 213,9 198 183,5 188,8 DBO soluble mg/l 75,7 58,3 49 41,8 44,2 61,9 62,2 54,6 43,4 23,03 38,2 73,5 Sólidos en suspensión totales mg/l 146 132 152 130 162 206 118 176 204 218 202 190 Sólidos en suspensión volátiles mg/l 136 124 148 104 116 162 112 130 174 176 182 166 DQO total mg/l 52,8 290,9 64,4 40,8 122,4 42,8 92,4 44,6 92,2 35,7 68,4 80,4 DQO soluble mg/l 33,1 70,1 50 33,9 23,4 18,6 63,4 24,5 38,5 14,8 31,4 25,5 DBO total mg/l 28,8 25,5 32,8 26,1 21,3 25,6 22,1 32,3 61,3 23,4 31,8 25 DBO soluble mg/l 1,4 5,1 1,3 3,1 1,7 2 2,5 1 2,4 0,18 1,1 3,2 Sólidos en suspensión totales mg/l 14 22 19 22 24 34 4 16 32 22 42 22 Sólidos en suspensión volátiles mg/l 14 22 19 22 24 34 4 16 32 22 42 22 Sólidos en suspensión totales mg/l 1340 1560 1350 1720 1710 1660 2070 2300 2290 2410 2530 2250 Sólidos en suspensión volátiles mg/l 1200 1360 1260 1480 1380 1410 1670 1790 1860 1920 2100 1840 Sólidos en suspensión totales mg/l 1040 1220 1110 1300 1350 1270 1520 1670 1640 1690 1760 1710 Sólidos en suspensión volátiles mg/l 960 1100 1100 1150 1060 1080 1270 1320 1360 1430 1470 1380 Sólidos en suspensión totales mg/l 890 970 880 990 1080 1060 1180 1300 1330 1410 1450 1430 Sólidos en suspensión volátiles mg/l 820 930 880 910 880 910 1040 1050 1140 1220 1200 1200 EFLUENTE PRIMARIO EFLUENTE FINAL REACTOR 1 REACTOR 2 REACTOR 3 LODO DE EXCESO Volumen L 575,31 577,51 579,51 570,78 576,86 573,99 574,43 547,57 517,57 574,43 574,65 580,62 Sólidos en suspensión totales mg/l 890 970 880 990 1080 1060 1180 1300 1330 1410 1450 1430 Sólidos en suspensión volátiles mg/l 820 930 880 910 880 910 1040 1050 1140 1220 1200 1200 ANEXO E Programación de los comandos ejecutables Microsoft Excel 2013 (Visual Basic) Sub Inicializar() 'Programa desarrollado por el personal O&M de la Planta Piloto 'Limpiar registros Worksheets("Ingreso").Range("D3:D5").ClearContents Worksheets("Ingreso").Range("F3:F4").ClearContents Worksheets("Ingreso").Range("E8:O49").ClearContents Worksheets("Ingreso").Range("H3").ClearContents Range("D3").Activate End Sub Sub GuardarDatos() 'Programa desarrollado por el personal O&M de la Planta Piloto Dim TIT As String, Fecha As String, Tipo(11) As String, NM As Single, dia As Single, NMF As Single Dim DQO(11) As String, DQOs(11) As String, DQOfs(11) As String, DBO(11) As String, DBOs(11) As String, SST(11) As String, SSV(11) As String Dim NH3N(11) As String, NKT(11) As String, NKs(11) As String, NO2s(11) As String, NO3s(11) As String, PO4(11) As String, PT(11) As String Dim Alc(11) As String, Hel(11) As String Dim Q(11) As String, T(11) As String, TU(11) As String, pH(11) As String, OD(11) As String, VL1(11) As String, VL2(11) As String, VL3(11) As String Dim Vlp(11) As String, DQOlp(11) As String, SSTlp(11) As String, SSVlp(11) As String, IVLlp(11) As String, NKTlp(11) As String Dim NO2slp(11) As String, NO3slp(11) As String, Hellp(11) As String Dim Vle(11) As String, DQOle(11) As String, SSTle(11) As String, SSVle(11) As String, IVLle(11) As String, NKTle(11) As String Dim NO2sle(11) As String, NO3sle(11) As String, Helle(11) As String Dim WARCH As String, Filt As String, FilterIndex As Integer, Title As String, Filename As String ChDir "C:\Users\HazenAnd\Desktop\2015\PROCESAMIENTO DE DATOS PP\Captura y procesamiento de datos experimentales" 'Asignar valores Worksheets("Ingreso").Select Range("D3").Select: TIT = Range("D3") Range("F3").Select: NM = Range("F3") Range("D4").Select: Fecha = Range("D4") Range("F4").Select: dia = Range("F4") Range("H3").Select: NMF = Range("H3") For i = 1 To 11 Cells(7, i + 4).Select: Tipo(i) = Cells(7, i + 4) Cells(8, i + 4).Select: DQO(i) = Cells(8, i + 4) 'DQO Cells(9, i + 4).Select: DQOs(i) = Cells(9, i + 4) 'DQOs Cells(10, i + 4).Select: DQOfs(i) = Cells(10, i + 4) 'DQOfs Cells(11, i + 4).Select: DBO(i) = Cells(11, i + 4) 'DBO Cells(12, i + 4).Select: DBOs(i) = Cells(12, i + 4) 'DBOs Cells(13, i + 4).Select: SST(i) = Cells(13, i + 4) 'SST Cells(14, i + 4).Select: SSV(i) = Cells(14, i + 4) 'SSV Cells(15, i + 4).Select: NH3N(i) = Cells(15, i + 4) 'NH3Ns Cells(16, i + 4).Select: NKT(i) = Cells(16, i + 4) 'NKT Cells(17, i + 4).Select: NKs(i) = Cells(17, i + 4) 'NKs Cells(18, i + 4).Select: NO2s(i) = Cells(18, i + 4) 'NO2s Cells(19, i + 4).Select: NO3s(i) = Cells(19, i + 4) 'NO3s Cells(20, i + 4).Select: PO4(i) = Cells(20, i + 4) 'PO4 Cells(21, i + 4).Select: PT(i) = Cells(21, i + 4) 'PT Cells(22, i + 4).Select: Alc(i) = Cells(22, i + 4) 'Alc Cells(23, i + 4).Select: Hel(i) = Cells(23, i + 4) 'Hel Cells(24, i + 4).Select: Q(i) = Cells(24, i + 4) 'Q Cells(25, i + 4).Select: T(i) = Cells(25, i + 4) 'T Cells(26, i + 4).Select: TU(i) = Cells(26, i + 4) 'TU Cells(27, i + 4).Select: pH(i) = Cells(27, i + 4) 'PH Cells(28, i + 4).Select: OD(i) = Cells(28, i + 4) 'OD Cells(29, i + 4).Select: VL1(i) = Cells(29, i + 4) 'VL1 Cells(30, i + 4).Select: VL2(i) = Cells(30, i + 4) 'VL2 Cells(31, i + 4).Select: VL3(i) = Cells(31, i + 4) 'VL3 Cells(33, i + 4).Select: Vlp(i) = Cells(33, i + 4) 'Vlp Cells(34, i + 4).Select: DQOlp(i) = Cells(34, i + 4) 'DQOlp Cells(35, i + 4).Select: SSTlp(i) = Cells(35, i + 4) 'SSTlp Cells(36, i + 4).Select: SSVlp(i) = Cells(36, i + 4) 'SSVlp Cells(37, i + 4).Select: NKTlp(i) = Cells(37, i + 4) 'NKTlp Cells(38, i + 4).Select: NO2slp(i) = Cells(38, i + 4) 'NO2sp Cells(39, i + 4).Select: NO3slp(i) = Cells(39, i + 4) 'NO3slp Cells(40, i + 4).Select: Hellp(i) = Cells(40, i + 4) 'Hellp Cells(42, i + 4).Select: Vle(i) = Cells(42, i + 4) 'Vle Cells(43, i + 4).Select: DQOle(i) = Cells(43, i + 4) 'DQOle Cells(44, i + 4).Select: SSTle(i) = Cells(44, i + 4) 'SSTle Cells(45, i + 4).Select: SSVle(i) = Cells(45, i + 4) 'SSVle Cells(46, i + 4).Select: NKTle(i) = Cells(46, i + 4) 'NKTle Cells(47, i + 4).Select: NO2sle(i) = Cells(47, i + 4) 'NO2sle Cells(48, i + 4).Select: NO3sle(i) = Cells(48, i + 4) 'NO3sle Cells(49, i + 4).Select: Helle(i) = Cells(49, i + 4) 'Helle Next i 'Establece lista de filtros de archivo Filt = "Archivos de texto (*.txt),*.txt," & _ "Archivos separados por comas (*.csv),*.csv," & _ "Archivos de datos (*.dat), *.dat," & _ "Archivos ASCII (*.ASC), *.asc," & _ "Todos los archivos (*.*), *.*" FilterIndex = 1 'Establece el título del cuadro de diálogo Title = "Seleccionar archivo para guardar datos" 'Obtener el nombre del archivo Filename = Application.GetSaveAsFilename _ (FileFilter:=Filt, FilterIndex:=FilterIndex, Title:=Title) 'Salir si se cancela el cuadro de diálogo If Filename = "" Then MsgBox "No se ha seleccionado ningún archivo" Exit Sub End If WARCH = Filename 'Grabar valores en archivo digital Open WARCH For Output As #1 Print #1, TIT; ","; Fecha; ","; NM; ","; dia; ","; NMF For i = 1 To 11 Print #1, Tipo(i) Print #1, DQO(i); ","; DQOs(i); ","; DQOfs(i); ","; DBO(i); ","; DBOs(i); ","; SST(i); ","; SSV(i) Print #1, NH3N(i); ","; NKT(i); ","; NKs(i); ","; NO2s(i); ","; NO3s(i); ","; PO4(i); ","; PT(i); ","; Alc(i); ","; Hel(i) Print #1, Q(i); ","; T(i); ","; TU(i); ","; pH(i); ","; OD(i); ","; VL1(i); ","; VL2(i); ","; VL3(i) Print #1, Vlp(i); ","; DQOlp(i); ","; SSTlp(i); ","; SSVlp(i); ","; NKTlp(i); ","; NO2slp(i); ","; NO3slp(i); ","; Hellp(i) Print #1, Vle(i); ","; DQOle(i); ","; SSTle(i); ","; SSVle(i); ","; NKTle(i); ","; NO2sle(i); ","; NO3sle(i); ","; Helle(i) Next i Close #1 End Sub Sub LeerDatos() 'Programa desarrollado por el personal O&M de la Planta Piloto Dim TIT As String, Fecha As String, Tipo(11) As String, NM As Single, dia As Single, NMF As Single Dim DQO(11) As String, DQOs(11) As String, DQOfs(11) As String, DBO(11) As String, DBOs(11) As String, SST(11) As String, SSV(11) As String Dim NH3N(11) As String, NKT(11) As String, NKs(11) As String, NO2s(11) As String, NO3s(11) As String, PO4(11) As String, PT(11) As String Dim Alc(11) As String, Hel(11) As String Dim Q(11) As String, T(11) As String, TU(11) As String, pH(11) As String, OD(11) As String, VL1(11) As String, VL2(11) As String, VL3(11) As String Dim Vlp(11) As String, DQOlp(11) As String, SSTlp(11) As String, SSVlp(11) As String, IVLlp(11) As String, NKTlp(11) As String Dim NO2slp(11) As String, NO3slp(11) As String, Hellp(11) As String Dim Vle(11) As String, DQOle(11) As String, SSTle(11) As String, SSVle(11) As String, IVLle(11) As String, NKTle(11) As String Dim NO2sle(11) As String, NO3sle(11) As String, Helle(11) As String Dim WARCH As String, Filt As String, FilterIndex As Integer, Title As String, Filename As String ChDir "C:\Users\HazenAnd\Desktop\2015\PROCESAMIENTO DE DATOS PP\Captura y procesamiento de datos experimentales" 'Inicializar hoja Ingreso Worksheets("Ingreso").Range("D3:D5").ClearContents Worksheets("Ingreso").Range("F3:F4").ClearContents Worksheets("Ingreso").Range("E8:O49").ClearContents Worksheets("Ingreso").Range("H3").ClearContents 'Establece lista de filtros de archivo Filt = "Archivos de texto (*.txt),*.txt," & _ "Archivos separados por comas (*.csv),*.csv," & _ "Archivos de datos (*.dat), *.dat," & _ "Archivos ASCII (*.ASC), *.asc," & _ "Todos los archivos (*.*), *.*" FilterIndex = 1 'Establece el título del cuadro de diálogo Title = "Seleccionar archivo para importar datos" 'Obtener el nombre del archivo Filename = Application.GetOpenFilename(FileFilter:=Filt, FilterIndex:=FilterIndex, Title:=Title) 'Salir si se cancela el cuadro de diálogo If Filename = "" Then MsgBox "No se ha seleccionado ningún archivo" Exit Sub End If WARCH = Filename Open WARCH For Input As #1 Input #1, TIT, Fecha, NM, dia, NMF 'Leer el archivo seleccionado For i = 1 To 11 Input #1, Tipo(i) Input #1, DQO(i), DQOs(i), DQOfs(i), DBO(i), DBOs(i), SST(i), SSV(i) Input #1, NH3N(i), NKT(i), NKs(i), NO2s(i), NO3s(i), PO4(i), PT(i), Alc(i), Hel(i) Input #1, Q(i), T(i), TU(i), pH(i), OD(i), VL1(i), VL2(i), VL3(i) Input #1, Vlp(i), DQOlp(i), SSTlp(i), SSVlp(i), NKTlp(i), NO2slp(i), NO3slp(i), Hellp(i) Input #1, Vle(i), DQOle(i), SSTle(i), SSVle(i), NKTle(i), NO2sle(i), NO3sle(i), Helle(i) Next i Close #1 'Grabar datos del archivo en hoja de -IngresoRange("D3").Select: Range("D3") = TIT Range("D4").Select: Range("D4") = Fecha Range("F3").Select: Range("F3") = NM Range("F4").Select: Range("F4") = dia Range("H3").Select: Range("H3") = NMF For i = 1 To 11 Cells(7, i + 4).Select: Cells(7, i + 4) = Tipo(i) Cells(8, i + 4).Select: Cells(8, i + 4) = DQO(i) 'DQO Cells(9, i + 4).Select: Cells(9, i + 4) = DQOs(i) 'DQOs Cells(10, i + 4).Select: Cells(10, i + 4) = DQOfs(i) 'DQOfs Cells(11, i + 4).Select: Cells(11, i + 4) = DBO(i) 'DBO Cells(12, i + 4).Select: Cells(12, i + 4) = DBOs(i) 'DBOs Cells(13, i + 4).Select: Cells(13, i + 4) = SST(i) 'SST Cells(14, i + 4).Select: Cells(14, i + 4) = SSV(i) 'SSV Cells(15, i + 4).Select: Cells(15, i + 4) = NH3N(i) 'NH3Ns Cells(16, i + 4).Select: Cells(16, i + 4) = NKT(i) 'NKT Cells(17, i + 4).Select: Cells(17, i + 4) = NKs(i) 'NKs Cells(18, i + 4).Select: Cells(18, i + 4) = NO2s(i) 'NO2s Cells(19, i + 4).Select: Cells(19, i + 4) = NO3s(i) 'NO3s Cells(20, i + 4).Select: Cells(20, i + 4) = PO4(i) 'PO4 Cells(21, i + 4).Select: Cells(21, i + 4) = PT(i) 'PT Cells(22, i + 4).Select: Cells(22, i + 4) = Alc(i) 'Alc Cells(23, i + 4).Select: Cells(23, i + 4) = Hel(i) 'Hel Cells(24, i + 4).Select: Cells(24, i + 4) = Q(i) 'Q Cells(25, i + 4).Select: Cells(25, i + 4) = T(i) 'T Cells(26, i + 4).Select: Cells(26, i + 4) = TU(i) 'TU Cells(27, i + 4).Select: Cells(27, i + 4) = pH(i) 'PH Cells(28, i + 4).Select: Cells(28, i + 4) = OD(i) 'OD Cells(29, i + 4).Select: Cells(29, i + 4) = VL1(i) 'VL1 Cells(30, i + 4).Select: Cells(30, i + 4) = VL2(i) 'VL2 Cells(31, i + 4).Select: Cells(31, i + 4) = VL3(i) 'VL3 Cells(33, i + 4).Select: Cells(33, i + 4) = Vlp(i) 'Vlp Cells(34, i + 4).Select: Cells(34, i + 4) = DQOlp(i) 'DQOlp Cells(35, i + 4).Select: Cells(35, i + 4) = SSTlp(i) 'SSTlp Cells(36, i + 4).Select: Cells(36, i + 4) = SSVlp(i) 'SSVlp Cells(37, i + 4).Select: Cells(37, i + 4) = NKTlp(i) 'NKTlp Cells(38, i + 4).Select: Cells(38, i + 4) = NO2slp(i) 'NO2slp Cells(39, i + 4).Select: Cells(39, i + 4) = NO3slp(i) 'NO3slp Cells(40, i + 4).Select: Cells(40, i + 4) = Hellp(i) 'Hellp Cells(42, i + 4).Select: Cells(42, i + 4) = Vle(i) 'Vle Cells(43, i + 4).Select: Cells(43, i + 4) = DQOle(i) 'DQOle Cells(44, i + 4).Select: Cells(44, i + 4) = SSTle(i) 'SSTle Cells(45, i + 4).Select: Cells(45, i + 4) = SSVle(i) 'SSVle Cells(46, i + 4).Select: Cells(46, i + 4) = NKTle(i) 'NKTle Cells(47, i + 4).Select: Cells(47, i + 4) = NO2sle(i) 'NO2sle Cells(48, i + 4).Select: Cells(48, i + 4) = NO3sle(i) 'NO3sle Cells(49, i + 4).Select: Cells(49, i + 4) = Helle(i) 'Helle Next i End Sub ANEXO F Currículo Vitae de los Autores ANEXO F-1 Currículo Vitae Lissette Campoverde C U R R I C U L U M VITAE Apellidos y nombres completos: CAMPOVERDE PINEDA LISSETTE ESTEFANIA Lugar y fecha de nacimiento: Santo Domingo de los Tsáchilas, 22 de febrero de 1990 25 años Estado Civil: Soltera Dirección domiciliaria: Cristóbal Sandoval Oe6-147 y Carlos Cabezas; Edificio Sagitario 1-3 Sector Pinar Bajo: Quito-Ecuador Telf.:02 3300839 Cel.: +593 0984317296 Correo electrónico: [email protected] OBJETIVOS Desempeñarme dentro de mi campo laborar en una institución que valore mi potencial de desarrollo y me permita contribuir con mi conocimiento y mis competencias de gestión para el eficaz cumplimiento de los objetivos propuestos. FORMACIÓN ACADÉMICA Primaria: Escuela Fiscomisional “MADRE LAURA” Ciudad Santo Domingo, (1996- 2002) Secundaria: Colegio Particular Marista Mixto “PIO XII”: Bachiller en Físico matemático Ciudad Santo Domingo. (2003- 2008) Universitaria: Universidad Central del Ecuador: Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental: Carrera de ingeniería Ambiental – Egresada de Ingeniería ambiental (Septiembre-Febrero2012).- (2008- 2014). LUGARES DONDE HA TRABAJADO PR AC T IC AS PR EPR O F ESIO N AL ES Julio 2014H AZ EN & S AW Y ER EN VIROM ENT AL EN G IN EER S AN D SCIENTISTS Operador Planta Piloto de Tratamiento de Aguas Residuales por el método de lodos activados. Actualmente culmino una investigación para mi tesis de grado sobre la determinación de coeficientes cinético: Producción de biomasa y requerimientos de oxígeno para el tratamiento de aguas residuales de la descarga del Batán, Quito- Ecuador Septiembre 2013- Mayo 2014 AM B IEN C ON SU L Técnico Ambiental. Elaboración de ficha y estudios ambientales, términos de referencia, planes de manejo, manejo de sistema de ISO 9001-1400, etc. Agosto 2013 FRANCISCO DE LA TORRE, Consultor Ambiental Soporte en la fase de campo Proyecto Rellenos Sanitarios Manabí. Febrero- Marzo 2013 AS AM T ECH Auditoría Ambiental de Cierre Aeropuerto Mariscal Sucre, Informe Consolidado de Agua y Suelos Diciembre 2012 AM B IEN C ON SU L -Soporte técnico en la elaboración de fichas ambientales Ecuador Estratégico (Proyecto: Unidades del Milenio) -Soporte técnico en la elaboración de EsIA Campo Tapi (PETROAMAZONAS) Agosto 2012 H OL C IM – Plant a d e Ag reg ad os Pico az á Seguridad industrial - Inducción de seguridad industrial, Análisis de riesgos, Conocimiento de los FPE (elemento de prevención de fatalidad) y de el Safety security observation (SOT), Proceso de explotación de material, Manejo de explosivos. - Medio ambiente SGA, Plan de reforestación de las minas cerradas, Revisión del PMA ambiental de la planta Picoaza, para presentar la documentación de verificación de cumplimiento del Plan de Manejo Ambiental (PMA) al Ministerio del Ambiente. Febrero- Marzo 2012 H AZ W AT - CR A ( C ent ro d e R em ediación Am b ien tal) -Seguridad Industrial - Manejo de Reglamento Interno de Seguridad y Salud - Planes de capacitaciones anuales -Medio Ambiente -Manejo de matrices de impactos y efectos ambientales -Informes de Biorremediación e Incineración AGIP -Aplicación de normativas ambientales Noviembre 2011- Marzo 2012 F U ND IC / Secretaria d e Am b ient e DM Q Apoyo técnico en el Proyecto de Manejo integral de Residuos Sólidos en los barrios de Cotocollao Alto Act iv id ad es realizad as: Manejo de Ordenanza 332, Campaña de capacitación sobre uso de dispositivos de acopio diferenciado, Capacitación ambiental a distintos unidades educativa, Visitas familiares informativas. Febrero – Marzo 2010 FIGEMPA Practicas pre-profesionales en el laboratorio Químico ambiental de la Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental, (192 horas) Actividades realizadas: Informe de entrega sobre muestreo, Manejo de muestras sólidas (secado, separación, medición), Manejo de muestras liquidas (suspensión), Uso de espectrofotómetro para determinar concentraciones específicas, diluciones, etc., Técnicas de muestreo para sólidos, líquidos, gases CON - OCIMIENTO ESPECIAL Manejo de Sistemas de Informacion geográfica (GIS) AUTOCAD Manejo de Office 2010® Inglés, nivel académico 4 (CEC-EPN) CURSOS EXTRACURRICULARES - Curso Parques Eólicos, FIGEMPA Instituto Nacional de Preinversión - - Operación y Control De Procesos en la industria petrolera, Facultad de Ingeniería Química- UCE, Noviembre 2012. - Taller De Legislación Espacial Aplicado Al Cambio Climático Y Seguridad Alimentaria- Secretaria Pro-tempore , (16 horas): Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental; Quito-Ecuador - Seminario de especialización sobre sellado mecánico en bombas hidráulicas, V Encuentro Académico Ambiental, 10 de junio del 2011, Quito-Ecuador - Conferencia sobre Manejo de Cuenca Hidrográfica Amazónica, Semana Expocultural Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental; Quito-Ecuador - Prácticas preprofesionales en el Laboratorio Químico Ambiental de Facultad de Ingeniería en Geologia, Minas, Petróleos y Ambiental, Febrero- marzo 2010. (192horas) REFERENCIAS PERSONALES Ing. Julio Álvarez 0999568182 Gerente Gloarsaga cía. Ltda. Dr. Francisco Carranza 0999295553 Director Técnico del Proyecto Planta Piloto [email protected] [email protected] Dr. Fabián Yánez 099933777 Jefe Planta Piloto [email protected] Ing. Carlos Luis Peña BAKER HUGHES 099 8318752 [email protected] Ing. Lenin Villalba ASAMTECH 0999941030 [email protected] Biol.Tashkin Meza AMBIENCONSUL 0987563997 [email protected] Ing. Jimmy Álava Jefe de Planta HOLCIM Picoazá Ing. Mario Campoverde MIDUVI Santo Domingo de los Tsachilas Dr. Yovanny Jimenez Gerente FUNDIC Ing. Doris Caiza Seguridad, Calidad y Ambiente HAZWAT 09 94553467 09 91893134 02 2271894 [email protected] [email protected] ANEXO F-1 Currículo Vitae Ricardo Loayza HOJA DE VIDA LOAYZA PROAÑO SERGIO RICARDO Lugar y Fecha de Nacimiento: Quito, 25 de enero de 1990 C.I: 1721829917 Dirección Domiciliaria: 6 De Diciembre #158 y Los Pinos, sector la Kennedy: Quito-Ecuador. Telf.: 022404893 Cel.: 0995878389 Correo electrónico: [email protected] FORMACIÓN ACADÉMICA Primaria: Escuela Fiscal “Dr. Isidro Ayora” Provincia: Cotopaxi ; Ciudad Latacunga, (1995 2001) Secundaria: Colegio Particular Técnico Industrial “Hermano Miguel”: Bachiller en Físico Matemático, Auxiliar en manejo de equipos de cómputo. Provincia: Cotopaxi; Ciudad Latacunga, (2001 - 2007). Universitaria: Universidad Central del Ecuador: Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental: Carrera de Ingeniería Ambiental (Egresado). CURSOS EXTRACURRICULARES Taller de Legislación Espacial Aplicado al Cambio Climático y Seguridad Alimentaria- Secretaria Pro-tempore , (16 horas): Facultad de Ingeniería en Geología, Minas, Petróleos y Ambiental; Quito-Ecuador Seminario de especialización sobre sellado mecánico en bombas hidráulicas, V Encuentro Académico Ambiental, 10 de junio del 2011, Quito-Ecuador. Nivel intermedio del idioma Inglés cursado en el Centro Universitario de Idiomas de la Universidad Central del Ecuador: Noviembre 2011 - Diciembre 2012. Curso Auditor Interno ISO 14001:2004, dictado por SGS del 22 al 24 de Julio del 2013. Duración: 24 horas. Curso Auditor Interno ISO 9001:2008, dictado por SGS del 25 al 27 de Julio del 2013. Duración: 24 horas. Taller de Análisis y Evaluación del Recurso Eólico, Diseño, Ingeniería y Evaluación de Impacto Ambiental de Parques Eólicos, en el marco del Proyecto “Estudio de prefactibilidad y factibilidad del Parque Eólico García Moreno”, dictado por Gas Natural Fenosa con el apoyo del Instituto Nacional de Preinversión. Realizado del 07 al 14 de noviembre del 2013. Duración: 40 horas. Charla de aplicaciones biotecnológicas en la mejora del ambiente, dictada por el Centro de investigaciones Biotegnológicas del Ecuador de la Escuela Politécnica del Litoral: 20 diciembre del 2013. Duración: 6 horas. PRÁCTICAS PRE PROFESIONALES Ilustre Municipio del Cantón Latacunga, desde el 02 hasta el 27 de agosto del 2010, en La Dirección de Gestión Ambiental, cumpliendo con el programa sobre Gestión de Desechos Peligrosos e Impactos Ambientales. Planta Procesadora de Aves Bucay - PRONACA, desde el 01 hasta el 31 de agosto del 2011, en los procesos de la Planta de Tratamiento de Aguas Residuales Industriales. Programa Gestión del Agua del Fondo para la Protección del Agua (FONAG), desde el 07 de marzo del 2013 al 07 de marzo del 2014, en el monitoreo, tratamiento de datos, elaboración de anuarios y mantenimiento de estaciones meteorológicas, pluviométricas e hidrológicas que dirige el programa, realización de aforo y análisis físico-químico (in situ y de laboratorio) de agua en el río Aglla. EXPERIENCIA LABORAL HAZEN & SAWYER ENVIROMENTAL ENGINEERS AND SCIENTISTS, Operador Planta Piloto de Tratamiento de Aguas Residuales por el método de lodos activados de la descarga del Batán, desde el 01 de julio del 2014 hasta el presente, cumpliendo con las tareas propias de operación, tomas de muestras para posterior análisis en laboratorios externos, pruebas de laboratorio, manejo de equipos de control (PLC), procesamiento de datos reportados por los laboratorios bajo lenguajes de programación (Visual Basic). REFERENCIAS PERSONALES Ing. Lina Altamirano – 0984074996 Dra. Rocío Bustos - 0998842416 Ing. Jacqueline Cisneros – 0992612037 Dr. Fabián Yánez - 099933777 Dr. Francisco Carranza – 0999295553 Ing. Julio Álvarez – 0999568182