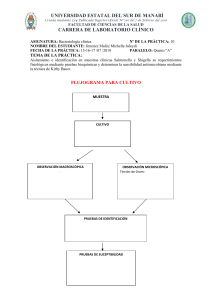
FACULTAD DE MEDICINA PROGRAMA DE ESTUDIOS DE MEDICINA SEMINARIO / TALLER N° 4: PRUEBA DE SUSCEPTIBILIDAD ANTIMICROBIANA 1. INTRODUCCIÓN La resistencia bacteriana es un tema de importancia en la salud pública debido a esto, el conocimiento de los perfiles de susceptibilidad antimicrobiana debe orientar a la elaboración de esquemas de tratamiento más eficaces y además, la información proporcionada por la vigilancia debe servir de insumo para la elaboración de un programa de uso racional de antibióticos. Cada tipo de agente antimicrobiano tiene un modo de acción único siendo necesario comprender algunas características básicas de la estructura celular bacteriana y cómo funcionan los blancos de los antimicrobianos en la célula bacteriana. A pesar que las estructuras de las bacterias Gram-positivas y Gram-negativas son similares, existen algunas diferencias claves. Estas diferencias son las bases de la capacidad que tiene un agente antimicrobiano para inhibir el crecimiento ya sea de bacterias Gram-positivas o Gramnegativas. Sin embargo, algunos agentes actúan en ambos tipos de bacteria y estos a menudo se conocen como agentes de amplio espectro. Existen grupos bacterianos que presentan enzimas del tipo betalactamasas, las cuales son capaces de hidrolizar los antimicrobianos betalactámicos, inactivándolos y haciéndolos inefectivos. Las enzimas de espectro extendido (BLEE) están entre las de mayor relevancia clínica e incluyen tres tipos principales, TEM, SHV y CTX-M. Otro grupo bacteriano como Staphylococcus aureus, en cuanto a su variabilidad, la rápida respuesta adaptativa frente a cambios del medio, y su continua adquisición de determinantes de resistencia antibiótica, han hecho de éste un residente habitual del hábitat hospitalario, donde origina problemas de multirresistencia, ocasionalmente importantes. Aunque el término resistencia a meticilina incluye resistencia a derivados ß-lactámicos, las cepas SARM presentan, en general, resistencia múltiple a varios grupos de antibióticos. A través de diversos mecanismos, estos aislados presentan resistencia al cloranfenicol, tetraciclinas, macrólidos, lincosaminas, aminoglucósidos e, incluso, quinolonas, describiéndose cada vez con mayor frecuencia brotes SARM sensibles sólo a los glucopéptidos. El presente documento pretende informar al alumno de las pautas a seguir para desarrollar el Seminario/Taller sobre Prueba de sensibilidad antimicrobiana correspondiente a la Sesión Procedimental Nº 4 de la Asignatura de Microbiología y Parasitología IV Ciclo del semestre 2021-II. 2. PAUTAS A SEGUIR: a. En los primeros 10 minutos el Docente organizará los sub grupos de trabajo para el desarrollo del Seminario/Taller. b. El trabajo preparado debe ser una Información Corta (Breve) sobre el tema elegido, en 10-12 PPT como máximo (incluyendo la carátula), teniendo en cuenta los siguientes aspectos: - Introducción. - Marco Conceptual: A) Procedimientos para la realización de antibiograma: medios de cultivo y reactivos, B) Lectura e interpretación del antibiograma (De como ejemplo para una bacteria Gram (+) y una Gram(-), C) Métodos fenotípicos y moleculares para la detección de bacterias Betalactamasas y MRSA. D) Información de Resultados de bacterias betalactamasas y MRSA. - Conclusiones. - Referencias Bibliográficas (VANCOUVER). c. En los siguientes 95 min los alumnos sustentarán el trabajo preparado y serán evaluados usando una Rúbrica de evaluación de Taller Práctico. 3. REFERENCIAS BIBLIOGRÁFICAS 1. Velazco, J. y Cols. Manual Práctico de Bacteriología Clínica. 1ª Ed, Universidad de los Andes, Editorial Venezolana, Venezuela, 2011. 2. Cavalieri S. Coyle M. Manual de pruebas de susceptibilidad antimicrobiana. 2005. ANLIS. Argentina. 3. Sacsaquispe R, Velásquez J. Manual de procedimientos para la prueba de sensibilidad antimicrobiana por el método de Disco Difusión. 2002. INS. Lima-Perú. 4. Lezameta L, Gonzáles E, Tamariz J. Comparación de cuatro métodos fenotípicos para la detección de beta-lactamasas de espectro extendido. Rev Peru Med Exp Salud Publica. 2010; 27(3): 345-51. http://www.scielo.org.pe/pdf/rins/v27n3/a06v27n3.pdf 5. Arce, Z.; Llontop, J; Alarcón, E. y Lopez, E. Detección de los genes SHV, TEM y CTX-M en cepas de Escherichia coli β-lactamasas de espectro extendido procedente de un hospital de Chiclayo-Perú. Rev Cuerpo Med. HNAAA 7(3) 2014. http://docs.bvsalud.org/biblioref/2020/03/1052079/rcm-v7-n3-2014_pag27-30.pdf 6. Horna, G. Evaluación de métodos fenotípicos para la detección de Staphylococcus aureus resistente a meticilina. Rev Esp Quimioter 2015, 28 (2): 98-100. http://www.seq.es/seq/0214-3429/28/2/horna.pdf 7. Espejo, L.; Rodriguez, K.; Rodriguez, M. y Ramirez, P. Identificación genotípica de Staphylococcus con fenotipo meticilino resistente aislados de muestras de humanos, animales y ambiente. Rev Inv Vet Peru 2019; 30(1): 364-376. http://www.scielo.org.pe/pdf/rivep/v30n1/a37v30n1.pdf 8. Camarena J.J. Infección por Staphylococcus aureus RESISTENTE A METICILINA https://seimc.org/contenidos/ccs/revisionestematicas/bacteriologia/sarm.pdf https://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobio logia/seimc-procedimientomicrobiologia38.pdf https://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobio logia/seimc-procedimientomicrobiologia39.pdf Docentes Asignatura de Microbiología y Parasitología