Diagramas de Fases y Solidificación: Análisis de Aleaciones Pb-Sn
Anuncio

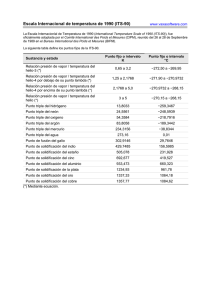
DIAGRAMA DE FASES Y SOLIDIFICACIÓN María Paz Fajardo Hanrryra, Juan Manuel Nieto Tobónb, Enmanuel Román Vanegasc, Cristhian Camilo Nieto Guerrerod Departamento de Antioquia, Universidad Pontificia Bolivariana, Medellín, Colombia [email protected] [email protected] [email protected] [email protected] I. INTRODUCCIÓN Cuando se busca mejorar las propiedades de un material se tienen muchas opciones y caminos diferentes para alcanzar este objetivo, en estos laboratorios se analizaron dos métodos comunes como lo es la aleación de dos metales y la velocidad de enfriamiento de estos. Para el laboratorio de fases se analizó la solubilidad del plomo y estaño para obtener referencias de temperatura de solidificación en función de la proporción de los materiales en la aleación; por otro lado, en el laboratorio de solidificación se realizaron pruebas visuales en el microscopio de diferentes muestras para analizar la composición estructural en la superficie del material y separarlas según la velocidad a la cual estas se solidificaron. A. Procedimiento 1) Laboratorio Diagrama de fases Para el desarrollo del laboratorio de aleaciones se tomaron una serie de muestras de plomo y estaño, primero estas muestras fueron pesadas y puestas en recipientes cerámicos, el objetivo era obtener una aleación de plomo-estaño lo más precisa posible a un porcentaje requerido, en este caso se intentó obtener una serie de 5 muestras de aleaciones con porcentajes de Pb – 10% Sn, Pb – 25% Sn, Pb – 50% Sn, Sn – 25% Pb y Sn – 10% Pb. Luego de tener ordenadas y caracterizadas las muestras en recipientes cerámicos resistentes a altas temperaturas, se ingresaron las muestras a un horno que calentó las aleaciones hasta su temperatura de fusión (el horno se encontraba a unos 450 °C), a continuación se sacaron los recipientes del horno y se procedió a realizar una toma de temperatura en función del tiempo, desde que las aleaciones se encontraban en estado líquido hasta que estas volvieran a solidificarse, para esta medición se tomó en cuenta el tiempo desde que se sacaron las muestras tomando intervalos de temperatura cada 5 segundos. Luego de que las muestras retornaran a estado sólido y los tiempos fueron correctamente tomados se dio por finalizado el laboratorio. 2) Laboratorio de Solidificación Para el desarrollo de este laboratorio se prepararon previamente una serie de muestras de un mismo material metálico el cual solidificó a diferentes velocidades, más exactamente una de las muestras fue dejada a condiciones ambiente para su solidificación, otra fue ingresada en agua y la última fue dejada en aceite, para comenzar con el análisis de estas 3 muestras primero se realizó un proceso de lijado superficial de la muestra, con una superficie especial para este propósito y un líquido compuesto de alúmina pulverizada a 5 micras, hasta lograr un acabado tipo espejo. Luego del proceso de lijado de las muestras se procedió a ingresarlas en un microscopio electrónico para así realizar un estudio de micrografía a la superficie del material, identificando formaciones dendríticas y demás defectos superficiales que pudieron haber sido causados por las diferentes velocidades de solidificación, luego de analizar y tomar fotos de las 3 muestras se procedió a atacarlas químicamente durante 50 segundos para así volver a realizar el mismo análisis microestructural, las muestras en este laboratorio fueron atacadas químicamente con el fin de revelar con mayor detalle los defectos causados en la superficie; todo esto con el fin de identificar de manera visual cual muestra se solidifico con ayuda del agua, aceite y las condiciones ambiente, luego de analizar y tomar fotografías estructurales de la superficie de las muestras se dio por finalizado el laboratorio. II. METODOLOGÍA A. Marco teórico 1) Laboratorio Diagrama de fases Los diagramas de fases son representaciones gráficas a varias temperaturas, presiones y composiciones, de las fases que están presentes en un sistema de materiales. Los diagramas de fases se realizan mediante condiciones de equilibrio (enfriamiento lento) y son utilizados para entender y predecir muchos aspectos del comportamiento de los materiales. El estudio del equilibrio heterogéneo entre fase sólida y líquida, puede realizarse mediante el análisis térmico (basado en la determinación de las curvas de enfriamiento). Lo que se realiza experimentalmente es colocar en distintos recipientes los componentes puros y las mezclas, fundirlos y tomar las temperaturas en función del tiempo, mientras las sustancias se enfrían y posteriormente se solidifican Parte de la información que se puede obtener a partir de estos diagramas, es la siguiente: Fases presentes a diferentes composiciones y temperaturas. Solubilidad de un elemento o compuesto en otro. Temperatura a la cual una aleación que se deja enfriar empieza a solidificar; así como el rango de temperaturas en el que tiene lugar la solidificación. Temperatura a la que se funden o empiezan a fundirse las distintas fases. 2) Laboratorio de Solidificación La solidificación es un proceso que se lleva a cabo desde un estado líquido a un estado sólido. Es una técnica muy importante y usada en la industria, ya que muchos metales se funden para moldearlos con el fin de darles un acabado específico según los requisitos necesarios para su uso. Los materiales en estado sólido poseen un conjunto de granos o cristales que se forman durante el proceso de solidificación. Cuando se tiene un metal dentro de un recipiente, los átomos que forman a este metal poseen una energía almacenada que es conocida como energía libre de volumen y se representa mediante GL si el metal se encuentra en estado líquido y Gs si se encuentra en estado sólido. Ambas energías, Gs y GL, para la misma cantidad de material y para la misma temperatura, son diferentes en cada estado; siendo el estado líquido el que posee mayor energía libre almacenada. Es por esto que cuando un material pasa de líquido a sólido, libera energía a medida que se da el cambio de fase. Cuando se va formando el sólido, se forma también una superficie que corresponde a una interfase entre el sólido y el entorno que lo rodea. La solidificación en principio, sigue dos etapas: 1. Nucleación: Formación de partículas sólidas estables en el fundido. 2. Crecimiento: Se da hasta la formación de cristales y la formación de una estructura granular organizada La nucleación a su vez, se divide en dos tipos: Homogénea: cuando se juntan varios átomos y forman un núcleo completamente rodeado de líquido. Heterogénea: cuando el núcleo se forma sobre impurezas o en las paredes que contienen líquido. El núcleo no se encuentra totalmente rodeado de líquido. El área superficial del núcleo heterogéneo es menor, por lo que requiere de menor cantidad de energía para formarse. Normalmente los procesos de solidificación reales comienzan debido a nunca nucleación heterogénea. La nucleación homogénea raras veces se da en la vida real. Cuando el material es puro, todos los granos que se forman durante la solidificación poseen la misma estructura cristalina, pero cuando el material posee impurezas, pueden formarse granos con diferentes estructuras cristalinas. III. MATERIALES Y EQUIPOS A. Laboratorio diagrama de fases Plomo Estaño Termocupla Recipientes cerámicos Pinzas Horno de temperatura controlada Guantes resistentes a temperaturas altas B. Laboratorio de solidificación Muestra metalográfica 1. (Aleación Pb0,6-Sn0,4) - 330g de Pb y 220g de Sn. Muestra metalográfica 2. (Aleación Pb0,6-Sn0,4) -165g de Pb y 110g de Sn. Reactivos: 10ml HnO3, 10ml ácido acético, 80ml de glicerina y Nital. Microscopio VI. ANÁLISIS DE RESULTADOS A. Resultados 450 400 Temperatura [°c] 350 300 250 200 150 0 100 200 300 400 500 600 700 800 Tíempo [s] Muestra 1 Muestra 2 Muestra 3 Muestra 4 Gráfica I. Curvas de enfriamiento de muestras Figura 1. Diagrama de fases. Muestra 5 Figura 2. Micrografía muestra 1 sin atacar. Figura 5. Micrografía muestra 2 sin atacar. Figura 3. Micrografía muestra 1 sin atacar, concentración interdendrítica. Figura 6. Micrografía muestra 2 atacada. B. Análisis de los resultados Figura 4. Micrografía muestra 1 atacada. Según los datos obtenidos, se puede apreciar que para cada uno de los especímenes, su curva de enfriamiento presenta zonas en la que se experimenta un cambio en la pendiente y una planicie (Grafica I), lo anterior se debe a que el espécimen luego de estar cierto tiempo lejos de una fuente de calor, este comienza a liberar su energía y por ende comienza a reducir su temperatura hasta llegar a la temperatura de solidificación, en donde, inicia su proceso de cambio de fase, en ese momento, el espécimen, comienza a liberar el calor latente, por ende, este va a conservar una temperatura isoterma (lo que explica la planicie de la gráfica), de forma que el sistema pierda la energía sobrante para comenzar a solidificarse, comenzando a formar un conjunto de embriones, que más a adelante se comenzaran a convertir en núcleos (dependiendo de su tamaño estos pueden seguir creciendo o disolverse) que formarían la base de los granos del material sólido[1]. Como se puede apreciar en la gráfica 1, la temperatura de solidificación para cada espécimen tiene ciertas variaciones, la variación más notoria la presentó la muestra 1, la cual, tuvo una temperatura de transición de 297.6 °C, esta muestra, tenía una composición de 89,76% de Plomo, por tal razón se explica, que la temperatura de solidificación fuese mayor, ya que, el plomo tiene una temperatura de solidificación de 327.4°C [2], por lo tanto, como esta muestra tenía un gran porcentaje de ese material, su punto de salificación era bastante alto a comparación de los otros. Con base a la muestra 5, esta presentó un punto de solidificación de 295.1°C, esta temperatura no tiene mucho sentido, puesto que sobrepasa los datos teóricos, ya que, esta muestra tiene una composición del 89,95% de estaño y su punto de fusión es mucho más bajo (231.9°C) [3], por lo tanto, se asume que este punto no es completamente confiable, esto se evidenció en el laboratorio, puesto que el termómetro estaba presentando valores incoherentes. Analizando el diagrama de fases, las muestras 1, 2 y 3, presentan una composición hipoeutéctica (es la fase rica en plomo), y las muestras 4 y 5, tienen concentración hipereutéctica (fase rica en estaño). [4] Como se puede observar en el diagrama de fases, la muestra 1, se encuentra por debajo de la línea de solidus, por tal razón, se esperaría que su micrografía fuera de una fase completamente sólida con una composición rica en Plomo [1]. Para la muestra 2 y 3, se evidencia que experimentalmente, la temperatura de solidificación está por encima de la línea eutéctica por tal razón se espera una fase α proeutéctica [4] y líquido sin transformar. Para la muestra 4, esta tiene formación de una fase β proeutectica más liquido (debido a que ha aumentado la composición de Estaño y disminuido la composición de Plomo) y por último, el diagrama de fases experimental indica que la muestra 5 se encuentra en fase liquida, es decir por encima de la línea de liquidus. Para el siguiente laboratorio, se tomaron micrografías de dos especímenes que tuvieron dos mecanismos de solidificación distintos, en la figura 2, se puede evidenciar un crecimiento dendrítico, especialmente, cerca de la superficie, puesto que allí es donde tuvo mayor importancia la transferencia de calor, estas dendritas tienen su crecimiento en dirección perpendicular a la dirección de transferencia de calor. El crecimiento dendrítico se da a causa de un subenfriamiento que presenta el líquido en el proceso de solidificación, de tal modo, las dendritas funcionan como mecanismo de transferencia de calor, para poder transferir el calor latente del solido al líquido y a los alrededores, para poder aumentar un poco la temperatura del líquido y hacer efectiva la solidificación (el proceso mediante el cual el líquido subenfriado aumenta su temperatura hasta la temperatura de solidificación se denomina recalescencia)[1]. En la figura 3, se puede observar una especie de ramificaciones más pequeñas entre los brazos de las dendritas, estas ramificaciones se conocen como concentraciones interdendríticas y son causa de una porosidad por concentración [1], este problema, es fácil de solucionar, solamente es necesario disminuir el tiempo de enfriamiento, con esto, se reduce el tamaño de la dendrita y por ende este tipo de porosidad. La figura 4, muestra un crecimiento de dos fases, la α (ramificaciones oscuras) y la β (espacios circulares sin ramificación), se puede observar que las dendritas presentan una tonalidad más oscura, esto se debe a que son más profundas y el ácido atacó mas esta zona (esta zona tiene mayor cantidad de plomo, por lo tanto es α eutéctica). La figura 5, muestra que no hay un crecimiento dendrítico predominante, por tal razón, la transferencia de calor fue deficiente, lo que explica, que la temperatura del líquido se mantuvo por encima de la temperatura de solidificación hasta llegar a ella y nunca presentó un subenfriamiento, por lo tanto, este espécimen presentó un crecimiento planar. [1] La figura 6, evidencia la superficie por donde se dio a cabo la transferencia de calor, a diferencia de la figura 5, aquí se muestran una serie de porosidades (son más notorias a causa del ataque químico), las cuales son consecuencia de la concentración de las fases α y β, se puede observar que hay mayor concentración de la fase α puesto que el plomo reacciona con mayor facilidad con el ácido, por ende, se puede ver en la micrografía ciertos lugares de una tonalidad oscura relativamente grandes. Por lo tanto, culminando el análisis de la muestra 1 y 2, se puede evidenciar que la muestra 1 presentó una nucleación homogénea, ya que el líquido evidenció subenfriamiento que conllevó a la formación de dendritas, de tal modo, que este espécimen presento convección natural. La muestra 2, no presentó crecimiento dendrítico predominante, por lo tanto se le atribuye a que pudo tener una nucleación heterogénea, ya que el líquido no tuvo la necesidad de subenfriarse y por ende tuvo un crecimiento planar, esta muestra, tuvo que ser enfriada por medio de convección forzada. VII. CONCLUSIONES Al obtener los datos experimentales, se notó que la muestra 5 presentaba un error superior al 27% con respecto a su punto o temperatura de solidificación; esto puede ser debido a que los metales empleados en la práctica presentaban impurezas en su microestructura interna, datos erróneos de los equipos utilizados o no realizar la toma de los datos en momento preciso. VII. CITAS Los diagramas de fases representan información recurrente a los estados estables, es decir, los estados a los que, en ciertas condiciones dadas, el material en estudio posee el mínimo valor de energía almacenada o energía libre de volumen. De acuerdo a esto, los cambios de estados reflejados en el diagrama también hacen referencia a las condiciones de equilibrio. En la práctica y en los procesos industriales, el diagrama de fases es utilizado para estudiar las transformaciones a pequeñas velocidades de calentamiento o enfriamiento. Resulta de mucha utilidad en el momento de diseñar un proceso de fabricación para un producto metálico y se necesita conocer las fases que están presentes a determinada temperatura. En esta práctica, se consideraron los diagramas de fases binarios en los cuales la temperatura y la composición son variables. Con base en los resultados experimentales y los conceptos teóricos, la solidificación de los metales depende principalmente de su pureza o en el caso de estudiar aleaciones, dependerá del grado de concentración del soluto; además, la velocidad con la que se solidifique el sistema dependerá en gran medida de la velocidad con la que se dé la extracción calórica de la fase liquida para así llegar al resultado esperado. [1] Ciencia e Ingeniería De Materiales, Donald R. Askeland. Pradeep P. Wendelin J. Séptima edición, Cengage Learning, 2017. Páginas: 343, 397, 337, 349 [2] Lenntech. Propiedades químicas del Plomo. [2019] Recuperado de: https://www.lenntech.es/periodica/elementos/pb.htm [3] Lenntech. Propiedades químicas del Estaño. [2019] Recuperado de: https://www.lenntech.es/periodica/elementos/sn.htm [4] Diagramas de fase. Udima. Lucas Castro Martinez. Recuperado de: http://www.cartagena99.com/recursos/alumnos/apuntes/ Manual%20Tema%208%20Diagramas%20de%20fase% 20FORMATO2.pdf [5] W. D. Callister “Introducción a la Ciencia e Ingeniería de los Materiales”. Libro I (Capítulo 7) Ed. Reverté (2000) [6] Solidificación dinámica de metales y aleaciones, Gerardo Danilo Valdés Delgado, Instituto Superior Politécnico José Antonio Echevarría, facultad de ingeniería Mecánica, 2016 [7]Solidificación de materiales metálicos e imperfecciones cristalinas, María Soledad Roselli Menciones, 2016.