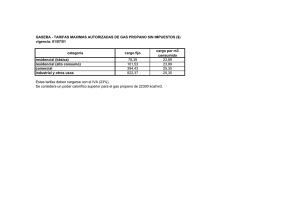
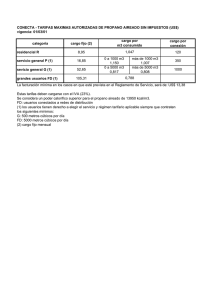
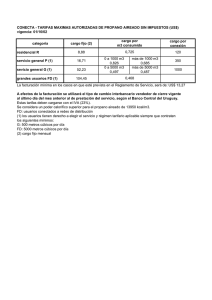
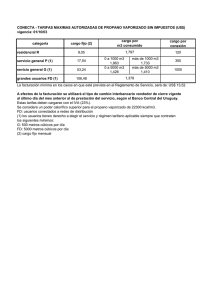
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE INGENIERÍA TERMODINÁMICA II. TAREA 1, UNIDAD 1: ANÁLISIS DEL FACTOR DE COMPRESIBILIDAD Z PARA EL AGUA Y EL PROPANO EN ZONA DE SATURACIÓN. PROFESORA: ADRIANA PATRICIA VILLEGAS QUICENO POR: MARIO ALONSO BOTERO VARGAS C.C 71792104 1. INTRODUCCIÓN. En el curso de termodinámica I se trabajaron las sustancias idealizadas a un comportamiento de gas ideal, sin embargo en la realidad muchas de estas sustancias, en determinadas condiciones de temperatura y presión, se alejan de ese comportamiento idealizado; con el fin de tener una aproximación de cuanto se aparta el comportamiento de la sustancia de un estado de gas ideal, se cuenta con el factor de compresibilidad, representado por la letra Z, este nos da una idea cuantitativa del estado de la sustancia de trabajo en determinadas condiciones termodinámicas. “Cualitativamente, valores de Z menores que 1 indican que las fuerzas de atracción entre los átomos o moléculas constituyentes son más fuertes que las fuerzas repulsivas, mientras que valores de Z mayores que 1 indican que las interacciones repulsivas son dominantes”, para valores de Z iguales a 1, el comportamiento de la sustancia es similar a gas ideal. En este trabajo se calcula el valor de Z a partir de la presión, la temperatura, el volumen especifico y la constante universal de los gases. 2. RESUMEN. En el presente escrito se plasman los análisis y resultados del calculo de los valores de Z f y Zg para el agua y el propano, estos cálculos se hicieron en estado de saturación, para temperaturas superiores a la crítica con varias presiones y a la temperatura crítica con varias presiones, tales cálculos se hicieron para las dos sustancias mencionadas, adicionalmente se gráficaron los resultados, en zona de saturación, con gráficas de Presión contra volumen y Z contra presión. 3. PROCEDIMIENTO. 3,1. Situación problema: Deducir en hojas de cálculo los valores del factor de compresibilidad para el agua y el propano en zona de saturación, realizar sus respectivas gráficas de Z contra presión y presión contra volumen también en saturación, finalmente analizar los resultados. 3,2. Método de solución: Para poder encontrar los valores de Z en distintas condiciones de presión y temperatura para el agua y el propano se utilizo la siguiente ecuación de estado derivada de la de gas ideal. Z= Pv RT (1) Donde Z es el factor de compresibilidad adimensional, P la presión en pascales, v el volumen especifico en m³/Kg, R la constante universal de los gases igual a 8,31451 J/mol.K y T la temperatura en K. Con los datos tabulados en las tablas del libro de Shapiro para el agua (tablas A-2, A-3 y A-4) y el propano (tablas A-16, A-17 Y A-18) se obtuvieron los valores de presión, temperatura y volumen para diferentes condiciones en estado de saturación, con estos datos y la ecuación (1) se calcularon los valores de Zf y Zg en hoja de calculo (en este caso se uso Libreoffice calc), adicionalmente en las hojas de calculo se construyeron las gráficas de Presión contra volumen y Z contra presión para el agua y el propano en zona de saturación. Asimismo, con el fin de observar el comportamiento de las sustancias en estados “extremos”, se calcularon valores de Z para varias presiones a temperatura crítica y por encima de ella; para el agua se usaron las isotermas de 374,15 °C, que es la temperatura crítica del agua, y una isoterma elegida aleatoriamente con la condición de que fuera superior a la crítica de 400 °C; para el propano se usaron las isotermas de 96,85 °C, que es la temperatura crítica del propano, y una isoterma elegida alaeatoriamente con la condición de que fuera superior a la crítica de 100 °C, los resultados también fueron calculados con la ecuación (1) y tabulados en hojas de cálculo, sin embargo, para poder encontrar los volúmenes de las dos sustancias a sus respectivas temperaturas críticas y a varias presiones, en las hojas de cálculo fue necesario aplicar un algoritmo de interpolación con los valores extremos conocidos para hallar valores intermedios pues los valores de volúmenes a estas temperaturas no se encontraban tabulados en las tablas de Shapiro, los resultados de estos datos no fueron gráficados. 3,3. Procedimiento para interpolación: v T 1=mT 1 +b (2) v T 2=mT 2 +b (3) de (2) b=v T 1 −mT 1 (4) (4) en (3) v T 2=mT 2 + v T 1−mT 1 (5) v T 2−v T 1=m(T 2−T 1 ) v T 2−v T 1 T 2−T 1 (6) v Tx =mT x +b (7) m= Donde para dos datos consecutivos; vT1 es el volumen menor a T1, vT2 es el volumen mayor a T2, vTx es el volumen desconocido intermedio a los dos datos vT1 y vT2, m es la pendiente, b el intercepto, T1 es la temperatura menor, T2 es la temperatura mayor y Tx la temperatura elegida para encontrar su respectivo volumen vTx. 4. RESULTADOS Y ANÁLISIS DE RESULTADOS. 4,1. Resultados: A continuación se presentan los resultados de tablas y gráficas obtenidos en la hoja de cálculo hecha en Libreoffice calc. El propano para la presión de 40 bar y temperatura de 100 °C no tiene valores tabulados en las tablas de Shapiro, por tanto se le dio un valor de cero a v T1 en la ultima iteración (número 18) en la tabla que corresponde al algoritmo de interpolación para valores de z a temperatura crítica y diferentes presiones para el propano (observar algoritmo en hoja de cálculo). Tabla 1. Valores de Zf y Zg en saturación para el agua a diferentes presiones y temperaturas. Tabla 2. Valores de Z para el agua a 400 °C y diferentes presiones. Tabla 3. Valores de Z para el agua a temperatura crítica y diferentes presiones. Tabla 4. Valores de Zf y Zg en saturación para el propano a diferentes presiones y temperaturas. Tabla 5. Valores de Z para el propano a 100 °C y diferentes presiones. Tabla 6. Valores de Z para el propano a temperatura crítica y diferentes presiones. Gráfica 1. Z contra presión para agua saturada. Gráfica 2. Presión contra volumen para agua saturada. Gráfica 3. Z contra presión para propano saturado. Gráfica 4. Presión contra volumen para propano saturado. 4,2. Análisis de resultados: Haciendo un análisis cualitativo de cada una de las tablas y gráficas nos lleva a hacer las siguientes observaciones. Con respecto a la tabla 1 se puede ver que el agua como líquido saturado se aparta mucho del comportamiento de gas ideal sobre todo a bajas temperaturas y presiones, a pesar de que el aumento de la temperatura hace que el líquido saturado tienda a un comportamiento cada ves mas próximo al de gas ideal, las presiones son muy elevadas y no permiten que las moléculas se alejen entre ellas lo necesario para llegar a un valor de Zf suficientemente próximo a 1, los valores extremos de Z f para el líquido saturado se encuentran entre ≈ 2,88x10-5 y ≈ 0,23 lo que infiere que las fuerzas de atracción son muy fuertes en este estado del agua y no permiten que su comportamiento pueda ser tratado como el de gas ideal, sin embargo el agua como vapor saturado si se aproxima mucho mas al comportamiento de gas ideal a bajas presiones y temperaturas, este comportamiento se prolonga, pero en menos intensidad, a medida que la presión y la temperatura aumentan hasta la vecindad de las propiedades criticas de el agua; los valores extremos de Zg para el vapor saturado se encuentran entre ≈ 0,99 y ≈ 0,23, esto nos indica que el agua como vapor saturado hasta ciertas temperaturas y presiones que no se encuentran en la vecindad de las propiedades críticas, se puede modelar como gas ideal . Adicionalmente detallamos que los valores finales de temperatura y presión, en la parte inferior de la tabla 1, se aproximan mucho a los valores de las propiedades criticas del agua, presión crítica (220,48 bar) y temperatura crítica (374,15 °C), en este estado tanto el líquido saturado como el vapor saturado tienen un comportamiento que para nada se puede asumir como ideal pues sus respectivos valores de Z f y Zg se alejan considerablemente de 1 y ambos son aproximados a 0,23 . Con respecto a la tabla 2, para una isoterma de 400 °C, superior a la temperatura crítica, y para varias presiones, con el agua como sustancia de análisis, vemos que a bajas presiones (por ejemplo 0,06 bar) el agua tiene un comportamiento muy cercano al de gas ideal (Z≈0,99) y se encuentra como vapor sobre calentado, este comportamiento ideal va decayendo levemente a medida que aumenta la presión, indicio que las moléculas se aglomeran cada vez mas cerca, finalmente para las ultimas presiones de la tabla 2 se observa un rápido descenso del comportamiento ideal a medida que aumenta la presión, es así como para una presión de 320 bar Z es ≈ 0,24, este valor es sospechosamente cercano al Z c que se observo en la parte inferior de la tabla 1. En la tabla 3 observamos que a pesar que trabajamos con la temperatura crítica del agua (374,15 °C), las presiones son lo suficientemente bajas como para que los valores de Z sean muy próximos a 1, sin embargo, a medida que la presión aumenta, el comportamiento ideal va decreciendo lentamente y para la presión de 180 bares Z ya se aleja mucho del comportamiento ideal (Z≈0,46). Con respecto a los resultados para el propano, en las tablas 4 y 6 se presentan similares tendencias de comportamiento como las de las tablas 1 y 3, sin embargo los valores numéricos son distintos, podemos observar que el propano se comporta similar al agua a temperaturas y presiones menores que ésta; para el propano el Zc se encuentra a una temperatura de ≈ 96,7 °C y a una presión de 42,48 bar, con un Z ≈ 0,27, datos de la parte inferior de la tabla 4 y que son muy aproximados a los de la teoría donde T c = 96,85 °C y Pc = 42,44 bar, para estas dos tablas (4 y 6) tenemos similares observaciones a las realizadas para las tablas 1 y 3, sin embargo la tabla 5 presenta un comportamiento distinto pues los valores de Z, a pesar de encontrarse en vapor sobre calentado, no se aproximan a 1, el valor mas cercano es Z ≈ 0,5, lo que dista mucho de comportamiento de gas ideal, estos resultados podrían justificarse en base a que el propano como sustancia en estado sobre calentado no es tan similar al gas ideal como el agua sobre calentada, sin embargo hay que tener en cuenta que la temperatura elegida de 100 °C no esta en todo el rango de presiones para propano como vapor sobre calentado lo que nos indica que esta temperatura solo se configura como vapor sobre calentado a partir de ciertas presiones para el propano en zona de vapor sobre calentado. Las gráficas nos permiten visualizar y hacernos una mejor idea del comportamiento de las dos sustancias en saturación, las isotermas fueron dibujadas a ojo y en la realidad no necesariamente pasan por todos los puntos descritos por la curva. 5. CONCLUSIONES En la vida real la mayoría de las sustancias no se comportan como gas ideal, saber esto nos ayuda a asumir bajo que modelo podemos trabajar determinada sustancia, una ecuación que nos permite dictaminar la idealización de gas ideal es la del factor de compresibilidad Z cuyos valores permiten además darnos una idea de la magnitud las fuerzas intermoleculares de la sustancia que hacen que sus moléculas se alejen o se aglomeren. Adicionalmente este trabajo nos ayuda a visualizar los efectos de los cambios de temperatura y presión sobre las propiedades de una sustancia.; las diferentes sustancias pueden tener comportamientos similares entre ellas, estos comportamientos son determinados por configuraciones especificas de temperatura y presión y se visualizan en el factor de compresibilidad Z. 6. BIBLIOGRAFÍA . Libro Koretsky segunda edición. . Tablas del libro de Shapiro segunda edición. . Artículo: Medición del factor de compresibilidad de gases: un experimento de laboratorio de química física. (Compartido por la profesora el semestre pasado).