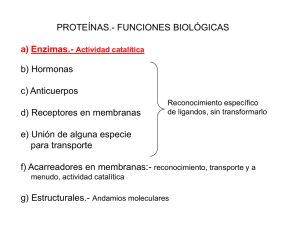
Semana 4-Sección 7-2019 BIOQUÍMICA 2 Estrategias catalíticas Facultad de Ciencias de la Salud Bioquímica – Dra. María del Pilar Navarro – Sesión 01 6/11/2020 3 Objetivos • Conocer la estrategias catalíticas de las enzimas Agenda: 1. 2. 3. 4. 5. 6. Introducción Catálisis covalente Catálisis ácido-base Catálisis por aproximación Catálisis por ion metálico Conclusiones Introducción Estrategias catalíticas: (Mecanismos de acción de las enzimas) Proceso en donde el enzima facilita la formación del estado de transición, mediante la utilización de la energía de unión de Enzima y Sustrato por adaptación inducida. La energía de unión tiene como función: 1. Establecer la especificidad del sustrato 2. Aumentar la eficacia catalítica 6 Introducción Sustrato (S) correcto interacciona con el enzima y potencia la energía de unión (Especificidad de la E por el S) Formación del complejo E-S (estabilizar el estado de transición-disminuyendo la energía de activación) La energía de unión promueve cambios estructurales en el E y el S favoreciendo la catálisis por el modelo de adaptación inducida 7 Introducción Mecanismos de acción de las enzimas para conllevar la catálisis de las reacciones, pueden ser: 1. 2. 3. 4. Catálisis Catálisis Catálisis Catálisis covalente ácido-base por aproximación por ion metálico 8 Catálisis covalente El centro activo del enzima presentan algunos residuos de aminoácidos con cadena lateral con grupos nucleofílicos o electrofílicos, los cuales pueden formar enlaces covalentes unidos con el sustrato para formar un intermediarios 1. 2. Grupos nucleofílicos: reactivos que suplen un par de electrones. Están usualmente cargados negativamente o positivamente. Grupos electrofílicos: Reactivos que tienen un orbital vacío, los cuales pueden aceptar un par de electrones. Están cargado positivamente y negativamente. 9 Catálisis covalente • • Es secretada por los acinos del páncreas, como enzima inactiva (zimógeno). Convertida a quimiotripsina por la tripsina, y posterior autodigestión de la quimiotripsina (intestino delgado) Esta formada por tres cadenas polipéptidicas enlazadas por puentes disulfuros 10 Catálisis covalente Quimiotripsina Rompe los enlaces peptídicos del extremo carboxilo de aminoácidos con grupo R aromáticos y apolares alifáticos 11 Rompe a las proteínas en el extremo carboxilo de aminoácidos aromáticos o hidrofóbicos Quimiotripsina 12 Catálisis covalente Triada catalítica Grupo nucleofílico Ser 195 13 Catálisis covalente Quimiotripsina Triada catalítica La conformación de estos residuos es estabilizada por puentes de hidrógeno 14 Catalisis covalente de la quimiotripsina Bolsillo hidrófobico es donde se acomodan las cadenas laterales de Phe y Trp Lugar de ruptura ComplejoES Estado de transición 1er. Intermediario Acil-E Generar la enzima libre Complejo acilE +H2O (Hidrólisis para liberar el ácido carboxílico y liberar la E) H2O transfiere el H+ a la His y el OH al sustrato 15 Catálisis covalente Triada catalítica Quimiotripsina Tripsina Elastasa Presentan la mismo estrategia catalítica, pero actúan sobre aminoácidos diferentes 16 Quimiotripsina Tripsina Elastasa 216 Val 190 189 17 18 2. Catálisis ácido-base 19 2. Catálisis ácido-base 1. Una molécula diferente al agua actúa como dador o aceptor de un protón. 20 21 2. Catálisis ácido-base 1. Una molécula diferente al agua actúa como dador o aceptor de un protón. Quimiotripsina Actúa como catalizador básico para aumentar el poder nucleofílico de la Ser195 22 2. Catálisis ácido-base 1. Una molécula diferente al agua actúa como dador o aceptor de un protón. • • Las facilitan la unión de H+ de una molécula de agua unida al Zn+2 para formar OH Tres centros de coordinación ocupados por anillos de imidazol de tres His (94, 96 y 119). Un centro de coordinación adicional formado por H2O o por OH dependiendo del pH. Anhidrasa carbónica 23 2. Catálisis ácido-base Reacción catalizada por la Anhidrasa carbónica 24 2. Catálisis ácido-base Reacción catalizada por la Anhidrasa carbónica 1. Zn+2 facilita la liberación de un protón de una molécula de H2O, generando un ion OH 25 2. Catálisis ácido-base Reacción catalizada por la Anhidrasa carbónica 2. El CO2 se une al centro activo del enzima y se posiciona para reaccionar con el OH- 26 2. Catálisis ácido-base Reacción catalizada por la Anhidrasa carbónica 3. El OH- ataca al CO2 convirtiéndolo en ion HCO3- 4. El centro catalítico se regenera con la liberación del HCO3- y la unión de otra molécula de agua 27 3. Catálisis por aproximación 28 3. Catálisis por aproximación Daniel Koshland 1920 – 2007, las enzimas orientan y aproximan los grupos reactivos. 1.La combinación de los factores de proximidad y orientación favorece que los sustratos se unan al centro activo, lo cual explica los incrementos de velocidad observados en algunas reacciones catalizadas enzimáticamente. los enzimas todavía pueden utilizar la energía de fijación de un modo adicional para producir catálisis. 2.Proximidad: Aumenta la velocidad de la reacción como las interacciones enzimasustrato alinean grupos químicos reactivos y los mantienen juntos. Reduce la entropía de los reactivos y por lo tanto hace que las reacciones tales como las ligaduras o reacciones de adición sean más favorables. 3.Orientación:El efecto de orientación tiene en cuenta la orientación/disposición espacial de las sustancias reaccionantes. 29 3. Catálisis por aproximación La anhidrasa carbónica se une al dióxido de carbono y al agua en centros adyacentes para facilitar su reacción. 30 4. Catálisis por ion metálico 31 Catálisis por iones metálicos • Existen enzimas que requiere la presencia de iones metálicos para su actividad catalítica. • Clases de enzimas que requieren iones metálicos. 1. Metaloenzimas: Contiene iones metálicos fuerte mente unidos, metales de transición (Fe+2 , Fe+3 , Cu+2 , Zn+2 , Mn+2 , Co+3 ). 2. Enzimas activados por metal: Fijan débilmente metales presentes en una solución (Na+ , K+ , Mg+2 o Ca+2 ). 32 Catálisis por iones metálicos Metaloenzimas: El ion facilita la formación de nucleófilo como el ion OH Anhidrasa carbónica 33 Catálisis por iones metálicos Enzimas activados por metal (estrategia utilizada por miosina y enzimas que utilizan ATP). ADN y ARN polimerasa Iones (Mg+2; Mn+2) orientan y estabilizan electrostáticamente el grupo trifosfato cargados negativamente en los desoxinucleótidos y ribonucleótidos. El ion metálico forma un puente entre el enzima y el sustrato, incrementando la energía de unión, lo que mantiene al sustrato en una conformación adecuada. 34 4. Catálisis por ion metálico Los iones metálicos participan en el proceso catalítico de tres modos principales: 1. Fijándose a sustratos, de modo que los orientan adecuadamente para la reacción. 2. Facilitando reacciones de oxido-reducción, mediante cambios reversibles en el estado de oxidación del ion metálico. 3. Estabilizando o apantallando electrostáticamente las cargas negativas. 35 Conclusiones -Las enzimas presentan mecanismos de acción para llevar a cabo reacciones específicas. -Las actividades de las enzimas regulan la reacciones bioquímicas mediante distintas estrategias catalíticas. 36 2019 MUCHAS GRACIAS 37