Potenciometria: corbes de valoració
Anuncio
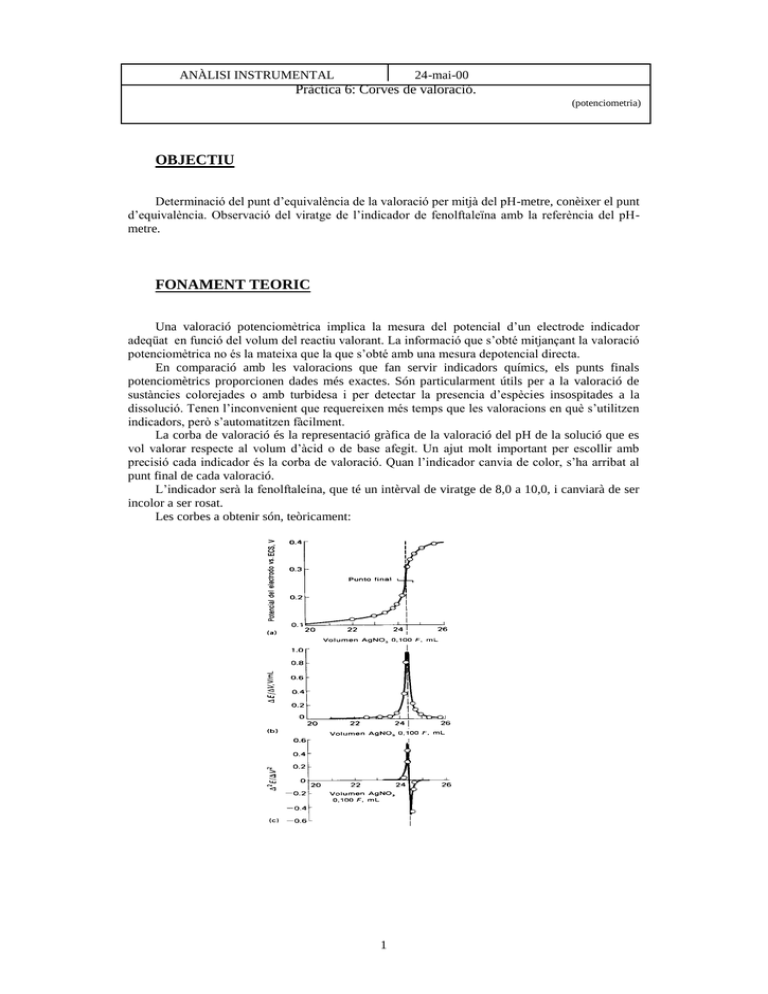
ANÀLISI INSTRUMENTAL 24-mai-00 Pràctica 6: Corves de valoració. (potenciometria) OBJECTIU Determinació del punt d’equivalència de la valoració per mitjà del pH-metre, conèixer el punt d’equivalència. Observació del viratge de l’indicador de fenolftaleïna amb la referència del pHmetre. FONAMENT TEORIC Una valoració potenciomètrica implica la mesura del potencial d’un electrode indicador adeqüat en funció del volum del reactiu valorant. La informació que s’obté mitjançant la valoració potenciomètrica no és la mateixa que la que s’obté amb una mesura depotencial directa. En comparació amb les valoracions que fan servir indicadors químics, els punts finals potenciomètrics proporcionen dades més exactes. Són particularment útils per a la valoració de sustàncies colorejades o amb turbidesa i per detectar la presencia d’espècies insospitades a la dissolució. Tenen l’inconvenient que requereixen més temps que les valoracions en què s’utilitzen indicadors, però s’automatitzen fàcilment. La corba de valoració és la representació gràfica de la valoració del pH de la solució que es vol valorar respecte al volum d’àcid o de base afegit. Un ajut molt important per escollir amb precisió cada indicador és la corba de valoració. Quan l’indicador canvia de color, s’ha arribat al punt final de cada valoració. L’indicador serà la fenolftaleína, que té un intèrval de viratge de 8,0 a 10,0, i canviarà de ser incolor a ser rosat. Les corbes a obtenir són, teòricament: 1 En funció del mètode que es faci servir per a detectar el punt final. MATERIAL PH-metre. Vasos de precipitats de 100 ml. Bureta de 50 ml. Pipetes de 5 i 10 ml. Agitador magnètic. Suport. Nous. Pinces. REACTIUS Hidròxid sódic (NaOH) 0,1N comercial. Corrosiu C R35: Provoca cremadures greus. S26: En cas de contacte amb els ulls, rentar amb aigua abundant i anar al metge. S36/37/39: Fer servir indumentaria i guants adeqüats i protecció per als ulls/la cara. S45: En cas d’accident o malestar, acudir al metge (si es possible, mostrar-li l’etiqueta). Acid clorhídric (HCl) 0,1N; 1,19 g/ml; 37%. Corrosiu, C i Irritant Xi R34: Provoca cremadures. R37: Irrita les vies respiratories. S26: En cas de contacte amb els ulls, rentar amb aigua abundant i anar al metge. S36/37/39: Fer servir indumentaria i guants adeqüats i protecció per als ulls/la cara. S45: En cas d’accident o malestar, acudir al metge (si es possible, mostrar-li l’etiqueta). Fenolftaleína (C20H14O4) Acid acètic 0,1 M. (CH3COOH). Irritant, Xi S26: En cas de contacte amb els ulls, rentar amb aigua abundant i anar al metge. R36/38: Irrita els ulls i la pell. 2 MÈTODE Corba de valoració àcid fort – base forta 1. 2. 3. 4. 5. 6. 7. Ompliu la bureta amb la dissolució 0,1 N de NaOH. Mesureu 20 ml de la dissolució d’àcid clorhídric 0,1 M i poseu-los dins d’un vas de precipitats, afegiu dues gotes de fenolfaleïna. Introduiu l’electrode de vidre, prèviament calibrat, tot agitant magnèticament i anoteu el valor del pH. Calculeu el volum de dissolució d’hidròxid sòdic necessari per neutralitzar els 20 ml de la dissolució d’àcid clorhídric 0,1 M. Aneu afegint petits volums de NaOH de la bureta mesurant el pH després de cada adició. Anoteu el pH en el moment del viratge de l’indicador i afegiu fins a 10 ml més d’hidròxid de sodi. Construirem la corba de valoració quan s’afegeix gradualment dissolució de NaOH 0,1 M a 20,0 ml de solució de HCl 0,1 M. Corba de valoració àcid feble – base forta 1. 2. 3. 4. 5. 6. 7. Ompliu la bureta amb la dissolució de NaOH 0,1 M. Mesureu 20 ml d’àcid acètic 0,1 M i poseu-los dins d’un vas de precipitats, afegiu-hi dues gotes de fenolftaleïna. Introduïu l’electrode de vidre, prèviament calibrar, tot agitant magnèticament i anoteu el valor del pH. Aneu afegint petits volums de NaOH 0,1M de la bureta, mesurant el pH després de cada addició. Anoteu el pH en el moment del viratge de l’indicador, i afegiu 5 ml més d’hidròxid de sodi. Anoteu els valors dels pH corresponents. Construïu la gràfica de pH enfront dels volums de NaOH 0,1 M. RESULTATS I CÀLCULS Per a la valoració de HCl 0,1 N amb NaOH 0,1 N ml afegits pH increment pH increment ml afegits increment pH/increment ml afegits 0 1,4 5 1,66 0,26 5 0,1566 10 1,83 0,17 5 0,0929 15 2,04 0,21 5 0,1029 18 2,37 0,33 3 0,1392 19 2,51 0,14 1 0,0558 19,5 2,61 0,1 0,5 0,0383 19,6 2,64 0,03 0,1 0,0114 19,7 2,67 0,03 0,1 0,0112 19,8 2,69 0,02 0,1 0,0074 19,9 2,71 0,02 0,1 0,0074 20 2,75 0,04 0,1 0,0145 20,1 2,77 0,02 0,1 0,0072 20,2 2,82 0,05 0,1 0,0177 20,3 2,85 0,03 0,1 0,0105 20,4 2,88 0,03 0,1 0,0104 20,5 2,92 0,04 0,1 0,0137 20,6 2,97 0,05 0,1 0,0168 3 20,7 20,8 20,9 21 21,1 21,2 21,3 21,4 21,5 21,6 21,8 22 22,5 23 23,5 24 24,5 25 3,04 3,11 3,17 3,24 3,36 3,54 3,75 3,95 5,25 8,04 9,55 10,22 10,77 11,03 11,2 11,34 11,41 11,48 0,07 0,07 0,06 0,07 0,12 0,18 0,21 0,2 1,3 2,79 1,51 0,67 0,55 0,26 0,17 0,14 0,07 0,07 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,2 0,2 0,5 0,5 0,5 0,5 0,5 0,5 0,0230 0,0225 0,0189 0,0216 0,0357 0,0508 0,0560 0,0506 0,2476 0,3470 0,1581 0,0656 0,0511 0,0236 0,0152 0,0123 0,0061 0,0061 H C l/N aO H 14 12 8 6 4 2 m l a fe g its 4 24 ,5 22 ,6 21 ,3 21 21 ,7 20 ,4 20 ,1 20 ,8 19 ,5 19 15 0 0 pH 10 H C l/N aO H 0 ,4 0 0 0 in c .p H /i n c .v o l. 0 ,3 5 0 0 0 ,3 0 0 0 0 ,2 5 0 0 0 ,2 0 0 0 0 ,1 5 0 0 0 ,1 0 0 0 0 ,0 5 0 0 24 ,5 22 ,6 21 ,3 21 21 ,7 20 ,4 20 ,1 20 ,8 19 ,5 19 15 0 0 ,0 0 0 0 m l a fe g its Apart de la determinació gràfica, (21,6 ml NaOH) trobem que la màxima inflexió es troba entre 21,5 i 21,6 ml a la primera valoració, de forma que es pot considerar el punt d’equivalència com 21,55 ml NaOH 0,1N. La valoració d’àcid acètic 0,1 M amb sosa 0,1 M. ml afegits 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 17,1 17,2 17,3 17,4 17,5 pH 3,07 3,33 3,8 3,97 4,12 4,24 4,36 4,47 4,55 4,66 4,75 4,84 4,94 5,04 5,116 5,29 5,45 5,65 5,68 5,7 5,75 5,77 5,8 Increment pH increment ml afegits 0,26 0,47 0,17 0,15 0,12 0,12 0,11 0,08 0,11 0,09 0,09 0,1 0,1 0,076 0,174 0,16 0,2 0,03 0,02 0,05 0,02 0,03 increment pH/increment ml afegits 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0,1 0,1 0,1 0,1 0,1 5 0,0781 0,1237 0,0428 0,0364 0,0283 0,0275 0,0246 0,0176 0,0236 0,0189 0,0186 0,0202 0,0198 0,0149 0,0329 0,0294 0,0354 0,0053 0,0035 0,0087 0,0035 0,0052 17,6 17,7 17,8 17,9 18 18,1 18,2 18,3 18,4 18,5 18,6 18,7 18,8 18,9 19 19,1 19,2 19,3 19,4 19,5 19,6 19,7 19,8 19,9 20 21 22 23 24 25 5,83 5,87 5,95 6,01 6,05 6,11 6,19 6,27 6,34 6,42 6,5 6,56 6,78 7 7,93 9,28 9,88 10,08 10,35 10,45 10,56 10,62 10,71 10,73 10,79 11,19 11,33 11,47 11,56 11,65 0,03 0,04 0,08 0,06 0,04 0,06 0,08 0,08 0,07 0,08 0,08 0,06 0,22 0,22 0,93 1,35 0,6 0,2 0,27 0,1 0,11 0,06 0,09 0,02 0,06 0,4 0,14 0,14 0,09 0,09 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 1 1 1 1 1 0,0051 0,0068 0,0134 0,0100 0,0066 0,0098 0,0129 0,0128 0,0110 0,0125 0,0123 0,0091 0,0324 0,0314 0,1173 0,1455 0,0607 0,0198 0,0261 0,0096 0,0104 0,0056 0,0084 0,0019 0,0056 0,0357 0,0124 0,0122 0,0078 0,0077 Ac .a c é tic /N a O H 14 12 8 6 4 2 ml afegits 6 25 21 ,7 19 ,3 19 ,9 18 ,5 18 ,1 18 ,7 17 ,3 17 16 12 8 4 0 0 pH 10 Ac .a c é tic /N a O H in c r.p H /in c r.v o lu m 0 ,1 6 0 0 0 ,1 4 0 0 0 ,1 2 0 0 0 ,1 0 0 0 0 ,0 8 0 0 0 ,0 6 0 0 0 ,0 4 0 0 0 ,0 2 0 0 25 21 1 9 ,7 1 9 ,3 1 8 ,9 1 8 ,5 1 8 ,1 1 7 ,7 1 7 ,3 16 12 8 4 0 0 ,0 0 0 0 ml afegits A la segona valoració tenim un punt d’equivalència entre 19 i 19,1, per tant anotem 19,05 ml NaOH com a punt d’inflexió. Segons la gràfica, el punt d’equivalència seria 19,1 ml. El punt teòric es de 20 ml a les dues valoracions, ja que, segons les reaccions que es produeixen: NaOH + HCl NaOH + NaCl + H 2O CH3COOH CH 3COONa + H 2O I tenint en compte que les dissolucions tenen la mateixa concentració, 1 unitat de volum de base equival a 1 unitat de volum d’àcid (sempre parlant de la teoria). OBSERVACIONS 1. 2. 3. 4. La primera valoració (NaOH 0,1 N amb HCl 0,1 N) l’hem repetit dues vegades per problemes amb el maneig de l’instrumental. L’origen de les dissolucions de NaOH 0,1 M i HCl 0,1 M ja deixa esperar uns resultats tan poc ajustats a la realitat com els obtinguts. Provenen d’agrupar diferents dissolucions amb diferents factors. El mètode per a determinar el punt final de les valoracions integrades ha estat extret de la bibliografia, i es justifica tenint en compte que el punt d’inflexió no es pot determinar de forma exacta si és el primer salt o el segon, per això es relacionen els dos punts més alts de la taula de dades. Durant la pràctica tracto de normalitat i de molaritat indistintament per ser equivalent a totes les espècies químiques que intervenen a la pràctica. 7 BIBLIOGRAFIA Catálogo MERCK de productos químicos. Química analítica. Skoog/West. 8



