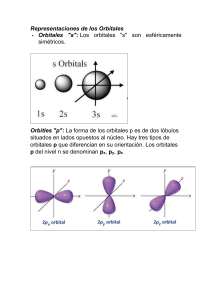
Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico • Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple. • Los átomos pueden compartir 1, 2 o 3 pares de electrones Formando enlaces simples, dobles o triples, • Otros tipos de enlace son formados por átomos cargados (iónico) y átomos metálicos (metálico). 1 Teoría de enlace valencia Las funciones solución como combinaciones lineales de las funciones de onda (orbitales) de un átomo que describen los dos estados posibles. Ψ uv c11 c 2 2 Teoría de enlace valencia Dos formas en que se encuentra un mínimo: 1 2 c1 c 2 1 c1 c 2 1 1 2 1 ( 1 2 ) 2 1 ( 1 2 ) 2 2 Teoría de enlace valencia Dos formas en que se encuentra un mínimo: c1 c 2 1 1 2 (12 22 21 2 ) 2 c1 c 2 1 1 2 (12 22 21 2 ) 2 Orbitales Moleculares Si hay orbitales en los átomos, ¿por qué no ha de haber orbitales en las moléculas? Para que haya orbitales en las moléculas es necesario construir funciones de onda monoelectrónicas para las moléculas. 3 Orbitales Moleculares (2) Para que haya orbitales en las moléculas es necesario construir funciones de onda mono electrónicas para las moléculas. Orbitales Moleculares (3) Los orbitales moleculares se construyen mediante una combinación lineal de orbitales atómicos (Método LCAO) de los átomos que forman parte de la molécula. Todos los átomos de la molécula contribuyen con sus orbitales atómicos para formar los orbitales moleculares. OM Nc1 A c 2 B ... 4 Orbitales Moleculares (4) Los electrones que en un principio correspondían a un átomo al estar en los orbitales atómicos, ahora pertenecen a todos los átomos que forman la molécula al estar en los orbitales moleculares. OM Nc1 A c 2 B ... Orbitales Moleculares (5) Objetivos; Los objetivos de la teoría de orbitales moleculares es describir moléculas de forma similar a como describimos átomos, esto es, en términos de orbitales, diagramas de energía de los orbitales y configuración electrónica. OM Nc1 A c 2 B ... 5 Diagrama de energía de la formación de un enlace sigma por traslape orbital Orbitales Atómicos y Moleculares Mezclado de Orbitales Cuando los átomos comparten electrones forman un enlace, sus orbitales atómicos se mezclan para formar enlaces moleculares . A fin de que estos orbitales se puedan mezclar ellos deben: Tener niveles de energía similares. Tener buen traslape. Estar cercanos. Este es un ejemplo del mezclado de orbitales. Los dos átomos comparten un electrón de su capa exterior . En este caso. Ambos orbitales 1s traslapan y comparten sus electrones de valencia. http://library.thinkquest.org/27819/ch2_2.shtml 6 Ejemplos de formación de enlace Sigma (s) Orbitales Atómicos y Moleculares (cont.…) En átomos, los electrones ocupan orbitales atómicos, pero en moléculas ocupan orbitales moleculares similares en los cuales rodean a la molécula. Los 2 orbitales atómicos 1s se combinan para formar 2 orbitales moleculares, uno de enlace (s) y uno de antienlace (s*). Diagrama de orbitales moleculares para H2. • Nótese que un electrón de cada átomo es “compartido” para formar un enlace covalente. Este es un ejemplo de mezclado de orbitales. http://www.ch.ic.ac.uk/vchemlib/course/mo_theory/main.html 7 Teoría del Orbital Molecular Cada línea en el diagrama representa un orbital. El volumen de orbital molecular comprende a la molécula en su totalidad. Los electrones ocupan los orbitales moleculares de moléculas como lo hacen en los orbitales atómicos de los átomos Teoría del Orbital Molecular Electrones van en los orbitales de menor energía disponibles para formar menor energía potencial para la molécula. El numero máximo de electrones en cada orbital molecular es 2 (principio de exclusión de Pauli ) Un electrón va en orbitales de igual energía, con espín paralelo, antes de empezar a formar pares. (Regla de Hund.) 8 Energía como función de la longitud de enlace para H2+ 9 Diatómicas homo nucleares La combinación de orbitales 1s da dos valores en la energía: Un orbital s1s de enlace (menor energía que los 1s separados) Un orbital s1s de antienlace (mayor energía que los 1s separados) E Diatómicas homo nucleares 10 Diatómicas homo nucleares Diatómicas homo nucleares La combinación de orbitales 2p da: Un orbital s2p de enlace. Un orbital s2p de antienlace. Dos orbitales 2p de enlace (x, y). Dos orbitales 2p de antienlace (x , y ) 11 Diatómicas homo nucleares Diatómicas homo nucleares 12 Diatómicas homo nucleares General 13 Principio de Aufbau para moléculas De hidrogeno a nitrógeno; 2p s2p s1s s1s s2s s2s 2px = 2py s2p 2px = 2py s2p Principio de Aufbau para moléculas E De oxígeno a neón; s2p 2p s1s s1s s2s s2s s2p 2px = 2py 2px = 2py s2p 14 Diagrama de Orbitales Moleculares (H2+) Diagrama de Orbitales Moleculares (H2+) 15 Diagrama de Orbitales Moleculares (H2) http://www.ch.ic.ac.uk/vchemlib/course/mo_theory/main.html H2 Configuración electrónica (s 1s)2 16 H2 Configuración electrónica (s 1s)2 Orden de enlace Orden de enlace (o de unión) = (número de electrones en orbital de enlace - número de electrones en orbital de antienlace) / 2 17 H2 OE = (2-0)/2 = 1 H–H M = 2S + 1 = 2(0) + 1 = 1 Singulete Propiedades magnéticas Si la molécula tiene electrones desapareados paramagnética (es repelida por campos magnéticos). Si la molécula no tiene electrones desapareados diamagnética (es atraída por campos magnéticos). H2 es diamagnética. ¿ H2+? 18 H2+ ¿Configuración electrónica? (s 1s)1 ¿ Orden de enlace? OE = (1-0)/2 = ½ H2+ ¿ Propiedades magnéticas? Paramagnética ¿Multiplicidad? M = 2S + 1 = 2(½) + 1 = 2 Doblete 19 He2 ¿ Orden de enlace? OE = (2-2)/2 = 0 He2 No existe He2+ • ¿Configuración electrónica? (s 1s)2 (s 1s*)1 • ¿Orden de enlace? OE = (2-1)/2 = ½ ¿Propiedades magnéticas? Paramagnética ¿Multiplicidad de espín? M = 2(½) + 1 = 2 Doblete 20 Li2 Orden de enlace: OE = (4-2)/2 = 1 Multiplicidad: M = 2(0) + 1 = 1 singulete ¿ Propiedades magnéticas? Diamagnética 21 Li2 LUMO (Low energy Unoccupied Molecular Orbit) orbital molecular ocupado de menor energía. Orbitales Frontera HOMO (High energy Occupied Molecular Orbit) orbital molecular ocupado de mayor energía. Be2 • Orden de enlace: OE = (4-4)/2 = 0 Be2 No existe 22 B2 Configuración electrónica (s 1s)2 (s 1s*)2 (s 2s)2 (s 2s*)2 ( 2px)1 ( 2py)1 Orden de enlace: OE = (6-4)/2 = 1 Paramagnética. M = 2(1) + 1 = 3 Triplete C2 Configuración electrónica (s 1s)2 (s 1s*)2 (s 2s)2 (s 2s*)2 ( 2px)2 ( 2py)2 Orden de enlace: OE = (8-4)/2 = 2 (C= C) Diamagnética. M = 2(0) + 1 = 1 Singulete 23 N2 Configuración electrónica (s 1s)2 (s 1s*)2 (s 2s)2 (s 2s*)2 ( 2px)2 ( 2py)2 (s 2p)2 Orden de enlace: OE = (10-4)/2 = 3 N N Diamagnética. M = 2(0) + 1 = 1 Singulete O2 Configuración electrónica (s 1s)2(s 1s*)2(s 2s)2(s2s*)2 (s 2p)2( 2px)2( 2py)2 ( 2px*)1( 2py*)1 Orden de enlace: OE = (10-6)/2 = 2 O= O ¿Multiplicidad? La teoría de orbitales M = 2(1) + 1 = 3 Triplete moleculares es la única que Paramagnética. predice el paramagnetismo del oxígeno. 24 Diagrama de OM para O2 http://www.chem.uncc.edu/faculty/murphy/1251/slides/C19b/sld027.htm O2 M = 2(1) + 1 = 3 Triplete 25 Paramagnetismo del O2 F2 Configuración electrónica: (s 1s )2(s 1s*)2(s2s )2(s2s*)2(s2p)2(2 2 2 2 2 px) ( 2py) ( 2px*) ( 2py*) Orden de enlace: OE = (10-8)/2 = 1 F- F Diamagnética. M = 2(0) + 1 = 1 Singulete 26 Ne2 • Orden de enlace: OE = (10-10)/2 = 0 Ne2 No existe Resumen Molec . O. E. OMF H2 1 HOMO + LUMO He2 0 Desconocida Li2 1 HOMO + LUMO Be2 0 Desconocida B2 1 HOMO + LUMO C2 2 HOMO + LUMO N2 3 HOMO + LUMO O2 2 HOMO + LUMO F2 1 HOMO + LUMO Ne2 0 Desconocida Especies de orden cero, son todas desconocidas, mientras aquellas de orden > 0 son todas conocidas... Aunque no necesariamente como materiales estables a temperatura ambiente. Especies diatómicas de Litio, boro y carbono 'polimerizan' como materiales metálicos o como redes covalentes. 27 Moléculas diatómicas hetero-nucleares La teoría OM puede ser usada para describir moléculas diatómicas heteronucleares & Iones moleculares como: • LiH Hidruro de Litio • HF Fluoruro de Hidrógeno • CO Monóxido de Carbon • CN– Ion Cianuro 28 Moléculas diatómicas hetero-nucleares Como la diferencia de electronegatividad aumenta, los orbitales interactuantes tendrán diferentes energías. El resultado es que la energía de enlace covalente disminuye, contrario a un incremento en la atracción electrostática +/– la cual no esta representada en el diagrama de OM. Requisitos de los orbitales interactuantes; • Similar energía • Igual simetría Moléculas diatómicas hetero-nucleares (CO) CO (monóxido de carbono) • Orden de enlace: OE = (6-0)/2 = 3 C O Singulete (diamagnética) Especie isoelectrónica con N2 29 Moléculas diatómicas hetero-nucleares (CO) Diagrama de orbitales moleculares y trazo de los orbitales moleculares para la molécula de CO Moléculas diatómicas hetero-nucleares (HF) HF (fluoruro de hidrógeno) • Orden de enlace: OE = (2-0)/2 = 1 H—F Singulete (diamagnética) 30 Diagrama de Orbitales Moleculares (HF) http://www.ch.ic.ac.uk/vchemlib/course/mo_theory/main.html Moléculas diatómicas hetero-nucleares Los iones diatomicos heteronucleares cianuro , CN –, y nitrosonio , NO+, son también isoelectrónicos con dinitrógeno, N2, y al monóxido de carbono. La única diferencia entre los diagramas de OM son las relativas energías de los orbitales. 31 Orbitales Molecular para moléculas poliatómicas El concepto de orbital molecular es extendido a proveer una descripción de la estructura electrónica de una poli-atómicas molécula. Además, la teoría del orbital molecular forma las bases para muchas de las investigaciones teóricas cuantitativas de las propiedades de moléculas grandes. Orbitales Molecular para moléculas poliatómicas En general, un orbital molecular en un sistema poli atómico se extiende sobre todos los núcleos en la molécula. Si comprendemos y predecimos las propiedades espaciales de los orbitales, entonces haremos uso de las propiedades de simetría poseídas por el “esqueleto” nuclear . Un análisis de los orbitales moleculares para la molécula de agua provee una buena introducción a la forma en la cual la simetría de una molécula determina la forma de los orbitales molecular en un sistema poli-atómico. 32 Diagrama de Orbitales Moleculares (H2O) Diagrama de Orbitales Moleculares (CH4) Así, si tenemos moléculas con mas de dos átomos, los diagramas de OM pueden también ser usados para moléculas grandes. http://www.ch.ic.ac.uk/vchemlib/course/mo_theory/main.html 33