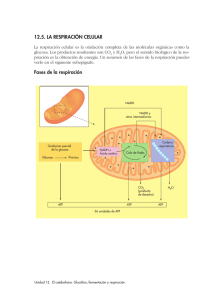
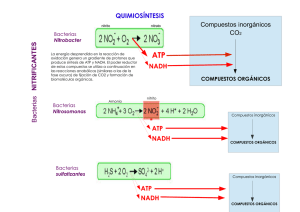
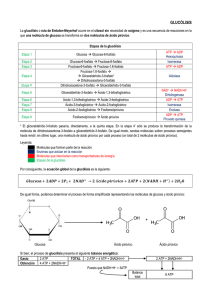
Guía de estudio bioquímica parcial 2. RESPIRACION CELULAR. Es el proceso por el cual la energía química de las moléculas de "alimento" es liberada y parcialmente capturada en forma de ATP. Los carbohidratos, grasas y proteínas pueden ser usados como fuentes de energía en respiración celular. La glucosa es el ejemplo más común para examinar las reacciones y caminos involucrados. Algunas moléculas que participan en el metabolismo energético: • La Glucólisis.- Se lleva acabo en el citoplasma. FAD.- Participa en la ocidacion y reducción y ciclo de Krebs. NAD+ NAD.- Participa en la glucolisis. • El Ciclo de Krebs.- Se lleva a cabo en la matriz Procesos metabolicos Coenzima A. de la mitondria. • La Fosforilación oxidativa o cadena de Anaeróbicas: No consumen oxígeno libre. transporte de e-.- Se lleva a cabo en la Vías Metabólicas Aeróbicas: Consumen oxígeno libre. membrana interna de la mitocondria Ocurre en el citoplasma, en ausencia de oxígeno (reacción anaeróbica o anaerobia). La Glucosa (azúcar de 6 carbonos) se rompe en dos moléculas de tres carbonos llamadas piruvato. Ganancia neta de 2 moléculas de ATP y 2 moléculas de NADH. Via anareobica. Enfermedades: Enzima deficiente: Glucosa 6- fosfatasa. * Enfermedad de Von Gierke Datos clínicos: Acumulación de glucógeno en el hígado y en la células de los túbulos renales Enfermedad de pompe Glucolisis Enzima deficiente: Mastasa acida o lisosomal (glucosa no pasa a glucogeno). Datos clínicos: Acumulacion de glucogeno en los lisosomas Enfermedad de Forbe o de Cori Dextrinosis limite. Enzima deficiente: enzima desramificadora hepática y muscular. Datos clínicos: Debilidad musculara. Enzima deficiente: enzima desramificadora hepática y muscular. Datos clínicos: No hay debilidad musculara. Enfermedad de Tarui Enfermedad de Andersen Sindrome de McArdle Enzima deficiente: Enzima remificadora. Datos clínicos: Acumulacion de polisacáridos con pocos puntos de de ramificación. Enzima deficiente: Fosforilasa muscular Datos clínicos: Poca tolerancia de ejercicio y glucógeno muscular elevado. Enzima deficiente: Enfermedad de Fosforilasa hepática Hers Datos clínicos: Acuulacion de glucogeno en el higado. Enzima deficiente: Fosfofructocinasa. Datos clínicos: no comer carbohidratos y dolor muscular • A la falta de oxígeno, el ácido pirúvico puede convertirse en etanol (alcohol etílico) o ácido láctico según el tipo de célula • El ácido pirúvico formado en la glucólisis se convierte anaeróbicamente en etanol. • En el primer caso se libera dióxido de carbono, y en el segundo se oxida el NADH y se reduce a acetaldehído. Alcohólica: 2 ácido pirúvico + 2 NADH ⇒ 2 etanol + 2 CO2 + 2 NAD+ Fermentación Alcohólica Protozoarios, Protistas (levaduras) Fermentación Láctica. Células animales Ciclo de Krebs Reacciones Aeróbicas En esta reacción el NADH se oxida y el ácido pirúvico se reduce transformándose en ácido láctico. En las células musculares como resultado de ejercicios extenuantes durante los cuales el aporte de oxígeno no alcanza a cubrir las necesidades del metabolismo celular. Láctica: 2 ácido pirúvico + 2 NADH ⇒ 2 ácido láctico + 2 NAD+ Se lleva a cabo en la matriz mitocondrial. El Piruvato es transportado dentro de la mitocondria y pierde dióxido de carbono para formar la Acetil Coenzima A (Acetil CoA), una molécula de dos carbonos. Cuando la acetil CoA es oxidada a dióxido de carbono en el ciclo de Krebs, la energía química es liberada y capturada en forma de NADH, FADH2 y ATP Preparación del Ácido Pirúvico Ciclo de krebs El ácido pirúvico sale del citoplasma y atraviesa las membranas externa e interna de las mitocondrias. Antes de ingresar al Ciclo de Krebs, el ácido pirúvico, (3 C), se oxida. carbono (descarboxilación oxidativa) y queda un grupo acetilo (AcetilCoA), de dos carbonos. En esta reacción exergónica, el hidrógeno del carboxilo reduce a una molécula de NAD+ a NADH. Rendimiento es por cada grupo acetilo que ingresa al ciclo: 2 moléculas de CO2. 1 molécula de ATP. 3 moléculas de NADH. 1 molécula de FADH2. Ambas moléculas son transportadores de electrones y transfieren energía al ATP por la vía de la cadena de transporte de electrones. Fosforilación oxidativa por la Cadena de transporte de electrones Permite la liberación de una gran cantidad de energía química almacenada en el NAD+ que había sido reducido a NADH y FAD reducido a FADH2. La energía liberada es capturada en la forma de un ATP: 3 ATP por NADH y 2 ATP por FADH2. Los transportadores de electrones se reducen y oxidan para ir cediendo electrones siendo el Oxigeno el aceptor final de electrones Mecanismos producción ATP Tiene 3 fases: 1.-Glucolisis 2.- ciclo de Krebs 3.- Fosforilación oxidativa. Fosforilación (adición de un grupo fosfato al ADP). Teoría de la quimiósmosis: se da en las membranas, por medio de la actividad de la ATP sintetasa. Uso de la energía almacenada en el gradiente de concentración de iones H+ CADENA RESPIRATORIA. Oxidación Ganancia de oxígeno Pérdida de e- o hidrógenos Reducción Pérdida de oxígeno Ganancia de e- o hidrógenos Complejos Coenzima A se encuentra en la mitocondria y forma Acetil Co A. Componentes de la cadena respiratoria Flavoproteínas-. Tienen Flavina como grupo prostético. Centros Sulfoférricos.- Contienen hierro no hemínico, unido a azufre Coenzima Q o Ubiquinona.- No unida a Proteínas y se aloja en la porción no polar de la membrana plasmática Citocromos.- Son hemoproteínas • El Fe 3+ capta e- • Hay varios tipos: a: a y a3 b: b566 y b562 c: c y c1 • Orden: potencial de reducción creciente b566 - b562 - c1 – c - a – a3 Complejo I: NADH DESIDROGENASA - Coenzima Q reductasa.- Es donde ingresa la mayoría de los electrones a la cadena. Los electrones son transferidos desde NADH a CoQ a traves del FMN que es partes del complejo I. (Rotenona, Amital) 3ATP. Complejo II: Succinato Deshidrogenasa- Coenzima Q reductasa.- Otro punto de entrada de electrones a la cadena, exclusivo de Krebs, succinato se convierte en fumarato, transfiere FAD los electrones a CoQ. 2ATP Complejo III.- Coenzima Q – citocromo reductasa.- Recibe a los electrones del complejo I y II, a partir de este paso transportar e- y los H+ quedan libres. Energia cinetica. Complejo IV.- Citocromo C oxidasa.- Fe, reacciones axido-reduccion, aquí se lleva a cabo l fosforilación oxidativa. (cianuro) Tranfiere ½ O2 y genera H2O (reduce ½ O2 en H2o) Complejo V.- ATP sintasa.- Recibe todo del complejo IV esta formado por dos complejos, entra por DOMINIO F0 – energía potencial canal protónico y sale por el dominio F1 – energía cinetica sintetiza ATP a partir de ADP y Pi. Productos de la fosforilación oxidativa: ATP, CO2 , F2O. Radicales. Aniones. Superóxido dismutasa (SOD) Tipo 1.- CITOPLASMATICA. Cu2+.- Actividad catalítica. Zn2+.- Estabilidad estructural. Codificación en el cromosoma 21. Tipo 2.- MITOCONDRIAL. Mn2+.- Actividad catalítica Termosensible. Codificación en el genoma nuclear. Tipo 3.- BACTERIANA. Fe2+ Actividad catalítica. Termoestable. Catalasa . Enzima peroxisomal metabolizada H2O2 producido por B-oxidación de ácidos grasos en peroxisomas. En eritrocitos es citoplasmático y junto al SOD estructura el sistema. B-oxidación degrada Ac. Grasos. Genera ATP TG Gliserol + 3 Ac. Grasos. Trabaja con Hemoglobina. 4 pasos para la B-oxidación: oxidación, hidrolisis, oxidación y tiolisis. 2 H2O2 O2 + 2H2O. Cofactor: Fe++. Efectividad de los antioxidantes en función a su potencial REDOX. Glutatión. Patologías asociadas al estrés oxidativo Se asocia en selenio. Apoya de la cisteína. Utiliza ribosoma -5 para el Ac. úrico. Órganos protegidos Eritrocito, riñón, hígado, mucosa intestinal y testículos. Se asocia a selenio- cisteína codificadora por triplete UAG GLUTATION PEROXIDASA: Cataliza Rx de glutatión glutatión disulfura utilizando peróxido. GLUTATION REDUCTASA.- Detoxifica H2O2 y utiliza ATP. 1.- colitis vicerosa. 2.- Enf. Cardiovasculares. 3.- Cáncer. 4.- Esclerosis múltiples. 5.-Diabetes mellitus. 6.- Parkinson. 7.-Alzheimer. 8.- Distrofia muscular. 9.- Retinopatías ( cataratas y glaucoma). Catalasa.- Esta enzima se encuentra en las mitocondrias y los peroxisomas, y cataliza la reducción del peróxido de hidrógeno a agua: 2H2O2 → 2H2O + O2. Cabe mencionar que esta enzima también tiene actividad de peroxidasa: H2O2 + RH2 → 2H 2O + R. Glutatión peroxidasa.- Esta enzima cataliza la reducción de peróxidos empleando dos moléculas de glutatión reducido (GSH). Los productos de la reacción son el glutatión oxidado (GSSG) y el agua. H2O2 + 2GSH → GSSG + H2O (21) ROOH + 2GSH → GSSG + ROH + H2O. Única enzima natural que va de reducción a oxidación. Glutatión reductasa.- Es una enzima que se encuentra en citoplasma y tiene a la coenzima FAD en su sitio activo. Esta enzima cataliza la reducción de GSSG empleando la coenzima NADPH: GSSG + NADPH + H+ → NADP+ + 2GSH Aparentemente el NADPH reduce el FAD, el cual transfiere dos electrones a la unión disulfuro (—S—S—) entre dos residuos de cisteína del sitio activo. Los dos grupos —SH formados interactúan entonces con el GSSG reduciéndolo a dos moléculas de GSH. Superóxido dismutasa: Cataliza la conversión del anión superóxido a peróxido de hidrógeno: 2O2 .–+ 2H+ → H2O2 + O2 OXIDACION DE GLUCOSA POR DOS VIAS. CARBOHIDRATOS. Biomoléculas orgánicas compuestas por C, H O y cuya función primaria y principal es el aporte de energía. Función . Clasificación. Energética ATP Estructural Proteoglucanos y glucosaminoglicanos. Reserva Glucógeno ( almacenado en hígado y musculo). Señalización Membrana, glucoproteínas. Fermentación de azucares. Reserva de lípidos y proteínas. Transportadores de glucosa GLUTS. GLUT 1.- Glóbulos rojos, barrera hematoencefálico. GLUT 2.- Glucosa higado. GLUT 3.- Neuronas. GLUT 4.- Dependiente de insulina. Glucosa Musculo y tejido adiposo. GLUT 5.- Exclusivo de fructosa en el intestino y gametogénesis en los testículos. A-GLUTS – 1.- Dependiente de SODIO. Anaerobia.- El piruvato es el producto final de la glucolisis en células con mitocondrias y en fuente adecuada de oxígeno. El piruvato a lactato a medida que el NADH se oxida a NAD+, permite que la producción de ATP en tejidos que carecen de mitocondrias. Ciclo de cori. Aerobia. Prepara el camino para la descarboxilación oxidativa del piruvato a acetil-CoA, un combustible principal de l ciclo de los ATC. El piruvato a lactato a medida que el NADH se oxida a NAD+. C. Krebs y fosforilación oxidativa. 1.- Polisacáridos: Celulosa, quitina, glucógeno, almidón. 2.- Oligosacáridos: Estatiosta, inulina, rafinosa. 3.- Disacáridos: Maltosa, lactosa y sacarosa. Gluconeogénesis 4.- Monosacáridos: Glucosa, fructosa y galactosa. Enfermedades por acumulación de glucógeno. Glucolisis. Formación de nueva glucosa a partir de precursores NO glucosídicos. Glucogenólisis Glucogénesis. Oxalacetato. Lactato. Alanina. Glicerol. Oxalacetato + fosfoenil piruvato = GLUCOGENO. Degradación de glucógeno a glucosa. Glucosa 1-fosfato a fosfato. Inhibe a la insulina. Activa en el hígado, hormona y glucagón . Se lleva glucosa a hígado y musculo para hacer almacenados en glucógeno. Intolerancia a la lactosa *Adquirida la mas común * Hereditaria: Falla bioquímica: deficiente de una disacaridasa.- lactosa lactasa. Pruebas de laboratorio: Azucares reductores. Clínica: Diarrea, distención abdominal, dolor tipi cólico, flatulencias, náuseas, vomito. Gastroenteritis. Infeccion por fiebre o diarreas, puede ser bacteriana ( se observan PMN) o viral (se observa MN), que hace una citología. Diabetes mellitus. Enf metabolica, hereditaria, crónica y multisistémica que se caracteriza por niveles elvados de glucosa y alteraciones en la síntesis de la insulina. Hay 3 tipos: insulinodependiente (5-15 años) idiopática, adquirida, gestacional ( en el embarazo y el estudio se llama curva de la intolerancia de la glucosa). El control puede ser por: HbA1C, HDL, LDL, Electrolitos séricos, EGO. Fructosemia. Falla bioquímica: defecit de la enzima fuctosa 1,6- bifosfatasa o aldolasa B, que es necesaria para que la fructosa pueda ser metabolizada con normalidad, es una enfermedad metabólica congénita, clínica: vomito,, náuseas, ictericia, diarrea, sueño excesivo. Galactosemia: Carencia de galactosa 1- fosfato uridiltransferasa, trastorno autosómico recesivo, causa galactosemia y galactosuria, vómitos, diarreas e ictericia. Se ve afectado el gen GALY y la característica principal es peso y talla baja para su edad O-glucosídico es el enlace mediante el cual se unen monosacáridos para formar disacáridos o polisacáridos. En este tipo de enlace, un grupo OH de un carbono anomérico de un monosacárido reacciona con un grupo OH de otro monosacárido, desprendiéndose una molécula de agua. El tipo de reacción que ocurre es de condensación o deshidratación. Los monosacáridos quedan unidos por un átomo de oxígeno. Puede ser lineal (alfa) o cruzado (B) Enlaces glucosídicos. N-Glucosídico se forma entre un -OH y un compuesto aminado, originando aminoazúcares. Glucosaminoglicanos También como mucopolisacáridos, son estructuras glucídicas, con una función de biomoléculas estructurales que podemos encontrar principalmente en tejido conectivo, tejido óseo, medio intercelular y tejido epitelial. Son altamente polares y con la capacidad de atraer agua, por lo que son idóneos para los funciones biológicas que realizan. También son utilizados como lubricantes o para absorber impactos. Cada uno está compuesto de hexosamina y una hexosa, o ácido hialurónico. Ácido uránico + Amino azúcar= GLUCOSAMINOGLUCANO Fisiología Osteomuscular Tipos de glucosaminoglucanos Acido hialurónico (el único no sulfatado). Condroitinsulfatos (en cartílago). Queratansulfato (presente en córnea y tejido ósea). Heparansulfato (que se encuentra en el hígado, los pulmones y la aorta). Monosacáridos: Estructura de monosacáridos. son los azúcares más sencillos, pues no pueden descomponerse por hidrólisis para dar lugar a otros azúcares más simples. La estructura básica de todos los monosacáridos es una cadena de átomos de carbono no ramificada en la que todos ellos están unidos por enlaces simples. Si el grupo carbonilo se encuentra en un extremo de la cadena carbonada el monosacárido es un aldehído y recibe el nombre de aldosa. Si el grupo carbonilo se encuentra en cualquier otra posición el monosacárido es una cetona y recibe el nombre de cetosa. Puede sufrir cambio como: intercambio de grupos funcionales, oxidación y reducción Derivados de los monosacáridos. Aminoazúcares.- En ellos el grupo hidroxilo unido al carbono 2 del monosacárido de origen está sustituido por un grupo amino. En ocasiones este grupo amino aparece acetilado, como en la Nacetil-glucosamina Azúcares-alcoholes.- Se obtienen por reducción del grupo carbonilo a grupo hidroxilo. Entre los azúcares-alcoholes destaca la glicerina, un polialcohol de tres átomos de carbono que se encuentra formando parte de muchos lípidos. Azúcares-ácidos.- Se obtienen por oxidación de algún átomo de carbono del monosacárido de origen a grupo carboxilo. Si el carbono oxidado es el carbono carbonílico se obtienen los ácidos aldónicos; si es el carbono hidroxílico del otro extremo de la cadena se obtienen los ácidos urónicos. Entre los azúcares-ácidos destacan los derivados de la glucosa denominados ácido glucónico (un ácido aldónico) y ácido galacturónico (un ácido urónico). Se encuentran normalmente ionizados a pH 7, por lo que se pueden nombrar correctamente como gluconato, glucuronato, etc. Desoxiazúcares.- En ellos, alguno de los grupos hidroxilo del monosacárido de origen está sustituido por un átomo de hidrógeno. El más importante es la 2´- desoxirribosa, que forma parte de los ácidos nucleicos. Azúcares-fosfato.- Son azúcares fosforilados (unidos a un grupo fosfato mediante enlace éster) en alguno de sus grupos hidroxilo. En la síntesis y degradación de los glúcidos, los compuestos intermedios no suelen ser los propios azúcares sino sus derivados fosforilados. Ello se debe a que estos derivados poseen cargas netas a pH 7, lo que evita su difusión a través de las membranas celulares. Glucósidos.- Es sabido que los hemiacetales y hemicetales pueden reaccionar con una segunda molécula de alcohol para, liberando una molécula de agua, dar lugar a acetales y cetales respectivamente. Un ejemplo seria lo constituye la que se produce entre un monosacárido en forma cíclica (que es un hemiacetal o hemicetal intramolecular) y un alcohol para formar un glucósido liberando una molécula de agua. El interés de este tipo de compuestos reside en que el tipo de enlace mediante el cual se unen los monosacáridos para formar ósidos puede considerarse como un caso particular de la reacción entre un monosacárido y un alcohol para formar un glucósido. Están formadas por polímeros lineales de N– acetilglucosamina (o N-acetilgalactosamina) y ácido glucurónico. Los más habituales son: Proteoglucanos Están formados por una proteína central a la que se unen una gran cantidad de cadenas de glucosaminoglucanos (GAG, también llamados mucopolisacáridos). Se encuentran en la matriz extracelular de los tejidos conectivos. Las cadenas de glucosaminoglucanos Deficiencia de Proteoglucanos: Alteraciones en el desarrollo de cartílago, epífisis osea, alteraciones del desarrollo oseo. depende de sus moléculas de glucosaminogucanos: función de los proteoglucanos Diferencia sobre todo en la secuencia y en la longitud de la cadena de aminoácidos y en el número y en el tipo de moléculas de glucosaminoglucanos que tiene unidos. Acción mecánica El ácido hialurónico (en el tejido conjuntivo, el humor vítreo o los líquidos sinoviales). El condroitín sulfato (tejido óseo y cartilaginoso). La heparina (anticoagulante en pulmón, hígado y piel). hidratación. resistencia a presiones mecánicas. Lubricantes. Diferenciación. Movilidad. fisiología celular. Esencial en los cartílagos y en las articulaciones. Pero además, son puntos de anclaje de las células a la matriz extracelular que le rodea. Acción directa por ser moléculas integrales de la membrana plasmática, porque forman uniones con fosfolípidos de la membrana. Son reconocidos por proteínas de adhesión presentes en las membranas plasmáticas como las integrinas. Los proteoglucanos son sintetizados en el interior celular. La parte proteica se sintetiza en el interior celular en el retículo endoplasmático rugoso, donde también se inicia la adición de glúcidos. Sin embargo, la elongación de las cadenas de repeticiones de glucosaminoglucanos y la sulfatación se produce en el lado trans del aparato de Golgi. La mayoría de los proteoglucanos son exocitados al espacio intercelular, pero algunos formarán parte de la membrana plasmática gracias a que su parte proteica contiene secuencias de aminoácidos hidrófobos que se insertan entre las cadenas de ácidos grasos de la membrana.