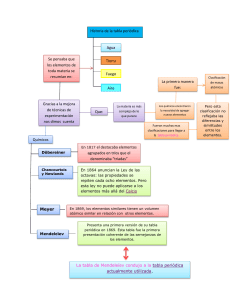
La organización de los elementos químicos Química-Séptimo Dinelly Landázury Galé Docente Ejes temáticos 1 • • • • Los primeros símbolos químicos: Las tríadas de Döbereiner, La ley de las octavas. La tabla periódica: La tabla periódica de Meyer, la tabla periódica de Mendeléyev. La tabla periódica en la actualidad: La tabla periódica de Moseley, La ley periódica, elementos representativos y de transición. La clasificación de los elementos: según grupo, período y bloque; según sus propiedades físicas Introducción Primeros elementos químicos descubiertos La teoría atómica de Dalton Los elementos empezaron a reconocerse por símbolos. Dalton los representó en forma de círculos, los cuales distinguió con la letra inicial del nombre u otro símbolo en su interior Introducción Primeros clasificación de los elementos En 1814, Jöns Jacob Berzelius sugirió que cada elemento debía tener un símbolo, propuso utilizar la letra inicial del nombre latino o griego del elemento y organizarlos en orden alfabético. Para comprender • ¿En qué se diferencian los símbolos de Dalton y Berzelius? Las tríadas de Döbereiner Elementos organizados por Döbereiner Tríadas En 1829, Johann Döbereiner ordenó a los elementos descubiertos. Los clasificó en grupos de tres, llamados tríadas. Estos poseían propiedades químicas parecidas • En las tríadas, el elemento central tiene una masa aproximada al promedio de las masas de los elementos. La ley de las octavas En 1864, el químico John Newlands ordenó los elementos según su peso atómico creciente. Los que eran semejantes tendrían que quedar en la misma fila horizontal La tabla periódica de Meyer En 1869, el químico Julius Meyer organizó 55 elementos químico en la tabla periódica. También relacionó el concepto de volumen atómico con las masas atómicas. La tabla periódica de Mendeléyev En 1869, Mendeléyev publicó la tabla periódica con los elementos en orden ascendentes de las masas atómicas. También observó cambios en las valencias de los átomos La tabla periódica en la actualidad La tabla periódica de Moseley En 1913, ordenó los elementos químicos según su número atómico en orden creciente y no como había hecho Mendeléyev de acuerdo con las masas atómicas Debido a la construcción de la tabla periódica actual, Moseley postuló la ley periódica que dice “las propiedades físicas y químicas de los elementos varían de manera periódica de acuerdo al orden creciente de los números atómicos” La tabla periódica de Moseley Elementos representativos Se caracterizan por presentar los electrones de valencia en los orbitales s y p Elementos de transición Se caracterizan por presentar los electrones de valencia en el orbital d Elementos de transición interna Lantánidos y actínidos. Están ubicados en los períodos 6 y 7. Se caracterizan por presentar los electrones de valencia en el orbital f La clasificación de los elementos según grupo, período y bloque Los grupos en la tabla periódica son 18 y corresponden a las columnas numeradas de 1 a 18 Los períodos en la tabla periódica son 7 y corresponden a las filas horizontales. El período equivale al último nivel de energía Relación entre los grupos de la tabla periódica y la configuración electrónica En la configuración electrónica, los electrones de valencia indican el grupo al que pertenecen los elementos de los grupos 1 y 2. Para los elementos de los grupos 13 al 18, el segundo dígito del número del grupo es igual al número de estos electrones La clasificación de los elementos según grupo, período y bloque La configuración electrónica permite localizar el bloque al que pertenece el elemento químico ACTIVIDAD EN CASA ACTIVIDAD EN CASA