UNIDAD II TABLA PERIÓDICA Y TIPOS DE ENLACE (18069)
Anuncio

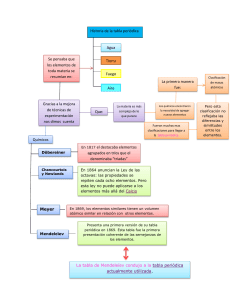
UNIDAD II TABLA PERIÓDICA Y TIPOS DE ENLACE TABLA PERIÓDICA Una de las características del hombre ha sido su constante búsqueda de un orden en la naturaleza y su capacidad creadora para clasificar todo aquello que considera de importancia. Así por ejemplo tenemos un sistema de clasificación de los seres vivos. A principio del siglo XIX, los químicos se inquietaban por buscar criterios para clasificar los 55 elementos conocidos en ese tiempo y en su momento poder predecir futuros descubrimientos. Fur así como se empezaron a desarrollar las primeras clasificaciones de los elementos en una agrupación que se llamaría tabla periódica. La creación de la tabla periódica de uso actual se originó en 1869, con los trabajos independientes de dos químicos: el alemán Julius Lothar Meyer y el ruso dimitri Mendeleiev. Meyer publicó su primera tabla periódica en 1864, pero incompleta, en 1869 la presentó con 56 elementos establecidos en orden creciente de sus masas atómicas Posteriormente en 1869 Mendeleiev pudo predecir la existencia de otros elementos aún no conocidos en su tiempo y las propiedades que los distinguirían dejando espacios vacios en su tabla, pudo predecir la existencia de escandio, Galio y Germanio. A pesar de su gran avance para la clasificación de los elementos, presenta algunos problemas, porque las masas atómicas no estaban ordenadas en forma creciente como es el caso del Níquel y el cobalto. Henry Moseley en 1913, estableció el concepto de número atómico, como aquel que relacionaba el número de cargas positivas del núcleo de un átomo que coincide con el número de electrones en los niveles de energía; con lo que concluyó que los elementos se deberían ordenar con base a sus números atómicos crecientes. Moseley estableció la Ley periódica: Repetición periódica de las propiedades físicas y químicas de los elementos, al organizarse en orden ascendente con respecto al número atómico. Símbolo del elemento: En 1814 Berzeluis, diseño una forma sencilla de identificación de los elementos por medio del símbolo que derivan del nombre del elemento, es decir el símbolo de un elemento es la representación del elemento a través de la Unión Internacional de Química Pura y aplicada (IUPAC) no deben ser más de tres. La primera siempre será mayúscula y el resto minúscula, y si el símbolo está formado por una sola letra esta será mayúscula. Los nombres usados actualmente para designar a los elementos químicos provienen de su nombre en latín o griego principalmente, del país donde fueron descuniertos, del científico que los encontró (o de otro que merece reconocimiento), de alguna de sus características, entre otros. La excepción a esta costumre ocurrió en 1976, cuando se propuso un sistema para provisionalmente nombrar a los elementos del 104 en adelante con los nombres de los números en látin . Así el nombre del elemento 105 sería unnilpentio: un (1), nil (0), pent (5), con la terminación –io (del latin ium). Sin embargo en 1997 la IUPAC propuso los nombres de rutherfordio, hahnio, seaborgio, bohrio, hassio y meitnerio para los elementos del 104 al 109 respectivamente. Distribución de los elementos en la tabla periódica En la actualidad sabemos que están clasificados 118 elementos químicos, 89 de los cuales existen en la naturaleza, mientras que el resto ha sido creado artificialmente por el hombre. Los elementos sintéticos son el prometio Pm (Z=61), y del neptunio Np (Z=93) al Oberón On (Z= 118). Con respecto a su estado de agregación, la mayoría son sólidos en condiciones normales de presión y temperatura (TNP), sólo dos son líquidos a TNP: mercurio y bromo. Los que constituyen gases en estado natural son el hidrógeno, nitrógeno, oxigeno, fluor, cloro y los gases nobles. h