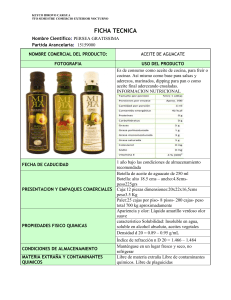
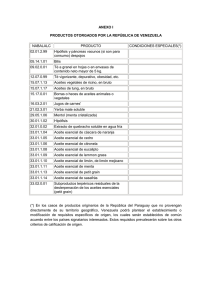
INFLUENCIA DEL ACEITE DE LA SEMILLA DE COROBA SOBRE LAS PROPIEDADES DEL ACEITE DE COCO
Anuncio

UNIVERSIDAD DE ORIENTE NÚCLEO DE ANZOÁTEGUI ESCUELA DE INGENIERÍA Y CIENCIAS APLICADAS DEPARTAMENTO DE INGENIERÍA QUÍMICA INFLUENCIA DEL ACEITE DE LA SEMILLA DE COROBA (Attalea macrolepis) SOBRE LAS PROPIEDADES FÍSICAS Y QUÍMICAS DEL ACEITE DE COCO (Cocos nucífera L.) EXTRAÍDO POR PRENSADO Realizado por: MORON PACITTO DANIELA STHEFANIA PERNIA ZAMBRANO JHORKLEY OSMAY Trabajo de Grado presentado ante la Universidad de Oriente como Requisito Parcial para optar al Título de: INGENIERO QUIMICO Barcelona, Febrero de 2019 UNIVERSIDAD DE ORIENTE NÚCLEO DE ANZOÁTEGUI ESCUELA DE INGENIERÍA Y CIENCIAS APLICADAS DEPARTAMENTO DE INGENIERÍA QUÍMICA INFLUENCIA DEL ACEITE DE LA SEMILLA DE COROBA (Attalea macrolepis) SOBRE LAS PROPIEDADES FÍSICAS Y QUÍMICAS DEL ACEITE DE COCO (Cocos nucífera L.) EXTRAÍDO POR PRENSADO ASESOR ACADEMICO Lic. Quim. Rafael Alemán MSc. Asesor académico Barcelona, Febrero de 2019 UNIVERSIDAD DE ORIENTE NÚCLEO DE ANZOÁTEGUI ESCUELA DE INGENIERÍA Y CIENCIAS APLICADAS DEPARTAMENTO DE INGENIERÍA QUÍMICA INFLUENCIA DEL ACEITE DE LA SEMILLA DE COROBA (Attalea macrolepis) SOBRE LAS PROPIEDADES FÍSICAS Y QUÍMICAS DEL ACEITE DE COCO (Cocos nucífera L.) EXTRAÍDO POR PRENSADO JURADO CALIFICADOR: Lic. Quím. Rafael Alemán MSc. Asesor Académico Lic. Quím. Francia Castellar Ing. Quím. Francisco García MSc. MSc. Jurado Principal Jurado Principal Barcelona, Febrero de 2019 RESOLUCIÓN De acuerdo al artículo 41 del Reglamento de Trabajos de Grado (Vigente a partir del II Semestre 2009, según comunicación CU-034-2009): “Los trabajos de grado son exclusiva propiedad de la Universidad de Oriente y solo podrán ser utilizados a otros fines con el consentimiento del Consejo de Núcleo Respectivo, quien le participara al Consejo Universitario, para su autorización” iv AGRADECIMIENTOS A mis padres Ángela y Adolfo por darme esta vida, y guiarme en todo momento por toda la trayectoria, ya sea con las competencias y en la carrera. A mi hermana por ser una segunda mama. A mi novio Rubén Machado quien de verdad se caló toda mi carrera, todos mis lloriqueos, cuando pensaba que me quedaría una materia, por esos trasnocho donde me ayudaba y por siempre prestarme tu apoyo incondicional. A nuestro querido profesor Rafael Alemán quien nos acogió para realizar este trabajo para formar parte de estos 20 años de investigación de la coroba. Al profesor David García quien nos recibió y apoyo en los laboratorios de la Universidad Simón Rodríguez A los ingenieros Maritza Parra y Marisol Rodríguez, por su apoyo en COPOSA. Y por supuesto a mi querida compañera de batalla como le decimos, Jhorkley Pernia, donde aprendimos juntas, y comenzamos este camino para obtener nuestro preciado título, gracias por aguantarme jhor, lo logramos. Daniela Sthefania Morón Pacitto v AGRADECIMIENTOS Primeramente a Dios sobre todas las cosas, por nunca dejarme sola, por siempre estar allí cuidando de mí, de mis pasos, dándome luz y sabiduría, enseñándome día tras día que las cosas son cuando deben ser y como deben ser. Por darme vida y salud para poder vivir este día tan esperado. A nuestro tutor y querido profesor Rafael alemán, por aceptarnos, ayudarnos y apoyarnos en todo momento, gracias por siempre estar allí pendiente de nosotras, por regañarnos y corregirnos en los momentos necesarios, por eso hoy este sueño es posible. Al profesor David García por el apoyo prestado en los laboratorios de la Universidad Simón Rodríguez A los Ingenieros de las instalaciones de PDVSA por brindar apoyo en cuanto a las instalaciones y equipos necesarios. A los ingenieros de la Empresa COPOSA, principalmente a la ingeniero Maritza Parra e Ingeniero Marisol Rodríguez por ese granito de arena que para nosotras significo el corazón de la tesis. Y a mi súper compañera de tesis, Daniela Morón, porque desde el primer momento confió en mí, en nosotras, en que si podíamos; porque nunca se rindió y dio todo de sí misma para que lográramos esta meta. Gracias por todo, por lo bueno, por lo malo, por ayudarme en esta batalla vi que a medida que se acercó el momento se hizo efecto bola de nieve, pero que juntas superamos. Hoy es nuestro día…Lo logramos. Jhorkley Osmay Pernia Zambrano vii DEDICATORIA Bueno primero que nada se la dedico a mis padres Ángela Pacitto y Adolfo Morón, por poner cada granito de arena para formarme como persona, apoyando en todo momento, A mi hermanita Vanessa. A mi novio Rubén Machado. Daniela Sthefania Morón Pacitto viii DEDICATORIA Este logro va dedicado a mi Hermosa Madre, Luz Magaly Zambrano Moreno. A Ti madre mía, por ser mi pilar, mi fuerza, mi apoyo incondicional, quien me levanto mil veces, me regaño, me guío y nunca dejó que perdiera la Fe. Porque en los momentos que pensé que ya no podía más, siempre me llenaste de esa fe tan infinita que llevas dentro, me arropaste en tus brazos y me diste mil y un motivo para seguir luchando. Sin ti, nada de esto hubiera sido posible. Gracias por siempre confiar en mí y hacerme ver y saber que todo lo que me proponga puedo alcanzarlo. Gracias por nunca cansarte, por las noches de desvela solo por acompañarme y por cada uno de tus sacrificios para que hoy día, sea quien soy, en lo personal y ahora profesionalmente. Eres la mejor mamicha del mundo mundial, Te amo inmensamente hoy mañana y siempre. Jhorkley Osmay Pernia Zambrano ix ÍNDICE GENERAL RESOLUCIÓN ............................................................................................... iv AGRADECIMIENTOS ..................................................................................... v AGRADECIMIENTOS .................................................................................... vi DEDICATORIA ............................................................................................ viii DEDICATORIA .............................................................................................. ix ÍNDICE GENERAL.......................................................................................... x ÍNDICE DE TABLAS .................................................................................... xiv ÍNDICE DE FIGURAS ................................................................................... xv RESUMEN ................................................................................................... xvi CAPITULO I .................................................................................................. 17 EL PROBLEMA............................................................................................. 17 1.1 Planteamiento del Problema ............................................................... 17 1.2 Objetivos ............................................................................................. 18 1.2.1 Objetivo general ......................................................................... 18 1.2.2 Objetivos especifico ..................................................................... 19 CAPITULO II ................................................................................................. 20 MARCO TEORICO ....................................................................................... 20 2.1 Antecedentes de la Investigación ....................................................... 20 2.2 Fundamentos de grasas y aceites ...................................................... 22 2.2.1 Los aceites y las grasas .............................................................. 22 2.2.2 Los lípidos ................................................................................... 23 2.2.3 Funciones de los lípidos .............................................................. 23 2.2.4 Clasificación de los lípidos........................................................... 24 2.3 Análisis físicos y químicos .................................................................. 35 x 2.3.1 Densidad ..................................................................................... 37 2.3.2 Punto de humo y punto de ignición ............................................. 37 2.3.3 Índice de acidez........................................................................... 38 2.3.4 Índice de peróxidos ..................................................................... 39 2.3.5 Índice de saponificación .............................................................. 40 2.3.6 Índice de yodo ............................................................................. 40 2.3.7 Estabilidad oxidativa .................................................................... 41 2.4 Oleaginosas ........................................................................................ 42 2.4.1 Palma de coco ............................................................................. 43 2.4.2 Palma coroba .............................................................................. 48 2.5 Extracción de aceites .......................................................................... 52 2.5.1 Tipos de extracción ..................................................................... 53 2.6. Método estadístico ............................................................................. 58 2.6.1 Características del análisis de la varianza (ANAVA) ................... 58 CAPITULO III ................................................................................................ 59 MARCO METODOLOGICO .......................................................................... 59 3.1 Procedimiento experimental ............................................................... 59 3.1.1 Identificar las condiciones operacionales de funcionamiento de los equipos de operaciones unitarias, en la obtención del aceite de coco en la fábrica de aceite refinado de coco .................................................... 60 3.1.2 Describir el proceso de obtención artesanal del aceite de semilla de coroba (Attalea macrolepis) ............................................................. 61 3.1.3 Mezcla de aceites ........................................................................ 62 xi 3.1.4 Caracterización de las propiedades físicas y químicas de los aceites puros y de cada mezcla realizada ............................................ 62 3.1.5 Determinación del perfil de ácidos grasos e índice de yodo de las muestras obtenidas .............................................................................. 68 3.1.6 Determinación de la estabilidad oxidativa de los aceites resultantes ............................................................................................ 69 3.1.7 Análisis estadísticos .................................................................... 69 3.2 Descripción de equipos, materiales, sustancia y herramientas ......... 70 3.2.1 Equipos ....................................................................................... 70 3.2.2 Materiales .................................................................................... 70 3.2.3 Sustancias ................................................................................... 71 3.2.4 Herramientas ............................................................................... 72 3.3 Tabla de datos .................................................................................... 72 3.4 Muestra de cálculo .............................................................................. 78 3.4.1 Porcentaje de rendimiento ........................................................... 78 3.4.2 Ensayos físicos y químicos de los aceites puros y sus mezclas . 79 3.4.3 Estabilidad oxidativa .................................................................... 81 3.4.4 Cálculos estadísticos ................................................................... 81 CAPITULO IV................................................................................................ 85 ANALISIS Y DISCUSION DE RESULTADOS .............................................. 85 4.1 Análisis de los resultados ................................................................... 85 4.1.1 Porcentaje de rendimiento de la obtención del aceite de coco y semilla de coroba ................................................................................. 85 xii 4.1.2 Características físicas y químicas de los aceites de coco, semilla de coroba y de las mezclas resultantes................................................ 86 4.1.3 Determinar el perfil de ácidos grasos en las muestras obtenidas ............................................................................................................. 94 4.1.4 Analizar la estabilidad oxidativa de los aceites resultantes ......... 96 4.1.5 Recomendar el uso (cosmético, farmacéutico, alimenticio, entre otros) de los aceites obtenidos de acuerdo a los resultados encontrados ............................................................................................................. 98 CONCLUSIONES ....................................................................................... 100 RECOMENDACIONES ............................................................................... 101 BIBLIOGRAFÍA ........................................................................................... 102 METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO ......... 108 xiii ÍNDICE DE TABLAS Tabla 2.1 Ácidos grasos saturados (Badui, 2006) ........................................ 30 Tabla 2.2 Ácidos grasos insaturados (Badui, 2006)...................................... 32 Tabla 3.1. Valores para determinar el rendimiento de extracción de aceite de la semilla de coroba y del coco. .................................................................... 72 Tabla 3.2. Valores obtenidos para determinar la densidad relativa a una temperatura de 25 °C (% aceite de coco / % aceite de semilla de coroba). . 73 Tabla 3.3. Datos de punto de humo y de ignición (% aceite de coco / % aceite de semilla de coroba).................................................................................... 74 Tabla 3.4. Valores obtenidos para determinar el índice de acidez (% aceite de coco / % aceite de semilla de coroba) con hidróxido de sodio 0,1054 N. 75 Tabla 3.5. Valores obtenidos para determinar el índice de peróxido (% aceite de coco / % aceite de semilla de coroba) con tiosulfato de sodio 0,0958 N y un volumen de blanco de 0,2 mL. ................................................................. 76 Tabla 3.6. Valores obtenidos para determinar el índice de saponificación (% aceite de coco / % aceite de semilla de coroba) con ácido clorhídrico 0,5029 N y un volumen de blanco de 25,4 mL. ......................................................... 77 Tabla 3.7. Valores para calcular la estabilidad oxidativa (% aceite de coco / % aceite de semilla de coroba). ........................................................................ 78 Tabla 3.8. Valores de la densidad relativa de los aceites puros y sus mezclas (% coco / % semilla de coroba)..................................................................... 82 Tabla 3.9. Tabla resumen del ANOVA para el cálculo de densidad relativa. 84 xiv ÍNDICE DE FIGURAS Figura 2.1. Resumen de la clase de lípidos (Holum, 2005). ......................... 24 Figura 2.2 Componentes de la cera (Holum, 2005) ...................................... 25 Figura 2.3 Componentes de las grasas y triacilgliceroles (Holum, 2005) ..... 26 Figura 2.4 Reacciones de formación de ácidos grasos (Holum, 2005) ......... 26 Figura 2.5 Ecuación general de saponificación (Holum, 2005). .................... 27 Figura 2.6. Palma de coco. ........................................................................... 44 Figura 2.7. Fruto de la palma de coco. ......................................................... 45 Figura 2.8. Palma coroba (Chirinos y col, 2010). .......................................... 49 Figura 2.9 Ubicación de la palma coroba. ..................................................... 50 Figura 2.10. Fruto de la palma coroba (Chirinos y col, 2010). ...................... 51 Figura 2.11 Diagrama de flujo para la obtención de aceite de oleaginosas. . 53 Figura 3.1 Esquema para el desarrollo del proyecto. .................................... 59 Figura 4.1 Rendimiento de la extracción de aceite de coco y de la semilla de coroba. .......................................................................................................... 86 Figura 4.2 Densidad relativa de los aceites puros y sus mezclas. ................ 87 Figura 4.3 Temperatura de humo y de ignición de los aceites puros y sus mezclas. ........................................................................................................ 88 Figura 4.4 Índice de acidez de los aceites puros y sus mezclas. .................. 89 Figura 4.5 Índice de peróxido de los aceites puros y sus mezclas. .............. 91 Figura 4.6 Índice de saponificación de los aceites puros y sus mezclas. ..... 92 Figura 4.7 Índice de yodo de los aceites puros y sus mezclas. .................... 94 Figura 4.8 Perfil de ácidos grasos de los aceites puros y sus mezclas. ....... 96 Figura 4.9 Estabilidad oxidativa de los aceites puros y sus mezclas. ........... 97 xv RESUMEN El objetivo principal de esta investigación fue la evaluación del efecto del aceite de semilla de coroba sobre las propiedades físicas y químicas del aceite de coco. En cuanto a la extracción del aceite de semilla de coroba, se realizó por medio del método artesanal siguiendo la tecnología aplicada por los habitantes de la región de Caicara del Orinoco (selección, recolección, descascarillado, molienda y separación de fases) del cual se obtuvo un rendimiento del 48,60 %. En el caso del aceite de coco, su extracción fue mecánica, bajo el método industrial implementado en una fábrica de aceite refinado de coco ubicada en el oriente del país, (recepción de la copra, disminución de partícula y prensado al vapor) obteniendo un rendimiento del 52,20 %; estos se usaron como base para realizar mezclas de ellos en diferentes proporciones (75/25, 50/50, 25/75) % aceite de coco / % aceite de semilla de coroba respectivamente. Se determinaron y evaluaron las propiedades físicas y químicas de los aceites puros y las mezclas resultantes; los valores obtenidos de los análisis realizados varían de acuerdo a la proporción de aceite de coco en la muestra, presentando diferencia significativa en todos ellos de acuerdo al método estadístico ANOVA. La cromatografía de gases, reporto una variación de ácidos grasos saturados e insaturados, encontrándose ácido laúrico en mayor proporción. En la estabilidad oxidativa se observó que el aceite de coroba aumenta el tiempo de vida útil del aceite de coco. xvi CAPITULO I EL PROBLEMA 1.1 Planteamiento del Problema El mundo de los lípidos se encuentra constituido por dos grandes grupos, como lo son las grasas y los aceites, siendo estos la fuente energética con mayor valor calórico de la industria alimenticia, son excelentes conductores de vitaminas liposolubles y además son la base de muchas emulsiones cosméticas. Según estudios hechos anteriormente, Venezuela se encuentra entre uno de los principales países consumidores de aceites vegetales de América del Sur, sin embargo debido a la situación crítica que atraviesa el país actualmente, este posee un déficit en el área de producción y refinación de aceites, por ello, la gran mayoría de la grasa animal y vegetal es importada, generando esto, cierta vulnerabilidad comercial y altos costos de adquisición en el mercado. Por ende diariamente se buscan alternativas naturales y nacionales de fácil acceso. Este país, ha sido tierra fértil de una gran variedad de fuentes oleíferas como el seje, el pijiguao, el inchi, el coco y la coroba, (siendo estos últimos, los frutos centrales de la presente investigación), donde La palma coroba se ubica en el municipio Cedeño del estado Bolívar, específicamente en la región de Caicara del Orinoco esta es considerada como autóctona del municipio y es uno de los pocos productos que pueden crecer en los suelos de esta zona debido al alto grado de drenaje y acidez que poseen. Este fruto está constituido por un cabezal, concha, pulpa, cascara y por la semilla que a pesar de ser su parte más pequeña, es una de las más importantes, pues allí contiene un alto porcentaje de aceite. 18 Mientras que la palma de coco se cultiva en muchas zonas costeras de Venezuela como el Zulia, Falcón, Sucre, entre otros y es muy reconocida por sus variadas aplicaciones. De su fruto se conoce una drupa de tres caras con un endospermo dividido en dos partes (pulpa y agua de coco), siendo la pulpa aquella de mayor interés, pues de ella se obtiene el aceite de coco; la pulpa también es conocida como copra, capa fibrosa o parte blanca del coco. Como se puede notar el aceite de estas oleaginosas, son punto clave para esta investigación y por lo tanto es importante resaltar que los aceites están constituidos por compuestos como triglicéridos, antioxidantes, vitaminas, esteroles, pigmentos, entre otros; los cuales pueden sufrir modificaciones al momento de realizar mezclas y adicionalmente, aspectos como la luz y la temperatura pueden generar cambios físicos y químicos en los mismos, tales como oxidación, polimerización, hidrolisis, entre otros. El presente estudio se basa en evaluar cómo influirá el aceite de semilla de coroba en las características propias (físicas y químicas) del aceite de coco, para darle valor agregado al mismo. Para ello se aplicarán diferentes técnicas de análisis como índices de acidez, peróxido, yodo y saponificación, a su vez, también se evaluaran propiedades físicas como densidad relativa, punto de humo e ignición, análisis de la estabilidad oxidativa y perfil de ácidos grasos. 1.2 Objetivos 1.2.1 Objetivo general Evaluar la influencia del aceite de la semilla de coroba (Attalea macrolepis) sobre las propiedades físicas y químicas del aceite de coco (Cocos nucifera L.) extraído por prensado a vapor. 19 1.2.2 Objetivos especifico 1. Identificar las condiciones operacionales de funcionamiento de los equipos de operaciones unitarias, en la obtención del aceite de coco en la fábrica de aceite refinado de coco C. A. 2. Describir el proceso de obtención artesanal del aceite de semilla de coroba (Attalea macrolepis). 3. Caracterizar las propiedades físicas (densidad) y químicas (acidez, índice de peróxidos, índice de saponificación, e índice de iodo) de los aceite de coco, aceite de semilla de coroba y resultantes bajo los lineamientos de las de las mezclas respectivas normas COVENIN. 4. Determinar el perfil de ácidos grasos en las muestras obtenidas. 5. Analizar la estabilidad oxidativa de los aceites resultantes. 6. Recomendar el uso (cosmético, farmacéutico, alimenticio, entre otros) de los aceites obtenidos de acuerdo a los resultados encontrados. CAPITULO II MARCO TEORICO 2.1 Antecedentes de la Investigación Méndez (2014), cuantificó y caracterizó el contenido de sólidos y estabilidad térmica de diferentes tipos de oleínas de palma africana y mezclas con aceite de soya. Determinó el contenido de sólidos en las oleínas de palma y en la mezcla con aceite de soya, en función de la temperatura, realizando análisis de estabilidad térmica a través de curvas de caracterización, considerando la cantidad de solidos presentes en las mezclas realizadas, constató que al aumentar la temperatura disminuye los sólidos disueltos, y determinó que la estabilidad térmica en las mezclas no se comporta de la misma manera. (Méndez, 2014) Figueroa (2013), evaluó el rendimiento de extracción y las características fisicoquímicas de la fracción lipídica de la copra del coco (Cocos nucífera L,) utilizando tres solventes, siendo el hexano el que presentó mayor rendimiento. Al comparar el método soxhlet con la maceración dinámica (usando el mismo solvente) evidenció que el método soxhlet tenía un mayor rendimiento extractivo. Caracterizó los aceites según los diferentes métodos de extracción, encontrando que la solubilidad y punto de fusión varían según el método y solvente utilizado, acotando que el índice de refracción y la densidad no varían significativamente en función del método de extracción ni solvente. También determinó el perfil de ácidos grasos, en el cual demostró que el ácido graso más abundante en la copra es el ácido laúrico. 21 Ayala (2011), evaluó la calidad del aceite en mezclas vegetales empleado para freír plátano hartón verde, utilizándolo en doce frituras sucesivas. El estudio se llevó a cabo realizando pruebas de determinación de la calidad del aceite como densidad, índice de saponificación y yodo, en las cuales no encontró diferencias significativas relacionadas con el aumento de las frituras, en cuanto al índice de peróxidos y acidez no aumentaron significativamente a partir de la fritura 7 y 10 respectivamente. Al finalizar la investigación todos los índices menos el de yodo, sobrepasaron los máximo permitidos según las normas por las cuales se rige el trabajo. Los aceites se vieron afectados química y físicamente al someterse al proceso de frituras sucesivas, deteriorando la calidad nutricional y sensorial. (Ayala, 2011) Alemán (2008), evaluó las características fisicoquímicas del aceite de semilla de coroba obtenida por el método artesanal, con solvente orgánico a escala piloto y un método semiartesanal, resultando el método artesanal más eficiente en la extracción de aceite de semilla de palma de coroba. Observo además que el aceite extraído artesanalmente presentó menor acidez, índice peróxido similar e índice yodo mayor al reportado por Salazar y col (2002). En cuanto al perfil de ácidos grasos se determinó que no existe diferencia significativa en cuanto al método aplicado, y presento una grasa saturada principalmente de tipo láurico 41,89%. Al igual que los estudios ya realizados, la presente investigación estará enfocada en la mezcla de dos tipos de aceites como, el aceite de semilla de coroba y aceite de coco. Las investigaciones anteriores brindan referencias con respecto al tipo de análisis que se le deben realizar a los aceites y el cómo observar las diferencias entre las propiedades de las mezclas obtenidas. Con los resultados de esta investigación, se pretende contribuir en alguna de las áreas de usos oleicos como por ejemplo cosmetología, 22 alimentos, farmacéutica o servir como pauta para futuras investigaciones relacionadas con el tema. 2.2 Fundamentos de grasas y aceites 2.2.1 Los aceites y las grasas Las grasas y aceites son compuestos de origen animal y vegetal que constan principalmente de ésteres del propanotriol, glicerol o glicerina, y ácidos grasos. Se designan como ésteres triglicéridos. No hay distinción clara entre los términos „‟grasas‟‟ y „‟aceites‟‟. La primera generalmente, significa que está en estado sólido corrientemente, „‟aceite‟‟, se aplica a la forma líquida. La vaguedad de esta terminología es evidente por el hecho de que una grasa en una zona de temperatura ambiente, puede ser un aceite a temperaturas tropicales. Las grasas se caracterizan por: ser insolubles en agua y solubles en la mayor parte de los disolventes orgánicos; poseer un carácter oleaginoso; tener pesos específicos menores que el del agua y ser fácilmente saponificables con álcalis. Los aceites comestibles que no se consumen bajo la forma de sustancias original oleaginosa, se tratan posteriormente, puesto que los aceites vegetales crudos (excepto el aceite de oliva) no son apropiados para su consumo como comestible. El tratamiento de un aceite vegetal es una fase importante de la tecnología de las grasas y aceites (Mehlenbacher, 1979). 23 2.2.2 Los lípidos Las primeras definiciones estaban basadas principalmente en consideraciones de solubilidad, de forma que moléculas tales como los carotenoides y tritepenos se incluían dentro de este grupo. Según esto los lípidos eran considerados como sustancias insolubles en agua, pero solubles en disolventes orgánicos como éter, cloroformo y benceno. Posteriormente se ha dado menos énfasis a las características de solubilidad y las definiciones actuales están basadas en que las moléculas de los lípidos son derivados reales o potenciales de los ácidos grasos y sustancias relacionadas, pero, excluyendo al colesterol y otros esteres, más no a sus esteres (Chapman. 1973). Los lípidos pueden ser separados o aislados con solventes de baja polaridad tales como: tetracloruro de carbono, cloroformo, éter de petróleo, éter etílico, bencina, benceno, tolueno (Baudi. 2006). 2.2.3 Funciones de los lípidos Los lípidos son constituyentes importante en nuestra dieta balanceada, debido a las diferentes funciones que estos cumplen dentro del organismo, entre las cuales se destacan: Función de reserva energética: las grasas neutras suministran calorías, fácilmente utilizables en período de escasez, además de ser un eficiente protector contra el frío externo. Función estructural: los lípidos forman las bicapas lipídicas de las membranas celulares. Además recubren a los órganos, protegiéndolos. Función catalizadora: algunos lípidos favorecen o facilitan las reacciones químicas que se producen en los seres vivos; estas 24 funciones las cumplen las vitaminas lipídicas, las hormonas esteroideas y las prostaglandinas (Maraculla y col. 2001). 2.2.4 Clasificación de los lípidos Debido a la heterogeneidad estructural presentada por los lípidos, ha existido una gran dificultad en la clasificación sistemática de ellos (figura 2.1). No obstante, hoy en día existen diversas formas de clasificar a los lípidos, con base principalmente en las propiedades físicas y químicas que los caracterizan. Una de las maneras de clasificarlos está basada en su capacidad para producir jabones a través de una reacción de hidrolisis usando hidróxido de potasio o sodio para generar sales de ácidos grasos, quedando por consiguientes dos grupos: los lípidos saponificables y los lípidos insaponificables (Baudi. 2006). Figura 2.1. Resumen de la clase de lípidos (Holum, 2005). 25 2.2.4.1 Lípidos saponificables 2.2.4.1.1 Ceras Las ceras vegetales son esteres simples con largas cadenas hidrocarbonadas, son los compuestos más simples de los lípidos saponificables, se encuentran en las capas protectoras de las frutas y hojas, así como en el pelo, las plumas y la piel de los animales. Casi todas las ceras son de cadena larga (aproximadamente entre con número par de átomos de carbono 26-34) por lo que son muy parecidas a los hidrocarburos. Cualquier cera en particular, como la cera de abeja, está formada por una mezcla de compuestos similares, que comparten una estructura. Cualquier cera en particular (figura 2.2), como la cera de abeja, está formada por una mezcla de compuestos similares que comparten una estructura (Holum, 2005). Figura 2.2 Componentes de la cera (Holum, 2005) 2.2.4.1.2 Triacilgliceroles Los triacilgliceroles son triésteres del glicerol (figura 2.3). Los triacilgliceroles son las moléculas de los lípidos más abundantes, estos son ésteres del glicerol y ácidos monocarboxílicos de cadena larga, o ácidos grasos. De manera diferente a los lípidos más complejos, las moléculas de triacilglicerol no tienen sitios iónicos, por lo que algunas veces se denominan grasas neutras. 26 Figura 2.3 Componentes de las grasas y triacilgliceroles (Holum, 2005) Los triacilgliceroles incluyen la manteca de cerdo y de res, todas las grasas animales como la de la leche y los aceites vegetales como el de olivo, maíz, cacahuate, soya, coco y semillas como la de linaza y algodón. Los triacilgliceroles pueden hidrolizarse, saponificarse e hidrogenarse. Durante la digestión, los triacilgliceroles se hidrolizan (figura 2.4). Las enzimas que se encuentra en el tracto digestivo del hombre y los animales catalizan la hidrolisis de las uniones éster de los triacilgliceroles. Figura 2.4 Reacciones de formación de ácidos grasos (Holum, 2005) 27 Los jabones se fabrican mediante la saponificación de los triacilgliceroles (figura 2.5). La saponificación de las uniones éster en los triacilglicerol por la acción de una base fuerte (hidróxido de sodio o hidróxido de potasio) produce glicerol y una mezcla de sales de ácidos grasos. Figura 2.5 Ecuación general de saponificación (Holum, 2005). 2.2.4.1.2.1 Ácidos grasos Los ácidos grasos en su mayoría son ácidos monocarboxílicos no ramificados de cadena larga. Los ácidos grasos que se obtienen de los lípidos de la mayoría de las plantas y animales tienen las siguientes características: 1. Por lo general son ácidos monocarboxílicos, RCO2H. 2. El grupo R generalmente es una cadena no ramificada. 3. El número de átomos de carbono casi siempre es par. 4. El grupo R puede ser saturado o puede tener uno o más enlaces dobles, los cuales son “cis” o “trans”. Las unidades CH2 se presentan entre enlaces dobles. 28 En forma pura, todas las grasas y los aceites están constituidos exclusivamente por triacilglicerol (o triglicéridos), los que a su vez son ésteres de ácidos grasos con glicerol; por consiguiente, dichos ácidos representan un gran porcentaje de la composición de los triacilglicerol y en consecuencia de las grasas y los aceites. Las diferencias de estabilidad a la oxidación, de plasticidad, de estado físico, de patrón de cristalización, de índice de yodo, de temperaturas de solidificación y de fusión, de las grasas y los aceites se deben fundamentalmente a sus ácidos grasos constituyentes (Castillo, 2006). Los ácidos grasos se producen industrialmente a partir de diversas fuentes de grasas, y se utilizan en la elaboración de aditivos para la industria alimentaria. Los de 16 a 18 átomos de carbono, palmítico, oleico y esteárico, se emplean como emulsionantes en forma de sus respectivos ésteres. Además, las sales de calcio y de magnesio del palmítico y del esteárico se usan como anti-aglomerantes en vegetales deshidratados y en otros productos secos porque son insolubles en agua y, al recubrir las partículas sólidas, repelen el agua y evitan la aglomeración. Para su estudio, los ácidos grasos se han dividido en dos grandes grupos, los saturados y los insaturados (Castillo, 2006). 2.2.4.1.2.1.1 Saturados Se muestran sólidos a temperatura ambiente, presentan solo enlaces simples (C-C), Son característicos de la grasa de origen animal (animales terrestres), grasas con esqueleto lineal, número par de carbonos y hacen parte de los triglicéridos, en fuentes vegetales y de bajo peso molecular (<14 carbonos) solo están presentes en la leche de coco y palma, mientras que los de peso molecular mayor (<18 carbonos) se detectan en las leguminosas (Castillo, 2006). Otras características resaltantes son: 29 Muy poco reactivos. La libre rotación de los sustituyentes alrededor de los enlaces sencillos proporciona una gran flexibilidad a la cadena, siendo la conformación más estable aquella en la que dicha cadena se encuentra lo más extendida posible, minimizando así las interacciones repulsivas entre átomos vecinos. Los de cadena corta contribuyen al aroma y al sabor de los derivados lácteos. En ocasiones, su presencia es dañina y en otras es muy deseable, como en los quesos y la mantequilla. Se considera que un consumo excesivo de ellos puede ser la causa de problemas de arteriosclerosis. Por ello se recomienda que no representen más del 10 % de las calorías de una dieta. Su solubilidad en agua es inversamente proporcional al peso molecular Son mucho más estables que los insaturados ante la oxidación; sin embargo, en condiciones de temperatura muy alta (más de 180ºC), como llega a suceder en el freído y en presencia de oxígeno, pueden sufrir reacciones oxidativas. (Badui, 2006). Los saturados son mucho más estables que los insaturados, ante la oxidación; sin embargo, en condiciones de temperatura muy alta (más de 180ºC), como llega a suceder en el freído, y en presencia de oxígeno, pueden sufrir reacciones oxidativas. (Badui, 2006). En la tabla 2.1 se muestra los ácidos grasos saturados más comunes. 30 Tabla 2.1 Ácidos grasos saturados (Badui, 2006) Nombre Nombre trivial científico Butírico Butanoico CH3(CH2)2COOH -5.9 Caproico Hexanoico CH3(CH2)4COOH -3.4 Caprílico Octanoico CH3(CH2)6COOH 16.7 Cáprico Decanoico CH3(CH2)8COOH 31.6 Láurico Dodecanoico CH3(CH2)10COOH 44.2 Mirístico Tetradecanoico CH3(CH2)12COOH 54.4 Palmítico Hexadecanoico CH3(CH2)14COOH 63.0 Esteárico Octadecanoico CH3(CH2)16COOH 69.4 Araquídico Eicosanoico CH3(CH2)18COOH 76.0 Behénico Docosanoico CH3(CH2)20COOH 79.9 Lignocérico Tetracosanoico CH3(CH2)22COOH 84.2 Cerótico Hexacosanoico CH3(CH2)24COOH 87.7 Formula Punto de fusión (°C) 2.2.4.1.2.1.2 Insaturados Predominan en los lípidos y contienen uno, dos o tres grupos alilo, con el doble enlace aislado y con puentes de metileno que siempre tiene la configuración cis, considerada biológicamente activa. Estos ácidos grasos se pueden clasificar según el terminal metilo en tres familias: w-3, w-6 y w-9 (9), siendo los w-3 y w-6 ácidos grasos esenciales. Los ácidos grasos insaturados también se pueden clasificar según la estructura de su molécula en “cis” o “trans”. La mayoría de los ácidos grasos insaturados de la dieta humana tienen conformación cis; sin embargo, la carne y la leche de los rumiantes, como bovinos y ovejas, contienen pequeñas cantidades de ácidos grasos insaturados en forma de trans. Suelen encontrarse en diversas formas, siendo las más comunes: ácido linoleíco (en aceites de maíz, 31 algodón, sorgo y soya) y ácido Araquidónico (Castillo, 2006). Algunas características destacables son: Presentan entre 1 y 6 dobles enlaces, C=C. Adoptan las configuraciones cis y trans. Tienen una gran reactividad química. La presencia del doble enlace cis produce un quiebre en la molécula que aumenta su flexibilidad, lo que influye considerablemente en sus propiedades físicas y tienen notables implicaciones biológicas. La presencia de dobles enlaces impide la libre rotación obligando a la molécula a un giro de la cadena del hidrocarburo haciendo disminuir de esta manera la fuerza de Van der Waals y como consecuencia su punto de fusión disminuye. La mayor parte de los ácidos grasos insaturados que existen en la naturaleza son cis. Se ha reportado que los isómeros trans no tienen las funciones biológicas deseables de los cis. Además, generalmente los isómeros trans de ácidos grasos insaturados tienen efectos nocivos, ya que distorsionan la estructura de las membranas celulares. En general, los aceites líquidos a temperatura ambiente presentan más insaturados que las grasas sólidas; los de peces de agua fría tienen el mayor porcentaje de insaturados, el pollo más que el cerdo, y éste, a su vez, más que la res. Hablar de aceites o grasas saturadas e insaturadas es incorrecto puesto que todas contienen ambos grupos de ácidos grasos, únicamente en distinta proporción (Badui, 2006). En la tabla 2.2 se muestra los ácidos grasos insaturados más comunes: 32 Tabla 2.2 Ácidos grasos insaturados (Badui, 2006) Nombre Punto de Nombre científico Fórmula Palmitoleico Hexadeca-9-enoico C15H29COOH -0.5 Oleico Octadeca-9-enoico C17H33COOH 13.0 Linoleico Octadeca-9:12-dienoico C17H31COOH -5.0 Linolénico Octadeca-9:12:15-trienoico C17H29COOH -11.0 Eicosa-5:8:11:14-tetraenoico C19H31COOH -49.5 Vaccénico trans-Octadeca-11-enoico C17H33COOH 40.0 Gadoleico Eicosa-11-enoico C19H37COOH 23.5 Erúcico Docosa-13-enoico C21H39COOH 38.0 trivial Araquidónic o fusión (°C) 2.2.4.1.2.1.3 Ácidos grasos esenciales Se consideran esenciales el ácido linoleíco (omega-6) y el α-Linolenico (omega-3), ya que deben ser consumidos en la dieta del ser humano, pues este carece de las enzimas necesarias para sintetizarlos (Mahan y col. 2009). Los ácidos grasos esenciales son necesarios para el crecimiento, para el desarrollo y para mantener una buena salud; entre sus funciones se encuentran el ser reguladores metabólicos en los sistemas cardiovascular, pulmonar, inmune, secretor y reproductor, el ser imprescindibles para preservar la funcionalidad de las membranas celulares y la participación en los procesos de trascripción genética (Coss, 2004). Aunque el organismo es capaz de convertir el ácido α-linolénico en ácidos de cadena larga EPA (ácido eicosapentanoico) y en menor medida en DHA (ácido docosahexanoico), dicha capacidad es bastante limitada; por este motivo, estas grasas omega-3 de cadena larga se deben obtener directamente de los 33 alimentos y su fuente más rica son los pescados grasos de aguas profundas como el salmón. (Mahan, Escott-Stimp, & Raymond, 2009) 2.2.4.1.3 Esteres de glicerol Los glicéridos son ésteres de la glicerina. Se utiliza un sistema de numeración para indicar que los dos agrupamientos alcohólicos primarios no son intercambiables. Representando la glicerina según la proyección de Fisher, de forma que el grupo hidroxilo secundario este a la izquierda del C-2 se le llama C-1 y al debajo C-3. El uso de esta numeración estéreo especifica se indica con el prefijo „‟sn‟‟ delante del nombre del compuesto. La creación de esta terminología para distinguir los dos grupos alcohólicos primarios de la glicerina, se ha utilizado para describir la estereoquímica de los derivados, indicando los átomos de carbono que están sustituidos (Chapman, 1973). 2.2.4.1.3.1 Fosfoglicéridos Los fosfoglicéridos tienen unidades de fosfato además de dos unidades acilo, poseen dos enlaces éster del glicerol del lado de los ácidos grasos y un enlace éster del lado del ácido fosfórico, cuya unidad está unida a una pequeña molécula de alcohol mediante una unión de éster fosfato. Sin esta unión el compuesto se llama ácido fosfatídico (Holum, 2005). 2.2.4.1.3.2 Plasmalógenos Los plasmalógenos tienen un grupo éter y éster. Ellos constituyen otra familia de fosfolípidos a base de glicerol y se presentan en grandes cantidades en las membranas de las células nerviosas y musculares. Estos difieren de los fosfoglicéridos por la presencia de un grupo éter insaturado, en lugar de un grupo acilo, en un extremo de la unidad de glicerol (Holum, 2005). 34 2.2.4.1.4 Ésteres de esfingosina Esfingosina o esfingolípidos son los lípidos que poseen el aminoalcohol de cadena larga esfingosina. Son análogos a los derivados lipídicos de la glicerina, siendo ahora la esfingosina su polialcohol característico. Los dos tipos de lípidos a base de esfingolípidos, son las esfingomielinas y los cerebrósidos. También como constituyente importantes de la membranas celulares (Holum. 2005). 2.2.4.1.4.1 Esfingomielinas Son diésteres de fosfato de la esfingosina. Sus unidades acilo se presentan como porciones acilamido, las cuales provienen de ácidos grasos no comunes y que no se encuentran en las grasas neutras (Holum. 2005). 2.2.4.1.4.2 Cerebrósidos Los cerebrósidos no son en realidad fosfolípidos, sino más bien Glucolípidos, es decir, lípidos con una unidad de azúcar (glucosa) y no un sistema de éster fosfato. La unidad de azúcar, con muchos grupos OH, proporciona un sitio fuertemente polar, la cual generalmente es una unidad de D-galactosa, D-glucosa o un derivado amino de estas (Holum. 2005). 2.2.4.2 Lípidos no saponificables 2.2.4.2.1 Esteroides Los esteroides son compuestos alifáticos con pesos formula altos cuyas moléculas tienen la estructura característica de cuatro anillos llamada núcleo esteroides. Varios esteroides tienen una gran actividad fisiológica. Algunos son conocidos son el colesterol, el ácido biliar hormonas adrenocortical, aglucón cardiaco, precursor de la vitamina D3, entre otros (Holum. 2005). 35 2.2.4.2.2 Terpenos Los terpenos, terpenoides o isoprenoides, son lípidos derivados del hidrocarburo isopreno (o 2-metil-1,3-butadieno). Algunos terpenos importantes son los aceites esenciales (mentol, limoneno, geraniol), el fitol (que forma parte de la molécula de clorofila), las vitaminas A, K y E, los carotenoides (que son pigmentos fotosintéticos) y el caucho (que se obtiene del árbol Hevea brasiliensis). Desde el punto de vista farmaceútico, los grupos de principios activos de naturaleza terpénica más interesantes son: monoterpenos y sesquiterpenos constituyentes de los aceites esenciales, derivados de monoterpenos correspondientes a los iridoides, lactonas sesquiterpénicas que forman parte de los principios amargos, algunos diterpenos que poseen actividades farmacológicas de aplicación a la terapéutica (Holum. 2005). 2.2.4.2.3 Eiconoides Los eicosanoides o icosanoides son lípidos derivados de los ácidos grasos esenciales de 20 carbonos tipo omega-3 y omega-6. Los principales precursores de los eicosanoides son el ácido araquidónico, el ácido linoleíco y el ácido linolénico. Todos los eicosanoides son moléculas de 20 átomos de carbono y pueden clasificarse en tres tipos: prostaglandinas, tromboxanos y leucotrienos (Holum. 2005). 2.3 Análisis físicos y químicos Dado que los aceites comestibles de primera calidad tienen un alto valor en el mercado, puede existir la tentación de adulterar los aceites caros con material menos costoso o de vender aceites de calidad inferior como si fueran de mejor calidad. Con el fin de proteger a los consumidores y al comercio, los aceites auténticos están definidos por leyes y normas descritas en una base de datos correspondientes a: contenido en humedad, impurezas 36 y ácidos grasos libres, así como a su valor en peróxido de hidrógeno donde los límites indican si el aceite está sin refinar, total o parcialmente refinado. En la actualidad, a nivel comercial se dificulta más este tipo de adulteraciones, pues empresas e industrias cuentan con métodos muy sofisticados como la Espectroscopia Infrarrojo con transformada de Fourier (FTIR) , siendo una técnica utilizada para el análisis de aceites y grasas comestibles y no comestibles incluyendo lubricantes, a partir del uso de equipamiento de alta tecnología. Además la técnica permite el análisis rápido y preciso de un gran número de muestras, evitando procesos largos y costosos, facilitando el análisis de distintos componentes presentes en el aceite, indica el estado de conservación, pureza y calidad. Así mismo, posibilita evaluar sustancias potencialmente perjudiciales para la salud, como los isómeros trans. A pesar de que en la actualidad existen diversos métodos sofisticados y actualizados que sustituyen varios análisis como pruebas de color, detección de oxidantes y emulsificantes, hoy día aún muchos laboratorios de pequeña escala siguen usando los métodos tradicionales para la identificación de aceites y grasas. Y teniendo en cuenta que la mayoría de los aceites crudos comestibles, están conformados principalmente en un 95 % por triglicéridos, es esta porción del aceite crudo la cual interesa analizar y estudiar, para constatar su posible uso. La porción remanente sin triglicéridos posee cantidades variables de impurezas, tales como ácidos grasos libres y materiales no grasos, generalmente clasificados como gomas, fosfolípidos, pigmentos, esteroles, grano molido, materiales oxidados, ceras, humedad e impurezas. 37 La determinación de impurezas, por los métodos tradicionales es posible a través de un muestreo por triplicado de análisis físicos y químicos que determinen el grado de cada una de éstas, cada una presentes en la muestra; posterior a esto es conveniente aplicar análisis proximales para obtener mayor exactitud al momento de comparar con los rangos y parámetros establecidos para determinados usos (Raposo, 2013). Entre los análisis más comunes se encuentran: 2.3.1 Densidad Las determinaciones densimétricas son simples y de ejecución rápida, generalmente aplicables a los alimentos líquidos o en solución. Algunas veces la gravedad específica es referida como densidad relativa. En el sistema C.G.S. la unidad de masa específica será la correspondiente a un cuerpo que tenga en un centímetro cúbico de volumen un gramo de masa. Si el gramo fuera exactamente la masa del cm3 de agua a 4 °C, la densidad del agua a esta temperatura sería la unidad; siendo tan próxima a un gramo la masa de un cm3 de agua a 4 °C, para estudios que no requieran absoluta precisión no hay inconveniente en tomarla como unidad. Por eso usualmente, se toma como referencia la densidad del agua a 4 °C (Fenema, 1981). La densidad absoluta de la relación de masa por unidad de volumen, es expresado en gramos por mililitros. 2.3.2 Punto de humo y punto de ignición Es la temperatura descomposición tales en como: la que cetonas se y producen aldehídos, compuestos y son de visibles; dependiendo de los ácidos grasos libres y monoacilglicéridos de la grasa. La presencia de 1 % de estos compuestos en un aceite para freirá provoca la 38 reducción de 230 °C a 160 ºC en la temperatura de formación de humos. Al seguir aumentando la temperatura, el aceite será expuesto a una llama externa, repetidas veces, hasta que la muestra alcance dicho punto, lo cual se visualizara con una llama que se mantenga al menos 5 segundos (Badui, 2006). 2.3.3 Índice de acidez El índice de acidez (Ia) se define como el número de miligramos de NaOH requeridos para neutralizar los ácidos grasos libres contenidos en un gramo de grasa. La acidez de las sustancias grasas es muy variable. Generalmente las grasas frescas o recién preparadas no contienen ácidos grasos libres o si los contienen los tienen en muy pequeñas cantidades, suelen aparecer: por hidrólisis enzimática, tratamiento químico, acción bacteriana. Al envejecer, especialmente sino han estado protegidos de la acción del aire y la luz su acidez crece lentamente al principio y con cierta rapidez después. La acidez tiene importancia tanto para aceites comestibles como para los lubricantes, porque ni unos ni otros pueden contener ácidos grasos libres más allá de un límite dado según las normas (Torres, 2012). En su determinación no se emplea agua debido a la insolubilidad en agua de las grasas. Se emplea como disolvente el alcohol etílico, debe hacerse una buena agitación para garantizar la solubilidad de todos los ácidos grasos libres y una buena distribución del indicador antes de realizar la valoración y el cambio de color se observa en la fase alcohólica. La acidez se considera como impureza en las grasas y generalmente se expresa en porcentaje como el número de gramos de ácidos grasos libres contenidos en 100 gramos de grasa. Comúnmente se define en función al ácido libre predominante, que suele ser el ácido oleico (Torres, 2012). 39 2.3.4 Índice de peróxidos También conocido como el proceso degenerativo del aceite en presencia de oxígeno (oxidación), se expresa en mili equivalentes de oxígeno activo por 1 kilogramo de grasa. Los peróxidos formados durante la oxidación de las grasas son de carácter variable, depende de las condiciones bajo las que se formaron. Las grasas sufren oxidación espontánea por el oxígeno del aire, por acción enzimática o por microorganismos, además también actúan la luz, el calor y ciertas impurezas tales como el agua y los metales. La fase inicial de la oxidación de la grasa implica la adición del oxígeno al átomo de carbono del doble enlace con formación de un hidroperóxido, producto de la descomposición primaria de la oxidación de las grasas. Los productos de la descomposición secundaria incluyen: aldehídos, cetonas, ácidos, alcoholes y agua. Durante la primera fase de oxidación de las grasas, hay un cambio muy pequeño en cuanto a composición, sabor y olor, así mismo se produce un aumento gradual en la concentración de peróxidos y no hay cambios significativos en el contenido de ácidos grasos, índices de yodo y saponificación. En el segundo período aumenta la oxidación y se desarrolla la rancidez, presentándose olores y sabores desagradables debidos a la formación de otras sustancias. La resistencia de las grasas a enranciarse se denomina estabilidad. Cuando la rancidez progresa hay cambios en el Índice de acidez, índice de yodo e índice de saponificación. Es decir, este índice mide la cantidad de peróxidos que ocasionan la oxidación del yoduro potásico y por ende el nivel de enranciamiento que presenta el aceite, grasa o harina. Es estimado mediante la titulación con tiosulfato de sodio, valorado después de que la muestra haya sido tratada bajo condiciones específicas con una solución de ioduro de potasio en ácido 40 acético glacial. La cantidad de yodo libre depende de la cantidad de oxígeno disponible en la grasa (Torres. 2012). 2.3.5 Índice de saponificación No es más que los mg NaOH o KOH necesarios para saponificar 1,00 gramo de aceite. El valor o índice de saponificación (SAP) de un aceite o grasa determinado es la cantidad en miligramos de hidróxido potásico, necesaria para saponificar 1 g de aceite o grasa. Cada uno de estos, tiene un valor SAP distinto. Por lo tanto, para saponificar distintos aceites y grasas se necesitan cantidades diferentes de álcali. Cuando se trabaja con una combinación de grasas o aceites se debe determinar el valor del índice de saponificación de la mezcla, para lo cual se debe conocer el valor SAP de cada grasa o aceite, así como el porcentaje de éstos que intervienen en la mezcla. Se debe multiplicar el peso total de las grasas o aceites por el valor SAP combinado para calcular la cantidad necesaria de hidróxido (Ziller, 1996). 2.3.6 Índice de yodo Los aceites comestibles contienen gran cantidad de ácidos grasos insaturados, lo que genera índices de yodo relativamente altos debido a la relación entre el grado de insaturación y el grado de enranciamiento, pues los glicéridos de ácidos grasos con 2 o 3 dobles enlaces son más sensibles a la oxidación; también guarda relación con la densidad (a > Índice de yodo > densidad). El índice de yodo es útil para caracterizar diferentes grasas y para descubrir si están o no mezcladas, varía de acuerdo al cuerpo donde está contenido, ejemplo, los índice de yodo de aceite de pescado son muy elevados (pasan de 120), el de oliva y almendras es inferior a 100, maíz y algodón tienen índices intermedios, grasas animales inferiores a 90 y grasas 41 vegetales entre 60 y 30 (CODEX. 2017). Por lo general las grasas viejas y enranciadas tienen Índices de yodo inferiores a los de las grasas frescas. Por tanto, se puede definir como una medida del número de insaturaciones en las cadenas de ácidos grasos que conforman un triglicérido. Se expresa en forma del porcentaje de halógeno calculado en el iodo, que es absorbido por la grasa, o sea, el número de gramos de iodo que es absorbido por 100 gramos de grasa bajo condiciones de tratamiento con mono cloruro de iodo (Torres, 2012). 2.3.7 Estabilidad oxidativa Se denomina estabilidad a la oxidación a, la resistencia a oxidarse de las grasas y los aceites. En el método Rancimat, se acelera el proceso de oxidación calentando el recipiente de reacción y haciendo pasar aire continuamente a través de la muestra. Este proceso produce la oxidación de las moléculas de ácidos grasos en la muestra. En primer lugar se forman peróxidos como productos de oxidación primarios. Al cabo de un tiempo, los ácidos grasos se descomponen completamente y se forman productos de oxidación secundarios, entre ellos, ácidos orgánicos volátiles de bajo peso molecular como, por ejemplo, ácido acético y ácido fórmico. Estos son transportados por una corriente de aire a un segundo recipiente con agua destilada. Allí tiene lugar una medición continua de la conductividad. El aumento de la conductividad indica la presencia de ácidos volátiles. El tiempo transcurrido hasta la formación de estos productos de reacción secundarios es lo que se denomina «tiempo de inducción», «periodo de inducción» o «índice de estabilidad oxidativa» (OSI, por sus siglas en inglés). Este valor es indicativo de la resistencia de la muestra a la oxidación. 42 Cuanto más largo es el tiempo de inducción, más estable es la muestra (Mahan y col, 2009). 2.4 Oleaginosas Las plantas oleaginosas son vegetales de cuya semilla o fruto puede extraerse aceite, para algunos casos comestibles y en otros casos de uso industrial. Las oleaginosas se dividen en dos grandes grupos: oleaginosas de bajo contenido graso, que son aquellas con un 20% de aceite o menos y las oleaginosas que pueden tener hasta un 60 - 65 % de aceite, por lo que se les considera que son de un alto contenido graso. En Venezuela las fuentes oleaginosas tradicionalmente han estado representada por el coco, el maní, el algodón, ajonjolí, girasol, soya y más recientemente la palma africana (Mazzani, 1983). Otra clasificación de las oleaginosas pueden clasificarse en convencional y no convencional. Convencionales: las correspondientes al primer grupo suelen ser aquellas fuentes naturales que ofrecen un amplio aprovechamiento económico y en forma de material oleoso, entre estas se tienen: el lino, del que pueden extraerse fibras textiles, harinas y semillas alimenticias; el algodón, del cual su semilla es usada para la fabricación de aceite usado en aderezos y panaderías; Colza o nabina siendo uno de los 4 principales aceites refinados a nivel mundial cuyo contenido en ácido erúcico debe ser igual o menor del 5 %. También es llamado aceite de “canola”; la semilla del ajonjolí, contiene amplio contenido de aceite que puede usarse como comestible o en la industria jabonera; El girasol, de gran uso para la alimentación humana por el alto contenido en fibra, carbohidratos y proteínas, entre otras. 43 No convencionales Son el grupo de plantas que por alguna razón aun no son explotadas o estudiadas a fondo, algunas de ellas son llamadas especies promisorias, a la espera de una respuesta oficial por parte del estado para aportes científicos y tecnológicos que contribuyan con su utilización y valor agregado a la materia prima, entre estas se pueden encontrar el inchi, la jojoba, el seje, el pijiguao, el babasú y la coroba, etc (Alemán, 2008). 2.4.1 Palma de coco La palabra coco proviene del portugués “cocu” con referencia al fruto, que sugiere una cara de mono. Cocos nucífera L. Se distribuye en regiones tropicales y subtropicales de África, el Caribe y América del Sur. De esta especie no se conoce diferentes especies de coco. Su mayor variabilidad se presenta en el sureste asiático y en segundo lugar en el Caribe. Se cree que el cocotero original fue de gran talla y con cocos de gruesa corteza (figura 2.6); La variedad más productiva de porte enano, con frutos grandes y jugosos, serían el resultado de la selección humana. Las plantas de este tipo crecen en forma natural en Filipinas y al noreste de Australia. La gran dispersión de esta especie se atribuye a que los cocos flotantes son llevados por corrientes marinas o por acarreo del hombre en barcos como fuente de alimento y bebida, conservando su viabilidad por varias semanas. De esta manera es muy evidente su dispersión en un gran número de costas tropicales del mundo, donde el cocotero ha prosperado a pesar de las plagas, la arena, el viento, el agua salobre, entre otros factores que lo perjudiquen, desarrollándose también en tierras adentro (Sánchez y col, 2002). 44 Figura 2.6. Palma de coco. 2.4.1.1 Características de la palma de coco Cocos nucifera L., pertenece a la familia palmae, que comprende un solo género y a las oleaginosas convencionales. Su número cromosómico es 2n = 32. Es una planta monopódica que mide 12 a 25 m de alto. Su tallo esbelto y estipitoso crece más o menos torcido; a menudo es más ancho en la base, donde puede tener alrededor de 80 cm de diámetro; la porción superior del tronco raramente alcanza los 30 cm. Es una planta monoica que tiene flores masculinas y femeninas reunidas en una inflorescencia que se observa envuelta por una bráctea o espádice. Dicha palma puede encontrarse a alturas de hasta 1.200 msnm (metros sobre nivel del mar). Es una planta tropical que prospera mejor en climas sin marcadas fluctuaciones estacionales, con temperatura promedio superior a 20 °C, precipitación media anual de 1,000 a 1,800 mm, pudiendo soportar mayores precipitaciones en suelos con buen drenaje, en suelos de aluvión tipo migajón arenoso, con presencia de materia orgánica, aireación y con un pH entre 5 y 8. Por su capacidad para crecer en suelos arenosos sujetos a 45 inundación, ha desarrollado mecanismos de adaptación, como un extenso sistema de raíces que le proporciona un anclaje eficiente para soportar fuertes vientos; resistencia fisiológica para tolerar la salinidad del suelo, condiciones alcalinas e incluso heladas ocasionales. La profundidad mínima del suelo para su óptimo desarrollo radicular debe ser de 80 a 100 cm (Sánchez y col, 2002). 2.4.1.2 Fruto de la palma de coco El fruto es una drupa de tres caras, de 20 a 30 cm de diámetro, que pesa alrededor de 1.5 kg, con epicarpio brilloso (capa externa), mesocarpio fibroso (capa fibrosa) de color castaño a rojizo, endocarpio lignificado (concha) o “nuez” que encierra una sola semilla, con endospermo color blanco (pulpa solida de endospermo) y el endospermo liquido (agua de coco) (figura 2.7). El endospermo o reserva alimenticia de la semilla está formado por una porción carnosa o albuminosa y un jugo lechoso dulce, denominados respectivamente como carne y agua de coco. El endospermo carnoso seco se utiliza para producir la copra, de la cual se extrae el aceite de coco. Los frutos requieren de 9 a 10 meses para madurar (Persley, 1992). Figura 2.7. Fruto de la palma de coco. 46 2.4.1.3 Usos de la palma de coco y su fruto Pocas plantas tienen aplicaciones tan variadas como la palma de coco, entre las principales se tiene que, de la cubierta del fruto se saca fibra para la fabricación de fibras textiles y de aislantes térmicos; la cascara dura o endocarpio se utiliza como combustible y frecuentemente como vasija, de ella se obtiene también un carbón de primera calidad. El agua de coco es una bebida agradable y refrescante, la pulpa puede comerse directamente o bien se desmenuza y se deja secar; a menudo se muele y se filtra a presión a través de un lienzo, después de haberle añadido agua, la leche de coco resultante tiene un agradable sabor; pero los principales productos de la pulpa son el aceite y la copra. Sin embargo, existen otros usos quizá no muy nombrados pero son de importancia económica. (Sánchez y col. 2002). 2.4.1.3.1 Aceite de coco No hay que confundir el aceite de coco con el aceite de su palma. Aunque ambos provienen del mismo fruto (el coco), estos se extraen de partes distintas del coco y por tanto tienen propiedades diferentes. El aceite de palma se extrae del mesocarpio, que es la capa fibrosa no comestible que se encuentra inmediatamente después de la piel del fruto, mientras que el aceite de coco se extrae de la pulpa blanca (endoespermo), este se compone casi al 90% de grasas saturadas, siendo la mayoría de ellas los beneficiosos ácidos grasos de cadena Media (MCFA), compuestos aproximadamente en un 45% de ácido laúrico y en menor proporción otros como el palmítico, el esteárico y el mirístico. El ácido oleico está presente con valores inferiores al 6%. El aceite de coco se encuentra de manera líquida a partir de los 25 grados centígrados de temperatura. Por debajo de esa temperatura tiende a solidificarse. Las propiedades del aceite de coco no se alteran al pasar del 47 estado sólido a líquido ni viceversa. Su coloración es blanca en estado sólido y transparente ligeramente amarillenta en estado líquido. Debido a su larga lista de beneficios para la salud, el aceite de coco se usa principalmente en la alimentación y en la cosmética. Debido a que contiene sólo un 9 % de ácidos grasos no saturados se puede decir que es bastante resistente a la ranciedad. Aun cuando el aceite de coco contiene un alto porcentaje de ácidos grasos saturados, estos son de cadena corta, por lo que rápidamente son quemados como fuente de energía y por tanto, no están disponibles para su incorporación en la grasa del cuerpo ni para la síntesis de colesterol. En cambio, los ácidos grasos de cadena larga y las grasas polinsaturadas forman ésteres de colesterol que pueden depositarse en las arterias. Para la extracción de aceite a nivel industrial, la copra se reduce a polvo fino y se somete a calor y a fuertes presiones mediante potentes prensas hidráulicas. El aceite posteriormente se filtra y se purifica. Por su alto contenido de ácido láurico y otros ácidos grasos de cadena corta, que le confieren características especiales, tiene preferencia en el mercado, respecto de otros aceites vegetales particularmente porque tiene un amplio rango de posibilidades para consumo directo y en la industria. El aceite de coco, es empleado en la industria de oleoquímicos, en donde las propiedades hidrofílicas e hidrofóbicas de los ácidos grasos y sus derivados son de particular importancia en la fabricación de una gran variedad de productos tales como: surfactantes y espumas estabilizadoras para detergentes, shampoos, cosméticos, compuestos farmacéuticos, inhibidores de la corrosión, emulsificantes y plastificantes. 48 La extracción del aceite de coco ya sea en frio o en caliente permite versatilidad como alimento debido a que posee un elevado punto de fusión, estabilidad y resistencia a la oxidación y por tanto, a la rancidez (extracción al frio), y presentara resistencia a la rancidez posterior a un proceso de neutralización (extracción en caliente). Por ello puede ser empleado como aceite para freír; en productos lácteos simulados (helados, cremas para café, etc.), así como en la fabricación de galletas, margarinas, etc (Sánchez y col. 2002). 2.4.2 Palma coroba Se le encuentra asociada en la literatura a otros nombres como sinónimos tales como palma yagua, corozo, cucurito, etc. Igualmente en cuanto a la clasificación botánica aparece con diferentes nombres que han originado confusiones históricas (Rodríguez y col, 1980). La nombran como Jessenia policarpa. Pero con el nombre que es actualmente conocida es el de Attalea macrolepis (Stauffer y col. 2006). Es una palmácea de tronco áspero y cilíndrico, sin ramas, con penacho de grandes hojas que se parten en lacinias (figura 2.8). Empieza su producción a partir de los 3 años de haber sido planta con una producción de 20 años. De la coroba tradicionalmente se aprovechan muchas partes, sus hojas se utilizan en el techado de casas y churuatas, el huesito o endocarpio se quema para alejar la plaga, el mesocarpio se consume en forma cruda o cocida, también se emplea en la elaboración de arepas y bollos para añadírselo a las sopas (tolondron) y se prepara también un atol o mazamorra, de su semilla se extrae en forma artesanal un aceite que se usa como aderezo en las comidas o con fines cosmetológicos para el cabello y el tronco se usa en las construcciones rusticas de los habitantes de esas regiones (Alemán y col. 2006). 49 Figura 2.8. Palma coroba (Chirinos y col, 2010). 2.4.2.1 Ubicación de la palma coroba Se encuentra en formaciones boscosas, en suelos arenosos, arenofrancosos y franco-arcillo-arenosos extremadamente ácidos, con baja capacidad de intercambio iónico. Aunque se ubica en sitios asociados a escorrentías, de presiones moderadas del terreno y asociadas a corrientes de agua, no soportan el aguachina miento (Fariñas y col, 2004), se halla a orillas del río Orinoco y de sus afluentes, crecen en arboledas densas y homogéneas conocidos como corobales y se hallan en las orillas de las selvas tropicales colindantes con los pastizales y sabanales (FAO, 1949). Actualmente solo aparece registrada en el Municipio Cedeño del Estado Bolívar (figura 2.9), suponiéndose que esto se debe al problema originario en las clasificaciones. Se le considera autóctona del municipio Cedeño. 50 Figura 2.9 Ubicación de la palma coroba. 2.4.2.2 Fruto de la palma coroba Los frutos son de forma oblonga (figura 2.10), se dan en forma de racimos con un peso promedio de 25 Kg, los cuales nacen de la parte más baja de la copa del árbol. Tienen un color verde en estado inmaduro y amarillo o anaranjado cuando está maduro, tienen un peso individual promedio de entre 20 y 65 gramos. Externamente se asemeja a un coco en miniatura (Alemán y col, 2006). 2.4.2.2.1 Características del fruto de la palma coroba Presenta un cabezal en forma de gorro con un color que va de verde a marrón según la maduración, está en la parte superior y une al fruto con el vástago. El Epicarpio o concha es la parte externa, bastante lisa con una coloración que pasa de verde a amarillo hasta marrón en su etapa seca. El mesocarpio o pulpa es una capa fina, fibrosa que antes de su maduración es blanca y poco agradable al paladar pero al madurar pasa a anaranjado intenso con sabor dulce y bastante húmedo. El llamado endocarpio o huesito, 51 representa la mayor porción en peso del fruto, es liso con algunos ligeros canales de color marrón y semejanza a la cáscara del durazno. La almendra o semilla se encuentra en el interior del endocarpio, tiene sabor similar al coco, una masa compacta muy oleosa y puede haber de una a tres semillas en el interior del endocarpio. Almendra o semilla: Se encuentra depositada en el interior de la cascara, es de forma oblonga, recubierta por una membrana negruzca (epispermo) semejante a la que cubre la semilla de coco, fruto con el cual puede ser comparada, ya que el sabor, color y textura son similares. Constituye el 9% del peso total del fruto; su dimensión puede alcanzar entre 10 y 15 mm de espesor y de 20 a 30 mm de largo. El aceite obtenido de la semilla es considerado como potencial sustituto de los aceites de coco y palmiste de la palma africana. Figura 2.10. Fruto de la palma coroba (Chirinos y col, 2010). Investigaciones realizadas en el marco del proyecto palma Coroba por la Universidad de Oriente, en asociación con la Universidad Simón Rodríguez y el INIA (Monagas) además de otras colaterales han demostrado 52 el gran potencial que tiene esta palmera. En cuanto a las características del aceite del mesocarpio (Alemán y col. 2002) donde se encontró que contiene un 31,9 % de aceite, con una composición de 65,53 % de ácidos grasos insaturados principalmente y 34,4 % de ácidos grasos saturados. Se reportó un contenido de 58,21 % de materia grasa con un bajo índice de acidez (0,71) con un aproximadamente 80 % de ácidos grasos saturados principalmente láurico y un 20 % de insaturados principalmente oleico; también los otros parámetros físico químicos los hacen muy atractivos (Salazar y col. 2002) 2.5 Extracción de aceites La producción de aceites vegetales para consumo humano y no comestibles destinados a la producción de lubricantes, cosméticos, productos farmacéuticos o para biocombustibles, es referida a la remoción del aceite de plantas oleaginosas mediante extracción mecánica o química (figura 2.11). Para seleccionar el tipo de extracción adecuado, primero debe indicarse y conocerse las propiedades de la oleaginosa a tratar, pues por un lado se encuentran los frutos oleaginosos como el coco, la oliva y el maíz, pero del otro lado se encuentran las semillas oleaginosas como la de coroba, el sésamo, la almendra, el argán o el cacahuete. De acuerdo al tipo de oleaginosa, esta tendrá un uso en especial, el cual también infiere al momento de decidir si será una extracción de tipo mecánica o química (Bio Beauty, 2013). 53 Figura 2.11 Diagrama de flujo para la obtención de aceite de oleaginosas. 2.5.1 Tipos de extracción 2.5.1.1 Extracción mecánica o por expeller Este fue el primer método de extracción inventado por los egipcios (alrededor de los años 1650 A.C.) extrayendo aceite de los olivos de manera manual utilizando vasijas de madera y piedras para triturar y hacer presión. Mucho tiempo después, en 1795, surge el llamado “prensado” y fue realizado en Inglaterra utilizando una prensa hidráulica vertical, pero no fue hasta el año 1900 cuando la extracción mecánica fue realmente efectuada de forma continua e industrializada con la invención de la prensa “expeller” continua de tornillo sencillo (Mehlenbacher, 1979). El principio de extracción mecánica se basa en el proceso de molienda a través de la aplicación de presión sobre una masa de productos oleaginosos combinados en bolsas, telas, mallas, u otros. La presión de las semillas oleaginosas se realiza hoy en día casi exclusivamente mediante prensas continuas llamadas normalmente expeller (Fenema, 1981). En la prensa continua clásica se distinguen las siguientes partes principales: alimentación de la semilla, sin fin cónico de presión, cesta y cono regulable de salida o “turtó”. Las prensas continuas son utilizadas para dos fines: 54 a. Extraer la máxima cantidad posible de aceite de una semilla que posteriormente no va a ser sometida a ningún otro proceso. b. Extraer una cierta cantidad de aceite, siendo tratado posteriormente el turto resultante en otro proceso de recuperación del aceite residual. En general estas máquinas con una buena conducción, dejan un residuo de aceite de alrededor 5 %. Durante el tratamiento, la semilla está sometida a muy fuertes presiones, originándose al mismo tiempo un muy fuerte rozamiento entre la semilla, las espiras sin fin, del eje del mismo y las paredes de la cesta. Estas 2 acciones hacen aumentar fuertemente la temperatura que puede superar a los 160 °C en el interior de la cesta. Este aumento de temperatura es negativo por lo que se refiere a la calidad del aceite a posibilidades de uso de estos equipos. Se han construido prensas continuas con capacidad de presión de unos (100 – 150) TM/24h de semilla dejando el turtó con un contenido en aceite de alrededor de 16 – 18 % trabajando con una potencia instalada de (120 – 160) CV. Previo a la extracción deben realizarse ciertos procesos como: Almacenamiento: Las semillas que llegan a la planta para su conservación de la misma deben ser almacenadas con una humedad de 5 a 8 % debe ser sometida a un secado previo a almacenamiento. Limpieza: Las semillas oleaginosas al llegar a la fábrica presentan sustancias extrañas tales como tierra, barro, piedras, elementos metálicos, etc. todos estos elementos extraños deben separarse antes que la semilla pase a ser procesada, ya que se pueden originar graves daños en las instalaciones del proceso. Hoy en día se usan aparatos que utilizan la acción conjunta de cribas y 55 corrientes de aire. La separación se realiza aprovechando la diferencia de densidades entre las semillas y pasar la semilla por separadores magnéticos que pueden ser imanes permanentes o de campo giratorio. Preparación de la semilla: En esta etapa se incluyen todas las acciones necesarias para poner a la semilla de las mejores condiciones tales que permitan la extracción del aceite. Descascarillado: el cual consiste para separar la cáscara de la semilla, algunas semillas no precisan tratamientos especiales, tal como sucede con la colza y el cacahuate, pero hay otros que si lo precisan por ejemplo las semillas de algodón, girasol, soya entre otras. 2.5.1.1.1 Métodos de extracción mecánica Prensado en caliente para extracción de aceite vegetal: también llamado prensado al vapor. En el caso de las semillas oleaginosas, primero hay que descascarillarlas, después se limpian, se laminan o se trituran y finalmente se cuecen normalmente con vapor a 90 o 100 ºC por un determinado tiempo. Posteriormente, hay que exprimirlas a través de una prensa mecánica para separar el aceite vegetal del orujo obtenido tras la cocción (En el caso de extracción en el fruto oleaginoso, el paso de descascarillar se obvia). Analizando este método desde el punto de vista nutricional, representa una completa desnaturalización del producto, por lo que ya no podría llamarse “Aceite Virgen” pues ha perdido o alterado todas sus cualidades nutricionales y sus propiedades cosméticas naturales, lo que probablemente haga necesario la aplicación de algún tipo de refinado 56 en especial. Por tanto, es preferible usar aceites vegetales obtenidos de la primera presión en frío, que, en caso de ser refinados sea mediante un proceso físico para eliminar impurezas que alteren su olor o dificulten su conservación (Hart y col, 1984). Extracción por prensado en Frio: La extracción de aceites prensados en frío se sigue realizando hoy en día en forma simple y artesanal y es aplicable para frutos y semillas. En el caso de la semilla y de frutos como el coco, se descascaran parcialmente y se limpian mediante ventilación y zarandeo para eliminar impurezas, la semilla o copra limpia se rayan o se cortan en trozos más pequeños para luego ser llevados a la prensa, que por lo general es un extrusor a tornillo sinfín, donde se vigila especialmente que la temperatura generada por la presión no supere los 45 °C para asegurar la estabilidad molecular de los ácidos grasos poliinsaturados, se evita la disolución de ceras y otras sustancias y además la perdida de muchas de sus propiedades. Durante varios días el aceite bruto decanta en tanques de acero inoxidable. Luego se bombea por un filtro de algodón descartable y se envasa en botellas de vidrio oscuro o envases de hojalata para evitar la oxidación del aceite por acción de la luz ultra violeta. El refinado se hace innecesario y el aceite conserva el suave sabor propio de la oleaginosa de la cual proviene. 2.5.1.2 Extracción química o por solvente Esta tecnología se inició en Francia alrededor del año 1885 donde los primeros experimentos fueron conducidos utilizando di-sulfato de carbón para disolver el aceite retenido en la pasta de los olivos. Las primeras plantas extractoras por solvente a escala comercial fueron instaladas en Alemania 57 alrededor de 1927-1929 donde la remoción del aceite disponible tomaba lugar en el extractor utilizando hexano como solvente (actualmente es el más utilizado), extrayendo el aceite de las harinas con un cierto tiempo de retención en el extractor y con un consumo de hexano pre-establecido por tonelada de harina procesada. La harina restante debe llevarse a un separador del disolvente para eliminarlo (Bailey, 1961). Hoy día, se conoce que la extracción por solventes es el método más eficaz en la obtención del aceite y el que ofrece mejores ventajas sobre todo en aquellas semillas con bajos contenidos de aceite. Cuando en la materia prima oleaginosa el contenido graso es alrededor de 12 % no resulta económica la extracción por prensa, en tales casos el proceso más adecuado es el de extracción por solvente. Se sabe que la mayor parte del aceite fácilmente extraíble proviene de las células que se rompen durante los procesos de trituración, cocción, presión o laminado, mientras que la fracción más difícil de extraer proviene de las células enteras o rotas parcialmente. La extracción del aceite puede realizarse a temperatura ambiente como también a temperaturas elevadas. 2.5.1.3 Método de extracción artesanal El método artesanal fue uno de los primeros métodos usados, en pequeña escala, para la obtención de diversos productos, en este caso aceite. Algunos de estos procesos se siguen haciendo artesanalmente, y otros escalaron a nivel industrial en función de la tecnología aplicada, por ejemplo, en el aceite de coco es común observar su venta en los mercados. En el caso de la coroba el carácter artesanal prevalece aun, por lo que es cada zona donde es producido le aportan su propia „‟tecnología‟‟, por lo cual no existe aún un método estandarizado. 58 Tecnológicamente se puede clasificar este método, como una separación de fases, en donde la materia prima triturada y molida pasa por un calentamiento con agua, durante un periodo de tiempo, hasta lograrse la separación de la capa oleosa del resto del sistema, para ser separado por decantación (Alemán, 2008). 2.6. Método estadístico 2.6.1 Características del análisis de la varianza (ANAVA) En el año 1925, el Ingeniero Fisher desarrollaron una metodología para comparar promedios provenientes de varias poblaciones, lo cual se conoce como análisis de la varianza (ANAVA ó ANOVA). Este análisis permite comprobar si existen diferencias entre promedios de tres o más tratamientos y para ello se calcula el valor de F, al encontrar el valor de F es posible saber si existen diferencias entre los grupos, pero no entre cuales grupos (Cermeño, 2000). CAPITULO III MARCO METODOLOGICO 3.1 Procedimiento experimental El procedimiento experimental para el desarrollo y cumplimiento de los objetivos planteados en esta investigación, se realizó en un conjunto de áreas específicas como: el laboratorio de alimentos de la Universidad de Oriente, el laboratorio de biomoleculas de la Universidad Nacional Experimental Simón Rodríguez (UNESR), Núcleo Canoabo, estado Carabobo, laboratorios e instalaciones de la refinería de Puerto la Cruz y en el laboratorio de control de calidad de la empresa Coposa, ubicada en Acarigua, estado Portuguesa. En la figura 3.1 se refleja dicho procedimiento en secuencia resumida y general. Donde la materia prima requerida para este proyecto fueron las semillas de coroba y la copra del coco. Figura 3.1 Esquema para el desarrollo del proyecto. 60 3.1.1 Identificar las condiciones operacionales de funcionamiento de los equipos de operaciones unitarias, en la obtención del aceite de coco en la fábrica de aceite refinado de coco En el caso del aceite de coco, el método industrial consistió en la obtención de la copra pasando por una inspección de control de calidad, seleccionando los cocos de acuerdo al estado y apariencia. 3.1.1.1 Molienda Una vez la copra paso por un control de calidad fue llevada a un molino de martillo (ver en anexo C.1), pasando por una malla No. 10 con un tamaño de copra aproximado de 1/8 pulgadas o bien 1,5mm (ver anexo C.2). 3.1.1.2 Calentamiento La copra previamente molida se sometió a calentamiento (de forma indirecta) con vapor a una temperatura de 80°C por un período de 15 minutos. 3.1.1.3 Extracción del aceite de coco Luego de acondicionar la copra se pasó por una prensa tipo expeller (ver anexo C.3), la cual consta de un rendimiento aproximado del 52% (0,566 Kg de aceite / Kg de copra) (ver anexo C.4). El aceite obtenido se deja reposar y luego se envasa. 3.1.1.4 Calculo del rendimiento del proceso de extracción de aceite de coco (Cocos nucifera L.) Una vez terminada la extracción del aceite se calculó el rendimiento del proceso, donde se pesó la muestra de materia prima (copra) que pasó por el molino y los gramos de aceite obtenidos del proceso de obtención de éste. El cual viene expresado por la siguiente ecuación: 61 (Ec. 3.1) Dónde: M2: masa de aceite obtenido (g) M1: masa de muestra molida (g) R: rendimiento de la extracción (%) 3.1.2 Describir el proceso de obtención artesanal del aceite de semilla de coroba (Attalea macrolepis) Para la extracción del aceite de semilla de coroba, fue necesario hacer la recolección de las semillas de forma aleatoria en el sector Corocito, municipio Manuel Cedeño del estado Bolívar, procediendo la misma de frutos ya maduros. La cantidad total de semilla seleccionada fue de 500 g, se aplicó el método artesanal, el cual es un procedimiento tradicional usado por los pobladores del campo. 3.1.2.1 Molienda La semilla se trituró con un martillo (ver anexo C.5) para facilitar el paso por un molino casero de disco, marca corona (ver anexo C.6). 3.1.2.2 Extracción del aceite de la semilla de coroba La muestra previamente molida se colocó en agua hirviendo en una relación 1:2. Se dejó hervir aproximadamente por tres horas hasta lograr la separación de una capa oleosa del resto del sistema. El aceite al flotar se separó por decantación (ver anexo C.7) obteniendo un rendimiento aproximado 48,60 %. El aceite obtenido (265,8 mL) (ver anexo C.8) se almacena en envases ámbar. 62 3.1.2.3 Calculó del rendimiento del proceso de extracción de aceite de semilla de coroba (Attalea macrolepis) Una vez terminada la extracción del aceite se calculó el rendimiento del proceso, donde se pesó la muestra de materia prima (semilla de coroba) que pasó por el molino y los gramos de aceite obtenidos del proceso de obtención de éste. 3.1.3 Mezcla de aceites Se procedió a realizar mezclas de los aceites de coco y semillas de coroba porcentaje masa / masa (100 / 0, 75 / 25, 50 / 50 25 / 75, 0 / 100 % de coco / % de semilla de coroba). 3.1.4 Caracterización de las propiedades físicas y químicas de los aceites puros y de cada mezcla realizada Se realizaron diferentes ensayos que permitieron conocer las propiedades físicas y químicas de los aceites puros y sus mezclas. Estos ensayos se llevaron a cabo según las normas COVENIN para aceites y grasas. 3.1.4.1 Preparación de la muestra de aceite Se aplicó la norma COVENIN 635:1997 en su apartado para un aceite líquido, claro y sin sedimentos. 3.1.4.2 Determinación de la densidad relativa La densidad relativa se determinó según la norma COVENIN 703:2001. Procedimiento: Se calibro un picnómetro. Se limpió, seco y peso el picnómetro. 63 Se llenó con agua destilada recién hervida el picnómetro, se dejó enfriar y mantuvo en un baño de agua a 20°C hasta que alcanzo dicha temperatura. Se introdujo el tapón en el picnometro de tal manera que el capilar estuviera totalmente lleno de agua, y se mantuvo a 20 °C, hasta que no se produjo ningún cambio de volumen. Se limpió el tapón. Se ajustó el volumen del líquido al envase. Se retiró el picnómetro del baño, se secó la parte externa, se dejó en reposo un rato y peso. Se vacío y seco el picnómetro. Se llenó con la muestra de aceite que previamente se mantuvo cercana a 25 °C. se mantuvo el picnómetro en un baño térmico ajustado a 25°C. se introdujo el tapón de manera que el capilar estuviese este completamente lleno de aceite y se mantuvo a la temperatura deseada, hasta que no se produjo ninguna alteración del volumen. Se limpió el tapón y peso. La densidad relativa se determinó según la expresión matemática: (Ec. 3.2) Dónde: Dr: densidad relativa M2: masa de aceite (g) M1: masa de agua (g) α: coeficiente de dilatación del vidrio (0,00001 para vidrio de borosilicato) t: temperatura del aceite 64 3.1.4.3 Determinación del punto de humo El punto de humo se determinó según la norma NMX-F-048-SCFI-2012. Procedimiento: Se llenó la copa abierta para la flama con el aceite. Se suspendió el termómetro en una posición vertical en el centro de la muestra con el fondo del bulbo del termómetro a 6 mm (aproximadamente) del fondo de la copa. Se calentó la muestra rápidamente hasta estar aproximadamente a 42 °C del punto de humeo. Se regulo el calentamiento de tal forma que la temperatura de la muestra aumento de 5 – 6 °C por minuto. El punto de humo fue la temperatura indicada por el termómetro cuando la muestra emitió una delgada y continua corriente de humo azulado. 3.1.4.4 Determinación del punto de ignición El punto de ignición se determinó según la norma COVENIN 3343:1997. Procedimiento: Se agregó aproximadamente 100 mL de aceite, debido a que el vaso viene aforado a este volumen. Teniendo cuidado con que la muestra no sobrepasara el nivel indicado en el interior de la taza, se cerró bien la tapa, se colocó el termómetro de forma tal que el bulbo quedó sumergido en el aceite. Se adaptó la polea de agitación en lento y se encendió el interruptor. Se encendió el mechero y el piloto situando en la tapa porta muestra. Se ajustó la llama del mechero de forma que el aumento de temperatura por minuto no fuera menor que 5 °C ni mayor a los 6,1 °C. 65 Cuando la muestra alcanzo la temperatura de 121 °C, se detuvo la agitación y se realizó la prueba de llama. Se dio vuelta al dispositivo que abre el compartimiento donde estaba la muestra, hasta observar que uno de los pilotos descendía y que la llama aumento, tomando entonces esta temperatura como punto de ignición. 3.1.4.5 Determinación del índice de acidez El índice de acidez se determinó según la norma COVENIN 325:2001. Procedimiento: Se pesó 10 g del aceite líquido y homogenizado en un erlenmeyer de 250 mL. Se calentó 50 mL de alcohol etílico neutralizado, con indicador de fenolftaleína. Se añadió a la muestra de aceite el alcohol neutralizado y dos gotas de indicador. Se tituló la muestra caliente con hidróxido de sodio de 0,1 N, se agito vigorosamente hasta alcanzar el punto de equivalencia, es decir hasta obtener un color rosado pálido. El índice de acidez se determinó según la expresión matemática: (Ec. 3.3) (Ec. 3.4) Dónde: A: Acidez expresada como ácido oleico (g ácido oleico / 100 g aceite) 66 V: Volumen de solución de hidróxido de sodio gastada en la valoración de la muestra (en mL). N: Normalidad de la solución de hidróxido de sodio (eq-g/L). G: masa de la muestra (en g). Ia: índice de acidez. 3.1.4.6 Determinación del índice de peróxido El índice de peróxido se determinó según la norma COVENIN 508:2001. Procedimiento: Se pesó 2,5 g de muestra de aceite líquido y homogenizado en un erlenmeyer, provisto de un tapón esmerilado. Se agregó 15 mL de la mezcla de ácido acético glacial y cloroformo, se agitó y se observó si la muestra está limpia. Se añadió 1 mL de solución saturada de yoduro de potasio, se tapó el erlenmeyer y se esperó 5 minutos en oscuridad. Transcurrido el tiempo, se agregó 15 mL de agua destilada, empleando como indicador una solución de almidón y se valoró con la solución de tiosulfato de sodio de 0,1 N. Se agito vigorosamente el erlenmeyer para liberar el yodo de la capa de cloroformo, se continuó agregando tiosulfato de sodio, hasta la decoloración de la capa acuosa. En forma paralela, se efectuó un ensayo en blanco, el cual es usado como referencia. El índice de peróxido se determinó según la expresión matemática: (Ec. 3.5) 67 Dónde: Ip: Índice de peróxido (meq-g O2 / Kg de muestra de aceite) V: Volumen de tiosulfato de sodio gastado en la titulación del aceite (mL) V1: Volumen de tiosulfato de sodio gastado en la titulación del blanco (mL) P: Masa de la muestra de aceite (g) N: normalidad del tiosulfato de sodio (eq-g/L) 3.1.4.7 Determinación del índice de saponificación El índice de saponificación se determinó según la norma COVENIN 323:1998. Procedimiento: Se pesó 2 g de muestra de aceite líquido y homogenizado en un balón esmerilado. Se agregó 25 mL de solución alcohólica de hidróxido de potasio. Se conectó un condensador de reflujo, se calentó a ebullición en plancha de calentamiento durante 1,5 horas, se agito periódicamente. Se desconectó el condensador y se agregó 1 mL de solución de fenolftaleína. Se tituló el exceso de hidróxido de potasio con una solución de ácido clorhídrico al 0,5 N, hasta desaparición del color rosado de la muestra. En forma paralela, se efectuó ensayo en blanco. El índice de saponificación se determinó según la expresión matemática: (Ec. 3.6) 68 Dónde: V.S: índice de saponificación Vb: volumen de HCl gastado en la titulación del blanco (mL) Va: volumen de HCl gastado en la titulación del aceite (mL) N: normalidad de HCl (eq-g/L) G: masa de la muestra de aceite (g) 3.1.5 Determinación del perfil de ácidos grasos e índice de yodo de las muestras obtenidas El perfil de ácidos grasos e índice de yodo se determinó según la norma COVENIN 2281:2010, en el apartado del método de metóxido de sodio. Procedimiento: Se colocó un tubo de ensayo vacío de 13mm x 100mm en un bloque de calentamiento a 50°C por un minuto antes de añadir la muestra. Se agregó dos perlas de vidrio en el tubo de ensayo y se transfirió dos gotas de muestra de aceite líquido y homogenizado al tubo de ensayo dentro del bloque de calentamiento. Se añadió 1,5 mL de reactivo de derivatización, se dejó reaccionar por dos minutos, se agito el tubo de ensayo cada 3 segundos, y se volvió a colocar en el bloque de calentamiento. Después de dos minutos se removió el tubo de ensayo del calor y se añadió 1mL de heptano y se llenó el tubo con solución saturada de cloruro de sodio, se tapó y se agito vigorosamente por 15 segundos, se dejó separar las fases y se transfirió con un pipeta pasteur la capa de arriba al vial de 2 mL con alrededor de 100 mg de sulfato de sodio anhidro y se colocó la tapa. 69 Se inyecto la muestra inmediatamente en el cromatografo de gases (PERKIN ELMER Auto System XL). 3.1.6 Determinación de la estabilidad oxidativa de los aceites resultantes La estabilidad oxidativa se determinó según método Rancimat regida por norma AOCS 1966, equipo METROHM 743. Procedimiento: Se inyecto una porción de la muestra de aceite en una celda especial. Se incorporó aire a un flujo de 20 L/h a una temperatura de 120 °C. Se midió cambio de conductividad. La estabilidad oxidativa se determinó según la expresión matemática: (Ec. 3.7) Dónde: Estabilidad: estabilidad oxidativa (meses) Ti: horas Rancimat 3.1.7 Análisis estadísticos Para determinar las características físicas y químicas de los aceites % aceite de coco / % aceite de semilla de coroba (0 / 100, 25 / 75, 50 / 50, 25 / 75 y 0 / 100) se realizaron una serie de análisis por triplicados, excepto índice de yodo, la estabilidad oxidativa y perfil de ácidos grasos, pruebas que fueron realizadas en COPOSA y por ende bajo sus normativas. La evaluación estadística de los resultados obtenidos se hizo según el análisis de varianza ANOVA, el cual permite determinar si existen diferencias 70 estadísticamente significativas entre las diferentes muestras a un nivel de significancia de 95 % (α = 0,05), considerando un modelo lineal aditivo de cinco tratamientos (resultado de las mezclas deseadas) y de tres replicas en cada ensayo. 3.2 Descripción de equipos, materiales, sustancia y herramientas 3.2.1 Equipos Balanza analítica Sartorius Basic modelo BA1105 apreciación 1x10-4g. Balanza Adventure OHAUS Modelo AR2140. Filtro Molino de martillo Cromatógrafo de gases Perkin Elmer Tamiz Estufa al aire marca Memmert Mantas calentadoras Electro-Termal Modelo 0250CX1 Molino marca Corona. Plancha calentadora Corning Modelo PC-420 Platina de calentamiento marca Electrothermal Estufa marca BINDER Esterilizador caliente de aire modelo YCO-NO1(34L) Equipo Rancimat METROHM 743 3.2.2 Materiales Matraz redondo de 500 mL Probeta de 10 mL y 25 mL Bureta de 50 mL Pipetas volumétricas y graduadas de 1 mL y 10 mL Balón fondo plano 250 mL y 500 mL de cuello esmerilado 71 Beaker de 50 mL, 100 mL Matraz erlenmeyer 250 mL Picnómetro Tubos de ensayo Pie de bureta Pinzas Soporte de altura graduable Cronometro Espátula Termómetro Embudo de vidrio Papel filtro Agitador Gradilla Goteros Columna de reflujo Mangueras 3.2.3 Sustancias Aceite de coco (Cocos nucífera L.) Aceite de semilla de coroba (Attalea macrolepis) Mezcla de % aceites aceite de coco / % semilla de la coroba (100 / 0 75 / 25, 50 / 50, 25 / 75, 0 / 100) Solución de ácido clorhídrico (HCl) 0,5 N Solución de hidróxido de sodio (NaOH) 0,1 N Solución de tiosulfato de sodio 0,1 N Solución de hidróxido de potasio Solución de ácido aceito glacial cloroformo (60% - 40%) 72 Solución saturada de yoduro de potación Solución de almidón al 1 % Solución de fenolftaleína al 1 % Alcohol isopropilico al 95 % Metanol Agua destilada Vaselina comercial 3.2.4 Herramientas Cuchillo y cucharilla artesanal Rallador artesanal Recipientes artesanales Bandejas artesanales Martillo corriente 3.3 Tabla de datos A continuación se presentan una serie de tablas con los datos correspondientes a cada ensayo realizado a la mezclas de los aceites en distintas proporciones. Tabla 3.1. Valores para determinar el rendimiento de extracción de aceite de la semilla de coroba y del coco. Masa de Aceite Aceite obtenido muestra (g) obtenido (g) (mL) Coco 1000 522,1 566 Semilla de coroba 500 243,1 265,8 Oleaginosa 73 Tabla 3.2. Valores obtenidos para determinar la densidad relativa a una temperatura de 25 °C (% aceite de coco / % aceite de semilla de coroba). Muestra 1 2 3 4 5 Coco / semilla de Masa de Masa de coroba agua (g) aceite (g) 24,6206 22,7109 24,6308 22,7354 24,6309 22,7164 24,6207 22,6283 24,6206 22,6259 24,6205 22,6254 24,6206 22,5649 24,6209 22,5595 24,6103 22,5602 24,6206 22,4959 24,6207 22,4954 24,6209 22,4943 24,6204 22,5068 24,6206 22,4994 24,6312 22,5239 100 / 0 75 / 25 50 / 50 25 / 75 0 / 100 74 Tabla 3.3. Datos de punto de humo y de ignición (% aceite de coco / % aceite de semilla de coroba). Muestra 1 2 3 4 5 Coco / semilla de Temperatura de coroba humo (° C) 100 / 0 75 / 25 50 / 50 25 / 75 0 / 100 Temperatura de ignición (° C) 158,1 223 159,3 222,5 158,4 222,2 161,2 224,8 160,5 224,4 160,8 224,2 166,7 227,2 167,2 226,6 166,4 226,1 173,1 229,1 174,8 228,3 174,4 228,7 180,9 231,2 181,1 230,1 181,5 230,5 75 Tabla 3.4. Valores obtenidos para determinar el índice de acidez (% aceite de coco / % aceite de semilla de coroba) con hidróxido de sodio 0,1054 N. Muestra 1 2 3 4 5 Coco / semilla Masa de de coroba aceite (g) 100 / 0 75 / 25 50 / 50 25 / 75 0 / 100 Volumen de hidróxido de sodio (mL) 9,1016 38 9,2104 36,6 9,2283 37,1 9,9359 26,9 9,9286 25,9 9,9461 26,4 10,1939 23,7 10,3863 23,5 9,7177 22,1 9,9279 11,4 9,9751 11,8 10,2056 12,3 9,8956 0,3 9,8853 0,3 9.9869 0,4 76 Tabla 3.5. Valores obtenidos para determinar el índice de peróxido (% aceite de coco / % aceite de semilla de coroba) con tiosulfato de sodio 0,0958 N y un volumen de blanco de 0,2 mL. Muestra 1 2 3 4 5 Coco / semilla Masa de de coroba aceite (g) 100 / 0 75 / 25 50 / 50 25 / 75 0 / 100 Volumen de tiosulfato de sodio (mL) 2,4475 0,8 2,3312 0,7 2,2089 0,7 2,5601 0,6 2,5 0,6 2,6692 0,7 2,6486 0,5 2,4691 0,5 2,5 0,5 2,5604 0,4 2,5505 0,4 2,5874 0,4 2,5285 0,3 2,3562 0,3 2,4377 0,3 77 Tabla 3.6. Valores obtenidos para determinar el índice de saponificación (% aceite de coco / % aceite de semilla de coroba) con ácido clorhídrico 0,5029 N y un volumen de blanco de 25,4 mL. Muestra 1 2 3 4 5 Coco / semilla de Masa de aceite Volumen de ácido coroba (g) clorhídrico (mL) 2,0577 8,2 2,0103 8,1 2,0832 8,3 2,0440 8,4 2,0141 8,7 2,0289 8,1 2,0409 8,6 2,0654 8,4 2,0602 8,5 2,0626 8,9 2,0858 8,6 2,0961 8,2 2,0398 9,1 2,0693 9,3 2,0415 9,0 100 / 0 75 / 25 50 / 50 25 / 75 0 / 100 78 Tabla 3.7. Valores para calcular la estabilidad oxidativa (% aceite de coco / % aceite de semilla de coroba). Muestra Coco/ semilla de coroba Horas Rancimat 1 100 / 0 1:17 2 75 / 25 1:19 3 50 / 50 1:58 4 25 / 75 7:27 5 0 / 100 7,65 3.4 Muestra de cálculo 3.4.1 Porcentaje de rendimiento Obteniendo el porcentaje de rendimiento de cada uno de los aceites extraído, no es más el cociente de dividir la masa de aceite obtenido entre la masa de la muestra molida. Este procedimiento se usó para conocer el rendimiento de los aceites, para el caso del coco, se tomaron los datos de la tabla 3.1, y sustituyendo en la ecuación 3.1, se tiene: De la misma manera se obtuvo el rendimiento de la extracción del aceite de semilla de coroba, estos resultados se encuentra reportados en la tabla A.1 ubicada en apéndice. 79 3.4.2 Ensayos físicos y químicos de los aceites puros y sus mezclas 3.4.2.1 Densidad relativa Es el cociente de dividir la masa de un volumen determinado de aceite o grasa a una temperatura conocida y a un mismo volumen de agua a 20 °C. Este ensayo se realizó para cada muestra, por ejemplo, tomando los datos de la tabla 3.2 y sustituyendo en la ecuación 3.2, se tiene: Los resultado obtenidos para las diferentes muestras se reflejados en la tabla A.2 ubicada en apéndice. 3.4.2.2 Índice de acidez La acidez libre se expresa en forma de porcentaje de ácidos grasos libres, en cada una de las muestras, para este caso se expresa en forma de ácido oleico, tomando los datos de la tabla 3.4 y sustituyendo en la ecuación 3.3, se tiene: Para obtener el índice de acidez se tomó la acidez libre calculada y se sustituye en la ecuación 3.4: 80 Dicho procedimiento se aplicó al resto de las muestras, estos resultados están reflejados en la tabla A.4 ubicada en apéndice. 3.4.2.3 Índice de peróxido El índice de peróxido es el número de mili equivalentes de oxigeno activo contenido en 1 kilogramo de aceite. Dicho índice se obtuvo tomando los datos de la tabla de datos 3.5 y sustituyendo en la ecuación 3.5: De igual forma se obtuvieron el resto de los índices de peróxido para el resto de las muestras, los resultados se encuentran reportados en la tabla A.5 ubicada en apéndice. 3.4.2.4 Índice de saponificación El método consiste en saponificar completamente una cantidad conocida de aceite. El índice de saponificación se obtuvo tomando los datos de la tabla de datos 3.6 y sustituyendo en la ecuación 3.6: 81 De igual forma se obtuvieron el resto de los índices de saponificación para el resto de las muestras de aceites, los resultados se encuentran reportados en la tabla A.6 ubicada en apéndice. 3.4.3 Estabilidad oxidativa Se determina el tiempo de inducción o valor de estabilidad (es el tiempo necesario para que la muestra alcance un valor de conductividad) y este valor multiplicado por 2 (1 hora equivalente a 60 días) permite calcular el tiempo de duración del aceite en meses. Se tomaron los datos de la tabla número 3.7 y sustituyendo en la ecuación 3.7: De igual forma se obtuvieron el resto de estabilidad oxidativa para el resto de las muestras, los resultados se encuentran reflejados en la tabla A.9 ubicada en apéndice. 3.4.4 Cálculos estadísticos 3.4.4.1 Análisis del ANOVA para la densidad relativa Los valores de la densidad relativa determinados a cada muestra de aceite y sometidos a ANOVA se presentan en la tabla 3.8. 82 Tabla 3.8. Valores de la densidad relativa de los aceites puros y sus mezclas (% coco / % semilla de coroba) Corrida 100/0 75/ 25 50 / 50 25 / 75 0 / 100 1 0,9224 0,9190 0,9164 0,9136 0,9141 2 0,9230 0,9189 0,9162 0,9136 0,9138 3 0,9222 0,9189 0,9166 0,9135 0,9144 ΣXi 2,7676 2,7568 2,7492 2,7407 2,7423 Promedio 0,9225 0,9189 0,9164 0,9136 0,9141 4,2x10-4 5,0x10-5 2,0x10-4 3,0x10-4 5,0x10-5 Desviación estándar T= 2,7676+ 2,7568+2,7492+2,7407+2,7423= 13,7566 K= 5 n= 3 N= 15 Hipótesis planteadas: Hipótesis nula (H0): µ1 = µ2 = µ3 = µ4 (no hay diferencia entre tratamiento) Hipótesis alternativa (H1): µ1 ≠ µ2 ≠ µ3 ≠ µ4 (al menos uno de los tratamientos es diferentes) Nivel de significancia estadística: 95% (α=0,05) 1. Suma de cuadrados total (SCT): SCT= ΣX2ij - T2/N SCT= (0,92242 + 0,92302 + 0,92222 +0,91902 + 0,91892 + 0,91892 + 0,91642+ 0,91622 + 0,91662 + 0,91362+ 0,91362 +0,91352 + 0,91412 +0,91382 +0,91442) – (13,75662/12) 83 SCT= 0,00016519 2. Suma de cuadrados de tratamiento (SCtrat): SCtrat= ΣΣXi2/n – T2…/N SCtrat= (2,76762/3 + 2,75682/3 + 2,74922/3 + 2,74072/3 + 2,74232/3) – (13,75662/15) SCtrat= 0,00016457 3. Suma de cuadrados de error (de residuo): SCE= SCT - SCtrat SCE= 0,00016519 – 0,00016457 SCE= 0,00000062 4. Cuadrado medio de tratamiento CMtrat= SCtrat / (k-1) CMtrat= 0,00016457/ 5-1 CMtrat=0,0000411423 5. Cuadrado medio de error CME= SCE / (N – k) CME= 0,00000062 / 15 - 5 CME= 0,000000062 6. Calculo de la razón F (Fcal): Fcal= CMtrat /CME Fcal= 0,0000411423 / 0,000000062 Fcal= 663,586 84 Valor critico de F (Ftab): Este valor se obtiene al leer la tabla „‟Puntos porcentuales de la distribución F‟‟, para una significancia de 0,05; grados de libertad para el numerador (tratamiento 5 – 1 = 4) y grados de libertad para el denominador (error, 15 – 3 = 12). Según estas coordenadas, en la tabla señalada (ver apéndice figura B.1) se obtiene el valor de: Ftab= F0,05;4/12= 3,26 Tabla 3.9. Tabla resumen del ANOVA para el cálculo de densidad relativa. Fuente de Suma de Grados de Cuadrado variación cuadrados libertad medio Tratamiento 0,0001646 4 Error 0,00000062 -2 0,0001652 2 Residuo total Fcal Ftab 663,586 3,26 0,00004114 2 0,00000006 2 Para el resto de los análisis se procedió a realizar el mismo estudio estadístico ANOVA, y los resultados se encuentran reflejados en el apéndice B. CAPITULO IV ANALISIS Y DISCUSION DE RESULTADOS 4.1 Análisis de los resultados 4.1.1 Porcentaje de rendimiento de la obtención del aceite de coco y semilla de coroba En la figura 4.1 se muestra los rendimientos porcentuales de aceites obtenidos de la copra del coco y de la semilla de coroba, al comparar el rendimiento obtenido para la corpa de coco con los trabajaos realizados por Salcedo (1986) y Figueroa (2013) se tiene que ellos obtuvieron rendimientos del 63,20 % y 32,38 % respectivamente.; Salcedo baso su método en diferenciar el rendimiento según la humedad de la copra, resaltando que a mayor humedad de la copra menos aceite se obtenía de ésta, siendo un factor relevante al momento de la extracción del aceite; por otro lado Figueroa experimento el método de extracción de solvente, observando así las diferencias de los métodos de extracción influye en el rendimiento de la extracción del aceite de coco. Con respecto al rendimiento obtenido para el aceite de semilla de coroba es superior al reportado por Alemán (2008) el cual fue de 46,00%, esto se debe a diferentes factores tales como: causas estacionarias, y a la no estandarización del método de extracción del método artesanal. 86 Figura 4.1 Rendimiento de la extracción de aceite de coco y de la semilla de coroba. 4.1.2 Características físicas y químicas de los aceites de coco, semilla de coroba y de las mezclas resultantes 4.1.2.1 Densidad relativa La densidad es útil, a la hora de diseñar equipos para el procesamiento de aceites. Las densidades relativas obtenidas a la temperatura de 25 °C para los aceites puros y mezclas tratadas, se reflejan en la figura 4.2, donde el valor superior (0,9225) corresponde al aceite de coco puro y el inferior (0,9136) corresponde al aceite de semilla de coroba puro. En las mezclas se observa un efecto aditivo en función de la prevalencia del aceite en cuestión; esta aditividad es muy distinta a lo reportado por Benítez y Gómez (2018), en el cual existe un comportamiento sinoidal, causado por las interacciones estructurales en los aceites, que no se observa en el presente trabajo. En la tabla 3.9 (ANOVA) se observa que existen diferencias significativas entre todos los valores obtenidos. 87 Figura 4.2 Densidad relativa de los aceites puros y sus mezclas. Al comparar los resultados obtenidos de todas las muestras, con los valores límites (0,915 – 0,923) establecidos en la norma COVENIN 30:1997, se aprecia que están dentro de dicho rango. En el estudio realizado por Figueroa (2013) obtuvo un valor superior de 0,9260 para el aceite de coco. En cuanto a la densidad relativa del aceite de semilla de coroba obtenida, se encuentra por debajo del valor publicado por Salazar y col (2004) (0,9600), pudiendo ser una de las razones principales de las diferencia de valores antes mencionadas, el tiempo de cosecha del fruto y el método de extracción usado. 4.1.2.2 Punto de humo y punto de ignición Es importante conocer el punto de humo, ya que es un parámetro relacionado con la calidad del aceite, en la figura 4.3 se observan los valores de punto humo para los aceites estudiados. Siendo el aceite 100% semilla de coroba el que arrojo el mejor y más alto valor, con una temperatura de 181,2 °C para el punto de humo; siendo el valor menor el del aceite de coco 158,6 88 ºC siendo este inferior reportado por Dasilva (2017) 180 °C. En las mezclas se observó un comportamiento aditivo con diferencias significativas en función del aceite prevaleciente. A excepción del aceite de 100% coco, el resto de las muestras están en el rango señalado por Badui (2006) para el caso de aceites de fritura que está en un rango (160-180 °C). El punto de ignición es muy importante por razones de seguridad como lo expresa QUIMIPUR (2013) en su ficha de datos, así por ejemplo el aceite de coco están por arriba de los 200 °C. El comportamiento de las muestras dio un valor aditivo, correspondientes a 230,6 °C para el 100% aceite de semilla de coroba y 222,5 ºC para el 100% aceite de coco, con diferencias significativas para todas las muestras. Estos valores están dentro de lo establecido por QUIMIPUR (2013) para el punto de ignición. (QUIMIPUR, 2013) Figura 4.3 Temperatura de humo y de ignición de los aceites puros y sus mezclas. 89 4.1.2.3 Índice de acidez El índice de acidez es un valor importante debido al contenido de ácidos grasos libre contenido en el aceite, permitiendo así ser considerado en las industrias, por ejemplo como alimento tendrá un valor y otros muy distintos para la elaboración de jabones y cosméticos. En la figura 4.4 se observa que los valores obtenidos se encuentran en el rango de 23,9927 para la muestra 100 % coco y 0,1985 para la muestra de 100 % semilla de coroba. El comportamiento de las muestra fue aditivo en función al aceite prevaleciente, presentando sus valores diferencias significativas en todo momento tal como lo muestra el análisis estadístico. Figura 4.4 Índice de acidez de los aceites puros y sus mezclas. Los valores obtenidos son muy superiores a lo establecido por a la norma COVENIN 30:1997 para aceites comestibles (0,1). Este alto valor se debe al elevado contenido de ácidos grasos libres presentes en los aceites, estos se han formado por la hidrolisis en la estructura básica del triglicérido. 90 El proceso de extracción empleado favorece a la descomposición de las cadenas de triglicéridos, lo cual da origen a una mayor cantidad de ácidos grasos libres, ya que involucra calor y contacto con oxígeno, afectando la calidad de ambos aceites puros. Al comparar los resultados obtenidos, con los estudios realizados por Padrón (2015), donde el índice de acidez del aceite de coco fue de 24,37 y de Alemán (2008) con de 0,23 para el aceite de semilla de coroba, se puede notar que los resultados obtenidos presentaron una disminución, posiblemente por razones estacionarias. En función de los valores reportados se puede someter estas muestras a proceso de refinamiento físico, para ajustarlas a las necesidades de las industrias en particular. 4.1.2.4 Índice de peróxido El índice de peróxido es un indicador del grado de oxidación del aceite. En la figura 4.5 se expresan los resultados obtenidos para los aceites puros y sus mezclas, donde los valores límites se encuentran entre el aceite 100% de coco con 21,9095 meqO2 / Kg y el aceite 100 % de semilla de coroba con 3,9288 meqO2 / Kg. La variación de las muestras en este rango fue aditiva en función del aceite prevaleciente, presentando diferencias significativas. 91 Figura 4.5 Índice de peróxido de los aceites puros y sus mezclas. Según la norma COVENIN 30:1997 el índice de peróxido debe estar en el rango de 2 - 5 siendo el aceite de semilla de coroba el único en entrar en el rango aceptable. El valor de índice de peróxido obtenido del aceite de semilla de coroba duplica al reportado por Alemán (2008) (1,98 meqO2 / g de aceite), esto pudo deberse al tiempo de cosecha. Para el aceite de coco, Benítez y Gómez (2018) reportaron un valor de 3,8095 meqO2 / kg de aceite, mostrando una gran diferencia con respecto al resultado obtenido en el presente trabajo, lo que indica que el aceite ha sufrido un acelerado proceso de oxidación (debido al oxígeno del aire, acción enzimática, la luz, el calor, impurezas como el agua y algunos metales), la principal fuente de este deterioro fue el método de extracción, ya que el empleo de calor en la obtención del aceite afecta las propiedades naturales del coco. 92 En la primera fase de oxidación en los aceites hay un cambio en la composición, color y olor, en la segunda fase se desarrolla la rancidez y es donde se presentan los productos de descomposición tales como aldehídos, cetonas, ácidos alcoholes y agua, acarreando olores desagradables, por lo que hace necesario que las muestras pasen por un proceso de desodorización el cual consiste en eliminar las sustancias volátiles provenientes de la oxidación (Baudi; 2006). 4.1.2.5 Índice de saponificación El índice de saponificación es un valor referencial muy empleado en el proceso de tecnología de jabones, asociado también a la acidez del aceite utilizado. En la figura 4.6, los valores límites se encuentran corresponde a los aceites puros, de coco y semilla de coroba respectivamente 236,6569 mg KOH/g de aceite y 223,8649 mg KOH/g de aceite, presentando las muestras una variación aditiva en función del aceite prevaleciente, existiendo diferencias significativas entre ellos. Es interesante acotar que el aceite de coroba influye en mayor proporción en esta propiedad solo a partir del 50%. Figura 4.6 Índice de saponificación de los aceites puros y sus mezclas. 93 Los resultados obtenidos exceden lo establecido por La norma COVENIN 30:1997 para aceites y grasas comestibles (180-210), lo que indica la gran capacidad de saponificación que los aceites poseen, los cuales podrían ser una buena materia prima para la industria jabonera. En el estudio realizado por Padrón (2015) sobre el aceite de coco fue de 264,81 mg KOH/ g de aceite, presentando una diferencia apreciable con respecto a los valores obtenidos en el presente trabajo debido principalmente por el método de extracción usado .En cuanto al aceite de semilla de coroba Alemán (2008) tuvo un valor de 226 mg KOH/ g de aceite, presentando un valor muy cercano al obtenido. 4.1.2.6 Índice de yodo El índice de yodo es una propiedad química relacionada con la insaturación de la cadena carbonada. En la figura número 4.7 se presentan los resultados del índice de yodo, los valores limites se encuentran entre 24,30 cg I2/g aceite y 9,89 cg I2/g aceite para los aceites de semilla de coroba y de coco respectivamente, presentando las muestras una variación aditiva en función al aceite prevaleciente. Por lo tanto se clasifican como aceites no secantes. De acuerdo a los resultados obtenidos todas las muestras presentan valores inferiores a lo recomendado por la norma COVENIN 30:1997 para aceites y grasas comestibles (56 – 145); Sin embargo el aceite de coco se ajusta a lo establecido por el CODEX (2017) (6,3 - 10,6). Este valor experimental resulto inferior a lo reportado por Padrón (2015) (20,65), posiblemente por causa estacionarias, geográficas u otras. 94 En cuanto al aceite de semilla de coroba el valor obtenido fue superior a lo reportado por Alemán (2008) de 22,11. Las muestras estudiadas son más aptas para en la industria cosméticas. Figura 4.7 Índice de yodo de los aceites puros y sus mezclas. 4.1.3 Determinar el perfil de ácidos grasos en las muestras obtenidas Los ácidos grasos se clasifican en saturados (donde cada átomo de carbono de covalencia 4, está unido a otros dos átomos de carbono y a dos átomos de hidrogeno y tiene forma linean), e insaturados, (donde uno o más átomos de carbono están enlazados a un segundo átomo de carbono mediante un doble enlace, predominando la forma cis). Según el ácido graso predomínate en la muestra se puede emplear como materia prima para la elaboración de productos de interés industrial tales como: jabonera, alimenticia, farmacéutica entre otras. Según lo reflejado en la figura 4.8 se observa que los aceites puros presentan similitud en cuanto al ser clasificado como saturados del tipo láurico. 95 El aceite de coco presento un 90,57% de ácidos grasos saturados, siendo predominante el láurico (49,27), el mirístico (19,93) y el palmítico (8,8); estos valores están cercanos a lo establecido por el CODEX (2017) para el aceite de coco los cuales son: el láurico (45,1 – 53,2), el mirístico (16,8 – 21,0) y el palmítico (7,5 – 10,2). Estos valores experimentales difieren grandemente de lo reportado Benítez y Gómez (2018) presentado un total de saturación del 48,03% con respecto a los ácidos láurico (23,76), mirístico (9,35) y el palmítico (6,2), cabe destacar la influencia del método de fermentación utilizado para la extracción del aceite. En el aceite de semilla de coroba presento un 76,45% de ácidos grasos saturados, siendo predominantes el láurico (39,14), el mirístico (15,79) y el oleico (19,54). Este valor total de saturación es ligeramente inferior al reportado por Alemán (2008) (79,3 %) y al de Salazar y col (2004) (80,506 %) estos valores ligeramente diferentes, se pueden deber principalmente al método de extracción artesanal el cual no está estandarizado, a parte de otras causas. Las mezclas de los aceites presentaron ser aditivitas en función al aceite prevaleciente, siendo importante destacar que la presencia del aceite de coroba mejora la cantidad del ácido oleico (insaturado). En función del carácter láurico de las muestras se puede indicar que es una excelente materia prima para la fabricación de jabones, cosméticos, resinas y emulgentes (Coss, 2004). 96 Figura 4.8 Perfil de ácidos grasos de los aceites puros y sus mezclas. 4.1.4 Analizar la estabilidad oxidativa de los aceites resultantes Este ensayo permite predecir el tiempo de duración del aceite, siendo esto muy valioso en la industria. Las muestras fueron sometidas a un proceso acelerado de oxidación, el cual arrojo que el aceite con mayor estabilidad es el de 100% semilla de coroba con una duración aproximada de 15,30 meses y el del aceite de coco obtuvo un valor de 2,34 meses. En cuanto a las mezclas, estas presentaron comportamiento aditivo en función del aceite prevaleciente. Tanto el aceite de coroba, como la muestra 4 presentaron valores aceptables, pues estudios hechos para el aceite de oliva, bajo el mismo método han obtenido resultados entre 13,68 y 19,56 meses de estabilidad (Rodríguez 2015) tomando en cuenta que el aceite de oliva es considerado como el mejor y principal aceite vegetal y que los resultados obtenidos estén en dicho rango de estabilidad, se puede calificar como un buen tiempo de duración el de las muestras 4 y 5, en el estudio realizado por Alemán (2008) 97 reporto un valor de 9,24 para el aceite de semilla de coroba, para un el método de extracción semiartesanal, siendo este valor inferior al obtenido en la presenta investigación, esto indicó que el método de extracción influye en esta propiedad. La muestra 3 presento tiempo de estabilidad similar al reportado por Navas (2010) para el aceite de semilla de uva (3,1), bajo el método de extrapolación. Y para las muestras 1 y 2 la estabilidad oxidativa obtenida (2,34 y 2,38 meses respectivamente) se encuentra incluso por debajo del valor de duración del aceite de semilla de uva, siendo estos los valores más bajos y recordando que el valor de la estabilidad oxidativa es indicativo de calidad y vida útil de la muestra, lo cual se determinó que son las muestras con mayor necesidad de un proceso de conservación. Figura 4.9 Estabilidad oxidativa de los aceites puros y sus mezclas. 98 4.1.5 Recomendar el uso (cosmético, farmacéutico, alimenticio, entre otros) de los aceites obtenidos de acuerdo a los resultados encontrados Hoy en día las grasa y los aceites son la base de diversos estudios y formulación de nuevos productos o mejorar los ya existentes, debido a la versatilidad que éstas presenta en diversos campos, principalmente por su alto porcentaje de ácidos grasos saturados. Es conocido que el aceite de coco es un potente inhibidor de gran variedad de organismos patógenos desde virus, bacterias, hasta protozoos, debido principalmente por su alto contenido de ácido láurico, el cual lo hace recomendable para la fabricación de cosméticos, farmacéutica, jabones entre otras. En un estudio realizado por Real (2017) demostró que el aceite de coco ayuda atacar la placa dental y prevenir gingivitis, donde concluyó que reduce ampliamente la placa bacteriana, además de presentar ventaja sobre los enjuagues bucales de alto costo. Los productos a partir de aceites que contienen triglicéridos de ácidos grasos laúrico y mirístico, pueden mezclarse con pequeñas cantidades de manteca de cacao para la fabricación de labiales a base de éste (Garces y Cueller. 1997). Según Vásquez (2017) por su alto poder hidratante el aceite de coco ayuda a reducir las horquetillas del cabello, y presentar grandes mejoras a la apariencia física, según sus valores de ácidos grasos como mirístico y palmítico, estos aceites pueden utilizarse como emulsificantes y humectantes en productos cosméticos y cremas de afeitar. 99 A pesar de las diferente opiniones sobre el aceite de coco debido a su alto porcentaje de ácidos grasos saturados (90 %), tiene ventaja debido a que contiene ácidos grasos de cadena media y los cuales no queda almacenado en el cuerpo en forma de grasa. Los ácidos grasos de cadena media han demostrado aumentar el metabolismo. Siendo posible usar estos aceites para la creación de crema no láctea para el café donde la función básica de la grasa es proporcionar blanqueo, cuerpo y viscosidad al café, se usa principalmente grasas láuricas hidrogenadas (Garces y Cueller. 1997). Al realizar este estudio se demostró que el aceite de semilla de coroba presenta grandes similitudes al aceite de coco en sus propiedades debido al parecido en su composición de ácidos grasos, se puede decir que el aceite de semilla de coroba puede ampliar sus aplicaciones en función a este gran parecido que presenta con el aceite de coco. 100 CONCLUSIONES 1. Se identificó un molino de martillo de 100 caballos de fuerza, malla de tamiz 10, con un calentamiento de la copra a 80 °C para facilitar la extracción. 2. La extracción artesanal del aceite de semilla de coroba es un método no estandarizado, pasando por un molino de disco y una separación de fases en la cual se usó el proceso de decantación. 3. Tanto el índice de peróxido (aceite de semilla de coroba) y las pruebas físicas de: densidad relativa, punto de humo y punto de ignición de las muestras analizadas están dentro de los parámetros de las normas COVENIN. 4. Los ácidos grasos predominantes en el aceite de coco son el láurico, mirístico y palmítico, para el aceite de semilla de coroba y las mezclas fueron el láurico, mirístico y el oleico. Clasificándose en su mayoría como saturados. 5. El aceite de semilla de coroba es más resistente a la oxidación pero no tuvo gran influencia sobre el aceite de coco. 6. Todas las muestras pueden ser considerados como fuente para obtener ácidos grasos específicos a ser utilizados en la industrias (jabones, cosméticos, farmacéuticos, emulgentes, agentes tensoactivos, etc) cuando se requiera productos de alta calidad. 7. El aceite de semilla de coroba mejoró positivamente en cuanto a la propiedades físicas y químicas de manera proporcional al porcentaje de aceite de semilla de coroba presente en la muestra, menos en la estabilidad oxidativa. 101 RECOMENDACIONES Estudiar procesos para hidrólisis para los aceites puros de coco y semilla de coroba y sus mezclas, con la finalidad de obtener los ácidos grasos específicos. Realizar estudios para estandarizar la extracción artesanal del aceite de semilla de coroba. Al momento de realizar análisis de laboratorio para los aceites puros y mezclas, realizar más repeticiones en la medición para obtener datos más exactos y precisos. Evaluar el uso de las mezclas de aceites en la elaboración artesanal de jabones y productos similares de uso masivo. Realizar estudios físicos (viscosidad, punto de fusión, refracción, absorción de luz, entre otros) para ampliar el espectro de uso de los aceites y sus mezclas. Evaluar el efecto de refinación tales como: desodorización, neutralización, blanqueo entre otros, en el aceite de coco, en las propiedades evaluadas. 102 BIBLIOGRAFÍA 1. Aleman, R. (2008). "Caracteristicas quimicas del aceite de la semilla de coroba extraido por los metodos solvente, artesanal y semiartesanal". Barcelona: Universidad de Oriente (Ascenso a Profesor Agregado), pp 119. 2. Aleman, R., Belen, D., Zorrilla, M., Bastardo, L., Alvarez, F., y Moreno, M. (2002). "Características fisicoquímicas del aceite del mesocarpio de la coroba (Jessenia polycarpa karts)”. Grasas y Aceites, Puerto la Cruz, Venezuela, vol 53, pp 369-399. 3. Aleman, R., Jimenez, N., y Pinto, K. (2006). “Estudio piloto del potencial agroindustrial de la palma coroba (Attalea macrolepis) en el Municipio Cedeño del Estado Bolívar”. Fundacite Bolívar. Venezuela. 4. Ayala, M. J. (2011). "Evaluacion de la calidad del aceite de mezclas vegetales utilizando en doce frituras sucesivas empleado para freir platano harton verde". Bogotá: Universidad Javeriana, facultad de Ciencias, (Disertación Grado Nutrición y Dietética), pp 47. 5. Badui, S. (2006). "Química de los alimentos". 4ta edicion, Person educacion, Mexico pp 245-297. 6. Bailey, A. (1961). "Aceites y grasas industriales". Reverte, Barcelona, España. 7. Benítez, G. y Gómez, M. (2018) “Evaluación del efecto en las propiedades físicas y químicas del aceite de coco (Cocos nucifera L.) sobre el aceite del mesocarpio de la palma coroba (Attalea macrolepis).”. Barcelona: Universidad de Oriente, Facultad de ingeniería Química, (disertación de grado Ingeniero Químico), pp 86. 8. Bio Beauty. (2013). "Metodos de extracción de los aceites". Recuperado el 26 de agosto de 2018, de Copyright biotrendies beauty: 103 https://beauty.biotrendies.com/metodos-de-extraccion-de-los-aceitesvegetales.html 9. Borgtoft, P.; Balslev, H. (1993). Palmas útiles. Especies ecuatoriales para agroforestería y extractismo. Ediciones ABYA-YALA. Quito, Ecuador. 158 pp. 10. Castillo, S. D. (2006). "Nutrición básica humana". Universidad de Valencia. Valencia. 11. Cermeño, J., (2000). "Estadística y diseño de experimentos". Ingeniería Química, Fondo Editorial UDO. Primera edición, Anzoátegui, Venezuela. 12. Chapman, D. (1973). "Lipidos". Primera edicion. Alhambra. Madrid, pp 162. 13. Chirinos, J., y Rodríguez, G., (2010). "Evaluación de las propiedades fisicoquímicas y reologicas del almidón extraído del mesocarpio del fruto de palma coroba (Attalea macrolepis)". Barcelona: Universidad de Oriente, Facultad de Ingenieria Quimica (disertación grado Ingeniero químico),pp 119. 14. CODEX ALIMENTARIUS, normas internacionales de los alimentos. (2017). "Norma para aceites vegetales especificados (CODEX STAN 210-1999)". 15. Coss, M. (2004). El libro del jabón artesanal. España: Paidotribo. 16. FAO. (1949). "Mision a venezuela Oleaginosas". FAO. Washington, D.C: Organizacion de las Naciones Unidas para la agricultura y la alimentacion, pp 70. 17. Dasilva, C., (2017)."Extraccion de aceite de coco (Cocos nuciferas L.) como estrategiass de aprovechamiento de los productos locales de Mitú". Informe tecnico presentado a VAUPÉS INNOVA, pp 82-89 18. Fariñas, J., Barrios, R., y Diaz, A. (2004). "Algunas aspectos sobre la taxonomia, ecologia y agonomia de a plama coroba". Informe especial 104 presentado a INIA Monagas-Gobernacion del estado Bolivar. Venezuela, pp 83-88 19. Fenema, O. (1981). ''Introduccion a la ciencia de los alimentos''. 1era edicion. Reverte. Barcelona, España. 20. Fennema, O. (2010). “Química de los alimentos”. 3ra Edición. Acribia editorial. Zaragoza, España 21. Figueroa, E. (2013). “Evaluación del rendimiento y caracterización fisicoquímica de la extracción de la fracción lipídica de la copra del coco (cocos nucifera l.) Variedad verde utilizando tres solventes a escala laboratorio”. Guatemala: Universidad de San Juan de Guatemala, facultad de ingenieria. (disertación grado Ingeniero químico), pp 151 22. Garces, I., y Cuellar, M. (1997). “Productos derivados de la industria de la palma de aceite. Usos”. PALMAS. (8): 33-48. 23. Hart, y Fisher. (1984). "Analisis moderno de los alimentos". Acribia. 24. Holum, J. R. (2005). "Fundametos de quimica general, organica y bioquimica para ciencias de la salud". Limusa Wiley. Mexico, pp 570 585. 25. Mahan, L., Escott-Stimp, S., y Raymond, J. (2009). "Dioterapia". Rlsevier Masson. Barcelona. 26. Maraculla, J., Marini, A., y Maraculla, A. (2001). "Bioquímica Cuantitativa". Reverte S. A. Barcelona, España. 27. Marina, A. U. (2002). Norma Mexicana. foods – vegetable and animal fats and oils – (NMX-F-048-SCFI-2006). Mexico. 28. Mazzani, B. (1983). “Cultivo y mejoramiento de las plantas oleaginosas”, Fondo de Investigaciones Agropecuarias (FONAIAP), 1ra Edición, Caracas. 29. Mehlenbacher, V. C. (1979). "Analisis de aceites y grasas". 1ra Edición. URMO, S.A, , España 105 30. Méndez, M. E. (2014). "Cuantificacion y caracterizacion del contenido de solidos y estabilidad termica de diferentes tipos de oleinas de palma africana y mezclas con aceite de soya". (Trabajo de grado para optar por el título de Ingeniera química). Universidad de San Juan de Guatemala Guatemala. 31. Navas, H. (2010). "componentes minoritarios y propiedades antioxidantes de aceites vírgenes y torta residuales obtenidos por presión en frio a partir de fuentes vegetales convencionales y no convencionales". Tesis doctoral. Universidad de Casilla la Mancha. Facultad de Ciencias Químicas. España. 32. Normas internacionales de los alimentos CODEX. (2017). “Normas para aceites vegetales especificados”. Disponible en: HYPERLINK "https://bit.ly/2JtRCVe" https://bit.ly/2JtRCVe , 33. Norma Venezolana COVENIN. (2001). Aceites y grasas vegetales. Numero 30:1997. Norma general. Comision Venezolana de Normas Industriales. 34. Norma Venezolana COVENIN. (1998). Aceites y grasas vegetales. Numero 323:1998. Determinacion del indice de saponificacion. Caracas: Comision Venezolana de Normas Industriales. 35. Norma Venezolana COVENIN. (2001). Aceites y grasas vegetales. Numero 325:2001. Determinacion de la acidez. Comision Venezolana de Normas Industriales. 36. Norma Venezolana COVENIN. (2001). Aceites y Grasas vegetales. Numero 508:2001. Determinacion del indice de peroxido. Caracas: Comision Venezolana de Normas Industriales. 37. Norma Venezolana COVENIN. (1997). Aceites y grasas vegetales. Numero 635:1997. Preparacion de la muestra para análisis. Comision Venezolana de Normas Industriales. 106 38. Norma Venezolana COVENIN. (2001). Aceites y Grasas vegetales. Numero 703:2001. Determinacion de la densidad relativa a t/20°C. caracas: Comision Venezolana de Normas Industriales. 39. Norma Venezolana COVENIN. (2002). Aceites y grasas vegetales. Numero: 2281:2010. Determinacion del perfil de acidos grasos e indice de iodo por cormatografia de gases. Caracas: Comision de trabajo venezolana. 40. Norma Venezolana COVENIN. (1997). Aceites y grasas vegetales. Numero 3343:1997. Punto de llama. Comision Venezolana de Normas Industriales. 41. Padrón, A. (2015). Tesis para obtener el título de Ingeniero Químico Industrial. “Obtención de ácidos grasos a partir de aceite de coco, soya y canola mediante hidrolisis acida”. Instituto Politécnico Nacional. México, D.F. 42. Persley, G. J. (1992). Replanting the tree of life. Towards an International agenda for coconut palm research. C.A.B. International. 156 pp 43. QUIMIPUR. (2013). "Ficha de datos de seguridad del aceite de coco". Madrid, España. 44. Raposo, M. (2013). "Revisión y optimización de los porcesos de refinación de aceite de maíz en APC planta Turmero". Universidad Simón Bolívar. Venezuela 45. Real, A., (2017) “Beneficios de la utilización del oil pulling (aceite de coco) para la reducción de placa bacteriana en los niños de sexto gaño de la unidad educativa Rosa Zarate de la comunidad de san José Puñachizac del Canton Quero” Abato: Universidad Regional Autónoma De Los Andes, facultad de ciencias médicas (disertación licenciado en odontología). pp 120. 107 46. Rodriguez, G., Villanueva, E., Glorio, P., y Baquerizo, M., (2015). "Estabilidad oxidativa y estimacion de vida util del aceite de sacha inchi (Plukenetia volubilis L.)". Universidad Nacional de Trujillo. Facultad de ciencias agropecuarias. 47. Rodriguez, M., y Silva, M. (1980). "Analisis de factibilidad economica de la industrializacion de la coroba". tesis de grado, facultad de Ingenieria Industrial, Universidad de Carabobo, Valencia. Venezuela. 48. Salazar, E., Belen, D., Jimenez, N., y Pinto, K. (2002). "Caracteristicas fisicoquimicas del aceite de semilla de coroba (Jesenia polycarpa Karst)". Grasas y Aceites vol 55., 423-427. 49. Salcedo, G. (1986)." Disminucion del rendimiento de copra y aceite debido a la germinacion del fruto del cocotero". Universidad Autonoma Chapingo. Serie agronomia No. 11. Tabasco, Mexico. 50. Sanchez G., D., y Lopez Rios, G. F. (2002). "Manejo de la palma de coco (Cocos nucifera L.)" Revista Chapingo. Serie Ciencias Forestales y del Ambiente . México. 51. Stauffer, F., y Fariñas, J. (2006). "The identidad of attalea macrolepis (burret) Wess. boer (arecaea)". Candoella, 83-88. 52. Torres, F. (2012). "Control de acidez y oxidación en aceites y harinas de subproductos de origen animal". Poultry processing and rendering consultant. 53. Vásquez, M., (2017) “Estrategias de belleza capilar y su influencia en la imagen física de los estudiantes de tercero de bachillerato de la unidad educativa los Guayacanes del Canton Quevedo, 2017” Quevedo: Universidad técnica de Babahoyo, facultad de ciencias jurídicas, sociales y de la educación. (Disertación licenciatura en ciencias de la educación mención artesanía). pp 145. 54. Ziller. (1996). "Grasa y aceites alimentarios". Acribia S.A. España. METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO Influencia del aceite de la semilla de coroba (attalea TÍTULO macrolepis) sobre las propiedades físicas y químicas del aceite de coco (cocos nucífera l.) extraído por prensado SUBTÍTULO AUTOR (ES): APELLIDOS Y NOMBRES Morón P., Daniela S. Pernia Z., Jhorkley O. CÓDIGO CVLAC / E MAIL CVLAC: 25.387.959 E-MAIL: [email protected] CVLAC: 20.628.421 E-MAIL: [email protected] PALABRAS O FRASES CLAVES: Aceite de la semilla de coroba, Attalea macrolepis, propiedades físicas y químicas, aceite de coco, Cocos nucifera L., extraído por prensado. METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO ÁREA Escuela de ingeniería y ciencias aplicadas SUBÁREA Ingeniería química RESUMEN (ABSTRACT): El objetivo principal de esta investigación fue la evaluación del efecto del aceite de semilla de coroba sobre las propiedades físicas y químicas del aceite de coco. En cuanto a la extracción del aceite de semilla de coroba, se realizó por medio del método artesanal siguiendo la tecnología aplicada por los habitantes de la región de Caicara del Orinoco (selección, recolección, descascarillado, molienda y separación de fases) del cual se obtuvo un rendimiento del 48,60 %. En el caso del aceite de coco, su extracción fue mecánica, bajo el método industrial implementado en una fábrica de aceite refinado de coco ubicada en el oriente del país, (recepción de la copra, disminución de partícula y prensado al vapor) obteniendo un rendimiento del 52,20 %; estos se usaron como base para realizar mezclas de ellos en diferentes proporciones (75/25, 50/50, 25/75) % aceite de coco / % aceite de semilla de coroba respectivamente. Se determinaron y evaluaron las propiedades físicas y químicas de los aceites puros y las mezclas resultantes; los valores obtenidos de los análisis realizados varían de acuerdo a la proporción de aceite de coco en la muestra, presentando diferencia significativa en todos ellos de acuerdo al método estadístico ANOVA. La cromatografía de gases, reporto una variación de ácidos grasos saturados e insaturados, encontrándose ácido laúrico en mayor proporción. En la estabilidad oxidativa se observó que el aceite de coroba aumenta el tiempo de vida útil del aceite de coco. METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO CONTRIBUIDORES: APELLIDOS Y NOMBRES ROL / CÓDIGO CVLAC / E_MAIL ROL Alemán, Rafael CA AS X TU CVLAC: 3.673.390 E_MAIL [email protected] JU E_MAIL ROL Castellar, Francia CA AS TU JU (X) CVLAC: 15.112.271 E_MAIL [email protected] E_MAIL ROL García, Francisco CVLAC: E_MAIL E_MAIL FECHA DE DISCUSIÓN Y APROBACIÓN: 2019 02 05 AÑO MES DÍA LENGUAJE. SPA CA AS 1.195.743 TU JU (X) METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO ARCHIVO (S): NOMBRE DE ARCHIVO TIPO MIME Tesis. Influencia del aceite de la semilla de coroba (attalea macrolepis) sobre las propiedades físicas y EVALUACIÓN. químicas del aceite de coco (cocos nucífera l.) MS.WORD Extraído por prensado.doc ALCANCE ESPACIAL: TEMPORAL: TÍTULO O GRADO ASOCIADO CON EL TRABAJO: Ingeniero Químico NIVEL ASOCIADO CON EL TRABAJO: Pregrado ÁREA DE ESTUDIO: Escuela de Ingeniería y Ciencias Aplicadas INSTITUCIÓN: UNIVERSIDAD DE ORIENTE/ NÚCLEO ANZOÁTEGUI METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO METADATOS PARA TRABAJOS DE GRADO, TESIS Y ASCENSO DERECHOS De acuerdo al artículo 41 del reglamento de trabajos de grado (Vigente a partir del II Semestre 2009, según comunicación CU-034-2009) “Los Trabajos de grado son exclusiva propiedad de la Universidad de Oriente y solo podrán ser utilizadas a otros fines con el consentimiento del consejo de núcleo respectivo, quien lo participara al Consejo Universitario, para su autorización” Morón, Daniela Pernia, Jhorkley Autor Autor Alemán, Rafael Castellar, Francia García, Francisco TUTOR JURADO JURADO POR LA SUBCOMISION DE TRABAJO DE GRADO ING. YRAIMA SALAS