La importancia biol¶ogica de los sistemas amortiguadores
E lis a V e g a A vila y Min a K o n ig s b e r g Fa in s t e in
D e p a r t a m e n t o d e Cie n c ia s d e la S a lu d . D .C.B .S . U A M-I. A .P . 5 5 -5 3 5 , 0 9 3 4 0 M¶ e xic o D .F.
ve g a @xa n u m .u a m .m x; m kf@xa n u m .u a m .m x.
Resumen
El tema de las disoluciones amortiguadoras es una
parte esencial en los cursos de qu¶³mica y bioqu¶³mica.
Sin embargo, la mayor¶³a de los cursos utilizan como ejemplos de soluciones amortiguadoras sistemas
meramente qu¶³micos y dejan de lado la importancia biol¶
ogica de este tipo de soluciones, siendo que
es muy interesante analizar los efectos de los amortiguadores en las reacciones que se producen en los
organismos vivos, en la tierra y en el agua. En este art¶³culo se revisan algunos ejemplos de amortiguadores relacionados con las cuestiones biol¶ogicas, especialmente con los organismos vivos, y de manera muy breve en los sistemas acu¶aticos.
est¶
a formado por un ¶
acido d¶ebil y su base conjugada o una base d¶ebil y su ¶
acido conjugado; de manera
tal que en la misma diluciones coexisten un componente que reacciona ante la adici¶
on de ¶
acidos (la base) y otro con las bases (¶
acido). Como ejemplos tenemos N aHCO3 ¡ N a2 CO3 ; H2 CO3 ¡ N aHCO3 , en
el primer caso el bicarbonato act¶
ua como ¶
acido mientras que en el segundo este act¶
ua como base. Los reguladores de pH que tienen importancia ¯siol¶ogica,
en los mam¶³feros, son del tipo ¶
acido d¶ebil-base conjugada (Valtin, 1973).
Sistemas reguladores que existen en los
mamiferos
Las c¶elulas del organismo funcionan de manera adecuada cuando se mantienen dentro de ciertos par¶
ametros como son la temperatura, la adecuada producci¶
on de energ¶³a, los niveles de sales, agua y nutrientes, as¶³ como el pH de los °uidos corporales. Sin embargo, como los °uidos corporales est¶
an formados por agua y substancias disueltas, son susceptibles a tener variaciones en su pH dependiendo de los alimentos que se ingieran o de reacciones metab¶
olicas normales del organismo. Si estos cambios en el pH son bruscos, pueden llegar a afectar al organismo (Garrido, 1991).
Abstract
Bu®er solutions are an important part of chemistry
and biochemistry courses, but their biological importance is rarely discussed. This paper discusses the
must important bu®er systems in men that are in the
lung and in the kidney where the pH of the blood is
regulated. Bu®er systems in aquatic niches are also brie°y reviewed.
Introducci¶
on
El concepto te¶orico as¶³ como y la preparaci¶
on pr¶
actica de las disoluciones amortiguadoras (tambi¶en llamadas disoluciones reguladoras, tampones o bu®ers) son temas fundamentales dentro de los programas de qu¶³mica y bioqu¶³mica que se imparten tanto en la divisi¶
on de
Ciencias B¶asicas como en la Divisi¶on de Ciencias Biol¶
ogicas y de la Salud. Sin embargo, su importancia biol¶ogica, ecol¶ogica y ¯siol¶ogica se discute poco. En este art¶³culo pretendemos dar algunos ejemplos interesantes que podr¶³an utilizarse en la docencia de estos temas.
La composici¶
on qu¶³mica del plasma sangu¶³neo (la
porci¶
on °uida de la sangre) y del °uido intersticial (el °uido que se encuentra entre las c¶elulas de
los tejidos) son muy similares entre si, en contraste a la composici¶
on del °uido intracelular. Los principales electrolitos del plasma sangu¶³neo y del °uido intersticial son los iones N a+ y Cl¡ , mientras
que para el °uido intracelular son los iones K + y
HP O42¡ . Esto indica que las c¶elulas tambi¶en deben tener sistemas espec¶³¯cos que les con¯eran la
capacidad para transportar y regular la concentraci¶
on de iones a las que se encuentran expuestas. Es
por ello que en el plasma sangu¶³neo, en los °uidos intersticiales y en las c¶elulas, se encuentran substancias como el ¶
acido carb¶
onico, los aniones bicarbonato, fosfato mono y dib¶
asico y algunas prote¶³nas,
que participan en la regulaci¶
on del pH, y que lo
Recordemos que una disoluci¶on amortiguadora tiene la caracter¶³stica de aminorar los cambios bruscos
de pH1 debidos a la adici¶on de ¶acidos o bases fuertes as¶³ como el que su pH no se modi¯ca por efecto de diluciones (Harris, 1992). El amortiguador
1 E l t¶
er m in o p H se u tiliza p ar a in d icar la con cen tr aci¶
on
d e p r oton es q u e tien e u n a solu ci¶
on , es d ecir , su acid ez. S e
ex p r esa com o: p H = ¡log[H + ]
23
24
ContactoS 42, 23{27 (2001)
mantienen en un intervalo constante de 7.35 a 7.45
(Wilbraham y Matta, 1989).
El control del pH en la sangre se realiza de manera conjunta por los sistemas respiratorio y urinario (Valtin, 1973, Wilbraham y Matta, 1989,
Olvera, 1988).
Los sistemas amortiguadores m¶as importantes en la sangre son prote¶³nas como la hemoglobina (HHb), la oxihemoglobina (HHbO2 ), y los sistemas de bicarbonato (HCO3¡ =H2 CO3 ) y fosfato (H2 P O4¡ =HP O42¡ ). El sistema HCO3¡ =H2 CO3
predomina en el plasma y °uido intersticial, mientras que el fosfato (H2 P O4¡ =HP O42¡ ) y prote¶³nas (Hb=HHbO2 ) predominan en los espacios intracelulares (Valtin, 1973).
El metabolismo celular, normalmente y de manera
natural, genera una gran cantidad de protones, que
de no eliminarse acidi¯car¶³an el l¶³quido intersticial y
el plasma. En este caso el primer sistema amortiguador que interviene es el del ¶acido carb¶
onicobicarbonato. Los protones excretados por los tejidos activos reaccionan con el bicarbonato de la sangre dando lugar a la formaci¶on del ¶acido carb¶
onico.
donde posteriormente se libera el di¶
oxido de carbono
mediante la reacci¶
on:
HCO¡ + HHbO2(ac) ¡!
á
3(ac)
¡
+ H2 O + CO2(g)
HbO2(ac)
#
A
lo s te jido s
#
Ex ha la do
Donde HHbO2 es la forma ¶
acida de la oxihemoglobina mientras que HbO2¡ es la forma b¶
asica de la misma. Esta reacci¶
on tambi¶en se desplaza hacia la derecha ya que la oxihemoglobina es un ¶
acido m¶
as fuerte (pKa = 6.68) que la hemoglobina (pKa = 7.93),
lo que facilita la conversi¶
on del HCO3¡ a CO2 .
Cuando la sangre llega a los pulmones, el H2 CO3
se descompone en H2 O y di¶oxido de carbono por la
acci¶
on de la anhidrasa carb¶onica (enzima presente en
los gl¶
obulos rojos). El CO2 que se produce durante
la descomposici¶on del HCO3¡ se expele a trav¶es de
los pulmones (Wilbraham/Matta, 1989).
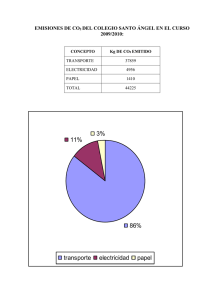
En caso de que se presente una acidez muy elevada, pronto se consumir¶³an todos los aniones bicarbonato y el sistema amortiguador m¶
as importante de la sangre se agotar¶³a. El hecho de que esto no suceda, se debe a la contribuci¶
on amortiguadora del sistema renal, donde los ri~
nones son la fuente de nuevos aniones bicarbonato. Como se aprecia
en la ¯gura 1, el CO2 se transporta fuera de los tejidos por la sangre que entra por los nefrones, como parte del ¯ltrado (1), y por la acci¶
on de la anhidrasa carb¶
onica se forma el ¶
acido carb¶
onico (2)
el cual se disocia en HCO3¡ y H + (3). Los protones son intercambiados por iones sodio (4), de manera que por cada N a+ que se bombea, las c¶elulas de
la pared del t¶
ubulo excretan un prot¶
on hacia la orina. Los iones sodio y bicarbonato penetran dentro del torrente sangu¶³neo a trav¶es de los capilares
pr¶
oximos al t¶
ubulo distal (5).
- o nic a H2 O + CO2
H2 CO3 a nhidra sa c a rb¶
Pero, >qu¶e pasa con los protones que pasan a formar
parte de la orina?
H + + HCO3¡ ¡! H2 CO3
El di¶
oxido de carbono que se forma en los tejidos
durante el metabolismo, es acarreado por la sangre
principalmente en forma de ion bicarbonato. En dicha reacci¶
on tambi¶en participa la hemoglobina en
su forma ¶
acida (HHb) y b¶asica (HB ¡ ). Ya que las
substancias presentes en los °uidos corporales est¶
an
disueltas en agua se emplea (ac) para indicar el medio acuoso.
¡
¡
¡!
H2 O + CO2(ac) + HB(ac)
á HHb(ac) + HCO3
ba se
a c ido
#
A
lo s pulmo ne s
El H2 CO3 es un ¶acido m¶as fuerte (pKa = 6.1 en
la sangre) que la hemoglobina (pKa = 7.93), por
lo que la reacci¶
on anterior tiende a desplazarse a la
derecha y el destino del HCO3¡ son los pulmones en
Se sabe que la orina generalmente es ¶
acida, sin embargo, dicha acidez tambi¶en debe ser regulada o de
lo contrario se generar¶³an alteraciones a nivel renal.
Para impedir que la acidez aumente de manera considerable, el organismo cuenta con un sistema amortiguador de fosfatos mono y dib¶
asicos que regulan el
pH en valores cercanos a 6.0.
H + + HP O42¡ ¡! H2 P O4¡
Si los sistemas respiratorio y renal se encuentran funcionando en condiciones ¶
optimas, el pH
de la sangre se mantiene en 7.4 y la proporci¶
on de HCO3¡ =H2 CO3 es de 20:1.
La importancia biol¶ogica de los sistemas amortiguadores. Elisa Vega Avila y Mina Konigsberg Fainstein. 25
F ig .1 . Lo s io ne s bic a rbo na to se re inte g ra n a la sa ng re , po r lo s ri~no ne s e n un pro c e so de 5 e ta pa s.
26
ContactoS 42, 23{27 (2001)
Este mismo sistema amortiguador de fosfatos tambi¶en se encuentra de manera importante en las
c¶elulas sangu¶³neas. Su reacci¶on en este caso es la
siguiente:
H2 P O4¡
2¡
+
+ H2 O á
¡! HP O4 + H3 O
El pKa del H2 P O4¡ en los °uidos corporales es de
6.8, por lo que el rango en el cual presenta su m¶
axima
capacidad amortiguadora (pKa §1) es de 5.8 a 8.8
(Day y Underwood, 1989). El intervalo en el cual el
pH del plasma sangu¶³neo es compatible con la vida
es de 7.00 a 7.80 (Valtin,1973), esto indica que el
H2 P O4¡ tiene un poder amortiguador espec¶³¯co y
compatible con los sistemas vivos.
Si por alguna raz¶on los sistemas amortiguadores no
funcionan de manera adecuada, se puede presentar
una acidosis (pH < 7.35) o alcalosis (pH > 7.45) como consecuencias de alteraciones respiratorias o metab¶
olicas (Olvera 1986, Valtin 1973, Wilbraham y
Matta, 1989). Como ejemplo de alcalosis respiratoria pensemos en una respiraci¶on profunda y r¶
apida
en la cual se exhala demasiado CO2 (g), y como consecuencia la presi¶on parcial del CO2 en los pulmones es m¶
as baja que en los tejidos, por lo que el CO2
se difunde de la sangre a los pulmones, lo que afecta el equilibrio CO2 =H2 CO3 =HCO3¡ normal en la
sangre.
p¶e rdida de CO2
"
¡
+
H2 O + CO2 ¡!
á H2 CO3 ¡!
á H + HCO3
¾
dire c c i¶o n e n la q ue se de spla z a e l e q uilibrio
De acuerdo al principio de Le-Chatelier, al disminuir
la cantidad de CO2 , el organismo responder¶a produciendo m¶
as CO2 , lo que hace que el equilibrio se desplace hacia la izquierda (producci¶on de H2 O y CO2
y disminuci¶
on de H2 CO3 , H + + HCO3¡ ).
En caso de que se tuviera una presi¶on parcial elevada
de CO2 , este se difunde de los pulmones a la sangre,
lo que ocasiona que el equilibrio se desplace hacia
la derecha, como se observa en la reacci¶on, lo que
ocasionar¶
a acidosis respiratoria.
a ume nto de CO2
#
¡
+
H2 O + CO2 ¡!
á H2 CO3 ¡!
á H + HCO3
dire c c i¶o n e n la q ue se de spla z a e l e q uilibrio
En la acidosis metab¶
olica, los protones se difunden
desde los tejidos al riego sangu¶³neo, desplazando el
sistema CO2 =H2 CO3 =HCO3¡ hacia la izquierda para restablecer el equilibrio.
a ume nto de H +
"
+
¡!
H
+ HCO3¡
H2 O + CO2 ¡!
H
CO
á 2
3 á
¾
dire c c i¶o n e n la q ue se de spla z a e l e q uilibrio
Este desplazamiento disminuye la concentraci¶
on de
HCO3¡ y aumenta la conecntraci¶
on de H2 CO3 , lo
que trae como consecuencia una disminuci¶
on en la
relaci¶
on HCO3¡ =H2 CO3 . La alcalosis metab¶
olica se
presenta por la p¶erdida de aniones, principalmente
Cl¡ , de¯ciencia de K + , o la administraci¶
on de medicamentos del tipo de sales alcalinas.
a ume nto de HCO3¡
"
¡
+
H2 O + CO2 ¡!
á H2 CO3 ¡!
á H +HCO3
¾
dire c c i¶o n e n la q ue se de spla z a e l e q uilibrio
Sistemas reguladores en el agua
Entre los factores que contribuyen a los cambios de
pH en el agua del subsuelo y en los lagos de una determinada regi¶
on geogr¶
a¯ca, se encuentran los vientos, el clima, el tipo del suelo, las fuentes de agua,
la naturaleza del terreno, las caracter¶³sticas de la vida vegetal, la actividad humana as¶³ como las caracter¶³sticas geol¶
ogicas de la regi¶
on.
El principal amortiguador natural en el agua es el ion
bicarbonato (pK1 = 6.35, pK2 = 10.32) (Skoog et al
1995). Dado que la capacidad amortiguadora de una
soluci¶
on es proporcional a la concentraci¶
on del amortiguador (Day y Underwood, 1989), la susceptibilidad del agua a acidi¯carse depender¶
a en gran medida de su capacidad amortiguadora. En el agua, la
fuente m¶
as importante del ion bicarbonato es la piedra caliza o carbonato de calcio, CaCO3 , la cual
reacciona con los iones hidronio de acuerdo a la siguiente ecuaci¶
on:
+
¡
2+
¡!
CaCO3(s) + H3 O(ac)
á HCO3(ac) + Ca(ac)
Los lagos, en cuyo fondo abunda la piedra caliza presentan concentraciones relativamente elevadas de bicarbonato disuelto, y por tanto son menos susceptibles a la acidi¯caci¶
on. El granito, la piedra arenosa, la grava y otros tipos de rocas que tienen poco o nada de CaCO3 se asocian con lagos que tienen
La importancia biol¶ogica de los sistemas amortiguadores. Elisa Vega Avila y Mina Konigsberg Fainstein. 27
una gran susceptibilidad a la acidi¯caci¶on. La capacidad amortiguadora de los lagos junto con el pH
de la precipitaci¶on pluvial correlacionan con la vida acu¶
atica. Sin la existencia de los sistemas amortiguadores naturales, ser¶³a dif¶³cil la supervivencia de
la vida acu¶
atica en el planeta.
Conclusi¶
on
Los ejemplos anteriores muestran como las disoluciones amortiguadoras est¶an relacionadas con los sistemas biol¶
ogicos. En especial se trataron los sistemas biol¶
ogicos relacionados con los mam¶³feros, debido a que pueden ser de mayor inter¶es para los alumnos. Sin embargo existe una gran cantidad de ejemplos en donde los sistemas amortiguadores ayudan
a mantener y regular el pH en otros sistemas fundamentales como son los suelos y el agua. Todo esto nos indica la gran importancia que tienen los sistemas amortiguadores en mantener la vida en el planeta. Por u
¶ltimo, el leer este art¶³culo nos lleva a re°exionar que la mayor parte de los temas que se estudian en materias b¶asicas como f¶³sica o qu¶³mica, tienen una aplicaci¶on biol¶ogica y que su estudio pudiera ser muy interesante y enriquecedor.
2. Garrido, P. A, Qu¶³mica. Para Ciencias de la
Salud. Interamericana-McGraw-Hill de Espa~
na,
Madrid, 1991, p. 218-244.
3. Harris, D. C., An¶
alisis Qu¶³mico Cuantitativo,
Grupo Editorial Iberoam¶erica, S.A. de C.V.
M¶exico, 1992, p.191-202.
4. Olvera, D. Bioqu¶³mica y Fisiolog¶³a. Nueva
Editorial Interamericana S.A. de C.V. M¶exico.
1988, p. 34-39.
5. Skoog, A. D., West, D. M., y Holer, F. J.,
Qu¶³mica Anal¶³tica, 6a edici¶
on, McGraw-Hill,
M¶exico, 1995, p.181-183.
6. Valtin, H. Renal Function: Mechanisms Preserving Fluid and Solute Balance in Health. Little, Brown and Company. Boston, 1973, p. 149196.
7. Wilbraham, A. C. y Matta, M. S. Introducci¶
on
a la Qu¶³mica Org¶
anica y Biol¶
ogica. AddisonWesley Iberoamericana, S.A., 1989, p.378-385.
Referencias
1. Day, Jr. R. A y Underwood, R. A., Qu¶³mica
Anal¶³tica Cuantitativa, 5a edici¶on, PrenticeHall Hispanoamericana, S.A, M¶exico, 1989,
p.188-194.
cs