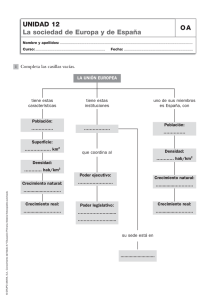
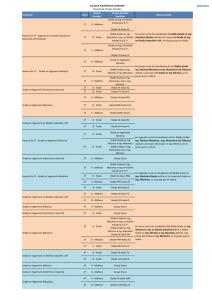
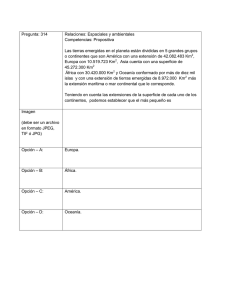
- Ninguna Categoria
Diversidad de Mamíferos en la Amazonía Peruana: Tesis
Anuncio
UNIVERSIDAD NACIONAL DE LA AMAZONÍA PERUANA Escuela de Formación Profesional de Ciencias Biológicas “DIVERSIDAD Y ESTADO ACTUAL DE MAMÍFEROS MAYORES ENTRE LAS CUENCAS DE LOS RÍOS TIGRE Y NAPO, AMAZONÍA PERUANA” TESIS Autor: Luis Alberto López Ramirez 2014 JURADO CALIFICADOR Y DICTAMINADOR _______________________ Blgo. Arturo Acosta Díaz Dr. Presidente _____________________________________ ___________________________ Blga. Meri del Pilar Ushiñahua Álvarez Mag. Zoo Blgo. Willy Rafael Sandoval Meza Miembro Miembro ii ASESORES _____________________________ _____________________________ Blga. Etersit Pezo Lozano MSc. Blgo. Rolando Aquino Yarihuamán Asesora-UNAP Asesor-UNMSM iii ACTA DE SUSTENTACIÓN iv DEDICATORIA A mi madre Sra. YOLANDA, por ser mi columna vertebral en todo lo que hago y por enseñarme que los logros se consiguen con sacrificio y esmero. A mi hermana PILAR y familia en general por el apoyo incondicional brindado antes y durante el desarrollo de mi tesis. v AGRADECIMIENTO A The Mohamed Bin Zayed Species Conservation Fund, Idea Wild y Universidad Nacional Mayor de San Marcos (UNMSM), por el soporte económico y material proporcionado para el desarrollo de la presente tesis, el cual fue ejecutado dentro del Proyecto: “Distribución, Abundancia de Atélidos (Atelidae: Primates) y Amenazas para su Supervivencia en la Amazonía Peruana” Fase I. Mi sincero y honda gratitud a mi asesor, Blgo. Rolando Aquino, responsable del proyecto antes mencionado, a quien tuve el honor de conocerlo, y por la confianza puesta en mí, además de transmitir su enorme conocimiento hacia mi persona para la ejecución de este proyecto de investigación y de mi tesis. Mi agradecimiento a mi asesora de tesis, Blga. Etersit Pezo MSc. por sus excelentes orientaciones, consejos y por confiar ciegamente en mi persona durante el desarrollo de la tesis. Además, agradecer infinitamente a la Blga. Emerita Tirado quién fue mi brújula en mi época de estudiante en la introducción del estudio de los mamíferos, en particular los primates. Especial deferencia a mis colegas Iris Arévalo, Elvis Charpentier, Gabriel García y al Sr. Gilmer Montero, con quienes compartí encantadoras e imborrables experiencias durante mi permanencia en los bosques, y quienes me apoyaron en la colecta de los datos de campo. A todos los guías de campo de las diferentes comunidades asentadas entre las cuencas Tigre y Napo, sin ellos, tampoco no se habría cristalizado la ejecución del trabajo de campo y el cumplimiento de nuestros objetivos. vi INDICE DEL CONTENIDO Pag. JURADO CALIFICADOR Y DICTAMINADOR ............................................................. ii ASESORES ........................................................................................................... iii ACTA DE SUSTENTACIÓN ..................................................................................... iv DEDICATORIA....................................................................................................... v AGRADECIMIENTO .............................................................................................. vi INDICE DEL CONTENIDO ..................................................................................... vii LISTA DE FIGURAS ................................................................................................ x LISTA DE TABLAS ................................................................................................. xi LISTA DE ANEXOS ............................................................................................... xii RESUMEN ......................................................................................................... xiii I. INTRODUCCIÓN ............................................................................................. 1 II. REVISIÓN DE LITERATURA ............................................................................. 3 2.1. Riqueza de mamíferos mayores en la Amazonía peruana ............................ 3 2.2. Densidad poblacional de los mamíferos en la Amazonía peruana ............... 8 2.3. Amenazas para las poblaciones de mamíferos en la Amazonía peruana ... 15 III. MATERIALES Y MÉTODOS ............................................................................ 20 3.1. Área de estudio............................................................................................ 20 3.1.1. Sectores de muestreo .......................................................................... 20 3.2. Métodos....................................................................................................... 25 3.2.1. Censos por transecto lineal ................................................................. 25 3.2.2. Registros asistemáticos........................................................................ 28 vii 3.2.3. Entrevistas............................................................................................ 28 3.2.4. Determinación de la riqueza y composición........................................ 29 3.2.5. Estimación de la densidad poblacional................................................ 29 3.2.6. Identificación de las amenazas ............................................................ 30 3.2.7. Análisis y procesamiento de datos ...................................................... 31 IV. RESULTADOS ............................................................................................... 35 4.1. Riqueza y diversidad de mamíferos mayores .............................................. 35 4.1.1. En el área de estudio ........................................................................... 35 4.1.2. En los sectores de muestreo ................................................................ 35 4.1.3. Índices de diversidad ........................................................................... 37 4.1.4. Índices de similaridad .......................................................................... 39 4.2. Densidad poblacional de los mamíferos ..................................................... 41 4.2.1. En el área de estudio ........................................................................... 41 4.2.2. En los sectores de muestreo ................................................................ 41 4.3. Amenazas para las poblaciones de mamíferos ........................................... 45 4.3.1. En el área de estudio ........................................................................... 45 4.3.2. En los sectores de muestreo ................................................................ 48 V. DISCUSIÓN .................................................................................................. 59 5.1. Riqueza y diversidad de mamíferos mayores .............................................. 59 5.1.1. En el área de estudio ........................................................................... 59 5.1.2. En los sectores de muestreo ................................................................ 61 5.2. Densidad poblacional de los mamíferos ..................................................... 63 5.2.1. En el área de estudio ........................................................................... 63 5.2.2. En los sectores de muestreo ................................................................ 67 viii 5.3. Amenazas para las poblaciones de mamíferos ........................................... 71 5.3.1. En el área de estudio ........................................................................... 71 5.3.2. En los sectores de muestreo ................................................................ 72 VI. CONCLUSIONES ........................................................................................... 74 VII. RECOMENDACIONES ................................................................................... 76 VIII. REFERENCIAS BIBLIOGRÁFICAS .................................................................... 77 IX. ANEXOS ...................................................................................................... 91 ix LISTA DE FIGURAS Pag. Figura 1. Ubicación de los sectores de muestreo en el interfluvio Tigre-Napo. ....... 24 Figura 2. Representación gráfica del método de censo por transecto lineal. .......... 28 Figura 3. Vial abandonado para el remolque de madera comercial. ........................ 51 Figura 4. Linea sísmica (izquierda) y campamento base (derecha) abandonados.... 54 Figura 5. Individuo adulto de Lagothrix lagotricha "choro" muerto por cazador..... 55 Figura 6. Campamento abandonado por la actividad maderera. ............................. 55 Figura 7. Trocha carrozable que une los ríos Napo y Putumayo. .............................. 56 x LISTA DE TABLAS Pag. Tabla 1. Sectores de muestreo para la evaluación de los mamíferos. ...................... 25 Tabla 2. Longitud recorrida (km) por sector de muestreo en el área de estudio. .... 26 Tabla 3. Riqueza y composición de especies por sector de muestreo. ..................... 38 Tabla 4. Índices de diversidad comparativa por sector de muestreo. ...................... 39 Tabla 5. Especies compartidas e índices de similaridad por sector de muestreo. .... 40 Tabla 6. Densidad poblacional de los mamíferos por sector y área de estudio. ...... 46 Tabla 7. Actividades que ocasionan impactos negativos a la fauna silvestre. .......... 58 xi LISTA DE ANEXOS Pag. Anexo 1. Ficha de Evaluación (censos por transectos). ............................................ 92 Anexo 2. Longitud total recorrida (km) por especie en el interfluvio Tigre-Napo. ... 93 Anexo 3. Especies y número de observaciones por sector de muestreo. ................ 94 Anexo 4. Porcentaje (%) de avistamiento de los mamíferos durante los censos. .... 95 Anexo 5. Variación del tamaño de grupo de los mamíferos por sector evaluado. ... 96 Anexo 6. Glosario. ..................................................................................................... 97 xii RESUMEN El documento contiene información sobre la diversidad, densidad poblacional y amenazas para la fauna silvestre que habitan entre las cuencas de los ríos Tigre y Napo localizado en el nororiente de la Amazonía peruana. Para este propósito fueron conducidos censos por transecto complementada con observaciones fuera de censos y con información proveniente de las entrevistas a cazadores. Como resultado de las observaciones sistemáticas y asistemáticas en el área de estudio fueron registradas 45 especies agrupadas en 7 ordenes, 20 familias y 37 géneros, siendo los carnívoros y primates los más representativos con 10 y 17 especies, respectivamente, entre sociales y solitarios. Por otro lado, 12 especies resultaron compartidas entre los cinco sectores de muestreo, en tanto que la mayor similitud ocurrió entre los pares Huanganayacu-Curaray, Nanay-Curaray, y Napo-Curaray. Las densidades poblacionales más altas fueron para Lagothrix lagotricha “choro” (55 ind./km2), y Lagothrix poeppigii “choro común” (36.2 ind./km2) y las más bajas para Tapirus terrestris “sachavaca” (0.27 ind./km2) y Mazama nemorivaga “venado cenizo” (0.65 ind./km2). La caza y la deforestación son las principales actividades que constituyen amenazas para los mamíferos mayores y fauna silvestre en general, puesto que la excesiva caza y disminución de hábitats afectan a las poblaciones, en particular para aquellas especies susceptibles a las moderadas perturbaciones de los bosques. De los resultados obtenidos, los sectores más diversos fueron los ríos Curaray y Napo con 37 y 29 especies, respectivamente. El río Curaray presento las densidades poblacionales más altas a los otros sectores sobresaliendo L. poeppigii xiii (77.5 ind./km2) y Tayassu pecari “huangana” (33.8 ind./km2) y las más bajas presentaron los ríos Itaya y Nanay, entre ellos Alouatta seniculus “coto” (1.7 ind./km2) y Mazama americana “venado colorado” (0.11 ind./km2). Por ultimo, como consecuencia de la sobrecaza y deforestación Ateles belzebuth “maquizapa de frente amarilla” está localmente extinta en los sectores evaluados, excepto en el río Curaray, en tanto que T. pecari, A. seniculus y T. terrestris se encuentran camino a la extinción local; para el resto de especies, en particular ungulados sus poblaciones estarían sujetos a la sobrecaza. xiv I. INTRODUCCIÓN El Perú como integrante de la región neotropical es uno de los países que cuenta con una gran diversidad de mamíferos (1). En sus bosques alberga 508 especies, por lo que el Perú es considerado como el tercer país en el neotrópico con mayor diversidad de especies (2), por su parte la IUCN (3), lo considera como el quinto país más diverso a nivel mundial. Esta diversidad es mayor en la selva baja y varía de acuerdo a los diferentes ecosistemas y tipos de hábitats (2). La alta diversidad desafortunadamente está siendo amenazada por actividades como la caza, agricultura migratoria, ganadería, exploración y extracción de petróleo, entre otros (4) (5) (6) (7) (8) (9). Estos impactos ocasionan impactos negativos como perdida de hábitats, desaparición y/o extinción de especies de vertebrados, reducción en la tasa de dispersión de semillas y disminución de plantas alimenticias (10) (11) (12) (13) (14). En cuanto al área de estudio, pocos son los estudios realizados para determinar la diversidad y abundancia de los mamíferos, asi como amenazas para sus poblaciones. Así entre los ríos Tigre y Putumayo figuran los ríos Curaray Pucacuro y Arabela (17) (18), Nanay (19), Itaya (6) (20) (21) (22) (23) (24) (25) (15) (16), y los bosques aledaños de la carretera Iquitos–Nauta y Reserva Nacional Allpahuayo Mishana (27) (28). (26) Asímismo, se realizaron inventarios rápidos entre ellos están los que se hicieron en los ríos Pucacuro Nanay, Mazán y Arabela (32), (29), Curaray Putumayo (30), (33), Ampiyacu, Apayacu y Putumayo Yanayacu (34) y Yaguas–Cotuhé (35). (31), No obstante, con excepción de la parte alta del río Itaya, todavía existen sectores que 1 aún falta conocer estos aspectos como la cuenca media del río Tigre, cuenca alta del río Nanay, cuenca media y alta de los ríos Napo y Algodón, y la cuenca del río Curaray próximo a la frontera con el Ecuador. Es en este contexto y con el propósito de continuar incrementando el conocimiento sobre los mamíferos, fue llevado a cabo este estudio dentro del marco del proyecto de investigación intitulado: “Distribución y Abundancia de Atélidos (Atelidae: Primates) y Amenazas para su Supervivencia en la Amazonía Peruana”, cuyo propósito estuvo orientado a determinar las especies de mamíferos mayores que habitan y el estado en que se encuentran sus poblaciones entre las cuencas de los ríos Tigre y Napo. Para cumplir con este propósito fueron planteados los siguientes objetivos específicos: 1) Determinar la riqueza y abundancia de los mamíferos mayores para el área de estudio y para cada sector de muestreo, 2) Estimar la densidad poblacional para el área de estudio y para cada sector de muestreo, 3) Identificar las actividades que constituyen amenazas para la supervivencia de sus poblaciones. 2 II. REVISIÓN DE LITERATURA 2.1. Riqueza de mamíferos mayores en la Amazonía peruana En la cuenca del río Nanay como resultado de sus observaciones directas e indirectas y el registro de animales muertos y despojos, reporta 39 especies de mamíferos. Además, menciona que en su parte alta fue el sector más diverso con 38 especies agrupados en los siguientes ordenes: Cingulata (3 especies), Pilosa (4 especies), Primates (11 especies), Rodentia (6 especies), Carnívora (8 especies), Perissodactyla (1 especie) y Cetartiodactyla (4 especies) (19). En la parte alta del río Itaya basados en entrevistas, observaciones directas e indirectas (vocalizaciones y rastros) realizadas durante los censos (sistemático) y fuera de censos (asistemático) lograron el registro de 48 especies de mamíferos. De ellas las más representativas pertenecieron a los carnívoros con 14 especies, seguido por los primates con 11 especies y roedores con 9 especies (24). En los bosques de Allpahuayo Mishana mediante entrevistas, observaciones directas, vocalizaciones, huellas, entre otras, reporta el registro de 36 especies de mamíferos, de los cuales el orden Primates sobresalió con 11 especies, seguido por Carnívora con 9 especies (27). En la cuenca del río Pucacuro, después de un inventario fundamentada en avistamientos, vocalizaciones, rastros y otras huellas, dan como resultado 44 3 especies de mamíferos agrupadas en los siguientes ordenes: Cingulata (4 especies), Pilosa (5 especies), Primates (12 especies), Rodentia (7 especies), Carnívora (11 especies), Perissodactyla (1 especie) y Cetartiodactyla (4 especies) (29). En las cabeceras de los ríos Ampiyacu, Apayacu y Yaguas como resultado de sus observaciones directas e indirectas (huellas, rastros de actividad alimenticia, afilamiento de garras, vocalizaciones, cuevas, entre otras) dan cuenta de la presencia de 33 especies de mamíferos. La mayor diversidad fue registrada en el sector Yaguas con 27 especies, donde sobresalieron los Primates con 9 especies, y Carnívora y Rodentia, ambos con 5 especies (31). Después de un inventario rápido en base a observaciones directas e indirectas (huellas, heces, madrigueras, huecos, restos de comida, entre otros) en las cabeceras de los ríos Nanay, Mazán y Arabela, dan cuenta del registro de 33 especies de mamíferos. Asimismo, sostienen que la mayor diversidad fue encontrada en el sector de Panguana (río Arabela) con 30 especies, sobresaliendo los primates con 12 especies y los carnívoros con 7 especies (32). Entre los ríos Putumayo y Lagartococha en Güeppi (Ahora Parque Nacional Güeppi Sekime), reportan la presencia de 34 especies de mamíferos. Entre los sectores muestreados, resaltan a Redondococha donde registraron 29 especies; de las 34 especies en total, 15 correspondieron a los carnívoros, 11 a los primates y 8 a los roedores (33). 4 En un inventario rápido en las cabeceras de los ríos Yaguas y Cotuhé mediante avistamientos directos e indirectos (huellas y otros rastros de actividad) y la instalación de cámaras trampa registraron 36 especies de mamíferos. Resaltan al sector de Cachimbo para el cual reportan 28 especies, siendo los primates los más representativos con 9 especies, seguidos por los carnívoros y roedores, ambos con 6 especies (35). Después de una evaluación basada en avistamientos directos e indirectos, vocalizaciones, animales muertos y mascotas, dan cuenta del registro de 30 especies de mamíferos para la cuenca del río Pastaza. Entre sus resultados hacen mención de San Antonio de Bancal (río Uritoyacu) como el sector de mayor diversidad con 23 especies, entre los que sobresalen los primates con 10 especies, en tanto que los roedores y carnívoros estuvieron apenas representados por 3 y 2 especies, respectivamente (50). Basándose en observaciones directas y registro de cráneos en la zona de Yavarí y Yavarí-Mirín, dan cuenta de la presencia de 35 y 46 especies de mamíferos, respectivamente. En el Yavarí-Mirín, las 46 especies estuvieron agrupadas en los siguientes ordenes: Cingulata (4 especies), Pilosa (4 especies), Primates (13 especies), Rodentia (7 especies), Carnívora (13 especies), Perissodactyla (1 especie) y Cetartiodactyla (4 especies) (51). Entre el Ojo de Contoya, Tapiche y Sierra del Divisor, después de haber realizado un inventario rápido mediante observaciones directas e indirectas e instalación de 5 cámaras trampas, reportan 35 especies de mamíferos. Además, indicaron que el sector del Tapiche fue el más diverso con 30 especies, sobresaliendo los primates con 12 especies y luego los carnívoros y roedores, ambos con 5 especies (52). Producto de un inventario rápido en los ríos Gálves, Blanco y Yaquerana correspondiente a la etnia de los Matsés da cuenta del registro de 40 especies de mamíferos. Resalta a Choncó como el sector de mayor diversidad con 34 especies, siendo los Primates y Rodentia los ordenes más representativos con 12 y 5 especies, respectivamente (53). Como resultado de sus observaciones directas e indirectas durante el inventario rápido realizada entre los ríos Pauya y Pisqui en la Cordillera Azul, lograron el registro de 27 especies de mamíferos. Entre sus resultados destacan al sector Pisqui donde registraron la más alta diversidad con 25 especies agrupadas en los siguientes ordenes: Primates (9 especies), Rodentia (6 especies), Carnívora (6 especies), Perissodactyla (1 especie) y Cetartiodactyla (3 especies) (54). En la microcuenca baja y media del río Blanco y alrededores de la comunidad de San Pedro basado en observaciones directas y registros de cráneos durante muchos años da cuenta del registro de 48 especies de mamíferos agrupados en los siguientes ordenes: Cingulata (4 especies), Pilosa (4 especies), Primates (14 especies), Rodentia (10 especies), Carnívora (11 especies), Perissodactyla (1 especie) y Cetartiodactyla (4 especies). Del total de especies registradas, siete son consideradas de vida larga y ellas son Myrmecophaga tridactyla “oso hormiguero”, 6 Priodontes maximus “Yangunturo”, Lagothrix lagotricha “choro”, Ateles chamek “maquizapa negro”, Puma concolor “Lluichupuma”, Panthera onca “otorongo” y Tapirus terrestris “sachavaca” (55). En base a observaciones directas, vocalizaciones y huellas durante una evaluación rápida realizada entre los ríos Tambopata (Departamento de Madre de Dios) y Távara (Departamento de Puno) registraron 36 especies de mamíferos, sobresaliendo el sector denominado Collpa Guacamayos con 33 especies agrupados en los siguientes ordenes: Cingulata (1 especie), Pilosa (4 especies), Primates y Carnívora (ambos con 8 especies), Rodentia (7 especies), Lagomorpha (1 especie), Perissodactyla (1 especie) y Cetartiodactyla (3 especie). Entre las especies, es oportuno resaltar a M. tridactyla “oso hormiguero”, P. onca, T. terrestris y A. chamek, todas consideradas como de vida larga (56). En la cuenca baja del río Urubamba como resultado de sus observaciones directas e indirectas dan por confirmado la presencia de 43 especies de mamíferos. Además, mencionaron que el sector San Martin-3 presentó la mayor diversidad con 28 especies, los cuales estuvieron agrupados en los siguientes ordenes: Cingulata (1 especie), Pilosa (3 especies), Primates (6 especies), Rodentia (6 especies), Lagomorpha (1 especie), Carnívora (7 especies), Perissodactyla (1 especie) y Cetartiodactyla (3 especies) (57). En base a observaciones directas e indirectas, así como entrevistas y el registro de otros autores dan por confirmado la presencia de 55 especies de mamíferos para el 7 área conformada por Cocha Cashu−Pakitza y la parte alta del río Purús. Resalta al Purús como el sector con mayor diversidad (54 especies), seguido por Cocha Cashu−Pakitza (52 especies). Las 55 especies fueron agrupadas en los siguientes ordenes: Cingulata (4 especies), Pilosa (5 especies), Primates (15 especies), Rodentia (9 especies), Lagomorpha (1 especie), Carnívora (16 especies), Perissodactyla (1 especie) y Cetartiodactyla (4 especies) (58). Empleando entrevistas y registros directos e indirectos durante el inventario rápido en la cuenca media del río Tambopata registraron 26 especies de mamíferos. Entre los sectores inventariados sobresale Curva Alegre con 13 especies, siendo los primates los más representativos (59). Basados en observaciones directas e indirectas (vocalizaciones, huellas, madrigueras), animales cazados y el hallazgo de restos y despojos, dan cuenta del hallazgo de 41 especies de mamíferos mayores para la parte alta del río Itaya. Los primates y carnívoros fueron las más representativos, ambos con 11 especies, seguido por los roedores con 8 especies (60). 2.2. Densidad poblacional de los mamíferos en la Amazonía peruana En los bosques adyacentes a los ríos Napo y Curaray con un longitud censada 132 Km, estimaron en 13.5 ind./km2 la densidad poblacional de Saguinus tripartitus “pichico dorado” (15). 8 En los bosques comprendidos entre los ríos Aushiri-San Antonio, Curaray-Nashiño, Curaray-Arabela y afluentes del río Napo basados en censos por transecto lineal estimaron en 1.5 y 16.5 ind./km2 la densidad de Ateles belzebuth “maquizapa de frente amarilla” (16). En base a 647 km de longitud censada en la cuenca del río Pucacuro, estimaron la densidad poblacional para Pecari tajacu “sajino” y Tayassu pecari “huangana” en 1.5 ind./km2 y 3.9 ind./km2, respectivamente (17). En base a 164.6 km de longitud censada proporcionan densidades para los primates que habitan en el Lote 39, concesión petrolera situada entre los ríos Curaray, Arabela y Pucacuro cerca de la frontera con Ecuador. Los autores resaltan las densidades para Lagothrix poeppigii “choro común” (30.64 ind./km2), A. belzebuth (13.27 ind./km2) y Saguinus fuscicollis “pichico común” (14.78 ind./km2) (18). Proporciona estimados de densidad poblacional con un total 484 km de longitud censada para zonas sujetas a diferente presión de caza en la cuenca media y alta del río Nanay. Los resultados indican bajas densidades para ungulados, en particular P. tajacu (0.36–1.8 ind./km2), Mazama americana “venado colorado” (0.51–1.96 ind./km2) y Mazama gouazoubira (Ahora M. nemorivaga) “venado cenizo” (0.36 ind./km2) y para algunas especies de primates como Alouatta seniculus “coto” (0.09–0.13 ind./km2) y L. poeppigii (0.14–9.6 ind./km2), en tanto que las densidades más altas fueron para los mamíferos considerados de tamaño pequeño como S. fuscicollis (10.9–23.7 ind./km2) y Saimiri sciureus (4.37–32.1 ind./km2), Dasyprocta 9 fuliginosa “añuje” (0.65 ind./km2–1.73 ind./km2) y Nasua nasua “achuni” (0.71–1.9 ind./km2) (19). Teniendo como cobertura 1,021 km de censos proporcionan densidades para mamíferos de caza de la parte alta del río Itaya. Los resultados para la mayoría de las especies evaluadas indican bajas densidades, excepto para S. sciureus (18.2 ind./km2) y L. poeppigii (15.4 ind./km2). Entre las especies, A. seniculus con 0.15ind./km2 fue la más escasa (20). En los alrededores de la carretera Iquitos-Nauta determinaron la abundancia de mamíferos, siendo los primates los más abuntantes, entre ellos S. fuscicollis (1.6–4.8 grupos/10 km) y Callicebus lucifer “tocón negro” (0.3–3.7 grupos/10 km), en tanto que la abundancia de cérvidos como M. americana y M. gouazoubira fueron relativamente escasos con 0.2 ind./10 km y 0.5 ind./10 km, respectivamente (26). En los bosques de Allpahuayo-Mishana determinó el índice de abundancia para los mamíferos, siendo los más abundantes los de tamaño pequeño como S. fuscicollis (0.3–4.7 grupos/10 km), S. sciureus (0.3–1 grupos/10 km) y los menos abundantes fueron para los considerados como de tamaño grande, entre ellos M. gouazoubira (0.3–0.4 ind./10 km), M. americana (0.2–0.7 ind./10 km) y L. poeppigii (0.5 grupos/10 km) (27). Después de evaluar tres diferentes tipos de hábitats en los alrededores de la carretera Iquitos-Nauta, estimaron la densidad poblacional para 8 especies de 10 primates. Como era de esperar, las especies consideradas de tamaño pequeño sobresalieron por su alta densidad, con excepción de Callicebus torquatus “tocón negro” (0.4–12 ind./km2) (28). En base a 2,332 km de longitud recorrida dan a conocer información sobre densidad poblacional para la zona de moderada caza de la cuenca del río Samiria. En primates, los resultados indican alta densidad para Saimiri boliviensis “fraile” (92.5 ind./km2) y Cebus apella “mono negro” (31 ind./km2) y baja para Pithecia monachus “huapo negro” (7.1 ind./km2). Entre otros resultados, figuran los ungulados, entre ellos M. americana (0.6 ind./km2), T. pecari (10.5 ind./km2), P. tajacu (2.4 ind./km2) y T. terrestris (0.06 ind./km2) (38). Basándose en 507 km de longitud censada estimaron la densidad poblacional para los mamíferos en la cuenca alta del río Yavarí. Entre sus resultados destaca a algunas especies de primates como los de mayor densidad, en particular L. poeppigii (32.7 ind./km2), y Saguinus mystax “pichico de barba blanca” y S. fuscicollis, ambas con 30.4 ind./km2, mientras que A. chamek y Cebus albifrons “mono blanco” conjuntamente con los ungulados y roedores figuran entre los menos abundantes, en particular M. americana (0.7 ind./km2) y M. gouazoubira (0.43 ind./km2). Los mismos autores dan estimados de densidad poblacional para la cuenca baja y alta del río Yavarí-Mirín, cuyos resultados fueron similares al anterior (51). En la Reserva Comunal Tamshiyacu-Tahuayo proporciona información sobre densidad poblacional de ungulados. Es oportuno resaltar que entre sus resultados la 11 más baja densidad fue para T. terrestris (0.4 ind./km2) y la más alta para P. tajacu (3.3 ind./km2) (62). Basados en 756 km de longitud censada en Samiria, 482 km en Yavarí-Mirín y 626 km en Tahuayo-Blanco, determinaron la densidad para P. tajacu en 1.8 ind./km2, 1.6 ind./km2 y 1.4 ind./km2, respectivamente; en cambio para T. pecari los estimados fueron 5.2 ind./km2, 13.1 ind./km2 y 6.6 ind./km2, respectivamente (63). Como parte de un estudio sobre el uso sostenible de la caza en el río Samiria proporcionan estimados de densidad poblacional para los mamíferos, entre ellos T. pecari (4.5 ind./km2), P. tajacu (0.58 ind./km2), M. americana (0.96 ind./km2), T. terrestris (0.3 ind./km2) y A. chamek (0.72 ind./km2). Para Yavarí-Mirín las densidades reportadas fueron para T. pecari (9.7 ind./km2), P. tajacu (2.1 ind./km2), M. americana (0.96 ind./km2), M. gouazoubira (0.17 ind./km2), T. terrestris (1.7 ind./km2), L. poeppigii (24.2 ind./km2), A. seniculus (0.65 ind./km2) y A. chamek (2.3 ind./km2) (64). Basados en 1,495 km de longitud censada en zonas con y sin caza en el Parque Nacional Manu, proporcionan información sobre densidad poblacional para 10 especies de primates, 3 de ungulados y 2 de roedores. Las densidades estimadas para todos los primates fueron altas, en particular S. boliviensis (4–49.7 ind./km2 ), S. fuscicollis (37–53.3 ind./km2), Lagothrix cana “choro” (9.7–48.5 ind./km2 ) y A. chamek (7.8–49 ind./km2); en ungulados, para T. pecari (5.8–43.8 ind./km2) y en roedores para Dasyprocta variegata “añuje” (1.6–3.5 ind./km2). Los resultados 12 también indican densidades bajas para Mazama sp. (2.7–4.7 ind./km2) y Myoprocta pratti “punchana” (0.53–2.2 ind./km2) (65). Utilizando el método de censos por transecto lineal en la parte alta del río Purús estimaron la densidad poblacional para P. tajacu y T. pecari en 2.5 ind./km2 y 9.2 ind./km2, respectivamente (66). En base a 120 y 170 km de longitud censada en los ríos Tahuayo-Blanco y YavaríMirín, respectivamente, estimaron la densidad para los primates. Así, en TahuayoBlanco, los estimados fueron relativamente altos para S. fuscicollis (21.7 ind./km2), S. mystax (21.7 ind./km2) y Saimiri spp. “fraile” (18 ind./km2) y bajas para Callicebus cupreus “tocón colorado” (2 ind./km2), P. monachus (3.5 ind./km2) y C. albifrons (5.6 ind./km2). En Yavarí-Mirín, las densidades fueron similares, aunque a ellas se adicionan L. poeppigii (25.7 ind./km2) y A. chamek con apenas 2.5 ind./km2 (67). Basados en 1,172 km de longitud censada en área de frecuente caza y 1,203 km en área de ligera caza proporcionan estimados de densidad poblacional para los primates de la cuenca del río Samiria. Las densidades más altas fueron para C. apella (36 a 55.2 ind./km2) y L. poeppigii (15.1 a 24.2 ind./km2) y la más baja fue para A. belzebuth y A. chamek con 0.5 a 0.2 ind./km2 y 0.2 a 0.4 ind./km2, respectivamente (68). En el lado Oeste como Este del río Tapiche basados en censos por transecto menores a 160 km proporcionan información sobre densidad poblacional para 13 primates. En ambos lados las densidades fueron altas para S. boliviensis (53.3 a 95 ind./km2), A. seniculus (18.5 a 20.1 ind./km2) y Cacajao calvus “huapo colorado” (7.4 a 25.8 ind./km2) y la más baja para C. apella (11.5 ind./km2) (69). Utilizando el método de censos por transecto lineal recorrió 141 y 204 km de longitud y estimó la densidad poblacional para los mamíferos de caza que frecuentan los aguajales semi-eutrofizados y de origen reciente en la Reserva Nacional Pacaya Samiria. Entre sus resultados indican altas densidades para T. pecari (25 ind./km2), L. poeppigii (6.7–20 ind./km2), C. albifrons (16.8–54.6 ind./km2), S. boliviensis (336–350 ind./km2), y bajas densidades para T. terrestris (0.76 ind./km2), D. fuliginosa (1.8 ind./km2) y A. chamek (1 ind./km2) (70). En base a 200 km de censos por transecto lineal estimaron la densidad para los mamíferos que habitan en la parte baja del río Algodón. En ungulados, la densidad poblacional más alta fue para T. pecari (9.8 ind./km2) y más baja para M. americana (0.7 ind./km2) y T. terrestris (0.67 ind./km2); en primates, la más alta fue para L. lagotricha y más baja para C. lucifer (1.2 ind./km2), finalmente en roedores, la más alta fue para M. pratti (3.6 ind./km2) y baja para D. fuliginosa (0.9 ind./km2) (71). Basados en 647 km de longitud censada proporcionan la densidad poblacional para 9 especies de primates que habitan en la cuenca del río Pucacuro. Los resultados con excepción de L. poeppigii indican baja densidad poblacional para la mayoría de los primates, entre ellos A. belzebuth (0.8 ind./km2) y A. seniculus (2.1 ind./km2), en 14 tanto que para la primera de las citadas la densidad fue relativamente alta (10 ind./km2) (72). Reportan densidades para 8 especies de primates que habitan en la cuenca baja del río Urubamba y en el interfluvio Urubamba-Tambo. Los resultados indican alta densidad para los considerados de tamaño pequeño y mediano, y baja densidad para los de tamaño grande, entre ellos A. seniculus (8.9 ind./km2), L. cana (5.2 ind./km2) y A. chamek (8.3 ind./km2) (73). En la cuenca del río Samiria como resultado de los censos de 1,287 y 1,552 km estimaron la densidad poblacional para A. belzebuth y A. chamek en 1.02 ind./km2 y 0.51 ind./km2, respectivamente (74). 2.3. Amenazas para las poblaciones de mamíferos en la Amazonía peruana En la parte alta del río Itaya indicaron que está sujeto a constantes amenazas por actividades como la caza y deforestación que muchas veces ponen en grave riesgo la existencia de la fauna silvestre, especialmente de los mamíferos. Asimismo, sostienen que la caza es la principal amenaza, que no solamente es practicada por las comunidades asentadas en dicho río, sino también por los denominados “madereros”, quienes indirectamente son una amenaza potencial para la sobrevivencia de los primates y de otros componentes de la fauna silvestre. También mencionan que después de la caza, la exploración sísmica será la principal amenaza potencial cuando inicien sus actividades, por cuanto el tráfico aéreo, 15 generación de ruidos, presencia de fuerza laboral, apertura de helipuertos, zonas de descarga e instalación de campamentos, apertura de líneas sísmicas, detonación de explosivos y muchas otras actividades relacionadas tendrán sus efectos generando ahuyentamiento y alteraciones en los desplazamientos, cuya consecuencia podría ser una drástica disminución de la fauna silvestre (6) (23). En el nororiente de la Amazonía peruana refieren que la caza, ganadería, agricultura, extracción de madera, asi como la minería y explotación de petróleo son actividades que constituyen potenciales amenazas para la supervivencia de A. belzebuth. Además, resaltaron que la última actividad podría incluso causar mayor peligro por la tala del bosque para la instalación de helipuertos, y/o campamentos, así como la apertura de transectos para las exploraciones sísmicas (16). En la parte alta del río Itaya consideran a la caza y extracción selectiva de árboles de valor comercial (bajo la modalidad de concesiones forestales) y extracción de hojas de irapay (Lepidocaryum tenue “irapay”) como las principales amenazas para los mamíferos. A éstos se sumará en el corto plazo la explotación de hidrocarburos, cuyo impacto negativo podría ser mayor a las mencionadas anteriormente, puesto que podría incluso conducir a la extinción local de ciertas especies (25). Menciona que la baja densidad de mamíferos de caza en la Reserva Nacional Allpahuayo Mishana se debe entre otros factores a la presión de caza desequilibrada, la cual es practicada por los comuneros vivientes en los alrededores de dicha unidad de conservación (27). 16 Mencionaron que la caza es la principal amenaza para las poblaciones de primates en el río Curaray y en el corto plazo también será la deforestación con fines de extracción de madera de alto valor comercial (30). En las cabeceras de los ríos Ampiyacu, Apayacu, Yaguas y Medio Putumayo consideran a la excesiva cacería y la extracción de madera en gran escala como las principales amenazas para la fauna silvestre (31). Señalaron que la cacería a gran escala, en particular para especies vulnerables y de alto precio como “maquizapas” y “huanganas” es la amenaza potencial en las cabeceras de las cuencas de los ríos Nanay, Mazán y Arabela. También señalaron como amenazas a la deforestación con fines de extracción maderera, minería (extracción de oro), agricultura y ganadería, puesto que estas actividades eliminan hábitats críticos para los mamíferos y otros componentes de la fauna silvestre (32). Mencionan a la cacería sin manejo como la principal amenaza para la fauna silvestre en la Parque Nacional Güepi Sekime, siendo los más afectados los mamíferos grandes y de alto valor económico como los primates y ungulados. También, consideran como amenazas a la deforestación con fines de exploración y extracción de petróleo, extracción maderera, agricultura migratoria en gran escala y la ganadería intensiva, generando así la destrucción y modificación de hábitats que son críticos para la subsistencia de algunas especies de mamíferos (33). 17 En la cuenca alta y baja del río Yaguas y cabecera del río Cotuhé citan a la cacería y extracción maderera como las principales amenazas para los mamíferos (35). En la Reserva Comunal Matsés consideran a la cacería y la pérdida y deterioro de los hábitats como las grandes amenazas para las poblaciones de mamíferos, en particular para los primates de tamaño grande, sachavaca y armadillo gigante (53). Sostienen que los bosques de la cuenca media del río Tambopata están expuestas a ciertas amenazas como la deforestación con fines de extracción minera informal y la producción de monocultivos como el café que traen como consecuencia la perdida de diversidad y degradación de los hábitats. También hacen mención de la construcción de carreteras y el cultivo ilegal de coca como amenazas, el primero influiría en el incremento de colonos en la zona de amortiguamiento del Parque Nacional Bahuaja Sonene con la consecuente alteración de los hábitats (59). En la cuenca alta del río Purús mencionan a la extracción de madera y productos forestales, migración de la gente y construcción de carreteras como amenazas potenciales para la fauna silvestre, pero enfatiza a la extracción de maderera como la principal amenaza (75). Sostiene que la continua destrucción de los bosques y la sobreexplotacion de especies de caza tienen un efecto negativo en la estructura de las comunidades de animales silvestres en la cuenca del río Urubamba. Hace incapié que la 18 deforestación se debe a las actividades agrícolas (principalmente en la parte baja del Urubamba) y a las colonizaciones que ocupan grandes extensiones de tierra (76). Consideran que la fauna silvestre en la Región Ucayalí está sujeta a diversas amenazas, citando entre las más serias a la actividad maderera, extracción de productos del bosque, migración de otras poblaciones humanas a la región, así como los proyectos de construcción de carreteras (77). 19 III. MATERIALES Y MÉTODOS 3.1. Área de estudio El estudio fue conducido en el nororiente de la Amazonía peruana y está delimitada por las cuencas de los ríos Tigre y Napo (Figura 1). El área de estudio políticamente pertenece a las Provincias de Maynas y Loreto, Departamento Loreto. En el área, con excepción del sector del río Curaray, el resto por su cercanía a los centros poblados se encuentran muy alterado debido a la extracción de madera de valor comercial y de hojas de L. tenue, así como por la caza y cosecha de frutos silvestres, en particular de Mauritia flexuosa “aguaje”, Oenocarpus bataua “ungurahui” y Astrocaryum murumuru “huicungo”, de modo que la fauna silvestre en general era relativamente escasa. A fin de cumplir con los objetivos planteados, en el área de estudio fueron definidos cinco sectores de muestreo. Con excepción del sector Napo-Algodón, los otros sectores pertenecen a la “Ecoregión Bosques Húmedos del Napo” (36), el cual se caracteriza por ser una de las ecoregiones con mayor biodiversidad en el mundo. 3.1.1. Sectores de muestreo El trabajo de investigación fue conducido de febrero a noviembre del 2013 y consistió en realizar censos por transectos y entrevistas en cinco sectores de muestreo, todos distribuidos en el nororiente de la Amazonía peruana (Tabla 1). Estos sectores fueron los siguientes: 20 a) Río Itaya (Parte alta) Localizado al suroeste de la ciudad de Iquitos, perteneciendo políticamente al distrito de San Juan Bautista, provincia de Maynas. Está limitado entre los ríos Tigre, Amazonas y Nanay, cuya fisiografía varió entre terraza baja y alta, y colina baja con pendientes de hasta 60% de inclinación. Cobertura vegetal sobre suelo arenoarcilloso y compuesto por árboles de fuste casi rectos con alturas entre 10 a 25 m y algunos emergentes superiores a 35 m como Parkia sp. “pashaco”, Elaeoluma sp. “quinilla”, Manilkara sp. “sacha caimito” y Eschweilera spp. “machimango”, entre otras. Entre las palmeras, sobresalieron por su relativa abundancia Socratea sp. “huacrapona”, Iriartea sp. “cashapona”, O. bataua y Astrocaryum chambira “chambira”. Sotobosque poblado algunas veces por L. tenue y en otras por plantas herbáceas perennes y/o anuales. Piso del bosque generalmente cubierto por un colchón de hojarascas entre 10 a 15 cm de espesor, particularmente en terrazas altas y cimas de colina baja (20). b) Río Huanganayacu (Parte alta) Situado al noroeste de la ciudad de Iquitos correspondiendo al distrito de El Tigre, provincia de Loreto. Afluente del río Tigre en su margen derecha, la cual en su parte alta estuvo ubicado el sector de muestreo conformado por un piso arcilloso y algo compacto, cuya fisiografía varió desde terraza alta hasta terraza baja, este último 21 sujeto a inundaciones temporales. Vegetación compuesta por árboles entre 25 a 30 m de altura y algunos emergentes arriba de 35 m como Eschweilera spp. y Parkia sp. Entre las palmeras sobresalieron por su relativa abundancia L. tenue, O. bataua, Iriartea sp. y Euterpe sp. “huasai”. Sotobosque poblado la mayoría de veces por L. tenue y Attalea butyracea “Shapaja”. En las terrazas media y baja fueron comunes los aguajales densos y mixtos (asociación de M. flexuosa), los mismos que se encontraban muy alterados por la extracción de los frutos. c) Río Nanay (Parte alta) Ubicado al noroeste de la ciudad de Iquitos entre los ríos Tigre, Amazonas y Napo. Políticamente pertenece a la jurisdicción del distrito de San Juan Bautista, provincia de Maynas. En este sector predominó el bosque de colina baja fuertemente disectado, con pendientes empinadas y valles profundos, pero también estuvo presente el aguajal de altura en pequeños parches. Piso del bosque conformado mayormente por arena blanca y cubierto por un colchón de hojarascas de hasta 15 cm de espesor, lo que indica la pobreza de sus suelos (37). Vegetación en su mayoría de tipo varillal, conformado por árboles de porte mediano entre 15 a 20 m de altura, con algunos emergentes arriba de 25 m. Entre las palmeras, O. bataua sobresalió por su mayor abundancia tanto en terraza alta como en terraza media. 22 d) Río Napo (Parte media) – Río Algodón (Parte alta) El sector de muestreo estuvo ubicado al noreste de la ciudad de Iquitos entre los ríos Napo, Amazonas y Putumayo, perteneciendo políticamente al distrito del Putumayo, provincia de Maynas, el cual corresponde a la zona de vida “Bosque Húmedo Tropical”. El campamento estuvo ubicado en la parte alta del río Algodón en donde predomina el bosque de colina baja, pero también están presentes los bosques de terraza alta y terraza media. Vegetación arbórea en promedio 28 m de altura, mientras que las especies emergentes alcanzaron hasta los 35 m. Las especies arbóreas más comunes están presentes Scleronema praecox, Iriartea deltoidea “cashapona” y Minquartia guianensis. Los bosques de terrazas altas se encuentran sobre suelo areno-arcilloso, cubierto por una capa densa de raicillas y hojarascas que pueden llegar hasta 15 cm de grosor. Entre las especies de valor económico todavía se encuentran Cedrelinga cateniformis “tornillo” y Simarouba amara “marupá”. Entre las palmeras fueron comunes I. deltoidea, L. tenue, A. butyracea y O. bataua. e) Río Curaray (Parte alta) Ubicado al norte de la ciudad de Iquitos, entre los ríos Napo y Tangarana en el límite fronterizo con el Ecuador, pertenece a la jurisdicción del distrito de Iquitos, provincia de Maynas. Aquí están presentes los bosques de terraza alta que es el que predomina, pero también se encuentran los bosques de terraza media, terraza baja 23 y bosque de colina baja. En la terraza baja es común la presencia de aguajales densos y mixtos. En los bosques de terraza alta y colina baja, la vegetación estuvo representada por árboles de porte alto, entre 25 a 30 m, con algunos emergentes de hasta 40 m, sobresaliendo por su mayor predominancia O. bataua, Micropholis sp., Pouteria sp., C. macrocarpa y Parkia sp., entre otras. En los bosques de galería y terraza baja, la vegetación arbórea estuvo conformada por árboles de porte mediano entre 20 a 25 m de altura, con algunos emergentes de hasta 30 m, muchos de ellos cubierto por enmarañado de bejucos y lianas. Los aguajales de altura fueron comunes y se caracterizaron por su disposición en fajas de hasta 1 km de largo y entre 50 a 200 m de ancho y poblados principalmente por M. flexuosa, Euterpe oleraceae “huasai”, Iriartea exorrhiza “cashapona” y Ficus spp. “renaco”. Figura 1. Ubicación de los sectores de muestreo en el interfluvio Tigre-Napo. 24 Tabla 1. Sectores de muestreo para la evaluación de los mamíferos. Sectores de muestreo Coordenadas del campamento (UTM) Altitud (m.s.n.m) Mes de evaluación Río Itaya (Parte alta) 615679/9540649 134 Febrero Río Huanganayacu (Parte alta) 473383/9627228 126 Abril Río Nanay (Parte alta) 542669/9617188 110 Julio Río Napo (Parte media) 682890/9725466 156 Setiembre 475731/9821084 191 Río Curaray (Parte alta) 3.2. Margen derecha Noviembre Margen izquierda 474749/9821868 195 Métodos 3.2.1. Censos por transecto lineal El transecto lineal es un método que nos permite obtener datos para estimar la densidad poblacional. Este método se fundamenta en abrir trochas en el interior del bosque para posteriormente registrar a los animales por observación directa a lo largo del transecto (38). Con 24 horas de anticipación y usando brújulas fueron abiertas las trochas desde el campamento, pero en direcciones distintas. Para medir la longitud de las trochas se utilizó una cinta métrica de 50 m. En cada sector de muestreo se abrieron 6 trochas, cada una de 4 a 5 km de longitud, las cuales se marcaron con cintas de color cada 500 m que sirvieron de referencia durante los censos. El trabajo de campo fue de 20 días, tiempo estimado para realizar una cobertura mínima de 400 km, los cuales fueron cubiertos por 3 grupos de observadores, cada uno conformado por un investigador y un asistente de campo 25 (Tabla 2). Cada grupo diariamente recorrió un transecto diferente, cubriendo un mínimo de 8 km. Los censos en cada uno de los transectos fueron de ida y vuelta y se inició por las mañanas de 06:30 a 12:00 horas, para luego continuar con el censo de retorno (previo descanso al final del transecto), desde las 13:00 a 16:30 horas, tiempo estimado para la llegada al punto de partida. Tabla 2. Longitud recorrida (km) por sector de muestreo en el área de estudio. Sectores de muestreo Río Itaya (Parte alta) Río Huanganayacu (Parte alta) Río Nanay (Parte alta) Tipos de bosques predominantes Longitud recorrida (km) Colina baja, terraza alta y baja (orilla río) 410 Terraza alta y baja, incluyendo aguajales densos y mixtos Colina baja, terraza baja incluyendo varillales y aguajales mixtos Río Napo (Parte media)Colina baja, terraza media y alta Río Algodón (Patre alta) Margen Terraza alta y media incluyendo aguajales densos Río Curaray derecha y mixtos (Parte alta) Margen Colina baja y terraza alta izquierda Total Tomando en consideración las recomendaciones de Aquino et al. 406 402 421 230 200 2,069 (38) el recorrido por los transectos se realizó a una velocidad promedio de 1.0 km/hora, con paradas cada cierta distancia por uno a dos minutos con la finalidad de auscultar los diferentes estratos y de esta manera detectar cualquier movimiento y/o percibir algún ruido o vocalización (Figura 2). 26 Cada vez que hubo un encuentro directo con los mamíferos se procedió a anotar en una ficha de campo los siguientes datos: 1) hora de avistamiento, 2) especie, 3) número de individuos (para el caso de mamíferos sociales), 4) distancia perpendicular del primer individuo avistado a la línea del transecto, 5) tipo de bosque, 6) altura del primer individuo avistado (para el caso de especies arborícolas), 7) actividad del primer individuo avistado al momento del contacto, 8) asociaciones interespecíficas (para el caso de primates) y 9) coordenadas (Anexo 1). Para facilitar el reconocimiento de las especies se contó con binoculares y cuando los mamíferos no pudieron ser identificados al momento del avistamiento (por la rápidez de la fuga) se procedió a inspeccionar el lugar de donde fugó el animal para verificar las huellas (animales terrestres), mientras que en otros casos hubo la necesidad de perseguirlos (animales arborícolas). Fueron excluidos de los censos los animales de hábitos nocturnos, en particular especies de roedores, edentados y carnívoros. También se excluyeron Aotus vociferans “musmuqui” por su hábito nocturno y Cebuella pygmaea “leoncito” por habitar exclusivamente en bosques de galería. Otras especies de roedores diurnos como las ardillas Sciurus sp., Sciurillus pusillus “ardilla pigmea neotropical” y Microsciurus flaviventer “ardilla enana amazónica” no fueron tomados en cuenta para la estimación de densidad poblacional por tratarse de especies que habitan en lugares específicos donde es difícil de visualizarlos. 27 Figura 2. Representación gráfica del método de censo por transecto lineal. 3.2.2. Registros asistemáticos Cada vez que hubo oportunidad de observar mamíferos mayores fuera de los censos se procedió al registro. El propósito fue para incrementar la riqueza de especies, pero no fueron tomados en cuenta para los análisis de diversidad y densidad poblacional. 3.2.3. Entrevistas Las entrevistas a manera de dialogo se hicieron a dos personas por cada sector de muestreo. Las personas entrevistadas fueron mayormente cazadores y madereros que generalmente eran contactadas al interior del bosque realizando sus actividades. Estos encuentros ocurrieron durante el traslado a los sectores de estudio, en el campamento, a veces en pleno censo y al retornar después de 28 finalizar cada trabajo de campo. Además, se visitaron a cazadores más antiguos de comunidades más cercanas a los sectores de evaluación con el propósito de obtener mayor información sobre la presencia y/o ausencia de especies de mamíferos. Durante las entrevistas, a fin de facilitar la identificación de los animales se les mostró las ilustraciones de Aquino et al. (38) y Emmons & Feer (39). 3.2.4. Determinación de la riqueza y composición La riqueza de especies es el número total de especies observadas (directa e indirectamente) durante un estudio (40). Para determinar la riqueza de especies de mamíferos mayores que habitan en el área de estudio y por sectores de muestreo se utilizaron los registros sistemáticos y asistemáticos (24). Los sistemáticos consistieron en el registro de especies durante los censos tanto por observación directa como indirecta a través de sus vocalizaciones y rastros (huellas, madrigueras, bañaderos, caminos, despojos, heces, pelos y/o cerdas, rasguños en troncos de árboles, emanación de sustancias odoríferas, entre otros). Los asistemáticos son observaciones directas e indirectas ocurridas fuera de los censos. Para la lista base también se consideraron los restos y despojos de la caza. 3.2.5. Estimación de la densidad poblacional El bajo registro de observaciones directas para la mayoría de las especies (menor de 60 avistamientos) no fue suficiente para estimar la verdadera densidad poblacional(41) mediante la aplicación del software Distance versión 5.0 (42) por lo 29 que se usó la siguiente fórmula: D=N/2dL (43), donde N es el número de grupos y/o individuos observados a lo largo de los transectos, L es la longitud total recorrida (km) y d es la distancia perpendicular promedio del primer animal observado al transecto, la misma que fue distinta para cada especie. Para los mamíferos sociales, el cálculo de individuos/km2 se obtuvo multiplicando D (densidad) por el tamaño promedio del grupo familiar. Este método es ampliamente usado en evaluaciones de la fauna silvestre con pocos registros. 3.2.6. Identificación de las amenazas El registro de actividades que constituyen amenazas para las poblaciones de mamíferos y la fauna silvestre en general se hizo paralelo a los censos por transecto. Estas actividades fueron constatadas “in situ” por observación directa como la deforestación hecha por madereros (con fines de instalación de campamentos, apertura de trochas para la ubicación de árboles maderables o extracción de hojas, construcción de viales para el remolque de trozas de madera), agricultores (presencia de chacras), ganaderos (presencia de pastizales) y compañías petroleras (para la exploración y explotación de hidrocarburos que implica apertura de transectos para la exploración sísmica, construcción de helipuertos, plataforma, entre otros). Otra de las actividades fue la caza ya sea con fines de subsistencia o para la venta, por lo que esta actividad podría ser intensiva, periódica o esporádica. Para complementar la información, después de la culminación de los censos, se visitaron a comunidades más cercanas de cada sector de estudio a fin de dialogar 30 con cazadores más antiguos sobre la presencia o ausencia y abundancia de las poblaciones de mamíferos en sus bosques y sobre las actividades que constituyen amenazas para los animales que viven en su entorno. 3.2.7. Análisis y procesamiento de datos Para determinar la composición de los mamíferos para el área de estudio y por sectores de muestreo se tomó en cuenta: la riqueza y diversidad de especies. La riqueza fue determinada mediante el conteo de especies registradas en el área de estudio y para cada sector de muestreo. Para la diversidad se utilizó únicamente las especies y el número de individuos registrados por sector durante los censos. En cuanto a los índices de diversidad y similaridad, los datos obtenidos fueron analizados mediante el Software estadístico para Windows PAST versión 2.09 (44). La identificación de especies se hizo con la ayuda de la literatura disponible como Aquino et al. Huareco (46), (38), Emmons & Feer Navarro & Muñoz (47) (39), Aquino & Encarnación y Carvalho et al. (48). (45), Simonetti & Las especies de primates registradas fueron ordenadas siguiendo la clasificación de Rylands et al. (49) y Pacheco et al. (2) para el caso de otros mamíferos. La densidad poblacional, fue estimado utilizando los grupos y/o individuos registrados por observación directa y las distancias perpendiculares de los mamíferos mayores registrados en los censos (38). 31 Para algunas especies de vida social que no fue posible contar el tamaño de grupo completo en cada sector el cálculo de individuos/km2 fue obtenida multiplicando D (Densidad) por el tamaño promedio del grupo familiar calculada para el área de estudio (interfluvio Tigre-Napo), el cual fue obtenida de los grupos donde fue posible el conteo completo, excepto para S. sciureus y T. pecari que fueron tomados de Aquino et al. (6) y Aquino et al. (17) estimadas en 43.5 y 130 individuos, respectivamente. Para la densidad, la distancia promedio también fue calculada de la sumatoria de todas las distancias perpendiculares correspondientes a cada especie y divididas entre el número de grupos y/o individuos observados en el área de estudio y no por sectores. Con la información obtenida se elaboró una base de datos mediante el programa computarizado Microsoft Office Excel 2010, cuyos resultados se presentan mediante tablas. 3.2.7.1. Índices de diversidad a) Índice de diversidad de Margalef Es uno de los más sencillos, supone que hay una relación funcional entre el número de especies y el número total de individuos, lo que quiere decir, que a medida que aumenta el tamaño de la muestra también hay incremento de especies (40). La fórmula es la siguiente: 32 Donde: S= número de especies N= número total de individuos ln= Logaritmo natural b) Índice de Shannon-Wiener (Equidad) Expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra. Mide el grado promedio de incertidumbre en predecir a que especie pertenecerá un individuo escogido al azar de una colección. Asume que los individuos son seleccionados al azar y que todas las especies están representadas en la muestra. Adquiere valores entre cero, cuando hay una sola especie y el logaritmo de S, cuando todas las especies están representadas por el mismo número de individuos (40). La fórmula es la siguiente: Donde: Pi= Proporción de individuos de la especie i (ni/N) ln= Logaritmo natural c) Índice de Simpson (Dominancia) Presenta la probabilidad de que dos individuos tomados al azar de una comunidad pertenezcan a la misma especie. Está fuertemente influido por la importancia de las especies más dominantes (40). La fórmula es la siguiente: Donde: Pi= Abundancia proporcional de la especie i, es decir, el número de individuos de la especie i dividido entre el número total de individuos de la muestra. 33 3.2.7.2. Índices de similaridad Expresa el grado en el que dos muestras son semejantes por las especies presentes en ellas, por lo que son una medida inversa de la diversidad beta, que se refiere al cambio de especies entre dos muestras (40). a) Coeficiente de similitud de Jaccard (Cualitativo) El intérvalo de valores para este índice va de 0 cuando no hay especies compartidas entre ambos sectores hasta 1 cuando los dos sectores tienen la misma composición de especies (40). La fórmula es la siguiente: Donde: a= número de especies presentes en el sitio A b= número de especies presentes en el sitio B c= número de especies presentes en ambos sitios AyB b) Índice de Morisita–Horn (Cuantitativo) Este índice está fuertemente influido por la riqueza de especies y el tamaño de las muestras y tiene la desventaja de que es altamente sensible a la abundancia de la especie de mayor abundancia (40). La fórmula es la siguiente: Donde: ani= número de individuos de la i-ésima especies en el sitio en el sitio A bni= número de individuos de la j-ésima especie en el sitio B da= ani2 / aN2 db= bnj2 / bN2 34 IV. RESULTADOS 4.1. Riqueza y diversidad de mamíferos mayores 4.1.1. En el área de estudio Fueron registradas 45 especies agrupadas en 7 ordenes, 20 familias y 37 géneros, siendo los carnívoros y primates los más representativos con 10 y 17 especies, respectivamente. De las especies registradas, Galictis vittata “comadreja”, Mustela africana “hurón”, Bassaricyon alleni “chosna pericote” y Potos flavus “chosna” fueron observadas fuera de los censos, mientras que P. maximus y M. tridactyla únicamente a través de sus huellas. Por otro lado, C. torquatus, Leopardus pardalis “tigrillo” y P. onca fueron observadas solamente en el río Itaya; Cyclopes didactylus “inti pelejo”, P. concolor y Speothos venaticus “sacha perro” en el sector de la cuenca alta del río Nanay; Dasypus sp. “armadillo”, Bradypus variegatus “pelejo”, Saguinus nigricollis “pichico”, C. lucifer y L. lagotricha en el sector correspondiente de la cuenca media y alta de los ríos Napo y Algodón. Finalmente, Tamandua tetradactyla “shihui”, S. tripartitus, A. vociferans, A. belzebuth, Hydrochoerus hydrochaeris “ronsoco” y T. pecari solamente en el sector del río Curaray (Tabla 3). 4.1.2. En los sectores de muestreo a) Río Itaya (Parte alta) En este sector fueron registradas 24 especies agrupados en 6 ordenes, 15 familias y 21 géneros, siendo los roedores y los primates los más representativos con 5 y 10 35 especies, respectivamente. De ellas, 21 fueron registradas durante los censos (20 por observación directa y 1 por medio de huellas) y 2 fuera de los censos (1 por observación directa, 1 por vocalización) y 1 muerto por un cazador (Tabla 3). b) Río Huanganayacu (Parte alta) El resultado de los registros indica 25 especies agrupadas en 7 ordenes, 16 familias y 23 géneros, siendo los roedores y primates los más representativos con 5 y 10 especies, respectivamente. Del total, 22 fueron registradas durante los censos (17 por observación directa y 5 por huellas) y 3 fuera de los censos (2 por observación directa y 1 por vocalización), tal como se indica en la Tabla 3. c) Río Nanay (Parte alta) Los registros para este sector indican 26 especies agrupadas en 7 ordenes, 18 familias y 24 géneros, siendo los carnívoros y primates los más representativos con 6 y 9 especies, respectivamente. De ellas, 24 fueron registradas durante los censos (19 por observación directa, 4 por huellas y 1 a través de sustancias odoríferas) y 2 fuera de los censos (1 por observación directa y 1 por vocalización) (Tabla 3). d) Río Napo (Parte media) – río Algodón (Parte alta) Para este sector, los registros 29 especies agrupadas en 7 ordenes, 17 familias y 28 géneros, siendo los roedores y primates los más representativos con 6 y 8 especies, respectivamente. De ellas, 26 fueron registradas durante los censos (20 por 36 observación directa, 5 por huellas y 1 a través de sustancias odoríferas) y 3 fuera de los censos (2 por observación directa y 1 por vocalización) (Tabla 3). e) Río Curaray (Parte alta) Para este sector los registros indican 37 especies agrupadas en 7 ordenes, 17 familias y 33 géneros, siendo los carnívoros y los primates los más representativos con 8 y 13 especies, respectivamente. De ellas, 34 fueron registradas durante los censos (26 por observación directa, 7 por huellas y 1 a través de madriguera) y 3 por observación directa fuera de los censos, tal como se muestra en la Tabla 3. 4.1.3. Índices de diversidad De un total de 1,204 registros pertenecientes a 41 especies, siendo los más representativos los roedores y primates con 7 y 17 especies, respectivamente (Anexo 3). De ellas, 473 correspondió al río Curaray, convirtiéndose así en el sector con el más alto registro de avistamientos. Lo contrario ocurrió con la cuenca alta del río Nanay con solamente 156 registros entre avistamientos directos e indirectos. Tratándose de especies, los mayores registros correspondieron a los primates, entre los que sobresalieron Pithecia aequatorialis “huapo negro”, S. fuscicollis y L. poeppigii con 95, 132 y 151 avistamientos, respectivamente, mientras que las especies menos registradas correspondieron a los carnívoros, en particular L. pardalis, P. concolor, P. onca, entre otras (Anexo 3). Los registros también fueron escasos para A. vociferans e H. hydrochaeris, y los componentes del orden Pilosa como B. variegatus y C. didactylus (Anexo 3). 37 Tabla 3. Riqueza y composición de especies por sector de muestreo. Orden Familia Especie Dasypus sp. Priodontes maximus Bradypodidae Bradypus variegatus Cyclopedidae Cyclopes didactylus Pilosa Myrmecophaga tridactyla Myrmecophagidae Tamandua tetradactyla Cebuella pygmaea Saguinus nigricollis Callitrichidae Saguinus fuscicollis Saguinus tripartitus Saimiri sciureus Cebidae Cebus apella Cebus albifrons Aotidae Aotus vociferans Primates Callicebus discolor Callicebus torquatus Pitheciidae Callicebus lucifer Pithecia monachus Pithecia aequatorialis Alouatta seniculus Ateles belzebuth Atelidae Lagothrix lagotricha Lagothrix poeppigii Sciurillus pusillus Sciuridae Microsciurus flaviventer Sciurus sp. Rodentia Caviidae Hydrochoerus hydrochaeris Dasyprocta fuliginosa Dasyproctidae Myoprocta pratti Cuniculidae Cuniculus paca Leopardus pardalis Felidae Puma concolor Panthera onca Canidae Speothos venaticus Eira barbara Carnivora Mustelidae Galictis vitatta Mustela africana Bassaricyon alleni Procyonidae Nasua nasua Potos flavus Perissodactyla Tapiridae Tapirus terrestris Pecari tajacu Tayassuidae Tayassu pecari Cetartiodactyla Mazama americana Cervidae Mazama nemorivaga Cingulata Dasypodidae Ita. Mu Huan. Nan. H H NaAl. O H O Cur. M H O H SO O* O O O O O O O V O O O O O V O O O O V O H SO H O O O O O V O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O* O O O H O O O H O H O O O O O O O H H O O O O O O O O H H H H H O* O* O H O O O O O* O O H O H O O* H O O O O O* O O H O O O* O O* O O O O O O: Observación directa en censos; O*: Observado directa fuera de censos; V: Vocalizacion; M: Madriguera; D: Despojo; M: Muerto y SO: Sustancias Odoriferas. 38 La aplicación de los índices de Margalef, Simpson y Shannon-Winner (H’) indican al río Curaray como el sector más diverso, y el sector que corresponde entre los ríos Napo-Algodón como el segundo más diverso. Además, estos mismos índices indican al río Itaya como el menos diverso, es decir, por debajo de los ríos Huanganayacu y Nanay (Tabla 4). Se interpreta que estos resultados están influenciados por la sensibilidad de cada índice respecto al número de especies e individuos de la muestra. Tabla 4. Índices de diversidad comparativa por sector de muestreo. Índices Sectores de Número de Número de muestreo registros especies Río Itaya Margalef Simpson Shannon Dmg 1-D H 213 22 3.92 0.88 2.49 191 22 3.99 0.90 2.64 Río Nanay (Parte alta) 156 24 4.55 0.91 2.68 Río Napo (Parte media) 171 26 4.86 0.92 2.84 Río Curaray (Parte alta) 473 34 5.36 0.94 3.17 (Parte alta) Río Huanganayacu (Parte alta) Total 1,204 4.1.4. Índices de similaridad Del total de especies registradas, solamente 12 fueron compartidas entre los cinco sectores evaluados y se trataron de Dasypus sp., S. sciureus, C. albifrons, D. fuliginosa, M. pratti, Cuniculus paca “majas”, P. onca, N. nasua, T. terrestris, P. 39 tajacu, M. americana y M. nemorivaga (Tabla 5), lo cual no quiere decir que las otras especies no están presentes, pero durante los censos no fueron observados y otras por no estar presente por distribución. Comparando entre sectores, mayor número de especies fueron compartidas entre los pares Huanganayacu–Curaray, Nanay–Curaray y Napo–Curaray con 22 especies cada una, pero el coeficiente de Jaccard indica a los pares Huanganayacu–Curaray (0.65) e Itaya–Huanganayacu (0.69), como los sectores con mayor similitud, al menos así lo indican los valores obtenidos; pero para el índice de Morisita, mayor similitud existe entre los pares Itaya–Nanay (0.84) y Huanganayacu–Nanay (0.85) (Tabla 5). Lo contrario ocurrió entre los pares Itaya-Napo, Huanganayacu-Napo, Nanay-Napo, en los tres los valores obtenidos están por debajo de 0.5. Tabla 5. Especies compartidas e índices de similaridad por sector de muestreo. Índices Sectores de muestreo Especies compartidas Jaccard Morisita Itaya–Huanganayacu 18 0.69 0.79 Itaya–Nanay 18 0.64 0.84 Itaya–Napo 15 0.45 0.14 Itaya–Curaray 21 0.6 0.55 Huanganayacu–Nanay 18 0.64 0.85 Huanganayacu–Napo 15 0.45 0.19 Huanganayacu–Curaray 22 0.65 0.77 Nanay–Napo 16 0.47 0.13 Nanay–Curaray 22 0.61 0.74 Napo–Curaray 22 0.58 0.26 Todos los sectores 12 40 4.2. Densidad poblacional de los mamíferos 4.2.1. En el área de estudio Para el cálculo de la densidad poblacional se han considerado especies con avistamientos directos por lo tanto se excluye los indirectos. En consecuencia, la densidad poblacional para el área de estudio fue estimada únicamente para 23 especies de los 45 registrados. En cuanto a la longitud total recorrida (km), las mayores longitudes pertenecieron a los mamíferos con amplia distribución como las especies del grupo de los roedores y ungulados como T. pecari y M. americana, así como la mayoría de las especies de primates (Anexo 2). La densidad poblacional de los mamíferos estimada para el área de estudio y para los sectores de muestreo está contenida en la Tabla 6. En referencia a los primates, los resultados indican altas densidades para L. lagotricha (55 ind./km2), L. poeppigii (36.2 ind./km2) y S. sciureus (34.4 ind/km2) y las más bajas para A. seniculus (4.1 ind./km2), C. lucifer (3.4 ind./km2), C. discolor “tocón colorado” (4.2 ind./km2), C. torquatus (4.2 ind./km2) y A. belzebuth (4.3 ind./km2). En ungulados, la densidad más alta fue para T. pecari (7 ind./km2) y la más baja para T. terrestris con apenas 0.27 ind./km2. En roedores, la mayor densidad fue para M. pratti con 4.7 ind./km2. 4.2.2. En los sectores de muestreo La densidad se calculó únicamente para especies con avistamientos directos por cada sector de muestreo. En consecuencia, la densidad poblacional fue estimada 41 para 14 especies en cada uno de los sectores Itaya, Huanganayacu, Nanay y NapoAlgodón. En cambio, en el río Curaray se estimó para 19 especies resultando el sector con mayor número de especies que se tomaron en cuenta para el cálculo de la densidad poblacional (Tabla 6). Del total de grupos y/o individuos observados, más del 30% correspondió al Curaray, lo que indica una alta frecuencia de encuentros en comparación con el río Itaya con apenas 20% (Anexo 4). En referencia a las especies de hábitos sociales, con excepción de P. tajacu, P. aequatorialis y S. fuscicollis, los grupos y/o rebaños más grandes fueron registrados en el río Curaray, en particular T. pecari que superaron los 45 individuos y en primates destacaron C. albifrons y L. poeppigii con hasta 17 y 21 individuos, respectivamente (Anexo 5). La densidad poblacional por sector de muestreo se presenta a continuación: a) Río Itaya (Parte alta) En referencia a este sector la densidad poblacional fue estimada para 14 especies entre primates, ungulados, roedores y carnívoros. En primates, las especies que destacaron por su mayor abundancia fueron S. fuscicollis (37.3 ind./km2) y S. sciureus (38.7 ind./km2), lo contrario ocurrió con C. discolor (1.1 ind./km2) y C. apella (1.9 ind./km2). En ungulados, la más alta densidad fue para P. tajacu (4.2 ind./km2) y la más baja para M. nemorivaga (0.17 ind./km2). Entre los roedores, M. pratti destacó por su mayor densidad (5.3 ind./km2), quizá porque se trata de una 42 de las especies menos cazada debido a su tamaño pequeño. En carnívoros, la densidad de N. nasua fue estimada en 1.3 ind./km2 (Tabla 6). b) Río Huanganayacu (Parte alta) Al igual que el sector anterior, la densidad poblacional fue estimada para 14 especies entre primates, ungulados, carnívoros y roedores. En primates, las densidades más altas fueron para S. fuscicollis y L. poeppigii con 18 ind./km2 y 37.3 ind./km2, respectivamente y las más bajas para C. discolor (1.6 ind./km2) y A. seniculus (3.6 ind./km2). En ungulados, la mayor densidad fue para P. tajacu (6.7 ind./km2) y la más baja para T. terrestris (0.27 ind./km2). En roedores, M. pratti contó con la más alta densidad (1.6 ind./km2). En carnívoros, N. nasua alcanzó una densidad de 1.4 ind./km2 (Tabla 6). c) Río Nanay (Parte alta) Al igual que los dos anteriores, la densidad poblacional fue estimada para 14 especies entre primates, ungulados, carnívoros y roedores. En primates, las densidades más altas fueron para L. poeppigii (19.8 ind./km2) y S. fuscicollis (23 ind./km2), en tanto que la más baja fue para A. seniculus con apenas 1.7 ind./km2. En ungulados, P. tajacu destacó por su mayor densidad (2.1 ind./km2), lo contrario fue para M. americana con apenas 0.11 ind./km2. En roedores, la mayor densidad una vez más fue para M. pratti con 6.6 ind./km2. En carnívoros, la densidad de N. nasua fue estimada en 1.4 ind./km2 (Tabla 6). 43 d) Río Napo (Parte media) – Río Algodón (Parte alta) Al igual que los sectores anteriores la densidad poblacional fue estimada para 14 especies entre primates, ungulados, roedores y carnívoros. En primates, las densidades más altas fueron para S. nigricollis (21.5 ind./km2), S. sciureus (23.9 ind./km2) y L. lagotricha (55 ind./km2), y las más bajas para A. seniculus y C. lucifer con 1.3 ind./km2 y 3.4 ind./km2, respectivamente. En ungulados, la más alta densidad fue para P. tajacu (4.8 ind./km2) y la más baja para M. nemorivaga (0.34 ind./km2 ). En roedores, M. pratti sobresalió por su más alta densidad (1.2 ind./km2). En carnívoros N. nasua destacó por su mayor densidad (4.8 ind./km2) (Tabla 6). e) Río Curaray (Parte alta) En el caso de este sector, la densidad poblacional fue estimada para 19 especies entre primates, ungulados, roedores y carnívoros. En primates, las densidades más altas fueron para L. poeppigii con 77.5 ind./km2 y S. sciureus con 82.6 ind./km2, respectivamente y las más bajas para P. monachus (8.4 ind./km2) y A. seniculus (9.8 ind./km2). En ungulados, la densidad más alta fue para T. pecari (33.8 ind./km2) y la más baja para T. terrestris (0.52 ind./km2). En roedores, la más alta densidad fue para M. pratti (8.5 ind./km2). En carnívoros, la densidad para N. nasua fue estimada en 9.2 ind./km2 (Tabla 6). 44 Las densidades de los primates del Curaray, en particular de L. poeppigii, S. sciureus y S. fuscicollis fueron mayores a los estimados para los otros sectores, excepto al del Napo-Algodón donde habitan especies distintas como L. lagotricha, P. monachus y S. nigricollis. En cambio, todas las especies de ungulados, excepto T. terrestris resaltaron por su mayor densidad comparado con los otros sectores, igualmente la mayor densidad sucedió con M. pratti, lo que no ocurrió con D. fuliginosa (Tabla 6). Comparando con los otros sectores, el río Curaray presentó las más altas densidades de mamíferos, excepto para algunas especies como P. aequatorialis y T. terrestris, cuyas densidades fueron más altas en el río Itaya y el sector comprendido entre los ríos Napo-Algodón, respectivamente. Además, fue el único sector donde se observó A. belzebuth registrando muchos y grandes tamaños de grupos (Tabla 6). 4.3. Amenazas para las poblaciones de mamíferos 4.3.1. En el área de estudio Fueron identificadas seis actividades practicadas por el hombre: caza, extracción legal e ilegal de especies forestales, exploración y explotación de hidrocarburos, extracción de hojas y frutos, agricultura y trocha carrozable, los mismos que se han convertido en amenazas para las poblaciones de mamíferos mayores y otros componentes de la fauna silvestre que habitan en sus bosques (Tabla 7). 45 Tabla 6. Densidad poblacional de los mamíferos por sector y área de estudio. Especies Dasyprocta fuliginosa* Myoprocata pratti* Tapirus terrestris* Mazama americana* Mazama nemorivaga* Tayassu pecariᵠ Pecari tajacuᵠ Nasua nasuaᵠ Ateles belzebuthᵠ Lagothrix poeppigiiᵠ Lagothrix lagotrichaᵠ Alouatta seniculusᵠ Cebus albifronsᵠ Cebus apellaᵠ Saimiri sciureusᵠ Pithecia aequatorialisᵠ Pithecia monachusᵠ Callicebus discolorᵠ Callicebus torquatusᵠ Callicebus luciferᵠ Saguinus fuscicollisᵠ Saguinus nigricollisᵠ Saguinus tripartitusᵠ Itaya Huanganayacu Gr./km2 Ind./km2 Gr./km2 Ind./km2 4.9 1.5 5.3 1.6 0.27 0.44 0.78 0.17 Sectores de muestreo Nanay Napo-Algodón Gr./km2 Ind./km2 Gr./km2 Ind./km2 2 0.95 6.6 1.2 0.53 0.11 0.86 0.53 0.34 1.4 0.24 4.2 1.3 1.8 0.25 6.7 1.4 0.71 0.25 2.1 1.4 1.3 14.2 ncd 2.7 37.3 ncd 3.6 6.2 7.2 14.3 9.5 ncd 1.6 ncd ncd 18 ncd ncd 1.6 19.8 ncd 1.7 4.4 11 10.9 4.3 ncd 6.2 0.81 0.43 0.89 3.1 0.41 2.6 6.9 5.2 1.9 38.7 13.3 ncd 1.1 8.3 ncd 37.3 ncd ncd 0.89 0.57 0.88 0.33 2.8 0.62 3.4 0.56 0.41 1.1 0.25 1.4 2.5 3.9 ncd 23 ncd ncd 0.85 0.47 2.2 0.32 1.03 0.55 1.7 0.99 3.7 4.8 1.8 ncd ncd 55 1.3 11.9 ncd 23.9 ncd 6.6 ncd 3.4 ncd 21.5 ncd Curaray Gr./km2 Ind./km2 1.9 8.5 0.52 1.2 2.2 0.26 33.8 2 9.2 0.93 6.5 1.3 16.3 5.1 77.5 ncd 1.4 11.2 1.9 26.2 2.8 34.2 1.9 82.6 2.8 10.4 1.9 8.4 4.1 12.3 ncd ncd 6.8 38.1 ncd 2.1 11.8 Área estudio (Tigre-Napo) Gr./km2 Ind./km2 2.2 4.7 0.3 0.7 0.65 0.054 7 1.3 5.1 0.43 2.4 0.35 4.3 2.7 36.2 2.2 55 0.68 4.1 0.95 10.3 1.1 9 0.79 34.4 2.5 9 1.8 7.4 1.5 4.2 1.3 4.2 0.99 3.4 5.1 28 3.7 21.5 2.1 11.8 *Especie solitario, ᵠespecie social, ncd: no corresponde su distribución 46 De ellas, la caza y extracción de madera comercial son las principales actividades que se han convertido en las mayores amenazas, por lo que fue común observar trochas y campamentos en uso en los sectores de muestreo, habiendo incluso contactado con cazadores y madereros, en particular en las cuencas altas de los ríos Itaya y Nanay, por lo que los bosques se encuentran muy perturbados con excepción del río Curaray, donde la presencia humana fue muy esporádica, no solo por su lejanía de los centros poblados, sino por el alto costo económico que significa para aquellos que pretenden incursionar a sus bosques. Los mamíferos de mayor tamaño fueron los preferidos por los cazadores, en particular ungulados y primates como A. belzebuth, L. poeppigii, L. lagotricha y A. seniculus. De los cinco sectores evaluados, las cuencas altas de los ríos Itaya y Nanay fueron los más frecuentados por cazadores y madereros, por lo que en ellos se cazan hasta primates de tamaño pequeño como S. fuscicollis y Callimico goeldii “supay pichico”. La existencia aún de especies maderables de alto valor económico como Swietenia sp. “caoba”, Cedrela odorata “cedro”, Chorisia insignis “lupuna”, C. cateniformis y Aniba amazonica “moena amarilla”, hace que los madereros incursionen en estos bosques para extraer grandes cantidades de trozas. Lo mismo ocurre con la fauna, puesto que la existencia aún de mamíferos mayores como ungulados y primates grandes hace que incursionen cazadores profesionales con el propósito de extraer “carne de monte” con fines comerciales. En el corto o mediano plazo también lo será la explotación de hidrocarburos, porque este tipo de actividades genera expectativas de trabajo, por lo que hay una alta concentración de la fuerza laboral, mientras que esperan 47 oportunidades de trabajo se dedican a la caza para sobrevivir, tal como viene ocurriendo en el río Corrientes. 4.3.2. En los sectores de muestreo a) Río Itaya (Parte alta) Las actividades que constituyen amenazas en este sector son la caza, extracción de madera y en un futuro la extracción de petróleo (Tabla 7). La caza no solamente es practicada por pobladores de las comunidades asentadas en el río Itaya, sino también por cazadores foráneos que utilizan la fauna mamífera para su alimentación y para la venta. Esta actividad es una de las principales amenazas que ha puesto en el camino de la extinción local a especies como T. pecari, A. belzebuth, A. seniculus y de otros componentes de la fauna silvestre, entre ellos Mitu salvini “paujil vientre blanco”. La caza también es practicada por los “madereros”, para incorporar en su dieta alimenticia, convirtiéndose en una amenaza potencial para la supervivencia de las poblaciones de mamíferos. En este sector fue común encontrar casquillos de cartuchos en los transectos, así como campamentos para habitar durante las actividades de caza y extracción de madera. La extracción de madera de valor comercial y deforestación con fines agrícolas y ganaderas también está ocasionando grandes pérdidas de bosques, por lo que se convierten en otras de las principales amenazas. La primera es realizada legalmente a través de las concesiones forestales o a través de “madereros ilegales”, la segunda es realizada por grupos organizados que van estableciéndose muy cerca de la cabecera del Itaya 48 donde ya se han talado algunas hectáreas de bosques para convertirlos en campos de cultivo de pan llevar. Cabe mencionar que los madereros incrementan la deforestación con la apertura de viales de hasta 500 m de longitud y 9 m de ancho para facilitar el remolque de las trozas de madera hasta la quebrada más cercana, luego estos viales son ampliados para convertirlos en chacras. La deforestación también se incrementa con la tala de árboles para la cosecha de los frutos para el consumo humano en abierta competencia con los animales. La consecuencia de esta tala indiscriminada está poniendo en riesgo de extinción local de especies como C. macrocarpa y Rhigospira sp. “yahuar huayo”. La exploración y posterior explotación de hidrocarburos es otra de las amenazas potenciales para la fauna silvestre en general. En efecto, el sector de muestreo se encuentra dentro del Lote 124 que pertenece a la compañía petrolera Burlington Resources. Previo a la evaluación, ya se habían realizado la exploración sísmica, lo que ha incrementado la perturbación del bosque con el ruido por el tráfico aéreo, presencia de fuerza laboral, apertura de helipuertos, zonas de descarga e instalación de campamentos, apertura de líneas sísmicas, detonación de explosivos y muchas otras actividades relacionadas con la exploración sísmica, para más adelante dar inicio a la extracción de petróleo. Las líneas sísmicas tienen aproximadamente 1.5 m de ancho y cientos de kilómetros de longitud, los cuales son usadas por los cazadores. Además, estas líneas sísmicas son también usadas para la extracción de peces ornamentales por los llamados pishiñeros y para la extracción de hojas de L. tenue y de otras palmeras. Debido a la alta perturbación del bosque la fauna nos pareció 49 relativamente escasa y la ausencia de algunas especies, puesto que durante los censos no encontramos indicios de la presencia de A. belzebuth ni de T. pecari. En las entrevistas con los pobladores nos mencionaron que anteriormente existía A. belzebuth en sus bosques, prueba de ello una de las quebradas aquí presentes lleva el nombre de “maquizapa” donde fue cazado tal vez el último ejemplar en el 2007 (R. Aquino, com. pers.). b) Río Huanganayacu (Parte alta) En este sector, las principales amenazas son la caza y deforestación y en un segundo plano la emisión de ruidos (Tabla 7). La caza es practicada por pobladores Kichwas de las comunidades más cercanas como Bolognesi y 28 de julio, quienes visitan estos bosques para abastecerse de “carne de monte” para el consumo de subsistencia compuesta principalmente de mamíferos grandes como L. poeppigii, A. seniculus, P. tajacu y T. pecari. Como en el caso anterior, los bosques se encuentran fuertemente perturdados por la presencia de trochas y campamentos, algunos de ellos incluso estaban habitados cuando arribamos al sector de muestreo. La segunda amenaza potencial es la extracción de madera de valor comercial por los denominados “madereros ilegales” provenientes de comunidades cercanas o de diferentes lugares de la Amazonía, como el grupo que se encontró compuesto por ocho personas proveniente de San Martín y Ucayalí, quienes además de ocasionar la deforestación, también cazan animales para abaratar costos de manutención. Consecuencia de la extracción de madera no solamente son los claros existentes por 50 la tumba de los árboles sino también los numerosos viales encontrados para el remolque de las trozas hacia las quebradas (ver Figura 3). Figura 3. Vial abandonado para el remolque de madera comercial. Producto de estas actividades, los impactos se ven reflejados en la ausencia de A. belzebuth y reducción en el tamaño de los grupos de primates en particular de L. poeppigii y la escazes de T. pecari que en el futuro es probable su extinción local que según manisfestaron los entrevistados que hace más de 50 años abundaban estos animales en sus bosques por lo que pusieron el nombre a este río como Huanganayacu. Es oportuno precisar que la escazes de “huanganas” y de otros ungulados no solamente se debe a la caza y deforestación, sino también al derrame del crudo de petróleo ocurrido hace más de quince años, el cual fue ocasionado por PlusPetrol empresa petrolera dueña del Lote 8 que opera varios años en el río Corrientes. En este sector, la emisión de ruidos es otra de las amenazas, los cuales son producidos por enormes helicópteros que transportan gran cantidad de personas y por motores generadores de electricidad para los trabajos de 51 explotación de petróleo. En síntesis, como consecuencia de estas actividades, los bosques aquí presentes mostraron de moderada a alta perturbación, por lo que la fauna nos pareció relativamente escasa, particularmente ungulados y primates de tamaño grande. c) Río Nanay (Parte alta) En este sector, la caza es la principal amenaza, seguida por la exploración de hidrocarburos y en un futuro cercano también lo será la explotación de este recurso natural. La caza es realizada básicamente por las comunidades de Santa Elena y Albarenga asentadas en los río Tigre y Nanay, respectivamente, para cuyo propósito utilizan las líneas sísmicas que no fueron cerradas, lo que les facilita explorar zonas más lejanas a su entorno y así incrementar sus posibilidades de obtener “carne de monte”, lo que les ha permitido incluso observar ocasionalmente mamíferos que creían extintos en su área de influencia como A. belzebuth, M. tridactyla y P. concolor, quienes probablemente provengan de la Reserva Nacional Pucacuro, cuyos bosques poco perturbados cuentan con hábitats adecuados para la supervivencia de los mamíferos antes mencionados y de otros componentes de la fauna. En Santa Elena, los cazadores mencionaron que en el 2013 hubo dos ocasiones que cazaron dos ejemplares de A. belzebuth muy cerca del campamento, pero que durante los censos no se logró observar ni escuchar sus vocalizaciones. La caza no solamente se limita a los animales de tamaño grande sino también a los de tamaño pequeño como se constató durante la estadía en este sector con la caza de 52 un ejemplar de C. goeldii y C. discolor a manos de un cazador de Santa Elena. Caso contrario sucede en los bosques cercanos al río Nanay donde la fauna mayor es muy escasa por la alta presión de caza ejercida por miembros de la comunidad de Albarenga y que hoy ante la ausencia de animales, muchos se dedican a la extracción de peces ornamentales. La segunda amenaza son las actividades relacionadas con la exploración de hidrocarburos, en efecto el sector de muestreo es parte del Lote 123, cuyas líneas sísmicas fueron aprovechadas para ampliar sus fronteras de caza tanto por parte de la comunidad de Santa Elena como de Albarenga y de otros cazadores foráneos que hacen su ingreso a través del río Nanay. Durante los censos observamos trochas y campamentos activos, cartuchos vacíos, así como líneas sísmicas, campamentos base, helipuertos y zonas de descarga en abandono, los mismos que son aprovechados por los cazadores para los fines de caza y pesca (ver Figura 4). Además, escuchamos disparos que pertenecerían a madereros ilegales aún cuando no encontramos árboles derribados ni viales recién aperturados. El asedio casi constante de cazadores y “pishiñeros” habría sido un factor en contra para el avistamiento de escasos animales y la ausencia de otros como A. belzebuth y C. torquatus, cuyos bosques forman parte de su área de distribución. En el corto plazo la explotación de hidrocarburos podría constituirse en la amenaza potencial, porque facilitaría la creación de nuevos centros poblados como ocurrió en el río Corrientes y como consecuencia de ella se incrementaría la deforestación para la apertura de chacras y también aumentaría la presión de caza. Como en los sectores anteriores, los bosques aquí presentaron 53 fuertes perturbaciones por las actividades antes mencionadas de modo que la fauna silvestre en general fue relativamente escasa. Figura 4. Linea sísmica (izquierda) y campamento base (derecha) abandonados. d) Río Napo (Parte media) – Río Algodón (Parte alta) Las principales amenazas observadas son la caza, deforestación y construcción de la carretera que conectara los ríos Napo y Putumayo con la finalidad de afianzar los lazos con el vecino país de Colombia (Tabla 7). La caza es practicada principalmente por cazadores de las comunidades de Puerto Arica y Lancha Poza asentadas en el río Napo, quienes mayormente cazan mamíferos de tamaño grande como L. lagotricha, A. seniculus, P. tajacu y T. pecari, todavía presentes por encontrarse relativamente lejos de las comunidades (dos días de camino) por lo que son pocos los que logran incursionar a estos bosques para cazar, lo corroboran los escasos campamentos y trochas hallados, la mayoría en desuso, de modo que aquí los bosques todavía se mantienen en buen estado de conservación (ver Figura 5). La caza también es practicada por los madereros por el tiempo que dura la extracción de madera de 54 valor comercial, pero solo para los fines de subsistencia (Ver Figura 6). La deforestación es la segunda amenaza expresada en la tala y destrucción de los bosques y está en estrecha relación con la extracción de madera de alto valor comercial. La extracción selectiva de árboles de valor comercial es realizada a través de concesiones forestales y por los “madereros ilegales” que prefieren ingresar a estos bosques por la presencia y abundancia de especies de alto valor económico conocida como “madera colorada”. Figura 5. Individuo adulto de Lagothrix lagotricha "choro" muerto por cazador. Figura 6. Campamento abandonado por la actividad maderera. 55 Finalmente, está la construcción de la carretera Napo-Putumayo, iniciada hace más de treinta años y por ahora abandonada, aún cuando la trocha carrozable es mantenida por el estado hasta los 15 km. La tala de árboles en una amplitud de 30 m y la remoción de tierras de hecho ha ocasionado impactos en poblaciones de algunas especies de mamíferos al seccionar su área domiciliar (ver Figura 7). A pesar de estas actividades existen todavía poblaciones relativamente abundantes de mamíferos. Los bosques en términos generales muestran un aspecto moderadamente alterado, por lo que la fauna silvestre en general todavía es relativamente abundante. Figura 7. Trocha carrozable que une los ríos Napo y Putumayo. e) Río Curaray (Parte alta) En este sector cercano al límite fronterizo con Ecuador fueron percibidas como amenazas la caza, deforestación (extracción de madera de valor comercial) y las 56 actividades de exploración de hidrocarburos (Tabla 7). De las citadas, las dos primeras pueden ser consideradas de nivel bajo, porque ambas son eventuales y están limitadas principalmente a las orillas del río Curaray y sus afluentes, de modo que los impactos negativos son muy limitados. Lo mismo se puede decir de la exploración sísmica, cuyos impactos fueron temporales, pero que aún queda la explotación de hidrocarburos, cuyos impactos son difíciles de predecir, por cuanto las empresas petroleras cuentan con programas para mitigar los impactos negativos. Por ahora las amenazas al parecer no han ocasionado mayores impactos que el desplazamiento temporal en casos extremos y quizá disminución de poblaciones a nivel del bosque de galería, por lo que en términos generales los bosques aquí presentes se caracterizan por presentar un aspecto de lígera perturbación por la existencia de escasos senderos en uso para la extracción selectiva de madera de alto valor comercial, entre ellos C. odorata; mientras que la caza también es muy esporádica y está limitado a los bosques de galería, por lo que la fauna silvestre nos pareció relativamente abundante, en particular ungulados y primates de tamaño grande, entre ellos T. pecari, A. belzebuth y L. poeppigii. 57 Tabla 7. Actividades que ocasionan impactos negativos a la fauna silvestre. Actividades Caza Extracción legal e ilegal de especies forestales Exploración y Explotación de hidrocarburos Extracción de hojas y frutos Agricultura/Chacras Trocha carrozable Impactos negativos Desplazamiento temporal* Contaminación sonora Disminución de las poblaciones* Extinción local de especies* Alteración del comportamiento causando estrés o nerviosismo Alteración del hábitat Contaminación sonora Escases del recurso alimenticio (baja tasa de reproductividad) Desplazamiento temporal* Alteración y reducción del hábitat Contaminación sonora Alteración del comportamiento causando estrés o nerviosismo Alteración del hábitat Alteración y reducción del hábitat Destrucción y desaparición de zonas de vida sensibles (colpas, bañaderos, bebederos, caminos, plantas alimenticias, madrigueras entre otros) Alteración del hábitat Sectores de muestreo It. Hua. A A A A A A M A A M A M M M Na. Na-Alg. Cura. M A A A A B M M B B B M B B B A A B B M A A A B Niveles de perturbación*: A: alto, M: moderado, B: bajo *Ver en Glosario. Anexo 6 58 V. DISCUSIÓN 5.1. Riqueza y diversidad de mamíferos mayores 5.1.1. En el área de estudio Comparando con otras áreas de la selva baja nororiental, el registro de mamíferos mayores en el área de estudio (interfluvio Tigre-Napo ) es una de las más altas, puesto que superó en 12 al de las cabeceras de los ríos Ampiyacu, Apayacu y Yaguas(31), en 11 al de los ríos Putumayo y Lagartococha (33), en 9 a los de las cabeceras de los ríos Yaguas y Cotuhé (35), en 15 especies a los registrados entre los ríos Pastaza y Uritoyacu (50), en 10 a los del río Yavarí (51) y entre el Ojo de Contoya, Tapiche y Divisor (52). También, resultó mayor en cinco especies a los registrados entre los ríos Gálvez, Blanco y Yaquerana correspondiente a la etnia de los Mátses(53), y en 18 al de los ríos Pauya y Pisqui en la Cordillera Azul (54). No obstante, la diversidad registrada fue inferior en tres especies a los de la cuenca baja y media del río Blanco, afluente del río Tahuayo (55). En cuanto a este último, el mayor registro podría estar relacionada al factor tiempo, puesto que los resultados corresponden a la colecta e información proporcionada de otros estudios desde hace más de veinte años, en comparación a los aproximadamente 100 días de muestreo para este estudio. Con respecto al suroriente, la diversidad de mamíferos del área de estudio fue mayor en 9 a los registrados entre los ríos Tambopata y Tavara en Madre de Díos (56), 59 y en 2 a los de la parte baja del río Urubamba (57); pero resultó inferior en 10 a los de Cocha Cashu-Pakitza y Purús (58). Esta diferencia podría estar relacionada con la baja o nula perturbación de sus bosques debido a la lejanía de grandes centros poblados y al uso de registros de estudios anteriores, así como al uso de otras metodologías como las entrevistas, que a mi entender deben ser tomadas con cierta cautela, puesto que éstas no son confiables. Los resultados también indican que el número de especies obtenidas entre los ríos Itaya, Nanay y Huanganayacu, fueron iguales entre sí, y en conjunto resultaron menores en dos especies a las obtenidas en este estudio en los bosques comprendidos entre los ríos Napo-Algodón. De los sectores evaluados, el río Curaray sobresalió por su mayor diversidad (37 especies) y fue mayor incluso en 1 al de la Reserva Nacional Allpahuayo-Mishana (27), en 10 a los del río Yaguas (31), en 7 al del río Arabela (32), en 8 al de Redondococha en Güepi (33), en 9 al de Cachimbo en el río Yaguas (35), en 14 especies a los registrados entre los ríos Uritoyacu y Pastaza (50), en 2 a los del río Yavarí (51), en 7 al del río Tapiche (52), y en 3 al de Choncó en el río Gálves (53). La diversidad de mamíferos obtenida en el río Curaray también superó en 12 al del río Pisqui en la Cordillera Azul Madre de Dios (56), (54), en 4 al de Collpa Guacamayos en en 9 al de San Martin–3 en el río Urubamba (57), y en 24 al de Curva Alegre en el río Tambopata (59); pero resultó inferior en 1 al de la cuenca del río Nanay (19), en 7 al de la cuenca del río Pucacuro (29), en 9 al de los ríos Yavarí- Mirín (51), en 17 al del río Purús, en 15 al de Cocha Cashu-Pakitza (58) y en 4 al del río Itaya (60). En referencia al río Itaya, esta diferencia podría estar relacionada con los 60 registros de animales muertos por cazadores de cada comunidad que fueron tomadas en cuenta para el incremento de la diversidad, mientras que en la cuenca alta del río Nanay estaría relacionado con los diferentes tipos de hábitats evaluados, lo que no ocurrió en este este estudio por la premura del tiempo. Recientemente Aquino et al. (24), registran 48 especies de mamíferos mayores para el río Itaya y entre ellas no figuran M. africana, A. belzebuth, S. tripartitus, S. nigricollis, L. lagotricha y C. lucifer, si a esta lista se adicionan estas seis especies, en el área de estudio conformado entre las cuencas de los ríos Tigre y Napo-Algodón estarían habitando no menos de 54 especies, superando así a la mayoría de los inventarios realizados entre el nororiente y suroriente peruano. Esta diversidad podría incluso incrementarse si a la lista adicionamos C. goeldii registrada en Julio del 2005 por Terrones y Cornejo (com. personal) en bosques aledaños al centro poblado de Santa Elena, río Tigre, muy cerca del sector de muestreo en el río Nanay. 5.1.2. En los sectores de muestreo Como era de esperar, el río Curaray fue el sector más diverso, el cual tiene mucho que ver con la baja perturbación de los bosques y probablemente otros factores ecológicos. En contraposición al anterior, los ríos Itaya y Huanganayacu son los sectores con menor riqueza de especies y con los valores más bajos en los índices de Margalef (Dmg), Simpson (1 - D) y Shannon (H’). Estos datos sugieren que los bosques con alta perturbación albergan menor diversidad de especies que los bosques de baja perturbación. 61 Comparando con los otros sectores de muestreo, el río Curaray se caracterizó por albergar la más alta diversidad de especies, el cual de hecho tiene relación con la alta calidad del bosque al mostrar ligeras perturbaciones por actividades de caza y extracción de madera de valor comercial. Por otro lado, en los cinco sectores evaluados los mamíferos más comunes y por ende con altos registros, correspondiendo éstas a L. poeppigii, L. lagotricha, S. fuscicollis, S. nigricollis, P. aequatorialis y P. monachus, lo que indicaría en términos generales que estos bosques se encuentran desde moderado a fuertemente alterado, principalmente por actividades de caza y extracción de madera de valor comercial, y quizá en menor proporción por las actividades para la exploración y explotación de hidrocarburos, considerando que en el área de estudio se encuentras los lotes petroleros 1-AB, 8, 39, 67, 102, 123 y 129. De acuerdo con los Índices de diversidad de Margalef (Dmg), Shannon-Wiener y Dominancia de Simpson, el río Curaray resultó como el sector de mayor diversidad. No obstante, la compartición de escasas 12 especies (Dasypus sp., S. sciureus, C. albifrons, D. fuliginosa, M. pratti, C. paca, P. onca, N. nasua, T. terrestris, P. tajacu, M. americana y M. nemorivaga) entre estos sectores nos indica claramente que existe diferencia en su composición, en particular el sector ubicado entre los ríos Napo-Algodón donde habitan L. lagotricha, S. nigricollis y C. lucifer, ausentes en los otros sectores de muestreo. En referencia al resto como los ríos Itaya, Huanganayacu y Nanay, la baja diversidad tendría relación con la constante presencia de cazadores y madereros (formales e informales), cuyo acceso hacia 62 estos sectores son facilitados por su cercanía a los centros poblados. Lo contrario ocurre con el río Curaray, el cual se encuentra bastante alejado de los centros poblados, por lo que la caza es muy esporádica, de allí la presencia de varios grupos saludables de T. pecari y A. belzebuth, asi como de individuos de M. tridactyla, T. terrestris y P. maximus, escasos o extintos en el resto de sectores evaluados. La alta diversidad y el buen estado de conservación de los bosques en el río Curaray amerita para ser considerada como Área de Conservación, más aún si consideramos que la mayoría de especies que habitan en ella se encuentra en alguna de las categorías de amenazas de la UICN (3) y legislación peruana (61). 5.2. Densidad poblacional de los mamíferos 5.2.1. En el área de estudio Entre los ungulados, la densidad estimada para T. pecari en el área de estudio fue mayor a los reportados para los ríos Tamshiyacu-Tahuayo (62), ríos Tahuayo-Blanco y Samiria (63), cuenca del río Samiria (64) y zona con caza del Parque Nacional Manu (65); pero resultó inferior al estimado para el área de moderada caza de la cuenca del Samiria (38), cuenca baja y alta del río Mirín (51), ríos Yavarí-Mirín (63) (64), zona de Pakitza considerada como área sin caza del Parque Nacional Manu (65) y cuenca alta del río Purús (66). En referencia a los ríos Yavarí-Mirín, está diferencia podría estar relacionada con la metodología aplicada para la estimación de la densidad y con la baja presión de caza que existe en estas cuencas. Por otro lado, la densidad estimada para P. tajacu fue mayor a los estimados para la zona de moderada caza 63 de la cuenca del río Samiria Tahuayo (62), (38), cuenca baja del Mirín (51), los ríos Tamshiyacu- cuencas de los ríos Yavarí-Mirín, Tahuayo-Blanco y Samiria (63) (64), y cuenca alta del río Purús (66); pero resultó inferior a los estimados para la cuenca de los ríos Yavarí y alto Mirín (51) y área con caza y sin caza del Parque Nacional Manu(65). La alta densidad de P. tajacu en la cuenca alta de los ríos Yavarí-Mirín y del Parque Nacional Manú, podría estar relacionada con la presencia de poblaciones bajas de T. pecari, tal como sostienen algunos autores al mencionar que donde existen poblaciones bajas de T. pecari hay alta densidad de P. tajacu. En cuanto a los ríos Tahuayo-Blanco, Samiria, parte baja y alta de los ríos Yavarí-Mirín y Purús, respectivamente esta diferencia podría estar relacionada con la longitud censada que en nuestro caso fue mayor a las cuencas citadas y con la metodología para el cálculo de la densidad. En referencia a los venados, la densidad estimada para M. americana fue mayor a los reportados para la zona de moderada caza de la cuenca del río Samiria (38); pero resultó inferior a los estimados para los ríos Tamshiyacu-Tahuayo (62), cuenca del río Samiria (64), cuenca baja y alta del río Mirín, y Yavarí-Mirín (51) (64) y área sin caza y con caza del Parque Nacional Manu (65). La mayor densidad estimada en las cuencas citadas tendría relación con la cobertura censada, que en nuestro caso fue superior a los 2000 km y con la metodología aplicada para el cálculo de la densidad. En relación a M. nemorivaga la densidad estimada fue mayor a los reportados para la cuenca del río Yavarí (51) y cuencas de los ríos Yavarí-Mirín (64); pero resultó inferior a los estimados para los ríos Tamshiyacu-Tahuayo (62) y áreas sin caza y con caza del 64 (65). Parque Nacional Manu Estas diferencias estarían relacionadas con la metodología aplicada para el cálculo de la densidad y con la longitud censada, que a diferencia de este estudio fueron significativamente menores. En cuanto a T. terrestris, la densidad estimada fue mayor a los reportados para la cuenca del río Samiria (38); pero fue inferior a los estimados para la cuenca baja y alta del río Yavarí-Mirín (51), para los ríos Tamshiyacu-Tahuayo (62), y cuencas de los ríos Samiria y Yavarí-Mirín (64). Como en los casos anteriores, esta diferencia podría estar relacionada con la metodología aplicada para el cálculo de la densidad y con la longitud censada que fue mucho menor al recorrido en este estudio. En roedores, la densidad de D. fuliginosa fue superior a los reportados para la zona de moderada caza de la cuenca del río Samiria (38), cuenca del río Yavarí y cuenca baja del Yavarí-Mirín (51) y al de la zona con caza del Parque Nacional Manu (65); pero fue inferior a los reportados para la cuenca alta del Yavarí-Mirín cuenca del Yavarí-Mirín (64), (51), río Samiria y y zona sin caza del Parque Nacional Manu (65). Resultados similares fueron para M. pratti. La mayor densidad de estos roedores en las cuencas mencionadas podría estar relacionada con la metodología aplicada para el cálculo de la densidad y a la longitud censada que fue mucho menor al recorrido en el área de estudio. Con referencia a los primates, las densidades estimadas en este estudio fueron mayores a los reportados por Puertas & Bodmer (67) para las especies que habitan en los ríos Tahuayo-Blanco, excepto para Saimiri spp., S. fuscicollis y C. apella para la 65 cuenca del río Yavarí-Mirín, pero fueron similares a las proporcionadas por Salovaara et al. (51) y Bodmer et al. (64). Estos últimos autores reportaron en los bosques inundables de la cuenca del río Samiria densidades altas para A. seniculus, P. monachus y S. boliviensis, las mismas que coinciden con las estimadas por Aquino et al. (38) (68) para estas mismas especies en el Samiria. Las densidades estimadas para S. boliviensis y A. seniculus también fueron menores a los reportados por Salovaara et al. (51) para las cuencas del Yavarí-Mirín, Endo et al. (65) para el Parque Nacional Manu, y por Bennett et al. (69) para el río Tapiche; diferencia que estaría relacionda con la metodología que los autores mencionados aplicaron para el cálculo de las densidades, es decir, el uso del software Distance, cuando este método recomienda como mínimo 30 muestras. Por otro lado, la alta densidad reportada para las cuencas del Yavarí-Mirín y Tapiche estaría relacionada con la baja presión de caza por su lejanía de los grandes centros poblados. En cuanto a la cuenca del Samiria, la mayor densidad está relacionada con la alta producción de frutos en los bosques inundables, particularmente M. flexuosa tal como sostiene Aquino et al. (70) para los aguajales donde las densidades estimadas fueron altas a los reportados para otros lugares de la Amazonía peruana; además, por el difícil acceso para los cazadores hacia estos bosques puesto que el piso generalmente cubierto por agua cuenta con raíces zancas que dificultan la caminata. 66 5.2.2. En los sectores de muestreo Entre los ungulados T. pecari fue registrado únicamente en el Curaray cuya densidad fue superior a los estimados para la cuenca del río Pucacuro Samiria(38), cuenca de los ríos Yavarí-Mirín (51), Tamshiyacu-Tahuayo (62), (17), Samiria, Yavarí-Mirín y Tahuayo-Blanco (63) (64), cuenca alta del río Purús (66), aguajales del río Samiria (70) y cuenca baja del río Algodón (71); pero fue ligeramente inferior al estimado para Pakitza en el Parque Nacional Manu (65). En referencia a esta última, la diferencia podría estar relacionada a la casi nula presión de caza debido a su lejanía con respecto a los centros poblados. En cuanto a P. tajacu, la densidad estimada para el Curaray fue ligeramente mayor a los bosques de Huanganayacu y Napo-Algodón y mucho mayor a los estimados para la parte alta del Itaya y Nanay, pero también superó a los estimados para el río Pucacuro (17), cuenca alta de los ríos Nanay e Itaya (19) (20), Tamshiyacu-Tahuayo Manu (65), río Purús río Samiria (62), (66) (38) (64), cuenca baja y alta del Yavarí-Mirín Yavarí-Mirín y Tahuayo-Blanco y cuenca baja del Algodón (71); (63) (64), (51), Parque Nacional pero fue inferior a los estimados para la cuenca del Yavarí (51). En cuanto a este último, la diferencia podria estar relacionado con el método aplicado para la estimación de la densidad, que en este caso fue mediante la aplicación del software Distance o porque el área está ubicada lejos de los grandes centros poblados. En referencia a los venados, la densidad de M. americana estimada para el Curaray fue mayor a los otros sectores en este estudio y a los reportados para la cuenca 67 media del Nanay (19), parte alta del río Itaya (20), río Samiria (38), cuenca del río Yavarí y parte alta y baja del Yavarí-Mirín (51), y los ríos Samiria y Yavarí-Mirín (19), resultó inferior a los estimados para la cuenca alta del río Nanay Tahuayo (62), áreas con caza y sin caza del Parque Nacional Manú baja del río Algodón (71). (64); pero Tamshiyacu- (65), y la cuenca La relativa baja densidad poblacional en el río Curaray podría estar relacionado con la mayor población de T. pecari, en particular en los bosques de terraza baja y media. Mazama nemorivaga fue otra de las especies cuya densidad estimada para el río Curaray fue mayor a los otros sectores evaluados en este estudio. También fue mayor al de la cuenca alta del río Nanay (19), cuenca alta del Itaya (20), río Yavarí (51), cuenca del Tamshiyacu-Tahuayo (62), y cuenca del Yavarí-Mirín (64); pero resultó inferior a los estimados para el área sin caza y con caza del Parque Nacional Manu(65). En referencia a este último, esta diferencia podría estar relacionada con la metodología aplicada para el cálculo de densidad y con la longitud censada que en este caso fue mucho menor. Tratándose de T. terrestris la densidad estimada para el Curaray fue ligeramente mayor al del Napo-Algodón y mucho mayor al del Huanganayacu; diferencia que podría estar relacionada con la longitud censada, puesto que en el Curaray también se hizo censos nocturnos; no obstante, se debe tener en cuenta que tanto en Huanganayacu y Napo-Algodón existe mayor presión de caza. La densidad de los mamíferos del Curaray también fue superior a los estimados para la cuenca baja y alta del río Yavarí-Mirín (51), Tamshiyacu-Tahuayo (62), cuenca del río Samiria (63) (38); 68 pero fue inferior a los estimados por Bodmer et al. (63) para los ríos Yavarí-Mirín, así como para los aguajales del río Samiria (70) y cuenca baja del río Algodón (71). La mayor densidad registrada en los aguajales del río Samiria al parecer tiene relación con la alta produción de frutos de M. flexuosa y otras palmeras y por la baja presión de caza. En cuanto al río Algodón, la alta densidad tendría mucho que ver con el método aplicado para el cálculo de la densidad que en este caso usaron el sofware Distance pese al reducido número de muestras. En roedores, la densidad de D. fuliginosa en la parte alta del río Itaya fue ligeramente mayor a los estimados para la cuenca alta del río Nanay y Curaray, y fue más alto para el sector Huanganayacu y Napo-Algodón. Esta diferencia se debería principalmente a los pocos competidores por el recurso alimenticio y quizá a la presencia de los “irapayales” (asociación de L. tenue) que constituyen microhábitats adecuados para el desarrollo de esta especie. Asimismo, fue mayor a los estimados para la cuenca baja y alta del Nanay cuenca baja y alta del Yavarí-Mirín (19), (51), cuenca del río Samiria (38), río Yavarí y cuenca del río Samiria y Yavarí-Mirí (63), Parque Nacional Manu (65), aguajales del río Samiria (70), cuenca baja del Algodón (71); pero fue ligeramente inferior a los estimados por Aquino et al. (20) para la cuenca alta del Itaya. La baja densidad reportada para el Samiria, Algodón y Parque Nacional Manu tendría relación con los tipos de bosques, predominando en ellos el bosque de terraza baja en comparación a los ríos Curaray e Itaya que corresponden mayormente a bosques de terraza alta y colina baja con abundantes palmeras, cuyas semillas constituyen un importante recurso alimenticio para este roedor. 69 Los resultados para M. pratti fueron muy similares al de D. fuliginosa; es decir, las mayores densidades correspondieron a los ríos Curaray, Nanay e Itaya, el cual contrasta con los obtenidos en Huanganayacu y Napo-Algodón, pero que se desconocen los factores que podrían estar influyendo. Con respecto a los primates, el Curaray cuenta con la más alta densidad para la mayoría de las especies y fueron similares o muy cercana a las reportadas para la cuenca de los ríos Tahuayo-Blanco y Yavarí-Mirín (63) (67), cuenca del Samiria (38) (63), excepto para S. sciureus, P. monachus y A. seniculus que fueron significativamente mayores. Los resultados del Curaray tambien fueron muy cercanos a los reportados para todas las especies que habitan en el río Itaya, parte alta del río Yavarí, parte baja y alta de los ríos Yavarí-Mirín, parte baja del río Algodón y alta del río Pucacuro (6) (20) (51) (71) (72), la mayoría de ellos considerados como de baja y/o moderada presión de caza. Sin embargo, las densidades estimadas para los primates en el río Tapiche resultaron mayores al del Curaray, excepto para S. boliviensis, A. seniculus y C. cupreus que fueron menores (69). Finalmente, fueron mayores a los reportados para el Parque Nacional Manu (65) y la parte baja del río Urubamba (73), excepto para S. fuscicollis, C. brunneus, Alouatta sara y A. chamek. Para el caso de S. tripartitus con distribución restringida entre los ríos Curaray Napo, la densidad estimada fue inferior al de los ríos San Antonio y Aushiri, afluentes derecho del río Napo (15), pero el de A. belzebuth fue superior al estimado para los ríos Aushiri-San Antonio, Curaray-Nashiño y curso inferior de los ríos CurarayArabela (16), ríos Pucacuro y Arabela (18) y cuenca del Samiria (74). 70 Los resultados también indican que las densidades más altas correspondieron a las especies de primates considerados de tamaño pequeño, los cuales coinciden con los estimados para las zonas con caza persistente de la cuenca media y alta del río Nanay (19), Reserva Nacional Allpahuayo-Mishana (26) (27) y alrededores de la carretera Iquitos-Nauta (28). 5.3. Amenazas para las poblaciones de mamíferos 5.3.1. En el área de estudio Entre las diversas actividades que se practican en el área de estudio las de mayor frecuencia son la caza, extracción de madera de valor comercial y el establecimiento de chacras y pastizales; a ellos se adicionan la exploración de hidrocarburos, cosecha de frutos silvestres y extracción de hojas y bejucos por lo que es común encontrar deforestaciones. De las actividades citadas, la caza, extracción de madera y apertura de chacras son las principales actividades que constituyen amenazas para la fauna silvestre, en particular para los mamíferos mayores, puesto que la excesiva caza y disminución de hábitats afectan a las poblaciones, en particular para aquellas especies que son muy susceptibles a las moderadas perturbaciones de los bosques, coincidiendo así con otras áreas de la Amazonía peruana como el reporte de Montenegro & Escobedo (31) para las cabeceras de los ríos Ampiyacu, Apayacu, Yaguas y cuenca media del Putumayo, Bravo & Borman (33) para la Reserva Nacional Güepi, Montenegro & Moya (35) para la cuenca baja y alta del río Yaguas y la cabecera del río Cotuhé, Amanzo (53) para la Reserva Comunal Matsés, Shoobridge & 71 Fagan (75) cuenca alta del río Purús, Figueroa Urubamba y Quintana et al. (77) (76) para la cuenca baja del río para los bosques de la región Ucayalí. La drástica disminución de sus poblaciones y la extinción local de ciertas especies de hecho tiene relación con la excesiva caza y deforestación, puesto que en estas áreas no existe ningún programa de manejo para contrarrestar la alta presión de caza, por lo que se debería implementar programas de manejo sostenible con participación comunitaria tal como se viene realizando en el Área de Conservación Regional Tamshiyacu-Tahuayo (62) (63) (64). En cuanto a la extracción de madera comercial, tampoco existe control, lo que ha derivado en la ilegalidad puesto que incluso se vienen extrayendo madera de las concesiones forestales, no por los concesionarios, sino por otras personas ajenas a estas concesiones como viene ocurriendo en las cabeceras de los ríos Itaya y Nanay. 5.3.2. En los sectores de muestreo De los sectores evaluados, los mamíferos que habitan en el río Itaya son los más amenazados por la caza y extracción de madera de valor comercial, en tanto que los menos amenazados son aquellos que habitan en los bosques del río Curaray cercano al límite fronterizo con el Ecuador. En el río Itaya, la ausencia de ciertas especies como A. belzebuth, A. seniculus, T. pecari e H. hydrochaeris se debe principalmente a la alta presión de caza al que fueron sometidos desde hace muchos años a tal punto de extinguirse localmente. En este sector, A. belzebuth todavía es recordada por los pobladores más antiguos de las ultimas comunidades, 72 tal es así que una quebrada lleva el nombre de “Maquizapa” donde en el año 2007 un ejemplar quizá el único sobreviviente fue muerto por un cazador de Villa Belén (R. Aquino, com. pers.). Otras especies que vienen sufriendo el estrago de la alta presión de caza en el río Itaya son A. seniculus y T. pecari, ambas en proceso de extinción local, por lo que ya son díficiles de observar. En cuanto a A. seniculus, el registro de un solo grupo por Navarro & Terrones (60) y audición de vocalización en una sola oportunidad por Aquino et al. (24) corroboran esta afirmación. En cuanto T. pecari, en este estudio no se registró ninguna evidencia de su presencia; sin embargo, en el 2011 fue observada por única vez un grupo de aproximadamente 20 individuos por un colector de hojas de irapay. La ausencia de esta especie también es evidente en la parte alta del río Nanay, así como los bosques de la cuenca baja del río Nanay (19) y de la Reserva Nacional Allpahuayo-Mishana (27). Entre los sectores evaluados, los bosques del Curaray cercanos a la frontera con Ecuador es el menos amenazado; no obstante, en el corto plazo podría encontrarse bajo amenaza por la caza intensiva y masiva extracción de madera comercial como lo menciona Aquino et al. (16) y Heymann et al. (30), puesto que aguas abajo de los puntos de muestreo estas actividades se practican con mayor frecuencia. 73 VI. CONCLUSIONES Los registros sistemáticos y asistemáticos indican para el área de estudio un total de 45 especies agrupadas en 7 ordenes, 20 familias y 37 géneros, siendo L. poeppigii y S. fuscicollis las especies más comunes. Entre los sectores evaluados, el río Curaray contiene la más alta diversidad de especies, en particular primates, igualando así al Área de Conservación Regional Tamshiyacu-Tahuayo y Parque Nacional Manu, ambos con 13 especies. En el río Curaray, el alto porcentaje de registros de ungulados y primates, en particular de L. poeppigii y A. belzebuth se debe al buen estado de conservación de los bosques por la casi ausencia de actividades como la caza, extracción de madera de valor comercial y establecimiento de chacras y pastizales. Exceptuando al río Curaray, A. belzebuth no fue observado ni escuchado sus vocalizaciones durante los censos, por lo que esta especie ya se encontraría extinta en los otros sectores evaluados. Entre los primates, A. seniculus estuvo ausente en el río Itaya, mientras que en otros sectores que no incluye al río Curaray los registros fueron muy escasos y en grupos muy pequeños, lo que indicaría que se encuentra en proceso de extinción local. Entre los ungulados, el escaso registro de huellas de T. pecari y T. terrestris indicaría que ambas especies también estarían camino a la extinción local. 74 Las densidades poblacionales más altas correspondieron a los bosques aledaños del río Curaray y las más bajas para los ríos Itaya y Nanay, lo que indicaría que en estos sectores la mayoría de las especies están expuestas a la sobrecaza. Entre las diversas actividades que se realizan en el área de estudio, la caza, extracción de madera y establecimiento de chacras y pastizales son las principales amenazas para los mamíferos mayores y fauna silvestre en general. 75 VII. RECOMENDACIONES La alta diversidad de especies de primates y otros componentes de fauna silvestre registrados en el río Curaray próximo al límite fronterizo con Ecuador amerita la creación de un área de conservación. La densidad poblacional estimada para los mamíferos es un indicador del estado actual de sus poblaciones, pero se desconoce si la caza es o no sostenible para la mayoría de ellas, por lo que se debería implementar programas para el registro de la caza a fin de determinar la sostenibilidad de la caza. Por la riqueza de especies de primates y de otros animales, el río Curaray como parte del área de estudio es apropiado para la investigación y el ecoturismo, por lo que debería declararse como área de conservación u otro a fín. 76 VIII. 1. REFERENCIAS BIBLIOGRÁFICAS Voss R, Emmons L. Mammalian diversity in neotropical lowland rainforests: A preliminary assessment. Bull. Amer. Museum Nat. Hist. 1996.230 p. 2. Pacheco V, Cadenillas R, Salas E, Tello C, Zeballos H. Diversidad y endemismo de los mamíferos del Perú. Rev. Peru. Biol. 2009; 16(1):5–32. 3. UICN. Unión Internacional para la Conservación de la Naturaleza (Internet). EE.UU. 2014 (Consultado el 10 de febrero del 2014). Disponible:http://www.iucnredlist.org>. 4. Torres VJ. Manejo Forestal. Un camino hacia la conservación de los bosques en la selva baja. En: Kalliola R, Puhakka M, Danjoy W, editores. Amazonía peruana, vegetación húmeda tropical en el llano subandino. Finland: Gummerus Printing; 1993. p.221–233. 5. Finer M, Jenkins CN, Pimm SL, Keane B, Ross C. Oil and gas projects in the western amazon: Threats to wilderness, biodiversity and indigenous peoples. PLoS ONE. 2008;3(8): e2932. 6. Aquino R, Terrones W, Navarro R, Terrones C, Cornejo FM. Caza y estado de conservación de primates en la cuenca del río Itaya, Loreto, Perú. Rev. Peru. Biol. 2009;15(2):33–39. 77 7. Suarez E, Morales M, Cueva R, Utreras BV, Zapata-Ríos G, Toral E, Torres J, Prado W, Vargas OJ. Oil industry, wild meat trade and roads: indirect effects of oil extraction activities in a protected area in north-eastern Ecuador. Animal Conservation. 2009;12:364–373. 8. Felton AM, Felton A, Foley WJ, Lindenmayer DB. The role of timber tree species in the nutritional ecology of spider monkeys in a certified logging concession, Bolivia. For. Ecol. Manag. 2010;259:1642–1649. 9. Dammert BJL, Cárdenas C, Canziani E. Potenciales impactos ambientales y sociales del establecimiento de cultivos de palma aceitera en el departamento de Loreto. Lima: Tarea Asociación Gráfica Educativa;2012. 130p. 10. Bodmer RE, Eisenberf JF, Redford KH. Hunting and the likelihood of extinction of amazonian mammals. Conservation Biology. 1997;11(2):460– 466. 11. Pacheco LF, Simonetti JA. Consecuencias demográficas para Inga ignoides (Mimosoideae) por la perdida de Ateles paniscus (Cebidae), uno de sus dispersores de semillas. Ecología en Bolivia. 1998;31:67–90. 78 12. Arroyo RV. Efectos de la fragmentación sobre la calidad del hábitat para monos aulladores (Alouatta palliata mexicana) en Los Tuxtlas, Veracruz. (Tesis). (México): Instituto de Ecología. 2005. 51 p. 13. Nunez-Iturri G, Olsson O, Howe HF. Hunting reduces recruitment of primatedispersed trees in Amazonian Peru. Biological Conservation. 2008; 141:1536–1546. 14. Holbrook KM, Loiselle BA. Dispersal in a neotropica tree, Virola flexuosa (Myristicaceae): Does hunting of large vertebrates limit seed removal? Ecology. 2009;90(6):1449–1455. 15. Aquino R, Ique C, Gálvez H. Reconocimiento preliminar de la densidad y estructura poblacional de Saguinus tripartitus Milne-Eduards en la Amazonía peruana. Rev. Peru. Biol. 2005;12(3):435–440. 16. Aquino R, Cornejo FM, Pezo E, Heymann EW. Distribution and abundance of white-fronted spider monkeys, Ateles belzebuth (Atelidae), and threats to their survival in Peruvian Amazonia. Folia Primatol. 2013;84:1–10. 17. Aquino R, Bodmer RE, Pezo E. Evaluación de poblaciones del pecarí de collar (Tayassu tajacu) y pecarí labiado (T. pecari) en la cuenca del río Pucacuro, río Alto Tigre. En: Fang TG, Montenegro OL, Bodmer RE, editores. Manejo y 79 Conservación de Fauna Silvestre en América Latina. Santa Cruz: 1999. p. 469–477. 18. Kolowski JM, Alonso A. Primate abundance in an unhunted region of the northern Peruvian amazon and the influence of seismic oil exploration. Int. J. Primatol. 2012;33:958–971. 19. Ferreyra FR. Abundancia, estado de conservación y presión actual de mamíferos y aves en el sector medio y alto de la cuenca del río Nanay. Loreto-Perú. (Tesis). (Iquitos): Universidad Nacional Amazonía Peruana. 2003. 90 p. 20. Aquino R, Terrones C, Navarro R, Terrones W. Evaluación del impacto de la caza en mamíferos de la cuenca del río Alto Itaya, Amazonía peruana. Rev. Peru. Biol. 2007;14(2):181–186. 21. Aquino R, Terrones W, Cornejo F, Heymann EW. Geographic distribution and posible taxonomic distribution of Callicebus torquatus populations (Pitheciidae: Primates) in Peruvian Amazonia. Amer. J. Primat. 2008;70:1181–1186. 22. Aquino R, Cornejo FM, Pezo LE, Heymann EW. Geographic distribution and demography of Pithecia aequatorialis (Pitheciidae) in peruvian Amazonia. Amer. J. Primat. 2009;71:1–5. 80 23. Aquino R, Gil D, Pezo E. Aspectos ecológicos y sostenibilidad de la caza del majás (Cuniculus paca) en la cuenca del río Itaya, Amazonía peruana. Rev. Peru. Biol. 2009;16(1):67–72. 24. Aquino R, Tuesta C, Rengifo E. Diversidad de mamíferos y sus preferencias por los tipos de hábitats en la cuenca del río Alto Itaya, Amazonía peruana. Rev. Peru. Biol. 2012;19(1):35–42. 25. Aquino R, Cornejo F, Pezo E. Primates de la cuenca del río Alto Itaya: caza, situación actual y amenazas para su supervivencia. En: Aquino R, PezoLozano E, Gil-Macedo DE, editores. Mamíferos de la Cuenca del Río Alto Itaya, Amazonía Peruana. Saarbrücken: Editorial Académica Española; 2013. p. 295–316. 26. Alvarez J, Soini P. Evaluación y Conservación de la Diversidad Biológica para el Ecoturismo. En: Informe final del sub proyecto Evaluación de la fauna silvestre en el área de influencia de la carretera Iquitos-Nauta, Perú. PBIOIIAP, Iquitos. 2000. 27. Oversluijs VMR. Animales de caza en la Zona Reservada Allpahuayo Mishana. Folia Amazónica. 2003;14(1):7–16. 28. Aquino R, Charpentier E, Mendoza G. Diversidad y abundancia de primates en bosques del área de influencia de la carretera Iquitos-Nauta, Loreto, Perú. 81 En: Aquino R, Pezo Lozano E, Gil Macedo DE, editores. Mamíferos de la cuenca del río alto Itaya, Amazonía Peruana. Saarbrücken: Editorial Académica Española; 2013. p. 95–118. 29. Soini P, Dosantos A, Calle A, Lily A. Mamíferos. En: Conservación y Manejo de la Biodiversidad de la Cuenca del Pucacuro. Programa del Aprovechamiento Sostenible de la Biodiversidad. Informe Técnico. Iquitos: IIAP. 2001. p. 27– 35. 30. Heymann EW, Encarnación F, Canaquín J. Primates of the río Curaray, northern Peruvian Amazon. Int. J. Primatol. 2002;23(1):191–201. 31. Montenegro O, Escobedo M. Mamíferos. En: Pitman NR, Smith RC, Vriesendorp C, Moskovits D, Piana R, Knell G, Wachter T, editores. Perú: Ampiyacu, Apayacu, Yaguas, Medio Putumayo. Rapid Biological Inventories Report 12. Chicago: The Field Museum; 2004. p. 79–87. 32. Bravo A, Ríos JA. Mamíferos. En: Vriesendorp C, Álvarez JA, Barbagelata N, Alverson WS, Moskovits DK, editores. Perú: Nanay, Mazán, Arabela. Rapid Biological Inventories Report 18. Chicago: The Field Museum; 2007. p.73–78. 33. Bravo A, Borman R. Mamíferos. En: Alverson SW, Vriesendorp C, del Campo A, Moskovits DK, Stotz DF, García DM, Borbor LLA, editores. Ecuador-Perú: 82 Cuyabeno-Güeppí. Rapid Biological and Social Inventories Report 20. Chicago: The Field Museum; 2008. p. 105–111. 34. Bravo A. Mamíferos. En: Gilmore MP, Vriesendorp C, Alverson WS, del Campo A, von May R, López Wong C, Ríos Ochoa S, editores. Perú: Maijuna. Rapid Biological and Social Inventories Report 22. Chicago: The Field Museum; 2010. p. 90–96. 35. Montenegro O, Moya L. Mamíferos. En: Pitman N, Vriesendorp C, Moskovits D, von May R, Alvira D, Wachter T, Stotz DF, del Campo A, editores. Perú: Yaguas-Cotuhé. Rapid Biological Inventories Report 23. Chicago: The Field Museum; 2011. p. 126–133. 36. Olson DM, Dinerstein E. The Global 200: Priority ecoregions for global conservation. Annals of the Missouri Botanical Garden. 2002; 89:199-224. 37. Vriesendorp C, Davila N, Foster R, Nuñez-Iturri G. Flora y Vegetación. En: Vriesendorp C, Álvarez JA, Barbagelata N, Alverson WS, Moskovits DK, editores. Perú: Nanay, Mazán, Arabela. Rapid Biological Inventories Report 18. Chicago: The Field Museum; 2007. p. 50–56. 38. Aquino R, Bodmer RE, Gil G. Mamíferos de la Cuenca del Río Samiria: Ecología Poblacional y Sustentabilidad de la Caza. Lima: Imprenta Rosegraff, 2001. 108 p. 83 39. Emmons LH, Feer F. Mamíferos de los bosques húmedos de América Tropical. Santa Cruz de la Sierra: Editorial F.A.N; 1999. p. 298. 40. Moreno CE. Métodos para medir la biodiversidad. Manuales & Tesis SEA, vol. 1. 1era ed. Zaragoza. 2001. 84 p. 41. Buckland ST, Anderson DR, Burnham KP, Laake JL, Borchers DL, Thomas L. Introduction to Distance Sampling. Estimating abundance of biological populations. Oxford University Press. 2001. 42. Thomas L, Laake JL, Strindberg S, Marques FFC, Buckland ST, Borchers DL, Anderson DR, Burnham KP, Hedley SL, Pollard JH, Bishop JRB, Marques TA. Distance 5.0. Release “x”1. Research Unit for Wildlife Population Assessment, University of St. Andrews. UK. 2006. 43. Burnham KP, Anderson DL, Laake JL. Estimation of density from line transects sampling of biological populations. Wildl. Monogr. 1980;72:1–202. 44. Hammer O, Harper DAT, Ryan PD. PAST: Paleontological statistics software package for education and data analysis. Paleontología Electrónica 2001; 4(1):1–9. 45. Aquino R, Encarnación F. Primates del Perú. Primate Report. 1994;40: 1-130. 84 46. Simonetti JA, Huareco I. Uso de huellas para estimar diversidad y abundancia relativa de los mamíferos de la Reserva de la Biosfera – Estación Biológica del Beni, Bolivia. Mastozoología Neotroprical. 1999;6(1):139–144. 47. Navarro JF, Muñoz J. Manual de huellas de algunos mamíferos terrestres de Colombia. Medellin, Colombia: Multimpresos; 2000. p. 123. 48. Carvalho JO, Cavalcante LN. Pegadas: Série Boas Práticas. Belém-PA: EDUFPA.V.3. 2008. p. 64. 49. Rylands AB, Mittermeier RA. The Diversity of the New World Primates (Platyrrhini): An Annotated Taxonomy. En: Garber PA, Estrada A, BiccaMarques JC, Heymann EW, Strier KB, editors. South American PrimatesComparative Perspectives in the Study of Behavior, Ecology, and Conservation. Chicago: University of Chicago; 2009. p. 23–54. 50. CDC-UNALM – WWF. Evaluación ecológica del abanico del río Pastaza. Centro de Datos para la Conservación, UNALM–Word Wildlife Fund, Perú. Lima: Tipog; 2002. p. 76. 51. Salovaara K, Bodmer RE, Recharte M, Reyes F. Diversidad y Abundancia de Mamíferos. En: Pitman N, Vriesendorp C, Moskovits D, editores. Perú: Yavarí. Rapid Biological Inventories Report 11. Chicago: The Field Museum; 2003. p. 74–82. 85 52. Jorge MLSP, Velazco PM. Mamíferos. En: Vriesendorp C, Schulenberg TS, Alverson WS, Moskovits DK, Rojas I, editores. Perú: Sierra del Divisor. Rapid Biological Inventories Report 17. Chicago: The Field Museum; 2006. p. 98– 105. 53. Amanzo J. Mamíferos medianos y grandes. En: Vriesendorp C, Pitman N, Rojas Moscoso JI, Pawlak BA, Rivera Chavez CL, Mendes LC, Vela CM, Fasabi RP, editores. Perú: Matsés. Rapid Biological Inventories Report 16. Chicago: The Field Museum; 2006. p. 98-106. 54. Pacheco V, Arias L. Mamíferos. En: Alverson WS, Rodriguez L, Moskovits D, editores. Perú: Biabo. Cordillera Azul. Rapid Biological Inventories Report 02. Chicago: The Field Museum; 2001. p. 85–88. 55. Valqui M. Inventario de mamíferos de San Pedro del río Blanco, Loreto, Perú. Colaboración entre la población local y profesionales. En: Fang TF, Montenegro O, Bodmer RE, editores. Manejo y Conservación de Fauna Silvestre en América Latina. La Paz, Bolivia. 1999. p. 343–49. 56. Emmons L, Romo M. The Tambopata-Camdamo Reserved Zone of Southeastern Perú: A Biological Assessment, RAP Working Papers 6. Washingotn D.C: Conservation International; 1994. p. 46-47. 86 57. Boddicker M, Rodríguez J, Amanzo J. Indices for assessment and monitoring of large mammals with an adaptive management framework. Env. Monit. Assess. 2002;76:105–123. 58. Pitman RL, Beck H, Velazco PM. Mamíferos Terrestres y Arbóreos de la Selva Baja de la Amazonía Peruana: Entre los ríos Manu y Alto Purús. En: Pitman RL, Pitman N, Álvarez P, editores. Alto Purús. Biodiversidad, Conservación y Manejo. Lima: Center for Tropical Conservation; 2003. p. 109–122. 59. Pacheco V, Márquez G, Salas E, Centty O. Diversidad de mamíferos en la cuenca media del río Tambopata, Puno, Perú. Rev. Peru. Biol. 2011;18(2):231–244. 60. Navarro R, Terrones C. Evaluación del impacto de la caza en mamíferos de la cuenca alta del río Itaya, Loreto (Tesis). (Iquitos): Universidad Nacional de la Amazonía Peruana. 2006. 95 p. 61. MINAGRI. Actualización de la lista de clasificación y categorización de especies amenazadas de fauna silvestre. Decreto supremo Nº 004-2014MINAGRI. Lima: El Peruano; 2014. 520497-520504 p. 62. Bodmer RE. Manejo de Fauna Silvestre con las Comunidades Locales: El Caso de la Reserva Comunal Tamshiyacu-Tahuayo. Virginia: Foundation Community Based Conservation Workshop;1993.19 p. 87 63. Bodmer RE, Aquino R, Puertas P, Reyes C, Fang T, Gottdenker N. Manejo y uso sustentable de pecaríes en la Amazonía peruana. Occassional Paper No. 18. Quito, Ecuador:Comisión de Supervivencia de Especies, IUCN;1997. 102p. 64. Bodmer RE, Aquino R, Puertas P. Alternativas de manejo para la Reserva Nacional Pacaya Samiria: Un análisis sobre el uso sostenible de la caza. En: Fang TG, Bodmer RE, Aquino R, Valqui T, editores. Manejo de Fauna Silvestre en la Amazonía. La Paz: Instituto de Ecología; 1997. p. 65–74. 65. Endo W, Peres CA, Salas E, Mori S, Sanchez-Vega JL, Shepard GH, Pacheco V, Yu DW. Game vertebrate densities in hunted and nonhunted forest sites in Manu National Park, Peru. Biotropica. 2010;42:251–261. 66. Lleellish M, Amanzo J, Hooker Y, Yale S. Evaluación poblacional de pecaríes en la región del Alto Purús. En: Pitman RL, Pitman N, Álvarez P, editores. Alto Purús. Biodiversidad, Conservación y Manejo. Center for Tropical Conservation, Nicholas School of the Environment, Duke University. 2003. p. 137–145. 67. Puertas P, Bodmer R. Conservation of a high diversity primate assemblage. Biodiv. Conserv. 1993;2:586–593. 68. Aquino R, Bodmer RE, Gil G. Impacto de la caza en poblaciones de primates de la cuenca del río Samiria, Reserva Nacional Pacaya Samiria. En: San 88 Martín Howard F, García Podesta M, editores. La Primatología en el Perú Vol. II. Lima: Master Graf. Editores; 2000. p. 91–101. 69. Bennett CL, Leonard S, Carter S. Abundance, diversity, and patterns of distribution of primates on the Tapiche river in Amazon Peru. Am. J. Primatol. 2001;54:119–126. 70. Aquino R. Alimentación de mamíferos de caza en los “aguajales” de la Reserva Nacional Pacaya Samiria. Rev. Peru. Biol. 2005;12(3):417–425. 71. Aquino R, Pacheco T, Vásquez M. Evaluación y valorización económica de la fauna silvestre en el río Algodón, Amazonía peruana. Rev. Peru. Biol. 2007; 14(2):187–192. 72. Aquino R, Bodmer RE, Pezo E. Evaluación de primates en la cuenca alta del río Pucacuro, Amazonía Peruana. En: San Martín Howard F, García Podesta M, editores. La Primatología en el Perú Vol. II. Lima: Master Graf. Editores; 2000. p. 92–110. 73. Aquino R, Cornejo FM, Heymann EW. Primate abundance and habitat preferences on the lower Urubamba and Tambo rivers, central-eastern Peruvian Amazonia. Primates. 2013;54:377–383. 89 74. Aquino R, Bodmer RE. Distribución y abundancia de Ateles belzebuth E. Geoffroy y Ateles chamek Humboldt (Cebidae: Primates) en la Reserva Nacional Pacaya Samiria, Perú. Rev. Peru. Biol. 2006;13(1):103–106. 75. Shoobridge D, Fagan C. Una investigación de la extracción ilegal de madera en el Parque Nacional Alto Purús y alrededores. Durham, Carolina del Norte: Parks Watch. 2005. 76. Figueroa J. Mamíferos. En: Vriesendorp C, Rivera Chávez L, Moskovits D, Shopland J, editores. Perú. Megantoni. Rapid Biological Inventories Report 15. Chicago: The Field Museum; 2004. p. 110–118. 77. Quintana H, Pacheco V, Salas E. Diversidad y conservación de los mamíferos de Ucayalí, Perú. Ecología Aplicada. 2009;8(2): 91–103. 90 IX. ANEXOS 91 Anexo 1. Ficha de Evaluación (censos por transectos). Investigadores: ………………………………………………………………………………………………………………………………………………………………………………….. Lugar de muestreo: ………………………………………………………………………………………………… N° de transecto: ………….…………. Fecha: …………………………... Hora inicial: ……………………….. Hora final: ………….……………………. Distancia total recorrida:…………….……………………………. Condiciones climaticas: (soleado), (nublado), (lluvioso), (llovizna) ………………………………………………………………………. Nº Hora Especie Nº Ind. D.P. (m) Actividad Asociación Hábitat Coordenadas Observaciones N° ind: número de individuos, D.P: distancia perpendicular, m: metros 92 Anexo 2. Longitud total recorrida (km) por especie en el interfluvio Tigre-Napo. Especie Dasyprocta fuliginosa* Myoprocta pratti* Tapirus terrestris* Mazama americana* Mazama nemorivaga* Tayassu pecariᵟ Pecari tajacuᵟ Nasua nasuaᵟ Ateles belzebuthᵟ Lagothrix poeppigiiᵟ Lagothrix lagotrichaᵟ Alouatta seniculusᵟ Cebus albifronsᵟ Cebus apellaᵟ Saimiri sciureusᵟ Pithecia aequatorialisᵟ Pithecia monachusᵟ Callicebus discolorᵟ Callicebus torquatusᵟ Callicebus luciferᵟ Saguinus fuscicollisᵟ Saguinus nigricollisᵟ Saguinus tripartitusᵟ TOTAL Longitud total recorrida 2069ᵠ 2069ᵠ 2069ᵠ 2069ᵠ 2069ᵠ 2069ᵠ 2069ᵠ 2069ᵠ 1648ᶿ 1648ᶿ 421ᶷ 2069ᵠ 2069ᵠ 1448ᶲ 2069ᵠ 1448ᶲ 621† 1648ᶿ 812‡ 421ᶷ 1448ᶲ 421ᶷ 200ᵝ Grupos y/o individuos observados 46 58 10 31 19 6 39 9 31 151 26 31 59 46 49 95 20 38 17 10 132 28 12 963 *Especie solitaria, ᵟespecie social, ᵠtodos los transectos, ᶿtransectos entre los ríos Tigre y Napo (margen derecha), ᶷtransectos entre los ríos Napo y Algodón, ᶲtodos los transectos, excepto al norte del Curaray y Napo-Algodón, †transectos al norte del Curaray y NapoAlgodón, ‡transectos en el río Itaya y Nanay, ᵝtransectos entre los ríos Curaray y Napo (margen derecha) 93 Anexo 3. Especies y número de observaciones por sector de muestreo. Orden Cingulata Pilosa Primates Rodentia Carnivora Perissodactyla Cetartiodactyla Familia Especie Dasypus sp. Priodontes maximus Bradypodidae Bradypus variegatus Cyclopedidae Cyclopes didactylus Myrmecophaga tridactyla Myrmecophagidae Tamandua tetradactyla Cebuella pygmaea Saguinus nigricollis Callitrichidae Saguinus fuscicollis Saguinus tripartitus Saimiri sciureus Cebus apella Cebidae Cebus albifrons Aotidae Aotus vociferans Callicebus discolor Callicebus torquatus Pitheciidae Callicebus lucifer Pithecia monachus Pithecia aequatorialis Alouatta seniculus Ateles belzebuth Atelidae Lagothrix lagotricha Lagothrix poeppigii Sciurillus pusillus Sciuridae Microsciurus flaviventer Sciurus sp. Caviidae Hydrochoerus hydrochaeris Dasyprocta fuliginosa Dasyprotidae Myoprocta pratti Cuniculidae Cuniculus paca Leopardus pardalis Felidae Puma concolor Panthera onca Canidae Speothos venaticus Mustelidae Eira barbara Procyonidae Nasua nasua Tapiridae Tapirus terrestris Pecari tajacu Tayassuidae Tayassu pecari Mazama americana Cervidae Mazama nemorivaga Dasyproctidae Total por sector Total en el área (Tigre-Napo) Itaya Huang. Nanay Nap-Alg. Curaray O.D. O.I. O.D. O.I O.D. O.I O.D. O.I O.D. O.I 0 0 0 0 0 0 0 0 51 0 11 5 10 0 2 17 0 0 33 0 0 0 18 0 3 5 0 20 13 1 1 0 1 0 2 1 0 8 0 4 1 213 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 1 0 25 0 4 10 7 0 3 0 0 0 30 8 0 0 37 0 0 7 1 6 4 2 0 0 0 0 0 1 2 10 0 7 0 191 3 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 4 0 0 2 0 0 0 6 3 3 2 2 0 0 0 1 0 0 0 0 28 0 3 13 5 0 12 0 0 0 15 5 0 0 22 2 0 0 0 8 16 0 0 2 0 3 2 1 0 4 0 1 3 2 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0 1 1 0 0 0 2 1 0 0 0 156 1,204 1 0 1 0 0 0 0 28 0 0 7 0 13 0 0 0 10 13 0 3 0 26 0 2 1 4 0 4 3 0 0 0 0 0 1 2 4 5 0 8 2 4 2 0 0 2 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 7 0 0 3 0 0 0 3 3 3 3 1 171 O.D: observación directa, O.I: observación Indirecta 94 0 0 0 0 0 1 7 0 28 12 24 18 24 1 21 0 0 7 17 15 31 0 74 7 9 17 2 8 22 0 0 0 0 0 0 4 4 12 6 11 13 473 24 17 0 0 7 2 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 14 1 1 4 0 1 0 6 0 0 0 0 Anexo 4. Porcentaje (%) de avistamiento de los mamíferos durante los censos. Especie Dasyprocta fuliginosa* Myoprocta pratti* Tapirus terrestris* Mazama americana* Mazama nemorivaga* Tayassu pecariᵠ Pecari tajacuᵠ Nasua nasuaᵠ Ateles belzebuthᵠ Lagothrix poeppigiiᵠ Lagothrix lagotrichaᵠ Alouatta seniculusᵠ Cebus albifronsᵠ Cebus apellaᵠ Saimiri sciureusᵠ Pithecia aequatorialisᵠ Pithecia monachusᵠ Callicebus discolorᵠ Callicebus torquatusᵠ Callicebus luciferᵠ Saguinus fuscicollisᵠ Saguinus nigricollisᵠ Saguinus tripartitusᵠ TOTAL Itaya Huanganayacu N % 6 13 4 7 2 20 7 23 N 20 13 % 44 22 4 1 13 5 8 1 20 11 10 1 18 ncd 12 37 ncd 8 7 10 4 30 ncd 3 ncd ncd 25 ncd ncd 154 10 5 11 33 ncd 2 17 ncd 51 ncd ncd 194 17 11 23 35 5 100 39 20 Nanay N 8 16 % 17 28 1 3 3 16 26 11 4 1 10 11 24 22 ncd 5 5 13 3 15 ncd 12 15 26 12 22 8 31 8 19 16 ncd 28 ncd ncd 136 16 8 28 6 16 Napo-Algodón N % 4 9 3 5 4 40 8 26 2 11 5 2 ncd ncd 26 3 13 ncd 7 ncd 13 13 22 100 10 22 14 65 32 ncd 10 100 21 14 28 ncd 128 100 13 Curaray N % 8 17 22 38 4 40 11 35 13 68 6 100 12 31 4 45 31 100 74 49 ncd 15 48 24 41 18 39 24 49 17 18 7 35 21 55 ncd ncd 28 21 ncd 12 100 351 37 Área (Tigre-Napo) N % 46 100 58 100 10 100 31 100 19 100 6 100 39 100 9 100 31 100 151 100 26 100 31 100 59 100 46 100 49 100 95 100 20 100 38 100 17 100 10 100 132 100 29 100 12 100 963 100 *Especie solitario, ᵠ especie social, ncd: no corresponde su distribución 95 Anexo 5. Variación del tamaño de grupo de los mamíferos por sector evaluado. Especie Dasyprocta fuliginosa Myoprocta pratti Tapirus terrestris Mazama americana Mazama nemorivaga Tayassu pecari Pecari tajacu Nasua nasua Ateles belzebuth Lagothrix poeppigii Lagothrix lagotricha Alouatta seniculus Cebus albifrons Cebus apela Saimiri sciureus Pithecia aequatorialis Pithecia monachus Callicebus discolor Callicebus torquatus Callicebus lucifer Saguinus fuscicollis Saguinus nigricollis Saguinus tripartitus Rango Itaya T. prom. ± D.S 1 1 1 1 Huanganayacu Rango T. prom. ± D.S 1 1 1 1 Rango Nanay T. prom. ± D.S 1 1 1 1 2-5 >1 3±1.2 (N=5) 2-7 >6 3.7±1.9 (N=8) 2-5 >7 3±1.7 (N=3) 7-15 10.9±2.6 (N=8) 8-28 13.8±5.6 (N=13) 8-21 12.4±4.3 (N=9) 4 >10 >8 >11 2-5 N=1 3 >12 9-11 >8 2-6 N=1 5-10 4-5 >20 2-7 6.4±2.1 (N=5) 4.5±0.7 (N=2) 4.3±1.4 (N=14) >2 2-6 3.2±1.3 (N=8) 2-9 5.4±2.2 (N=26) 3.4±0.9 (N=11) Napo-Algodón Rango T. prom. ± D.S 1 1 1 1 1 4-7 4 5.7±1.5 (N=3) N=1 19-31 4 8-17 25±5.1 (N=6) N=1 11.6±3.6 (N=5) 10±1 (N=3) >22 3.1±1.3 (N=14) 2-3 2.6±0.6 (N=3) 2-4 2.5±0.8 (N=11) 2-8 5.3±1.8 (N=13) 2-10 5.9±2.1 (N=15) 2-6 3.9±1.4 (N=10) 2-6 3.4±1.6 (N=7) 4-10 5.8±1.8 (N=11) Curaray Rango T. prom. ± D.S 1 1 1 1 1 >45 4-5 4.6±0.6 (N=3) 7 N=1 6-18 12.2±5.5 (N=5) 9-21 15.2±4.5 (N=14) 5-11 9-17 7-15 >35 2-6 2-7 2-5 7±1.9 (N=8) 13.8±2.8 (N=6) 12.2±3.3 (N=5) 4-8 5.6±1.1 (N=17) 3-8 5.6±1.9 (N=8) T. prom: tamaño promedio; D.S: desviación estándar, N: el tamaño de muestra para el cálculo del tamaño promedio de grupo difiere del número de grupos observados puesto que el conteo completo no siempre fue posible aConteo incompleto, por lo tanto, promedio tomado de Aquino et al. (17) bConteo incompleto, por lo tanto, promedio tomado de Aquino et al. (6) 3.7±1.4 (N=9) 4.4±1.9 (N=7) 3±1.0 (N=18) Área (Tigre-Napo) Rango T. prom. ± D.S 1 1 1 1 1 >45 130a 2-7 3.9±1.7 (N= 22) 2-7 5.5±2.1 (N=2) 6-18 12.2±5.5 (N=5) 8-28 13.4±4.7 (N=44) 19-31 25±5.1 (N=6) 3-11 6.1±2.2 (N=11) 5-17 10.8±4.2 (N=16) 2-15 8.2±4.7 (N=13) >35 43.5b 2-7 3.6±1.3 (N=48) 2-7 4.1±1.6 (N=17) 2-5 2.8±0.9 (N=32) 2-6 3.2±1.3 (N=8) 2-6 3.4±1.6 (N=7) 2-10 5.5±1.8 (N=71) 4-10 5.8±1.8 (N=11) 3-8 5.6±1.9 (N=8) 96 Anexo 6. Glosario. Desplazamiento temporal: se refieren cuando los mamíferos se desplazan temporalmente de su área domiciliar pero que luego retornan cuando cesan las actividades que ocasionan impactos. Disminución de las poblaciones: Se reduce el número de individuos generalmente por efecto de una sobre caza y por el desplazamiento temporal o definitivo. Extinción local de especies: Ausencia de las especies por exterminio de las poblaciones debido generalmente por la sobre caza que usualmente ocurre con especies de vida larga como A. belzebuth y T. terrestris. Niveles de perturbación: Alto (A) : Se desplaza más de una especie y no retornan hacia el lugar impactado. Medio (M) : Se desplaza más de una especie, pero la mayoría de ellas retornan al lugar impactado. Bajo (B) : Cuando una especie se desplaza, pero retorna al lugar impactado. 97
 0
0
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados