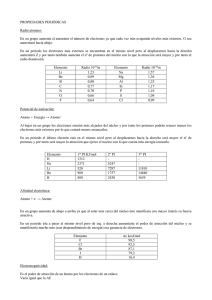
Consta de un determinado número de protones con carga positiva en el núcleo y una cantidad igual de electrones, con carga negativa, girando en diferentes órbitas en el espacio, que reciben el nombre de envoltura Así, en la 1 órbita junto al núcleo, llamada órbita K, caben como máximo dos electrones; en la 2 o L caben 8; en la 3 o M, 18; en la 4, 32. De esta forma, el átomo del cuerpo simple llamado sodio, que contiene en su núcleo 11 protones, dispone de 3 órbitas, existiendo dos electrones en la 1, ocho en la 2 (L) y uno solo en la 3(M) ATOMO Cada elemento se diferencia de los demás en el número de electrones y protones que contiene. Así, el hidrógeno posee un electrón y un protón; el litio, tres protones y tres electrones; el carbono, seis protones y seis electrones Se llama átomo estable el que tiene completa de electrones su última órbita o al menos dispone en ella de 8 electrones. Así, el helio, con 2 electrones y 2 protones, y el neón, con 10 protones y 10 electrones, son átomos estables por tener completas sus órbitas de valencia, tal como se muestra en la figura MAPA CONCEPTUAL Unidad 5 Estructura del Atomo Los átomos inestables, que son los que no tienen llena su órbita periférica ni tampoco 8 electrones en ella, tienen una gran propensión a convertirse en estables, bien desprendiendo los electrones de valencia o bien absorbiendo del exterior electrones libres hasta completar la última órbita; FRANCISCO JAVIER RODRIGUEZ DURAN SISTEMAS DE ENERGIA SOLAR