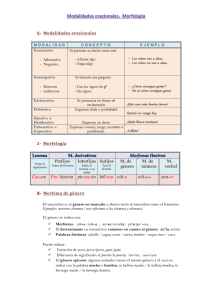
Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. Concepto de desarrollo embrionario y diferenciación sexual Una vez que se ha producido la fecundación, se presenta un proceso de clivaje o división mitótica del cigoto, dando lugar a los denominados períodos de crecimiento Ovular, Embrionario y Fetal, que corresponden a etapas diferentes de desarrollo del embrión (Figura N°2). El periodo ovular se extiende hasta el día 16, en el cual el concepto no es fácilmente reconocible como miembro de una especie en particular. La primera división o clivaje genera dos células cada una de las cuales se denomina blastómero; estas divisiones son mitóticas y cada blastómera recibe la distribución cromosómica completa. Las segmentaciones iniciales son simultáneas para posteriormente dividirse de manera independiente entre sí. Por lo tanto, el periodo ovular comprende las fases de Segmentación y Gastrulación. El periodo embrionario es la fase de crecimiento y desarrollo de todos los órganos u organogénesis, además de los diferentes sistemas. Igualmente se efectúa la implantación y el desarrollo de la placenta o placentación, extendiéndose hasta el día 45 postfecundación. El periodo fetal es una etapa en la que aumentan de tamaño los diferentes órganos y sistemas, así como la adaptación del nuevo individuo para su nutrición, por intermedio de la placenta definitiva, extendiéndose hasta el nacimiento (Gaona, 2014). Determinación del sexo cromosómico A inicios del siglo XX, con el descubrimiento de los cromosomas humanos y de otros mamíferos se estableció la importancia de los cromosomas sexuales X e Y, siendo el Y el responsable por la generación de productos del sexo masculino (Palma, 2008). En mamíferos euterianos se determinó que la diferenciación sexual es un proceso secuencial que se inicia con el establecimiento del sexo genético o cromosómico (cromosomal) en el momento de la fecundación (XX o XY). El espermatozoide portador del cromosoma Y determinara la formación de un individuo del sexo masculino y el espermatozoide portador de X uno de sexo femenino. La primera fase de la diferenciación sexual es denominada determinación primaria del sexo y cuando tiene lugar la organogénesis gonadal, en función del sexo genético del embrión, culminando con la formación del fenotipo sexual. Cada etapa de este proceso es 1 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. dependiente de la etapa precedente y, en circunstancias normales, el sexo cromosómico está de acuerdo con el sexo fenotípico (Jost y col., 1973; George y Wilson, 1994). En los mamíferos euterianos, el cromosoma X es grande, representa 5% del genoma haploide y es portador de genes que codifican numerosas funciones específicas. En tanto, el cromosoma Y es uno de los menores cromosomas de la mayoría de los mamíferos euterianos, representa solamente el 2% del complemento haploide y la porción distal está compuesta por secuencias repetidas y no codificantes (Graves y Shetty, 2001). Una teoría que fue muy discutida durante los años 70 y 80 fue que el inductor primario de la diferenciación de los testículos seria el antígeno de histocompatibilidad (H-Y) una proteína de superficie. Actualmente existen evidencias considerables que la relación entre la expresión del antígeno H-Y y el desarrollo de los testículos no es una causa y efecto. Por lo tanto, en mamíferos la determinación del sexo tiene lugar a través del desarrollo de los testículos por la presencia de un gen o genes localizados en el cromosoma Y. En el cromosoma Y se localiza un gen, El gen SRY (del inglés sex-determining region Y), descubierto en 1990, es un gen de determinación sexual en los mamíferos marsupiales y placentarios localizado en el brazo corto del cromosoma Y. Codifica la proteína TDF (testis-determining factor), también conocida como SRY, una de las responsables de que las aproximadamente 4000 células germinales de los órganos genitales del embrión empiecen a formar los testículos. Su ausencia, una mutación que afecte el marco de lectura del gen o una translocación al cromosoma X, generan individuos XX masculinos e individuos XY femeninos (Berta y col., 1990; Wallis y col., 2008; Mittwoc, 1988). Pese a ser un factor determinante, el gen SRY se transcribe solo en el desarrollo embrionario y exclusivamente en células que van a formar los testículos; su expresión desencadena la expresión de muchos otros genes que también intervienen en el proceso y luego se desactiva permanentemente. Probablemente la expresión de SRY no es requerida para el mantenimiento del estado diferenciado. Posiblemente el SRY ejerce su función a través de la activación de varios genes involucrados en el sistema de cascada que conducen a la diferenciación de las gónadas a testículos. Se desconocen aún que genes están involucrados en el proceso de regulación de SRY. Tampoco la interacción con otros factores en su función determinante del sexo no está completamente esclarecida (Veitia y col., 1997). Aun cuando no se ha esclarecido el mecanismo de regulación genética de la determinación gonadal, una manera de aproximarse 2 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. al entendimiento del mismo, es determinar las condiciones bajo las cuales el sexo gonadal puede ser revertido experimentalmente. Una segunda aproximación es identificar aquellas mutaciones, capaces de revertir el sexo gonadal. Estas mutaciones estarían presentes en individuos XX de sexo gonadal masculino y en individuos XY de sexo gonadal femenino. Diferenciación gonadal En el feto el aparato reproductor consta de dos gónadas sexualmente indiferenciadas, dos pares de conductos, un seno urogenital, un tubérculo genita y pliegues vestibulares. Este sistema se origina básicamente de dos bordes germinales en el lado dorsal de la cavidad abdominal, y puede diferenciarse en un aparato masculino o femenino, una condición denominada bisexualidad embrionaria. El sexo del feto depende de mensajes genéticos, gonadogénesis y formación y maduración de órganos reproductivos accesorios. La expresión del sexo genético es un proceso de desarrollo que depende del funcionamiento de las gónadas fetales y, a veces, del funcionamiento de la corteza suprarrenal (Figura N° 1) (Hafez, 1996). 1- La Gónada Indiferenciada La primera manifestación de las gónadas se aprecia en un embrión en forma de un par de eminencias longitudinales llamadas crestas o pliegues gonadales. Situadas a ambos lados de la línea media entre los mesonefros (riñón en desarrollo) y el mesenterio dorsal. En los embriones de los mamíferos, las células genitales primordiales aparecen en etapas muy tempranas del desarrollo. Son células grandes, de citoplasma claro y núcleo grande y redondo, localizadas en la pared del saco vitelino, cerca del alantoides. Estas células tienen gran capacidad de proliferación y van a migrar desde el endodermo del intestino y el epitelio del saco vitelino, a través del mesenterio, hasta las crestas gonadales. Esto ocurre hacia el día 26 de la gestación en el bovino. Su migración se realiza gracias a movimientos de translocación pasiva y desplazamiento amiboideo activo y algunos autores hablan también de una sustancia quimiotáxica positiva, denominada “teleferón”, que colabora con este mecanismo. Se desconoce el mecanismo por el cual estas células son dirigidas hacia las crestas gonadales. Por lo tanto, la gónada primitiva está integrada por dos tipos de tejidos: Una formadas por las células germinales primordiales (precursoras de los gametos masculinos o femeninos), rodeadas 3 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. de células somáticas de las que posteriormente se derivarán las células de Sertoli en el macho y las células de la granulosa en la hembra. El tejido que formará el estroma de la gónada: tejido conectivo, vasos sanguíneos y las células intersticiales con actividad esteroidogénicas (células de Leydig en el testículo y la teca interna del ovario). El epitelio de las crestas gonadales prolifera y junto con el parénquima subyacente se forman varios cordones irregulares denominados cordones sexuales primitivos, que poco a poco rodean a las células sexuales primordiales invasoras. En este momento las gónadas son indiferenciadas y bipotencialmente sexuales. Siendo imposible diferenciar una gónada masculina de una femenina. En esta etapa ya se encuentran presentes las estructuras de las cuales se desarrollan los conductores mesonéfricos o de Wolf y los conductos paramesonéfricos o de Müller (Amaya, 2008). 2- Diferenciación Gonadal La gónada primitiva consta anatómicamente de una médula (interna) y una corteza (externa) y conforme al lugar en donde ocurra la colonización de las células germinales se diferenciará en testículo u ovario, respectivamente. En el testículo las células germinales se localizan en la medula y en el ovario en la corteza. En el macho los cordones sexuales primarios dan origen a los túbulos seminíferos, que contiene el epitelio que producirá los espermatozoides al llegar a la pubertad. En la hembra cordones epiteliales se fragmentan, de tal manera que cada ovocito queda rodeado de células epiteliales cubiertas por una lámina basal delgada. Para que la gónada primitiva se desarrolle en testículo es indispensable la presencia de cromosomas Y, independientemente del número de cromosomas X que contenga el genoma de un individuo. Los genes determinantes de un testículo se encuentran localizados en el cromosoma Y, ya que se ha identificado una proteína de superficie con capacidad de antigénica presente sólo en las células masculinas. El cromosoma X también es importante en la diferenciación gonadal, debido a que en la hembra (cariotipo XX) tiene que ocurrir la inactivación de uno de los cromosomas sexuales X para que se mantenga el equilibrio génico en ambos sexos al igualar el contenido de ADN de los cromosomas. Este cromosoma inactivado constituye el llamado corpúsculo de Barr. Sin embargo, para que la meiosis se efectúe se necesita de los cromosomas X activos en los ovocitos para asegurar la diferenciación ovárica y la fertilidad (Amaya, 2008). . 4 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. 3- Diferenciación de los Conductores Sexuales El embrión posee además de las gónadas indiferenciadas, dos sistemas de conductos, los de potencialidad femenina o conductos de Müller o paramesonéfricos. Si la diferenciación gonadal ha conducido a la formación de un testículo, a partir del conducto mesonéfrico o de Wolff se desarrollaran los conductos eferentes, el epidídimo, los conductores deferentes y las vesículas seminales. Las hormonas importantes en el desarrollo del aparato genital masculino son la testosterona, producida por las células de Leydig y su forma 5œ reducida, la 5œdihidrotestosterona. Se cree que la testosterona sea responsable de la virilización de los conductos de Wolff y la dihidrotestosterona de los órganos genitales externos. En el macho los conductos de Müller se atrofian debido a la acción de una hormona fetal de origen testicular denominada hormona inhibidora de las estructuras de Müller (HIM). La diferenciación de los órganos genitales de la hembra ocurre en forma Pasiva, ya que la ausencia de testículo y por lo mismo de la hormona inhibidora de los conductos de Müller (HIM), así como de los andrógenos virilizantes, favorece el desarrollo de los conductos de Müller, mientras que los de Wolff sufren atrofia. Los conductos de Müller en la hembra forman los oviductos, el útero y la parte craneal de la vagina (Amaya, 2008). . Por lo tanto, dependiendo del sexo gonadal, uno de los sistemas de gonoductos se diferenciará, mientras el otro experimentará una regresión, dando lugar a la formación del tracto reproductor y en consecuencia a la expresión del sexo fenotípico. 1. Gónadas: las gónadas se forman a partir de un grupo de grandes células granulares de saco vitelino que invaden los bordes germinales. En la hembra suceden dos invasiones. La inicial es abortiva, pero la segunda da por resultado la formación de los cordones sexuales, que más tarde se diseminan en sentido ascendente hacia el interior de las células germinales primordiales (oogonios). Los cordones sexuales de la hembra se denominan cordones medulares; los del macho son los túbulos seminíferos. Los testículos se desarrollan 5 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. primordialmente a partir de la médula de la gónada sexualmente indiferenciada, mientras que el ovario surge principalmente de su corteza. 2. Conductos reproductivos: los conductos de Wolff y los de Müller están presentes ambos en el embrión sexualmente indiferenciado. En la hembra, los de Müller se transforman en un sistema gonadoductal y los de Wolff se atrofian; lo opuesto ocurre en el macho. Los conductos de Müller de la hembra se fusionan caudalmente para formar un útero, un cuello uterino y la parte anterior de la vagina. En el feto masculino los andrógenos testiculares influyen en la persistencia y el desarrollo de los conductos de Wolff y la atrofia de los de Müller. 3. Seno urogenital: El seno urogenital da origen al vestíbulo. Los pliegues que rodean el seno forman los labios de la vulva. El falo femenino o clítoris, homólogo del pene masculino, aumenta poco de tamaño. Figura N° 1: Diferenciación gonadal (George y Wilson, 1988). Diferenciación Sexual del Hipotálamo Los procesos de diferenciación sexual no se limitan únicamente a las células somáticas del organismo del feto, sino que incluyen también a los centros nerviosos superiores del cerebro. De la misma manera en que la gónada y los conductos sexuales se desarrollan hacia el tipo femenino o masculino se ha propuesto que el cerebro puede ser “masculinizado” o permanecer “feminizado” La diferenciación del hipotálamo va a depender del ambiente 6 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. esteroidal del neonato y ocurre en la etapa perinatal. Estos eventos serán de gran trascendencia en la vida reproductiva del individuo. Tanto la hembra como el macho nacen con la capacidad de secreción de gonadotropinas de acuerdo con un patrón cíclico, sin embargo, en el macho la exposición del hipotálamo a la acción de los andrógenos testiculares durante los primeros días de la vida extrauterina causa la masculinización, con lo cual el hipotálamo del macho se programa para que la secreción de gonadotropinas, por parte de la hipófisis, se realice a un ritmo relativamente constante (secreción tónica). En la hembra tanto la secreción tónica como clónica, se conservan. La inyección de testosterona o el trasplante de testículo en la rata hembra, durante los primeros días de vida suprimen su futura actividad estral. Por otra parte, si se trasplantan ovarios a la rata macho normal castrada en la edad adulta, el animal no desarrolla ninguna actividad cíclica, pero si los machos trasplantados se castran al nacer, el ovario es capaz de efectuar cambios cíclicos y ovulaciones. Esto ha sido demostrado en roedores, pero no en animales domésticos o en la especie humana. Por lo tanto, el patrón de secreción de gonadotropinas, ya sea cíclico o tónico, no depende de la hipófisis, sino del hipotálamo y su correcta diferenciación (Amaya, 2008). Figura N° 2: Proceso de determinación de sexo (http://www.mun.ca/biology/scarr/4241_Devo_MammalSex.html). en mamíferos 7 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. male: macho Leydig cells: células de Leydig inmature male genitalita: genitales masculinos inmaduros extern sex characteristics: características sexuales externas adult phenotype: fenotipo adulto female: hembra testosterone: testosterona testis: testículos cortex: corteza ovary: ovario MRF: Factor de regresión malheriana (HIM) chromosome with Y genes: cromosoma Y con genes. Freemartinismo en bovinos Durante la fase embrionaria de los rumiantes puede generarse la anomalía conocida como freemartinismo, a partir de la cual se produce una hembra usualmente infértil proveniente de gestación gemelar con un macho. El desarrollo de los órganos reproductivos femeninos se ve suprimido en diferentes grados, dando paso al desarrollo del tracto reproductivo masculino y de un fenotipo generalmente masculinizado (Brace y col., 2008). Los individuos freemartin son el resultado de la anastomosis de los vasos placentarios, que conlleva a una circulación común entre los embriones que permite que la diferenciación sexual del macho, anterior a la de la hembra, interfiera con el desarrollo normal del tracto reproductivo de ésta (Moncaleano y col., 2006). En la presente revisión se resaltan los diversos sucesos que ocurren en la generación de individuos freemartin, los cuales pueden utilizarse para detectar esta anomalía y se relacionan con los diferentes métodos diagnósticos que se utilizan en la actualidad, incluyendo el examen clínico, el análisis citogenético (Peretti y col., 2008), las pruebas serológicas, la hibridación fluorecente in situ (Sohn y col., 2007) y la reacción en cadena de la polimerasa (PCR) (Brace y col., 2008). El término freemartin se aplica a una vaca estéril concebida en una gestación múltiple que involucre individuos de ambos sexos, en la que en más del 92% de los casos se presenta anastomosis vascular placentaria (Figura 3) antes de la diferenciación sexual, entre los 30 y 40 días de gestación, originando un intercambio de células (quimerismo hematopoyético) y sustancias plasmáticas (v. gr. hormonas) que llevan a la hembra a un estado intersexual, en donde los genitales externos son morfológicamente femeninos y los genitales internos presentan un grado de afectación variado, en donde es característica la hipoplasia gonadal, la represión de los conductos de Müller, la masculinización de las gónadas y la estimulación de los conductos de Wolf (Ayala y col., 2007). 8 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. Figura N° 3: Anastomosis placentaria en una gestación gemelar de una hembra y un macho bovino (Wilkes, 1981). Para que se genere freemartinismo en los bovinos son necesarios diversos sucesos. Primero que dos óvulos sean fertilizados generando gemelos dicigotos; segundo, que uno de los embriones sea homogamético (XX) y el otro heterogamético (XY), y por último que se produzca fusión placentaria durante la gestación temprana, llevando a la anastomosis de vasos sanguíneos corio-alantoideos, entre los dos embriones (Hunter, 1995). Esta anastomosis ocurre antes del inicio o durante la diferenciación sexual, permitiendo el intercambio de células sanguíneas precursoras entre los gemelos y generando quimerismo cromosómico, ya que cada gemelo posee células procedentes de cigotos diferentes tanto XX como XY. En este punto la hormona anti-mulleriana (HAM), producida por las gónadas del macho, se transfiere a la hembra. Teniendo en cuenta esta transferencia celular y hormonal, se han generado dos hipótesis para la inhibición del desarrollo normal del conducto de Müller o paramesonéfrico en el tracto reproductivo de la hembra gemela (Hinrichs y col., 1999). La teoría hormonal de Lillie (James y Dove, 1996) demostró la unión del sistema circulatorio entre dos embriones bovinos, postulando que las hormonas procedentes del macho eran las responsables de la inhibición del desarrollo sexual de su hermana gemela. Durante la diferenciación sexual, el tracto genital masculino empieza a desarrollarse en el día 40 de gestación, es decir, más tempranamente que el de la hembra que empieza a diferenciarse hacia el día 60. Este hecho permite que la HAM secretada por las células de Sertoli, desarrolladas en el macho, sea transportada por la circulación común de los gemelos hasta las células mesenquimales localizadas junto al conducto de Müller, en las cuales actúa un gen que se 9 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. expresa como receptor específico de esta hormona, generando regresión del tracto genital femenino. Cabianca y col. (2007) demostraron que las gónadas masculinizadas en las hembras freemartin tienen un papel activo en la producción de la hormona antimuleriana, por lo que el efecto de inhibición del conducto de Müller se da tanto por la HAM procedente del gemelo macho como por la producida por las gónadas de la misma hembra freemartin. Por otra parte, la teoría celular propone que la presencia del quimerismo cromosómico en los animales freemartin demuestra que además de hormonas se intercambian células entre los gemelos dicigotos ( James y Dove 1996). Es así como después de numerosos experimentos (Wachtel y col., 1975 en McFeely 1990, Onho y col. 1976 en McFeely 1990) postuló la hipótesis del origen celular del freemartinismo refiriéndose a la transferencia de células masculinas portadoras del cromosoma Y del macho a su gemela, debido a que en este cromosoma se encuentra el gen Sry (región Y de determinación sexual). Según Cavalieri y Farin (1999) en este cromosoma también se encuentra el gen que codifica al antígeno H-Y (Ag H-Y), el cual actúa como iniciador de la diferenciación testicular; este Ag H-Y fue relacionado con el desarrollo testicular debido a que está presente en machos y en animales freemartin y por el contrario no se encuentra en hembras normales, lo cual sugiere que la formación del tracto genital masculino requiere la presencia del H-Y y el tracto femenino se desarrolla en ausencia de este (McFeely, 1990). Por otra parte se debe tener en cuenta que en la pareja de gemelos no solo la hembra se ve afectada por la anastomosis placentaria, ya que en machos quiméricos se reporta disminución de la fertilidad y una menor concentración y motilidad espermática, las cuales han sido relacionadas con disminución de la actividad de los túbulos seminíferos causada posiblemente por transmisión de la línea de células germinales XX provenientes de su hermana gemela (Rejduch y col., 2000). Diagnóstico de animales freemartin Teniendo en cuenta el efecto adverso que tiene la circulación común entre gemelos de diferente sexo, el diagnóstico de bovinos con quimerismo cromosómico es de especial interés para los productores de leche, debido a que esto permite proceder a la eliminación de los animales estériles o subfértiles (Jiménez, 2000). La identificación de una hembra freemartin se realiza mediante la aplicación de métodos diagnóstico que van desde el examen clínico hasta 10 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. pruebas moleculares de identificación de ADN. En más del 80% de los casos, los animales normales y freemartin pueden ser diferenciados con base en los hallazgos de un examen clínico mediante palpación rectal. Sin embargo la gran variabilidad en la estructura anatómica del tracto reproductivo de las hembras freemartin, que puede ir desde un fenotipo femenino de conformación corporal aparentemente normal, con una vagina ciega o un poco más corta de lo normal, estructuras uterinas y ovarios, hasta acercarse a un fenotipo totalmente masculino con presencia de prepucio primordial, hemipene o testículos (Peretti y col., 2008). Cuando el grado de masculinización es muy extenso, el desarrollo del tejido testicular produce cantidades suficientes de hormona masculina, para generar algunas características secundarias y comportamiento sexual masculino, produciendo hembras que son comúnmente utilizadas para detectar celo (Ayala y col., 2007). Esta variabilidad, que depende del momento de desarrollo embrionario en que se produce la anastomosis vascular, puede hacer que en algunos casos los diagnósticos sean equivocados, ya que pueden encontrarse gemelos heterosexuales que no presentaron anastomosis vascular de placentas y que siendo fértiles se eliminan, con la consecuente pérdida de potencial genético (Jiménez, 2000). El desarrollo de pruebas moleculares como la técnica de Reacción en Cadena de la Polimerasa (PCR) y el uso de secuencias específicas de ADN del cromosoma Y, constituyen un significativo avance en la detección del freemartinismo, en especial cuando se presenta una ternera que tiene pocas células con complemento cromosómico XY, ya que la PCR es un método in vitro altamente sensible que permite producir grandes cantidades (millones o billones) de copias exactas de un fragmento de ADN específico de longitud definida a partir de pequeñas cantidades de ADN. A pesar de que la proporción de células XY sea diferente en cada caso, los métodos moleculares permiten diagnosticar el individuo freemartin. Esta técnica permite detectar la presencia de alelos relacionados con la determinación sexual en el ADN del individuo afectado, ofreciendo una alta confiabilidad, dado que puede detectarse la presencia de una secuencia en una célula afectada dentro de la muestra (Valencia y col., 2005). La incidencia de gemelación en ganado lechero va del 2.5 al 5.8%, con una variación que va desde el 1% en el primer parto, hasta casi el 10% en las gestaciones posteriores. El efecto del número de partos en la tasa de gemelación no se entiende con claridad pero se puede explicar por una habilidad incrementada de vacas mayores para soportar gemelos durante la gestación, un aumento en la tasa de doble ovulación o una interacción de ambos factores. Además, la incidencia de la doble ovulación en las vacas 11 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. lecheras en lactancia es de aproximadamente el 14% (Fricke y vol., 1998). Proporcionar dietas de mayor energía a las vacas de alta producción lechera puede incrementar la incidencia de doble ovulación y por lo tanto la tasa de gemelación (Kinsel y col., 1998). Teniendo en cuenta que en la actualidad el mejoramiento genético animal tiende a una mayor producción láctea sería posible que también aumentaran los casos de partos gemelares y con estos la presentación de freemartinismo. 1. Amaya, JL. 2008. https://jlanderoamaya.files.wordpress.com/2012/06/landero3.pdf. 2. Ayala, MA, D Villagómez, J Galindo, D Sánchez, D Ávila & L Guerrero. 2007. Estudio anatomopatológico, citogenético y molecular del síndrome freemartin en el bovino doméstico (Bos taurus). REDVET. 8 3. Ayala-Valdovinos MA, DAF Villagómez, J GalindoGarcía & D Sánchez-Chiprés. 2008. Diagnóstico molecular (pcr-multiplex) del estado intersexual síndrome freemartin en el bovino doméstico (Bos taurus). Instituto de Biotecnología Animal, Departamento de Producción Animal, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara. 4. Berta P, Hawkins JR, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, Fellous M (1990). «Genetic evidence equating SRY and the testis-determining factor». Nature 348 (6300): 448–50. 5. Brace, MD, O Peters, P Menzies, WA King & MI Nino-Soto. Sex chromosome chimerism and the freemartin syndrome in Rideau Arcott sheep. Cytogenet Genome Res. 120:132-139 Cabianca, G, A Rota, B Cozzi & C Ballarin. 2007. Expression of AMH in female fetal intersex gonads in the bovine. Anat. Histol. Embryol. 36:24-6 6. Cavalieri, J & PW Farin. 1999. Birth of a Holstein freemartin calf co-twinned to a schistosomus reflexus fetus. Theriogenology 52:815-826 Fricke PM, JN Guenther & MC Wiltbank. 1998. Efficacy of decreasing the dose of GnRH used in a protocol for synchronization of ovulation and timed AI in lactating dairy cows. Theriogenology 50:1275-1284. 7. Gaona MG. 2014. http://reproduccionbovina- mgrg.blogspot.com.ar/p/gestacion_5.html 12 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. 8. George FW and JD Wilson (1994) Sex determination and differentiation In: Knobil E and JD Neill The Physiology of Reproduction second Edition Raven Press New York, 3-28 9. Greene WA, HO Dunn & RH Foote. 1977. Sex-chromosome ratios in cattleand their relationship to reproductive development in freemartins. Cytogenet. Cell Genet. 18: 97-105 10. Graves JM and Shetty S (2001) Sex from W to Z: evolution of vertebrate sex chromosomes and sex determining genes J Exp Zoology 290, 449-462 11. Hafez, ESE.1998. Anatomía del aparato reproductor femenino. Reproducción e Inseminación artificial en animales, pp20. 12. Hinrichs K, LC Buoen & G Ruth. 1999. XX/XY chimerism and freemartinism in a female llama co-twin to a male. Scientific Record. 215: 1140- 1141 Hunter RHF. 1995. Sex determination differentiation and intersexuality in placental mammals. Cambridge. University press. James F & FW Dove. 1996. Cattle twins and immune tolerance. Genetics. 144: 855÷859 13. Jiménez, LM. 2000. La citogenética en medicina veterinaria. Universidad Nacional de Colombia, Sede Bogotá, FMVZ, Laboratorio de citogenética. 14. Jiménez LM, & CA Sánchez. 1999. Utilidad de la evaluación citogenética para el diagnóstico temprano del Freemartin. Veterinaria al día. p. 27-29 15. Jost A, Vigier B, Prepin J and JP Perchellet (1973) Studies on sex differentiation in mammals RecentProg Horm Res 29, 1-41 16. Kinsel, ML, WE Marsh, PL Ruegg, WG Etherington 1998. Risk factors for twinning in dairy cows. J. Dairy Sci. 81: 989-993. Long SE. 1990. Development and diagnosis of freemartinism in cattle. In Practice 12:208-210 17. Mc Feely, R. (Ed.) 1990. Advances in Veterinary Science and Comparative Medicine: Domestic Animal Cytogenetics. Advances in Veterinary Medicine. Vol. 34. Academic Press. NY. 18. McNiel EA, NJ Madrill, AE Treeful & LC Buoen, AF Weber. 2006. Comparison of cytogenetics and polymerase chain reaction based detection of the amelogenin gene polymorphism for the diagnosis of freemartinism in cattle. J Vet DiagnInvest. 18:46972. 13 Guía de Trabajos Prácticos Nº 1. Cátedra de Teriogenología. Facultad de Cs Veterinarias. UNNE. 2015. 19. Mittwoch U (1988). «The race to be male». New Scientist 120 (1635): 38–42. 20. Moncaleano, JS, LM Jimenez & CA Sanchez. 2006. Quimerismo leucocitario en hembras bovinas nacidas de parto gemelar heterosexual. Orinoquia 10 N° 2. 21. Moreno, Y, P Piqueres, JL Alonso, A Jiménez, A González & MA Ferrús. 2007. Survival and viability of Helicobacter pylori after inoculation into chlorinated drinking water. Water Res. 41: 3490-3496. Peretti, V, F Ciotola, S Albarella, O Paciello, C Dario, V Barbieri & L. Iannuzzi 2008. XX/XY chimerism in cattle: clinical and cytogenetic studies. Sex Dev. 2: 24-30 22. Palma GA.2008. Selección del sexo en mamíferos. Biotecnología e la Reproducción, pp 415-420. 23. Rejduch, B, E Slota & I Gustavsson. 2000. 60, XY/60, XXchimerism in the germ cell line of mature bulls born in heterosexual twinning. Theriogenology. 54: 621-627 Setiabudi, R. 1993. Application of the polymerase chain reaction (PCR) technique for determination of sex on the cellular level. Licenciate Thesis. Swedish University of Agricultural Sciences. Department of Animal Breeding and Genetics. Sveriges Lantbruksuniv. Uppsala, Sweden 24. Sohn, SH, EJ Choa, WJ Sonc & CY Leeb. 2007. Diagnosis of bovine freemartinism by fluorescence in situ hybridization on interphase nuclei using a bovine Y chromosomespecific DNA probe. PubMed. 68: 1003-1011 25. Valencia, A, J Navarro & E Duque. 2005. Identificación anatómica, citogenética y molecular de un caso de síndrome de Freemartin. Revista lasallista de investigación 2: 45-49 Wilkes PR, WVS Wijeratne & IB Munro. 1981. Reproductive anatomy and Cytogenetics of freemartin heifers. The veterinary record. 108: 349-353 26. Veitia RA, Nunes M, Mcelreavey K and M Fellous (1997) Genetic basis of human sex determination:an overview Theriogenology 47, 83-91 27. Wallis MC, Waters PD, Graves JA (2008). «Sex determination in mammals - Before and after the evolution of SRY». Cell. Mol. Life Sci. 65 (20): 3182–95. 28. Zhang T., Buoen L.C., Seguin B.E., Ruth G.R. & Weber A.F. 1994. Diagnosis of freemartinismo in cattle: The need for clinical and cytogenic evaluation. JAVMA. 204 (10): 1672-1675 14