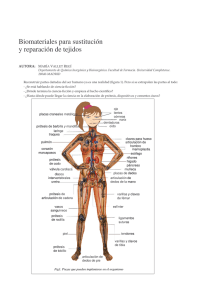
BIOMATERIALES
(NOTAS DE CLASE)
Por:
CLAUDIA PATRICIA GARdA G.
Profesora Asistente
Departamento de Fisico
Faeultad de CienciQ$
Universidad Nacional de Colombia
Sede Medellin
TABLA bE CONTENIDO
Introduccion
3
Definicion
44
Breve resefia historica
4
Aplicaciones actuales de los biomateriares
5",
: Materiales inertes y casi inertes
10
Materiales reabsorbibles
11
Materiales bioactivos
11
Cerdmicas cristalinas casi inertes
12
Cerdmicas porosas .,.
14
, Vidrios bioactivos y vitrocerdmicos
15
,Cerdmicas de Fosfato de calcia
24­
Fosfatos de Calcio reabsorbibfes
" Materiales de jmptant~ con base Carbon . .
Clasificacion de los biomateriales segun la naturaleza de los materiales·
Bibliograffa
24
19
. 27 ..
32
INTROOUcaON
EI tema de los biomateriales ha ido creciendo en interes en los uJtimos tiempos
entre la comunidad academica, sobre todo en aqueHos estudiantes que cursan
las asignaturos de la ifnea de profundizaci6n en Materiales Cerdmicos y
Vftreos.
Esta situaci6n motivo mi deseo de publicar unas notos de clase que compilan
alguna de la bibliograffa consultada POI" mi en la etapa de preparaci6n de este
tema, como uno de los t6picos que se trabajon en la asignatura Ingenierfa
Cerdmica.
Estos ·notas tienen como objetivo principal, ayudar al estudiante a introducir
dentro de 50 formocion el tema de ros biomateriares y a motivarlo a que se
interese por el, sembrando la inquietud ocerco de la gran variedad de
disciplinas que este t6pico involucra y de la gran cantidad de trabajos de.
investigaci6n que es posibJe desarroUar en un drea que a la vez, tiene un atto
contenido socia£, dada la utilidad practica de dichos materiales.
~
Espero que estas notQS sean realmente uti les a los estudiantes que tas
consulten y constituyan una herramienta de trabQjo en presentes y futures
investigaciones que se desarrollan en fa sede.
3
BIOMATERIALES
DEFINICJ:6N
• Un biomaterial es un material sin vida usado en un dispositivo destinado a
interactuar con sistemas biologicos. En esta definicion es necesario definir
tambien biocompatibilidad, que es la capacidad de un material de responder
adecu<ldamente cuando se coloca dentro de una aplicaci6n.
• Materiales del"ivados de productos naturales y sinteticos desarrollados
para sustituir partes del cuerpo humano que POl" alguna razeSn dejaron de
.funcionar. Estos materiales deben trabojar en contacto intimo con tejidos
vivos con un mlnimo de reacciones advers<lS.
,
• Un biomaterial es un material sintetico usado para reemplazar parte de un
sistema vivo 0 para funcionar en intimo contacto con tejido vivo.
• Una sustancia sistematica y farmatologicamente inerte disenada para. la
implantacion () la incorporacion con sistemas vivos.
BREVe REse~A HIST6RICA
EI usa de materiale$ extrano$ como implantes no e.s' nueVO. En 10 era pre
Cristiana, hubo reportes de sustituciones de partes de hueso, dirigidas (1
~ reparar danos muy severos sufridos en el cuerpo. En la mitad del siglo XIX, la
ciencia habla adelantado bastante para reparctr partes del cuerpo humano
usando materiales extranos. Lamentablemente. el estudio de tos materiales
PrQpiamente no se habra desarrollado y se usaran implantes basados en bronce
y cobre, fos cuales obviamente fallaron a causa de la corrosion.
EI usa de los biomateriales no se volvio prdctito hasta la aparicion de las
tecnic(lS de cirugia asceptica, desarrollada par Uster en 1860. Los
. procedimientos de cirugia anteriores a este descubrimiento. involucrara
. biomateriafes 0 no, fueron ,.generalmente infructuosos· a causa de las
infecciones. Los problemas de Jas infecciones tienden a ser mayores en la
presencia de biomateriales, dado que los impfantes proveen una region
i,naccesible pc'lra las celulas del sistema inmunol6gico del cuerpo. Los primeros
implantes exitosos, asr como una gran proporci6n de los modernos fueron en el
sistema esqueletico. Las'platinas de hueso fueron introducidas en los anos
. 1900 para ayudar en fa fijacion de las fracturas. Muchas de e$as primeras
platinas se quebrctban como resultado de un disefio mecanico inapropiado:ellas
fueron demasiado delgadas y tenran esquinas donde Se concentrabdn fos
esfuerzos. Tambh~n se descubri6 que los materiales tales como el ocero al
4
vanadio, los clKlles 5e utilizaban par sus buenas propiedades mecdnicas, se
corrDfan reipidamente en eJ cuerpo. Pronto Se realizaron mejores disePios y se
utilizaron mejores materiales. En 1930 se introdujo el usa de aeeros
inoxidables y aleaciones cromo - cobalto, obteniendo con estos grandes exitos
en lafijacion de fracturas y se realizo ta primera ch'ugfa de reemplazamiento
de articulacion.
En cuanto a Iospolimeros, se descubrio que los pilotos de las aeronaves de la
guerra mundial que fueron heridos par fragmentos de la cubierta pldstica de
Jos aviones (polimetil· metacrilato PMMA), no suf~ieron reocciones crcSnicas
adversas par la presencia de los fragmentos en el cuerpo. EI PMMA se usa
ampliamente despues de fa n guerra mundial para reemplazamiento de c6rnea
y de secciones del hueso del creineo.
Siguiendo los avances en materiates y en tecnicas quinlrgicas, se produjeron,
reemplazamientos de vdlwlas del corazeSn y de articulaciones cementadas en
n
1960.
Aplic"ciones ar;tuales de los biomaterial" .
Hoy en dfa los biomateriales se usan en aplicaciones tales como:
•
•
,
•
•
Vdlwlas cardiacas artificiales:
Son fabric::adas en Carbono, Metal,
Polfmeros 0 a portir de vdfvufas naturales (de cerdo) 0 de otros tejidos
pretratados para reducir Jo.actividad inmunolcSgica. y oumentar la
durabilidad.
'
PrcStesis de cadera: Un reemplazamiento total del hueso de 1a cadera estd
generalmente ligada a dolencias reumatol6gicasy degenerativas que
conllevan un desgaste de la articulacion natural con perdida de la movilidad.
Una protesis de cadera tiene companentes fabricados en varios materiales
que incluyen figas de titanio en aceros inoxidables, cer<imicos, composites y
polietileno de alto peso molecular. La vida media de est:os implantes es de
10 a 15 anos, tendientes a aumentar a20 anos.
Implantes dentales! La implantofogfa oral fue revolucionada con las ligas de
titanio. Los implantes forman una ralz artificial gel diente 10: cual se fija a
una corona. EI titanio implantado debe evitar' la invasion de bacteries a
traves de la saliva y debe garantizar. una unieSn perfecta con el nueso
maxilar 0 mandibular. As! mismo es importante la resistencia al desgaste y
ta corrosion.
L.entes intraocuiares. Este tipo de lentes se usa para sustituir fa lente
natural que se torna turbia con las cotaratas
5
•
Ceramicas cicatrizantes y reconstituyentes de piel obtenidas a partir de
.zeolitas enri'Necidas con Co y Zn
• Dispositivos especiales para suministrar medicamentos como por ejempJo la
quimoterapia que asi tiene to posibiJidad de aplicarse sobre el drea que la
necesita directamente y evita el dano de celuias no afectadas en otras
partes del cuerpo
• Implantes de metales recubiertos por vidrios bioactivos que por un lado
conservan las propiedades mecanicas del metal y par otro lado mejoran la
bioactividad en fa union con el tejido vivo.
Otros ejemplos de los biomateriales pueden observarse en la Tabla 1.
. Tabla 1.
Usos de 10$ biomaterial.
AREA PROBLEMA
EJEMPLOS
Reemplazamiento de partes danadas 0 Articulacion de 141 cadera artificial
enfermas
MaqtJina de dialisis del rinon
sutures, platinas ytornillos en (os
Ayudar ala cicatrizacion "
huesos
Marcapasos . cardiacos, Jentes de
Mejorar funciones
contacto
Corregir funciones anormales
Columna vertebral de Harrington .
Correjir.problemas cosmeticos
Aumento de los senos 0 eadera
Ayudar al diagn6stico
Sondas y eateteres \
Cateteresydrenajes
Ayudar al tratamiento
Dodas las aplieaciones, los biomateriales de~n tener las' siguientes
earacterlsti c(t.S:
• Ser biocompabtibles, 0 sea .que no produzean respuestas t6xicas 0
inmunolagicas adversas (no ser taxico 0 cancerfgeno)
• Inercia y estabilidad qufmicCl biologiea
• Propiedadesmecanicas adecLladas
• Peso y densidad adecuados
• Costo relativamente bajo, ser reproducible y de facil produccion
• Estimular reacciones biologicas favorables en relacion con sus funciones de
uso
y
6
EI .estudio . de los biomateriales requiere necesariamente un trabajo
'.
interdiscipJinario, ya que el desarrollo de un biomaterial incluye varias etapas,
d~de la formulacion de la idea, su implementacion, hasta la sustitucion de una
pieza dada en un paciente. Este desarro1lo requiere de medicos, cientfficos de
materiales, ingenieros, qufmicos de poifmeros, ceramistas, ademds de un
componente empresariat de mercadeo# de derecho,' de verificacion de
cuaJidades, especificaciones normativas. etc.
Una componente importante es la etica, ya que se involucr(ln:
• EI uso· de modelos animales. Requiere justificacion en cadd caso ya que de
,cualquier forma se trata del sacrificio de un ser vivo
• La experimentaci6n en humanos, en la que se deben minimizar los riesgos
para el paciente y establecer una buena relacion riesgo - beneficio
Ningiln material es efectivo para todas las aplicaciones biomateriales. Las
cerdmicas, los vidrios' y los vitrocerdmicos (que son los que se tratardn a
continuacion), se uSan gener(llmente para reemplazar 0 reparar tejidos duros
conectivos muscuJoesqueleficos. su uso depende de lograr una union estable
con el tejido conectivo. Las cercimicas basadas en carbon son tambie.n usadas
para reemplazar vdlwlas cardiacas, donde la resistencia 01 fluido sanguineo y a
Ia fatiga mecdnica son caracteristicas ~enciales
.
,
,
'.
EI mecanismo de union estd intimamante relacionado can el tipc de respuesta
del tejido a la interfase del impJante.
Ningun' material implantado es
completamente inerte. Todos los materiales producen unarespuesta de. los
fejidos vivos. Son posibles cuatro tipos de respuestas, como puede observarse
. en la Tabla 2
Tabla 2.
RespuestQs de los teJidos vivos ante tos imptantes de diferehtes
materiales
CARACTERISTICAS DEL MATERtAL. RESPUESTA DEL. TEJIDO
IMPL.ANTADO
Toxieo
Muerte del tejido alrededor
No toxico, biokSgicamente inactivQ
Forma tejido fibroso de variable
espesor
No taxieo I bioacfivo
forma uniones interfaciales
No toxico, soluble
Material
tejido
que
reemplaza
alrededor
7
Los diferentes tipos de respuestas de fos tejidos vivos, permiten cuatro
diferentes man-eras de fijar las protesis al sistema musculoesqueletico. La
Tabla 3 resume los mecanismos con ejemplos.
Tabla 3. Mecanismos de union de una preSt.sis con el tejido vivo
llPO DE UNI6N
EJEMPLO
Censa, no porosa, casi una union AI~03 (CriS1:al simple y po Ii cristaIi no)
ceramica inerte, pOr crecimiento del LTI (Carb6n isotr6pico de baja
hueso dentro de las irregularidades de temperatura)
la superficie 0 por cementacion del
qispositivo dentro de los tejidos, por
presion adecuada dentro de un defecto
o par la via de uniones cocidas (fijaci6n
morfol6gica)
Para implantes inertes, porosos# AI 20 3 (PoJicristalina)
ocurren intercrecimientos del hueso, Metc:iles
porosos
cubiertos de
los cuales unen meccinicamente el hidroxiopatito
hueso a los materiales (fijacion
biologica)
Densa, ~; parosa, . cerdmicas con Vidrios bioactivos
superficies reactivas, vidrios 'y Vitroceramicas bioactivas
vitrocerdmicos. ligados directamente Hidroxiapatita
par uniones qufmicas con el hueso
(fijacion bioactiva)
Densa, no parosa (0 porosa). Sulfato de calcio
Cerdrnicas reabsorbibles son disenadas Fosfato Tricdlcico
para ser lentamente reemplazadas par Sales de fosfato de calcio
elhueso
La fjgura 1 muestra una comparaci6n de ta actividad (furmica relativa de los
diferentes tipos de biocerdmicas, vidrios y vitroceramicos.
8
1~",t. ~
.. "
! '
1ff!.~f:rt»l;{r~
Figura 1. Velocidades relativas de bioreactividad para hlateriales de implantes
cerdhlicos. A, aiovidrio 4555. a, Ceravital KGS. C, biovidrio 5554. D,
Vitrocerdrnic;o A/W,E, hi~roxiap<ltita. F, CeravitaJ KGX.· G, Nitruro de Silicio
· y Alumina
La reactividad relativa se correfaciona muy de cerCa con ra velocidad de~
formacion de una union interfacial entre el c;erdmico, vidrio 0 vitroceramico con
el hueso, como se ilustra en Jo figura 2.
AJ,c~. Si~t••
, ::o~:---::-~_-!::-_-+---+--~,::---~_--LI--L------l
. " c."
f;
1~
'"
4J!.I
411
t(\O
;!UIJ
'XI
~t~.
la~:,
ll,ttl'l!t"n~jf)l'f lim;,:, -,j;rr~
Figura 2. Tiempb de formacion de union con el hueso para los materiales
mostrados en 10 figura 1
La reactividad relativa se correlaciona muy de cerca con la velocidad de
formation de una uni6n interfacial entre et implante de ceramica, vidrio 0
vitroceramico con el hueso.
·Cuando los biomateriales son casi inertes y la interfase no es unida qufmica 0
biot6gicamente, hay movimiento relativo y'desarrollo progresivo de una cdpsula
fibrosa en tejidos blondos y duros. La presencia de movimiento en 10 interfase
biomaterial - tejido, eventualmente conlleva 01 deterjoro· en la funcion del
·implante 0 en la interfase del tejido 0 ambas. El espesor de 10 capsula no
#
9
r
adherente varra dependiendo tanto del material como de la superficie de
rnovimiento relativo.
Materio.le. incrtu Y CGSi inertes
Se denomina material inerte
casi inerte aquel que no sufre ningun cambio
qUlmico evaluable despues de un tiempo prolongado de' contacto en el medio
biologico. Un ejempfo trpico de este material es fa Alumina.
EI tejido fibroso en ta interfase de los implantes de Alumina densa es muy
delgado. De aquf que si el dispositiv~ de Alumina se implanta can un acceso
~ecanico. muy hermetico y se trabajo principalmente a compresion es exltoso.
Por el contrario, si un implante casi inerte se cargo de tal manera que puede
ocurrir el movimiento intet'focial, la capsula fibrosa se puede vo)ver varios
cientos de micr6metros de delgada y el implante puede perderse muy pronto.
EI concepto detras de materiales microporosos casi inertes es el
intercrecimiento de tejido dentro de pot'os sobre 10. superficie 0 a troves del
implante. EI incremento del area interfacial entre el implante y el tejido
resufta en un incremento de 10. resistencio. inercio.l al movimiento del dispositivo
en el tejido. La interfase se establece par el tejido vivo en los J)C)ros.
Conseeuentemente este metodo de union es frecuentemente denominado
Fijacion biol6gica. Es capaz de resistir estados de esfuerzo mds complejos que
los implontes con fijacion morfo logi ca. La Iimitaci6n aso~ioda con implantes
porosos, sin embargo, es que debido 01 tejido que permanece vivo y saludable es
nece$ario que 'los por~s sean mas grandes que 50 a 150 Ilm. La gran area
interfacial requerida par la porosidad es debido a 10 necesidad de proveer un
suministro de sangre 01 tejido conectivo del intercrecimiento ;en teJidos
vasculares no se presentan por~s menores que 100 (lm de tamana. Si el
micromovimiento ocurre en Ja interfase de un implante paroso, ef tejido se
dana, eJ suminjstro de sangre se interrumpe. el tejido puede morir, pueden
ocurrir inflamaciones y la estabilidad interfacial $e puede destruir. Cuando el
material es un metal un incremento en el area superficial puede proveer un
foco de corrosi6n del implante y una perdrda de iones metdlicos dentro, de los
teJidos. Esto 58 puede soludonar, usondo un material cerdmico bioaetivo tal'
como el hidroxiapatito como una cubierta sobre el material poroso. LC1 fracci6n
de gran pororsidad en algun material tambien degrada el esfuerzo del material
proportional a 10 fraccion de volumen de la porosidad. Consecuentemente, esta
aproximacion para solucionar la estabilidad interfacial es mejor cuQndo se usa
como cubiertas 0 cuando se usa rellenando espacios vados en teJidos.
0
10
Material" NGbsorbibles
Sa considera reabsorbible el material que al ser implantado, se disuelve
.graduafmente en los fJuidos y tejidos corporales.
Son disenados para
degrodar gradual mente en un periodo de tiempo y ser reemplazCldos per el
tejido huesped natural. Esto significa un espesor intefacial muy delgado. Esta
es la soludon optima de los problemas de los biomateriales t si los
requerimientos de esfuerzo y desempeno en el corto tiempo se pueden
alcanzar.
Tejidos naturales se pueden reparar por si mismos y son
gradualmente reemplazados a traves de fa vida. De ahf que los biomateriales
reabsorbibfes se basan en los mismos principios de reparaci6n que han
evolucionado sobre miIlones de aMs. Complicaciones enel desarrollo de
bioeeramicos reabsorbibles son ~
• Mantenimiento del esfuerzo y fa estabilidad de fa interfase durante el
periodo de degradacion y reemplazamiento por el tejido huesped natural
• Igualdad en las velocidades de absorcion y reparacion de los· tejidos del
cuerpo. Algunos materiales se· disuelven demasiado rapidamente y otros
demasiado lentamente.
• Debido a que grandes cantidades de materiaf puede ser reempfazado. as
tambien esencial que un biomaterial reabsorbible consista solo de sustandas
aceptables metabcSlicamente.
Materiales ceramicos de fosfato calcico particulado 0 poroso tales como
Fosfato tricdlcico (TCP) son materiales exitO$OS para reemplazamientos de
tejidos durosreabsorbibles cuando se apliean bajos cargos sobre. e1 material.
Material.. bioactivos
Otra aproximaci6n para resolver problemas de uniones interfaciafes es el usa
de materiales bioactivos. EI concepto de materiaf bioactivo esintermedio
entre reabsorbible y bioinerte. Sa considera material bioactivo, aquelcapaz de
interactuar directamente con el medio biologico, en ausencia de una interfase
. de naturale;z;a djferente Q la del tejido en que es implantada, 0 sea que es aquel
que produce una respuesta biologica especffica en la interfase, la cual resulta
en la formacion de·una union entre los tejidos yel material. Este concepto ha
sido expandido para incluir un gran numero de materiales bioactivos con un
amplio rango de velocidades de union y de espesor de las capas interiaciates de
union. Ellos incluyen vidios bioactivos tales como el Biovidrio, vitrocerdmicos
bioactivos tales como el Ceravital A / W o· vitrocerdmicas maquinables I
hidrOxiapatito denso tal como tal Durapatito 0 Calcitita, 0 compuestos
11
bioactivos tales como Palavital 0 Biovidrios reforzados con fibras de acero.
Todos los materiales bioactivos arriba mencionados forman una union
interfacial con el tejido adyacente. Sin embargo, dependiendo del tiempo de la
union, su resistencia, mecanismo y espesor de la zona de union difiere para
varios materiales.
Relativamente pequenos cambios en la composicion de un biomaterial pueden
.afectar dramaticamente, bien sies bioinerte, reabsorbible 0 bioactivo.
Cercimieas eristalinas casi inertes
AI 20s de alta densidad yalta pureza (>99.5%) se usa en pr6tesis de cadera e
implantes dentales debido a su combinacion de excelente resistenciCl a la
corrosion,' buena compatibilidad, alta resistencia at uso yalta resistencia al
esfuerzo. Aunque algunos implantes dentales son zafiros monocristalinos, let
mayorfa de los instrumentos de Alumina son Alumina policristalina de grano muy
fino producida pOl" presion y sinterizacion a temperaturas entre 1600 y 1700
°e. Una muy pequena cantidad de Magnesia (MgO) se usa como aditivo para
sinterizar y limitar el crecimiento del· grano durante la sinterizacion. La
resistenciCl al esfoerzo, a la fatiga y a la fractura de la (1. Alumina
po Ii cristalina, son funcion del tamano de grana y la pureza. Alumina con un
promedio de tamano de grana menor que 4 jlm y mayor que 99.7 % de pureza,
.exhibe .buena resistencia a 10 presion y a la compresion. Esas· y otras
propiedades ffsicas se resumen en la Tabla 4. Pruebas extendida~ han
mostrado que. los implantes de alumina que satisfacen 0 exceden las normas
ISO tienen excelente resistencia dinamica y a la fatiga del impacto y tambh~n
. resisten el crecimiento de la fractura subcritica. Un incremento eneJ tamaPio
de grano promedio al mcyor a 7 Ilm puede ,. hacer decrecer las propiedades
mecanicas alrededor del un 20 %. Se deben evitar adiciones altas de.·aditivos
de sinterizacion debido a que se retienen en los hordes de fos granos y
degradan la resistencia a la fatiga.
12
Tabla' 4 .Caracterlsticas Flsfcas de bioceramicos de AbOs
CERAMICAS
ALUMINA
Contenidode Alumina %
< 99.8
2
) 3.93
Densidad# g/cm
Tamail'o de grana promedio J.lm. 3-6
Dureza Vickers
2300
Rugosidad de la superfitie 0.02
(Rs), J.lm
Resistencia a la compre.sion 4500 (653)
Mpa (ksi)
Adherencio Mpa (ksi) (despues 550 (80)
de probarlo en solucion de
bE
ALTA STANDARD ISO
6474
:?: 99.50
:?: 3.90
<7
>2000
...
...
400(58)
Rin~r)
Modulo de Young, Gtxl (psi x 380 (55.2)
...
6
10 )
Toughness, fractura
Mpa. m1l2 (ksi in1l2)
(Kic), 5-6 (4.5 - 5.5)
...
j
Existen me-todos para predecir el tiempo de vida y disefios estadfsticos para
probar las cerdmicas que soportan carga. ,Aplicaciones de" esas te~nicas
muestran que los Ifmites de carga de las protests especfficas se pueden fijar
para un dispositivo de alumina en la resistencia a 10 flexion del material y su
. ambiente de uso. Se han predicho tiempos de vida de 30 anos a 12000 N de
cargo. Resultados de estudios de envejecimiento y ,fatiga muestran que es
esencial que los implantes de, alumina sean produddos bajo los mas altos
estdndar,s de garantfa de caUdad, especialmente si ellos se van a usar en
protesis ortopedicas en pacientes jovenes.
La alUmina se ha usado en cirugfa ortopedica por cerca de 20 anos motivado
principalmente par dos facto res :
. • Excelente biocompatibilidad y formacion en cdpsulas muy delgadas! 10 que
permite la fijaci6n con menos cemento de la protesis.
;
• Excepcionalmente bajo coeficiente de fricdon y velocidad de consume:>.
Las excelentes propiedades tribologicas (friccion y consumo) de la alumina solo
se presentan cuando los granos son muy pequeffos «4J.lm) ytienen muy estrecha
distribucion del tamano de grano.
13
Las superficies de Alumina sobre Alumina que soportan carga tales como en las
prottsis de cadera, deben tener un muy alto grada de esfericidad, par .
desgaste y pulida de lasdos superficies acopladas. Una bola y una cuenca de
Alumina en una pr6tesis de cadera son pulidas juntas y usadas como un par. EI
alto coeficiente de friction de una union Alumina - Alumina decrece can el
tiempo y se apraxima 01 valor de una union normal. Esto conlleva a que el
desgaste de superficies de articulbcion de alumina sobre alumina sean urea de
10 veces mas bajas que las superficies metal - palieti lena. (Ver figura 3)
l:~;..,:;:.:::.. . .'.'~~~.;;..,..;..-..;.;.---~~~-~
.
'::",:,6 .
.~.
.
10. .'
Figura 3. Friccion y usa de una union de cadera alumina ­ alumina comparada
con una protesis metal- poliet~leno y una union natural probada in vivo
Otras aplic(lciones clfniCClS de fa alumina incluyen: pr6tesis de rodillas,
tOf'nillos de huesos, codenas alveotares y reconstrucciones maxilafaciales,
, sustitutos de hoosos occiculares, kerataproteis (reemplcuamientos de cornea),
reemplazamientos de huesos segmentales e implantes postdentoles.
4
Ceramieas porosas
La ventaja potencial. ofrecida por un implante de cercimicct porosa es que son
merlOs inertes combinada can la estabilidad mecanica de Ia interface altamente
intercrecida desarrol1ada cuando los huesas crecen dentro de las poros de 14
ceramico. Sin embargo, requerimiento$ meccinicos de las prcitesis restringen
severamente el uso de cercimicas porosas de baja resisfencia a aplicacior,les que
no sopertan cargo. Algunos autores han mostrado que cuando el sometimiento
a carga no es un requerimjentaprimario, cerdmicas porosas casi inertes pueden
proveer un implante funcional. Cuando el tamano de Ips poras excede los 100
J.1ftl, el hueso crecerci dentro de los canales de poros interconectadas cerca ala
50perficie y mantener 50 vascularidad y una viabilidad de larga vida. De esta
14
forma, el implante sirve como un puente estructural y un modele de andamio
para 1« formaci6n de hueso. La microestructura de eiertos corales sirven como
un casi ideal material de investidura para el colado de estructuras con un
tamano de poro altamc:ente controlado. White et ai, desarroU6 un proceso para
duplicar 10 micrestructura porosa de los corales que tienen un alto grado de
uniformidad de paro e'interconexi6n. EI primer paso es maquiJ1ar el coral con la
microestructura apropiada en la forma deseada. ~EI' coral mas apropiado es
Porites, con pOros dentro del range de tamano de 140 a 160 J.lm, can todos los
poros interconectados. Otro coral interesante es 10 Goniopora, con un tamaRo
de poro mds grande, entre 200 y 1000 J.lm. La forma del coral maquinado se
quema para eliminar el C02 de 10 calcita, formando calcia (CO), mientras se
~antiene1a microestructura del cor~1 original. La estructura del CaO sirve
como un material de investidura para former el material poroso. Despues de,
que el material deseado es colado dentro de los poros, la CaO se remueve
fcicilmente del material, disolviendola en Hel dilufdo.
La principal ventaja de este proceso es que el tamaflo de los paros y las
microestructuras son uniformes y controladas y hay complete intercanexi6n
del los poras. Los materiales de reemplazamiento que se han usado para
implantes de huesos son a. Alumina, Dioxido de Titanio, Fosfatos de Calcio,
Poliuretano , 5 iii co Ra, Po Ii metiI metacrHato (PMMA) y aleaciones a base de
cobalto. De estos; los Fosfatos de Calcio son los mcis aceptados.
~ Las superficies de ceramicas porosas tambien pueden ser prepa~das
mezcfando metales solubles 0 partfculas de sal dentro de fa superficie 0 usando
un agente espumante tal como Cae03, et coat involucra gases durante el
. calentamiento. EI tamano def poro y fa estructura se determina por el tamano
y Ja forma de las particulas solubles que son subsecuentemente removidas con
un acido disponible. La capa superficial porosa producida por esta tecnica es
parte integral de la fase cercimica densa subyaciente. L.os materiales poros~s
son mas debiles que las formas densas equivalente en proporcion at porcentaJe.
de porosidad. Ademds en los materiaJes porosos, se expone mayor. area'
superficial~ de ahf que los efectos del ambiente sobre el decrecimiento de la
resistencia se vuelve mucho mas importante en los materiales porosos que en
los densos.
Vidrios bioactivos y vitroceramieos
Ciertas composiciones de vidrios, cercimicos, vitroceramicas y composites se
han usado para unir huesos.Estos materiales seconocen como ceramicas
bioactivas.
Algilnas composiciones de vidrios bioactivos algo mcis
15
especializadas, unirdn tejidos suaves asf como huesos. Una caracteristica de
los vidrios bioactivos es que con el tiempo ocurre.una modificacion cinetica de
fa $uperficie del. implante.. La superficie forma una capa de hidroxiapatita
bioJ6gicamente activa que provee la interfase de union con los tejidos.
.. Los materiales que son bioactivos desarrollan una interfase (ldhesiva can fos
tejidos que resiste fuerzas mecdnicas sustanciales. En muchos casas, fa
resistencia interfacial de adhesion es equivalente 0 mayor que la resistencia
cohe.siva del material del impJnnte 0 del tejido unido 01 implante bioactlvo.
Vidrios: La union de unhueso, inicialmente se demostro con vidrios que
contenfan Sflice (Si0 2), Sodio (NaaO), Catcio y oxido de F6sforo (PzOo). Hubo
tres caracteristicas especiales en esos vidrios que tos distinguen de los vidrios
de sUice, soda y calcio :
• Menos del 60% mol de 5i02.
.'
• A Ito contenido de NaaO y CaO
.­
• Alta relaci6n CaOIPaOfj
ESGS caracteristicas composicionoles hacen 10 superficie altamente reactiva
cuando se expone a un medio acuoso. Muchos vidrios de silice bioactivo$ se
basan en fa formula Hamada "45S5"que significa 45% en peso de Si02 y
relacion molar 5 :1 de CaO /Pa05. Vidrios con relaCiones molares mas bajas de
CaO. PzO!) no unen huesos. Sin embargo, sustituciones en la 44555 de 5 a 15%
en peso de oxido de Boro (Ba03) par Si020 12.5% en peso de fluoruro de <;alcio
(Cafa) por CaD 0 "ceramiandou, las composiciones de varios vidrios bioactivos
.para formar vitraceramicos, no tienen efectos medibles en la habiJidad del
material para formor una union en el hueso. Sin embargo, la adicion de at
menos 3% en peso de AJa03 a la formula 44555 evita uniones.
Vitrocercimicos: Groose et al han mostrado que un rango de vitrocerdmicos
sillceos bioactivos de bajo dlcalis (0-5% en peso Ceravital) tambien une los
huesos. Ellos encuentran que pequenas adiciones de alumina tantaUo, titaniO 0
circonio inhiben fa uni6n del hueso. .Un vitrocerdmico silicofosfatado de dos
fases compuesto de cristales de apatito. (CalO(P04)6(OH,Fz) y wollastonita
(CaOSi02) y una mQtriz vftrea de sflice residual lIamada vitrocerdmico A/W,
tombien se une con el hueso. Adicion de AfzOs 0 TiOz al vitrocerdmico A/W
inhibe unionesde hooso, mientras que la incorporacion de uno segunda fase de
fosfato l B-withlockite (3CaO-P2015) no 10 hace.
Otro
fosfosUicato
biooctivo
muftifase
que
contiene
flogopita
[(NaI K)Mga(AISis010)F2] y cristales de apatito, une huesos aun cuando la Al a03
l
16
: ,-.-.
este presehte en la composicion. Sin embargo, los iones de AI+! se incorporan
dentro ,de la fase cristalina y no altera ta cinetica de la reaccion de la
superficie del material. Composiciones de esos vidrios y vitrocercimicos
bioactivos se comparan en 10 tabla 5.
Superficies cat'acterlsticas de vidrios y vitrocerdmicos bioactivos forman una
peJicula protectora dual rica en CaO y P2 05 sobre la parte superior de una
pelicula rica en Si02 y pobre en dlcalis. Cuando los cationes multivalentes tales
como AI+3 , fe+3 , 0 Tj+4 estcin presentes, en el vidrio 0 'en la solucion, se forman
multiples capas sobre el vidrio cuando se excede cada complejo cationico. Esto.
conlfeva a formacion de una superficie donde no seadhiere tejido.
Unaecuacion . general describe la proporcion compteta del cambio de las
superficies del vidrio y da origeh Cl las proporciones de reaccion interfacial y a
fa dependencia del tiempo de los perfiles de uniones hueso. La proporcion de la
reaccion R depende de al menos 5 termino.s (para lin vidriode una fasesimple).
Para cerdmicas policristalinas, 0 vitroceramicas, los cuales tienen varias fases .
en sus microestructuras, cada fase tendrci una velocidad de reaccion
caracteristica, Rj , la cual debe ser multiplicada tantas veces su ft'accion,areal
expuesta al tejido en orden de describir la cineticQ eompleta de fauni6n:
R
Ecuaci6n 1
=-kitOS - k2tl +k3t l.O+ k4tY + ts
~1
Etapal
Blapa3
Etapa4
Etapa5
EI primer termino describe fa veJocidad de extra~cion del cilcQ~is del vidrio y es
lIamada Etapa 1 de fa reaccion. En esta etapa de ataque inicial 0 primaria es un
proceso que involucra el intercambio ionico entre los iones dtcalis del vidrio y
los jones de hidr6geno de la solucian, durante el cual los constituyentes
remanente5 del vidrio no 5e alteran. Durante ,Ia etapa 1 fa velocidad de
extracci6n del dlcalis del vidrio es de cardcter parab6lico.
La etapa 2 es una disoluci6n de la red interfacial por la eual lasuniones
siloxana~ se rompeh, formando una gran concentraci6n de grupos silanor en la
superficie. La cinetica de la etapa 2 es lineal. Un vidrio reabsorbible
experimenta una combinacion de ataques de la etapa 1 y 2.
17
Tabla 5.
CornpOsici6n y estMJCturcas de vidrios bioc:activos y vitro­
cerGmicos
F
Biovi Biovi
drio
drio
4555. 4055
4F
B5
Biovi Biovi Ceravi Cerdvi
drio
drio
tal
tal
5254. 5584. KGC
KG5
3
6
Ceravi A-W­
tal
GC
KGy21
3
Biovi Biovi
Material drio
drio
4555 4555
I~
MB-GC
lyente
Si02
45
45
45
40
52
55
4602
46
38
34.2
PzO rs
6
6
6
6
6
6
.n
...
16.3
Cao
24.5
12.25 ' 14.7
24.5
21
19.5
-­
19-52
4-24
31
44.9
9-3
...
...
Ca{PO,)z
CaF2
...
...
...
..,
12.25
9.8
...
..,
...
...
MgO
~O
24.5
24.5
~O
...
...
AlzO,
B2O,
...
...
...
...
To~~
24.5
...
...
."
21
2-4.5
19.5
...
,..
...
...
...
...
...
...
5
20.2
22.5
n •
2.9
4.8
0.4­
...
..
33
16
...
5
...
'0'
...
13.5
...
4
...
7
..,
...
0.5
4.6
...
..
,
...
...
...
...
,
5-15
3-5
3-5
12-33
...
6.5
/TiOI
Estructu Vidrio Vidrio Vidrio Vidrio Vidrio
ra
'"
Vitroc Vltroc
erami erdmi
co
co
0"
Vitroc Vitroce
rdmico
e
rdmico
Las etapas 3 y 4 resultan en una superficie del vidrio con una peJfcula
protectiva dUel!.
EI espesor de fas capas secundarias puede
varielr
consideroblemente# desde tan pequenas como 0,01 J.1m para capas ricas en
AI,03 - SiOz sobre vidrios inactivos hasta tan grandes como 30 J,lm para capas
ricas en
P,Oa sobre vidrio bioactivos. La formacion de pellculas dU(lles
se deben a Ia combinacion de lel repolimerizacion de 5i02 sobre to superficie
del vidrio (EtClpa 3) par ta condensacion de los silanoles (Si-OH) formados en
las etapas 1 y 2. Por ejempfo:
Cao ..
Si-OH +OH -Si - t Si
-o-s; +H 0
2
La etapa 3 protege 10 superficie del vidrio. La reacci6n de polimerizaci6n
contribuye 01 enriquecimiento en Si02 en to superficie caracterfstico de
vidrios de unlones de huesos. Esto
se
describe por el tercer termino en la
18
:
,
ecuacion 1. Esta reaccion es control.ada en la interfase con una dependencia
del tiempo de +KJt1.o. EI espesor interfacial de los vidrios mds reactives es
debido a esta reaccion. Et cuarto termino de la ecuaciofl 11 +~tY (etapa 4),
describe laprecipitacion de una pelicula de fosfato de calcio amorfo fa cuat es
caracteristica de vidrios bioactivos. En la etapa 5, la pelicula de fosfato de
calcio amorfo cristaliza para formar cristates de hidroxiapatito. Los iones de
calcio y fosfato en el vidrio 0 vitrocerdmico, provee los sitios de nudeacion
para la cristalizaCi6n. Los aniones de carbonato (C03 2-) se sustituyen par un ~
en la estructura del cristaf de apatito para formar un- apatito hidroxia­
carbonatado (HCA) similar al encontrado en los huesos vivos. La incorporacion
defluoruro de calcio (CaFz) en el vidrio resutta en la incorporaci6n de iones
ffuoruro en el apatito, resultando en un fluorapatito hidroxicarbonatado el coat
iguala el esmarte dental. La cristalizacion de HCA ocurre alrededor de fjbrillas~
de colcigeno presentes en la interfase del implante y resulta en una union
interfacial.
Para que un material sea bioactivo y forme una union interfacial, la cinetica de
la reaccion en 10 ecuacion 1 y especialmente las velocidades de las etapas 4 y 5,
deben equiparar las velocidades biomineralizacion que normarmente ocurren en
vivo. Si las veJocidades en la ecuacion 1 son demasiado rdpidas, ef impfante es
reabsorbible; si las velocidades son demasiado lentas, el implante es no
. bioactivo.
Cambiando la cinetiC(l de la reacci6n composicionalmente controlada (Ecuacion
1), las velocidades de farmaci6n de tejido duro en la interfase de un implante
bioactivo pueden ser· alteradas; de aquf que e[ nivel de bioactividad de un
material to.!ibb se puede relacionar en el tiempopor mas del 50% de la interfase
a .serunida: Indice de bioactividad, I s=(l00/to.!5bb). Es necesario imponer un
criterio de 50% de union para un fndice de bioactividad ya que 10 interfase
entre un implante y e1 hueso es irregurar.La concentraci6n inicial de ceJulas en
ta interase varia en funci6n del vidriado del implante y la condidon del defecto
de uni6n.· Consecuentemente, todos los implantes bioactivos requieren un
periodo de incubacion antes de que el hueso una. Este periodo de incuh<1ci6n
varia en un amplio rango dependiendo de la composieion.
Los implantes bioactivos con valores de Is intermedios no desarrollan una union
de tejido bJando estable; en vez de esto, la interfase fibrosa progresivamente
mineraliza para forman hueso. Consecuentemente, parece haber un Ifmite
aitico cuya bioactividad es restringida para una union de hueso £Stable.
19
Dentro del iimite critico, la bioactividad incluye tanto hueso estabtes como
uniones de tejido suave dependiendo de las celLilas progenitoras en contacto
con el impJante.
.
EI espesor de la zona de union entre un implante bioactivo y el hueso es
proporcional al indice de bioactjvidad lB. La resistencia a la falla de una union
fijada bioactivamente parece ser inversamente proporcional al espesor de la
zona de union. Por ejemplo, el biovidrio 4555 can un Is muy alto desarrollo una
capa gel de union de 200 j.lm de espesor la cual tiene una relativamente baja
resistencia a la cizatla. En contraste, el vitrocercimico A/W, con un Is
intermedio, tiene una interfase de union en el rango de 10 a 20 J.1my una muy
alta resistencia a 1a cizalla.. De aqu.f que la resistencia de la union interfacial
parecer ser optima para valores de Is ~ 4. Sin embargo es importante,
reconocer que el area interfacial para la union depende del tiempo. En
consecuenciCl, la resistencia interfacial es dependiente del tiempo y es una
funcion de factores morfologicos tales como el cambio en el area interfacial
con el tiempo, la mineralizacion progresiva de los tejidos interfaciales y el
incremento re$ultante del mOdulo de elasticidad de la union interfacial asi
como la resistencia a la cizolladura por unidad de area' unida. Una comparacion
del incremento en 10 resistencia de union interfacial de la fijacion bioactiva
se da en la figura 4.
de implantes unidos al hueso con otros tipos de fijaci6n
,
fa
:,"
'
.
tS.t
i
."",,_.­
"--r-
,-...,.
I'
eemem
-.­ .-. r-'-r-'­ '-. to
"~il)ft
I
...
a~
~
....I...
~
V
/""
7
1/
11.­
-­ _\­
....-::: :'~ -- -- --­ '--':f
---­ " ::: --­
.,.,...
-."
·1$ .
D
a
M'''t>/IoOl4>g;C
....
.ial~tII
\
I-­
"
.....
-""'~
$
..
',,:":,., , ...... < :"'1~ ,,'
~,,'
... '
:~
.­
15
It
. , .. )i..,., .....:·-.;,,
21.,;."
2'
.
. . ..
~
Figura 4. Dependencia del tiempo de IQ resistencia de la uni6n interfacial
de varios sistemas de fijacion en e1 hueSo.
20
..
.~"
,
'I
;\
Aplicaciones clfnicas de vidrios bioactivos y yjtrocerdmicos bioactivos se
muestran en la tabla 6. L.os ocho anos de uso exitoso del vitrocerdmico
ceravital en cirugfas del ordo medio es especialmente alentador como son los 4
anos·de usa del vitrocerdmico A/W en cirugravertebral y los 5 a los de usa del
biovidrio 4555 en el mantenil,.tiento de fa dorsal endoseosa.
Ceramicos de Fosfato de calcio
Los biceramicos de base fosfato de calcio, se han usado en medicina y
odontologfa par cerea de 20 anos. Las aplicaciones incluyen implantes dentates,
tratamientos periodontales, aumento del resalto alveolar ortopedia, cirugfa
maxilofacial y otolaringologfa. (Tabla 5). Se usan diferentes fases de
cerdmicos de fosfato de calcio dependiendo si se desean materiates,
reabsorbibles 0 bioactivos.
Tobia 6. Usos actUQle.s de blocercimicos
APUCAcr6N
Aplicaciones ortopedicQ$ que soporton
cargos
Revestimientos para uniones qufmicas
(pr6tesis ortopeedicas, dentales y
f1\O.Xi rares)
Implantes dentales
ApUcaciones otorrinolaringol6gicas
MATERIALES USADOS
AtzOs
HA, vidrios de superficie activo y
vitrocerQmicos
\
AlzO! HA, vidrios de superficie activo
A120S. HA. Vidrios de superficie activo y
vitrocerQl1\icos
Tendones artificiales y ligamentos
Pl.A (Composites fibrosas de AlzOs) Carban
Revestitnientos para intercrecimientos de AtzOs
tejidos
(pr6tesis
cardiovoscukJres
ortopedicos. dentoles y tnaXiiofaciales)
Rellenos temporales de espacios de Sales de fosfato tris6dico l Calcio y
huesos
Fosfato
Reconstrucci6n maxilofacial
AI~3. HAl Composites de HA ... PLA,
Vidrlos de superficie activo.
.
Dispositivos de occeso ~rcutc:ineo
Vitrocercimicos bioactivo$
Disposifivos de fijacion ortopedica
Fibras PL.A-Carb6n, fibra de vidrio de
base PLA - Calcio I fosforoso.
21
/"-
Las fases estables de cercimicos de Fosfato de calcio depende
considerablemente de la temperatura y de la presencia de agua durante el
proceso 0 en el·· ambiente de uso. A fa temperatura del cuerpa, solo dos
fosfatos de calcio son estables en contacto con medios aCIJOSOS, tales como los.
fluidos del cuerpa; a pH < 4,2, la fase estabfe es CaHP04.2HzO (dicalciofosfato
o Brushita), mientas que a pH :.:: 4,,2 la fase estable es CalO(P04)6(OH)2
(hidroxiapatito HA). A temperaturas mds altas, otras fases tales como
CCb(P04)Z (fosfato triccilcico ~, C3P 0 TCP) Y Ca4Pz09 (fosfato tetraccifcico C4P)
estcin presentes. las fases de fosfato de calcio .deshidratadas de alta
temperatura interactuan con agua 0 fluidos del cuerpo a 37°C para formar
hidroxiapatito. EI HA se forma sabre superficies expuestas de TCA par la
siguiente. reaccion
De aqui que la solubilidad de una superficie TCP se aproxima ala solubilidad de
HA y baja el pH de la solucion, la cual ademas incrementa la solubilidad del TCP
y mejora la reabsorcion. La presencia de microporos en Ie material sinterizado
puede incrementar fa solubilidad de esos foses.
I...a. sinterizacion de ce.rcimic(ls de fosfato de calcio usualmente ocurre en el
rango de 1000 a 1500 °C siguiendo la comptlctacion del polva segun ra forma
deseada. Las fases formadas a altas temperaturas dependen no so 10 de la
temperatura sinO tambien de la presion parciQI del agua en la atmosfera de
. sinterizacion. Esto se debe a que con agua presente, HA se puede formar y es
una fase estable par encima de 1360°C. Sin agua, C4P y C3P son las fases
estables. EI rango de temperatura de estabilidad de HA incrementa con la
presion parcial del agua como 10 haee la velocidad de transition de fase de C3P
o C4P aHA. Debido a las barreras cineticas que afectan las velocidades de
formacion de las fases e.stables de fosfato de calcio, esfrecuentemente diffcil
predecir la fraccion de volumen de fases de alta temperatura que se forman
. durante la sinterizacion y su· relativa estabilidad cuando se enfria a
temperatura ambiente.
Comenzando con polvas, se puede hacer mezclando en una solucion acuosa,la
proporcion moJar apropiada de nitrata de calcio y fosfato de amonio, los cuales
pN)ducen un precipitado de HA estequiometrico los iones Cal., pol- y OH"
pueden ser reemplazados par otros iones durante el procesamiento 0 en
22
arnbientes fisiol6gicos;
por ejemplo se puede formar fluorapatito,
CalO(P04~(OH)2~x con O<x<2; apatito ca..bonatado Ca1O(P04~(OH)2~2)«C01)x 0
Cal()..~(P04)6.x!OHlz.x.2y, donde O<x<2 y O<y<l/2x. EI fluorapatito se encuentra
en ef esmalte dental y eJ·apatito hidroxicarbonatado se presenta en los huesos.
EI comportamiento mecanico de Jas cercimicas de fosfato de calcio influencia
fuertemente su aplicacion como impiantes. Las resistencias Q la tension y Q 10
compresi6n y a Io fatiga depet1den del volumen de IQ posrosidad. La porosidad
puede estar en forma de microporos (d Jlm de didmetro, debido a fa
sinterizacion incompleta) 0 macroporos (>100 ~m de dicimetro, creados para
permitir intercreeimiento de hueso). La dependencia de fa resistencia de
compresion O'c y el volumen total de por~ Vp se da en Megapascales:
U
c
=700-~YJ>
Conde Vp esta entre 0 y 0,5. La resistencia Q la tension at, en Megapascales,~
dependeen gran parte de la fraccion de volumen dela microporosldad Vm:
Ut
::::
220-2OVm
El factor Weibull n, de ros implantes de hidroxiapatito es bajo (n=12) en
soluciones fisiologicas, 10 que indica baja fidelidad bajo cargos de tension.
Consecuentemente en practicas clinicas las bioceramicas de fosfato de caJcio
sepodrfan usar como:
o Polvos
o Implantes peqiJenos no sometidos a cartas tales como los del ofdo medio
o Con refuerlos metdlicos puntuales (omo en implantes dentales
0. Como recubrimientos (por ejemplo composites)
0. Como impfantes porosos de baja carga donde et intercrecimiento del hueso
Gctua como uno fase reforzante.
1...0$ mecanism'os de union de los implantes de hidroxiapatito dense {HA)
parecen ser muy direrentes de los descritos arrib<l para vidrios bioactivos.
Una rnatriz de hueso celular de osteoblastia diferenciada aparece en la
superficie, produciendo uno. banda estre<:ha, amona y electro densa de 3 a 5
J,lm de anchor Entre esta drea y las celulas, se han visto bolsas de coklgeno.
CristQles minerales de hueso se han identificado en esta area amorfa. Como el
sitio madura, fa zona de union se encoge hasta una profundidad de solo 0.05 ­
0.2 Jlm. EI resultado tS hueso normal pegado a troves de una capa de union
epitaxial a la mQSa def implante. Los tlndlisis de imdgenes del microscopio
23
electr6nico de transmisi6n (TEM) de las interfases de huesos HA hon mostrado
un alineC\miento epitaxial casi perfecto de ~ristaleS de apatito en el implante.
Una consecuencia de esta zona de union uft...adelgada es un muy alto gradiente
en el modulo de' elasticidad de la int~rfase de union entre e1 HA y el hueso.
Esta es una de las principaJes diferencias entre los apatitos bioactivos y ros
vidrios y vitrocerdmicos bioactivos.
I
Fosfato$ de Coleio reabsorbibles
Let reabsorcian 0 biodegradacion de las cerdmicas de fosfato de calcioes
causada por:
1. Disoluci6n fisicoqu,mcQt la cual depende de fa solubilidad del producto
del material y el pH de su ambiente local
2. La desintegracion fisica en pequefias particulas debido al ataque qufmico
preferencial de los bordes de los granos
3. Factores biolcSgicos, tales como fagocitosis el cual causa un
decrecimiento en concentt'aciones de pH locales
Todas las cerc.imicas de fosfato de calcio biodegradan a velocidades
incrementantes en el siguiente orden TCP > p-TCP»HA. La velocidad de
biodegradacion incrementa wando:
1. Area superficiar incrementa (palvos >s6lido poroso > solido denso)
2. Cristalinidaddecrece
3. La perfeccion del cristal decrece
4. EI tamafio del grano y del cristaf decrece
5. Sustituciones ianicas de C03 2., Mg2+ YSr2i' en HA Se incrementan
Los facto res que tienden Q disminuir la velocidad de biodegradacion incluyen
1. Sustituci6n de F" en HA
2., Sustitucion de Mg2+ en P-TCP
3. Relaciones mds bajas ~- TCP/HA en fosfatos calcicos bifcisicos
Materiales de implantes con base Carbon
...
usan principalmente tres tipos de carbOn en instrumentos biomeditos: L.a
variedad de carMn pirolftico isotropico de baja temperatura (I...TI), carbOn
Se
24
vftreo y la forma de vapor de carbOn depositado de temperatura ultrabaja
isotropico (ULTI)
Estos materiales de carbOn en uso son materiales monolltico.s e integrales
(carbon vltreo y carbon LTI 0 recubrimientos delgados impermeables (ULTI).
Estas tres formas no sufren de fos tfpicos problemas de integracion de los
otros materiaJes de carbon disponibles. Con fa excepcion de los carbones LTI
codepositados can sflice, todos los materiales cUnicos de carbon son carbOn
puro. Se ha anadido mas del 20% en peso de s1lice al carbon LTl sin que
afecte significativamente la biocompatibilidad del material. La composicion,
estructura y fabricacion de los tres carbones clfnicamente relevantes son
unicamente comparables con la forma de carbon mas comun que ocurre
natural mente (grafito) y otras formas industriales producidas de carbono puro.
Formas subcristalinas. Los carbones LTI , ULTI Y los vftreos son formas
$ubcristalinas y repre.sentan un mds bajo grado de perfeccion de cristaJ. No
hay orden entre las capas como en el grQfito natural, de ahf que la estructur'O
cristalina de £sos carbones es bidimensiona1.
EJ rango de densidades de esos carbones es entre 1.4 y 2.1 gl cc. Los carbones
LTI de alta densidad son las forma.s mas resistentes de carbOn y la resistencia
puede ser incrementada por adicion de sflice. El carbOn ULTI puede tambien
ser producido con altos densidades y resistencias, perc es disponible solo como
un recubrimiento delgado (0.1 - 1 J.lm) de carbon puro. El carbon vitreo es
inhet"entemente un material de baja densidad y como tal debil. Su resistencia
no puede ser incrementada Q trQv~ de procesamiento.
Las propiedades mecdnicas de varlos carbones estan intimamente Jigadas Cl sus
microestructuras. En un carbOn isotropico, es posible generar materiales con
mOdulo de elasticidad baJo (20 Gpo 0 2.9Xl04psi) yalta resistencia flexural
(275 a 620 Mpa 0 40 -90 Ksi). Hay muchos beneficios como resultado de esta
combinacion de propiedades. Es posible que soporten grandes tensiones sin
fractura.
Los materiales de carbOn son extremadamente resistentes comparados con
cerdmicos tales como la Qlumina. LQ energfa de fractut"Q par~ carbones LTI es
oproximadamente 5.5. MJ1m3 comparada con 0.18 MJ1m3 para 10 alumina, 0 sea
que el carbon es mas de 25 veces mds resistente.
25
La resistencia a fa fractura para los carbones depositados de vapor es mayor
que 5% siendo posible cubrir materiales poHmericos altamente flexibles tales
como polietileno, poliester y nylon Sin riesgo de fracturar el recubrimiento
cuando se flexiona el sustrato. Por comparaci6n, la resistencia a la fractura de
ta alumina es aproximadamente 0.1 %, apr()ximadamente 1/15 de la de los
carbones UL..TI
Estos materiales de carbOn tienen una extremadamente buena resistencia aJ
desgaste, algo de 10 cual se puede atribuir a su capacidad de sostener grandes
esfuerzos etasticos Jocares bajo Gargas concentradas 0 puntuales sin sufrir
daPios en su superficie.
La resistencia de union del carbon ULTI al acero inoxidable y al TI-6AI-4V .
excede de los 70 Mpa medidos con un probador de adhesion de pelfcuras
delgadas. Ena excelente union es en parte Jlevada a cabo a traves de fa
formacion de carburos interfaciales. EI recubrimiento de carbon UL..TI
generalmente tiene una resistencia a la union mas baja con materiales que no
forman carburos.
Otra caracterlstica Ilnica de los carbones es que e1l0s no se fatigan a
diferencia de los metales, fa resistencia esencial no se desgasta con cargas
dclicas. La resistencia a fa fatjga de esas estructuras de carbon es igua! a la
resistencia a ta fractura de cicio simple. Parece .que a diferencia de otros
solidos cristalinos, esas formas de carbon no contienen defectos moviles los
cuales a temperaturas normales se pueden mover y proveer un mecanismo para
la iniciacion de una fractura de fatiga.
.
La apJicaci6n biomedica mas importante estd en el area cardiovascular, tal
como en valwlas de corazon, fa primera de las cuales se implanto en 1969.
Desde entonces se han producido mas de 600.000 valw/as con componentes de
carbon pirolftico para implantes.
La aplicacion cardiovascular es
particularmente solicitada.
Los primeros intentos fallaron porque los
materiales usados fueron trombogenicos 0 sufrieron de alto grado de fallas cd
uso y mecdnicas. Trombosis, usc, distorsion y biodegradacion han sido
virtualmente eliminados debido a fa biocompatibilidad y durabilidad mecdnica
del carbOn piroliticos, estableciendolo claramente como el material escogido
para valwlas del carazan.
26
I
I
Las superficies del carbon s6n no solo tromboresistentes sino tambh~n
compatibles con los elementos celulares de fa sangre. Los materiales no
afectan las proteinas del plasma 0 alteran la actividad de las enzimas del
plasma. De hecho. una de las explicaciones propuestas para la compatibilidad
de estos materiales con la sangre es que enos absorben las protefnas de la
sangre en superficies sin alterarlas.
DE LOs BIOMATERIALES SEsUN LA NATURALEZA
DE LOS MATERIALES
o CLASIFICACI6N
De acuerdo con la naturaleza de los materiales los biornateriales tam bien
pueden clasificarse en:
1. Cerdmicos
2. Metales
3. Polfmeros
4. Composites
Los biomat.rJales polimericos son ampliamente usados debido a sus enormes
posibilidades. Ellos permiten una amptia variedad de composiciones. son fciciles
de producir bajo diferentes formas geometricas con propiedades bien
deferminadas y tambien pueden ser fabricados como fibras, tejidos, pelfculas 0
bloques.
Los polfmeros pueden ser naturales 0 sinteticos. y en ambos casos es posible
encontrar composiciones bioestables (para usarse en implantes permanentes, 0
para reemplazar parcial 0 totalmente tejidos u organos danados) y
biodegradableS (composiciones adecuadas para reemplazamientos temporales).
Hay muchas aplicaciones de esos productos en los campos de los implantes
quirurgicos, tejidos protectores y sistemas de distribucion de medicamentos.
Un ejemplo importante de mencionar es el cemento oseo acrilico. ampliamente
usado en odontologia y traumatologia debido a su facil manipulacion y rdpida
polimerizacion comparado con ofros cementos. Desafortunodamente, hay
inconvenientes con su uso, gracias a que el calentamiento generado durante la
polimerizacion, frecuentemente produce problemas de citotoxicidad y de
contraccion despues del curado, dando lugar a micromovimientos def implante y
por 10 tanto osteolisis y/o desgaste del cemento. Sin embargo, hoy en dio es
casi irremplazable.
27
1I
1
I
Generalmente hablando, 10$ biomateriales met61ico$ son hechos de pocos
elementos, si se considera que mas de tres cuartas partes de la tabla periodiea
son metales. La primera condicion para su uso en protesis es que elias sean
convenientemente toferados por eJ tejido y por otro parte, que la
concentracion de los metales. (lSI como las especies qufmicas que esten
presentes, puedan ser soportadas por los tejidos vivos. Otra condicion
fu,ndamental es su resistencia a 10 corrosion. La corrosion es un problema
general de los metafes aun mas en on ambiente hostil tal como el cuerpo
humano, (l temperaturas de aproximadamente 37°C. Pero hay metales que
evitan estos problemas, tales como los metales preciosos; otros elementos
tates como el titanio, son capaces de formar una capa pasiva de oxido en su
superficie, protegiendo el interior del metal y previniendo el avance de la
corrosion.
De cualquier forma, ros metales son exitosamente usodos en diferentes
pr6tesis. en particular cuando es neces(lrjo soportar cargas; un ejemplo de
esto es el reemplazamiento de rodilla, donde se usan aJeaciones de Cromo Cobalto y de Titanio. Dejando de lado los problemas que ellos pueden causar,
tales como metaliosis, no hay sustitutos apropiados par(l los metales en los
implantes que sopoMan cargas.
La ventaja principol de 10$ biOft1ateriales uramicos es su baja reactividad
qufmica, siendo generalmente inertes y por 10 tanto biocompotibles. Pero no
todas las biocerdmicas son inertes# y, de hecho, los materiales ceramicos
usados en cirugfa reconstructiva son bioinertes y bioactivas.
Se puede entender 10 que es un material bioactivo, de acuerdo a 10 siguiente
definicion: "Un material bioactivo permite una respuesta biologica en su
interfase, posibilitando la formacion de un vinculo entre el tejido y el
material". Desde el descubrihliento hecho por Hench, del BIOGLASS, sa han
desarrollado varios tipos de vidrios, vitrocercimicos y ceramicos bioactivos.
Hay tres posibles resultados de fa interaccion hueso - material implantado:
1. Si el material es inerte 0 cas; inerte, se forma una capsula fibrosa
alrededor del implante
2. Si el material es bioactivo, se forma nuevo hueso
3. Si el material es degradable, se reabsorbe
28
Para que un implante sea clfnicamente exitoso, es necesario obtener
simultaneamente
1. Una interfase estable con el t~jido conector
2. Un comportamiento mecdnico similar al del tejido reempJazante
Las cercimicas bioinertes tienen muy poca
ninguna influencia en tos tejidos
circundantes. Sin embargo, no existen los biomateriales totalmente inertes;
IJOr 10 que resulta mas adecuado definirlos como casi inertes. EI mejor eje.mplo
de esto es la Alumina u.
0
Por otra parte, las cercimicas bioactivas 0 cercirnicas reactivas son capaces de
unirse con at tejido vivo. Esta tambh~n parece ser una caracterfsticas de
algunos vidrios y vitro-cerdmicos, y de la hidroxiapatita.
Las bioceramicas fueron introducidas en los anos 70 cuando se presentaron
fallas Severas con los biomateriales usados hasta ese entonces tales como el
aooro inoxidable, las aleaciones de titanio y el poJimetifmecatifato. La razdn
estas faUas fue, ademas de otras razones, el encapsulamiento de e$os
materiales. Era obvio que Se necesitaba buscar una mejor osteointegracion y
para elto se usaron inicialmente los materiales cerdmicos. Su fragilidad
restringe el campo de su aplicacion, teniendose que usar solo en aplicaciones
con bajas especificaciones meccinicas. Las exceptiones de esta son la Alumina
y 10 Circona, usada en reemplazamientos de cadero.
Las biocerdm;cas podrian ser los biomateriales ideales dado que su
biocompatibilidad y oseointegracion son buenos, ademas son los materiales
cuyos componentes son los mcis similares a los componentes del hueso. Cuando
hay algun dana en el sistema esquelitico, hay dos posibilidades de action:
Reemplazar la parte dafiada 0 sustituirla por un material que jnduzca la
regeneracidn del hueso. Pero general mente hablando, se puede establecer que
el uso de pratesis artificiales estci causando problemas hoy en dia debido a la
diferencia en el requerimiento meccinico entre el hueso artificial y el natural,
provocando fracruras, y t(lmbh~n debido a la presencia de iones provenientes
del hueso artificial el cual puede ser tdxico 0 perjudicial y puede causar dano.
Es imposible re.generar hueso natural de esta forma. EI hueso artificial es
hecho basicamente de metales, alumina, circonia, etc., todos ellos
biomateriaJes bioinertes, 0 por 10 menos biotolerados, pero no todos bioactivos.
Esta situaci6n general permite anticipar un muy importante campo de
29
i .
I
1
investigacion, apuntando a la prepraracion de biocerdmicas basadas en fosfato
de calcio con buenos requerimientos mecdnicos. En este sentido serra
necesario reforzar Jas biocercimicas ya conocidas, por ejempto, la sfntesis de
biocomposites que mejoren las propiedades rneccinicas de las cercimicas y
ahondar en el conocimientos del mecanismo de'fa formacion del hueso natural,
apuntando hacia las condiciones de slntesis que permitirfan obtener
biomateriales compuestos organicos - inorgcinicos en el'aboratorio, alcanzando
buenos propiedades mecanicas.
La meta final de la comunidad cientffica trabajando en este campo es obtener
hueso artificial equivalente al hueso natural. Mientras esta meta se logra, se
pueden cumplir objetivos menos ambiciosos tales como entender bien los
mecanismos y buscar metodos adecuados de slntesis.
Se puede decir, de manera general, que el cuerpo humane estci principalmente
formado por tres componentes: Agua, colageno e hidroxiapatita. La ultima,
que es el mineral que compone los huesos, constituye aproximadamente el 5%
del peso total del cuerpo y juega un popel importante en el almacenamiento del
calcio, controlando la perdida y ganancia de este elemento. EI hueso natural es
un nanocomposite compuesto de apatita hidroxicarbonatada (80% aprox.). De
hecho, la hidroxiapatita biologica muestra algunas caracterfsticas distintivas
La
de 10. hidroxiapatita sintetizada estequiometrica, tales como:
hidroxiapatita
biol6gica, tiene tamano de cristal pequeno, gran area
en la red cristalina,
superficial, composicion no estequiometrica,
desorden en la estructura interna cristalina, ademcis tiene una retacion CalP <
1.667 Y la sintetizada tiene una relacion Ca/P =1.667
col-
Otro punto importante de mencionar en este campo de las bioceramicas es el
desarrollo de cementos para huesos basados en fosfatos de calcio. En estos, a
pesar de que se ha avanzado bastante, todavfa quedan problemas por solucionar
en el tiempo de curado, en la resistencia, etc.
Dejando de lado los bioceramicos basados en fosfatos de calcio, no podemos
olvidar una nueva cerdmica basada en Titanio. Kokubo ha desarrollado una
capa de titanio convenientemente tratado con hidrOxidos alcalinos, sobre
metales. Despues de un adecuado tratamiento termico, se forma una capa
estable de titanato. Los estudios in vitro e in vivo parecen indicar que los iones
alcalinos de la capa superficiat son sustituidos por iones OH- del fluido dando
I
30
lugar a la formaci6n de "Titanio hidratadoflen la superficie del metat 10 que
parece ayudar a fa nuleacion de apatita, la cual crece debido a la
supersaturaci6n del fluido. Aunque ~ste puede ser considerado un metal
bioactivo este titanio hidrafado es un componenete cerdmico. De cualquier
forma, muestra una alta resistencia a la fractura, y su modulo de elasticidad es
tambiel1 alto.
I
Otro grupo importante· de biomateriales 10 constituyen los materiales
biomagneticos, donde se incluyen muchos metales y ceramicos.
31
BIBLIOGRAFIA
1. Ortegas B. A' dos Sclntos, L.A. Simposio sobre a Ciencia e Engenheria de
Matriais no Mercosuf. 5 a 8 de outubro de 1998. Universidade Federal de
Sao Carlos. Cu..so V: Biomateriais. 1998
2. RavagHoli A'I Krajewski, A.
Bioceramics:
Materials, Properties,
Applications. Ed Chapm<ln and Hall. Great Britain. 1992
3. Hoffman, Schoen, l.emons. Biomate.rials science. Academic Press. San
Diego, California. 1996
4. Park, J., Lakes, R. Biomaterials an introduction. Second edition. Plenum
Press. New York and l.ondon. 1993
5. Hench, LL, Ethridge, E.C. Biomaterials an interfacial approach. Academic
Press. New York and London. 1982
I
32