- Ninguna Categoria
Citoplasma y Citoesqueleto: Funciones y Componentes Celulares
Anuncio
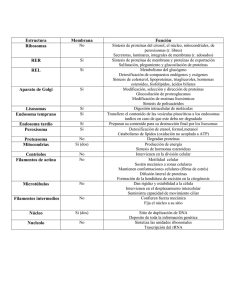
Citoplasma Función del citoplasma. El citoplasma es una dispersión coloidal, un fluido granuloso, que se encuentra en el interior de la célula, entre el núcleo celular y la membrana plasmática. ... Por ello, en el citoplasma se llevan a cabo diversas e importantes reacciones moleculares para el funcionamiento de la célula Su función es albergar los orgánulos celulares y contribuir al movimiento de estos. El citosol es la sede de muchos de los procesos metabólicos que se dan en las células. El citoplasma se divide en ocasiones en una región externa gelatinosa, cercana a la membrana, e implicada en el movimiento celular, que se denomina ectoplasma; y una parte interna más fluida que recibe el nombre de endoplasma y donde se encuentran la mayoría de los orgánulos.4 El citoplasma se encuentra en las células procariotas así como en las eucariotas y en él se encuentran varios nutrientes que lograron atravesar la membrana plasmática, llegando de esta forma a los orgánulos de la célula. Citoesqueleto El citoesqueleto es una estructura celular compuesta por filamentos. Se encuentra dispersa por el citoplasma y su función es principalmente de sostén, para mantener la arquitectura y forma celular. Estructuralmente se compone de tres tipos de fibras Funciones Dar forma Como su nombre lo indica, la función “intuitiva” del citoesqueleto es proporcionar estabilidad y forma a la célula. Cuando los filamentos se combinan en esta red intrincada, le otorga a la célula la propiedad de resistir a la deformación. Sin esta estructura, la célula no sería capaz de mantener una forma específica. No obstante, es una estructura dinámica (contrariamente al esqueleto humano) que le otorga la propiedad a las células de cambiar de forma. Movimiento y uniones celulares Muchos de los componentes celulares están unidos a esta red de fibras dispersas en el citoplasma, contribuyendo al arreglo espacial de los mismos. Una célula no se parece a un caldo con distintos elementos flotando a la deriva; tampoco es un ente estático. Al contrario, es una matriz organizada con los orgánulos ubicados en zonas específicas, y este proceso ocurre gracias al citoesqueleto. El citoesqueleto está involucrado en el movimiento. Esto ocurre gracias a las proteínas motoras. Estos dos elementos se combinan y permiten los desplazamientos dentro de la célula.También participa en el proceso de fagocitosis (proceso en el que una célula captura del medio externo una partícula, que puede o no ser alimento). El citoesqueleto permite conectar a la célula con su medio exterior, física y bioquímicamente. Este papel de conector es el que permite la formación de tejidos y uniones celulares. Filamentos de actina Los filamentos de actina poseen un diámetro de 7 nm. También son conocidos como microfilamentos. Los monómeros que constituyen los filamentos son partículas en forma de globo. Aunque son estructuras lineales, no tienen forma de “barra”: giran en su eje y recuerdan a una hélice. Están unidas a una serie de proteínas específicas que regulan su comportamiento (organización, localización, longitud). Existen más de 150 proteínas capaces de interactuar con la actina. Los extremos se pueden diferenciar; uno se denomina más (+) y el otro menos (–). Por estos extremos, el filamento puede crecer o acortarse. La polimerización es notablemente más rápida en el extremo más; para que ocurra la polimerización, se requiere ATP. La actina también puede estar como un monómero y encontrarse libre en el citosol. Estos monómeros se encuentran unidos a proteínas que impiden su polimerización. Funciones de los filamentos de actina Los filamentos de actina poseen un papel relacionado con el movimiento celular. Permiten que distintos tipos celulares, tanto de organismos unicelulares como de pluricelulares (un ejemplo son las células del sistema inmune), se desplacen en sus ambientes. La actina es bastante conocida por su papel en la contracción muscular. Junto con la miosina se agrupan en los sarcómeros. Ambas estructuras hacen posible dicho movimiento dependiente de ATP. Filamentos intermedios El diámetro aproximado de estos filamentos es de 10 µm; de allí el nombre “intermedio”. Su diámetro es intermedio con respecto a los otros dos componentes del citoesqueleto. Cada filamento se estructura de la siguiente manera: una cabeza con forma de globo en el N terminal y una cola con forma similar en el carbono terminal. Estos extremos se conectan entre sí por una estructura lineal formada de hélices alfa. Estas “cuerdas” presentan cabezas globulares que tienen la propiedad de enrollarse con otros filamentos intermedios, creando elementos entrelazados más gruesos. Los filamentos intermedios se ubican en todo el citoplasma celular. Se extienden hasta la membrana y a menudo están unidos a esta. Estos filamentos también se encuentran en el núcleo, formando una estructura llamada “lámina nuclear”. Este grupo se clasifica a su vez en subgrupos de filamentos intermedios: – Filamentos de queratina. – Filamentos de vimentina. – Neurofilamentos. – Láminas nucleares. Función de los filamentos intermedios Son elementos sumamente fuertes y resistentes. De hecho, si los comparamos con los otros dos filamentos (actina y microtúbulos), los filamentos intermedios ganan en estabilidad. Gracias a esta propiedad, su función principal es mecánica, resistiendo los cambios celulares. Se encuentran abundantemente en tipos celulares que experimentan constante estrés mecánico; por ejemplo, en células nerviosas, epiteliales y musculares. A diferencia de los otros dos componentes del citoesqueleto, los filamentos intermedios no pueden ensamblarse y deshacerse por sus extremos polares. Son estructuras rígidas (para poder cumplir con su función: el soporte celular y respuesta mecánica al estrés) y el ensamblaje de los filamentos es un proceso dependiente de fosforilación. Los filamentos intermedios forman estructuras llamadas desmosomas. Junto con una serie de proteínas (cadherinas), se crean estos complejos que forman las uniones entre células. Microtúbulos Los microtúbulos son elementos huecos. Son los filamentos más grandes que constituyen al citoesqueleto. El diámetro de los microtúbulos en su parte interna ronda los 25 nm. La longitud es bastante variable, dentro del rango de 200 nm hasta 25 µm. Estos filamentos son indispensables en todas las células eucariotas. Emergen (o nacen) de pequeñas estructuras llamadas centrosomas, y de allí se extienden a los bordes de la célula, en contraste con los filamentos intermedios, que se extienden por toda el ambiente celular. Los microtúbulos están constituidos por proteínas llamadas tubulinas. La tubulina es un dímero formado por dos subunidades: la α-tubulina y la β-tubulina. Estas dos monómeros se unen por medio de enlaces no covalentes. Una de sus características más relevantes es la capacidad de crecer y acortarse, siendo estructuras bastante dinámicas, al igual que en los filamentos de actina. Los dos extremos de los microtúbulos se pueden diferenciar entre sí. Por ello se dice que en estos filamentos existe una “polaridad”. En cada uno de los extremos —denominados más p positivo y menos o negativo— ocurre el proceso de autoensamblaje. Este proceso de ensamble y degradación del filamento da lugar a un fenómeno de “inestabilidad dinámica”. Función de los microtúbulos Los microtúbulos pueden formar estructuras muy diversas. Participan en los procesos de división celular, formando el huso mitótico. Este proceso ayuda a que cada célula hija cuente con un número igual de cromosomas. También forman los apéndices con forma de látigo usados para la movilidad celular, como cilios y flagelos. Los microtúbulos sirven como vías o “carreteras” en las que se desplazan distintas proteínas que poseen función de transporte. Estas proteínas se clasifican en dos familias: las kinesinas y las dineinas. Pueden recorrer largas distancias dentro de la célula. El transporte en distancias cortas generalmente es realizado sobre actina. Estas proteínas son los “peatones” de las carreteras formadas por microtúbulos. Su movimiento se asemeja bastante a una caminata sobre el microtúbulo. El transporte involucra movimiento de distintos tipos de elementos o productos, como por ejemplo vesículas. En las células nerviosas este proceso es bastante conocido porque los neurotransmisores son liberados en vesículas. Los microtúbulos también participan en la movilización de organelas. Particularmente, el aparato de Golgi y el retículo endosplasmático dependen de estos filamentos para tomar su posición adecuada. En ausencia de microtúbulos (en células mutadas experimentalmente), estas organelas cambian notablemente su posición. Otras implicaciones del citoesqueleto En bacterias En las secciones anteriores se describió el citoesqueleto de los eucariotas. Los procariotas también poseen una estructura similar y tienen componentes análogos a las tres fibras que componen el citoesqueleto tradicional. A estos filamentos se le añade uno propio perteneciente a las bacterias: el grupo MinD-ParA. Las funciones del citoesqueleto en bacterias son bastante similares a las funciones que cumplen en los eucariotas: sostén, división celular, mantenimiento de la forma celular, entre otras. En el cáncer Clínicamente, los componentes del citoesqueleto se han asociado con el cáncer. Ya que intervienen en los procesos de división, se consideran “blancos” para poder entender y a tacar al desarrollo celular descontrolado. SISTEMA DE ENDOMEMBRANAS INTRODUCCIÓN Una de las características distintivas de las células eucariotas respecto de las procariotas es su alto grado de compartimentalización. La presencia de un núcleo bien diferenciado, con una envoltura nuclear que confina el material genético al interior del núcleo, es sólo un aspecto de la separación espacial de funciones dentro de la organización celular. El citoplasma, a su vez, se encuentra recorrido en todas direcciones por un sistema de sacos y túbulos, cuyas paredes de membrana ofician de límite entre la matriz citoplasmática y la luz o cavidad del sistema. Este conjunto de estructuras membranosas, incluida la envoltura nuclear, se conoce como sistema de endomembranas (SE) o sistema vacuolar citoplasmático (SVC). COMPONENTES DEL SISTEMA DE ENDOMEMBRANAS Dentro del sistema de endomembranas se distinguen los siguientes elementos: a) Retículo endoplasmático granular o rugoso (REG o RER). Es un grupo de cisternas aplanadas que se conectan entre sí mediante túbulos. Presente en todos los tipos celulares, se halla especialmente desarrollado en las células secretoras de proteínas. El REG ofrece una cara citosólica tachonada de ribosomas, a los que debe su aspecto rugoso. Los ribosomas se unen a las membranas del REG por su subunidad mayor, mediante receptores específicos, las proteínas integrales de las membranas cisternales conocidas como riboforinas. b) Retículo endoplasmático agranular o liso (REA o REL). Su aspecto es más tubular y carece de ribosomas. Es poco conspicuo en la mayoría de las células, pero alcanza un notable desarrollo en las células secretoras de hormonas esteroides. c) Aparato o complejo de Golgi. Constituido por sacos discoidales apilados, como mínimo en número de tres, rodeados por pequeñas vesículas. Cada saco presenta una cara convexa y otra cóncava, esta última orientada hacia la superficie celular. En las células animales se ubica típicamente entre el núcleo y el polo secretor de la célula, en tanto en las células vegetales aparece fragmentado en varios complejos denominados dictiosomas o golgiosomas. d) Envoltura nuclear. Doble membrana que encierra una cavidad, la cisterna perinuclear, en directa continuidad con la luz del REG, del cual se considera una dependencia. Al igual que éste, presenta ribosomas sobre la cara citosólica. Durante la división celular se desorganiza y se fragmenta en cisternas que se incorporan al REG. Al finalizar la división, la envoltura nuclear se reconstituye a partir de aquél. Fig. 5.1 - El sistema de endomembranas FUNCIONES DEL SISTEMA DE ENDOMEMBRANAS El sistema de endomembranas es asiento de enzimas que participan en la síntesis de diversos tipos de macromoléculas: proteínas y glucoproteínas en el REG, lípidos en el REL y glúcidos complejos en el aparato de Golgi. A la vez, el SVC proporciona una vía intracelular para la circulación de sus productos y una sección de “empaque” para la exportación de algunos de ellos. Por último, maneja un sistema de señales que le permite dar a los mismos el destino final para el cual fueron sintetizados, ya sea en el interior de la célula o en el medio extracelular. Algo así como un “estampillado”, un sistema de códigos postales que guía a las moléculas en la dirección correcta. La vía de tránsito intracelular implica un transporte desde el RE hasta el aparato de Golgi; a partir de éste hay dos caminos posibles: hacia las vesículas de secreción y desde allí a la membrana plasmática, o bien hacia los lisosomas. Fig. 5.2 - Vías de tránsito intracelular en el SE El transporte vesicular El transporte en el SVC se lleva a cabo por medio de vesículas, pequeñas bolsas limitadas por membrana que se desprenden como brotes de un compartimento dador y viajan por el citosol hasta alcanzar el compartimento receptor; entonces se fusionan a este último.Hay varios aspectos que interesa destacar con respecto al transporte vesicular: Fig. 5.3- Transporte vesicular ¿Qué transportan las vesículas? Cada vesícula tiene un continente (la membrana) y un contenido (su naturaleza dependerá de cuál sea el compartimento dador); ambos se desplazan de un compartimento a otro. Cuando se produce la fusión al compartimento receptor, el contenido de la vesícula se vuelca al lumen del mismo. La membrana vesicular, por su parte, se incorpora a la membrana receptora. Si la estructura diana es la membrana plasmática, entonces el contenido es vertido al medio. ¿Qué mueve a las vesículas? En su trayecto de una cisterna a otra, las vesículas son movidas por elementos del citoesqueleto. Fig. 5.4- Vesículas revestidas ¿Qué causa la brotación? Las vesículas que participan en el transporte, cualquiera sea el compartimento de origen, son vesículas revestidas. Se entiende por tales a las vesículas que llevan una cubierta formada por subunidades proteicas ensambladas a modo de enrejado sobre la cara externa de la membrana vesicular. Dicho revestimiento es adquirido en el momento en que se produce la gemación o protrusión de la vesícula y es su misma causa: a medida que las subunidades se ensamblan generan la curvatura de la membrana que da origen al brote. El revestimiento se desensambla inmediatamente después de la brotación; este paso es necesario, pues mientras las vesículas se hallan revestidas no pueden fusionarse con otra membrana. ¿Cómo reconocen las vesículas al compartimento receptor? Las membranas de las cisternas poseen pares de moléculas complementarias: v-SNARE (en la vesícula de transporte) y t-SNARE (en la cisterna destino o target). La fusión de una vesícula con una cisterna sólo se produce previo reconocimiento del par v-SNARE /t-SNARE adecuado. Fig. 5.5 - Reconocimiento del compartimento receptor: v-SNARE = vesicle-SNAP receptor, t-SNARE = target-SNAP receptor ¿Cómo se mantiene constante la cantidad de membrana en cada compartimento? Las membranas vesiculares incorporadas a un compartimento receptor forman un nuevo brote (causado por proteínas de revestimiento) y se desprenden para regresar al compartimento de origen, como vesículas de reciclaje. El compartimento de origen, obviamente, ha de poseer las mismas t-SNARE que la cisterna receptora. El reciclaje no sólo permite mantener constante la cantidad de membrana de los distintos sectores del sistema, también hace posible que cada uno de ellos conserve su identidad, recuperando las moléculas que le son propias y le otorgan sus funciones particulares. Fig. 5.6- Reciclaje de membrana ¿Puede la membrana transportada permanecer como componente del compartimento receptor? Sí. De hecho, éste es el mecanismo por el cual las cisternas y la membrana plasmática incorporan nuevos componentes y crecen. ¿Cómo se corresponden las caras del sistema de endomembranas con las caras de la membrana celular? Como consecuencia del tránsito vesicular, las moléculas de membrana sintetizadas en el RE (liso y rugoso) o en el aparato de Golgi, llegan a integrarse a la membrana celular. Sabemos, por otra parte, que la membrana plasmática es asimétrica: los componentes lipídicos de ambas monocapas – la citosólica y la extracelular – son diferentes, los dominios proteicos tienen una orientación definida dentro de la bicapa y los restos glucídicos de glucolípidos y glucoproteínas sólo se orientan hacia el medio extracelular. ¿Dónde se genera esta asimetría? Se genera en los compartimientos de origen, donde los componentes de membrana adoptan su orientación definitiva; luego, el transporte vesicular se limita a mantener dicha orientación. De esta forma, todo aquello que tiene una posición luminal en el sistema de endomembranas, pasa a una ubicación extracelular en la membrana celular, en tanto que los componentes de la cara citosólica del sistema se integran a la cara citosólica de la membrana celular. Fig. 5.7- Asimetría de las membranas. Correspondencia entre el SE y la membrana plasmática. VESÍCULAS REVESTIDAS Se conocen hasta el momento dos tipos de vesículas revestidas: las vesículas con revestimiento de clatrina y las vesículas con revestimiento de coatómero. El revestimiento de clatrina se ensambla a partir de subunidades constituidas por seis cadenas proteicas enlazadas, los trisqueliones, que forman alrededor de la vesícula un enrejado donde alternan hexágonos y pentágonos, con el aspecto de una cúpula geodésica. Llevan cubierta de clatrina las vesículas que brotan del aparato de Golgi hacia los lisosomas, las vesículas de secreción regulada y las formadas por endocitosis. El revestimiento de coatómero se forma a partir de las COP (por proteínas del coatómero). Está presente en las vesículas que viajan del RE al aparato de Golgi, las que realizan transporte dentro de este complejo, las destinadas a la secreción continua y en todas las vesículas recicladoras. Tanto la cubierta de clatrina como la de coatómero se unen a membrana sólo después de que otra molécula, el ARF (factor de ribosilación del ADP) se haya fijado a la misma. El revestimiento promueve la deformación de la membrana y la gemación de la vesícula, en tanto que el ARF le señala dónde y cuándo hacerlo. Si la cubierta sólo es importante para la gemación -proceso que es básicamente el mismo en cada orgánulo- ¿por qué necesita diversos tipos de cubierta la célula? La razón más probable es que la cubierta seleccione la carga que ha de empacarse en cada vesícula. En algunos casos, las proteínas transportadas se localizan en la membrana, directamente unidas a la cubierta. En otros, la carga se fija a la cubierta a través de un intermediario, un receptor, localizado en el espesor de la membrana. El uso de cubiertas distintas posibilitaría el flete de cargas diferentes desde un mismo punto de origen y desde diferentes departamentos. Fig. 5.8- Participación de la clatrina y las COP en la selección del cargamento FUNCIONES DEL RETÍCULO ENDOPLASMÁTICO LISO a) Síntesis de lípidos. En las membranas del REL se sitúan las enzimas responsables de la síntesis de la mayor parte de los lípidos celulares: triglicéridos, fosfoglicéridos, ceramidas y esteroides. Los precursores para la síntesis provienen del citosol, hacia el cual se orientan los sitios activos de las respectivas enzimas. Por lo tanto, los lípidos recién sintetizados quedan incorporados en la monocapa citosólica del REL. Sin embargo, gracias a la participación de las flipasas del retículo, se logra el movimiento hacia la monocapa luminal de los lípidos correspondientes, asegurándose de esta forma la asimetría entre ambas capas, que será mantenida de aquí en más. b) El REL en las células musculares. El REL actúa como reservorio de calcio, el cual –frente a la llegada de un estímulo - es liberado al citosol, donde dispara una respuesta específica. Esta función es particularmente importante en las células musculares. Allí el REL, que toma el nombre de retículo sarcoplásmico, adopta una conformación muy especializada. El calcio es liberado frente al impulso nervioso desencadenado por la acetil colina en la unión neuromuscular, y una vez en el citosol participa en la contracción muscular. Cuando retorna al REL, por la acción de una bomba de calcio, se produce la miorrelajación. c) El REL en las células hepáticas. Está involucrado en dos funciones: detoxificación y glucogenólisis. La detoxificación consiste en la transformación de metabolitos y drogas en compuestos hidrosolubles que puedan ser excretados por orina. La glucogenólisis (degradación del glucógeno) tiene lugar en el citosol, donde los gránulos de glucógeno se encuentran en íntima relación con el REL. El producto de la glucogenólisis, la glucosa 6-fosfato (glucosa 6-P), es atacada entonces por la glucosa 6-fosfatasa, enzima de la membranas del retículo. Ésta cataliza la hidrólisis del grupo fosfato, permitiendo así que la glucosa atraviese la membrana celular hacia el torrente circulatorio. La glucosa 6-fosfatasa no se expresa en las células musculares, razón por la cual el glucógeno muscular no contribuye a la mantención de la glucemia. FUNCIONES DEL RETÍCULO ENDOPLASMÁTICO GRANULAR a) Síntesis de proteínas. Todas las proteínas sintetizadas en la célula (excepto las codificadas por ADN de mitocondria y cloroplasto) son iniciadas por ribosomas libres del citosol. Muchas de ellas, las proteínas nucleares, las citosólicas y las que están destinadas a cloroplastos, mitocondrias o peroxisomas, concluyen su síntesis en dichos ribosomas para luego dirigirse, por el citosol, hacia sus compartimentos diana. Otras, en cambio, como las proteínas integrales de membrana, las de secreción y las enzimas lisosomales, terminan su síntesis en el REG. ¿Cómo se dirige la síntesis hacia uno de estos dos ramales? ¿Existen diferentes poblaciones de ribosomas? ¿Dónde radica la señal que conduce a determinadas proteínas hacia el REG? Fig. 5.9- Síntesis de proteínas en el REG. Hipótesis de la señal. La respuesta a estos interrogantes fue proporcionada por Blobel y Sabatini, en el año 1971, cuando propusieron su hipótesis de la señal, ampliamente corroborada después. Las proteínas que se sintetizan en el REG tienen en su extremo aminoterminal una seguidilla de aproximadamente treinta aminoácidos cuyos radicales son predominantemente hidrófobos. Este primer fragmento de las proteínas recibe el nombre de péptido señal o péptido guía. No aparece péptido guía en las proteínas del citosol, núcleo, mitocondria, cloroplasto ni peroxisoma. Cuando el péptido guía está presente, es reconocido por la PRS (partícula de reconocimiento de la señal) situada en el citosol. La PRS interactúa con el péptido señal y detiene la síntesis temporariamente. Entonces el ribosoma se une a las membranas del REG. Recordemos que allí se ubican las riboforinas (receptores de ribosomas). También hay receptores para la PRS. Una vez que el ribosoma se adhiere a las membranas reticulares, entonces el péptido guía ingresa en un canal transmembranar, la PRS se separa y la traducción se reanuda. A medida que la proteína crece, se vuelca hacia el lumen del REG: la síntesis proteica y la translocación a través de la membrana son simultáneas (cotraslación). Fig. 5.10- Sïntesis de proteínas en el REG. Cotraslación Las proteínas que carecen de péptido señal no son reconocidas por la PRS; por este motivo no se dirigen hacia el sistema de endomembranas y su síntesis se completa en el citosol. Muchas de ellas atraviesan otras membranas con posterioridad (postraslación) para alcanzar su localización definitiva. Se han encontrado otras secuencias aminoacídicas, distintas del péptido señal, que actúan como marcas para dirigirlas a sus respectivos destinos. Las proteínas sintetizadas en el REG pueden dividirse en dos grandes grupos: membranares y luminales o solubles. Las membranares permanecen incluidas en la membrana, en algunos casos ligadas a ella mediante el péptido señal; en otras, secuencias de aminoácidos internas a la cadena funcionan como péptidos de anclaje, deteniendo la translocación de la proteína por el canal. Según la cantidad de secuencias de anclaje que presentan, hay proteínas de paso único o proteínas multipaso. Las proteínas intrínsecas insertas en la membrana a nivel del REG se retienen como componentes de este organoide o son transportadas en vesículas, formando parte del “envase”, hasta incorporarse a otras membranas del sistema o a la propia membrana plasmática. Fig. 5.11 a - Inserción de proteínas integrales en la membrana del REG Fig. 5.11 b- Inserción de proteínas integrales de multiple paso en la membrana del REG Las proteínas solubles no conservan el péptido señal ni poseen otros péptidos de anclaje. Cuando el péptido señal es escindido de la cadena (en este corte actúa una peptidasa señal ubicada en la cara luminal de las cisternas), ésta pierde contacto con la membrana y se vuelca por completo al lumen. Si las proteínas solubles no son residentes del REG, entonces siguen su ruta, en este caso como contenido de las vesículas transportadoras. Podemos citar en este grupo a las proteínas de secreción y a las hidrolasas lisosomales. Glicosilación. La mayor parte de las proteínas sintetizadas en el REG incorporan cadenas glucídicas a su paso por el mismo. La presencia en la cadena polipeptídica de la secuencia de aminoácidos asparagina– x-serina o asparagina–x–treonina (x es otro aminoácido cualquiera), señal de glicosilación, marca el sitio donde se unirá el glúcido. Todas las glucoproteínas sintetizadas en el REG reciben el mismo oligosacárido: una cadena ramificada de doce unidades de monosacárido. Fig. 5.12- Glicosilación nuclear. Ésta se sintetiza sobre un lípido de membrana -el dolicol-fosfato -, y luego es transferida en bloque a la asparagina de la señal de glicosilación (se forma un enlace N-glicosídico). En la síntesis del oligosacárido y su posterior transferencia participan las enzimas glicosiltransferasas. El glúcido se adiciona tantas veces como aparezca en la proteína la señal de glicosilación. Mientras la glucoproteína aún se halla en el REG, enzimas glicosidasas remueven algunas unidades de monosacárido, al tiempo que distintas glicosiltransferasas añaden otras nuevas. Se produce así la diversidad de cadenas a partir del primer bloque transferido. Un núcleo del oligosacárido original, no obstante, se conserva hasta el final en todas las glucoproteínas, de allí que esta glicosilación reciba el nombre de glicosilación nuclear. FUNCIONES DEL APARATO DE GOLGI El aparato de Golgi es la estación distribuidora final del sistema. Las macromoléculas sintetizadas en REL y REG llegan a él mediante transporte vesicular y son recibidas en la cara convexa del aparato o cara de recepción, donde se encuentra una zona de transición con el RE, la red cis. Desde allí, por el mismo mecanismo, son enviadas a la cisterna cis, luego a la medial, y por último al compartimento trans del complejo de Golgi, que se corresponde con su cara cóncava. A partir de otra zona de transición, la red del trans Golgi, brotan las vesículas que contienen los productos definitivos. El complejo de Golgi no se limita al transporte de las sustancias recibidas. En este sector, por el contrario, se da la forma final a las moléculas que ingresan. En el aparato de Golgi tienen lugar las siguientes reacciones: Glicosilación terminal. Es la modificación secuencial, por remoción y adición de monosacáridos, de las glucoproteínas sintetizadas en el REG. También se adicionan nuevos bloques oligosacarídicos construidos por completo en el aparato de Golgi, proceso denominado O-glicosilación (el enlace entre el glúcido y el resto de aminoácido es unión O-glicosídica). Síntesis de heteropolisacáridos. Los heteropolisacáridos constituyentes de los glicosaminoglicanos (GAG) se sintetizan en el aparato de Golgi y se unen a las proteínas provenientes del REG, ensamblando moléculas complejas como el ácido hialurónico o el condroitín-sulfato destinados a la matriz extracelular de las células animales. En las células vegetales, el aparato de Golgi sintetiza polisacáridos de la pared celular, por ejemplo hemicelulosas y pectinas. Síntesis de glucolípidos. Se adiciona la porción glucídica a la ceramida sintetizada en el REL. Secreción Las vesículas que brotan de la cara trans portan los productos acabados destinados al medio extracelular. La fusión de dichas vesículas con la membrana plasmática –exocitosis- da como resultado la secreción o exportación de diversas sustancias: enzimas, hormonas, moléculas de la matriz extracelular o de la pared celular, anticuerpos y otras, según el tipo celular. Hay dos rutas secretorias: la continua o constitutiva y la discontinua o regulada. La secreción continua o constitutiva está presente en todos los tipos celulares. Las vesículas que siguen esta ruta se exocitan en forma continua, a medida que brotan del aparato de Golgi. Por ejemplo, se secretan por esta vía las moléculas que se incorporan a la matriz extracelular. Fig. 5.13- Secreción La secreción regulada, en cambio, es propia de células secretoras especializadas. En estos casos, las vesículas se acumulan en el polo secretor de la célula, como gránulos de secreción, y la exocitosis se dispara sólo ante señales muy específicas. Por ejemplo, las células b de los islotes de Langerhans (en el páncreas), contiene gránulos de insulina que son exocitados en respuesta a una elevación de la glucemia. La secreción regulada requiere también un aumento de la concentración de calcio citosólico. Formación de lisosomas primarios Los lisosomas primarios son organoides derivados del sistema de endomembranas. Cada lisosoma primario es una vesícula que brota del aparato de Golgi, con un contenido de enzimas hidrolíticas (hidrolasas). Las hidrolasas son sintetizadas en el REG y viajan hasta el aparato de Golgi por transporte vesicular. Allí sufren una glicosilación terminal de la cual resultan con cadenas glucídicas ricas en manosa-6-fosfato (manosa 6-P). La manosa 6-P es el marcador molecular, la “estampilla” que dirige a las enzimas hacia la ruta de los lisosomas. Se ha estudiado una enfermedad en la cual las hidrolasas no llevan su marcador; las membranas del aparato de Golgi no las reconocen como tales y las empacan en vesículas de secreción para ser exocitadas. Quienes padecen esta enfermedad acumulan hidrolasas en el medio extracelular, mientras sus células carecen de ellas. Lisosomas y digestión: heterofagia y autofagia Los lisosomas primarios contienen una variedad de enzimas hidrolíticas capaces de degradar casi todas las moléculas orgánicas. Estas hidrolasas se ponen en contacto con sus sustratos cuando los lisosomas primarios se fusionan con otras vesículas. El producto de la fusión es un lisosoma secundario. Por lo tanto, la digestión de moléculas orgánicas se lleva a cabo en los lisosomas secundarios, ya que éstos contienen a la vez los sustratos y las enzimas capaces de degradarlos. Existen diversas formas de lisosomas secundarios, según el origen de la vesícula que se fusiona con el lisosoma primario: Fagolisosoma: se origina de la fusión del lisosoma primario con una vesícula procedente de la fagocitosis. Se encuentran, por ejemplo, en los glóbulos blancos, capaces de fagocitar partículas extrañas que luego son digeridas en estos cuerpos. Endosoma tardío: surge al unirse los lisosomas primarios con materiales provenientes de los endosomas tempranos. Los endosomas tempranos contienen macromoléculas que ingresan por los mecanismos de endocitosis inespecífica y endocitosis mediada por receptor. Este último es utilizado por las células para incorporar, por ejemplo, las lipoproteínas de baja densidad o LDL. Fig. 5.14- Endosoma temprano y tardío Autofagolisosoma: es el producto de la fusión entre un lisosoma primario y una vacuola autofágica. Algunos organoides citoplasmáticos son englobados en vacuolas, con membranas provistas por las cisternas del RE, para luego ser reciclados cuando estas vacuolas autofágicas se unen con los lisosomas primarios. La digestión que tiene lugar en los lisosomas secundarios, ya se trate de una heterofagia- hidrólisis de sustancias de origen exógeno- o de una autofagia –degradación de componentes celulares- da origen a moléculas más sencillas que atraviesan la membrana lisosomal, es decir son absorbidas por el citosol para su posterior asimilación. Lo que queda del lisosoma secundario después de la absorción es un residuales contienen desechos no digeribles que en algunos casos acumulándose en el citosol a medida que la célula envejece. Un ejemplo gránulos de lipofuscina que se observan en células de larga vida, como las cuerpo residual. Los cuerpos se exocitan y en otros no, de cuerpos residuales son los neuronas. La activación de las hidrolasas requiere un medio más ácido que el citosol, de pH 5, que se logra por la acción de una bomba de protones situada en la membrana lisosomal. Por otra parte, la membrana de los lisosomas es impermeable a las enzimas y resistente a la acción de éstas. Ambos hechos protegen normalmente a la célula de una batería enzimática que podría degradarla. Existen, sin embargo, algunos procesos patológicos, como la artritis reumatoidea, que causan la destrucción de las membranas lisosomales, con la consecuente liberación de las enzimas y la lisis celular. En otros casos, la liberación de las hidrolasas cumple un papel fisiológico, permitiendo la reabsorción de estructuras que ya no son útiles, por ejemplo la cola de los renacuajos durante la metamorfosis. Fig. 5.15- Autofagia y Heterofagia PEROXISOMAS Los peroxisomas, organoides presentes en todas las células eucariontes, son vesículas ovoideas de aproximadamente 0,5 mm, que al igual que los lisosomas están rodeadas por una membrana simple y contienen enzimas en su interior. Esta quizá sea la única similitud, pues se originan al igual que las mitocondrias por un proceso de fisión binaria, en este caso de peroxisomas preexistentes. Las enzimas que contienen en su matriz se incorporan desde el citosol, siendo sintetizadas en ribosomas libres. Según el tipo de enzimas que posean, existen muchos tipos de peroxisomas. La principal enzima de los peroxisomas es la catalasa, que descompone el peróxido de hidrógeno producido en el peroxisoma o el originado en otras localizaciones, como el citosol, RE y las mitocondrias. La actividad de la catalasa es la única común a todos los tipos de peroxisomas. En el peroxisoma, se reduce el oxígeno molecular en dos pasos. En el primero una oxidasa elimina los electrones de varios sustratos, como aminoácidos o ácido úrico. En el segundo, la catalasa, convierte el peróxido de hidrógeno, formado en el primer paso en agua. La catalasa también participa en la neutralización de los aniones superóxido, O2- (radicales libres). Estos radicales son primero eliminados con formación de H 2O2 por la superóxido dismutasa, y luego la catalasa de los peroxisomas convierte al H 2O2 en H2O y O2. La catalasa también neutraliza con consumo de H 2O2, sustancias tóxicas, como fenoles, formaldehído y el etanol de las bebidas alcohólicas, por eso son más numerosos en el tejido hepático y renal. Contiene además diferentes oxidasas, como la D-aminooxidasa, urato oxidasa y las responsables de la b-oxidación de los ácidos grasos (este proceso tiene lugar principalmente en la mitocondria). Todas estas enzimas oxidan sus sustratos produciendo energía térmica en lugar de ATP. En las células vegetales, encontramos glioxisomas, que son peroxisomas especializados en el metabolismo de los triacilgliceridos. Las enzimas de los glioxisomas, transforman los ácidos grasos de las semillas en hidratos de carbono por la vía del glioxilato. Los glioxisomas, también juegan un papel central en la fotorrespiración (se denomina así dicho proceso por requerir luz y O2 y liberar CO2), que tiene lugar en las hojas de las plantas verdes en los días de calor intenso y baja humedad ambiente. En los glioxisomas, se cataliza la oxidación del glicocolato a H 2O2 y glioxilato con consumo de oxígeno. Luego el H2O2 formado es descompuesto y el glioxilato es transformado en glicina, la cual ingresa al ciclo de Krebs.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados