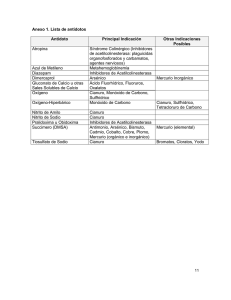
Hidrometalurgia para obtención de plata Martin castañeda lozano, IS13110690 Argentita La argentita (del latín argentum, que significa "plata"), también llamada argirita, es un sulfuro de fórmula Ag2S, si es pura contiene 87,1% de plata. La acantita, que es una polimorfa de la argentita, se forma a una temperatura inferior a 179 °C. Los yacimientos más importantes se encuentran en: Guanajuato, México, Freiberg (Saxe), Colquechaca en Bolivia, Andreasbserg (Harz). En Chile se ha encontrado en los yacimientos mencionados para plata nativa, e incluida en la paragénesis mineralógica de algunos yacimientos de Pb-Zn. Es una de las menas importantes de plata. Como la mayoría de los minerales de plata, a excepción de cloruros y bromuros de Ag, es atacada y disuelta por soluciones de cianuro (método hidrometalúrgico de cianuración). Argentitas en inclusiones en otros sulfuros como galena, puede ser recuperada por flotación selectiva. PROCESO OBTENCION DE LA PLATA EXTRACCION TRITURACION Con Electrolisis LIXIVIACION Por agitación Por Merril Crowel Ag (50- 70%) Ag (99.9%) NaAg(CN)2 PRECIPITACION EXTRACCION Partiremos de la argentita, de 600 toneladas/hr. de la cual contiene 8gr. de plata. La extracción de la argentita se realiza por medio de barrenos hechos por la perforadora, depositando cartuchos de un explosivo plástico y de ahí se obtiene el sulfato de plata . Ag2S, 1.33% , PbS, FeS2, ZnS y otros minerales 5.33% Alumina y Silice, 97% Trituración El mineral extraído desde la mina se transporta en camiones descargándose directamente en la Chancadora Primaria donde se reduce a un tamaño menor de 6". De ahí pasa a una zaranda que separa las fracciones mayores de 1.5" pasándolas a la Chancadora Secundaria. Luego todo el mineral se une al descargarse en una faja transportadora que lo lleva a una Tolva de Almacenamiento. El objetivo del Chancado es reducir el tamaño del mineral para facilitar la acción de la solución química que recuperará el Oro y la Plata en la etapa de Lixiviación. Desde la tolva de Almacenamiento, el mineral se transporta vía camiones sobre un área denominada "Pad de Lixiviación", donde se esparce con un tractor de orugas Lixiviación El principio básico de la lixiviación (cianuración) es aquella en que las soluciones alcalinas débiles tienen una acción directa disolvente preferencial sobre el Oro y la Plata contenidos en el mineral. La reacción enunciada por Elsher en su Journal PrakChen (1946), es la siguiente: 4Ag + 8NaCN + O2 + 2H2O →4NaAg(CN)2 + 4NaOH La química involucrada en la disolución de oro y plata en el proceso de cianuración en pilas es la misma aplicada en los proceso de cianuración por agitación. El oxígeno, esencial para la disolución del oro y plata, es introducido en la solución de cianuro, mediante la inyección directa de aire al tanque solución de cabeza, por irrigación en forma de lluvia y por bombeo de la solución recirculante. La velocidad de la disolución de los metales preciosos en soluciones de cianura depende del área superficial del metal en contacto con la fase liquida, lo que hace que el proceso de disolución sea un proceso heterogéneo; la velocidad de disolución depende también de la velocidad de agitación lo que indica que el proceso sufre la presión de un fenómeno físico. Factores que influyen • Tamaño de la Partícula: Cuando se presenta plata gruesa libra en la mena, la practica generalizada es recuperada por medio de trampas antes de la cianuración ya que las partículas gruesas podrían no disolverse en el tiempo que dura el proceso. Bajo condiciones consideradas ideales con respecto a la aereacion y agitación, Barsky encontró que la velocidad mínima de disolución de plata es 3.25 mg/cm2.hora • Oxigeno: El oxigeno tiene un rol fundamental en la lixiviación de la plata, pues la recuperación de oro y plata esta directamente relacionada con la cantidad de oxigeno disuelto en la pulpa mineral. Cuando se tienen faenas mineras a gran altura, como es de normal ocurrencia en nuestro país y en todo el Cordón de la Cordillera de los Andes, la cantidad de oxigeno disuelto disminuye, lo que afecta en gran medida los resultados metalúrgicos. En estos casos de inyección de oxigeno e muy recomendada, puesto que aumenta, como se dijo anteriormente, las recuperaciones de oro y plata, y además disminuye los consumos de cianuro. • Concentración de la solución de Cianuro: La solubilidad del oro en una solución de CN aumenta al pasar de las soluciones diluidas a las concentradas. La solubilidad es muy baja con menos de 0.005% NaCN, crece rápidamente cuando tienen 0,01% NaCN y después lentamente, llegando al máximo cuando contiene 0,25% NaCN. La proporción mas eficaz es de 0,05 a 0,07% NaCN. La concentración usual de CN para el tratamiento de menas de oro es de 0,05% NaCN y para menas de plata de 0.3%, para concentrados de oro-plata, la fuerza de NaCN esta entre 0,3 a 0,7%. El NaCN es el más usado en el proceso de cianuración, aunque también se emplea el KCN. Factores que influyen • Temperatura: La velocidad de disolución de los metales en una solución de NaCN aumenta con el incremento de la temperatura, hasta 85 °C; las descomposición del cianuro es un serio problema. • Porcentaje de finos: Este aspecto es muy importante, porque, cuando el % de finos es alto, mayor al 20% del total (< -10 mallas, 1.7 mm) las partículas tienden a aglutinarse en consecuencia no dejan pasar las soluciones de cianuro por lo que estos minerales requieren otro tratamiento, posiblemente curado con cal, cemento o ambos para lograr aglomerarlos y facilitar la percolación. • Alcalinidad Protectora: Las funciones del hidróxido de calcio en la cianuración son los siguientes: o Evitar pérdidas de cianuro por hidrólisis. o Prevenir perdidas de cianuro por acción del CO2 de aire. o Neutralizar los componentes ácidos. o Facilitar asentamiento de las partículas finas de modo que pueda separarse la solución rica clara de la mena cianurada. Lixiviación por agitación La mena molida a tamaños menores a las 150 mallas (aproximadamente tamaños menores a los 105 micrones), es agitada con solución cianurada por tiempos que van desde las 6 hasta las 72 horas. La concentración de la solución cianurada esta en el rango de 200 a 800 ppm (partes por millón equivale a gr de cianuro por metro cubico de solución). La velocidad de disolución del oro nativo depende entre otros factores, del tamaño de la partícula, grado de liberación, contenido de plata. Es la práctica común, remover el oro grueso (partículas de tamaño mayores a 150 mallas o 0,105 mm), tanto como sea posible, mediante concentración gravitacional antes de la cianuración, de manera de evitar la segregación y perdida del mismo en varias partes del circuito. Es de suma importancia, aparte de determinar la naturaleza de los minerales de oro, poder identificar la mineralogía de la ganga, ya que esta puede determinar la efectividad o no de la cianuración. Esto por que algunos minerales de la ganga pueden reaccionar con el cianuro o con él oxigeno, restando de esa manera la presencia de reactivos necesaria para llevar adelante la solubilización del oro. Se realizan ensayos a escala laboratorio, con el objeto de determinar las condiciones optimas para el tratamiento económico y eficiente de la mena. Cianuración con agitación Las menas molidas se agitan con soluciones de cianuro de sodio desde 6 hasta 72 horas. La solución cianurada se usa en concentraciones de 200 a 800 partes por millón (ppm). La concentración de una solución de cianuro rica, varía de 0.5 a 15 gramos de oro por metro cúbico de solución. Esta agitación se hace mecánicamente, y con inyección de aire, para lograr un mayor contacto entre reactivos. Esto mejora el rendimiento de la de lixiviación. El cianuro disuelve el oro de la mena en forma de un complejo estable de oro y cianuro. La velocidad de disolución del oro nativo depende de tres factores importantes: tamaño de la partícula, grado de liberación del oro de la mena y contenido de plata. Tanque Agitador de Alta Eficiencia Un agitador que forza la pulpa a circular en el tanque. Tiene un Volumen válido de 0.58~45m3 Las paletas en forma de paraguas hacen una presión hacia abajo a la plupa. La pulpa circula de arriba abajo mezclando completamente con el medicamento. La estructura de paleta es avanzada y la capacidad de agitación es alta. Las paletas de un tanque agitador de alta eficiencia son de una forma de paraguas con un mayor diámetro y velocidad lineal que pueden fortalecer la capacidad de agitación y circulación de la pulp y medicamento. El aumento de la capacidad de circularción eleva el índice de flotación. En el tanque hay un conductor de corriente que aumenta la succión y la circulación. Tanque agitador de alta eficiencia se aplica vastamente en la mezcla de pulpa antes de la flotación haciendo la pulpa y el medicamento mixto completamente. También se usa en la agitación de pulpa en la industria química, materiales de construcción, fábrica de cianura, de residuos y etc. Proceso de Merrill Crowel (precipitacion) Este proceso de cementación para la extracción del oro y la plata desde las soluciones cianuradas fue introducida en 1890. Durante los próximos 26 años se introdujeron tres modificaciones que llevaron al proceso a obtener alta eficiencia y menores costos. La primera modificación fue el agregado de sales de plomo (acetato, nitrato) para la formación de pares galvánicos Pb-Zn para promover la actividad electroquímica de las reacciones de cementación, la segunda, fue el reemplazo del Zn en laminas por Zn en polvos (C.V Merril) para aumentar la cinética del proceso a pesar que el zinc en polvo se usó en 1897 no se generalizo su uso hasta 1946 cuando T.B Crowel aplicó vacio para desairear las soluciones antes de la cementación. El aporte de Merril - Crowe, dio origen al proceso actual de cementación con Zn mas conocido como proceso de Merril Crowel. Etapas en el proceso Merril Crowel • Clarificación: El objetivo es eliminar la presencia de suspensiones en las soluciones provenientes de la lixiviación y entregar una solución clara (menos a 10 ppm de solido) para lograr una mayor eficiencia en la cementación y obtener mayor ley en los precipitados. Se puede realizar de variados equipos de filtración: • • • • Filtro clarificante de vacio tipo Hooka. Filtros a presión. Filtros con lecho de arena por gravedad. Unidades filtrantes con tubos plásticos porosos recubiertos con diatomea. • Desaireación: Las soluciones clarificadas son desaireadas (pues la presencia de O2 incrementa el consumo de zinc) para obtener un precipitación eficiente. El método Crowell emplea vacio el cual es el más eficiente para remover el O2 disuelto. La torre de vacio puede estar llena o vacía con alimentación atomizada para incrementar la superficie del líquido. • Ajuste de la concentración del cianuro y la cal: Antes de contactar con zinc la solución es necesario ajustar las concentraciones adecuadas de CN y cal libre para una optima precipitación. Se puede agregar solución conteniendo CN y cal en el clarificador para ajustar las concentraciones. Etapas en el proceso Merril Crowel • Adición del Zn: El zinc en polvo es agregado en cantidades de 0,6 a 1,5 de Zn por parte de Ay o Ag (1/1 para la plata es una razón muy recomendable). El zinc es alimentado al cono de mezcla en forma controlada mediante alimentadores tipo tornillo, correa o disco. Las sales de plomo también puede ser agregadas en este punto. Las cantidades usuales son de 35 a 15 gramos de Zn y 10 a 15 gramos de nitrato de plomo por tonelada métrica de solución y por lo menos 0,1 gpl de CN libre debe estar presente. La mezcla es impulsada por una bomba sellada al sistema de filtración. El precipitado se puede filtrar en: • Filtros bolsas. • Filtros de placa o presión. • Filtros estrellas. La solución pobre filtrada es retornada a la planta de lixiviación o al circuito de LCC. Las menas de plata entregan precipitados de alta ley (entre un 50 a 90%) las cuales pueden fundirse directamente con agregados de Na2CO3, bórax, vidrio molido, sílice, KNO3. Principio de precipitación El principio de la precipitación de metales preciosos contenidos en soluciones de CN empleando polvo de zinc, está basado en el hecho de que el oro y la plata son electronegativos respecto al zinc, ocurriendo un reemplazo electroquímico del oro y la plata por el zinc, seguido por el desplazamiento del hidrógeno del agua por el sodio según la siguiente reacción: NaAg(CN)2 + 2NaCN + Zn + H2O→ Na2Zn(CN)4 + Ag + H + NaOH En la práctica, ocurre un exceso en el consumo de Zn por encima de la demanda teórica debido a que tanto el CN con el álcali libre en la solución tienden a atacar al Zn disolviéndolo. Refinación mediante electrolisis Consta de un ánodo de lamina de plata y un cátodo una lámina de Cuº (metálico) , el ánodo de plata se disuelve por acción del acido nítrico pasando del estado metálico a solución: HNO3 → H + NO3NO3- + Ag+ → AgNO3 En el cátodo ocurre lo contrario, es decir el nitrato de plata genera el NO3-: AgNO3 →Ag+ + NO3El potencial empleado debe ser lo suficiente para mantener el equilibrio existentes entre el H, NO3- y Ag, el amperaje según procedimiento (1000 A); un sobre voltaje genera evacuación de H2 que desestabiliza el sistema el Voltaje mediante el cual se deposita la plata (2.5 - 3.0) volts. Se obtiene por esta refinación electrolítica una plata de alta ley 99,99%. los desechos En la mayoría de los procesos mineros, la roca extraída se encuentra en un cierto estado químico en el subsuelo. Este estado va a cambiar necesariamente cuando la roca sea llevada a la superficie de la tierra y expuesta al aire y a las precipitaciones, o tratada con productos químicos. Esta modificación del estado químico de la roca, así como su mezcla con productos tóxicos como el cianuro es el origen de los desechos producidos por la explotación minera de oro. Estos desechos se pueden clasificar en 3 categorías: • los estériles que son rocas no tratadas, • los desechos sólidos después del tratamiento de la roca, • los desechos líquidos después del tratamiento de la roca. Cada tipo de desecho puede tener un impacto irreversible sobre el medio ambiente. los complejos metal-cianuro Como compuesto altamente reactivo, el cianuro se une muy fácilmente en so- lución a metales como el hierro, el cobre, el níquel, el zinc, el cadmio etc., con los cuales forma una mezcla llamada “complejo metal-cianuro”. Estos complejos están muy presentes en las aguas usadas y contaminadas de la industria de oro, porque las rocas de las cuales se extrae el oro, incluyen ge- neralmente hierro, cobre, zinc o arsénico. Más aún, estos metales se encuentran en concentraciones mucho más altas que las del oro en las rocas tratadas. Por ejemplo, la concentración de hierro es hasta 35.000 veces mayor que la del oro. Por esta razón, el complejo cianoferrato (un complejo metalcianuro en el cual el hierro Fe está vinculado con el anión cianuro) está presente masivamente en las aguas de desecho de la minería de oro. Los análisis químicos de las soluciones cianuradas de tratamiento de la roca, muestran que la mayor parte del cianuro está ligado a otros metales además del oro o la plata. Los complejos metalcianuro son considerados a menudo menos tóxicos que el cianuro libre, aunque su toxicidad “no está bien entendida o documentada”. Un anión es un grupo químico que lleva una carga negativa. En “solución” quiere decir diluido en el agua. Cabe señalar además que estos componentes son “cargadores” a la vez de cianuro y de metales pesados. En consecuencia, una vez que llegan a las aguas naturales, se disocian, es decir se separan, y descargan estos productos particularmente tóxicos para la fauna acuática. Técnicas de tratamiento de los desechos cianurados – principios y limitaciones mitigación natural En general, el cianuro libre no permanece mucho tiempo en las aguas usadas dispuestas en los embalses de las explotaciones mineras, o en la aguas de super- ficie y en el suelo120 (sin embargo, puede permanecer durante periodos largos en las aguas subterráneas121). El cianuro libre se volatiliza en forma de cianuro de hidrógeno, que se va diluyendo en la atmósfera. La volatilización es más eficaz en un medio oxigenado con alta temperatura122. Se estima que cada año, los pozos de almacenamiento de desechos cianura- dos emanan al aire 20.000 toneladas de cianuro de hidrógeno123. Estos vapores pueden ser transportados por el viento a distancias considerables. Además, debido a que el cianuro de hidrógeno es muy estable, puede permanecer en la atmósfera durante años antes de ser degradado124. Las consecuencias de estas emanaciones para el medio ambiente son aún desconocidas. El mayor proceso de degradación natural, después de la formación de cianuro de hidrógeno con el cianuro libre, es la disociación de los complejos metal- cianuro. Esta degradación natural ocurre en los desechos mineros como las pilas de lixiviación abandonadas o las aguas usadas. Sin embargo, los complejos metalcianuro formados en el tratamiento de la roca por la solución de cianuro, permanecen más tiempo en las aguas usadas y en los desechos sólidos. Algunos complejos débiles se disocian fácilmente, mientras que los otros necesitan ser tratados por una mitigación procesada . El proceso de disociación natural implica la acidificación de los desechos al contacto con las lluvias y el dióxido de carbono del aire (durante el tratamiento por el cianuro, la roca se mantiene alcalina artificialmente). Esta acidez permite que se disocien los complejos metal-cianuro, es decir se rompan los enlaces que unen los metales al cianuro. Una vez liberado el cianuro, se forma el cianuro de hidrógeno. Las bacterias naturalmente presentes en los pozos de almacenamiento y el oxígeno del aire pueden provocar una oxidación natural de estos desechos. En este caso, el cianuro se transforma en cianato. En el caso de los desechos líquidos, la luz del sol puede contribuir a la disociación de unos complejos metal-cianuro. Sin embargo, no es generalmente el proceso dominante de degradación natural. Además, la luz no es capaz de disociar el cianuro libre ni a una buena parte de los complejos metal-cianuro125. Solamente los complejos fuertes como el cianoferrato son muy sensibles a la luz del sol126. Este proceso es muy lento por lo que no logra concretarse durante la noche o si el cielo esta nuboso127. En cuanto a las pilas de lixiviación, las aguas de lluvia las enjuagan naturalmente y pueden disolver el cianuro que contienen, y así contribuir al restablecimiento de una acidez normal (en este caso, estas aguas de enjuague se descargan en los pozos de almacenamiento). En conclusión, los procesos de degradación naturales generalmente toman varios meses, o inclusive varios años128. En la mayoría de los casos, esta falta de rapidez no permite que los niveles de cianuro se reduzcan de manera aceptable129. Además, el almacenamiento durante largo tiempo, de aguas usadas, aumenta considerablemente los impactos para el medio ambiente (muerte de especies, riesgo de derrames, etc). mitigación natural mejorada La industria trata de aprovechar la existencia de estos procesos naturales a fin de tratar los desechos cianurados. Medidas simples pueden aumentar su eficacia. Por ejemplo, los pozos de almacenamiento pueden ser lo más anchos posible para aumentar el contacto con el aire y con ello la velocidad de acidificación. Por otra parte, mover mecánicamente las aguas usadas puede ayudar a vaporizar el cianuro de forma natural. En cuanto a la pilas de lixiviación, se pueden enjuagar repetitivamente con agua para lograr niveles aceptables de acidez. Sin embargo, grandes volúmenes de agua son necesarios para proceder a este tratamiento, lo que incrementa el con- sumo de agua. La eficiencia de esta técnica para tratar las pilas adecuadamente no está comprobada. mitigación procesada Como hemos visto, en la mayoría de casos, la mitigación natural no es suficiente y los desechos cianurados producidos tienen que seguir un tratamiento adicio- nal para no ser catastróficos cuando se los descargue en el medio ambiente, y intentar alcanzar los niveles de concentración impuestos por las regulaciones. Se ha desarrollado muchas técnicas para reducir las concentraciones en cianu- ro de los desechos mineros. La gran mayoría de estos métodos consiste en la acidificación del medio y/o la oxidación de los cianuros130. agua oxigenada (proceso degrussa) Algunas de estas técnicas requieren el uso de un componente capaz de oxidar al cianuro. Es el caso del agua oxigenada (a la cual se puede añadir ácido sulfú- rico, y cobre para catalizar las reacciones), usada en el método conocido como el proceso Degrussa, que permite convertir los cianuros libres y los complejos metal-cianuro débiles en cianatos131. proceso inco Otra técnica usa sulfuro (el dióxido de sulfuro), que permite la oxidación de cia- nuros en cianatos. El proceso INCO, utiliza el aire con agua y dióxido de sulfuro para oxidar el cianuro libre y la mayoría de los complejos metal-cianuro (excepto los cianuros de hierro). Se usa principalmente cuando la roca contiene sulfatos de hierro o si los complejos de hierro están presentes en concentraciones considerables en las aguas usadas132. Esta técnica es rápida, de bajo costo y consume bajas cantidades de reactivos en comparación con otros procesos. Sin embargo, según el hidrogeólogo Robert Moran, “mientras el proceso INCO reduce eficazmente la concentración de cianuro, también implica la formación de grandes volúmenes de productos que pueden ser tóxicos para los organismos acuáticos, como: cianatos, tiocianatos, sulfatos, amoníaco, nitratos, cianuros libres, así como altos niveles de concentración de cobre”133. cloro Es un proceso más antiguo que usa cloro, para degradar los cianuros en tiocianato y cianato. Esta técnica implica la formación temporal de compuestos tóxicos como el cloro cianógeno, y otros altamente tóxicos para la fauna acuática, como algunos complejos metal-cianuro fuertes, cloraminos, y amoníaco134. acidificación También existen técnicas que aceleran la acidificación de los desechos, agregan- do compuestos como el ácido sulfúrico. Este proceso conlleva a la emanación brutal de vapores de cianuro de hidrógeno, por lo que se necesita una tecnología de control muy segura para proteger a los trabajadores. otros procesos Finalmente, existen procesos que usan ozono, biodegradación con bacterias, luz solar catalizada por dióxido de titanio, adición de hierro que provoca la forma- ción de metales sólidos, etc., pero se implementan más raramente porque son costosos, parcialmente eficaces o todavía en etapa experimental normas • NORMA Oficial Mexicana NOM-157-SEMARNAT-2009, Que establece los elementos y procedimientos para instrumentar planes de manejo de residuos mineros. • NORMA Oficial Mexicana NOM-023-STPS-2003, Trabajos en minas-Condiciones de seguridad y salud en el trabajo. • NOM-058-SEMARNAT-1993: Norma Oficial Mexicana NOM-058-SEMARNAT-1993, que establece los requisitos para la operación de un confinamiento controlado de residuos peligrosos • NOM-083-SEMARNAT-2003: Norma Oficial Mexicana NOM-083-SEMARNAT-2003, Especificaciones de protección ambiental para la selección del sitio, diseño, construcción, operación, monitoreo, clausura y obras complementarias de un sitio de disposición final de residuos sólidos urbanos y de manejo especial. • NOM-141-SEMARNAT-2003: Norma Oficial Mexicana NOM-141-SEMARNAT-2003, Que establece el procedimiento para caracterizar los jales, así como las especificaciones y criterios para la caracterización y preparación del sitio, proyecto, construcción, operación y postoperación de presas de jales. • NOM-052-SEMARNAT-2005: Norma Oficial Mexicana NOM-052-SEMARNAT-2005, Que establece las características, el procedimiento de identificación, clasificación y los listados de los residuos peligrosos. • NOM-053-SEMARNAT-1993: Norma Oficial Mexicana NOM-053-SEMARNAT-1993, Que establece el procedimiento para llevar a cabo la prueba de extracción para determinar los constituyentes que hacen a un residuo peligroso por su toxicidad al ambiente. • NOM-120-ECOL-1997, establece especificaciones de protección ambiental para las actividades de exploración directa • • • • • • • • • • NOM-052-SEMARNAT-2005: Norma Oficial Mexicana NOM-052-SEMARNAT-2005, Que establece las características, el procedimiento de identificación, clasificación y los listados de los residuos peligrosos. NOM-053-SEMARNAT-1993: Norma Oficial Mexicana NOM-053-SEMARNAT-1993, Que establece el procedimiento para llevar a cabo la prueba de extracción para determinar los constituyentes que hacen a un residuo peligroso por su toxicidad al ambiente. NOM-054-SEMARNAT-1993: Norma Oficial Mexicana NOM-054-SEMARNAT-1993, que establece el procedimiento para determinar la incompatibilidad entre dos o mas residuos considerados como peligrosos por la norma oficial mexicana NOM-052-SEMARNAT-1993. NOM-055-SEMARNAT-2003: Norma Oficial Mexicana NOM-055-SEMARNAT-2003, Que establece los requisitos que deben reunir los sitios que se destinarán para un confinamiento controlado de residuos peligrosos previamente estabilizados NOM-056-SEMARNAT-1993: Norma Oficial Mexicana NOM-056-SEMARNAT-1993, que establece los requisitos para el diseño y construcción de las obras complementarias de un confinamiento controlado de residuos peligrosos. NOM-057-SEMARNAT-1993: Norma Oficial Mexicana NOM-057-SEMARNAT-1993, que establece los requisitos que deben observarse en el diseño, construcción y operación de celdas de un confinamiento controlado para residuos peligrosos NOM-087-SEMARNAT-SSA1-2002: Norma Oficial Mexicana NOM-087-SEMARNAT-SSA12002, Protección ambiental - Salud ambiental - Residuos peligrosos biológico-infecciosos Clasificación y especificaciones de manejo. NOM-098-SEMARNAT-2002: Norma Oficial Mexicana NOM-098-SEMARNAT-2002, Protección ambiental-Incineración de residuos, especificaciones de operación y límites de emisión de contaminantes. Secretaría de Medio Ambiente y Recursos Naturales. NOM-157-SEMARNAT-2009: Norma Oficial Mexicana NOM-157-SEMARNAT-2009, Que establece los elementos y procedimientos para instrumentar planes de manejo de residuos mineros. NOM-161-SEMARNAT-2011: Norma Oficial Mexicana NOM-161-SEMARNAT-2011, Que establece los criterios para clasificar a los Residuos de Manejo Especial y determinar cuáles están sujetos a Plan de Manejo; el listado de los mismos, el procedimiento para la inclusión o exclusión a dicho listado; así como los elementos y procedimientos para la formulación de los planes de manejo.