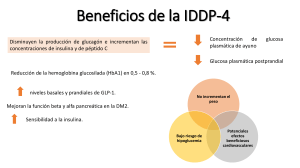
RAE: (CCL) Explicar en qué consiste la resistencia a la insulina y cuáles son sus efectos metabólicos. Contenido Insulina Cascada de señalización de insulina Mecanismos moleculares de la acción de la insulina Regulación de la señal de la insulina Resistencia a la insulina Fisiopatología Efectos metabólicos Insulina La insulina es un péptido de 51 aminoácidos producido y secretado por las células β de los islotes pancreáticos de Langerhans con el objetivo de mantener niveles óptimos de glucosa en sangre (hormona hipoglucemiante). Consiste de dos cadenas polipeptídicas, A y B, de 21 y 30 aminoácidos, respectivamente, que están conectadas por puentes disulfuro. Sus acciones biológicas se inician cuando se une con su receptor (RI), una glucoproteína integral de membrana (la atraviesa), el cual está formado por dos subunidades α y dos subunidades β. Es la principal responsable de controlar la captación, utilización y almacenamiento de nutrientes celulares. Aumenta la absorción de glucosa de la sangre, principalmente en el músculo y el tejido adiposo, en donde promueve su conversión a glucógeno (glucogenogénesis) y triglicéridos (lipogénesis), respectivamente, inhibiendo al mismo tiempo su degradación (1). Además, en el hígado inhibe la gluconeogénesis, la glucogenólisis y la cetogénesis, y promueve la síntesis de proteínas principalmente en el músculo. Estas acciones se llevan a cabo gracias a una combinación de efectos rápidos, como la estimulación del transporte de glucosa en las células adiposas y musculares y la regulación de la actividad de enzimas clave en el metabolismo, y de mecanismos a largo plazo que implican cambios en la expresión génica (1). En condiciones de no estímulo (ausencia insulina), las subunidades α ejercen un papel regulador sobre las subunidades β; inhibiendo la capacidad del receptor para autofosforilarse. Después de que la insulina se une a su receptor, las subunidades α sufren cambios conformacionales que permiten que las subunidades β se activen y sean capaces de autofosforilarse sus residuos de Tyr (2). Inicialmente, la insulina se une a la subunidad α de su receptor (extra membranal), lo que implica cambios conformacionales en la subunidad β que inducen la activación catalítica a través de la autofosforilación de residuos de tirosina de la subunidad β. Esto, a su vez, aumenta la actividad quinasa del receptor. http://endobioquimicologia.blogspot.com/2013/04/el-receptor-de-la-insulina-que_8.html Los residuos autofosforilados son reconocidos por diferentes proteínas adaptadoras, entre ellas: la familia del sustrato del receptor de insulina (IRS), de los cuales el IRS1 y el IRS-2 son las más importantes y representativos de la etapa inicial de propagación de la señal de insulina. Esto promueve la activación de 2 posibles vías de señalización: Vía de la fosfatidilinositol-3cinasa (PI3K)/Akt Vía de las cinasas activadas por mitógeno/Ras O (MAPK/Ras) Cinasa B (PKB) Responsable de la mayoría de sus acciones metabólicas Regula la expresión genética y los efectos mitogénicos asociados a la insulina REGULACIÓN SEÑAL INSULINA Entre las alteraciones más comunes de la resistencia a la insulina se encuentran la disminución en el número de receptores de insulina y de su actividad catalítica, el aumento en el estado de fosforilación en residuos de Ser/Thr del receptor de insulina y del IRS, el aumento en la actividad de fosfatasas de residuos de Tyr, principalmente PTP-1B, que participan en la desfosforilación del receptor y del IRS, la disminución de la actividad de las cinasas PI3K y Akt, y defectos en la expresión y función del GLUT-4. Estas alteraciones reducen la incorporación de glucosa en el tejido muscular y adiposo y promueven alteraciones a nivel metabólico. La actividad del receptor de insulina es regulada por la acción de fosfatasas de fosfotirosinas (PTP-1B) que desfosforilan residuos específicos de Tyr del receptor activo, reduciendo de este modo su actividad (1). La regulación del receptor de insulina es la fosforilación de la subunidad β en residuos de Ser/Thr. Existe evidencia que indica que esta fosforilación afecta a la actividad de cinasa del receptor en respuesta a la unión de la insulina, alteración que se ha observado en estados de resistencia y obesidad: Varios de los posibles sitios de fosforilación se encuentran próximos a los sitios de autofosforilación o dentro del dominio catalítico, lo cual podría afectar a la conformación del receptor o al acceso a los residuos de Tyr (1). La regulación del IRS, su fosforilación en residuos de Ser/Thr se ha considerado uno de los principales mecanismos de regulación tanto homóloga como heteróloga de la señal de insulina. Se tiene evidencia experimental de que la fosforilación de múltiples residuos de Ser/Thr del IRS representa un mecanismo clave en la inhibición de la señalización de la insulina, por la activación tanto fisiológica como fisiopatológica. Diversos estudios han demostrado que la fosforilación de estos residuos se asocia con la atenuación de la señal de la insulina, ya que se altera la capacidad del IRS de ser fosforilado en residuos de Tyr, se disminuye la actividad de PI3K y se promueve su degradación (1). Entre las alteraciones más comunes de la resistencia a la insulina se encuentran la disminución en el número de receptores de insulina y de su actividad catalítica, el aumento en el estado de fosforilación en residuos de Ser/Thr del receptor de insulina y del IRS, el aumento en la actividad de fosfatasas de residuos de Tyr, principalmente PTP-1B, que participan en la desfosforilación del receptor y del IRS, la disminución de la actividad de las cinasas PI3K y Akt, y defectos en la expresión y función del GLUT-4. Estas alteraciones reducen la incorporación de glucosa en el tejido muscular y adiposo y promueven alteraciones a nivel metabólico. Diversos agentes como las citocinas proinflamatorias, los ácidos grasos saturados (AGS), los aminoácidos, la endotelina, la angiotensina II (Ang II) y los estados de hiperinsulinemia aumentan la actividad de las cinasas, como varias isoformas de PKC, la cinasa de estrés JNK, mTOR, PKA y MAPK, que fosforilan a IRS (1). Síndrome metabólico (SM) Se imbrican alteraciones en el metabolismo glucolipídico, estados proinflamatorios y protrombóticos. El vínculo entre todas ellas se atribuye a la resistencia insulínica (RI), favorecida por el aumento de ácidos grasos libres, muchas veces relacionado con el sobrepeso. Este estado provoca trastornos en la utilización de glucosa celular, así como desregulación de su producción hepática. El metabolismo lipídico presenta también las consecuencias de la RI, que desembocan en las alteraciones características del SM: hipertrigliceridemia e hipocolesterolemia HDL. La hipertensión se relaciona con diferentes mecanismos como consecuencia de alteraciones en la vía de la insulina y en la regulación del sistema nervioso vegetativo. Además de las repercusiones en el desarrollo de la aterosclerosis, últimamente se han relacionado el SM y la RI con otras enfermedades, como el hígado graso no alcohólico y el síndrome del ovario poliquístico. Lista de referencias 1. Gutiérrez-Rodelo C, Roura-Guiberna A, Olivares-Reyes JA. Mecanismos Moleculares de la Resistencia a la Insulina: Una Actualización. Gaceta Medica de Mexico [Internet]. 2017;153:2–10. Disponible en: http://www.medigraphic.com/pdfs/gaceta/gm2017/gm172k.pdf 2. Reyes J, Plancarte A. Bases moleculares de la acción de la insulina [Internet]. Rev Mediagraphic 1(27); 2008 [citado 2019 Abril 25]. Disponible https://www.medigraphic.com/pdfs/revedubio/reb-2008/reb081c.pdf en: 3. Gimeno M, Martinez C, Pascual I, Casanova J. Síndrome Metabólico: Concepto y fisiología. Revista Española de Cardiología [Internet]. 5; 2005 Dic [citado 2019 Abril 25]. Disponible en: http://www.revespcardiol.org/es/content/articulo/13083442/