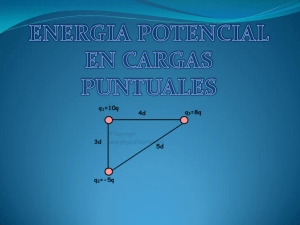
Materia Materia es todo lo que tiene masa y ocupa un lugar en el espacio. La materia está formada por átomos y moléculas. Todo lo que nos rodea e incluso nosotros mismos estamos hechos por materia. El aire, la tierra, el agua, los animales, las plantas, los edificios, los vehículos; están constituidos por miles de millones de átomos y moléculas que forman parte de nuestra vida diaria. Sustancias Puras Las sustancias puras están formadas por átomos o moléculas todas iguales, tienen propiedades específicas que las caracterizan y no pueden separarse en otras sustancias por procedimientos físicos. Las sustancias puras se clasifican en elementos y compuestos. Elemento Los elementos también pueden llamarse sustancias puras simples y están formados por una sola clase de átomos, es decir, átomos con el mismo número de protones en su núcleo y por lo tanto con las mismas propiedades químicas. Los elementos no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Son sustancias puras simples todos los elementos químicos de la tabla periódica. A las sustancias formadas por moléculas compuestas por átomos iguales también se les considera elementos, por ejemplo el oxígeno gaseoso, oxígeno molecular o dioxígeno. 1 Compuesto Los compuestos son sustancias formadas por la unión de dos o más elementos de la tabla periódica en proporciones fijas. Una característica de los compuestos es que poseen una fórmula química que describe los diferentes elementos que forman al compuesto y su cantidad. Los métodos físicos no pueden separar un compuesto, éstos solo pueden ser separados en sustancias más simples por métodos químicos, es decir, mediante reacciones. Por ejemplo, el agua es una sustancia pura, pero si la sometemos a electrólisis la podemos separar en los elementos que la forman, el oxígeno y el hidrógeno Mezcla Una mezcla resulta de la combinación de dos o más sustancias donde la identidad básica de cada una no se altera, es decir, no pierden sus propiedades y características por el hecho de mezclarse, porque al hacerlo no ocurre ninguna reacción química. Por ejemplo, si se mezcla limadura de hierro con azufre, cada sustancia conserva sus propiedades. La composición de las mezclas es variable, las sustancias que componen a una mezcla pueden presentarse en mayor o menor cantidad. Otra característica de las mezclas es que pueden separarse por métodos físicos. En la mezcla de hierro y azufre puede utilizarse la propiedad de magnetismo que presenta el hierro para ser separado del azufre. 2 Mezcla homogénea Las mezclas homogéneas se llaman también disoluciones. Tienen una apariencia totalmente uniforme por lo que sus componentes no pueden distinguirse a simple vista. Se dice que este tipo de mezclas tiene una sola fase. En química se denomina fase a una porción de materia con composición y propiedades uniformes. Por ejemplo, el agua de mar está formada por agua y muchas sales solubles, donde se observa una sola fase. Mezcla heterogénea Las mezclas heterogéneas presentan una composición no uniforme, sus componentes pueden distinguirse a simple vista, en otras palabras, se observan diferentes sustancias en la mezcla. Los componentes de este tipo de mezcla existen como regiones distintas que se llaman fases. Una mezcla heterogénea se compone de dos o más fases. Si observas la piedra de granito, puedes ver zonas de distinto color que indican que la roca está formada de cristales de distintas sustancias. Aspirina El ácido acetilsalicílico, conocido comúnmente como aspirina, es un fármaco usado frecuentemente como antiinflamatorio, analgésico, antipirético y disminuye el riesgo de formación de trombos sanguíneos. Aspirina es una mezcla homogenea, ya que se observa un sola fase y esta formada de acido acilsalicilico y almidon. 3 Cloruro de sodio En términos cotidianos se le conoce directamente con el término sal. Es vital para nosotros, puesto que gracias a él nuestro cuerpo absorbe el potasio y mantiene el equilibrio de los líquidos corporales. Sin embargo, su ingesta excesiva, aunada a factores como la edad, el consumo de grasas, la falta de actividad física y el hábito de fumar, incrementa el riesgo de enfermedades cardiovasculares. La sal o cloruro de sodio, es un compuesto que se da por interacción de dos o más átomos diferentes elementos, que solo se pueden separar por medios químicos aire El aire forma la atmósfera de la Tierra. El químico francés Antoine - Laurent Lavoisier (1743-1794), considerado actualmente como "el padre de la química", dedujo que el aire está formado por dos gases, el oxígeno, descubierto por el químico inglés Joseph Priestley, y el nitrógeno. Actualmente se sabe que los componentes del aire son alrededor de 78 % de nitrógeno, 21 % de oxígeno y el 1% restante se compone de gases como el dióxido de carbono, argón, neón, helio, y vapor de agua. El aire es una mezcla homogénea ya que sus componentes forman una sola fase. Sangre La sangre está formada por un líquido (plasma) y células como monocitos, neutrófilos, eosinófilos, basófilos, plaquetas, macrófagos y eritrocitos. Estas células se encuentran formadas de lípidos (en la membrana celular), agua y proteínas. La sangre es una mezcla hetereogénea, ya que se forma por dos fases una es el plasma y por células como monocitos, leucocitos, eosinofilos, basófilos,plaquetas, macrófagos y eritrocitos. Helado Es un alimento producido mediante la congelación, con o sin agitación, de una mezcla pasteurizada compuesta por una combinación de ingredientes lácteos. Puede contener grasas vegetales, frutas, huevo y sus derivados, saborizantes, edulcorantes y otros aditivos. Los helados que se comercializan en el mercado contienen diferentes porcentajes de grasa: con crema de leche, de 6 a 17 por ciento; con grasa vegetal, de 7 a 10 por ciento; con crema de leche bajos en calorías, de 1.6 a 4.5 por ciento. El helado es una mezcla hetereogénea ya que al observarlo en un microscopio se hace evidente la presencia de varias fases. Mercurio El mercurio presenta un punto de fusión de -38.4 °C y bulle a 357 °C. Sus aplicaciones son numerosas: en termómetros, barómetros y en las lámparas fluorescentes. Estas últimas contienen una pequeña cantidad de mercurio en forma de vapor mezclado con argón. El mercurio es un buen conductor de la electricidad y su función es dirigir el 4 flujo de la corriente eléctrica dentro del tubo. El mercurio es un elemento es decir por un mismo tipo de átomo. Plata Es un metal de color blanco-grisáceo. Posee las más altas conductividades térmica y eléctrica de todos los metales, por lo que se utiliza en puntos de contacto eléctricos y electrónicos. También se emplea mucho en joyería y piezas diversas. La plata es un elemento ya que esta formado por un mismo tipo de átomo. Oxígeno El 21% del aire, próximo a la superficie de la Tierra, está compuesto de oxígeno. Una de sus aplicaciones en la industria es en el soplete oxhídrico (oxígeno/hidrógeno), con el uso de estos gases se alcanzan temperaturas superiores a 3,400 °C para cortar y soldar metales. El oxigeno es un elemento ya que esta formado por un solo tipo de átomos y en la naturaleza se encuentra cmo molecula y tiene dos átomos iguales de oxigeno Leche La leche es un producto natural producido por las hembras de los mamíferos, que sirve como único alimento de sus hijos neonatos por un período de tiempo; su composición química le confiere un extremado valor en la dieta del hombre. En México la fuente principal de leche cruda o bronca es el ganado vacuno. La leche es una mezcla hetereogénea ya que presenta al menos dos fases. Sacarosa La sacarosa o azúcar común se produce a partir del jugo bajo en azúcar del betabel o de la caña de azúcar. La sacarosa abarca azúcar sin refinar, azúcar granulado, azúcar moreno, entre otras. El azúcar sin refinar es granulado, sólido o grueso y de color café. Se forma cuando se evapora la humedad del jugo de la caña de azúcar. El azúcar moreno se fabrica a partir de los cristales de azúcar obtenidos del almíbar de las melazas. La sacarosa es un compuesto que se da por interacción de dos o más átomos de diferentes elementos. Oro de 14 quilates Está formado por oro, plata y cobre. El oro se combina con estos metales para dar resistencia al material. El quilate es un término que se utiliza para describir el grado de pureza de los metales preciosos. Un quilate de un metal precioso corresponde a una veinticuatroava parte de la masa total de la aleación. El oro de 14 quilates está hecho con 14/24 partes de oro y tiene una pureza del 58%, el oro de 24 quilates está hecho con 24/24 partes de oro y tiene una pureza del 100%, por lo tanto es oro puro. El oro de 14 quilates es una mezcla homogénea, de oro, plata y cobre donde se observa una sola fase. 5 Oro de 24 quilates Está formado por oro, 100% El oro de 24 quilates está hecho con 24/24 partes de oro y tiene una pureza del 100%, el oro de 24 quilates está hecho con 24/24 partes de oro y tiene una pureza del 100%, por lo tanto es oro puro. El oro de 24 quilates es un elemento, formado por un mismo tipo de átomos Agua Este líquido tiene una importancia biológica fundamental porque es el medio en el cual tienen lugar las reacciones en el organismo. Una persona adulta está constituida por 70 % de agua aproximadamente. El agua es un compuesto por diferentes elementos unidos a través de enlaces químicos el agua es una molécula formado por dos átomos de hidrogeno y un átomo de oxigeno Sustancias Puras: Sustancias puras es la clase de materia que tiene una composición química definida en toda su extensión y se puede identificar por una serie de propiedades particulares. Veamos lo que quiere decir esto: 1. Composición química definida: Todas las sustancias tienen una fórmula química fija, procedan de donde procedan. Por ejemplo: el agua (H2O) es una sustancia, su fórmula está formada por dos átomos de hidrógeno y uno de oxígeno. 2. Propiedades particulares: Cada sustancia tiene propiedades físicas características, como densidad, punto de ebullición y punto de fusión. Por ejemplo: cualquier muestra de agua pura a 1 atmosfera de presión presenta los valores para el punto de congelación (0°C) y el punto de ebullición (100°C), y a 4°C su densidad es de 1 g/cm3. tipos de sustancias puras: elementos y compuestos. 1. Elemento químico: Un elemento es una sustancia pura que no se puede descomponer en otras más sencillas que ellas. Y están formados por una sola clase de átomos. Las láminas de cobre, están formadas únicamente por átomos de cobre. El oro es un elemento o el oxígeno que respiramos. A la fecha se han identificado 112 elementos, de los cuales 92 se encuentran en forma natural en la Tierra y los demás se han obtenido artificialmente. 2. Compuesto químico: son sustancias que están formadas por distintos tipos de átomos, es un tipo de materia constituido por dos o más elementos diferentes unidos químicamente en proporciones definidas. Por ejemplo, 1gr. de cloruro de sodio siempre contiene 0,3932gr. de sodio y y 0,607gr. de cloro. El agua es un compuesto porque está formada por oxígeno e hidrógeno. H2O 6 Átomos El elemento más pequeño de la materia en indivisible es el átomo. A lo largo de la historia se han dado distintas explicaciones a la composición de la materia y sus propiedades actualmente se acepta lo siguiente. El átomo está formado por tres partículas. Protones son partículas con carga positiva se encuentran en el centro del átomo en el núcleo. Neutrones No tienen carga y también se encuentran en el núcleo. Electrones Tienen carga negativa y se encuentran alrededor del núcleo Entre el núcleo y los electrones hay un espacio vacío. El átomo tiene la misma cantidad de electrones que de protones y por tanto es eléctricamente neutro . La masa del átomo se concentra casi exclusivamente en el núcleo. Los átomos se diferencian entre si por la distinta cantidad de protones que poseen. Los átomos pueden captar o soltar electrones en este caso se convierte en iones. Si la carga total del átomo es positiva se llaman cationes (+) y si es negativa se llaman aniones (-). 1) Los compuestos se pueden descomponer en sustancias simples. Básicamente se utilizan dos métodos: ● Descomposición térmica. Mediante calor, un compuesto se descompone en sustancias más simples. Generalmente se aplica a sólidos. Si calentamos piedra caliza obtendremos un sólido blanco de menor peso que el compuesto original.: CaCO 3 + calor ⇢ CaO + CO 2 ● Electrolisis. Al pasar una corriente eléctrica por una sustancia fundida o disuelta, se descompone en sustancias más simples. Se puede utilizar para la descomposición del agua en hidrógeno y oxígeno. H 2 O + electricidad ⇢ H 2 + O 2 Los átomos se unen entre sí generalmente para ganar estabilidad y de esta manera surgen los compuestos y sustancias que conocemos. Tipos de enlaces Enlace metálico . Formado por metal y metal . Se produce cuando los iones positivos de un metal comparten una nube de electrones. Son buenos conductores del calor y de la electricidad. Enlace covalente . Formado por no metal y no metal. Comparten electrones. Pueden formar cristales covalentes como el diamante (C) o el cuarzo (SiO 2 ) o gases y líquidos volátiles como hidrógeno (H 2 ), oxígeno (O 2 ), agua (H 2 O). Enlace iónico . Formado por metal y no metal . El metal cede electrones al no metal, quedando como ión positivo (Na +) , mientras que el no metal queda como ión negativo (Cl - ). Forman sólidos cristalinos solubles en agua. 7 30 EJEMPLOS DE Sustancias Puras: 1. Agua pura → es una sustancia pura compuesta, de fórmula H2O. 2. Estaño → es una sustancia pura simple o elemento, de símbolo Sn. 3. Sodio → es una sustancia pura simple o elemento, de símbolo Na. 4. Dióxido de carbono → es una sustancia pura compuesta, de fórmula CO2. 5. Níquel → es una sustancia pura simple o elemento, de símbolo Ni. 6. Óxido de Hierro → es una sustancia pura compuesta, de fórmula Fe2O3 7. Sal (NaCl) → es una sustancia pura compuesta, de fórmula NaCl 8. Alcohol Etílico → es una sustancia pura compuesta, de fórmula CH3CH2OH 9. Acetona → es una sustancia pura compuesta, de fórmula CH3COCH3 10. Metano → es una sustancia pura compuesta, de fórmula CH4 11. Azufre → es una sustancia pura simple o elemento, de símbolo S. 12. Lámina de aluminio, formado sólo por átomos de aluminio. 13. Ozono, formado solo por átomos de oxígeno. 14. El oro → es una sustancia pura compuesta, de símbolo Au 15. El gas hidrógeno (H2) está formado sólo por átomos de un mismo elemento. 16. Clavos de hierro, formado sólo por átomos de hierro (Fe) 17. La punta de los lápices es de grafito, que está formado por átomos de carbono (C). 18. Gas neón (Ne), usado en letreros de publicidad. → es una sustancia pura compuesta, 19. La sal de cocina o cloruro de sodio (NaCl) → es una sustancia pura compuesta 20. Nitrato de plata (AgNO3). es un elemento → es una sustancia pura compuesta 21. Sosa Cáustica o hidróxido de sodio (NaOH). → es una sustancia pura compuesta 22. Ácido bórico (H3BO3) → es una sustancia pura compuesta, 23. Ácido Clorhídrico (HCl) → es una sustancia pura compuesta, 24. Ácido sulfúrico (H2SO4) → es una sustancia pura compuesta, 25. Benzoato de Sodio (C6H5CO2Na) → es una sustancia pura compuesta, 26. Fluoruro de Sodio (NaF) → es una sustancia pura compuesta, 27. Óxido de Zinc (ZnO) → es una sustancia pura compuesta, 28. Carbonato de calcio (mármol, piedra caliza) – CaCO3 29. Cuarzo – SiO2 → es una sustancia pura compuesta, 30. Propano - C3H8 → es una sustancia pura compuesta, 8 30 ejemplos de mezclas homogéneas: 1. Agua con azúcar. 2. Agua con sal 3. El ácido clorhídrico en agua. 4. El ácido sulfúrico. 5. El cloro disuelto en agua. 6. El vinagre con agua 7. La masa de un pastel. 8. La masa para galletas. 9. La sosa caustica disuelta en agua. 10. Mezcla de cemento con agua y arena. 11. Pintura con aceite. 12. Tinta con agua. 13. Tinta con alcohol. 14. El bronce es una mezcla homogénea producida por dos metales el cobre y el estaño. 15. La plata esterling es una mezcla metálica de plata y otro metal. 16. El aire es una mezcla de varios gases, tales como el oxígeno, bióxido de carbono, vapor de agua, y otros gases. 17. El agua del mar es una mezcla homogénea de agua, sal y otros minerales disueltos. 18. Una taza de café es la mezcla homogénea de agua, azúcar y café disuelto en ella. 19. El oro blanco es una aleación mezcla de oro y metales como níquel, plata y/o paladio. 20. La leche es una mezcla (emulsión), de agua con otras sustancias perteneciente a las mezclas homogéneas. 21. Azúcar glas, harina y maicena son una mezcla homogénea sólida. 22. El detergente en agua es una disolución resultante de la mezcla de detergente en polvo o líquido en un disolvente universal que es el agua. 23. Agua con alcohol es una mezcla hecha de dos líquidos perteneciente a las mezclas homogéneas. 24. Los refrescos son mezclas de agua, azúcares, saborizantes y gas carbónico. 25. Los desodorantes en aerosol son la mezcla homogénea de fragancia, alcohol, y gas isobutano, que se encuentran en estado líquido y se atomizan. 26. La salmuera es una mezcla heterogénea de agua, sal y otras sustancias. 27. El acero es la mezcla homogénea de hierro y carbono. 28. La alpaca es la mezcla de plata con níquel y zinc. 29. El nitinol es una aleación mezcla de níquel y titanio. 30. El constantán es la aleación resultante de la mezcla homogénea de cobre con níquel. 9 30 ejemplos de mezclas heterogéneas: 1. El Agua y aceite. 2. Tierra y aserrín. 3. El arroz con frijoles. 4. Agua y diesel. 5. Agua y gasolina. 6. Vinagre y aceite. 7. La sopa de fideos. 8. Agua y gravilla. 9. Hojarasca y ramitas secas. 10. La cera y el agua. 11. Las piedras de arenisca. 12. La arena y piedras de río. 13. La grava y el arena. 14. La fruta en almíbar. 15. Las verduras encurtidas. 16. La sopa de verduras picadas. 17. La mezcla de cacahuates y pasitas. 18. La mezcla de frijoles, habas y maíces. 19. La mezcla de madera con piedrecillas. 20. La mezcla de habas y frijoles. 21. La mezcla de garbanzos y maíces. 22. La mezcla de zanahorias y papas picadas. 23. La mezcla de aceite de oliva y vinagre. 24. La Ensalada de pepino, zanahoria, lechuga, jitomate y jugo de limón. 25. La pintura vinílica es una mezcla en estado de suspensión. 26. El granito es una mezcla solidimentada de diversas partículas de piedra. 27. Las suspensiones de penicilina son mezclas heterogenias de un sólido en polvo y un líquido. 28. Las suspensiones de hidróxido de magnesio e hidróxido de aluminio para el malestar estomacal es la mezcla heterogénea de estas dos sustancias. 29. Las suspensiones de amoxicilina son la mezcla heterogenia de un medicamento antibiótico (en polvo) y un excipiente líquido. 30. El Papel y aserrín forman una mezcla heterogénea. 10 1. Separación de mezclas heterogéneas Las sustancias puras que constituyen una mezcla pueden separarse mediante métodos físicos. El método empleado depende del estado y propiedades de las sustancias que queremos separar. Criba es un procedimiento que se emplea para separar mezclas heterogéneas sólidas donde uno de los componentes tiene un tamaño muy distinto al otro. Ej: Arena y piedras. Empleado para separar sustancias sólidas que tengan distinto tamaño, como la arena de la grava cuando se desea preparar mortero en la construcción. Como la grava está formada por piedras de varios centímetros de tamaño y la arena por granos de apenas unos milímetros, empleando una criba, que tiene una red con agujeros de medio centímetro, los granos de arena atraviesan la criba mientras que la grava no puede atravesarla y, así, se separan. Dependiendo del tamaño de los granos a separar se puede emplear un tamaño de agujero menor, en cuyo caso, el instrumento que sirve para separar se llama tamiz, en lugar de criba. Filtración es un procedimiento que se emplea para separar mezclas heterogéneas sólido-líquido donde el sólido es insoluble en el líquido. Ej.: Arena y agua. El filtrado se emplea para separar las partículas de un sólido de las partículas de un líquido. Se basa en que las partículas del sólido son mucho más grandes que las partículas del líquido; con lo cual, éste atravesará sin problemas los poros del filtro, mientras que las partículas del sólido quedarán retenidas. Licuefacción de gases. Licuefacción o licuación de los gases es el cambio de estado que ocurre cuando una sustancia pasa del estado gaseoso al líquido, por el aumento de presión (compresión isoterma) y la disminución de la temperatura (expansión adiabática), llegando a una sobrepresión elevada. Separación magnética es un procedimiento que se emplea cuando uno de los componentes de la mezcla es ferromagnético (Fe, Ni, Co), el cuál se separa del resto empleando un imán. La separación magnética es muy útil para separar materiales ferromagnéticos (que son atraídos por imanes) de una mezcla con otras sustancias. En la imagen de la izquierda vemos una mezcla de arena e hierro. Acercando un imán a la mezcla, podemos retirar las partículas de hierro. El imán se envuelve en una bolsa para evitar que el hierro se quede adherido. De esta forma, quitando la bolsa, caerán las partículas de hierro al recipiente que queramos. 11 Decantación es un procedimiento que se emplea para separar mezclas heterogéneas de líquidos inmiscibles con diferente densidad. Para este procedimiento se usa un embudo llamado embudo de decantación, que tiene una válvula en la parte inferior. Cuando los dos líquidos están claramente separados, la válvula se abre y sale el primero que es el líquido de mayor densidad. Ej: Agua y aceite. En la imagen de la izquierda se puede ver una mezcla de agua y aceite, líquidos inmiscibles, que quedan separados en dos capas. En la capa inferior queda el agua, con mayor densidad, y en la capa superior queda el aceite, con menor densidad. Para separar ambas capas, añadimos la mezcla a un embudo de decantación (imagen inferior) y dejamos que repose. Al cabo de un tiempo, se separar perfectamente los dos líquidos. Para realizar la separación, se abre la llave de paso del embudo y se deja caer el líquido de mayor densidad, el agua. Cuando ha caído todo el agua, se cierra la llave y en el embudo queda solo el aceite, de menor densidad. Tamizado: es un procedimiento que consiste en separar una mezcla de materiales sólidos de tamaños diferentes, por ejemplo: granos de caraota y arena empleando un tamiz (colador). Los granos de arena pasan a través del tamiz y los granos de caraota quedan retenidos. El tamizado es un método físico para separar mezclas. Consiste en hacer pasar una mezcla de partículas de diferentes tamaños por un tamiz o cedazo. Las partículas de menor tamaño pasan por los poros del tamiz atravesándolo y las grandes quedan retenidas por el mismo. Si observamos el juego de tamices de la izquierda comprendemos que cada uno está hecho para retener partículas de diferente tamaño. El tamiz con forro marrón solo retendría piedras de un tamaño apreciable, mientras que el tamiz inferior derecho podría retener hasta arena fina. Si la mezcla es de sólidos de distintos tamaños, usaremos tamices, y si alguno de los componentes es metal, tal vez lo podremos separar usando un imán. Sedimentación: se deja reposar y el sólido se va depositando en el fondo del recipiente. Centrifugación: permite separar sólidos dispersos en líquidos (coloides). Para ello se usa una centrífuga que es un aparato que gira violentamente la cual tienen un movimiento de rotación constante y rápido, lo cual hace que las partículas de mayor densidad vayan al fondo y las más livianas queden en la parte superior potenciando el efecto de la gravedad, permitiendo que el sólido se deposite en el fondo. Después se elimina el líquido con un cuentagotas. consiste en la separación de materiales de diferentes densidades que componen una mezcla. 12 Lixiviación es un procedimiento que se emplea para extraer un soluto de un sólido, mediante la utilización de un disolvente líquido. Este procedimiento aprovecha que algunos componentes de una mezcla heterogénea son solubles en determinados disolventes y otros no. Por ejemplo, el azúcar se extrae de la remolacha con agua caliente que lo disuelve bien. El aceite de soja se extrae a partir de su semilla con disolventes orgánicos. Del mismo modo, es posible extraer el cobre a partir de muchos minerales de cobre por lixiviación con ácido sulfúrico. En este último caso, no se produce una simple disolución de la sustancia sino una reacción química. Si la mezcla es de líquidos, usamos un método diferente según los líquidos se mezclen bien o no: 2. Separación de mezclas hOMOgéneas Evaporación, cristalización: al evaporarse el agua (salinas) queda la sal separada en el fondo en forma de cristales. Evaporación: consiste en separar los componentes de una mezcla de un sólido disuelto en un líquido. La evaporación se realiza en recipientes de poco fondo y mucha superficie, tales como cápsulas de porcelana, cristalizadores, etc.) Cristalización es un procedimiento que se emplea para separar mezclas homogéneas de un sólido disuelto en un líquido. Esta técnica consiste en hacer que cristalice un soluto sólido con objeto de separarlo del disolvente en el que está disuelto. Para ello es conveniente evaporar parte del disolvente o dejar que el proceso ocurra a temperatura ambiente. Si la evaporación es rápida se obtienen cristales pequeños y, si es lenta, se formarán cristales de mayor tamaño. En la imagen de la izquierda se puede ver una mezcla de agua y sal común, en la que se deja evaporar el agua para que se produzca la cristalización. En la imagen de la derecha puede verse el resultado, al evaporarse toda el agua de la disolución. La sal común queda cristalizada. 13 Destilación es un procedimiento que se emplea para separar mezclas homogéneas de dos líquidos miscibles que hierven a temperaturas muy diferentes o también un sólido que tiene un líquido disuelto. Es el caso, por ejemplo, de una disolución de dos componentes, uno de los cuáles es volátil (es decir, pasa fácilmente al estado gaseoso). Cuando se hace hervir la disolución contenida en el matraz, el componente volátil, que tiene un punto de ebullición menor, se evapora y deja un residuo de soluto no volátil. Para recoger el disolvente así evaporado se hace pasar por un condensador por el que circula agua fría. Ahí se condensa el vapor, que cae en un vaso o en un erlenmeyer. Ejemplo: Esta técnica se emplea para separar mezclas de agua y alcohol. El alcohol es más volátil que el agua y es la primera sustancia en hervir, enfriándose después y separándose así del agua. Cromatografía es un procedimiento que se emplea para separar los distintos componentes de una mezcla homogénea aprovechando su diferente afinidad por un disolvente. En todas las técnicas cromatográficas hay una fase móvil, que puede ser un líquido o un gas, y una fase estacionaria, que suele ser un sólido. Los componentes de la mezcla interaccionan en distinta forma con la fase estacionaria. De este modo, los componentes atraviesan la fase estacionaria a distintas velocidades y se van separando. Un ejemplo, es la cromatografía en papel, un proceso muy utilizado en los laboratorios para realizar unos análisis cualitativos ya que, pese a no ser una técnica muy potente, no requiere de ningún tipo de equipamiento. La fase estacionaria está constituida simplemente por una tira de papel filtro. La muestra se deposita en un extremo colocando pequeñas gotas de la disolución y evaporando el disolvente. Luego el disolvente empleado como fase móvil se hace ascender por capilaridad. Esto es, se coloca la tira de papel verticalmente y con la muestra del lado de abajo dentro de un recipiente que contiene fase móvil en el fondo. 14 DISOLUCIONES Disolvente y soluto Una disolución es una mezcla homogénea formada por 2 ó más sustancias puras en proporción variable. Las disoluciones pueden ser binarias (2 componentes), ternarias (3 componentes), etc. Ejemplo: Una mezcla de agua con sal es una disolución. El componente de la disolución que se encuentra en mayor cantidad o proporción se llama disolvente y el o los que aparecen en menor cantidad o proporción se llama/n solutos. Ejemplo: En una disolución de sal en agua, la sal es el soluto y el agua es el disolvente. 15 Tipos de disoluciones Las disoluciones están compuestas de dos o más sustancias, cada una de las cuales puede presentarse en un estado físico distinto. En el cuadro siguiente se muestran ejemplos de disoluciones en diferentes estados físicos: SOLUTO GAS LÍQUIDO SÓLIDO GAS DISOLVENTE DISOLUCIÓN GAS GAS LÍQUIDO LÍQUIDO EJEMPLO Aire Niebla Polvo en el aire Amoniaco comercial LÍQUIDO Agua y alcohol SÓLIDO Agua y sal GAS LÍQUIDO SÓLIDO SÓLIDO Hidrógeno en paladio Amalgama (mercurio y metal) DISOLUCIONES: Un sistema material homogéneo formado por la mezcla de dos o más componentes se denomina disolución o mezcla homogénea. ● Se llama disolvente al compuesto mayoritario en la disolución. ● Se llama soluto al componente minoritario. Según la proporción de soluto y disolvente, las disoluciones pueden ser: ● Diluidas. Si la cantidad de soluto en relación con el disolvente es muy pequeña. ● Concentradas. Si la cantidad de soluto en relación con el disolvente es alta. ● Saturadas. Si el soluto está en la máxima proporción posible. Cualquier cantidad de soluto que se añada posteriormente a esta disolución no se disolverá. CONCENTRACIÓN DE UNA DISOLUCIÓN La concentración de una disolución expresa de forma numérica la proporción de soluto en una determinada cantidad de disolución. Se puede calcular de diversas formas y utilizando diversas unidades: Concentración en masa: (g/l). Concentración = ⊏⊐ Tanto por ciento de masa: % = ________masa g soluto______ = 100 masa g soluto + masa g disolvente 16 17 18