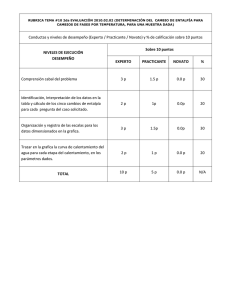
INSTITUCIÓN EDUCATIVA LA PLAZUELA SEDE "A" Zapatoca - Santander Código DANE 268895000364 Asignatura: QUIMICA Guía N° 1 Prof. Fredy F. Rodríguez C. Grado: UNDECIMO Fecha:_________ Competencias: Que yo realice lectura comprehensiva e interprete textos argumentales relacionados con los la cinética y el equilibrio químico (termodinámica, tono térmico y entalpía). Desempeños: Realizo lectura comprehensiva e interpreto textos relacionados con los la cinética y el equilibrio químico (termodinámica, tono térmico y entalpía). Actividad 1. Leer el siguiente texto teórico y contestar las preguntas propuestas. TERMODINAMICA La termodinámica (del griego termo, que significa "calor" y dínamis, que significa "fuerza") es la rama de la física que describe el comportamiento de sistemas macroscópicos, en lugar de moléculas individuales. Es un sistema lógico basado en unas pocas generalizaciones conocidas como las leyes de la termodinámica. Sistema termodinámico típico mostrando la entrada desde una fuente de calor (caldera) a la izquierda y la salida a un disipador de calor (condensador) a la derecha. El trabajo se extrae en este caso por una serie de pistones. PRIMERA LEY DE LA TERMODINAMICA También conocida como principio de conservación de la energía, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolás Léonard Sadi Carnot en 1824. La ecuación general de la conservación de la energía es la siguiente: Las unidades de calor y energía se expresan en Julios (J). El símbolo delta (Δ), en ciencias significa el cambio entre un valor final e inicial. 1 caloría equivale 4.186 Julios. Ejemplo: calcular el cambio de energía en un sistema si se agregan al mismo 500J de calor y 200J de trabajo ΔU = Q + W ΔU = 500J + 200J = 700J Como el valor de ΔU positivo, hay más energía en el sistema después de los cambios que antes de estos. TONO TERMICO Esencialmente el tono térmico es la diferencia que existe entre la energía calórica de un compuesto y de los elementos que la conforman. Se expresa en calorías o kilocalorías por mol para los compuestos y en mol-átomos para elementos. Ejemplo: H2(g) +O2(g) 2H2O(g) + 57800 calorías El tono térmico es: 57800 cal/mol ó 57.80Kcal/mol calorías Entalpía (del prefijo en y del griego "enthalpos" calentar) es una magnitud termodinámica, simbolizada con la letra H, cuya variación expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, es decir, la cantidad de energía que un sistema puede intercambiar con su entorno. La entalpía no puede medirse directamente, pero el calor que se consume o se produce en una reacción sí, estableciendo la diferencia entre la entalpía de los productos y la entalpía de los reaccionantes. El símbolo de este cambio de entalpía es (ΔH). ΔH = Hfinal - Hinicial Donde: ΔH es la variación de entalpía. Hfinal es la entalpía final del sistema. En una reacción química, Hfinal es la entalpía de los productos. Hinicial es la entalpía inicial del sistema. En una reacción química, Hinicial es la entalpía de los reactivos. En una reacción endotérmica se absorbe calor y por consiguiente, la entalpía de los productos es mayor que el de los reactantes; el signo de ΔH es positivo. El caso contrario es la reacción exotérmica, en la que se libera calor durante el proceso y la entalpía de los productos es menor que la de los reactantes; por lo tanto ΔH es negativo. ΔH > 0 (reacción endotérmica) ΔH < 0 (reacción exotérmica) INSTITUCIÓN EDUCATIVA LA PLAZUELA SEDE "A" Zapatoca - Santander Código DANE 268895000364 ENTALPIA DE FORMACIÓN (ΔfH) La entalpía de formación de un compuesto es la energía necesaria para formar un mol de dicho compuesto a partir sus elementos, medida, normalmente, en unas condiciones de referencia estándar, 1 atm de presión y una temperatura de 298 K (25 °C). Esta entalpía es negativa cuando se trata de una reacción exotérmica, que desprende calor, mientras que es positiva cuando es endotérmica, y resulta nula para los compuestos diatómicos. EJEMPLO: TEORIA DE LAS COLISIONES La teoría de las colisiones propuesta por Max Trautz y William Lewis en 1916 y 1918. Esta teoría está basada en la idea de que las partículas reactivas deben colisionar para que una reacción ocurra, este choque es el resultado del movimiento continuo y desordenado de las partículas de los reactivos. Al producirse las colisiones, las distancias entre las partículas que reaccionan son mínimas, con lo cual puede producirse rotura y creación de enlaces, de modo que se originan los productos de la reacción. La cantidad mínima de energía necesaria para que esto suceda es conocida como energía de activación. Cuanto mayor es la energía de activación, más lenta es la reacción porque aumenta la dificultad para que el proceso suceda. Cuanto menor es la energía de activación, menor la barrera de energía, más colisiones efectivas y por tanto una reacción más rápida. La energía de activación varía de acuerdo con el tipo de reacción química. En las reacciones endotérmicas ella es mayor que en las exotérmicas. La teoría de las colisiones está íntimamente relacionada a la cinética química. Los átomos de las moléculas de los reactivos están siempre en movimiento, generando muchas colisiones (choques). Parte de estas colisiones aumentan la velocidad de reacción química. Cuantos más choques con energía y geometría adecuada exista, mayor la velocidad de la reacción. Hay dos tipos de colisiones: – Colisión más lenta – Colisión más rápida, colisión efectiva Veamos los dos modelos de colisiones para la formación de dos moléculas de HCl: PREGUNTAS. Con base en la lectura detallada que anteriormente se realizó conteste las siguientes preguntas en el cuaderno: 1. ¿A qué se le llama termodinámica? 2. Escribo con mis palabras ¿cuál es la base de la primera ley de la termodinámica? 3. ¿Qué es un sistema? 4. Cuando hablamos de tono térmico ¿a qué hacemos referencia? 5. ¿Cómo se simboliza la entalpía y qué indica? 6. Con respecto a la entalpía ¿qué pasa cuando la reacción es exotérmica y cuando es endotérmica? 7. calcular el cambio de energía en un sistema si se agregan al mismo 700J de calor y 300J de trabajo 8. A cuantas calorías equivalen el trabajo del ejercicio anterior. Nota: en la lectura está el factor de conversión de calorías a julios. Leer detalladamente. 9. De la siguiente lista de entalpias de formación, indicar cuales son exotérmicas. 10. Explico ¿en qué consiste la teoría de las colisiones? 11. De los dos tipos de colisiones que existen, explicar ¿cuál es la más efectiva? 12. ¿Qué es el complejo activado según el diagrama de energía de activación? 13. Según la teoría, ¿Cuándo una la velocidad de reacción se incrementa? 14. ¿Por qué las colisiones horizontales, hacen la reacción más lenta? 15. Hacer la conversión de 500 Calorías a unidades de Joules. 16. Realizar en el cuaderno los diagramas de energía de activación para una reacción exotérmica y endotérmica. (Valor 5 pts).