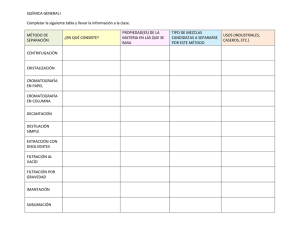
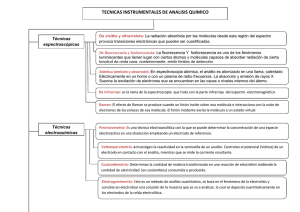
PRÁCTICA 1.- DETERMINACIÓN DE RESIDUOS DE PLAGUICIDAS EN AGUA METODO EXTRACCIÓN CON DICLOROMETANO 1. INTRODUCCIÓN Arial 12 interlineado sencillo 2cm de margen y sangria y justificado Este método está diseñado para la determinación por cromatografía de gases de residuos de plaguicidas en aguas. Los plaguicidas se extraen con Diclorometano y para la determinación y cuantificación de sus residuos se utiliza la cromatografía de gases. 2.Fundamento teórico La cromatografía de gases (GC) es un sistema que está compuesto: de gas portador, sistema de inyección de la muestra, columna, y detector. Esta técnica se basa en la volatilización de la muestra y su posterior inyección en la cabeza de una columna cromatográfica. Existen dos tipos de cromatografía de gases: Cromatografía gas-sólido (GSC): la fase estacionaria es sólida y la retención de los analitos se produce mediante adsorción. Cromatografía gas-líquido (GLC): la fase estacionaria son moléculas de líquido inmovilizadas sobre la superficie de un sólido inerte. Esta es la que se usa más ampliamente. La GC es un sistema que está compuesto: de gas portador, sistema de inyección de la muestra, columna, y detector. Gas portador: Debe ser un gas inerte para evitar que reaccione con el analito o con la columna. Los gases de uso más común son helio, nitrógeno, hidrogeno o argón. Sistema de inyección de muestra: El analito se inyecta usando una microjeringa en una cámara de vaporización instantánea sellada por una junta de silicona (Septum). Existen dos tipos de columnas, empaquetadas o de relleno y tubulares abiertas o capilares. Columnas de relleno: Son tubos de vidrio, metal inerte o teflón de 2 ó 3 metros de longitud y 2 a 4 mm de diámetro interno, el material de relleno del interior consiste en partículas esféricas para interaccionar con el analito. Las columnas capilares son más eficaces en la separación de compuestos, entre esta tenemos: las WCOT de pared recubierta, son tubos capilares donde la pared interna está recubierta con una fina capa de fase estacionaria. SCOT (soporte recubierto): tienen una capa en su lado interno de superficie adsorbente donde se acopla la fase estacionaria. Detectores: Dentro de los detectores tenemos dos que son los más utilizados, el 1 detector de ionización de llama: es un quemador de hidrógeno/oxígeno donde se mezcla el eluyente con hidrógeno. En esta cámara se produce una chispa para causar ignición, los compuestos orgánicos al quemarse se pirolizan y producen iones y electrones, aprovechando que se convierte en conductor se induce una corriente eléctrica, para detectar iones desprendidos y el detector de conductividad térmica: se basa en el calentamiento de una resistencia mediante el uso de una corriente eléctrica. Esta resistencia tiene una temperatura que depende del gas circundante. La resistencia es un hilo de tungsteno, platino u oro. Existen otros detectores como son: detector termoiónico, detector de captura de electrones y detector de emisión atómica entre otros. Este tipo de técnicas como la cromatografía de gases, es útil en el estudio de compuestos como el bióxido o dióxido de carbono que es producido en la respiración de humanos y animales, vegetales y microorganismos, es importante en la combustión de cualquier material que contenga carbono, como el papel o la madera y los derivados del petróleo. En la atmósfera, el dióxido de carbono, se encuentra en una proporción muy pequeña, y es uno de los gases que se conocen como gases invernadero. La característica de este tipo de gases es que atrapan parte de la energía que llega a la tierra desde el sol, lo cual promueve el calentamiento de la tierra. Si la cantidad promedio de gases invernadero aumenta, la temperatura de la Tierra también aumenta, lo que trae como consecuencia que los organismos vivos sensibles a los cambios de temperatura se adapten o desaparezcas de la faz de la Tierra. Por tal motivo es importante su determinación por métodos que califiquen y cuantifiquen el dióxido de carbono. 2. MATERIAL Y APARATOS - Frascos de extracción de vidrio 500 mL. Pipetas automáticas. Balanza analítica. Dispensador automático. Probeta graduada de 100 mL. Matraz de fondo redondo de 50 mL. Embudo de cristal 5,5 y 10 cm de diámetro. Embudo de decantación de 1000 mL. Soporte de varilla. Tubo de ensayo graduado de 10 mL. Papel de filtro sin cenizas 135 Albet. Baño-Rotavapor. Viales de 2 mL con tapón de rosca y septum. Equipo de cromatografía de gases con detector MS/MS. 3. REACTIVOS 2 - Diclorometano PAR. Acetato de etilo PAR. Ciclohexano PAR. Cloruro sódico. Sulfato sódico anhidro. Lana de vidrio. Disoluciones de plaguicidas. 4. METODOS 4.1 Preparación de la muestra Filtrar el agua con papel de filtro 135 Albet sobre embudo de rama corta. 4.2 Extracción - - Añadir 500 mL de agua filtrada a un embudo de decantación de 1000 mL apoyado sobre un soporte de varilla. Se añaden al embudo de decantación 5 g de cloruro sódico y se agita hasta su disolución. Se añaden 50 mL de diclorometano y se agita durante un minuto, transcurrido el cual se deja reposar. La fase orgánica se coge en un matraz de fondo redondo 50 mL, empleando un embudo de rama corta con lana de vidrio y sulfato sódico anhidro. Repetir el punto anterior dos veces más con 25 mL de diclorometano. Lavar el sulfato sódico del embudo con un volumen de diclorometano para arrastrar. Concentrar la fase orgánica en un baño-rotavapor a 40ºC hasta sequedad. 4.3 Determinación cromatográfica - Se disuelve el residuo con 1 mL de ciclohexano:acetato de etilo (9:1) en baño ultrasonidos durante 10 minutos, y se pasa mediante pipeta a un vial de tapón de rosca de 2 mL para su análisis por cromatografía. 5. DETERMINACIÓN Y CUANTIFICACIÓN 3 Inyectar el extracto y un multipatrón de 0,1 ppm (mg/L) en el CGMS/MS empleando el Método Practicas. Una vez identificado un compuesto se cuantifica mediante integración del área de éste, comparándola con la de su patrón correspondiente o curvas de integración del método. Los resultados se expresan en g/L (ppb), que expresan los microgramos del plaguicida contenidos en cada litro de agua. La ecuación a utilizar durante la cuantificación es: Am Vip Cp Vf C = Ap Vim V donde: C = Concentración muestra(ppm) Am = del plaguicida en la Área del pico del plaguicida en la muestra Ap = Área del pico del plaguicida en el patrón Vip = Volumen de inyección del patrón ( L) Vim = Volumen de inyección de la muestra ( L) Cp = Concentración del plaguicida en la disolución patrón (ppm) Vf = Volumen de aforo final (mL) V = Volumen de la muestra (mL) La cromatografía de gases es un medio excelente para confirmer la presencia o ausencia de un supuesto componente en una mezcla, siempre que se disponga de un patrón. 4 http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S018849992009000200005 5